Условия протекания химических реакций примеры. Условия самопроизвольного протекания химической реакции. Условия химического равновесия
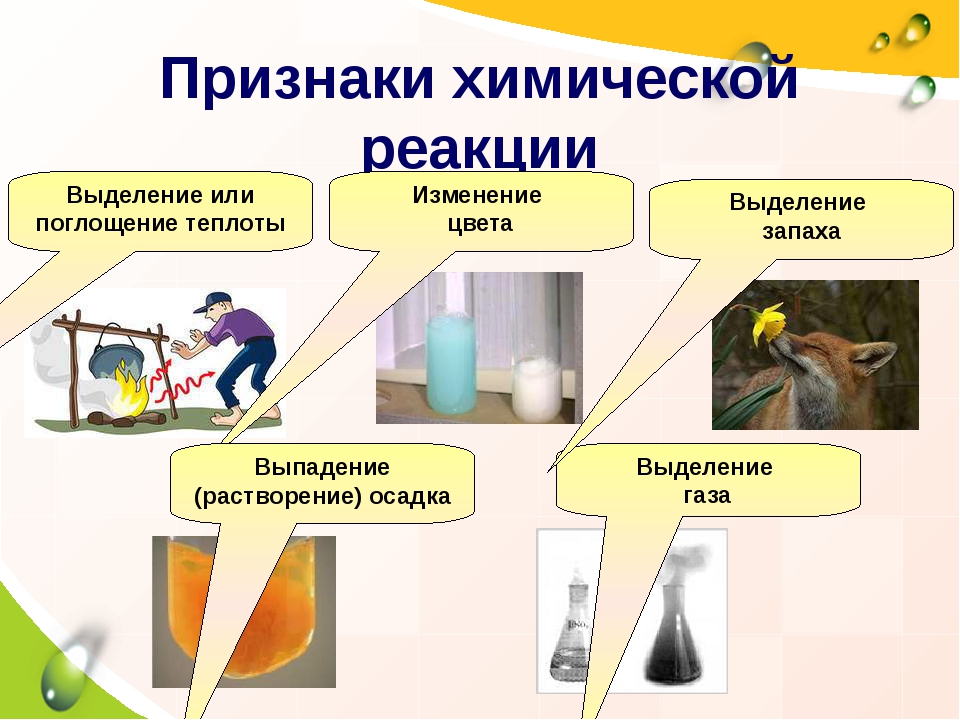
§ 1 Признаки химических реакций
При химических реакциях исходные вещества превращаются в другие вещества, обладающие другими свойствами. Об этом можно судить по внешним признакам химических реакций: образование газообразного или нерастворимого вещества, выделение или поглощение энергии, изменение цвета вещества.
Кусок медной проволоки нагреем в пламени спиртовки. Мы увидим, что та часть проволоки, которая находилась в пламени, почернела.
Прильем 1-2 мл раствора уксусной кислоты к порошку пищевой соды. Наблюдаем появление пузырьков газа и исчезновение соды.
Прильем 3-4 мл раствора хлорида меди к раствору едкого натра. При этом голубой прозрачный раствор превратится в ярко-синий осадок.
К 2 мл раствора крахмала добавим 1-2 капли раствора йода. И полупрозрачная белая жидкость станет непрозрачной темно-синей.
Самым главным признаком химической реакции является образование новых веществ.
Но об этом можно судить и по некоторым внешним признакам протекания реакций:
Выпадение осадка;
Изменение цвета;
Выделение газа;
Появление запаха;
Выделение или поглощение энергии в виде тепла, электричества или света.
Например, если к смеси водорода и кислорода поднести зажженную лучинку или пропустить через эту смесь электрический разряд, то произойдёт оглушительный взрыв, а на стенках сосуда образуется новое вещество — вода. Произошла реакция образования молекул воды из атомов водорода и кислорода с выделением тепла.
Наоборот, разложение воды на кислород и водород требует электрической энергии.
§ 2 Условия возникновения химической реакции
Однако для возникновения химической реакции необходимы определённые условия.
Рассмотрим реакцию горения этилового спирта.
Она происходит при взаимодействии спирта с кислородом воздуха, для начала реакции необходимо соприкосновение молекул спирта и кислорода.
В пробирку нальем 3%-й раствор перекиси водорода. Если оставим пробирку открытой, то перекись водорода начнет медленно разлагаться на воду и кислород. При этом скорость реакции будет такая низкая, что признаков выделения газа мы не увидим. Добавим немного чёрного порошка оксида марганца (IV). Наблюдаем бурное выделение газа. Это кислород, который образовался при реакции разложения перекиси водорода.
Необходимым условием для начала этой реакции было добавление вещества, которое не участвует в реакции, но ускоряет ее.
Такое вещество называется катализатор.
Очевидно, что для возникновения и течения химических реакций необходимы некоторые условия, а именно:
Соприкосновение исходных веществ (реагентов),
Их нагревание до определённой температуры,
Применение катализаторов.
§ 3 Особенности химических реакций
Характерной особенностью химических реакций является то, что они часто сопровождаются поглощением или выделением энергии.
Дмитрий Иванович Менделеев указывал, что важнейшим признаком всех химических реакций является изменение энергии в процессе их протекания.
Выделение или поглощение теплоты в процессе химических реакций обусловлено тем, что энергия затрачивается на процесс разрушения одних веществ (разрушение связей между атомами и молекулами) и выделяется при образовании других веществ (образование связей между атомами и молекулами).
Энергетические изменения проявляются либо в выделении, либо в поглощении теплоты. Реакции, протекающие с выделением теплоты, называются экзотермическими.
Реакции, протекающие с поглощением теплоты, называются эндотермическими.
Количество выделенной или поглощённой теплоты называют тепловым эффектом реакции.
Тепловой эффект обычно обозначают латинской буквой Q и соответствующим знаком: +Q для экзотермических реакций и -Q для эндотермических реакций.
Область химии, занимающаяся изучением тепловых эффектов химических реакций, называется термохимией. Первые исследования термохимических явлений принадлежат учёному Николаю Николаевичу Бекетову.
Значение теплового эффекта относят к 1 моль вещества и выражают в килоджоулях (кДж).
Большинство осуществляющихся в природе, лаборатории и промышленности химических процессов являются экзотермическими. К ним относятся все реакции горения, окисления, соединения металлов с другими элементами и другие.
Однако существуют и эндотермические процессы, например разложение воды под действием электрического тока.
Тепловые эффекты химических реакций колеблются в широких пределах от 4 до 500 кДж/моль. Наиболее значителен тепловой эффект при реакциях горения.
Попробуем объяснить, в чём сущность происходящих превращений веществ и что происходит с атомами реагирующих веществ. Согласно атомно-молекулярному учению все вещества состоят из атомов, соединённых друг с другом в молекулы или другие частицы. В процессе реакции происходит разрушение исходных веществ (реагентов) и образование новых веществ (продуктов реакции). Таким образом, все реакции сводятся к образованию новых веществ из атомов, входящих в состав исходных веществ.
В процессе реакции происходит разрушение исходных веществ (реагентов) и образование новых веществ (продуктов реакции). Таким образом, все реакции сводятся к образованию новых веществ из атомов, входящих в состав исходных веществ.
Следовательно, сущность химической реакции состоит в перегруппировке атомов, в результате которой из молекул (или других частиц) получаются новые молекулы (или другие формы вещества).
Список использованной литературы:
- Н.Е. Кузнецова. Химия. 8 класс. Учебник для общеобразовательных учреждений. – М. Вентана-Граф, 2012.
I. Признаки и условия протекания химических реакций
Вы уже знаете многие вещества, наблюдали их превращения и сопровождающие эти превращенияпризнаки.
Самым главным признаком химической реакции является образование новых веществ. Но об этом сожно судить и по некоторым внешним признакам протекания реакций.
Внешние признаки протекания химических реакций:
- выпадение осадка
- изменение цвета
- выделение газа
- появление запаха
- поглощение и выделение энергии (тепла, электричества, света)
Очевидно, что для возникновения и течения химических реакций необходимы некоторые условия:
- соприкосновение исходных веществ (реагентов)
- применение веществ, ускоряющих химическую реакцию (катализаторов)
II. Тепловой эффект химической реакции
Тепловой эффект химической реакции
Д.И. Менделеев указывал: важнейшим признаком всех химических реакций является изменение энергии в процессе их протекания.
В каждом веществе запасено определенное количество энергии. С этим свойством веществ мы сталкиваемся уже за завтраком, обедом или ужином, так как продукты питания позволяют нашему организму использовать энергию самых разнообразных химических соединений, содержащихся в пище. В организме эта энергия преобразуется в движение, работу, идет на поддержание постоянной (и довольно высокой!) температуры тела.
Выделение или поглощение теплоты в процессе химических реакций обусловлено тем, что энергия затрачивается на процесс разрушения одних веществ (разрушение связей между атомами и молекулами) и выделяется при образовании других веществ (образование связей между атомами и молекулами).
Энергетические изменения проявляются либо в выделении, либо в поглощении теплоты.
Реакции, протекающие с выделением теплоты, называются экзотермическими (от греч. «экзо» — наружу).
«экзо» — наружу).
Реакции протекающие с поглощением энергии называются эндотермическими (от латинского «эндо» — внутрь).
Чаще всего энергия выделяется или поглощается в виде теплоты (реже — в виде световой или механической энергии). Эту теплоту можно измерить. Результат измерения выражают в килоджоулях (кДж) для одного МОЛЯ реагента или (реже) для моля продукта реакции. Количество теплоты, выделяющееся или поглощающееся при химической реакции, называется тепловым эффектом реакции (Q).
Экзотермическая реакция:
Исходные вещества → продукты реакций + Q кДж
Эндотермическая реакция:
Исходные вещества → продукты реакций — Q кДж
Тепловые эффекты химических реакций нужны для многих технических расчетов. Представьте себя на минуту конструктором мощной ракеты, способной выводить на орбиту космические корабли и другие полезные грузы.
Допустим, вам известна работа (в кДж), которую придется затратить для доставки ракеты с грузом с поверхности Земли до орбиты, известна также работа по преодолению сопротивления воздуха и другие затраты энергии во время полета. Как рассчитать необходимый запас водорода и кислорода, которые (в сжиженном состоянии) используются в этой ракете в качестве топлива и окислителя?
Как рассчитать необходимый запас водорода и кислорода, которые (в сжиженном состоянии) используются в этой ракете в качестве топлива и окислителя?
Без помощи теплового эффекта реакции образования воды из водорода и кислорода сделать это затруднительно. Ведь тепловой эффект — это и есть та самая энергия, которая должна вывести ракету на орбиту. В камерах сгорания ракеты эта теплота превращается в кинетическую энергию молекул раскаленного газа (пара), который вырывается из сопел и создает реактивную тягу.
В химической промышленности тепловые эффекты нужны для расчета количества теплоты для нагревания реакторов, в которых идут эндотермические реакции. В энергетике с помощью теплот сгорания топлива рассчитывают выработку тепловой энергии.
Врачи-диетологи используют тепловые эффекты окисления пищевых продуктов в организме для составления правильных рационов питания не только для больных, но и для здоровых людей — спортсменов, работников различных профессий. По традиции для расчетов здесь используют не джоули, а другие энергетические единицы — калории (1 кал = 4,1868 Дж). Энергетическое содержание пищи относят к какой-нибудь массе пищевых продуктов: к 1 г, к 100 г или даже к стандартной упаковке продукта. Например, на этикетке баночки со сгущенным молоком можно прочитать такую надпись: «калорийность 320 ккал/100 г».
Энергетическое содержание пищи относят к какой-нибудь массе пищевых продуктов: к 1 г, к 100 г или даже к стандартной упаковке продукта. Например, на этикетке баночки со сгущенным молоком можно прочитать такую надпись: «калорийность 320 ккал/100 г».
Область химии, занимающаяся изучением тепловых эффектов, химических реакций, называетсятермохимией.
Уравнения химических реакций, в которых указан тепловой эффект, называют термохимическими.
Разделы: Химия
Тип урока : приобретение новых знаний.
Вид урока : беседа с демонстрацией опытов.
Цели:
Обучающие — повторить отличия химических явлений от физических. Сформировать знания о признаках и условиях протекания химических реакций.
Развивающие — развивать умения, опираясь на знание химии, ставить несложные проблемы, формулировать гипотезы., обобщать.
Воспитательные – продолжить
формирование научного мировоззрения учащихся, воспитывать культуру общения
через работу в парах «ученик-ученик», «ученик-учитель», а также
наблюдательность, внимание, пытливость, инициативу.
Методы и методические приемы : Беседа, демонстрация опытов; заполнение таблицы, химический диктант, самостоятельная работа с карточками.
Оборудование и реактивы . Лабораторный штатив с пробирками, железная ложечка для сжигания веществ, пробирка с газоотводной трубкой, спиртовка, спички, растворы хлорида железа FeCL 3 , роданида калия KNCS, медного купороса (сульфат меди) CuSO 4 , гидрооксида натрия NaOH, карбоната натрия Na 2 CO 3 , соляной кислоты HCL,порошок S.
Ход урока
Учитель. Мы изучаем главу «Изменения, происходящие с веществами» и знаем что изменения могут быть физическими и химическими. В чём отличие химического явления от физического?
Ученик. В результате химического явления изменяется состав вещества, а в результате физического явления состав вещества остается без изменения, а меняется лишь его агрегатное состояние или форма и размеры тел.
Учитель. В одном и том же
опыте можно одновременно наблюдать химические и физические явления. Если
медную проволоку расплющить молотком, то получится медная пластинка. Изменяется
форма проволоки, но состав её остаётся прежним. Это физическое явление. Если
медную пластинку нагреть на сильном огне, то исчезнет металлический блеск.
Поверхность медной пластинки покроется чёрным налётом, который можно соскрести
ножом. Значит, медь взаимодействует с воздухом и превращается в новое вещество.
Это химическое явление. Между металлом и кислородом воздуха происходит
химическая реакция.
Если
медную проволоку расплющить молотком, то получится медная пластинка. Изменяется
форма проволоки, но состав её остаётся прежним. Это физическое явление. Если
медную пластинку нагреть на сильном огне, то исчезнет металлический блеск.
Поверхность медной пластинки покроется чёрным налётом, который можно соскрести
ножом. Значит, медь взаимодействует с воздухом и превращается в новое вещество.
Это химическое явление. Между металлом и кислородом воздуха происходит
химическая реакция.
Химический диктант
Вариант 1
Задание. Укажите о каких явлениях (физических или химических) идет речь. Поясните свой ответ.
1. Сгорание бензина в двигателе автомобиля.
2. Приготовление порошка из куска мела.
3. Гниение растительных остатков.
4. Скисание молока.
5. Выпадение дождя
Вариант 2
1. Горение угля.
2. Таяние снега.
3. Образование ржавчины.
4. Образование инея на деревьях.
5. Свечение вольфрамовой нити в
лампочке.
Свечение вольфрамовой нити в
лампочке.
Критерии оценивания
Максимально можно набрать 10 баллов (по 1 баллу за правильно указанное явление и по 1 баллу за обоснование ответа).
Учитель. Итак, вам известно, что все явления подразделяются на физические и химические. В отличие от физических явлений при химических явлениях, или химических реакциях, происходит превращение одних веществ в другие. Эти превращения сопровождаются внешними признаками. Для того чтобы познакомить вас с химическими реакциями, я проведу ряд демонстрационных опытов. Вам нужно определить признаки, по которым можно сказать, что произошла химическая реакция. Обратите внимание на то, какие условия необходимы для протекания этих химических реакций.
Демонстрационный опыт №1
Учитель. В первом опыте нужно выяснить, что происходит с хлоридом железа (111) при добавлении к нему раствора роданида калия KNCS.
FeCL 3 + KNCS = Fe(NCS) 3 +3 KCL
Ученик. Реакция
сопровождается изменением окраски
Реакция
сопровождается изменением окраски
Демонстрационный опыт №2
Учитель. В пробирку нальём 2 мл медного купороса, добавим немного раствора гидрооксида натрия.
CuSO 4 + 2 NaOH = Cu (OH) 2↓ +Na 2 SO 4
Ученик . Выпадает осадок голубого цвета Cu (OH) 2↓
Демонстрационный опыт №3
Учитель. К полученному раствору Cu (OH) 2↓ добавить раствор кислоты HCL
Cu (OH) 2↓ + 2 HCL = CuCL 2 +2 HOH
Ученик . Осадок растворяется.
Демонстрационный опыт №4
Учитель. В пробирку с раствором карбоната натрия прильём раствор соляной кислоты HCL.
Na 2 CO 3 +2 HCL = 2 NaCL + H 2 O + CO 2
Ученик . Выделяется газ.
Демонстрационный опыт №5
Учитель. Подожжем в железной ложечке немного серы. Образуется сернистый газ-оксид серы (4) — SO 2.
S + O 2 = SO 2
Ученик. Сера загорается
синеватым пламенем, даёт обильный едкий дым, выделяется тепло и свет.
Демонстрационный опыт №6
Учитель. Реакция разложения пермангата калия — реакция получение и распознавания кислорода.
Ученик. Выделяется газ.
Учитель. Эта реакция идет при постоянном нагреве, стоит его прекратить, как прекращается и реакция (кончик газоотводной трубки прибора, где получали кислород, опущен в пробирку с водой — пока нагревание, кислород выделяется, и его можно заметить по выходящим из кончика трубки пузырькам, если же нагревание прекратить – прекращается и выделение пузырьков кислорода).
Демонстрационный опыт №7
Учитель. В пробирку с NH 4 CL хлоридом аммония добавить немного щелочи NaOH при нагревании. Попросить одного из учеников подойти и понюхать, выделяющийся аммиак. Предупредить ученика о резком запахе!
NH 4 CL +NaOH = NH 3 + HOH + NaCL
Ученик . Выделяется газ с резким запахом.
Учащиеся записывают в тетрадь признаки химических реакций.
Признаки химических реакций
Выделение (поглощение) тепла или света
Изменение цвета
Выделение газа
Выделение (растворение) осадка
Изменение запаха
Используя знания учащихся о химических реакциях, на основе проделанных демонстрационных опытов составляем таблицу условия возникновения и протекания химических реакций
Учитель. Вы изучили признаки
химических реакций и условия их протекания. Индивидуальная работа по карточкам.
Вы изучили признаки
химических реакций и условия их протекания. Индивидуальная работа по карточкам.
Какие из признаков характерны для химических реакций?
А) Образование осадка
Б) Изменение агрегатного состояния
В) Выделение газа
Г) Измельчение веществ
Заключительная часть
Учитель подводит итоги урока, анализируя полученные результаты. Выставляет оценки.
Домашнее задание
Приведите примеры химических явлений, которые встречаются в трудовой деятельности ваших родителей, в домашнем хозяйстве, в природе.
По учебнику О.С.Габриеляна «Химия -8 класс» § 26, упр. 3,6 с.96
1. Укажите, к физическим или химическим относятся явления, изображенные на рисунках.
2. Установите соотвествие.
Примеры химических реакций:
I. взаимодействие мрамора с соляной кислотой;
II. взаимодействие железа с серой;
III. разложение пероксида водорода;
IV. взаимодействие углекислого газа с извесковой водой.
Условия протекания химических реакций:
а) соприкосновение веществ;
б) нагревание;
в) использование катализатора.
Ответ : I — а; II — а, б; III — в; IV — а.
3. Заполните схему 2.
4. «Кроссоврд — наоборот». Все слова в кроссворде уже вписаны. Дайте каждому из слов как можно более точное определение.
«Ключевое слово» — первая химическая реакция, с которой познакомился человек.
1. Одно из четырех агрегатных состояний вещества.
2. Образование твердого вещества в растворе в ходе химической реакции.
3. Положение двух или нескольких тел, предметов, веществ.
4. Переносное или передвижное устройство для тушения очагов пожара.
5. Процесс характеризуется повышением температуры.
6. Химическое вещество, ускоряющее реакцию, но не входящее в состав продуктов реакции.
7. Воздействие объектов друг на друга.
На протяжении всей жизни мы постоянно сталкиваемся с физическими и химическими явлениями. Природные физические явления для нас столь привычны, что мы уже давно не придаём им особого значения. Химические реакции постоянно протекают в нашем организме. Энергия, которая выделяется при химических реакциях, постоянно используется в быту, на производстве, при запуске космических кораблей. Многие материалы, из которых изготовлены окружающие нас вещи, не взяты в природе в готовом виде, а изготовлены с помощью химических реакций. В быту для нас не имеет особого смысла разбираться в том, что же произошло. Но при изучении физики и химии на достаточном уровне без этих знаний не обойтись. Как отличить физические явления от химических? Существуют ли какие-либо признаки, которые могут помочь это сделать?
Природные физические явления для нас столь привычны, что мы уже давно не придаём им особого значения. Химические реакции постоянно протекают в нашем организме. Энергия, которая выделяется при химических реакциях, постоянно используется в быту, на производстве, при запуске космических кораблей. Многие материалы, из которых изготовлены окружающие нас вещи, не взяты в природе в готовом виде, а изготовлены с помощью химических реакций. В быту для нас не имеет особого смысла разбираться в том, что же произошло. Но при изучении физики и химии на достаточном уровне без этих знаний не обойтись. Как отличить физические явления от химических? Существуют ли какие-либо признаки, которые могут помочь это сделать?
При химических реакциях из одних веществ образуются новые, отличные от исходных. По исчезновению признаков первых и появлению признаков вторых, а также по выделению или поглощению энергии мы заключаем, что произошла химическая реакция.
Если прокалить медную пластинку, на её поверхности появляется чёрный налёт; при продувании углекислого газа через известковую воду выпадает белый осадок; когда горит древесина, появляются капли воды на холодных стенках сосуда, при горении магния получается порошок белого цвета.
Выходит, что признаками химической реакций являются изменение окраски, запаха, образование осадка, появление газа.
При рассмотрении химических реакций, необходимо обращать внимание не только на то, как они протекают, но и на условия, которые должны выполняться для начала и течения реакции.
Итак, какие же условия должны быть выполнены для того, чтобы началась химическая реакция?
Для этого прежде всего необходимы реагирующие вещества привести к соприкосновению (соединить, смешать их). Чем более измельчены вещества, чем больше поверхность их соприкосновения, тем быстрее и активнее протекает реакция между ними. Например, кусковой сахар трудно поджечь, но измельчённый и распылённый в воздухе он сгорает за считанные доли секунды, образуя своеобразный взрыв.
С помощью растворения мы можем раздробить вещество на мельчайшие частицы. Иногда предварительное растворение исходных веществ облегчает проведение химической реакции между веществами.
В некоторых случаях соприкосновение веществ, например, железа с влажным воздухом, достаточно, чтобы произошла реакция. Но чаще одного соприкосновения веществ для этого недостаточно: необходимо выполнение ещё каких-либо условий.
Но чаще одного соприкосновения веществ для этого недостаточно: необходимо выполнение ещё каких-либо условий.
Так, медь не вступает в реакцию с кислородом воздуха при невысокой температуре около 20˚-25˚С. Чтобы вызвать реакцию соединения меди с кислородом, необходимо прибегнуть к нагреванию.
На возникновение химических реакций нагревание влияет по – разному. Для одних реакций требуется непрерывное нагревание. Прекращается нагревание – прекращается и химическая реакция. Например, для разложения сахара необходимо постоянное нагревание.
В других случаях нагревание требуется лишь для возникновения реакции, оно даёт толчок, а далее реакция протекает без нагревания. Например, такое нагревание мы наблюдаем при горении магния, древесины и других горючих веществ.
сайт, при полном или частичном копировании материала ссылка на первоисточник обязательна.
Обратимые химические реакции. Химическое равновесие
Обратимые химические реакции. Химическое равновесие. Большинство химических реакций не протекает до конца. Реакции, которые могут одновременно протекать в двух взаимно противоположных направлениях, называются обратимыми. В реакции [c.224]
Химическое равновесие. Большинство химических реакций не протекает до конца. Реакции, которые могут одновременно протекать в двух взаимно противоположных направлениях, называются обратимыми. В реакции [c.224]Обратимость химических реакций. Химическое равновесие [c.82]
Обратимость химических реакций. Химическое равновесие и условия его смещения, принцип Ле Шателье. Константа равновесия, степень превращения. [c.501]
Двусторонняя химическая реакция, естественно, обратима в термодинамическом смысле только в непосредственной близости к состоянию химического равновесия. В состоянии же, далеком от равновесия, когда скорости прямого и обратного процессов сушественно различны и суммарная (результирующая) скорость реакции значительно отличается от нуля, она термодинамически необратима. Область применения понятия двусторонняя реакция шире, чем термодинамическое понятие обратимая реакция.
 Поэтому для реально протекающих реакций следовало бы придерживаться первого термина. Однако термин обратимая реакция в широком, не термодинамическом смысле укрепился и приходится, использовать его. [c.121]
Поэтому для реально протекающих реакций следовало бы придерживаться первого термина. Однако термин обратимая реакция в широком, не термодинамическом смысле укрепился и приходится, использовать его. [c.121]С увеличением обратимости химической реакции уменьшается скорость взаимодействия абсорбируемого компонента и хемосорбента и возрастает глубина проникновения абсорбируемого компонента. Химическая реакция выходит аа пределы пограничного реакционно-диффузионного слоя и охватывает всю массу жидкости. Для массопередачи с обратимой реакцией характерно такое состояние, когда Аж заметно больше нуля и существенно зависит от количества жидкости в аппарате иж- В зависимости от степени турбулизации жидкости, константы равновесия К и иж можно рассматривать две предельные области диффузионную (отношение Аж/Ар незначительно) и кинетическую (Аж/Ар = 1). [c.67]
Таким образом, для гетерогенных систем, в которых протекают обратимые химические реакции, условия равновесия определяются уравнениями (1ЛЗ) совместно с уравнениями типа [c. 10]
10]
Обратимость химических реакЦий. Константа равновесия [c.20]
Что называется порядком и молекулярностью химической реакции 3. Как формулируется закон действующих масс Каков физический смысл константы скорости реакции 4. Как влияет температура на скорость реакции Что показывает температурный коэффициент скорости реакции 5. Что такое энергия активации Схематически (на энергетической кривой) представьте энергию активации экзотермического и эндотермического процессов. 6. Какие вещества называются катализаторами Виды катализа. 7. В чем разница между гомогенным и гетерогенным катализом Каков механизм действия катализаторов в двух случаях катализа 8. Каков механизм цепных реакций Приведите примеры цепных реакций, идущих по неразветвленному и разветвленному механизмам. 9. Какие химические реакции называются обратимыми, а какие — необратимыми 10. Какое состояние системы называется состоянием химического равновесия Каков физический смысл константы равновесия реакции 11. Что называется смещением химического равновесия 12. Как формулируется принцип Ле Шателье Как влияет изменение концентраций реагирующих веществ, температуры и давления (для газов) на смещение химического равновесия [c.25]
Что называется смещением химического равновесия 12. Как формулируется принцип Ле Шателье Как влияет изменение концентраций реагирующих веществ, температуры и давления (для газов) на смещение химического равновесия [c.25]
Выше мы рассматривали простейший тип обратимой химической реакции, уравнение которой А- -В С- -0) содержит стехиометрические коэффициенты, равные единице. Вообще же в выражении константы равновесия указанные коэффициенты являются показателями степеней при концентрациях соответствующих веществ см. выражение для скорости химической реакции, стр. 106, формула (8—2а)]. [c.123]
Если в системе п веществ претерпевают химические изменения в обратимой химической реакции, то в условиях равновесия имеем два уравнения Связи для одной нз фаз [c.194]
Необратимые и обратимые реакции. Химическое равновесие (83 [c.185]
Особое состояние химической системы. Химическое равновесие наблюдается для любой обратимой реакции, протекающей в замкнутом объеме при определенных условиях реакции. Оно устанавливается, когда скорость прямой реакции ( ) и скорость обратной реакции ( о.р) равны. В этом случае в системе при постоянных условиях устанавливается определенное постоянное соотношение между концентрациями исходных веществ и продуктов реакции. [c.72]
Химическое равновесие наблюдается для любой обратимой реакции, протекающей в замкнутом объеме при определенных условиях реакции. Оно устанавливается, когда скорость прямой реакции ( ) и скорость обратной реакции ( о.р) равны. В этом случае в системе при постоянных условиях устанавливается определенное постоянное соотношение между концентрациями исходных веществ и продуктов реакции. [c.72]
Экспериментальный метод определения константы равновесия отличается высокой точностью и достоверностью, но его возможности весьма ограниченны. Во-первых, он распространяется лишь на практически обратимые реакции. Во-вторых, он не может быть использован для изучения медленно протекающих реакций, химическое равновесие в которых устанавливается слишком долго. В-третьих, не всегда удается подобрать подходящий метод анализа, обладающий достаточной чувствительностью, скоростью выполнения и не нарушающий при этом целостности изучаемой химической системы. [c.140]
Между ионами и недиссоциированными молекулами устанавливается динамическое равновесие, как при обратимой химической реакции [c. 43]
43]
Если в системе протекают обратимые химические реакции, то появляются дополнительные условия равновесия, определяемые условием химического равновесия (IX.32). [c.210]
В этом смысле почти все химические реакции являются двусторонними. В ходе их протекания исходные вещества образуют продукты, которые, вступая во взаимодействие между собой, образуют снова молекулы исходных веществ. Пока скорости этих процессов неодинаковы, происходят заметные изменения количеств реагентов. Если скорости прямого и обратного процессов становятся равными, то наступает динамическое равновесие, прямой и обратный процессы полностью компенсируют друг друга. В этом случае концентрации реагентов перестают изменяться и подчиняются термодинамическому закону действующих масс. Иногда химическая реакция практически может быть обусловлена лишь односторонним процессом. Это может произойти, если продукты быстро удаляются из зоны реакции и не успевают вступать во взаимодействие.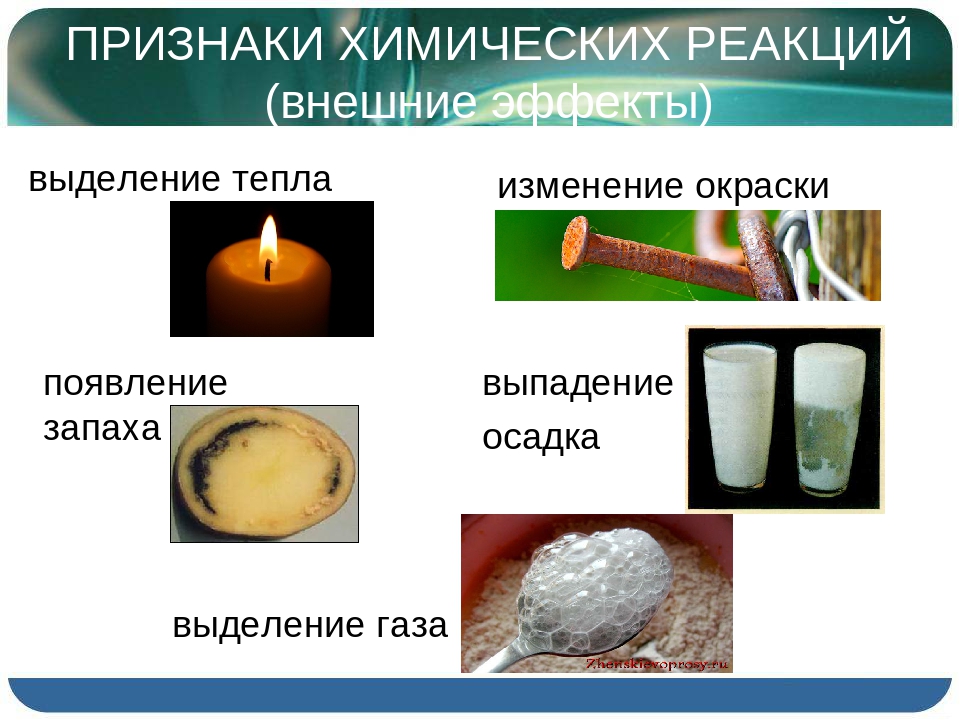 Например, выделение газа или выпадение осадка из раствора. В этом случае скорость обратной реакции несоизмеримо меньше скорости прямой. Заметим, что понятие двусторонних реакций не соответствует термодинамическому термину обратимый процесс . Двусторонние химические реакции могут быть названы термодинамически обратимыми только вблизи равновесия, когда скорости прямой и обратной реакций лишь бесконечно мало отличаются друг от друга. [c.267]
Например, выделение газа или выпадение осадка из раствора. В этом случае скорость обратной реакции несоизмеримо меньше скорости прямой. Заметим, что понятие двусторонних реакций не соответствует термодинамическому термину обратимый процесс . Двусторонние химические реакции могут быть названы термодинамически обратимыми только вблизи равновесия, когда скорости прямой и обратной реакций лишь бесконечно мало отличаются друг от друга. [c.267]
Приведенный пример с реакцией между йодом и водородом показывает, что в зависимости от условий химические реакции могут протекать либо в прямом, либо в обратном направлении. В этом смысле и надо понимать часто используемый термин обратимая реакция . Но такое понятие не идентично понятию обратимости, используемому в термодинамике. Химические реакции в обычных условиях принадлежат к числу необратимых процессов, идущих самопроизвольно лишь в одном определенном направлении до тех пор, пока не будет достигнуто состояние термодинамического равновесия . [c.166]
[c.166]
Время релаксации т — время обратимой химической реакции, не достигшей состояния равновесия, когда система приближается к состоянию равновесия в е раз, т. е. время, за которое в е раз уменьшится разница концентраций С — С или — С (С — равновесная концентрация реагента). [c.10]
Равновесие химическое — протекание химической реакции в прямом и обратном направлении (см. обратимые реакции в гл. IV), устанавливается такое состояние, когда скорости прямой и обратной реакции равны, а концентрации реагентов и продуктов постоянны (стационарны). Оно характеризуется константой равновесия а скорость его достижения — временем релаксации т (см. гл. IV, 1). [c.12]
Обратимые и необратимые реакции. Химическое равновесие 116 [c.381]
Необратимые и обратимые реакции. Химическое равновесие. Когда при химическом взаимодействии хотя бы одно из исходных веществ расходуется полностью, реакцию считают необратимой, протекающей до конца. Примером необратимой реакции может быть разложение бертолетовой соли [c.127]
Примером необратимой реакции может быть разложение бертолетовой соли [c.127]
Все химические реакции обратимы в том смысле, что в зависимости от условий они могут протекать как в прямом, так и в обратном направлении. Например, смесь азота и водорода реагирует с образованием аммиака. Последний, в свою очередь, частично распадается на исходные вещества. Эта обратимость, однако, не эквивалентна термодинамической обратимости. Реакция, обратимая термодинамически, должна как в прямом, так и в обратном направлении проходить через непрерывную последовательность равновесных состояний. С этой точки зрения химические реакции в обычных условиях их протекания принадлежат к числу необратимых процессов они совершаются самопроизвольно лишь в одном направлении, пока не будет достигнуто состояние термодинамического равновесия, называемое, применительно к химическим процессам, химическим равновесием. [c.123]
Когда в процессе обратимой химической реакции общее число молекул не меняется, изменение давления не влияет на состояние химического равновесия системы. [c.154]
[c.154]
Как известно, многие химические реакции, для которых характерны высокие энергии активации, при обычных условиях протекают очень медленно, а при нагревании скорость реакции возрастает. Однако нагревание как способ увеличения скорости реакции не всегда возможно. Например, регулировать скорости химических реакций, протекающих в живых организ- -мах, изменяя температуру в широких пределах, вообще нельзя. К тому же для обратимых реакций, как было показано на примере реакции синтеза аммиака, повышение температуры приводит к сдвигу химического равновесия в сторону уменьшения выхода аммиака, что не выгодно для производства. Поэтому в практике для регулирования скоростей реакций используют катализаторы. [c.119]
Стремление обратимой химической реакции к равновесию можно оценить с кинетической точки зрения. В данной реакции при условии Т onst мы должны рассмотреть две скорости скорость прямого процесса и скорость обратного процесса Wz, причем эти скорости направлены в противоположные стороны [c. 153]
153]
Это выражение константы равновесия указывает на возможность направлять обратимую химическую реакцию в ту или другую сторону. Так, например, увеличение концентрации одного из реагирующих веществ, т. е. или j. должно вызвать увеличение концентраций образующихся веществ g и с , так как только в этом случае константа равновесия останется неизменной. Наоборот, увеличивая концентрацию g или с , можно вызвать обратную реакцию. В нашем примере увеличение концентрации хлористого натрия или серной кислоты приведет к увеличению количеств NaHS04 и НС1. [c.22]
Это уравнение по существу 1грименимо лишь к обратимым химическим реакциям однако для случаев, когда скорости дальнейших превращений продуктов реакции очень малы, а в пределе равны нулю, некоторые авторы расширяют область его применения на реакции, по существу необратимые, в частности — на реакции образования и распада углеводородов. Таким образом, могут быть нроизведоиы, наиример, вычисления свободной энергии образования углеводородов различных типов из элементов и тому подобные расчеты. Хотя все вычисления этого рода за недостатком необходимых опытных данных неизбежно являются весьма приближенными, тем не менее ими можпо пользоваться для приблизительного расчета изменения свободной энергии при отдельных реакциях крекинга и пиролиза зная жо величину А, можно па основании вышеприведенного уравнения вычислить константу равновесия ТГ для данного процесса, которая, указывая на количественные соотношения концентраций веществ, принимающих участие в данном равновесии, по существу определяет направление реакции чем больше константа равновесия, тем глубже протекает реакция в данном направлении, и наоборот. Таким образом, с помощью расчета оказывается, по крайней море, возможным предугадать возможность или невозможность реакции в данном направлении. [c.459]
Хотя все вычисления этого рода за недостатком необходимых опытных данных неизбежно являются весьма приближенными, тем не менее ими можпо пользоваться для приблизительного расчета изменения свободной энергии при отдельных реакциях крекинга и пиролиза зная жо величину А, можно па основании вышеприведенного уравнения вычислить константу равновесия ТГ для данного процесса, которая, указывая на количественные соотношения концентраций веществ, принимающих участие в данном равновесии, по существу определяет направление реакции чем больше константа равновесия, тем глубже протекает реакция в данном направлении, и наоборот. Таким образом, с помощью расчета оказывается, по крайней море, возможным предугадать возможность или невозможность реакции в данном направлении. [c.459]
С другой стороны, имеется группа работ, в которых делается попытка осмыслить, как же образуется опорное значение для тех или иных переменных в организме [216, 253, 295, 362]. В частности, считается, что при более широком понимании установочная точка аналогична константе равновесия обратимой химической реакции [216, стр. 28]. Тем самым подчеркивается, что установочная точка — уставка — не столько является чем-то навязанным системе извне, сколько формируется в самой системе под влиянием взаимодействия ее компонент, а ее величина зависит от структуры системы. Например, для системы ориентации у рыб установочная точка определяется функциональной анатомией соответствующих органов чувств [216]. В системе терморегуляции поддержание нормальной температуры обеспечивается одновременным функционированием механизмов потоотделения, дрожи, сосудистых реакций и т. д., так что вся эта система, благодаря своей структуре, автоматически смещается к такому значению температуры, при котором суммарный темп теплопродукции равен темпу суммарной теплоЬтдачи [295, 362]. Эта равновесная температура и играет роль установочной точки в системе терморегуляции. Таким образом, в этих работах не предполагается, что все элементы модели рис. 7.4, а реально существуют в биологическом прототипе. Наконец, в ряде работ в свое время допускалось, что сравнивающие устройства (или их аналоги) и опорные значения могут реально существовать в организме [9, 34, 95].
28]. Тем самым подчеркивается, что установочная точка — уставка — не столько является чем-то навязанным системе извне, сколько формируется в самой системе под влиянием взаимодействия ее компонент, а ее величина зависит от структуры системы. Например, для системы ориентации у рыб установочная точка определяется функциональной анатомией соответствующих органов чувств [216]. В системе терморегуляции поддержание нормальной температуры обеспечивается одновременным функционированием механизмов потоотделения, дрожи, сосудистых реакций и т. д., так что вся эта система, благодаря своей структуре, автоматически смещается к такому значению температуры, при котором суммарный темп теплопродукции равен темпу суммарной теплоЬтдачи [295, 362]. Эта равновесная температура и играет роль установочной точки в системе терморегуляции. Таким образом, в этих работах не предполагается, что все элементы модели рис. 7.4, а реально существуют в биологическом прототипе. Наконец, в ряде работ в свое время допускалось, что сравнивающие устройства (или их аналоги) и опорные значения могут реально существовать в организме [9, 34, 95]. [c.214]
[c.214]
Для случая мгновенной обратимой химической реакции траектории процесса ректификации будут располагаться иа многообразиях химического равновесия, в связи с чем структура полной диаграммы фазового равновесия будет оказывать лишь косвенное влияние на поведение этих траекторий. В случае протекания одной обратимой реакции размерность многообразия химического равновесия будет на единицу меньше размерности концентрационного симплекса, соответствующего всей рассматриваемой многокомпонентной смеси. Это и понятно, так как выбранным условиям соответствует одно дополнительное уравнение связи. Естественно, каждое из многообразий химического равновесия будет обладать своей термодинамико-топологичес кой структурой, при> ем в основу различия этих структур может быть также положено общее число и взаимное расположение особых точек рассматриваемого многообразия. [c.195]
Реакции без изменения состояния окисления элементов чаще всего протекают в газовых и жидких растворах с участием ионов. Как известно, ионные реакции обратимы, и теоретически каждой системе ионов при данных условиях отвечает определенное состояние равновесия. Смещение химического равновесия (иногда практически нацело) происходит при уменьшении концентрации каких-либо ионов за счет образования относительно мало ионизирующихся молекул или комплексных ионов малорастворимых или летучих соединений правило Бертолле). Так, в реакции нейтрализации ионное равновесие смещается в сторону образования мало ионизирующихся молекул растворителя, например в водном растворе [c.207]
Как известно, ионные реакции обратимы, и теоретически каждой системе ионов при данных условиях отвечает определенное состояние равновесия. Смещение химического равновесия (иногда практически нацело) происходит при уменьшении концентрации каких-либо ионов за счет образования относительно мало ионизирующихся молекул или комплексных ионов малорастворимых или летучих соединений правило Бертолле). Так, в реакции нейтрализации ионное равновесие смещается в сторону образования мало ионизирующихся молекул растворителя, например в водном растворе [c.207]
Для простоты рассмотрим двухксмпонентную систему, состоящую из двух фаз аир. Анализ будем вести, допуская отсутствие обратимых химических реакций, а также пренебрегая гравитационными и капиллярными силами. Система, находящаяся в состоянии равновесия, должна удовлетворять условиям равновесия в виде (IX.22). Наиболее простой и наглядный вывод уравнения Ван-дер-Ваальса можно сделать на основе фундаментального уравнения Гиббса (VI.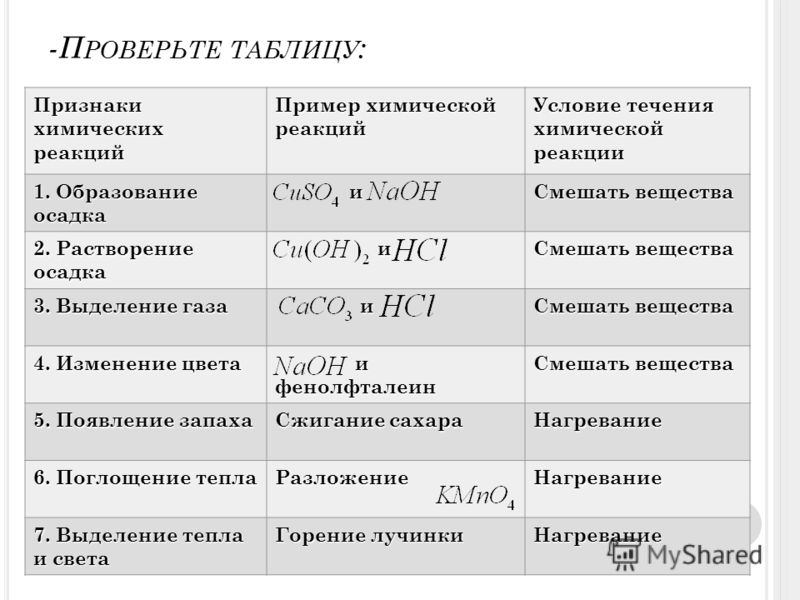 3I), которое для указанных фаз при учете (1.1) запишется в следующей форме [c.228]
3I), которое для указанных фаз при учете (1.1) запишется в следующей форме [c.228]
Величина Ка, характеризующая устойчивое равновесие системы, возникающее в результате данной обратимой химической реакции, является термодинамической константой равновесия. Так как активности — величины отвлеченные, то и константа равновесия безразмерна — вывод, вытекающий непосредственно и из (XIII, 4), и из сравнения размерностей и RT. [c.388]
Равновесие в обратимых химических реакциях описывается законом действующих масс (з. д. м.) (Гульдберг, Вааге, 1867). Если концентрации или парциальные давления веществ — участников реакции сравнительно малы, то з. д. м. устанавливает постоянство отно-шения произведения равновесных концентраций (или парциальных давлений) продуктов реакции к произведению концентраций (или парциальных давлений) исходных веществ, взятых в степенях, равных стехиометрическим коэффициентам (при Т = onst). [c.131]
Примеры возникновения и течения химических реакций.
 Классификация химических реакций
Классификация химических реакцийЧасть I
1. Химические явления, или химические реакции, — это явления, при которых происходит превращения одних веществ в другие.
2. Образование новых веществ сопровождается появлением новых признаков или свойств , характеризующих эти вещества, что можно зафиксировать с помощью органов чувств, т.е. заметить признаки химических реакций.
3. Заполните таблицу «Признаки химических реакций».
4. Классификация реакций по признаку выделения или поглощения теплоты.
5. Условия течения химических реакций:
— соприкосновение реагирующих веществ;
— первоначальное нагревание для некоторых экзотермических реакций;
— постоянное нагревание для эндотермических реакций.
Часть II
1. В каком случае можно говорить, что протекает химическая реакция?
1) В пробирку с раствором щёлочи приливают индикатор фенолфталеин.
3) В пробирку с раствором щёлочи приливают индикатор метиловый оранжевый.
Ответ поясните.
Так как в этих случаях наблюдается изменение окраски раствора, в 1 – раствор станет малиновый, во 3 – жёлтый.
2. Прочитайте внимательно стихотворение.
Явил ряд признаков подряд
Нам, разлагаясь, бихромат:
Цвет, звук, огонь и даже газ
Заметить каждый мог из нас.
Чтоб превращенье началось,
Поджечь кристаллы нам пришлось.
Тепло наружу – это экзо,
Горенье – свет,
Тепло вовнутрь – это эндо –
Обратный тепловой эффект!
О каких признаках описанной реакции говорится в стихотворении?
Изменение окраски, образование газа, появление запаха.
Если на уроке вам не демонстрировали эту реакцию, найдите в Интернете видеофрагмент «Разложение бихромата аммония», просмотрите его и сделайте рисунок, навеянный этой замечательной реакцией.
3. Установите соответствие между признаком и химической реакцией.
4. При приготовлении раствора серной кислоты следует:
При приготовлении раствора серной кислоты следует:
2) серную кислоту приливать к воде.
Ответ поясните.
Выделяется большое количество теплоты, вода может закипеть и выбросить брызги на лицо и руки работающего.
5. Верны ли следующие суждения?
А. Экзотермические реакции, как правило, идут при постоянном нагревании.
Б. Эндометрические реакции могут протекать без нагревания.
4) оба суждения неверны.
6. Чтобы увеличить скорость химической реакции между твёрдыми и газообразными веществами, нужно измельчить твёрдое вещество.
7. Чтобы увеличить скорость химической реакции между твёрдыми растворимыми веществами, нужно измельчить и растворить их в воде.
8. Укажите, что нужно сделать, чтобы ликвидировать возгорание:
1) твёрдых веществ и материалов – закрыть плотным материалом;
2) нефтепродуктов – использовать огнетушитель;
3) электроприборов – обесточить и накрыть плотным материалом.
В промышленности подбирают такие условия, чтобы осуществлялись нужные реакции, а вредные замедлялись.
ТИПЫ ХИМИЧЕСКИХ РЕАКЦИЙ
В таблице 12 приведены основные типы химических реакций по числу участвующих в них частиц. Даны рисунки и уравнения часто описываемых в учебниках реакций разложения , соединения , замещения и обмена .
В верхней части таблицы представлены реакции разложения воды и гидрокарбоната натрия. Изображён прибор для прохождения через воду постоянного электрического тока. Катод и анод представляют собой металлические пластинки, погружённые в воду и соединённые с источником электрического тока. В связи с тем, что чистая вода практически не проводит электрический ток, к ней добавляют небольшое количество соды (Nа 2 СО 3) или серной кислоты (Н 2 SО 4). При прохождении тока на обоих электродах происходит выделение пузырьков газа. В трубке, где собирается водород, объём оказывается вдвое большим, чем в трубке, где собирается кислород (о его наличии можно удостовериться с помощью тлеющей лучинки). Модельная схема демонстрирует реакцию разложения воды. Химические (ковалентные) связи между атомами в молекулах воды разрушаются, и из освобождающихся атомов образуются молекулы водорода и кислорода.
Химические (ковалентные) связи между атомами в молекулах воды разрушаются, и из освобождающихся атомов образуются молекулы водорода и кислорода.
Модельная схема реакции соединения металлического железа и молекулярной серы S 8 показывает, что в результате перегруппировки атомов в процессе реакции образуется сульфид железа. При этом разрушаются химические связи в кристалле железа (металлическая связь) и молекуле серы (ковалентная связь), а освободившиеся атомы соединяются с образованием ионных связей в кристалл соли.
К другой реакции соединения относится гашение извести СаО водой с образованием гидроксида кальция. При этом жжёная (негашёная) известь начинает разогреваться и образуется рыхлый порошок гашёной извести.
К реакциям замещения относят взаимодействие металла с кислотой или солью. При погружении достаточно активного металла в сильную (но не азотную) кислоту выделяются пузырьки водорода. Более активный металл вытесняет менее активный из раствора его соли.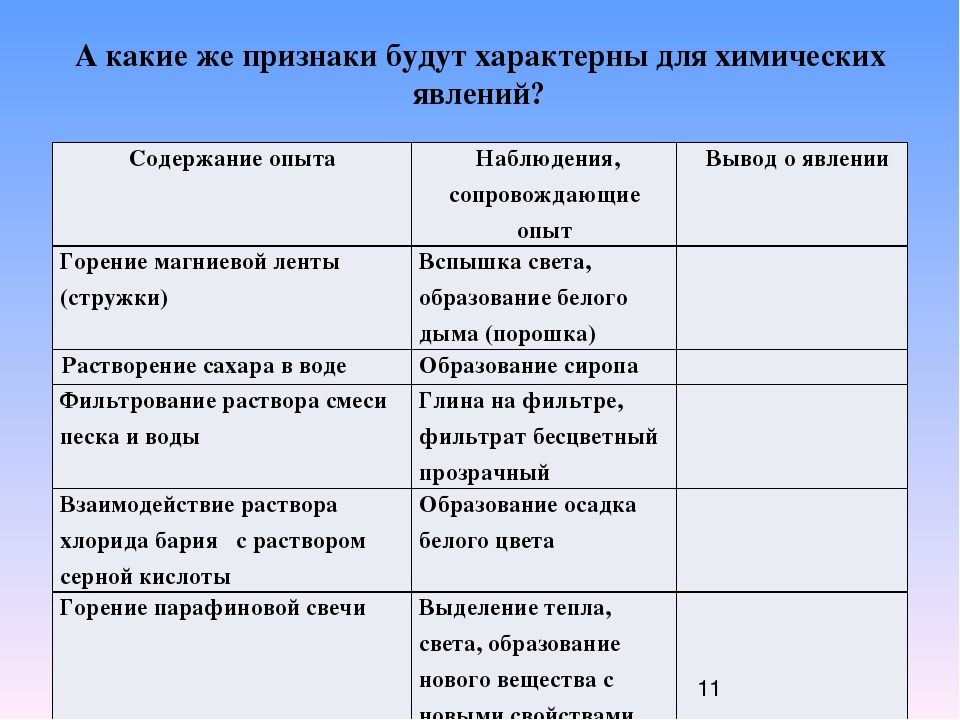
Типичными реакциями обмена является реакция нейтрализации и реакция между растворами двух солей. На рисунке показано получение осадка сульфата бария. За ходом реакции нейтрализации следят с помощью индикатора фенолфталеина (малиновая окраска исчезает).
Таблица 12
Типы химических реакций
ВОЗДУХ. КИСЛОРОД. ГОРЕНИЕ
Кислород является самым распространённым химическим элементом на Земле. Содержание его в земной коре и гидросфере представлено в таблице 2 «Распространённость химических элементов». На долю кислорода приходится примерно половина (47 %) массы литосферы. Он является преобладающим химическим элементом гидросферы. В земной коре кислород присутствует только в связанном виде (оксиды, соли). Гидросфера также представлена в основном связанным кислородом (часть молекулярного кислорода растворена в воде).
В атмосфере свободного кислорода содержится 20,9 % по объёму. Воздух – сложная смесь газов. Сухой воздух на 99,9 % состоит из азота (78,1 %), кислорода (20,9 %) и аргона (0,9 %). Содержание этих газов в воздухе практически постоянно. В состав сухого атмосферного воздуха также входят диоксид углерода, неон, гелий, метан, криптон, водород, оксид азота(I) (оксид диазота, гемиоксид азота – N 2 О), озон, диоксид серы, монооксид углерода, ксенон, оксид азота(IV) (диоксид азота – NО 2).
Содержание этих газов в воздухе практически постоянно. В состав сухого атмосферного воздуха также входят диоксид углерода, неон, гелий, метан, криптон, водород, оксид азота(I) (оксид диазота, гемиоксид азота – N 2 О), озон, диоксид серы, монооксид углерода, ксенон, оксид азота(IV) (диоксид азота – NО 2).
Состав воздуха определил французский химик Антуан Лоран Лавуазье в конце XVIII века (таблица 13). Он доказал содержание кислорода в воздухе, и назвал его «жизненный воздух». Для этого он нагревал на печи ртуть в стеклянной реторте, тонкая часть которой поводилась под стеклянный колпак, опущенный в водяную баню. Воздух под колпаком оказывался замкнутым. При нагревании ртуть соединялась с кислородом, превращаясь в оксид ртути красного цвета. «Воздух», оставшийся в стеклянном колпаке после нагревания ртути, не содержал кислорода. Мышь, помещённая под колпак, задыхалась. Прокалив оксид ртути, Лавуазье снова выделил из него кислород и вновь получил чистую ртуть.
Содержание кислорода в атмосфере стало заметно увеличиваться около 2 млрд. лет назад. В результате реакции фотосинтеза поглощался некоторый объём углекислого газа и выделялся такой же объём кислорода. На рисунке таблицы схематически показано образование кислорода при фотосинтезе. В процессе фотосинтеза в листьях зелёных растений, содержащих хлорофилл , при поглощении солнечной энергии происходит превращение воды и углекислого газа в углеводы (сахара) и кислород . Реакцию образования глюкозы и кислорода в зелёных растениях можно записать в следующем виде:
лет назад. В результате реакции фотосинтеза поглощался некоторый объём углекислого газа и выделялся такой же объём кислорода. На рисунке таблицы схематически показано образование кислорода при фотосинтезе. В процессе фотосинтеза в листьях зелёных растений, содержащих хлорофилл , при поглощении солнечной энергии происходит превращение воды и углекислого газа в углеводы (сахара) и кислород . Реакцию образования глюкозы и кислорода в зелёных растениях можно записать в следующем виде:
6Н 2 О + 6СО 2 = С 6 Н 12 О 6 + 6О 2 .
Образующаяся глюкоза превращается в нерастворимый в воде крахмал , который накапливается в растениях.
Таблица 13
Воздух. Кислород. Горение
Фотосинтез представляет собой сложный химический процесс, включающий несколько стадий: поглощение и транспортировку солнечной энергии, использование энергии солнечного света для инициирования фотохимических окислительно-восстановительных реакций, восстановление углекислого газа и образованием углеводов.
Солнечный свет – это электромагнитное излучение разных длин волн. В молекуле хлорофилла при поглощении видимого света (красного и фиолетового) происходят переходы электронов из одного энергетического состояния в другое. На фотосинтез расходуется только небольшая часть солнечной энергии (0,03 %), достигающей поверхности Земли.
Весь имеющийся на Земле диоксид углерода проходит через цикл фотосинтеза в среднем за 300 лет, кислород – за 2000 лет, вода океанов – за 2 млн. лет. В настоящее время в атмосфере установилось постоянное содержание кислорода. Он практически полностью расходуется на дыхание, горение и гниение органических веществ.
Кислород – одно из самых активных веществ. Процессы с участием кислорода называются реакциями окисления. К ним относят горение, дыхание, гниение и многие другие. На таблице показано горение нефти, которое идёт с выделением теплоты и света.
Реакции горения могут принести не только пользу, но и вред. Горение можно остановить, прекратив доступ воздуха (окислителя) к горящему предмету с помощью пены, песка или одеяла.
Пенные огнетушители наполняют концентрированным раствором питьевой соды. При её контакте с концентрированной серной кислотой, находящейся в стеклянной ампуле в верхней части огнетушителя, образуется пена углекислого газа. Для приведения в действие огнетушитель переворачивают и ударяют об пол металлическим штифтом. При этом ампула с серной кислотой разбивается и образующийся в результате реакции кислоты с гидрокарбонатом натрия углекислый газ вспенивает жидкость и выбрасывает её из огнетушителя сильной струёй. Пенистая жидкость и углекислый газ, обволакивая горящий предмет, оттесняют воздух и гасят пламя.
Похожая информация.
Проведению урока предшествует экскурсия в историко-этнографический музей на открытом воздухе “Тукай кырлай”, с посещением дома-музея Г. Тукая.
Задачи обучения. Сформировать знания о признаках и условиях протекания химических реакций, на этой основе усовершенствовать умение отличать физические процессы от химических.
Задачи развития. Совершенствовать умение
объяснять зависимость протекания химических
реакций от внешних условий.
Совершенствовать умение
объяснять зависимость протекания химических
реакций от внешних условий.
Эксперимент. Плавление парафина, обугливание крахмала, горение лучины, взаимодействие гидроксида натрия с соляной кислотой в присутствии фенолфталеина, взаимодействие сульфата меди (II) и гидроксида натрия, взаимодействие растворов карбоната натрия и соляной кислоты.
Планируемые результаты обучения. Учащиеся должны уметь на примерах конкретных химических реакций указывать условия их возникновения и дальнейшего протекания, а также признаки реакций.
Планируемые результаты развития. Учащиеся должны уметь объяснять связь между условиями и возможностью протекания химических реакций.
Урок начинается с прочтения учащимися стихов Г. Тукая на татарском языке, критерием при подборе стихов является отражение в них различных явлений природы
В процессе демонстрации опытов (плавление
парафина, обугливание крахмала) выясняем
сущность происходящих явлений и составляем
таблицу.
Для закрепления знаний проводим беседу с учащимися и отвечаем на вопросы.
Закружилась листва золотая
В розоватой воде на пруду.
Словно бабочек лёгкая стая с
Замираньем летит на звезду…
Вопросы учителя:
1. О каком явлении в жизни растений говорится в
стихах С. Есенина?
2. К физическим или химическим явлениям относится
листопад?
3. С чем связано изменение цвета листьев деревьев
осенью, какие явления физические или химические
происходят при этом?
4. Какой пигмент обуславливает зелёную окраску
листьев растений?
5. Какой процесс происходит в зеленых листьях
растений под действием солнечного света?
Сообщение ученика. Фотосинтез – химическое явление (на доске запись уравнения реакции фотосинтеза).
Для развития умений учащихся по самоконтролю знаний проводим тестированный контроль.
1. К химическим явлениям (в отличие от физических) относятся:
- Сгорание бензина в двигателе автомобиля,
- скисание молока,
- таяние снега,
- образование инея на деревьях.

2. Какие из природных явлений сопровождаются химическими реакциями?
- Выпадение дождя,
- извержение вулканов,
- гниение растительных остатков,
- ледоход на реке.
3. Какие из признаков характерны для химических реакций?
- Образование осадка,
- изменение агрегатного состояния,
- выделение газа,
- измельчение вещества.
4. К физическим явлениям (в отличие от химических) относятся:
- горение угля,
- приготовление порошка из куска мела,
- образование ржавчины,
- свечение вольфрамовой нити в лампочке.
Учитель. Для чего нам необходимо знать условия возникновения и условия протекания химических реакций?
Ученик. Для того, чтобы контролировать протекание химических реакций, иногда химическую реакцию необходимо прекратить, например, при пожаре мы стремимся прекратить реакцию горения.
Сообщение
ученика. Лесной пожар – это неконтролируемое
горение растительности, стихийно
распространяющееся по лесной территории.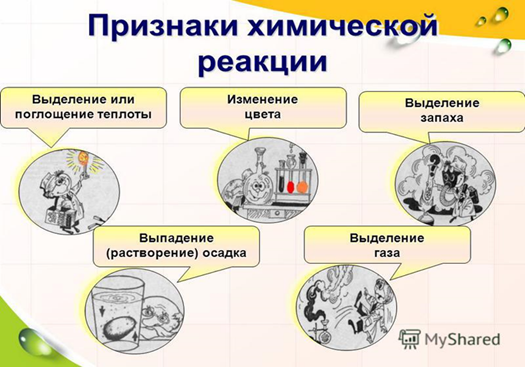 Лесные
пожары ежегодно возникают в лесах Татарстана, а
также в других странах мира на обширных площадях
и нередко принимают характер стихийного
бедствия. Лесные пожары уничтожают лесной фонд
Татарстана, а также представляют опасность и для
населения. При этом возникает непосредственная
угроза уничтожения огнём населённых пунктов и
объектов народного хозяйства, расположенных
вблизи лесных массивов, а также сильное
задымление и загазованность территорий, даже
удалённых от кромки леса.
Лесные
пожары ежегодно возникают в лесах Татарстана, а
также в других странах мира на обширных площадях
и нередко принимают характер стихийного
бедствия. Лесные пожары уничтожают лесной фонд
Татарстана, а также представляют опасность и для
населения. При этом возникает непосредственная
угроза уничтожения огнём населённых пунктов и
объектов народного хозяйства, расположенных
вблизи лесных массивов, а также сильное
задымление и загазованность территорий, даже
удалённых от кромки леса.
“Дым был столь обильным, что птицы не могли
парить, падали на землю»
Общая площадь лесов Республики Татарстан 1270,3
тыс. га, в том числе покрытая лесом – 1165,3 тыс. га,
из них лесные культуры 281,1 тыс. га. Общий запас
древесины – 168,8 млн.м 3 . Средний прирост
древесины – 4,13 м 3 /га
Почти все лесные пожары в Татарстане происходят
из-за людской небрежности.
Пожароопасный сезон 2004 года в Татарстане начался
20 апреля. За это время в республике леса горели
более 40 раз, сообщили Intertat. ru в пресс-службе
Главного Управления природных ресурсов и охраны
окружающей среды. Примечательно, что из 41 случая
лесных пожаров 39 связаны с нарушениями
гражданами требований Правил пожарной
безопасности в лесах РФ.
ru в пресс-службе
Главного Управления природных ресурсов и охраны
окружающей среды. Примечательно, что из 41 случая
лесных пожаров 39 связаны с нарушениями
гражданами требований Правил пожарной
безопасности в лесах РФ.
Для закрепления и обобщения знаний учащиеся отвечают на вопросы.
1. Каковы условия возникновения и прекращения горения?
2. Какие средства тушения пожара нужно использовать в следующих случаях:
а) загорелась одежда на человеке;
б) воспламенился бензин;
в) возник лесной пожар;
г) загорелась нефть на поверхности воды?
В заключительной части урока учитель подводит итог урока, ученики получают домашние задание.
Рассмотрим, как на уроках химии в VII-VIII классах следует развивать знания об условиях возникновения и течения химической реакции.
На первых уроках достаточно, если учащиеся узнают, что при одних и тех же условиях одно вещество подвергается химическому превращению, а другое — нет (нагревание стеарина и сахара), что в одних условиях с веществом происходит только физическое изменение, а при других-и химическое (растворение и нагревание сахара).
После ознакомления с признаками химической реакции проводят первое обобщение знаний об условиях химического взаимодействия, организуемое так. Учащимся предлагается ответить на вопрос: Какие условия нужны для того, чтобы: а) сахар обуглился, б) магний загорелся, в) медная пластинка покрылась черным налетом? Во всех этих случаях они называют одно и то же условие — нагревание веществ. Обсуждая ответы, учитель отмечает, что для горения Магния и почернения медной пластинки недостаточно только нагревания, необходимо соприкосновение металлов с кислородом воздуха. Для подтверждения он показывает накаливание кусочка блестящей тонкой листовой меди, сложенного в виде конвертика с плотно прижатыми краями или скрученных друг с другом толстых медных проволок. После охлаждения оказывается, что медь с внешней стороны почернела, а с внутренней осталась блестящей, так как сюда не проникали молекулы кислорода.
Учитель демонстрирует в стеклянном цилиндре раствор сернокислой меди, на который предварительно сверху был осторожно налит разбавленный раствор гидроокиси аммония. Он обращает внимание на появление ярко-синей окраски только в средней части сосуда и говорит, что химическая реакция, начавшись в том месте, где жидкости соприкасаются друг с другом, может произойти во всем объеме только в том случае, если применить перемешивание. У учащихся создаются первые представления о таких условиях химического взаимодействия, как соприкосновение реагирующих веществ к их перемешивание.
Он обращает внимание на появление ярко-синей окраски только в средней части сосуда и говорит, что химическая реакция, начавшись в том месте, где жидкости соприкасаются друг с другом, может произойти во всем объеме только в том случае, если применить перемешивание. У учащихся создаются первые представления о таких условиях химического взаимодействия, как соприкосновение реагирующих веществ к их перемешивание.
В заключение отмечают, что важнейшие условия химической реакции: 1) наличие веществ, которые могут испытывать химические превращения, 2) соприкосновение и перемешивание веществ (если реакция идет между двумя веществами), 3) нагревание.
Для проверки и закрепления знаний используют следующие вопросы и задания:
- Назовите условия, необходимые для химических реакций. Приведите примеры. Какое значение имеет знание этих условий для практики?
- Какие условия были необходимы для того, чтобы: а) медь покрылась черным налетом, б)известковая вода помутнела?
- Какие условия для возникновения химической реакции мы создаем, когда зажигаем спиртовку или газовую горелку? Какие из этих условий мы нарушаем, когда гасим пламя?
При изучении следующей темы — «Первоначальные сведения о строении и составе веществ» — учитель обращает внимание на условия тех превращений, которые используются для формирования понятии о реакции разложения и реакции соединения.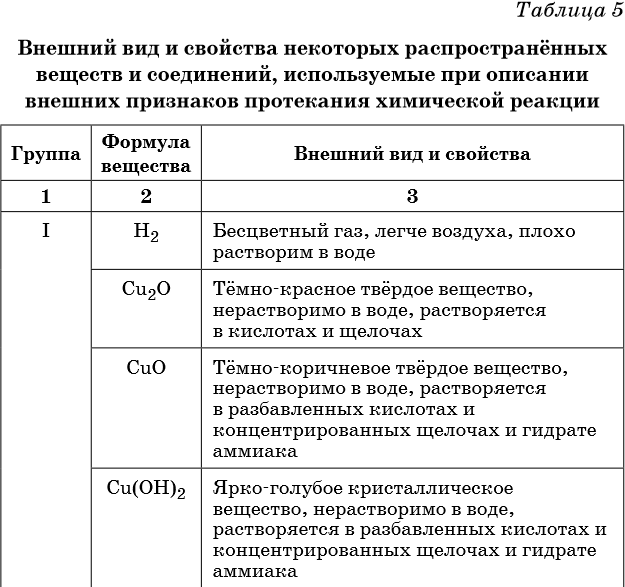 Подчеркивает, что для разложения окиси ртути и основной углекислой меди нужно постоянное нагревание, а для разложения воды-действие электрического тока. Соединение серы с железом начинается только при нагревании, а затем, поскольку при этой реакции выделяется теплота, дальнейшее нагревание смеси уже не нужно.
Подчеркивает, что для разложения окиси ртути и основной углекислой меди нужно постоянное нагревание, а для разложения воды-действие электрического тока. Соединение серы с железом начинается только при нагревании, а затем, поскольку при этой реакции выделяется теплота, дальнейшее нагревание смеси уже не нужно.
Учащиеся должны узнать, что не все реакции разложения идут с поглощением теплоты и не всякое соединение веществ сопровождается ее выделением. Учитель показывает опыт: нагревает пробирку с двухромовокислым аммонием только до начала реакции, которая продолжается и после прекращения нагревания. Разогревание вещества, выбрасывание из пробирки раскаленных частичек показывает, что реакция идет с выделением теплоты.
Затем приводится пример реакции соединения, про-исходящей с поглощением теплоты: соединение азота с кислородом идет при температуре выше 1200° С и требует постоянного нагревания.
Дальнейшее развитие и закрепление знаний об условиях химических реакций происходит в теме «Кислород. Воздух».
Воздух».
После изучения химических свойств кислорода учащимся предлагают вопросы:
- Какие условия необходимы для горения древесного угля; серы, фосфора и магния в кислороде и в воздухе? Почему эти вещества достаточно нагреть только до начала реакции?
- Для чего перед сжиганием стального пера в кислороде к кончику пера прикрепляют кусочек пробки? Происходит ли выделение теплоты при взаимодействии железа с кислородом? Почему вы так думаете?
- Какие условия горения и как мы создаем их, когда зажигаем газ на газовой плите?
Когда учащиеся изучат состав воздуха, им можно предложить следующие задания и вопросы:
- Сравните условия: а) образования красного порошка окиси ртути в опыте Лавуазье и б) разложения окиси ртути. В чем сходство и различие этих условий?
- Почему при слабом длительном нагревании ртути в закрытом сосуде с воздухом образование окиси ртути прекращается? Какое условие окисления ртути нарушается?
- В большую банку с воздухом поместили горящую свечу, затем банку закрыли пробкой.
 Свеча горела некоторое время, а затем погасла. Почему горение прекратилось? Какое условие взаимодействия веществ было нарушено?
Свеча горела некоторое время, а затем погасла. Почему горение прекратилось? Какое условие взаимодействия веществ было нарушено?
В теме «Водород» полезно разобрать, почему в аппарате Киппа при закрывании крана реакция прекращается, какое условие течения реакции при этом нарушается.
В теме «Вода. Расхворы» рассматривают химические свойства воды, изучают реакцию воды с металлами. При этом ставят опыты, которые позволяют отметить, что различные металлы вступают в реакцию с водой при различных температурных условиях. В той же теме желательно сравнить условия разложения воды и ее синтеза, обратить внимание на то, что разложение воды происходит при непрерывном действии электрического тока, а для взрыва смеси водорода с кислородом в эвдиометре достаточно электрической искры. После этого перед учащимися следует поставить вопрос, какая из рассматриваемых реакций идет с выделением, а какая — с поглощением энергии.
В VIII классе, когда изучают реакции обмена между двумя солями, солью и основанием, нужно обязательно показать, каковы важнейшие условия этих реакций: растворимость исходных веществ в воде и присутствие воды.
В конце изучения темы «Важнейшие классы неорганических соединений» учащиеся составляют таблицы, в которые включают ряд примеров изученных химических превращений растворимых и нерастворимых в воде неорганических веществ, а также сведения о типах и условиях этих превращений. Пример одной из таких таблиц приведен ниже.
При обсуждении содержания таблиц прежде всего подчеркивают, что между типом химического взаимодействия и условиями реакций нет вполне определенного соответствия: одни реакции замещения идут без нагревания, а другие (между окисью меди и водородом) — с нагреванием, то же можно сказать и о реакциях обмена. Все же некоторые связи между типами реакций, участием в них растворимых и нерастворимых веществ и условиями можно подметить.
Если в реакции замещения участвует растворимое в воде сложное вещество (кислота, соль), то реакция проводится в его растворе без нагревания. Если же сложное вещество нерастворимо в воде, то требуется нагревание.
Реакция обмена между ДВУМЯ солями, солью и основанием идет без нагревания только в том случае, если эти вещества растворимы. В реакции обмена между окислом и кислотой могут вступать и нерастворимые в воде окислы, но в этом случае нужно нагревание.
В реакции обмена между окислом и кислотой могут вступать и нерастворимые в воде окислы, но в этом случае нужно нагревание.
Развитие знаний об условиях возникновения и течения реакции продолжается в темах: «Углерод и его соединения», «Металлы», «Химия и ее значение в народном хозяйстве».
Изучая аллотропные видоизменения углерода, учитель знакомит учащихся с условиями получения искусственных алмазов.
Систематическое развитие знаний об условиях возникновения и течения химических реакций в VII и VIII классах позволяет поставить перед учащимися вопросы, выясняющие условия, необходимые для воспламенения веществ и продолжения горения. Демонстрируют опыты, например пламя спирта гасят, закрывая тигель крышкой, а пламя скипидара — погружая тигель в холодную воду.
В теме «Металлы» большое внимание нужно уделить выяснению условий ржавления железа и способам предохранения его от ржавления * .
* (П. А. Глориозов, Е. П. Клещева, Л. А. Коробейникова. Т. 3. Савич. Методика преподавания химии о восьмилетней школе. М., «Просвещение», 1966. )
М., «Просвещение», 1966. )
Наконец, в теме «Химия и ее значение в народном хозяйстве», обсуждая роль химии в народном хозяйстве СССР и в охране природы, очень полезно еще раз указать на большое значение накопленных в науке знаний об условиях химических реакций и их успешное применение в настоящее время в различных областях народного хозяйства в быту.
A) Горение магния cool Плавление льда C) Оседание речного песка в воде
D) Смешивание порошков серы и железа E) кипение воды
2. Молярная масса железа равна
А) 26 г/моль cool 56 г/моль C) 52 г/моль D) 112 г/моль E) 56
3. В формуле 2Na2S число атомов натрия и серы равны
А) 1 и 2 cool 4 и 1 C) 2 и 4 D) 4 и 2 E) 2 и 1
4. Формула оксида Mn (VII)
1. MnO2 cool Mn2O7 C) Mn2O3 D) MnO3 E) MnO
5. В схеме реакции P+O2 ? P2O5 нужно поставить коэффициенты
А) 4, 5, 2 cool 2, 1, 1 C) 2, 5, 2 D 5, 4, 2 E) 2, 4, 5
6. Уравнение реакции замещения это –
A) 4Na + O2 = 2 Na2O cool CaCO3 = CaO +CO2? C) Zn + CuS = ZnS +Cu
D) 2Mg + O2 = 2MgO E) 2h3 + O2 > 2 h3O
7. Железный гвоздь погруженный в раствор хлорида меди (II) покрывается красным налетом меди. Это пример реакции:
Железный гвоздь погруженный в раствор хлорида меди (II) покрывается красным налетом меди. Это пример реакции:
A) Обмена cool Разложение C) Замещение D) Соединение E) неn такой реакции
8. Символ химического элемента марганца
A) ?е cool Mg C) О D) Mn E) Mr
9. О химическом элементе, а не о простом веществе азоте идет речь в выражении
A) Азот является составной частью воздуха cool В состав азотной кислоты HNO3 входит азот
C) Формула азота N2 D) Жидкий азот иногда используется для замораживания продуктов
E) азот инертный газ
10. Для алюминия не характерно физическое свойство
A) Электропроводность cool Теплопроводность C) Серебристо-белый цвет
D) Способность намагничиваться E) газ при обычных условиях
11. Признак, позволяющий назвать ржавление гвоздя химической реакцией – это:
A) Выделение тепла cool Выделение газа C) Изменение окраски
D) Появление запаха E) выпадение осадка
12. Сульфид железа – это сложное вещество, а не смесь потому что
A) Его можно разделить магнитом на железо и серу
cool Его можно разделить дистилляцией на железо и серу
C) Состоит из атомов разного химического элемента и его нельзя разделить физическими методами на железо и серу
D) Он нерастворим в воде E) газ при обычных условиях
13. 3.01 * 10 23 атомов железа составляют
3.01 * 10 23 атомов железа составляют
A) 2 моль cool 3 моль C) 1 моль D) 0,5 моль E) 1,5 моль
14. 69 г натрия составляют
A) 3 моль cool 1 моль C) 6,3 моль D) 1,5 моль E) 0,5 моль
15.Фильтрованием можно разделить смесь:
A) медных и железных стружек cool сахара и воды C) мела и воды
D) воды и уксусной кислоты E) воды и бензина
16. Взаимодействие магния с кислородом относятся к реакциям:
A) разложения cool обмена C) соединения D) замещения E) неn такой реакции
17. К химическим явлениям относятся:
A) измельчение мрамора cool испарение воды C) таянье льда D) плавление меди E) сгорание угля
19.Чему равна валентность алюминия?
А) 1 cool 2 C)3 D) 4 E) 5
20.Единицы измерения молярной массы:
А) граммы cool грамм/ моль C) моль D) мелограмм E) нет единицы измерения
21. Молярная масса NaHCO3 равна:
А) 156 cool 156 г/ моль C) 84 г/ моль D) 84 E) 84 л
22.Укажите реакцию разложения:
А) 2h3 + O2 > 2 h3O cool 2Na +2h3O > 2NaOH + h3
C) C + O2 > CO2 D) 2Nh4 > N2 + 3h3
E) AgNO3 + HCl > AgCl +HNO3
23. Массовая доля кислорода в серной кислоте h3SO4 равна приблизительно:
Массовая доля кислорода в серной кислоте h3SO4 равна приблизительно:
А) 16% cool 33% C) 65% D) 2% E) 17%
25.В каком из данных рядов расположены только металлы?
А) K, Zn, Fe cool Si, Ca, Bi C)Al, C, Cr D) W, Os, В E) P, Au, Pb
26.Массовая доля серы в веществе SO2 равна:
А)32 % cool 64% C) 50% D) 80% E) 12%
27.Масса сульфида цинка, образовавшегося при нагревании 10 г серы с цинком, равна:
A) 12 г cool 30,31 г C) 25,6 г D) 10,5 г E) 32,4 г
28. Символ химического элемента криптона
A)Ca cool Kr C) K D) Cd E) C
29. Веществом является
A) Воздух B)медь C) Зеркало D) Гранит E) молоко
30. В списке физических свойств лишнее
A) Плотность cool горение C) Теплопроводность
D) Температура кипения E) температура плавления
Открытый урок «Химические реакции. Признаки и условия протекания химических реакций»
Тип урока: приобретение новых знаний.
Вид урока: беседа с
демонстрацией опытов.
Цели:
Обучающие — повторить отличия химических явлений от физических. Сформировать знания о признаках и условиях протекания химических реакций.
Развивающие — развивать умения, опираясь на знание химии, ставить несложные проблемы, формулировать гипотезы., обобщать.
Воспитательные – продолжить формирование научного мировоззрения учащихся , воспитывать культуру общения через работу в парах «ученик-ученик», «ученик-учитель», а также наблюдательность, внимание, пытливость, инициативу.
Методы и методические приемы: Беседа, демонстрация опытов; заполнение таблицы , химический диктант, самостоятельная работа с карточками.
Оборудование и реактивы.
Лабораторный штатив с пробирками, железная ложечка для сжигания веществ,
пробирка с газоотводной трубкой, спиртовка, спички, растворы хлорида
железа FeCL3, роданида калия KNCS, медного купороса (сульфат меди) CuSO4,
гидрооксида натрия NaOH, карбоната натрия Na2CO3, соляной
кислоты HCL,порошок S.
Ход урока
Учитель. Мы изучаем главу «Изменения, происходящие с веществами» и знаем что изменения могут быть физическими и химическими. В чём отличие химического явления от физического?
Ученик. В результате химического явления изменяется состав вещества, а в результате физического явления состав вещества остается без изменения, а меняется лишь его агрегатное состояние или форма и размеры тел.
Учитель. В одном и том же
опыте можно одновременно наблюдать химические и физические явления. Если
медную проволоку расплющить молотком, то получится медная пластинка. Изменяется
форма проволоки, но состав её остаётся прежним. Это физическое явление. Если
медную пластинку нагреть на сильном огне, то исчезнет металлический блеск.
Поверхность медной пластинки покроется чёрным налётом, который можно соскрести
ножом. Значит, медь взаимодействует с воздухом и превращается в новое вещество. Это химическое явление. Между металлом и кислородом воздуха происходит
химическая реакция.
Это химическое явление. Между металлом и кислородом воздуха происходит
химическая реакция.
Химический диктант
Вариант 1
Задание. Укажите о каких явлениях (физических или химических) идет речь. Поясните свой ответ.
1. Сгорание бензина в двигателе автомобиля.
2. Приготовление порошка из куска мела.
3. Гниение растительных остатков.
4. Скисание молока.
5. Выпадение дождя
Вариант 2
1. Горение угля.
2. Таяние снега.
3. Образование ржавчины.
4. Образование инея на деревьях.
5. Свечение вольфрамовой нити в лампочке.
Критерии оценивания
Максимально можно набрать 10 баллов (по 1 баллу за правильно указанное явление и по 1 баллу за обоснование ответа).
Учитель. Итак, вам известно, что все явления подразделяются на физические и химические. В отличие от
физических явлений при химических явлениях , или химических реакциях,
происходит превращение одних веществ в другие. Эти превращения сопровождаются
внешними признаками. Для того чтобы познакомить вас с химическими реакциями, я
проведу ряд демонстрационных опытов. Вам нужно определить признаки, по которым
можно сказать , что произошла химическая реакция. Обратите внимание на то,
какие условия необходимы для протекания этих химических реакций.
Эти превращения сопровождаются
внешними признаками. Для того чтобы познакомить вас с химическими реакциями, я
проведу ряд демонстрационных опытов. Вам нужно определить признаки, по которым
можно сказать , что произошла химическая реакция. Обратите внимание на то,
какие условия необходимы для протекания этих химических реакций.
Демонстрационный опыт №1
Учитель. В первом опыте нужно выяснить, что происходит с хлоридом железа (111) при добавлении к нему раствора роданида калия KNCS.
FeCL3 + KNCS = Fe(NCS)3 +3 KCL
Ученик. Реакция сопровождается изменением окраски
Демонстрационный опыт №2
Учитель. В пробирку нальём 2 мл медного купороса, добавим немного раствора гидрооксида натрия.
CuSO4 + 2 NaOH = Cu (OH)2↓ +Na2SO4
Ученик. Выпадает осадок голубого цвета Cu (OH)2↓
Демонстрационный опыт №3
Учитель. К полученному
раствору Cu (OH)2↓добавить
раствор кислоты HCL
К полученному
раствору Cu (OH)2↓добавить
раствор кислоты HCL
Cu (OH)2↓ + 2 HCL = CuCL2 +2 HOH
Ученик. Осадок растворяется.
Демонстрационный опыт №4
Учитель. В пробирку с раствором карбоната натрия прильём раствор соляной кислоты HCL.
Na2CO3 +2 HCL = 2 NaCL + H2O + CO2↑
Ученик. Выделяется газ.
Демонстрационный опыт №5
Учитель. Подожжем в железной ложечке немного серы . Образуется сернистый газ-оксид серы (4) — SO2.
S + O2 = SO2
Ученик. Сера загорается синеватым пламенем, даёт обильный едкий дым, выделяется тепло и свет.
Демонстрационный опыт №6
Учитель. Реакция разложения пермангата калия — реакция получение и распознавания кислорода.
KMnO4 =
Ученик. Выделяется газ.
Выделяется газ.
Учитель. Эта реакция идет при постоянном нагреве, стоит его прекратить , как прекращается и реакция (кончик газоотводной трубки прибора, где получали кислород, опущен в пробирку с водой — пока нагревание, кислород выделяется, и его можно заметить по выходящим из кончика трубки пузырькам, если же нагревание прекратить – прекращается и выделение пузырьков кислорода).
Демонстрационный опыт №7
Учитель. В пробирку с NH4CL хлоридом аммония добавить немного щелочи NaOH при нагревании. Попросить одного из учеников подойти и понюхать, выделяющийся аммиак. Предупредить ученика о резком запахе!
NH4CL +NaOH = NH3 ↑+ HOH + NaCL
Ученик. Выделяется газ с резким запахом.
Учащиеся записывают в тетрадь признаки химических реакций.
Признаки химических реакций
Выделение (поглощение) тепла или света
Изменение цвета
Выделение газа
Выделение (растворение) осадка
Изменение запаха
Используя знания учащихся о химических реакциях, на основе проделанных демонстрационных опытов составляем таблицу условия возникновения и протекания химических реакций
|
Химические реакции |
|
|
Условия возникновения |
Условия протекания |
|
1. 2. нагревание веществ до определённой температуры. |
1. тесное соприкосновение реагирующих веществ(необходимо) 2. нагревание (возможно) а) для начала реакции б)постоянно (на протяжении всей реакции) |
Учитель. Вы изучили признаки химических реакций и условия их протекания. Индивидуальная работа по карточкам.
Какие из признаков характерны для химических реакций?
А) Образование осадка
Б) Изменение агрегатного состояния
В) Выделение газа
Г) Измельчение веществ
Заключительная часть
Учитель подводит итоги урока, анализируя полученные результаты. Выставляет оценки.
Домашнее задание
Приведите примеры химических
явлений, которые встречаются в трудовой деятельности ваших родителей, в
домашнем хозяйстве, в природе.
По учебнику О.С.Габриеляна «Химия -8 класс» § 26, упр. 3,6 с.96
Выявление физических и химических изменений
Эта основная идея исследуется посредством:
Противопоставление студенческих и научных взглядов
Студенческий повседневный опыт
Студенты с трудом различают физические и химические изменения, несмотря на формальное обучение, и это различие несколько условно. Однако понимание различий между чисто физическими процессами, такими как плавление, испарение и кипение, и изменениями, происходящими в химических реакциях, особенно представление об образовании новых веществ, важно для понимания химии, и учащиеся очень часто путают эти два явления. .Типичны следующие разговоры:
Пэт (записывая записи группы о праке): Что случилось?
Ким: Он зашипел.
Пэт: Вы видели какие-нибудь новые вещества?
Ким: Нет.
Сэм: Что мне записать образовалось?
Крис: Синий цвет.
Исследование: Loughran, Mulhall & Berry (2002)
Исследования показывают, что учащиеся часто используют термин «химическое изменение» для описания изменений в физическом состоянии. Замораживание и кипение считаются примерами химических реакций.Это зависит от их представления о субстанции. Если учащиеся рассматривают лед как вещество, отличное от жидкой воды, они, вероятно, будут классифицировать таяние льда как химическое изменение. Одно исследование показало, что 80% студентов считают разницу в цвете между реагентом и продуктом свидетельством химического изменения. Учащиеся могут рассматривать растворение перманганата калия (кристаллы Конди) в воде как химическое изменение из-за сильной разницы в цвете. Некоторые студенты также считали плавление и расширение при нагревании свидетельством химических изменений.
Замораживание и кипение считаются примерами химических реакций.Это зависит от их представления о субстанции. Если учащиеся рассматривают лед как вещество, отличное от жидкой воды, они, вероятно, будут классифицировать таяние льда как химическое изменение. Одно исследование показало, что 80% студентов считают разницу в цвете между реагентом и продуктом свидетельством химического изменения. Учащиеся могут рассматривать растворение перманганата калия (кристаллы Конди) в воде как химическое изменение из-за сильной разницы в цвете. Некоторые студенты также считали плавление и расширение при нагревании свидетельством химических изменений.
Исследования: Driver, Rushworth & Wood-Robinson (1994)
Многие студенты не понимали, что химическое изменение характеризуется образованием вещества, обладающего свойствами, отличными от свойств исходного вещества, и значительная часть учащихся, которые это понимали, не могли привести подходящих причин для выделения «нового» вещества.
Исследования: Driver, Rushworth & Wood-Robinson (1994)
Студенты могут полагать, что вспенивание пива является примером химического изменения, а созревание яблока — физическим изменением.
Исследование: Цапарлис (2003)
Студенты обычно считают, что физические изменения обратимы, а химические – нет. Студенты также часто считают, что исходное вещество в химической реакции полностью и навсегда исчезает. Обычным повседневным применением обратимой химической реакции является зарядка и разрядка перезаряжаемых аккумуляторов, в том числе автомобильных аккумуляторов; однако учащиеся могут полагать, что батареи являются контейнером накопленного электричества, а не химических веществ, которые реагируют таким образом, что химическая энергия преобразуется в электрическую.
Другие широко распространенные взгляды заключаются в том, что химические изменения вызываются смешиванием веществ/реагентов или что необходимо добавить тепло (которое считается некоторой формой материала).
Научная точка зрения
При физическом изменении меняется внешний вид или форма материи, но не меняется вид материи в веществе. Однако при химическом изменении изменяется вид материи и образуется по крайней мере одно новое вещество с новыми свойствами.
Различие между физическими и химическими изменениями нечеткое.Часто студентов убеждают, что изменение является либо физическим, либо химическим. На самом деле это следует рассматривать скорее как континуум. Например, растворение соли в воде обычно считается физическим изменением, однако химические вещества в солевом растворе (гидратированные ионы натрия и хлора) отличаются от веществ в твердой соли. Растворение растворимого кофе в воде кажется физическим изменением, но в большинстве случаев растворение сопровождается изменением энергии и, вероятно, лучше рассматривать его как химический процесс, хотя исходные компоненты можно восстановить физическими средствами.Многие примеры растворения материалов (например, алка-зельтер в воде, металл в кислоте и воздействие кислотных дождей на мрамор и бетон) связаны как с химическими, так и с физическими процессами.
– Исследование: Fensham (1994)
Все химические реакции обратимы, хотя на практике это может быть сложно. Во многих учебниках по естествознанию для младших классов утверждается, что химические изменения необратимы, в то время как физические изменения можно обратить вспять. Разрезание бумаги на мелкие кусочки или дробление камня — очевидные физические изменения, но восстановить первоначальный лист бумаги или камень сложно.Аккумуляторы используют одну химическую реакцию при разрядке, а перезарядка включает обратную реакцию, превращая продукты обратно в исходные реагенты. Электрический генератор (генератор переменного тока) в автомобиле постоянно подзаряжает автомобильный аккумулятор при работающем двигателе автомобиля.
Разрезание бумаги на мелкие кусочки или дробление камня — очевидные физические изменения, но восстановить первоначальный лист бумаги или камень сложно.Аккумуляторы используют одну химическую реакцию при разрядке, а перезарядка включает обратную реакцию, превращая продукты обратно в исходные реагенты. Электрический генератор (генератор переменного тока) в автомобиле постоянно подзаряжает автомобильный аккумулятор при работающем двигателе автомобиля.
Критические идеи обучения
- При физическом изменении природа вещества, частицы, из которых оно состоит, и число частиц остаются неизменными.
- При химическом изменении свойства новых веществ отличаются от первоначальных, частицы другие и количество частиц может измениться.
- Хотя различие между физическими и химическими изменениями является полезным, его следует рассматривать скорее как континуум.
- Химические реакции можно обратить вспять, но на практике это может быть сложно.
Изучение взаимосвязей между представлениями о физических и химических изменениях на картах разработки концепций — (состояния вещества, химические реакции)
При обучении физическим и химическим изменениям важно, чтобы учащиеся рассматривали классификацию как континуум.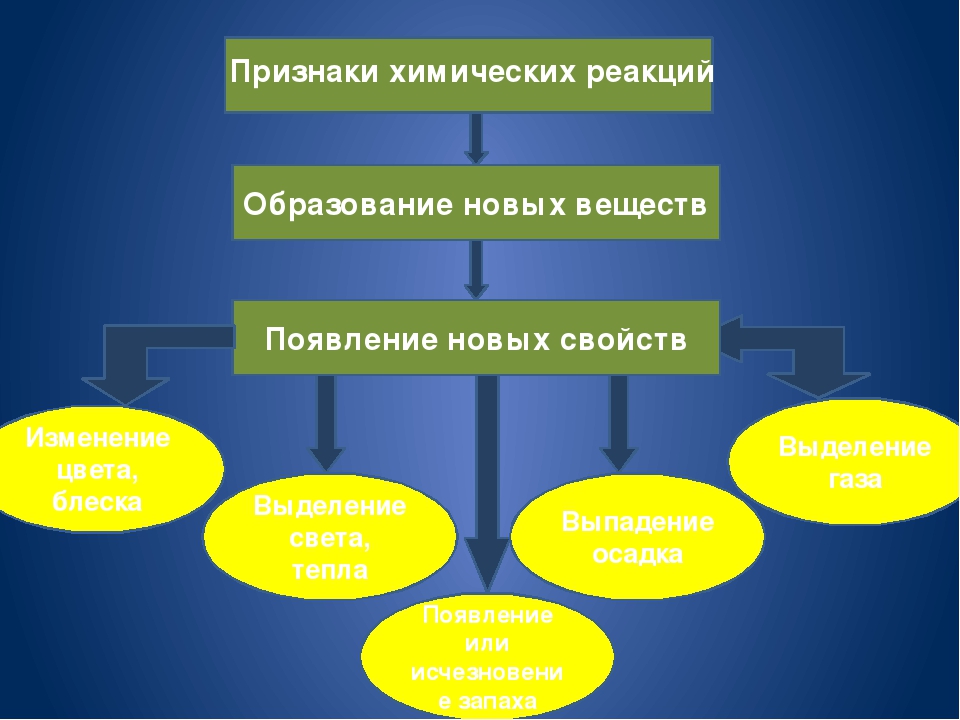 Они должны уметь наблюдать ряд изменений и формулировать свое мнение о видах изменений и проблемах, связанных с процессом классификации. Студенты должны прийти к пониманию того, что химические реакции производят новые химические вещества, отличные от исходных материалов, но химические процессы можно обратить вспять. Изучение примеров обратимых химических реакций и рассмотрение того, почему многие химические изменения трудно обратить вспять, может быть очень полезным.
Они должны уметь наблюдать ряд изменений и формулировать свое мнение о видах изменений и проблемах, связанных с процессом классификации. Студенты должны прийти к пониманию того, что химические реакции производят новые химические вещества, отличные от исходных материалов, но химические процессы можно обратить вспять. Изучение примеров обратимых химических реакций и рассмотрение того, почему многие химические изменения трудно обратить вспять, может быть очень полезным.
Преподавательская деятельность
Способствовать осмыслению и уточнению существующих идей
Следующие задания предназначены для того, чтобы учащиеся определили, а затем усовершенствовали свои идеи о физических и химических изменениях.Студентам важно наблюдать за рядом изменений и фиксировать свое мнение о происходящем. Они могли бы зафиксировать это в буклете, где они пишут и рисуют результаты и наблюдения. Их следует поощрять формулировать и фиксировать гипотезы о том, что происходит, зная, что их мнения не будут оцениваться на данном этапе.
Пример этой методики см. в разделе Использование журналов учета электроэнергии в 10-м году.
Это может помочь выявить их существующие идеи и помочь им бросить вызов и расширить свои существующие убеждения.
Студенты могли исследовать:
- Нагрев стальной ваты на воздухе и сбор полученного черного порошка, затем взвешивание реагента и продукта (должно быть увеличение). Это можно сделать как POE (Предсказать-Наблюдать-Объяснить): студентов просят предсказать, что произойдет с весом стальной ваты, когда она сгорит. Что было добавлено к стальной вате во время горения?
- Растворение сахара и соли в воде и сравнение того, что происходит с электропроводностью двух растворов в процессе растворения.Восстановление соли путем испарения показывает, что соль все еще там, но проводимость указывает на то, что образуется что-то новое.
- Сравнивая кипящую воду со смесью уксуса и пищевой соды — оба производят пузыри, но в чем разница? Пищевая сода и уксус могут быть смешаны в пакете для сэндвичей Ziploc, чтобы показать производство нового вещества, которое взрывает пакет.

- Реакции осаждения, особенно те, которые вызывают явное изменение цвета, такие как соли Эпсома и раствор аммиака.Это можно сравнить с добавлением марганцовки в воду. Каковы различия?
- Кислотно-основные реакции можно проиллюстрировать с помощью индикаторов как природных (капустный сок), так и синтетических. Изменения цвета помогают проиллюстрировать, что могут образовываться новые материалы.
Практикуйтесь в использовании и создавайте предполагаемую полезность научной модели или идеи
Важно, чтобы примеры изменений не ограничивались только материалами и химическими веществами, с которыми учащиеся сталкиваются в классе.В качестве домашнего задания учащихся можно попросить собрать примеры изменений, которые они видят вокруг себя, и классифицировать их по своей шкале физических и химических изменений. Некоторые примеры, которые они могут собрать, включают сжигание топлива, приготовление пищи и такие процессы, как пищеварение, дыхание и фотосинтез.
Прояснить и закрепить идеи для/посредством общения с другими и с другими
Чтобы закрепить свои взгляды, студентов в группах можно попросить выбрать два изменения, одно из которых находится на физическом конце континуума, а другое – на химическом конце, и объяснить класс, в чем отличия.Общение своих идей с другими может помочь учащимся прояснить и закрепить новые и существующие идеи об изменениях.
Практика использования научной модели или идеи и формирование воспринимаемой полезности
Наука — это область, в которой постепенно создается более глубокое значение для ряда ключевых идей путем их использования в различных ситуациях и акцентирования внимания на том, как одна и та же идея помогает найти смысл из многих ситуаций. Это особенно касается ключевых идей в химических науках, которые нельзя «открыть», «доказать» или даже продемонстрировать с помощью экспериментов в классе.И элементы, и соединения (ключевая идея на макроуровне), и атомы и молекулы (которые предполагают то же самое мышление на микроуровне) являются примерами этого, но их полезность можно развить, показав (среди прочего), как они могут помогают разобраться в физических и химических изменениях. Эти идеи могут быть представлены здесь или упомянуты, если они были представлены ранее. Запись химических уравнений в словесной и символической форме может быть введена как полезный способ описания некоторых изменений, которые наблюдали учащиеся, а также для демонстрации преимуществ химических символов в отслеживании элементов (или атомов) способами, недоступными для слов.Если точные химические формулы не могут быть написаны (как в случае с большинством биохимических веществ), радикальное упрощение все же может быть полезным. Например, древесина в основном состоит из целлюлозы, полимера глюкозы, и такое представление, как (C 6 H 10 O 5 ) n , можно использовать для отслеживания изменений в таких процессах, как горение.
Эти идеи могут быть представлены здесь или упомянуты, если они были представлены ранее. Запись химических уравнений в словесной и символической форме может быть введена как полезный способ описания некоторых изменений, которые наблюдали учащиеся, а также для демонстрации преимуществ химических символов в отслеживании элементов (или атомов) способами, недоступными для слов.Если точные химические формулы не могут быть написаны (как в случае с большинством биохимических веществ), радикальное упрощение все же может быть полезным. Например, древесина в основном состоит из целлюлозы, полимера глюкозы, и такое представление, как (C 6 H 10 O 5 ) n , можно использовать для отслеживания изменений в таких процессах, как горение.
. Например, в большинстве школ есть наборы для молекулярного моделирования, которые можно адаптировать, чтобы показать, как молекулы изменились, а атомы перегруппировались в результате изменений. Схемы размеров плакатов также могут быть нарисованы учащимися для помощи в объяснениях.
Схемы размеров плакатов также могут быть нарисованы учащимися для помощи в объяснениях.
Оспорить некоторые существующие идеи
Хотя трудно продемонстрировать обратимость химических изменений, учащиеся хорошо знакомы с необходимостью подзарядки своих мобильных телефонов, фотоаппаратов и других перезаряжаемых устройств. Это можно было бы просто обсудить, хотя исследование химических реакций, приводящих в действие эти устройства, могло бы стать полезным исследовательским проектом. Предупреждение здесь заключается в том, что большая часть доступной информации может быть очень технической.
Поощряйте размышления о том, как изменились идеи учащихся.
Повторное изучение их первоначальных дневниковых записей может способствовать размышлению о том, как изменились взгляды учащихся. Затем учащиеся могут применить свои новые идеи к большему количеству примеров изменений. Для обсуждения видов происходящих изменений и трудностей классификации некоторых изменений как физических или химических можно использовать такие мероприятия, как следующие:
- Растворение металлов в кислоте (магния и цинка) и тестирование полученного газа.

- Исследование известняка и кислотных реакций (образование известняковых пещер — что это за изменение?)
- Добавление цинка в раствор сульфата меди и наблюдение за происходящим изменением цвета.
- Сравнение схватывания клеев на водной основе, таких как Clag и Aquadhere , с двухкомпонентными клеями, такими как Araldite . Первый работает за счет испарения растворителя (воды) и является обратимым; последний включает химическую реакцию (реакцию термореактивной полимеризации) между двумя компонентами и не является обратимым.
Неионные химические реакции
Перициклические реакции
Важная группа химических реакций, отличающихся от ионных или свободнорадикальных реакций во многих отношениях, была признана и широко изучена. Среди характеристик, общих для этих реакций, три особенно выделяют их:
1. На них относительно не влияет смена растворителя, присутствие радикальных инициаторов или реагентов-акцепторов, а также (за некоторыми исключениями) электрофильные или нуклеофильные катализаторы.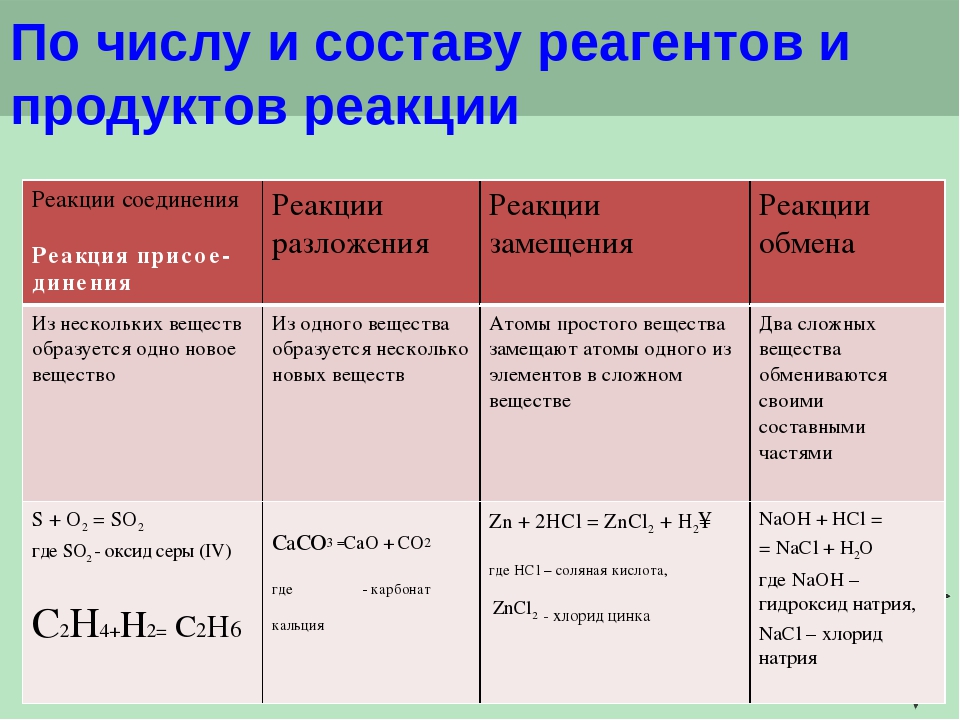
2. Они протекают в виде одновременной (согласованной) серии событий разрыва и образования связи на одном кинетическом этапе, часто с высокой стереоспецифичностью.
3. В соответствии с 1 и 2 на пути реакции не должно быть ионных, свободнорадикальных или других заметных промежуточных соединений.
Поскольку реакции такого рода часто протекают почти одновременной реорганизацией связывающих электронных пар посредством циклических переходных состояний, они были названы перициклическими реакциями .Четыре основных класса перициклических реакций называются: циклоприсоединение , электроциклические , сигматропные и ен-реакции . Общая иллюстрация каждого класса будет отображаться, если щелкнуть следующую диаграмму. Реакции циклоприсоединения и ена показаны в их межмолекулярном формате. Соответствующие внутримолекулярные реакции, создающие дополнительное кольцо, хорошо известны.
Все эти реакции потенциально обратимы (обратите внимание на серые стрелки). Обратное циклоприсоединение называется циклореверсией и происходит путем расщепления кольца и превращения двух сигма-связей в две пи-связи. Показанная выше электроциклическая реакция представляет собой процесс образования кольца. Обратная реакция электроциклического раскрытия цикла протекает путем превращения сигма-связи в пи-связь. Как показано, ретроеновая реакция расщепляет ненасыщенное соединение на два ненасыщенных фрагмента. Наконец, сигматропные сдвиги связи могут включать простую мигрирующую группу, как показано в приведенном выше примере, или могут иметь место между двумя пи-электронными системами (например,г. перегруппировка Коупа).
Обратное циклоприсоединение называется циклореверсией и происходит путем расщепления кольца и превращения двух сигма-связей в две пи-связи. Показанная выше электроциклическая реакция представляет собой процесс образования кольца. Обратная реакция электроциклического раскрытия цикла протекает путем превращения сигма-связи в пи-связь. Как показано, ретроеновая реакция расщепляет ненасыщенное соединение на два ненасыщенных фрагмента. Наконец, сигматропные сдвиги связи могут включать простую мигрирующую группу, как показано в приведенном выше примере, или могут иметь место между двумя пи-электронными системами (например,г. перегруппировка Коупа).
Общие описания, показанные выше, обеспечивают основу для классификации реакций, но необходимо позаботиться о том, чтобы данное преобразование было действительно согласованным. К сожалению, это не тривиальное определение, часто требующее комбинации изотопной маркировки и стереохимических исследований, чтобы прийти к правдоподобному заключению. Существует также тонкое различие между синхронной реакцией, в которой все события образования и разрыва связи происходят в унисон, и многостадийным согласованным процессом, в котором одни события предшествуют другим, не создавая промежуточного звена. государство.
Существует также тонкое различие между синхронной реакцией, в которой все события образования и разрыва связи происходят в унисон, и многостадийным согласованным процессом, в котором одни события предшествуют другим, не создавая промежуточного звена. государство.
Хотя некоторые перициклические реакции протекают спонтанно, большинство из них требует введения энергии в виде тепла или света, при этом результат заметно зависит от используемого источника энергии. Лучше всего оценить стереоселективные структурные изменения, вызываемые этими реакциями, путем изучения некоторых отдельных примеров.
1. Реакции циклоприсоединения
Согласованное сочетание двух π-электронных систем с образованием кольца атомов с двумя новыми σ-связями и двумя меньшими π-связями называется реакцией циклоприсоединения.Количество участвующих π-электронов в каждом компоненте указано в скобках перед названием, а реорганизация электронов может быть изображена циклом изогнутых стрелок, каждая из которых представляет движение пары электронов.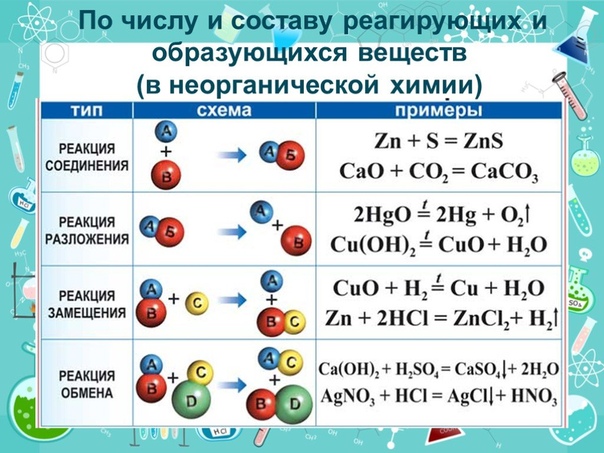 Эти обозначения показаны на рисунке справа. Реакция циклоприсоединения с образованием кольца описана синими стрелками, тогда как процесс раскрытия цикла циклореверсии обозначен красными стрелками. Обратите внимание, что количество изогнутых стрелок, необходимых для обозначения реорганизации облигаций, составляет половину общего числа, указанного в скобках .
Эти обозначения показаны на рисунке справа. Реакция циклоприсоединения с образованием кольца описана синими стрелками, тогда как процесс раскрытия цикла циклореверсии обозначен красными стрелками. Обратите внимание, что количество изогнутых стрелок, необходимых для обозначения реорганизации облигаций, составляет половину общего числа, указанного в скобках .
Наиболее распространенной реакцией циклоприсоединения является циклизация [4 π +2 π ], известная как реакция Дильса-Альдера. В терминологии Дильса-Альдера два реагента обозначаются как диен и диенофил .
На следующей диаграмме показаны два примера [4 π +2 π ] циклоприсоединения, а во втором уравнении последующее индуцированное светом [2 π +2 π ] циклоприсоединение. В каждом случае диеновый реагент окрашен в синий цвет, а новые σ-связи в аддукте окрашены в красный цвет.Стереоспецифичность этих реакций должна быть очевидна. В первом примере ацетоксизаместители диена имеют идентичные E -конфигурации и в циклическом аддукте остаются цис-по отношению друг к другу. Точно так же сложноэфирные заместители диенофила имеют транс-конфигурацию, которая сохраняется в аддукте. Оба реагента во втором уравнении являются моноциклическими, поэтому аддукт циклоприсоединения имеет три кольца. Ориентация шестичленного кольца хинона по отношению к бициклогептановой системе (окрашена синим цветом) является эндо, что означает, что оно ориентировано цис к самому длинному или более ненасыщенному мостику.Альтернативная конфигурация называется exo.
В первом примере ацетоксизаместители диена имеют идентичные E -конфигурации и в циклическом аддукте остаются цис-по отношению друг к другу. Точно так же сложноэфирные заместители диенофила имеют транс-конфигурацию, которая сохраняется в аддукте. Оба реагента во втором уравнении являются моноциклическими, поэтому аддукт циклоприсоединения имеет три кольца. Ориентация шестичленного кольца хинона по отношению к бициклогептановой системе (окрашена синим цветом) является эндо, что означает, что оно ориентировано цис к самому длинному или более ненасыщенному мостику.Альтернативная конфигурация называется exo.
Поскольку диенофил (хинон) имеет две активированные двойные связи, возможна вторая реакция циклоприсоединения при условии подачи достаточного количества диена. Второе циклоприсоединение происходит медленнее, чем первое, поэтому показанный здесь моноаддукт легко получается с хорошим выходом. Хотя этот [4+2]-продукт устойчив к дальнейшему нагреванию, он подвергается [2+2]-циклоприсоединению под воздействием солнечного света. Обратите внимание на потерю двух углерод-углеродных π-связей и образование двух σ-связей (обозначены красным) в ходе этого превращения.Также обратите внимание, что индекс pi часто опускается в обозначении [m + n] для большинства циклоприсоединений с участием π-электронных систем.
Обратите внимание на потерю двух углерод-углеродных π-связей и образование двух σ-связей (обозначены красным) в ходе этого превращения.Также обратите внимание, что индекс pi часто опускается в обозначении [m + n] для большинства циклоприсоединений с участием π-электронных систем.
При нажатии на эту диаграмму отобразятся еще два примера реакций циклоприсоединения. Реакция 3 представляет собой внутримолекулярную реакцию Дильса-Альдера. Поскольку диен и диенофил соединены цепочкой атомов, получающееся циклоприсоединение [4+2] фактически образует два новых кольца, одно из циклоприсоединения, а другое из связывающей цепи.И снова добавление является стереоспецифическим, без учета изопропилового заместителя, слияние колец происходит цис- и эндо. Четвертая реакция представляет собой [6+4] циклоприсоединение.
2. Электроциклические реакции
Электроциклическая реакция представляет собой согласованную циклизацию сопряженной π-электронной системы путем превращения одной π-связи в кольцо, образующее σ-связь. Обратную реакцию можно назвать электроциклическим раскрытием кольца. Два примера показаны справа. Замыкание электроциклического кольца обозначено синими стрелками, а раскрытие кольца — красными стрелками.Опять же, количество изогнутых стрелок, описывающих реорганизацию связи, составляет половину от общего числа электронов, участвующих в процессе.
Обратную реакцию можно назвать электроциклическим раскрытием кольца. Два примера показаны справа. Замыкание электроциклического кольца обозначено синими стрелками, а раскрытие кольца — красными стрелками.Опять же, количество изогнутых стрелок, описывающих реорганизацию связи, составляет половину от общего числа электронов, участвующих в процессе.
В первом случае транс,цис,транс -2,4,6-октатриен подвергается термическому замыканию цикла с образованием цис -5,6-диметил-1,3-циклогексадиена. Стероспецифичность этой реакции демонстрируется замыканием изомерного транс, цис, цис -триена в транс -5,6-диметил-1,3-циклогексадиена, как отмечено во втором примере.
При нажатии на эту диаграмму будут отображены два примера термического электроциклического раскрытия циклобутенов до сопряженных бутадиенов. Этому способу реакции способствует уменьшение деформации кольца, а обратное замыкание кольца (светло-синие стрелки) обычно не наблюдается. Фотохимическое замыкание кольца может быть осуществлено, но стереоспецифичность противоположна таковой при тепловом раскрытии кольца.
3. Сигматропные перегруппировки
Молекулярные перегруппировки, при которых σ-связанный атом или группа, фланкированные одной или несколькими π-электронными системами, перемещаются в новое место с соответствующей реорганизацией π-связей, называются сигматропными реакциями.Общее количество σ-связей и π-связей остается неизменным. Эти перегруппировки описываются двумя числами, указанными в скобках, которые относятся к относительному расстоянию (в атомах), на которое сместился каждый конец σ-связи, как показано в первом уравнении на диаграмме ниже. Чаще всего атом, подвергающийся сигматропному сдвигу, — это водород или один из его изотопов. Второе уравнение на диаграмме показывает легкий [1,5] водородный сдвиг, который превращает относительно нестабильную алленовую систему в сопряженный триен.Обратите внимание, что эта перегруппировка, которая включает перемещение трех пар связывающих электронов, может быть описана тремя изогнутыми стрелками.
При нажатии на эту диаграмму будут отображены два дополнительных примера теплового [1,5] водородного сдвига. Эти реакции особенно информативны тем, что [1,3] водородных сдвигов не наблюдается. Реагент в первом уравнении представляет собой 1,3,5-циклооктатриен, меченный дейтерием. При нагревании это соединение уравновешивается своим 1,3,6-триеновым изомером, и два атома дейтерия перемещаются между четырьмя указанными местами.Если бы имели место [1,3] или [1,7] водородные сдвиги, атомы дейтерия были бы распределены поровну между всеми восемью атомами углерода. При длительном нагревании или при более высоких температурах эти циклооктатриены претерпевают электроциклическое раскрытие кольца до 1,3,5,7-октатетраена и повторное замыкание до винил-1,3-циклогексадиенов.
Эти реакции особенно информативны тем, что [1,3] водородных сдвигов не наблюдается. Реагент в первом уравнении представляет собой 1,3,5-циклооктатриен, меченный дейтерием. При нагревании это соединение уравновешивается своим 1,3,6-триеновым изомером, и два атома дейтерия перемещаются между четырьмя указанными местами.Если бы имели место [1,3] или [1,7] водородные сдвиги, атомы дейтерия были бы распределены поровну между всеми восемью атомами углерода. При длительном нагревании или при более высоких температурах эти циклооктатриены претерпевают электроциклическое раскрытие кольца до 1,3,5,7-октатетраена и повторное замыкание до винил-1,3-циклогексадиенов.
Во втором примере показан еще один сдвиг водорода [1,5] от проксимальной метильной группы к карбонильному атому кислорода. Образовавшийся диенол быстро заменяет OH на OD до того, как сдвиг [1,5] изменится на противоположный.Таким образом, реакционноспособный метил вскоре превращается в CD 3 . Поскольку известно, что атомы водорода с альфа-группы на карбонильную группу подвергаются катализируемому кислотой или основанием обмену посредством промежуточных енолов, можно ожидать, что группа α’-CH 2 также будет заменена. Однако, если позаботиться об удалении потенциальных кислотных или основных катализаторов, тепловой сдвиг [1,3], необходимый для обмена, оказывается очень медленным.
Однако, если позаботиться об удалении потенциальных кислотных или основных катализаторов, тепловой сдвиг [1,3], необходимый для обмена, оказывается очень медленным.
[3,3]-сигматропная перегруппировка 1,5-диенов или аллилвиниловых эфиров, известная соответственно как перегруппировка Копа и Клайзена , относится к наиболее часто используемым сигматропным реакциям.Три примера перегруппировки Коупа показаны на следующей диаграмме. Реакции 1 и 2 (верхний ряд) демонстрируют стереоспецифичность этой реакции. Светло-голубая σ-связь соединяет две аллильные группы, ориентированные так, что их концы находятся рядом друг с другом. Поскольку каждый аллильный сегмент является локусом сдвига [1,3], общая реакция классифицируется как перегруппировка [3,3] . Три изогнутые розовые стрелки описывают перераспределение трех пар связывающих электронов в ходе этой обратимой перегруппировки.Диеновый реагент в третьей реакции находится в вытянутой конформации. Эта молекула должна принять спиральную конформацию (как указано выше), прежде чем может произойти перегруппировка [3,3]. Продуктом этой перегруппировки является енол, который немедленно таутомеризуется в свою кето-форму. Такие варианты называются перегруппировкой oxy-Cope и полезны, поскольку обратная перегруппировка блокируется быстрой кетонизацией. Если гидроксильный заместитель превращается в алкоксидную соль, энергия активации перегруппировки значительно снижается.
Продуктом этой перегруппировки является енол, который немедленно таутомеризуется в свою кето-форму. Такие варианты называются перегруппировкой oxy-Cope и полезны, поскольку обратная перегруппировка блокируется быстрой кетонизацией. Если гидроксильный заместитель превращается в алкоксидную соль, энергия активации перегруппировки значительно снижается.
Вырожденная или самовоспроизводящаяся перегруппировка Коупа была увлекательным предметом исследования. Например .
Два примера перестановки Клайзена можно увидеть, щелкнув по диаграмме выше. Реакция 4 . представляет собой классическую перегруппировку аллилфенилового эфира в орто-аллилфенол. Метильный заместитель в аллильном фрагменте служит для демонстрации сдвига связи в этом сайте. Исходный циклогексадиеноновый продукт немедленно таутомеризуется в фенол, восстанавливая стабильность ароматического кольца.Реакция 5 представляет собой алифатический аналог, в котором винильная группа заменяет ароматическое кольцо. В обоих случаях реорганизации подвергаются три пары связывающих электронов.
В обоих случаях реорганизации подвергаются три пары связывающих электронов.
При повторном нажатии на приведенную выше диаграмму будут отображены два примера сигматропных перегруппировок [2,3]. Алловый сульфоксид в реакции 6 обратимо перегруппировывается в менее стабильный сульфеновый эфир. Слабая связь SO может быть восстановительно расщеплена триметилфосфитом до аллилового спирта и тиола (не показано).Реакция 7 показывает аналогичную перегруппировку илида серы в циклический сульфид. Еще одним примером является [2,3]-перегруппировка Виттига.
4. Эне Реакции
Присоединение двойной или тройной связи к алкеновому реагенту, имеющему переносимый аллильный водород, называется еновой реакцией . Обратный процесс называется ретроеновой реакцией . В направлении связывания еновая реакция характеризуется перераспределением трех пар связывающих электронов.и может быть описан циклом из трех изогнутых стрелок. Как отмечалось ранее, эта реорганизация связи включает полное превращение π-связи в σ-связь (или наоборот в случае ретроеновой фрагментации). Это то же самое изменение учета связей, которое проявляется в электроциклических реакциях, но в еновой реакции не образуются и не разрываются кольца, если только она не является внутримолекулярной. Следующие примеры иллюстрируют некоторые типичные еновые реакции, при этом уравнение 3 представляет собой внутримолекулярную еновую реакцию.Реакции ена предпочтительнее, когда реагент, принимающий водород, «енофил», является электрофильным. Так обстоит дело с реакциями 1 и 2 , протекающими в более мягких условиях, чем реакция 3 , несмотря на внутримолекулярную природу последней.
Это то же самое изменение учета связей, которое проявляется в электроциклических реакциях, но в еновой реакции не образуются и не разрываются кольца, если только она не является внутримолекулярной. Следующие примеры иллюстрируют некоторые типичные еновые реакции, при этом уравнение 3 представляет собой внутримолекулярную еновую реакцию.Реакции ена предпочтительнее, когда реагент, принимающий водород, «енофил», является электрофильным. Так обстоит дело с реакциями 1 и 2 , протекающими в более мягких условиях, чем реакция 3 , несмотря на внутримолекулярную природу последней.
Водород является наиболее распространенным атомом, переносимым в реакции ена. Действительно, все приведенные выше примеры связаны со сдвигами водорода. Однако в еноподобных превращениях могут участвовать и другие атомы или группы.Два таких случая будут отображены выше, если щелкнуть по диаграмме. Реакция 4 представлена как ретроеновая, хотя не было показано, что она является общей для всех реакций аллиловых спиртов с тионилхлоридом. Уравнение 5 иллюстрирует необычную «реакцию ена магния», в которой функция Гриньяра перемещается в новое место до реакции с электрофильным реагентом, таким как CO 2 . Поскольку это внутримолекулярная еновая реакция, образуется новое кольцо. При повторном нажатии на диаграмму отобразятся два дополнительных примера.Уравнение 6 показывает, что таутомер енола даже в низкой концентрации может действовать как донор водорода в реакции ена. Уравнение 7 является одним из многих примеров катализа кислотой Льюиса в реакции ена. Аналогичная катализируемая кислотой реакция простых альдегидов с алкенами с образованием аллиловых спиртов, 1,3-диолов или 1,3-диоксанов известна как реакция Принса .
Уравнение 5 иллюстрирует необычную «реакцию ена магния», в которой функция Гриньяра перемещается в новое место до реакции с электрофильным реагентом, таким как CO 2 . Поскольку это внутримолекулярная еновая реакция, образуется новое кольцо. При повторном нажатии на диаграмму отобразятся два дополнительных примера.Уравнение 6 показывает, что таутомер енола даже в низкой концентрации может действовать как донор водорода в реакции ена. Уравнение 7 является одним из многих примеров катализа кислотой Льюиса в реакции ена. Аналогичная катализируемая кислотой реакция простых альдегидов с алкенами с образованием аллиловых спиртов, 1,3-диолов или 1,3-диоксанов известна как реакция Принса .
Некоторые ретроеновые реакции оказались полезными в качестве синтетических трансформаций. Примеры этих согласованных реакций элиминации можно изучить, нажав здесь
.
Более подробное описание внутримолекулярной реакции ена доступно по ссылке
.
5.Стереохимические обозначения 90 189
Одной общей характеристикой большинства перициклических реакций, отмеченной во многих случаях, описанных выше, является их стереоспецифичность. Это не первый класс реакций, для которых отмечена характерная стереоспецифичность. Реакции замещения могут протекать случайным образом или путем «инверсии» или «сохранения» конфигурации. Реакции элиминации могут происходить «анти» или «син» или могут быть конфигурационно случайными. Термины «син» и «анти» также применялись к реакциям 1,2-присоединения.
Это не первый класс реакций, для которых отмечена характерная стереоспецифичность. Реакции замещения могут протекать случайным образом или путем «инверсии» или «сохранения» конфигурации. Реакции элиминации могут происходить «анти» или «син» или могут быть конфигурационно случайными. Термины «син» и «анти» также применялись к реакциям 1,2-присоединения.
Поскольку эти обозначения изменения конфигурации не подходят для перициклических реакций, необходимы новые обозначения. Реакции циклоприсоединения и сигматропные перегруппировки включают пары событий образования σ-связи (или сопряженное образование и разрыв связи), связанных с π-электронной системой. Если все события связывания происходят на одной грани π-системы, конфигурация реакции называется супрафациальной . Если события связывания происходят на противоположных сторонах или гранях π-системы, реакция называется антарафациальной .Надфациальные примеры этих перициклических превращений показаны ниже. Цифры в квадратных скобках, обозначающие реакции такого рода, иногда содержат индексы (s или a), определяющие их конфигурацию. Таким образом, циклоприсоединение слева можно назвать процессом [4 90 105 s 90 106 + 2 90 105 s 90 106 ].
Цифры в квадратных скобках, обозначающие реакции такого рода, иногда содержат индексы (s или a), определяющие их конфигурацию. Таким образом, циклоприсоединение слева можно назвать процессом [4 90 105 s 90 106 + 2 90 105 s 90 106 ].
Хотя реакции циклоприсоединения являются согласованными (промежуточные соединения не образуются), две новые связи не обязательно образуются синхронно. В зависимости от распределения парциального заряда в диеновых и диенофильных реагентах образование одной связи может привести к развитию другой.Такое несимметричное связывание в переходном состоянии называется асинхронным.
Пример антарафациального [1,7] сдвига водорода показан на следующей диаграмме. Сопряженный триен принимает почти плоскую спиральную конформацию, в которой метиловый водород ориентирован непосредственно над концевым атомом углерода последней двойной связи. Для электроциклических реакций требуется другое обозначение изменения конфигурации. В этих случаях σ-связь между концами сопряженной π-электронной системы либо образуется, либо разрывается с соответствующей потерей или усилением π-связи.Чтобы это произошло, концевые атомы углерода сопряженной π-электронной системы должны регибридизироваться с сопутствующим поворотом или скручиванием примерно на 90°. Если смотреть вдоль оси вращения, две концевые группы могут поворачиваться в одном направлении, называемом противовращательным , или в противоположных направлениях, называемом невращательным .
Поскольку 90–149 еновые реакции 90–150 обычно включают в себя сопряженные операции образования и разрыва связи, связанные с системами коротких π-электронов (2 или 3 атома углерода), их стереоспецифичность почти всегда супрафациальна по отношению к обоим компонентам. Эта конфигурационная особенность иллюстрируется ретроградным уравнением справа. При нажатии на диаграмму будет нарисовано представление переходного состояния для этого стереоспецифического преобразования. Обратите внимание, что разрыв и образование связи происходит в поверхностной ориентации по отношению к каждой π-электронной системе.Этой реакции способствует снятие малой кольцевой деформации. Возможны несколько различных структурных взаимосвязей между реагирующими фрагментами внутримолекулярной еновой реакции. Примеры, показанные здесь и выше, представляют наиболее распространенную ориентацию. Чтобы увидеть примеры двух других аранжировок, нажмите здесь. 6. Непонятные особенности перициклических реакций Представленные здесь примеры перициклических реакций дают достаточно доказательств их полезности для конструирования или модификации сложных молекул, часто с высокой степенью стереоспецифичности.Однако, в отличие от общего применения большинства обычных ионных реакций, перициклические реакции часто проявляют заметную чувствительность к небольшим структурным изменениям. Таким образом, стереоспецифичность может колебаться, а скорости могут различаться в миллион раз и более. В случае реакций циклоприсоединения три уравнения справа иллюстрируют этот факт. Уравнения 1 и 2 показывают два очень похожих превращения, но первое происходит при умеренном нагреве, а второе нет. Обратите внимание, что в каждом случае тройная связь вносит только два электрона в переходное состояние циклоприсоединения.Обычное [4+2]-циклоприсоединение, известное как реакция Дильса-Альдера, протекает стереоспецифически по супрафациальному типу, но [14+2]-циклоприсоединение в уравнении 3 является антарафасциальным по отношению к полиену. 7. Полезное мнемоническое правилоПрежде чем можно будет использовать перициклические реакции предсказуемым и контролируемым образом, необходимо сформулировать широкое механистическое понимание факторов, влияющих на эти согласованные превращения.Самый простой, хотя и наименее строгий метод предсказания конфигурационного пути предполагаемой перициклической реакции основан на подсчете электронов в переходном состоянии. В большинстве более ранних примеров перициклические реакции описывались циклом изогнутых стрелок, каждая из которых представляла пару связывающих электронов. Общее число электронов, подвергающихся реорганизации, всегда четно и равно числу 4n+2 или 4n (где n — целое число). После подсчета электронов следующая таблица может быть использована для прогнозов.
Хотя эта скромная мнемоника не использует молекулярные орбитали в явном виде, более строгие методы, основанные на характеристиках таких орбиталей, позволили получить важные сведения об этих реакциях.Поскольку перициклические реакции протекают путем циклической реорганизации связывающих электронных пар, необходимо оценить изменения связанных молекулярных орбиталей, происходящие при переходе от реагентов к продуктам. В следующем разделе описаны подходы такого рода.
Теоретические модели перициклических реакцийВ 1965 г. Р. Б. Вудворд и Роальд Хоффманн из Гарвардского университета предположили и продемонстрировали, что согласованные реакции протекают наиболее легко, когда существует конгруэнтность между орбитальными симметриями реагентов и продуктов.Иными словами, при сохранении связующего характера всех занятых молекулярных орбиталей на всех стадиях согласованной молекулярной реорганизации такая реакция, скорее всего, будет иметь место. Чем больше степень связывания в переходном состоянии реакции, тем ниже будет ее энергия активации и тем больше будет скорость реакции. Общее введение в молекулярные орбитали было представлено ранее. Простое соединение этен состоит из шести атомов, соединенных вместе шестью ковалентными связями, как показано на следующем рисунке.Диаграмма молекулярных орбиталей этена создается путем объединения двенадцати атомных орбиталей, связанных с четырьмя атомами водорода и двумя гибридизованными атомами углерода sp 2 , с получением двенадцати молекулярных орбиталей. Шесть из этих молекулярных орбиталей (пять сигма и одна пи-орбиталь) являются связующими и заняты двенадцатью доступными электронами валентной оболочки. Остальные шесть молекулярных орбиталей являются разрыхляющими и пустыми. На правильные молекулярные орбитали влияют все ядра в молекуле, и для их полного описания требуется рассмотрение полной структуры и симметрии молекулы.Для большинства целей этот уровень лечения не требуется, и хорошо подходят более локализованные орбиты. В случае этена и других изолированных двойных связей описания локализованных π-орбиталей будут отображаться, если щелкнуть диаграмму выше. Необходимо указать на несколько важных характеристик молекулярных орбиталей, и эта диаграмма послужит их иллюстрацией. 1. Пространственное распределение электронной плотности для большинства занятых молекулярных орбиталей прерывистое, с областями высокой плотности, разделенными областями нулевой плотности, т.е.г. узловая плоскость . π-орбиталь слева имеет одну узловую плоскость (окрашена голубым), а π * -орбиталь справа имеет вторую узловую плоскость (окрашена желтым). Молекулярные орбитали с большей энергией, как правило, имеют большее количество узловых поверхностей или узлов. Модель p- и π-орбиталей двойной связи может быть исследована . Первоначальный подход Вудворда и Хоффмана заключался в построении «орбитальной корреляционной диаграммы» для каждого типа перициклической реакции.Симметрии соответствующих орбиталей реагентов и продуктов были сопоставлены, чтобы определить, может ли преобразование происходить без навязанного симметрии преобразования связывающих орбиталей реагентов в разрыхляющие орбитали продукта. Если корреляционная диаграмма показывала, что реакция может происходить без столкновения с таким барьером, налагаемым симметрией , это называлось разрешенной симметрией . Если присутствовал барьер симметрии, реакция обозначалась как -запрещенная по симметрии .Двумя родственными методами анализа перициклических реакций являются подход ароматичности переходного состояния и подход граничных молекулярных орбиталей . Каждый из этих методов имеет свои достоинства, и более подробное описание каждого из них можно просмотреть, нажав соответствующую кнопку ниже. 1. Некоторые примерыПрежде чем приступить к обзору репрезентативных примеров различных типов перициклических реакций, необходимо еще раз подчеркнуть предыдущее предостережение относительно того, что данное превращение должно быть действительно согласованным.Два уравнения, показанные на следующей диаграмме, описывают реакции [2+2] циклоприсоединения. Второй пример особенно интересен, поскольку [4+2] циклоприсоединение по Дильсу-Альдеру возможно, но дает лишь второстепенный продукт. Тщательное изучение этих реакций с использованием зондов для ионных и радикальных промежуточных соединений показало, что это несогласованные превращения. Диполярные и бирадикальные интермедиаты, предложенные для этих реакций, будут проиллюстрированы щелчком по диаграмме. При повторном нажатии на приведенную выше диаграмму будет показана кажущаяся реакция электроциклического раскрытия кольца.Симметрия, благоприятствующая обратновращательному согласованному пути, привела бы к образованию очень напряженной транс-циклогексеновой двойной связи, что энергетически маловероятно. Вместо этого при нагревании происходит расщепление связи с более высокой энергией активации до бирадикального промежуточного соединения. Рацемический диастереомер этого соединения подвергается такому же раскрытию кольца при более низкой температуре, и считается, что это согласованная конротационная электроциклическая реакция. Имея в виду это предостережение, можно составить обширный список перициклических реакций, и их рационализация с помощью упомянутого ранее мнемонического или орбитального анализа является одновременно замечательно успешной и поучительной.Многие реакции, приведенные ранее, вместе с дополнительными примерами будут отображены при нажатии на соответствующую кнопку. 2. Региоселективность и кислотный катализ ЛьюисаКогда оба компонента реакции циклоприсоединения несимметрично замещены, возможны два региоизомерных циклоаддукта. В случае реакций Дильса-Альдера они показаны здесь как для C-1, так и для C-2 замещенных диенов и монозамещенных (Z) диенофилов. Некоторые химики называют изомерные аддукты орто-, мета- и пара-соответствующими изомерами дизамещения бензола.Как правило, С-1-замещенные диены образуют преимущественно орто-аддукты, а С-2-замещенные диены образуют основной продукт пара-аддуктов. При нажатии на диаграмму будут показаны два примера этой региоселективности. Первый пример особенно интересен, поскольку сопряженный триен включает в себя два диеновых фрагмента, каждый из которых может участвовать в реакции Дильса-Альдера. В этом случае менее замещенный диен реагирует быстрее, что отражает общую чувствительность этого циклоприсоединения к стерическим затруднениям.Основным продуктом [4+2] является не только орто-изомер, несмотря на скученность заместителей, но также эндо-стереоизомер (обратите внимание на цис-связь ненасыщенной боковой цепи и альдегидной функции). Второй пример показывает предпочтение парааддуктов из С-2 замещенных диенов. Щелкнув по диаграмме второй раз, появятся еще два примера региоселективности. Продукт из 1,2-дизамещенного диена в примере 3 демонстрирует более сильное направляющее влияние заместителя С-1.Двузамещенный хинон в примере 4 также демонстрирует направляющее влияние алкильных заместителей на диенофил. И реакция Дильса-Альдера, и реакция ена катализируются кислотами Льюиса. Два примера катализа Дильса-Альдера на следующей диаграмме иллюстрируют улучшение выхода и региоселективности, которое часто сопровождает такой катализ.Хотя катализатором может служить трихлорид алюминия (второй ряд в примере 1), обычно используют более растворимое и менее агрессивное моно- или диэтилпроизводное, как указано в примере 2. Несмотря на диеновое и диенофильное замещение в данном случае , эндоаддукт образуется с высокой региоселективностью и выходом при относительно низкой температуре. В некоторых случаях катализ кислотой Льюиса может изменить региоселективность реакции Дильса-Альдера. Пример будет показан выше, если щелкнуть по диаграмме.Эндоаддукт предпочтителен в обоих случаях. Даже внутримолекулярные реакции Дильса-Альдера могут выиграть от такого катализа, как будет показано, если щелкнуть диаграмму второй раз. Предыдущие обсуждения факторов орбитальной симметрии были сосредоточены на конгруэнтности фаз в связующих взаимодействиях. Чтобы расширить эту трактовку для учета различных относительных ориентаций реагентов, необходимо оценить величину орбиталей ВЗМО и НСМО у каждого атома.Эта орбитальная величина обычно представлена коэффициентом , полученным из волновых уравнений для пи-орбиталей. Эти орбитальные коэффициенты также имеют знак (плюс или минус), отражающий их фазу. В случае 1,3-бутадиена, показанного слева, пи-орбиталь с наименьшей энергией (π 1 ) имеет меньшие орбитальные коэффициенты в точках C-1 и C-4 и большие коэффициенты в точках C-2 и C-. 3. Цифры, приведенные на диаграмме, произвольно взяты из простого расчета волновой функции. Остальные три пи-орбитали имеют аналогичные коэффициенты (± 0.37 или 0,60), но положение более высокого коэффициента смещается к концевым атомам углерода на ВЗМО и НСМО-орбиталях (π 2 и π 3 соответственно). Конечно, знаки фаз меняются для обозначения увеличения числа узлов. Несимметричное замещение диена или диенофила изменяет орбитальные коэффициенты несимметричным образом. Расчеты орбитальных коэффициентов в таких случаях приводят к привлекательному объяснению региоселективности, характеризующей их химию Дильса-Альдера.В наиболее распространенной ситуации встречаются электроноакцепторные заместители (Z) на диенофильной двойной связи и электронодонорные заместители (Y) на диене. Следовательно, при связывающем взаимодействии электроны будут течь от ВЗМО диена к НСМО диенофила. Нет необходимости рассматривать другие орбитали, и изначально ожидается наиболее значительное связующее взаимодействие между теми сайтами, которые имеют самые большие орбитальные коэффициенты. Терминальные коэффициенты некоторых граничных молекулярных орбиталейСледует подчеркнуть, что согласованный характер реакций [4+2]-циклоприсоединения не отрицается фокусировкой на начальном месте связывания.Действительно, несимметричное замещение реагентов подразумевает, что надповерхностное развитие двух новых сигма-связей также будет несимметричным (т. е. одна связь может быть почти установлена в переходном состоянии, а другая лишь слегка сформирована). Таким образом, можно представить множество переходных состояний в диапазоне от симметричных до крайне несимметричных. Эти состояния, однако, имеют общую характеристику компактного, высокоорганизованного надповерхностного комплекса диена с диенофилом, о чем свидетельствует большая отрицательная энтропия активации, а также отрицательный активационный объем. Модель переходного состояния Дильса-Альдера, которая иллюстрирует неравномерное связывание, связанное с несимметричными реагентами, может быть исследована . Во многих случаях этот анализ орбитальных коэффициентов ВЗМО и НСМО также дает хорошее объяснение положительного влияния катализа кислотой Льюиса. Все диенофилы в процитированных выше примерах были активированы электроноакцепторной карбонильной группой. Кислоты Льюиса образуют комплексы с основным атомом кислорода таких функций, делая их более электрофильными.Конъюгация с диенофильной двойной связью увеличивает орбитальный коэффициент, удаленный от карбонильной группы, и, следовательно, облегчает [4+2]-циклоприсоединение к ассоциированному региоизомеру. Если каждый из двух концов диенофила имеет карбонильный заместитель, как в случае хинонов и ангидридов, то катализ кислотой Льюиса может изменить региоселективность циклоприсоединения. 3. Полезная мнемоника для региоселективности.Расчеты молекулярных орбит, которые дают пи-орбитальные коэффициенты для диенов и диенофилов, выходят за рамки этого текста.Однако существует простой мнемонический прием, который во многих случаях позволяет предсказать региоселективность. Он включает в себя рисование четырех возможных бирадикальных промежуточных соединений, которые могут быть образованы гомолитическим связыванием на одном конце каждого реагента. Как только они будут различены, как это сделано для 1-замещенного диена на следующей диаграмме, наиболее стабильные виды бирадикалов обычно будут определять региоселективность этой реакции. Эта уловка работает, потому что как электронодонорные заместители, такие как алкил, алкоксил и амино, так и электроноакцепторные заместители, такие как нитро, циано и карбонил, оказывают стабилизирующее влияние на соседние радикалы, в отличие от их противоположного воздействия на соседние положительно и отрицательно заряженные атомы.В отсутствие каких-либо заместителей диеновая часть дает аллильный радикал (1° и 2°), а диенофильная группа — радикал 1°. Как уже отмечалось, заместители Y и Z стабилизируют соседние радикалы, поэтому предпочтение отдается бирадикалу I , который должен приводить к предпочтительному региоизомерному продукту. Всегда помните, что это всего лишь мнемонический трюк, большинство реакций Дильса-Альдера являются согласованными и не протекают через бирадикальное промежуточное соединение . При нажатии на приведенную выше диаграмму будет отображен пример этого анализа реакции 2-замещенного диена с замещенным диенофилом.
Что такое депрессия?Депрессия Депрессия (большое депрессивное расстройство) — распространенное и серьезное заболевание, которое негативно влияет на ваше самочувствие, образ мыслей и поведение.К счастью, это также излечимо. Депрессия вызывает чувство грусти и/или потерю интереса к занятиям, которыми вы когда-то наслаждались. Это может привести к множеству эмоциональных и физических проблем и может снизить вашу способность функционировать на работе и дома. Симптомы депрессии могут варьироваться от легких до тяжелых и могут включать:
Симптомы должны длиться не менее двух недель и должны отражать изменение вашего предыдущего уровня функционирования для диагностики депрессии. Кроме того, медицинские состояния (например, проблемы со щитовидной железой, опухоль головного мозга или дефицит витаминов) могут имитировать симптомы депрессии, поэтому важно исключить общие медицинские причины. Депрессия затрагивает примерно одного из 15 взрослых (6,7%) в любой данный год. А каждый шестой человек (16,6%) хоть раз в жизни испытывал депрессию. Депрессия может возникнуть в любое время, но в среднем она впервые появляется в период от позднего подросткового возраста до середины 20-летнего возраста. Женщины чаще, чем мужчины, испытывают депрессию. Некоторые исследования показывают, что одна треть женщин в течение жизни переживает серьезный депрессивный эпизод. Существует высокая степень наследуемости (примерно 40%), когда у ближайших родственников (родителей/детей/братьев и сестер) депрессия. Депрессия отличается от печали или горя/утратыСмерть близкого человека, потеря работы или прекращение отношений — тяжелые переживания для человека. Это нормально, когда в ответ на такие ситуации возникает чувство грусти или горя. Те, кто переживает утрату, часто могут описывать себя как «депрессивных». Но быть грустным — это не то же самое, что иметь депрессию. Процесс скорби естественен и уникален для каждого человека и имеет некоторые общие черты с депрессией.И горе, и депрессия могут сопровождаться сильной грустью и отказом от обычных занятий. Они также отличаются по важным параметрам:
Горе и депрессия могут сосуществовать У некоторых людей смерть близкого человека, потеря работы, физическое насилие или крупное бедствие могут привести к депрессии. Когда горе и депрессия возникают одновременно, горе становится более тяжелым и длится дольше, чем горе без депрессии. Различие между горем и депрессией имеет важное значение и может помочь людям получить помощь, поддержку или лечение, в которых они нуждаются. Факторы риска депрессииДепрессия может затронуть любого — даже человека, который, кажется, живет в относительно идеальных условиях. На депрессию могут влиять несколько факторов:
Депрессия является одним из наиболее поддающихся лечению психических расстройств. От 80% до 90% процентов людей с депрессией в конечном итоге хорошо реагируют на лечение.Почти у всех пациентов наблюдается некоторое облегчение симптомов. Перед постановкой диагноза или лечением медицинский работник должен провести тщательную диагностическую оценку, включая опрос и медицинский осмотр. В некоторых случаях может быть сделан анализ крови, чтобы убедиться, что депрессия не связана с заболеванием, таким как проблемы со щитовидной железой или дефицитом витаминов (устранение медицинской причины облегчило бы симптомы, подобные депрессии). Оценка выявит конкретные симптомы и изучит медицинские и семейные истории, а также культурные и экологические факторы с целью постановки диагноза и планирования курса действий. Лекарство: Химический состав мозга может способствовать развитию депрессии у человека и влиять на его лечение. По этой причине могут быть назначены антидепрессанты, чтобы помочь изменить химический состав мозга. Эти лекарства не являются седативными, «успокаивающими» или транквилизаторами. Они не вызывают привыкания. Как правило, антидепрессанты не оказывают стимулирующего действия на людей, не страдающих депрессией. Антидепрессанты могут дать некоторое улучшение в течение первой или двух недель применения, но полное улучшение может не проявиться в течение двух-трех месяцев.Если через несколько недель пациент чувствует незначительное улучшение или его отсутствие, его или ее психиатр может изменить дозу лекарства или добавить или заменить другой антидепрессант. В некоторых ситуациях могут помочь другие психотропные препараты. Важно, чтобы ваш врач знал, если лекарство не работает или если вы испытываете побочные эффекты. Психиатры обычно рекомендуют пациентам продолжать принимать лекарства в течение шести или более месяцев после улучшения симптомов. Для снижения риска будущих эпизодов у некоторых людей с высоким риском может быть предложено более длительное поддерживающее лечение. Психотерапия: Психотерапия, или «терапия разговорами», иногда используется отдельно для лечения легкой депрессии; при депрессии от умеренной до тяжелой психотерапия часто используется вместе с антидепрессантами. Было обнаружено, что когнитивно-поведенческая терапия (КПТ) эффективна при лечении депрессии. КПТ — это форма терапии, направленная на решение проблем в настоящем. КПТ помогает человеку распознать искаженное/негативное мышление с целью изменить мысли и поведение, чтобы более позитивно реагировать на вызовы. Психотерапия может включать только человека, но может включать и других. Например, семейная или парная терапия может помочь решить проблемы в этих близких отношениях. Групповая терапия объединяет людей с похожими заболеваниями в благоприятной среде и может помочь участнику узнать, как другие справляются с подобными ситуациями. .В зависимости от тяжести депрессии лечение может занять несколько недель или намного дольше. Во многих случаях значительное улучшение может быть достигнуто за 10–15 сеансов. Электросудорожная терапия (ЭСТ) — это медицинское лечение, которое чаще всего используется для пациентов с тяжелой большой депрессией, которые не реагируют на другие виды лечения. Он включает кратковременную электрическую стимуляцию головного мозга, когда пациент находится под наркозом. Пациент обычно получает ЭСТ два-три раза в неделю, всего от шести до двенадцати процедур. Обычно им управляет команда обученных медицинских работников, включая психиатра, анестезиолога и медсестру или фельдшера.ЭСТ используется с 1940-х годов, и многолетние исследования привели к значительным улучшениям и признанию ее эффективности в качестве основного, а не «последнего средства» лечения. . Самопомощь и преодоление трудностейЕсть ряд вещей, которые люди могут сделать, чтобы уменьшить симптомы депрессии. Многим людям регулярные физические упражнения помогают создавать положительные эмоции и улучшают настроение. Регулярное получение достаточного количества качественного сна, здоровое питание и отказ от алкоголя (депрессанта) также могут помочь уменьшить симптомы депрессии. Депрессия — это настоящая болезнь, и помощь доступна. При правильной диагностике и лечении подавляющее большинство людей с депрессией преодолеют ее. Если вы испытываете симптомы депрессии, первым делом обратитесь к семейному врачу или психиатру. Расскажите о своих опасениях и запросите тщательную оценку. Это начало решения ваших потребностей в области психического здоровья. Связанные условияПредменструальное дисфорическое расстройство Предменструальное дисфорическое расстройство (ПМДР) было добавлено в Диагностическое и статистическое руководство по психическим расстройствам (DSM-5) в 2013 году.Женщина с ПМДР имеет серьезные симптомы депрессии, раздражительности и напряжения примерно за неделю до начала менструации. Общие симптомы включают перепады настроения, раздражительность или гнев, депрессивное настроение и выраженную тревогу или напряжение. Другие симптомы могут включать снижение интереса к обычным занятиям, трудности с концентрацией внимания, недостаток энергии или легкую утомляемость, изменения аппетита с пристрастием к определенным продуктам, проблемы со сном или слишком долгий сон, чувство подавленности или неконтролируемости.Физические симптомы могут включать болезненность или отек молочных желез, боль в суставах или мышцах, ощущение «вздутия живота» или увеличение веса. Эти симптомы появляются от недели до 10 дней до начала менструации и уменьшаются или прекращаются к началу менструации. Симптомы приводят к значительному дистрессу и проблемам с регулярным функционированием или социальными взаимодействиями. Для постановки диагноза ПМДР симптомы должны проявляться в большинстве менструальных циклов в течение последнего года и должны иметь неблагоприятное влияние на работу или социальное функционирование.По оценкам, предменструальное дисфорическое расстройство ежегодно затрагивает от 1,8% до 5,8% менструирующих женщин. ПМДР можно лечить антидепрессантами, противозачаточными таблетками или пищевыми добавками. Могут помочь изменения в диете и образе жизни, такие как уменьшение употребления кофеина и алкоголя, достаточное количество сна и физических упражнений, а также применение методов релаксации. Предменструальный синдром (ПМС) похож на ПМДР тем, что симптомы появляются за семь-десять дней до начала менструации у женщины. Однако ПМС включает в себя меньше и менее серьезные симптомы, чем ПМДР. Деструктивное нарушение регуляции настроения — это состояние, возникающее у детей и подростков в возрасте от 6 до 18 лет. Оно включает хроническую и сильную раздражительность, приводящую к сильным и частым вспышкам гнева. Вспышки гнева могут быть словесными или включать в себя поведение, такое как физическая агрессия по отношению к людям или имуществу. Эти вспышки значительно непропорциональны ситуации и не соответствуют возрасту развития ребенка.Они должны возникать часто (в среднем три или более раз в неделю) и, как правило, в ответ на фрустрацию. В промежутках между вспышками настроение ребенка устойчиво раздражительное или злое большую часть дня, почти каждый день. Это настроение заметно окружающим, например, родителям, учителям, сверстникам. Для постановки диагноза деструктивного расстройства регуляции настроения симптомы должны присутствовать в течение как минимум одного года как минимум в двух условиях (например, дома, в школе, со сверстниками), и это состояние должно начаться до 10 лет.Деструктивное расстройство дисрегуляции настроения гораздо чаще встречается у мужчин, чем у женщин. Это может происходить наряду с другими расстройствами, включая большую депрессию, дефицит внимания/гиперактивность, тревогу и расстройства поведения. Деструктивное расстройство дисрегуляции настроения может оказать значительное влияние на способность ребенка функционировать и оказать значительное влияние на семью. Хроническая сильная раздражительность и вспышки гнева могут разрушить семейную жизнь, затруднить ребенку/подростку завязывание или сохранение дружеских отношений и стать причиной трудностей в школе. Лечение обычно включает психотерапию (когнитивно-поведенческую терапию) и/или лекарства. Персистирующее депрессивное расстройство У человека со стойким депрессивным расстройством (ранее называвшимся дистимическим расстройством) депрессивное настроение большую часть дня, больше дней, чем нет, в течение как минимум двух лет. У детей и подростков настроение может быть раздражительным или депрессивным и должно продолжаться не менее одного года. В дополнение к подавленному настроению симптомы включают:
Персистирующее депрессивное расстройство часто начинается в детстве, подростковом или раннем взрослом возрасте и затрагивает примерно 0.5% взрослых в Соединенных Штатах каждый год. Люди со стойким депрессивным расстройством часто описывают свое настроение как грустное или «подавленное». Поскольку эти симптомы стали частью повседневного опыта человека, он может не обращаться за помощью, просто предполагая, что «я всегда был таким». Симптомы вызывают значительный дистресс или трудности в работе, социальной деятельности или других важных областях жизнедеятельности. Хотя влияние стойкого депрессивного расстройства на работу, отношения и повседневную жизнь может сильно различаться, его последствия могут быть такими же или даже более сильными, чем у большого депрессивного расстройства. Большой депрессивный эпизод может предшествовать возникновению персистирующего депрессивного расстройства, но также может возникать во время (и накладываться) на предыдущий диагноз персистирующего депрессивного расстройства. Каталожные номераОтзыв врача Автор: Феликс Торрес, доктор медицинских наук, MBA, DFAPA Опиоидная зависимость: MedlinePlus GeneticsПричины опиоидной зависимости сложны. Это состояние возникает в результате сочетания генетических факторов, факторов окружающей среды и образа жизни, некоторые из которых не были идентифицированы. Многие гены, которые, как считается, играют роль в опиоидной зависимости, вовлечены в эндогенную опиоидную систему, которая является внутренней системой организма для регуляции боли, вознаграждения и аддиктивного поведения. Он состоит из опиоидных веществ, вырабатываемых естественным образом в организме (называемых эндогенными опиоидами), и их рецепторов, к которым опиоиды подходят как ключи к замкам. Опиоиды, вводимые извне (называемые экзогенными опиоидами), включая опиоидные препараты и героин, также оказывают свое действие, воздействуя на эти рецепторы.Вариации в генах, которые обеспечивают инструкции по созданию опиоидных рецепторов, широко изучались как генетические факторы риска опиоидной зависимости. Исследователи подозревают, что различия в структуре и функциях рецепторов влияют на то, как организм реагирует на опиоиды. Опиоидные рецепторы находятся в нервной системе, где они встроены во внешнюю мембрану нервных клеток (нейронов). Когда эндогенные или экзогенные опиоиды прикрепляются (связываются) к рецепторам, это взаимодействие запускает серию химических изменений внутри нейронов и между ними, что приводит к ощущению удовольствия и облегчению боли.Опиоидный рецептор мю (μ), продуцируемый геном OPRM1 , является первичным рецептором для большинства опиоидных препаратов. Общие вариации в гене OPRM1 , по-видимому, влияют на то, как организм реагирует на опиоиды, включая количество опиоидного препарата, необходимого для облегчения боли. По крайней мере, в некоторых популяциях эти вариации также связаны с риском опиоидной зависимости. Изменения в генах, участвующих в других аспектах функционирования нервной системы, также изучались как факторы риска опиоидной зависимости.Некоторые из этих генов играют роль в различных путях нейротрансмиттеров, в которых химические вещества, называемые нейротрансмиттерами, и их рецепторы передают сигналы от одного нейрона к другому. Другие гены предоставляют инструкции для белков, которые помогают контролировать рост, выживание и специализацию (дифференциацию) нейронов. Хотя вариации в некоторых из этих генов связаны с опиоидной зависимостью, неясно, как эти генетические изменения влияют на то, как нервная система реагирует на опиоиды. Опиоидная зависимость — это сложное расстройство, и негенетические факторы также играют решающую роль. Факторы, которые, как было показано, увеличивают риск опиоидной зависимости, включают злоупотребление психоактивными веществами в анамнезе; депрессия или другие психические расстройства; жестокое обращение или пренебрежение в детстве; и определенные черты личности, в том числе импульсивность и поиск острых ощущений. Жизнь в бедности и в сельской местности, общение с другими людьми, злоупотребляющими опиоидами или другими веществами, а также легкий доступ к отпускаемым по рецепту или незаконным опиоидам также повышают риск возникновения у человека опиоидной зависимости.Вполне вероятно, что сочетание факторов здоровья, социальных, экономических факторов и образа жизни взаимодействует с генетическими факторами, определяя индивидуальный риск. 8 характеристик жизни в биологии — видео и расшифровка урокаОпределение характеристик жизниПервой характеристикой жизни, которую мы перечислили, была клеточная организация . Это просто означает, что живые существа состоят из клеток. Клетки — самая основная единица жизни. Неважно, являются ли эти клетки растениями, животными, грибами или бактериями.Если что-то должно быть живым, оно должно состоять из клеток. Второй репродукция . Если что-то живое, оно должно быть способно воспроизводиться. Многоклеточные формы жизни, такие как люди, размножаются половым путем, в то время как одноклеточные формы жизни, такие как бактерии, размножаются бесполым путем. Важно помнить, что в любом случае живые существа размножаются. Далее мы подходим к нашей третьей характеристике, метаболизму. Некоторым учащимся эта концепция немного трудна для понимания. Метаболизм по существу представляет собой совокупность химических реакций, происходящих в организме (или клетке). Эти реакции различаются по форме и функциям, но способствуют таким процессам, как синтез белка, химическое пищеварение, деление клеток или преобразование энергии. Поскольку метаболизм включает реакции, связанные с другими характеристиками, его иногда группируют с этими другими характеристиками. Однако для наших целей мы оставим метаболизм отдельно. Наша четвертая характеристика – гомеостаз. Гомеостаз — это термин, используемый для описания поддержания стабильной внутренней среды. Другими словами, подумайте о том, как наш организм поддерживает постоянную температуру тела или как постоянен уровень сахара в крови. Если гомеостаз нарушен и у нас поднимается температура, это признак того, что что-то угрожает жизни. То же самое относится и к сахару в крови. Когда он становится слишком высоким или слишком низким, нарушается гомеостаз, и, к сожалению, это может быть смертельно опасным. Поэтому поддержание гомеостаза является жизненно важной характеристикой жизни. Далее мы подходим к наследственности. Наследственность означает, что наша генетическая информация может передаваться из поколения в поколение. Если у кого-то из ваших родителей темные глаза, и у вас тоже темные глаза, это из-за наследственности. Реакция на раздражители — следующая характеристика в нашем обратном отсчете. Это просто реакция на внутреннюю или внешнюю силу. Это то, что вы, вероятно, уже видели. Подумайте о подсолнухе, склоняющемся к солнцу, о собаке, задыхающейся от жары, или о деревьях, сбрасывающих листья осенью, когда уровень солнечного света уменьшается.Все живые существа так или иначе реагируют на раздражители; чтобы увидеть это, все, что нам нужно сделать, это посмотреть. Наша седьмая характеристика жизни заключается в том, что все живые существа растут и развиваются , что просто означает, что они становятся больше и взрослеют. Считайте себя примером. Вы были младенцем, затем малышом, затем маленьким ребенком и т. д. Сегодня вы, вероятно, взрослый человек. Рассмотрим эту бабочку в качестве другого примера. Хотя у всех живых существ могут быть разные этапы жизни, все живое растет и развивается. Наконец, мы приходим к способности жизни приспосабливаться путем эволюции. Эволюция — это изменение наследственных признаков в популяции. Это неизбежный факт, что все формы жизни адаптируются и подвергаются эволюции. Рассмотрим, как собак одомашнили от волков. Это представляет собой изменение наследственных признаков (приручение) в популяции и является формой эволюции. Все живые существа приспосабливаются путем эволюции. Краткий обзор урокаИногда бывает трудно отличить живое от того, чего нет.К счастью, биологи разработали список из восьми характеристик, общих для всех живых существ. Характеристики — это черты или качества. Этими характеристиками являются клеточная организация , репродукция , метаболизм , гомеостаз , наследственность , реакция на стимулы , рост и развитие 0, эволюция 49 через адаптацию 901. Некоторые вещи, такие как вирус, демонстрируют лишь некоторые из этих характеристик и поэтому не являются живыми.Однако другие вещи будут демонстрировать все восемь характеристик и, таким образом, считаться живыми. Определения восьми характеристик жизни
Результат обученияЗавершая видеоурок, постарайтесь запомнить и разъяснить каждую из восьми характеристик жизни. Причины, Симптомы, Стадии, Лечение, ПоддержкаОбзорЧто такое болезнь Паркинсона?Болезнь Паркинсона — это заболевание нервной системы, которое влияет на вашу способность контролировать движения.Заболевание обычно начинается медленно и со временем ухудшается. Если у вас болезнь Паркинсона, вы можете дрожать, испытывать ригидность мышц и испытывать трудности при ходьбе и поддержании равновесия и координации. По мере ухудшения состояния у вас могут возникнуть проблемы с речью, сном, психические проблемы и проблемы с памятью, изменения в поведении и другие симптомы. Кто болеет болезнью Паркинсона?Болезнью Паркинсона заболевают примерно на 50 % больше мужчин, чем женщин. Чаще всего встречается у лиц в возрасте 60 лет и старше.Однако до 10% пациентов диагностируют до 50 лет. Ежегодно в США диагностируется около 60 000 новых случаев болезни Паркинсона. Болезнь Паркинсона передается по наследству?Ученые обнаружили генные мутации, связанные с болезнью Паркинсона. Существует мнение, что некоторые случаи болезни Паркинсона с ранним началом (заболевание начинается до 50 лет) могут передаваться по наследству. Ученые выявили генную мутацию у людей с болезнью Паркинсона, мозг которых содержит тельца Леви, представляющие собой скопления белка альфа-синуклеина.Ученые пытаются понять функцию этого белка и его связь с генетическими мутациями, которые иногда наблюдаются при болезни Паркинсона и у людей с деменцией, называемой деменцией с тельцами Леви. Было обнаружено, что несколько других генных мутаций играют роль в развитии болезни Паркинсона. Мутации в этих генах вызывают аномальное функционирование клеток, что влияет на способность нервных клеток высвобождать дофамин и вызывает гибель нервных клеток. Исследователи все еще пытаются выяснить, что вызывает мутацию этих генов, чтобы понять, как генные мутации влияют на развитие болезни Паркинсона. Ученые считают, что от 10% до 15% людей с болезнью Паркинсона могут иметь генетическую мутацию, предрасполагающую к развитию болезни. Есть также факторы окружающей среды, которые до конца не изучены. Симптомы и причиныЧто вызывает болезнь Паркинсона?Болезнь Паркинсона возникает, когда нервные клетки (нейроны) в области мозга, называемой черной субстанцией, повреждаются или отмирают. Эти клетки обычно производят дофамин, химическое вещество (нейротрансмиттер), которое помогает клеткам мозга общаться (передавать сигналы, «сообщения» между областями мозга).Когда эти нервные клетки повреждаются или умирают, они производят меньше дофамина. Дофамин особенно важен для работы другой области мозга, называемой базальными ганглиями. Эта область мозга отвечает за организацию команд мозга для движения тела. Потеря дофамина вызывает двигательные симптомы, наблюдаемые у людей с болезнью Паркинсона. Люди с болезнью Паркинсона также теряют другой нейротрансмиттер, называемый норэпинефрином. Это химическое вещество необходимо для правильного функционирования симпатической нервной системы.Эта система контролирует некоторые вегетативные функции организма, такие как пищеварение, частота сердечных сокращений, артериальное давление и дыхание. Потеря норадреналина вызывает некоторые симптомы болезни Паркинсона, не связанные с движением. Ученые не уверены, что вызывает гибель нейронов, вырабатывающих эти химические нейротрансмиттеры. Каковы симптомы болезни Паркинсона?Симптомы болезни Паркинсона и скорость их снижения сильно варьируются от человека к человеку. Наиболее распространенные симптомы включают:
Другие симптомы включают:
Какие существуют стадии болезни Паркинсона?У каждого человека с болезнью Паркинсона симптомы проявляются по-своему. Не у всех проявляются все симптомы болезни Паркинсона. Вы можете не испытывать симптомы в том же порядке, что и другие. У некоторых людей могут быть легкие симптомы; другие могут иметь интенсивные симптомы. Скорость ухудшения симптомов также варьируется от человека к человеку, и ее трудно или даже невозможно предсказать с самого начала. Как правило, заболевание прогрессирует от ранней стадии к средней стадии, от средней поздней стадии до поздней стадии. Вот что обычно происходит на каждом из этих этапов: Ранняя стадия Ранние симптомы болезни Паркинсона обычно слабо выражены, проявляются медленно и не мешают повседневной деятельности. Иногда ранние симптомы нелегко обнаружить, или вы можете подумать, что ранние симптомы — это просто нормальные признаки старения. У вас может быть усталость или общее чувство беспокойства.Вы можете почувствовать легкий тремор или вам будет трудно стоять. Часто член семьи или друг замечает некоторые тонкие признаки раньше вас. Они могут заметить такие вещи, как ригидность тела или отсутствие нормальных движений (нет движения руками при ходьбе), медленный или мелкий почерк, отсутствие выражения на лице или затруднения при вставании со стула. Средняя ступень Симптомы начинают ухудшаться. Тремор, ригидность мышц и проблемы с движением теперь могут затрагивать обе стороны тела.Проблемы с равновесием и падения становятся все более распространенными. Вы все еще можете быть полностью независимыми, но повседневные повседневные задачи, такие как купание и одевание, становятся все более трудными и занимают больше времени. Средне-поздняя стадия Стоять и ходить становится все труднее, может потребоваться помощь ходунков. Вам может понадобиться помощь на полный рабочий день, чтобы продолжать жить дома. Продвинутая стадия Теперь вам требуется инвалидное кресло, чтобы передвигаться, или вы прикованы к постели.Вы можете испытывать галлюцинации или бред. Теперь вам требуется постоянный уход. Диагностика и тестыКак диагностируется болезнь Паркинсона?Диагностика болезни Паркинсона иногда затруднена, поскольку ранние симптомы могут имитировать другие расстройства, а специфических анализов крови или других лабораторных анализов для диагностики заболевания не существует. Визуализирующие исследования, такие как КТ (компьютерная томография) или МРТ (магнитно-резонансная томография), могут использоваться для исключения других заболеваний, вызывающих аналогичные симптомы. Для диагностики болезни Паркинсона вас спросят о вашей истории болезни и семейной истории неврологических расстройств, а также о ваших текущих симптомах, лекарствах и возможном воздействии токсинов. Ваш врач будет искать признаки тремора и мышечной ригидности, наблюдать за вашей походкой, проверять вашу осанку и координацию, а также искать замедление движений. Если вы считаете, что у вас может быть болезнь Паркинсона, вам, вероятно, следует обратиться к неврологу, предпочтительно к неврологу, специализирующемуся на двигательных расстройствах.Решения о лечении, принятые на ранней стадии заболевания, могут повлиять на долгосрочный успех лечения. Управление и лечениеКак лечится болезнь Паркинсона?Болезнь Паркинсона неизлечима. Тем не менее, лекарства и другие методы лечения могут помочь облегчить некоторые симптомы. Упражнения могут значительно облегчить симптомы болезни Паркинсона. Кроме того, физиотерапия, трудотерапия и речевая терапия могут помочь при проблемах с ходьбой и равновесием, проблемах с приемом пищи и глотанием и проблемах с речью.Хирургия является вариантом для некоторых пациентов. Какие лекарства используются для лечения болезни Паркинсона?Лекарства являются основным методом лечения больных болезнью Паркинсона. Ваш врач будет тесно сотрудничать с вами, чтобы разработать план лечения, наиболее подходящий для вас, исходя из тяжести вашего заболевания на момент постановки диагноза, побочных эффектов класса лекарств и успеха или неудачи в контроле симптомов лекарств, которые вы пробуете. Лекарства против болезни Паркинсона по:
Леводопа: Леводопа является основным средством для лечения симптомов замедленности движений, тремора и скованности при болезни Паркинсона. Нервные клетки используют леводопу для выработки дофамина, который восполняет небольшое количество, обнаруживаемое в мозге людей с болезнью Паркинсона. Леводопа обычно принимается с карбидопой (Sinemet®), чтобы позволить большему количеству леводопы достичь головного мозга и предотвратить или уменьшить тошноту и рвоту, низкое кровяное давление и другие побочные эффекты леводопы.Sinemet® доступен в формуле с немедленным высвобождением и в формуле длительного действия с контролируемым высвобождением. Rytary® — это более новая версия леводопы/карбидопы в капсулах более длительного действия. Новейшим дополнением является Inbrija®, ингаляционная леводопа. Его используют люди, которые уже регулярно принимают карбидопу/леводопу, когда у них бывают эпизоды «отключения» (обсуждается ниже). Поскольку люди болеют болезнью Паркинсона в течение более длительного периода времени, эффекты принимаемых ими доз леводопы не длятся так долго, как раньше, что приводит к ухудшению их симптомов (тремор, мышечная ригидность, медлительность) до того, как они должны будут принять следующую дозу. доза.Это называется «избавлением». Они также могут замечать непроизвольные, плавные, танцевальные или ерзающие движения своего тела, называемые дискинезиями. Эти движения могут указывать на то, что доза леводопы слишком высока. Эти подъемы и спады эффектов леводопы называются двигательными флуктуациями и часто улучшаются при корректировке лекарства неврологом. Агонисты дофамина: Эти препараты имитируют действие дофамина на мозг. Они не так эффективны, как леводопа, в контроле медленных движений мышц и мышечной ригидности.Ваш врач может сначала попробовать эти лекарства и добавить леводопу, если ваши симптомы плохо контролируются, в зависимости от тяжести ваших симптомов и вашего возраста. Новые дофаминовые препараты включают ропинирол (Requip®) и прамипексол (Mirapex®). Ротиготин (Neupro®) дается в виде пластыря. Апоморфин (Апокин®) — инъекционный препарат короткого действия. Побочные эффекты агонистов допамина включают тошноту, рвоту, головокружение, предобморочное состояние, проблемы со сном, отек ног, спутанность сознания, галлюцинации и компульсивное поведение (например, чрезмерное увлечение азартными играми, покупками, едой или сексом).Некоторые из этих побочных эффектов чаще встречаются у людей старше 70 лет. Ингибиторы катехол-О-метилтрансферазы (КОМТ): Эти препараты блокируют фермент, расщепляющий дофамин в головном мозге. Эти препараты принимаются с леводопой и замедляют способность вашего организма избавляться от леводопы, поэтому действие длится дольше и надежнее. Энтакапон (Comtan®) и толкапон (Tasmar®) являются примерами ингибиторов COMT. Опикапон (Ongentys®) — новейший препарат этого класса, получивший одобрение FDA в апреле 2020 года.Поскольку эти препараты повышают эффективность леводопы, они также могут усиливать ее побочные эффекты, включая непроизвольные движения (дискинезии). Толкапон назначают редко, поскольку он может повредить печень и требует тщательного наблюдения для предотвращения печеночной недостаточности. Ингибиторы МАО В. Эти препараты блокируют определенный мозговой фермент — моноаминоксидазу В (МАО В), — который расщепляет дофамин в вашем мозгу. Это позволяет дофамину оказывать более продолжительное воздействие на мозг. Примеры ингибиторов МАО B включают селегилин (Eldepryl®, Zelapar®), разагилин (Azilect®) и сафинамид (Xadago®).Побочные эффекты этих препаратов включают тошноту и бессонницу. Прием карбидопы-леводопы с ингибитором МАО В увеличивает вероятность галлюцинаций и дискинезии. Ингибиторы МАО В не назначают, если вы принимаете определенные антидепрессанты или наркотические препараты. Ваш врач рассмотрит все ваши текущие лекарства и сделает лучший выбор лечения для вас. Антихолинергические средства. Эти препараты помогают уменьшить тремор и ригидность мышц. Примеры включают бензтропин (Cogentin®) и тригексифенидил (Artane®).Это старейший класс препаратов для лечения болезни Паркинсона. Побочные эффекты включают помутнение зрения, запор, сухость во рту и задержку мочи. Лицам старше 70 лет, склонным к спутанности сознания и галлюцинациям или имеющим нарушения памяти, не следует принимать антихолинергические средства. Из-за высокой частоты побочных эффектов эти препараты используются реже. Амантадин. Амантадин (Симметрел®), впервые разработанный как противовирусное средство, полезен для уменьшения непроизвольных движений (дискинезии), вызванных препаратами леводопы.Существуют две формы препарата с пролонгированным высвобождением: Gocovri® и Osmolex ER®. Побочные эффекты включают спутанность сознания и проблемы с памятью. Истрадефиллин. Истрадефиллин (Nourianz®) является антагонистом рецептора аденозина A2A. Он используется для людей, принимающих карбидопу-леводопу, но испытывающих симптомы выключения. Как и другие препараты, повышающие эффективность леводопы, они также могут усиливать ее побочные эффекты, включая непроизвольные движения (дискинезии) и галлюцинации. Какие существуют хирургические методы лечения болезни Паркинсона?Большинство пациентов с болезнью Паркинсона могут поддерживать хорошее качество жизни с помощью лекарств.Однако по мере ухудшения состояния лекарства могут перестать быть эффективными у некоторых пациентов. У этих пациентов эффективность лекарств становится непредсказуемой: они уменьшают симптомы в периоды «включения» и больше не контролируют симптомы в периоды «выключения», что обычно происходит, когда заканчивается действие лекарства и непосредственно перед приемом следующей дозы. Иногда с этими изменениями можно справиться, заменив лекарства. Однако иногда они не могут. В зависимости от типа и серьезности ваших симптомов, неудачной корректировки ваших лекарств, снижения качества вашей жизни и общего состояния здоровья, ваш врач может обсудить некоторые из доступных хирургических вариантов.
ПрофилактикаМожно ли предотвратить болезнь Паркинсона?К сожалению, нет.Болезнь Паркинсона — это хроническое заболевание, которое со временем ухудшается. Хотя нет способа предотвратить или вылечить болезнь (на данный момент времени), лекарства могут значительно облегчить ваши симптомы. У некоторых пациентов, особенно у пациентов с поздней стадией заболевания, хирургическое вмешательство для улучшения симптомов может быть вариантом. Перспективы/прогнозКаковы перспективы для людей с болезнью Паркинсона?Хотя лекарства или абсолютных доказательств способов предотвращения болезни Паркинсона не существует, ученые усердно работают, чтобы узнать больше об этом заболевании и найти инновационные способы более эффективного лечения, предотвращения его прогрессирования и, в конечном итоге, излечения. В настоящее время усилия вашей медицинской бригады сосредоточены на медикаментозном лечении ваших симптомов, а также на общих рекомендациях по улучшению здоровья и образа жизни (упражнения, здоровое питание, улучшение сна). Выявляя отдельные симптомы и корректируя курс действий в зависимости от изменений симптомов, большинство людей с болезнью Паркинсона могут жить полноценной жизнью. Будущее с надеждой. Некоторые из проводимых исследований включают:
Ведутся и многие другие расследования. Многое было изучено, достигнут значительный прогресс, и, вероятно, будут сделаны дополнительные открытия. Жить сКакие изменения в образе жизни я могу внести, чтобы облегчить симптомы болезни Паркинсона?Упражнения: Упражнения помогают улучшить мышечную силу, равновесие, координацию, гибкость и уменьшить тремор.Также считается, что он улучшает память, мышление, снижает риск падений и уменьшает тревогу и депрессию. Одно исследование с участием людей с болезнью Паркинсона показало, что 2,5 часа упражнений в неделю приводили к улучшению способности двигаться и более медленному снижению качества жизни по сравнению с теми, кто не тренировался или начал заниматься только позже в течение болезни. . Некоторые упражнения, которые следует учитывать, включают силовые тренировки или тренировки с отягощениями, упражнения на растяжку или аэробику (бег, ходьба, танцы).Все виды упражнений полезны. Соблюдайте здоровую, сбалансированную диету: Это не только полезно для общего состояния здоровья, но и может облегчить некоторые симптомы болезни Паркинсона, не связанные с движением, такие как запор. Употребление в пищу продуктов с высоким содержанием клетчатки, в частности, может облегчить запор. Средиземноморская диета является одним из примеров здорового питания. Предотвращение падений и сохранение равновесия: Падения являются частым осложнением болезни Паркинсона. Хотя вы можете сделать многое, чтобы снизить риск падения, двумя наиболее важными из них являются: 1) работать с врачом, чтобы убедиться, что ваши методы лечения — будь то лекарства или глубокая стимуляция мозга — оптимальны; и 2) проконсультироваться с физиотерапевтом, который может оценить вашу походку и равновесие.Физиотерапевт является экспертом, когда дело доходит до рекомендации вспомогательных устройств или упражнений для повышения безопасности и предотвращения падений. Улучшите качество своего сна. Как предотвратить падение от распространенных опасностей?
Какие советы помогут мне сохранить равновесие?
РесурсыЖизнь с болезнью Паркинсона может быть разочаровывающей. Это нормально чувствовать злость, депрессию и тревогу.Вам и членам вашей семьи может быть полезно связаться с другими людьми, у которых есть это заболевание, чтобы поделиться своими знаниями и идеями, опытом и советами по жизни. Вы можете проверить местные группы поддержки этих организаций Паркинсона: Вам также может быть интересно узнать больше о клинических испытаниях или присоединиться к ним. Дополнительную информацию см. на следующих сайтах: .10.4: Физические и химические измененияРезультаты обучения
Физические измененияКогда кубик льда тает, его форма меняется, поскольку он приобретает способность течь. При этом его состав не меняется. Плавление является примером физического изменения . Физическое изменение — это изменение образца материи, при котором изменяются некоторые свойства материи, но не изменяется сущность материи. Физические изменения можно дополнительно классифицировать как обратимые и необратимые.Растаявший кубик льда можно снова заморозить, поэтому таяние является обратимым физическим изменением. Все физические изменения, связанные с изменением состояния, обратимы. Другие изменения состояния включают испарение (жидкость в газ), замерзание (жидкость в твердое) и конденсацию (газ в жидкость). Растворение также является обратимым физическим изменением. Когда соль растворяется в воде, говорят, что соль перешла в водное состояние. Соль можно восстановить, выкипятив воду, оставив соль. Рисунок \(\PageIndex{1}\): Тающий лед в море Бофорта.Когда кусок дерева измельчается в опилки, это изменение необратимо, поскольку опилки не могут быть преобразованы в тот же кусок дерева, что и раньше. Стрижка травы или измельчение камня были бы другими необратимыми физическими изменениями. Дрова также представляют собой необратимые физические изменения, поскольку их части нельзя собрать вместе, чтобы сформировать дерево. Рисунок \(\PageIndex{2}\): Вырубка дров — это физическое изменение, потому что их состав не меняется при вырубке.Химические измененияПри контакте с воздухом предмет из железа со временем начинает ржаветь (см. рисунок ниже). Рисунок \(\PageIndex{3}\): Ржавчина (оксид железа) образуется на незащищенной поверхности железа.По мере образования ржавчины на поверхности железа она отслаивается, обнажая больше железа, которое будет продолжать ржаветь. Ржавчина явно отличается от железа. Ржавление является примером химического изменения. Химическое свойство описывает способность вещества претерпевать определенные химические изменения .Химическое свойство железа заключается в том, что оно способно соединяться с кислородом с образованием оксида железа, химическое название ржавчины. Более общий термин для ржавчины и других подобных процессов — коррозия. Другими терминами, которые обычно используются при описании химических изменений, являются горение, гниение, взрыв, и ферментация . Химические свойства очень полезны в качестве способа идентификации веществ. Однако, в отличие от физических свойств, химические свойства можно наблюдать только тогда, когда вещество находится в процессе превращения в другое вещество. Химическое изменение также называют химической реакцией. Химическая реакция — это процесс, который происходит, когда одно или несколько веществ превращаются в одно или несколько новых веществ . Цинк \(\left( \ce{Zn} \right)\) представляет собой серебристо-серый элемент, который можно растереть в порошок. Если цинк смешать при комнатной температуре с порошкообразной серой \(\left( \ce{S} \right)\), ярко-желтым элементом, результатом будет просто смесь цинка и серы. Химической реакции не происходит.Однако, если к смеси подводится энергия в виде тепла, цинк будет химически реагировать с серой с образованием сложного сульфида цинка \(\left( \ce{ZnS} \right)\). На фото ниже представлены вещества, участвующие в этой реакции. Рисунок \(\PageIndex{4}\): Цинк (A) и сера (B) — это два элемента, которые при нагревании вступают в химическую реакцию с образованием соединения сульфида цинка (C).Реакцию между цинком и серой можно изобразить в так называемом химическом уравнении.Проще говоря, мы могли бы записать реакцию как: \[\text{цинк} + \text{сера} \rightarrow \text{сульфид цинка}\] Более удобным способом выражения химической реакции является использование символов и формул участвующих веществ: \[\ce{Zn} + \ce{S} \rightarrow \ce{ZnS}\] Вещества слева от стрелки в химическом уравнении называются реагентами. Реагент — это вещество, присутствующее в начале химической реакции. Вещества справа от стрелки называются продуктами. Продукт представляет собой вещество, которое присутствует в конце химической реакции . В приведенном выше уравнении цинк и сера являются реагентами, которые химически объединяются с образованием сульфида цинка в качестве продукта. Распознавание химических реакцийКак узнать, идет ли химическая реакция? Некоторые визуальные подсказки указывают на то, что химическая реакция вероятна (но не обязательно), включая следующие примеры:
Когда цинк реагирует с соляной кислотой, реакция сильно бурлит, так как образуется газообразный водород (см. рисунок ниже). Выделение газа также указывает на то, что может происходить химическая реакция. Рисунок \(\PageIndex{5}\): Цинк реагирует с соляной кислотой с образованием пузырьков газообразного водорода.При добавлении бесцветного раствора нитрата свинца (II) к бесцветному раствору йодида калия мгновенно образуется желтое твердое вещество, называемое осадком (см. рисунок ниже). Осадок представляет собой твердый продукт, который образуется в результате реакции и осаждается из жидкой смеси . Образование осадка также может свидетельствовать о протекании химической реакции. \[\ce{Pb(NO_3)_2} \left( aq \right) + 2 \ce{KI} \left( aq \right) \rightarrow \ce{PbI_2} \left( s \right) + 2 \ ce{KNO_3} \left( aq \right)\] Рисунок \(\PageIndex{6}\): Желтый осадок твердого йодида свинца (II) образуется немедленно при смешивании растворов нитрата свинца (II) и йодида калия.Авторы и авторство
|
|---|

 Свеча горела некоторое время, а затем погасла. Почему горение прекратилось? Какое условие взаимодействия веществ было нарушено?
Свеча горела некоторое время, а затем погасла. Почему горение прекратилось? Какое условие взаимодействия веществ было нарушено? приведение веществ в тесное соприкосновение (измельчение,
перемешивание, растворение).
приведение веществ в тесное соприкосновение (измельчение,
перемешивание, растворение).

 Затем может иметь место сигматропный водородный сдвиг [1 s ,7 a ], как показано четырьмя изогнутыми стрелками. Что касается примерной плоскости этой π-электронной системы (обозначенной зелеными связями), атом водорода отходит от нижней грани и присоединяется к верхней грани, поэтому перенос является антарафациальным.
Затем может иметь место сигматропный водородный сдвиг [1 s ,7 a ], как показано четырьмя изогнутыми стрелками. Что касается примерной плоскости этой π-электронной системы (обозначенной зелеными связями), атом водорода отходит от нижней грани и присоединяется к верхней грани, поэтому перенос является антарафациальным. Префиксы con и dis можно запомнить по ассоциации с их присутствием в словах согласен и не согласен .Эти два режима электроциклической реакции показаны на следующей диаграмме в том общем виде, в котором они наиболее часто наблюдаются. Конкретные примеры этих электроциклических реакций были приведены ранее.
Префиксы con и dis можно запомнить по ассоциации с их присутствием в словах согласен и не согласен .Эти два режима электроциклической реакции показаны на следующей диаграмме в том общем виде, в котором они наиболее часто наблюдаются. Конкретные примеры этих электроциклических реакций были приведены ранее.