Температура и скорость химической реакции
При изменении температуры на 10° С скорость диффузии, как показывает опыт, изменяется приблизительно в 1,2 раза, а скорость химической реакции — в 3—4, раза. Поэтому при понижении температуры скорость химической реакции убывает быстрее, чем скорость диффузии, и прн низких температурах процесс чаще протекает в кинетической области. [c.312]Скорость реакции зависит от природы реагирующих веществ, их концентрации, температуры и от присутствия в системе катализаторов. В тех случаях, когда для протекания реакции необходимо столкновение двух реагирующих частиц (молекул, атомов), зависимость скорости реакции от концентраций определяется законом действия масс при постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ. [c.89]
Влияние температуры. С повышением температуры скорость химической реакции, как правило, возрастает.
При низкой температуре скорость химической реакции достаточно медленна и СО2 постоянно обновляется диффузией в поры кокса. Вся поверхность, включая тонкие поры, находится в контакте с газовой фазой примерно постоянного состава. Говорят, что реакция протекает в кинетической области, потому что скорость газификации зависит исключительно от скорости химической реакции. [c.194]
Если поднять температуру, скорость химической реакции быстро возрастает, тогда как скорость обновления газов в порах (скорость диффузии) растет значительно медленнее. Менее доступные поры закупориваются получающимся СО и их поверхность принимает все меньшее участие в реакции. Весь СО2, попадающий в поры, поглощается, и скорость газификации ограничена количеством газа, диф- [c. 194]
194]
С повышением температуры скорость химических реакций возрастает, что зависит от числа эффективных столкновений. Согласно [c.30]
Зависимость скорости реакции от концентрации реагирующих веществ подчиняется закону действия масс при постоянной температуре скорость химической реакции пропорциональна произведению концентраций реагирующих веществ. Например, для реакции [c.32]
С повышением температуры скорость химической реакции также сильно возрастает. Опыт показывает, что [c.84]
Опыт показывает, что с повышением температуры скорость химической реакции возрастает. В уравнении химической кинетики
С повышением температуры скорости химических реакций, как правило, сильно возрастают. [c.276]
Эксперименты показывают, что с увеличением температуры скорость химической реакции быстро растет (константа скорости увеличивается). В большинстве случаев при повышении температуры на 10° скорость гомогенной реакции увеличивается в 2—4 раза (приближенное правило Вант-Гоффа). Температурный коэффициент [c.268]
Температурный коэффициент [c.268]
Когда к ц соизмеримы друг с другом, наблюдается переходная область. При этом с повышением температуры скорость химической реакции увеличивается и процесс сдвигается в диффузионную область. С другой стороны, увеличение интенсивности перемешивания приводит к увеличению скорости диффузии (вследствие уменьшения б) и сдвигу процесса в кинетическую область. Полезно также иметь в виду, что для газов коэффициент диффузии зависит от давления (обратно пропорционален давлению). Поэтому уменьшение давления увеличивает вероятность протекания реакции в кинетической области. [c.295]
С возрастанием температуры скорость химической реакции растет. Многочисленные данные эксперимента позволили Вант-Го( х )у установить правило [c.171]
Опыт показывает, что с повышением температуры скорость химической реакции увеличивается. Причем для гомогенных реакций между газообразными веществами при увеличении температуры на каждые 10° С скорость возрастает в 2—4 раза. Во столько же раз возрастет скорость реакции образования иодоводорода из иода и водорода при увеличении температуры, например, от 100 до 110° С. Казалось бы, естественным объяснением этому факту может служить то, что с ростом температуры скорость движения газообразных молекул повышается, следовательно, увеличивается число их столкновений и скорость реакции.
Во столько же раз возрастет скорость реакции образования иодоводорода из иода и водорода при увеличении температуры, например, от 100 до 110° С. Казалось бы, естественным объяснением этому факту может служить то, что с ростом температуры скорость движения газообразных молекул повышается, следовательно, увеличивается число их столкновений и скорость реакции.
При повышении температуры скорость химических реакций, как правило, быстро увеличивается. Примером для характеристики роста скорости реакции с температурой могут служить данные табл. 15. [c.221]
Зависимость константы скорости реакции от температуры. Скорость химических реакций, как правило, резко возрастает с увеличением температуры. Согласно правилу Вант-Гоффа при уве- [c.176]
При повышении температуры скорость химических реакций обычно увеличивается. Пусть при температуре 1 константа скорости равна ки а при температуре на 10° выше — г+ю- Отношение [c. 24]
24]
При высокой температуре скорость химической реакции возрастает быстрее, чем скорость диффузии, и поэтому суммарная скорость процесса будет определяться диффузионной стадией (диффузионная область гетерогенного процесса). При этом гетерогенная реакция характеризуется первым порядком реакции, слабой зависимостью скорости процесса от температуры и незначительным влиянием на скорость процесса величины поверхности раздела фаз. Скорость во многом начинает определяться факторами, влияющими на диффузию. [c.123]
Помимо концентрации реагирующих веществ другим важным фактором, влияющим на скорость реакции, является температура. С повышением температуры скорость химических реакций возрастает. Из уравнения (1У.2) видно, что в этом случае возрастание скорости реакции связано с увеличением константы, так как концентрация реагирующих веществ от температуры не зависит. Если обозначить через кт константу скорости реакции при температуре Т, а через кт+щ константу скорости при температуре на 10 °С большей, то отношение этих констант будет равно температурному коэффициенту скорости реакции 7  85]
85]
Температура. С ростом температуры увеличивается частота столкновений молекул реагирующих веществ, а следовательно, скорость реакций. Наоборот, с понижением температуры скорость химических реакций понижается. Установлено, что при повышении температуры на каждые 10 градусов скорость химической реакции возрастает в 2—4 раза, при понижении на каждые 10 градусов —уменьшается во столько же раз. Число, показывающее, во сколько раз увеличивается [c.164]
При диффузионном методе создают такие условия для возникновения процесса, при которых смесь сгорает немедленно при самом ее возникновении, т. е. при соприкосновении топлива и окислителя в соответствующих количественных соотношениях. Так как при высоких температурах скорость химической реакции становится несоизмеримо большей, чем скорость смесеобразования, то фактическая скорость сгорания топлива оказывается равной скорости смесеобразования, которая при необходимости может регулироваться в самых широких пределах.
Температура является одним из наиболее важных факторов, от которых зависит ход окисления. С ростом температуры скорость химической реакции увеличивается, подчиняясь экспоненциальной зависимости (рис. 3.2). [c.36]
При высоких температурах скорость химической реакции обычно высока и процесс протекает в диффузионной области. При небольших температурах в соответствии с кинетикой скорость химической реакции уменьшается и процессы протекают в кинетической области. При умеренных температурах процесс происходит в переходной области. [c.70]
Существенное влияние на скорость реакции оказывает температура. С повыщением температуры скорость химической реакции возрастает. Ускорение это происходит независимо от того, имеем ли мы дело с реакциями первого второго или более высокого порядка. Согласно правилу Вант-Гоффа величина температурного коэффициента колеблется в пределах 2—4, т.е. при повьпиении температуры на 10 скорость химической реакции возрастает в два—четыре раза.
Таким образом, с точки зрения термодинамики повышение температуры в огромном большинстве самопроизвольных реакций ведет к уменьшению выхода продукта. Вместе с тем, хорошо известно, что на практике многие реакции проводят при повышенных температурах, сознательно уменьшая выход ценного продукта. Этот парадокс объясним с ростом температуры скорости химических реакций растут гораздо быстрее, чем падают их выхода, что заставляет технологов идти на разумные компромиссы для увеличения производительности процессов. [c.423]
При низких температурах скорость химической реакции очень мала, в то время как диффузия СОа в порах частицы происходит сравнительно быстро. Поэтому окисление углерода идет практически равномерно по всей частице. Твердое вещество, окружающее поры, постепенно расходуется, пористость частицы сильно возрастает, вследствие чего при сохранении прежних размеров масса частицы экспоненциально падает. Такой процесс соответствует модели непрерывного превращения , к нему применимы уравнения (ХУ,4) и (XV,5). [c.412]
Такой процесс соответствует модели непрерывного превращения , к нему применимы уравнения (ХУ,4) и (XV,5). [c.412]
При повышении температуры скорость химической реакции возрастает значительно сильнее, чем скорость диффузии. Поэтому повышение температуры способствует переходу в диффузионную область. [c.263]
На рис. 5-6 изображена зависимость тепловыделения Qp и тепло-потерь Qт от температуры. Скорость химической реакции с ростом температуры увеличивается прогрессивно согласно закону Аррениуса, поэтому тепловыделение в единице объема выражается экспоненциальной кривой
Скорость химических реакций горения зависит от природы топлива и физических условий концентрации реагирующего газа на поверхности, температуры и давления. Температурная зависимость скорости химической реакции является наиболее сильной. В области низких температур скорость химической реакции мала и по потреблению кислорода во много раз меньше скорости, с которой кислород может быть доставлен диффузией. Процесс горения ограничивается скоростью самой химической реакции и не зависит от условий подвода кислорода, т. е. скорости воздушного потока, размера частиц и т. д. Поэтому эта область протекания гетерогенного горения называется кинетической. [c.330]
Процесс горения ограничивается скоростью самой химической реакции и не зависит от условий подвода кислорода, т. е. скорости воздушного потока, размера частиц и т. д. Поэтому эта область протекания гетерогенного горения называется кинетической. [c.330]
При некоторой температуре скорость химической реакции становится соизмеримой со скоростью доставки кислорода к ре- Рис. 15-1. Области протекания акционной поверхности и тогда скорость го- гетерогенной реакции, рения становится зависящей не только — кинетическая-, 2 2 — про- [c.331]
Обычно при повышении температуры скорость химической реакции увеличивается. Встречаются, однако, и такие реакции (среди тримолекулярных), у которых константа скорости уменьшается с ростом температуры. [c.31]
Влияние температуры на скорость реакций. Энергия активации. При повышении температуры скорость химических реакций увеличивается это увеличение весьма значительно. Так, скорость реакции 2Н2 + 0г=2Н20 при 300° С неизмеримо мала, а при 700° С реакция протекает уже мгновенно, в форме взрыва. [c.475]
[c.475]
Влияние концентрации веществ на скорость реакции определяется законом действующих масс, открытым К. Гульдбергом и П. Вааге (1864—1867), согласно которому при постоянной температуре скорость химической реакции пропорциональна произведению концентраций реагирующих веществ, возведенных в степенях, равных стехиометрическим коэффициентам в уравнении реакции. [c.20]
При повышении температуры скорость химических реакций обычно возрастает. Это объясняется теорией активации. Не все столкновения между молекулами приводят к их взаимодействию. Для этого молекулы должны обладать достаточной энергией. Такие молекулы называют активными. Энергия, необходимая для активирования молекул, называется энергией активации (Еакт) [c.141]
При гетерогенных процессах горения или газификации необходимо обеспечить подвод и отвод газообразных продуктов от реакционной поверхности. Для гомогенного реагрхрования необходимо иметь физическую стадию смесеобразования. При высоких температурах скорости химических реакций обычно настолько велики, что процесс горения или газификации в целом определяется и регулируется указанными физическими явлениями. [c.56]
При высоких температурах скорости химических реакций обычно настолько велики, что процесс горения или газификации в целом определяется и регулируется указанными физическими явлениями. [c.56]
С дальиейлним повышением температуры скорость химической реакции возрастает настолько, что становится несоизмеримой со скоростью внутренней диффузии, и внутреннее объемное горение практически прекращается. Прн этом внешняя диффузия кислорода к иоверхностн углерод-Н0] 0 тела мон ет значительно превышать скорость поверхностной химической реакции. Процесс горения перейдет во внешнюю кинетическую область. Прн очень высоких температурах скорость химической реакции становится настолько большой, что процесс в целом начинает опреде- тяться скоростью внешней диффузии, т. с. переходит ио внешнюю диффузионную область. [c.160]
Влияние температуры на скорость реакций. Энергия ак-ивации. При повышении температуры скорость химических реакций увеличивается это увеличение весьма значительно. Так, ско-юсть реакции 2Нг + Ог = 2НгО при 300 °С неизмеримо мала, а [ри 700 °С реакция протекает уже мгновенно, в форме взрыва. )бщий характер зависимости скорости реакции от температуры [ллюстрируется кривыми рис. 162. [c.469]
Так, ско-юсть реакции 2Нг + Ог = 2НгО при 300 °С неизмеримо мала, а [ри 700 °С реакция протекает уже мгновенно, в форме взрыва. )бщий характер зависимости скорости реакции от температуры [ллюстрируется кривыми рис. 162. [c.469]
При повышении температуры скорость химических реакций возрастает. Общий характер этой зависимости показывают кривые рис. 73. Степень влияния температуры может быть иллюстрирована, например, тем, что в реакции 2Нг + Ог = 2Н2О при 300° С скорость неизмеримо мала, а при 700° С эта реакция протекает уже мгновенно в форме взрыва. [c.322]
Влияние температуры на скорость химической реакции
Влияние температуры на скорость химических реакций. Если Т->оо, то Kj- Ko, т. е. константа Кт сильно растет (экспоненциально) и при температурах процессов сварки металлов плавлением (10 … 10 К) скорости взаимодействия будут очень велики и будут приближать состояние к равновесному, которое рассчитывается методами химической термодинамики.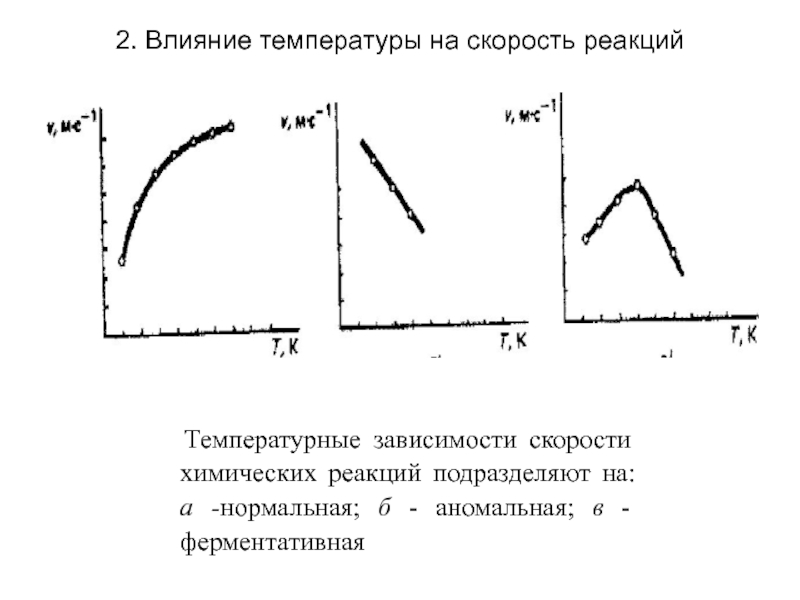 [c.297]
[c.297]Влияние температуры на скорость химической реакции [c.224]
Влияние температуры на скорость химической реакции учитывают в формуле для скорости реакции множителем к, где к —скорость реакции, отнесенная к концентрации. [c.56]
Количественное влияние температуры на скорость химической реакции выражается уравнением Аррениуса [c.80]
Для биологических процессов необходимо поддержание реакции среды в пределах 6—8,5, в связи с чем в воде обязательно контролируют величину pH. Температура воды — также один из важных параметров процесса, поскольку она влияет на растворимость кислорода в воде, а также на скорость биохимических реакций (аналогично влиянию температуры на скорость химических реакций). [c.64]
Влияние температуры на скорость химических реакций 206 [c.1]
Часто наблюдаемое на практике влияние температуры на скорости сталеплавильных реакций объясняется изменением скорости не собственно химической реакции, а других звеньев реакции, например диффузионных процессов. [c.56]
[c.56]
Влияние температуры на скорость газовой коррозии находится в прямой связи с соответствующими изменениями константы скорости химической реакции и коэффициента диффузии. Константа скорости гетерогенной химической реакции (газовой коррозии) и коэффициент диффузии растут с повышением температуры по экспоненциальному закону. Таким образом, повышение температуры должно влиять на скорость окисления металлов по аналогичному закону. [c.38]
Неоднозначно влияние температуры на скорость коррозионных процессов, каждый из которых представляет собой совокупность различных химических, физико-химических и чисто физических процессов. Скорости отдельных ступеней изменяются с температурой в неодинаковой степени. Когда интенсивность коррозии определяется скоростями электродных или электрохимических реакций либо скоростью диффузии, общая коррозия ускоряется с ростом температуры по логарифмическому закону (рис. 1.8). [c.41]
Коррозионный процесс представляет замкнутую цепь физико-химических и химических реакций и чисто физических процессов, причем кинетика каждого из них может иметь различную зависимость от температуры (различную энергию активации), Рассмотрим характерные случаи влияния температуры на скорость коррозии. [c.281]
[c.281]
Температура оказывает влияние на константу скорости химической реакции и на коэффициент массопередачи в процессе диффузии. [c.55]
Скорость химической реакции в общем случае зависит от химической природы и концентрации реагирующих веществ, а также от физических факторов — температуры и давления. Для большинства топочных процессов, протекающих при давлении, близком к атмосферному, наиболее существенным физически.м фактором является температура. Влияние давления на скорость процесса горения оказывается лишь в специальных установках, работающих под давлением. [c.66]
В реальных топочных условиях втекающая струя и топочные газы имеют резко различную температуру. Температура струи намного ниже температуры продуктов сгорания, заполняющих топочный объем, и потому горячие топочные газы прогревают струю. На начальном участке, в зоне смешения газового топлива с горячими топочными газами, по мере приближения к наружным границам струи температура повышается, а концентрация кислорода и топлива уменьшается. Согласно закону Аррениуса повышение, температуры должно приводить к резкому увеличению скорости химической реакции, а согласно закону действующих масс понижение концентрации должно ее уменьшить. Вследствие более резко выраженного влияния температуры наибольшая скорость реагирования достигается в слоях, ближе расположенных к перифериен струи (линии АВ на рис. 7-2). Переход из области отсутствия или слабого химического реагирования (в ядре потока) в область активного реагирования (на периферии) сопровождается воспламенением, которое распространяется через все сечение струи в глубь факела.
[c.101]
Согласно закону Аррениуса повышение, температуры должно приводить к резкому увеличению скорости химической реакции, а согласно закону действующих масс понижение концентрации должно ее уменьшить. Вследствие более резко выраженного влияния температуры наибольшая скорость реагирования достигается в слоях, ближе расположенных к перифериен струи (линии АВ на рис. 7-2). Переход из области отсутствия или слабого химического реагирования (в ядре потока) в область активного реагирования (на периферии) сопровождается воспламенением, которое распространяется через все сечение струи в глубь факела.
[c.101]
Химическая реакция, протекающая в жидкости или газе, приводит к выделению (поглощению) тепла и к образованию продукта, плотность которого отличается от плотности реагента. Неоднородности плотности, создаваемые за счет температуры и концентрации, приводят к появлению конвекции реагирующей среды. Такого рода ситуации интересны с разных точек зрения, в частности, в связи с выяснением влияния, которое могут оказать конвективные течения на скорость протекания реакций. Химическая активность среды может служить как основной причиной неустойчивости, так и сильно осложняющим фактором. При этом возможны различные постановки задач соответственно типу реакций, относительной роли теплового эффекта и пр. В данном параграфе обсуждаются две задачи такого рода.
[c.188]
Химическая активность среды может служить как основной причиной неустойчивости, так и сильно осложняющим фактором. При этом возможны различные постановки задач соответственно типу реакций, относительной роли теплового эффекта и пр. В данном параграфе обсуждаются две задачи такого рода.
[c.188]
Кузнецов ВЛ. Влияние флуктуаций температур и концентраций на среднюю скорость химической реакции в турбулентном потоке.// В кн. Второй Всесоюзный симпозиум по горению и взрыву. — М. ИХФ АН СССР, -1969. -С. 99-103. [c.326]
Нри решении задачи полагается, что химические реакции происходят в очень тонкой зоне, аналогичной своеобразному пограничному слою, особенность которого проявляется лишь том, что он случайным образом колеблется под действием крупномасштабных пульсаций. Поскольку толщина зоны реакции мала, ее можно рассматривать как локально плоскую, следовательно, внутренняя структура этой зоны описывается системой обыкновенных дифференциальных уравнений, в которых фигурируют лишь скорости химических реакций и слагаемые, характеризующие процессы переноса в направлении, нормальном зоне реакции. Для описания влияния крупномасштабных колебаний зоны реакции на осредненные значения концентраций продуктов сгорания и температуру используется распределение вероятностей восстановленной концентрации горючего 2 (массовая концентрация атомов горючего во всех образовавшихся химических соединениях).
[c.382]
Для описания влияния крупномасштабных колебаний зоны реакции на осредненные значения концентраций продуктов сгорания и температуру используется распределение вероятностей восстановленной концентрации горючего 2 (массовая концентрация атомов горючего во всех образовавшихся химических соединениях).
[c.382]
Сравнение расчетных значений индекса насыщения для холодной и горячей воды показывает, что для воды с температурой 60 °С индекс насыщения примерно на единицу выше, чем для воды того же состава при температуре 10 °С, и, следовательно, при нагревании количество агрессивной углекислоты уменьшается. Вместе с тем снижение содержания агрессивной углекислоты в горячей воде не обязательно уменьшает ее агрессивность, так как скорость химической реакции увеличивается при повышении температуры воды в результате подогрева воды влияние увеличения скорости реакции [c.17]
Изменение температуры газа влияет на степень неравновесности течения как через скорости химических реакций, так и через изменение уровня диссоциации газа перед соплом.
 Константы скорости реакций рекомбинации слабо зависят от температуры, поэтому основное влияние на скорость процесса оказывают активные радикалы, концентрации которых с ростом температуры увеличиваются. С другой стороны, с ростом температуры увеличивается степень диссоциации газа перед соплом, и, следовательно, может возрасти доля энергии, теряемой из-за неравновесности процесса. Поэтому изменение температуры может приводить как к увеличению, так и к уменьшению степени отклонения системы от равновесия, в зависимости от того, какой фактор окажется преобладающим.
[c.196]
Константы скорости реакций рекомбинации слабо зависят от температуры, поэтому основное влияние на скорость процесса оказывают активные радикалы, концентрации которых с ростом температуры увеличиваются. С другой стороны, с ростом температуры увеличивается степень диссоциации газа перед соплом, и, следовательно, может возрасти доля энергии, теряемой из-за неравновесности процесса. Поэтому изменение температуры может приводить как к увеличению, так и к уменьшению степени отклонения системы от равновесия, в зависимости от того, какой фактор окажется преобладающим.
[c.196]Щелочные растворы обычно подогревают до 70— 90 °С. Увеличение их температуры положительно влияет на процесс очистки, и только в некоторых случаях повышенная температура раствора нецелесообразна или даже вредна ). Между скоростью очистки и скоростью химической реакции установлена некоторая аналогия в том отношении, что повышение температуры на 11° С вызывает увеличение этих скоростей в два раза. Эта аналогия может быть справедливой только для отдельных случаев, так как в действительности влияние температуры меняется в зависимости от типа загрязнений и характеристики раствора. Обычно с повышением температуры скорость очистки возрастает, но повышение температуры на 11° С может удвоить и даже утроить скорость или же не отразиться на ней совсем в зависимости от уровня температуры раствора и других факторов.
[c.58]
Обычно с повышением температуры скорость очистки возрастает, но повышение температуры на 11° С может удвоить и даже утроить скорость или же не отразиться на ней совсем в зависимости от уровня температуры раствора и других факторов.
[c.58]
В главе VI на основе теории пограничного слоя были получены формулы для расчета теплоотдачи при обтекании плоских поверхностей теплоносителем с небольшой скоростью движения. Если влияние изменения физических параметров в пограничном слое, обусловленное торможением высокоскоростного потока, на интенсивность теплоотдачи учесть выбором определяющей температуры, а влияние химических реакций — множителем Le [c.384]
Исследования показывают, что в значительной области у обтекаемой поверхности при наличии химических реакций величины скорости, концентрации, температуры и энтальпии уменьшаются с увеличением интенсивности вдува (рУ)вд. Влияние вдува на коэффициент восстановления г = (Г,. — Гг )/(То —
[c.469]
Влияние вдува на коэффициент восстановления г = (Г,. — Гг )/(То —
[c.469]
Замена в законе Ньютона—Рихмана температур энтальпиями позволяет учесть основное влияние химических реакций на процесс теплоотдачи. При использовании уравнения (15-10) значения коэффициентов теплоотдачи в первом приближении можно брать из формул для течений без химических реакций. Конечно, при наличии химических превращений могут измениться и значения коэффициентов теплоотдачи, так как соответственно изменяются поля температур, скорости и концентраций, однако Влияние последних. факторов не столь значительно, как влияние тепловых эффектов реакций. Уравнение (15-10), по-видимому, дает наилучшие результаты, когда выполняются какие-либо из трех ранее отмеченных частных случаев. [c.357]
Роль условий электролиза. Возможность образования покрытий заданного состава зависит от многих условий, но определяющими являются взаимодействия между частицами, составными частями электролита, поверхностью растущего осадка и разряжающимся на катоде водородом. Для направленного получения КЭП необходимо учитывать заряды частиц и поверхности катода, их взаимную адгезию, смачиваемость частиц электролитом и возможные химические реакции между последними. Иными словами, необходимо знать, существует ли определенное сродство или отчужденность между катодной поверхностью и зарастаемой частицей. Проявление этих свойств определяется природой электролита (ионный состав, pH, наличием поверхностно-активных веществ и других добавок), условиями электролиза (плотность тока, градиент потенциала, температура, скорость движения суспензии и др.), а также природой металла и частиц. Рассмотрим влияние факторов электролиза на составы КЭП [1, с. 33—40].
[c.51]
Для направленного получения КЭП необходимо учитывать заряды частиц и поверхности катода, их взаимную адгезию, смачиваемость частиц электролитом и возможные химические реакции между последними. Иными словами, необходимо знать, существует ли определенное сродство или отчужденность между катодной поверхностью и зарастаемой частицей. Проявление этих свойств определяется природой электролита (ионный состав, pH, наличием поверхностно-активных веществ и других добавок), условиями электролиза (плотность тока, градиент потенциала, температура, скорость движения суспензии и др.), а также природой металла и частиц. Рассмотрим влияние факторов электролиза на составы КЭП [1, с. 33—40].
[c.51]
Гипотеза активированного состояния принадлежит Аррениусу, предвосхитившего универсальность активированных процессов. Еще в 1881 г. Аррениус, исследуя реакцию инверсии тростникового сахара отметил, что экспериментальные данные по влиянию температуры на скорость химической реакции нельзя объяснить, если не ввести новую гигютезу. Сущность гипотезы Аррениуса сводилась к тому, что реализующим веществом является не тростниковый сахар, так как количество сахара не меняется с температурой, а какое то другое гипотетическое вещество, которое вновь возникает из тростникового сахара, как только оно устраняется инверсией. Это вещество назвал активным трюстниковым сахаром .
[c.192]
Сущность гипотезы Аррениуса сводилась к тому, что реализующим веществом является не тростниковый сахар, так как количество сахара не меняется с температурой, а какое то другое гипотетическое вещество, которое вновь возникает из тростникового сахара, как только оно устраняется инверсией. Это вещество назвал активным трюстниковым сахаром .
[c.192]
В разделах учебников по технической термодинамике, посвященных термохимии, в основном рассматриваются следующие вопросы первый закон термодинамики в применении к химическим процессам закон Гесса и закон Кирхгофа второй закон термодинамики в примепении к химическим процессам максимальная работа в изохорио-изотермических и изобарно-изотермических процессах уравнение максимальной работы химическое равновесие, закон действия масс константа скорости химической реакции и константа равновесия зависимость между константой химического равновесия и максимальной работой влияние на химическое равновесие давления и температуры принцип Ле-Шателье тепловая теорема Нернста и ее следствия вычисление константы интегрирования в уравнении константы равновесия газовых реакций влияние температуры на скорость химической реакции и др. [c.338]
[c.338]
Для выяснения влияния температуры на скорость химической реакции используем способ, предложенный В. А. Спейшером [Л. 8], и объе- [c.41]
Скорость химической реакции зависит от многих факторов, основными из которых являются температура, концентрация компонентов, давление и катализаторы. Сильное влияние на скорость реакции оказывает температура. Однако влияние температуры оказывается неодинаковым для различных типов реакций. Скорость простой необратимой и обратимой эндотермических реакций с увеличением температуры в первом приближении экспоненциально возрастает, а обратимой экзотермической реакции сначала увеличивается, достигает максимума, а затем уменьщается. При увеличении концентрации исходных реагентов скорость химической реакции обычно возрастает. Давление также оказывает больщое влияние на скорость химических процессов. Особенно сильно это влияние проявляется в тех случаях, когда процессы протекают в газовой фазе или при взаимодействии газов с жидкими или твердыми веществами. Это объясняется тем, что повыщение давления равносильно увеличению концентрации реагирующих веществ. Механизм влияния катализаторов на скорость химической реакции связан со снижением энергии активации процесса. Скорость реакции в присутствии катализатора иногда увеличивается в миллионы раз.
[c.256]
Это объясняется тем, что повыщение давления равносильно увеличению концентрации реагирующих веществ. Механизм влияния катализаторов на скорость химической реакции связан со снижением энергии активации процесса. Скорость реакции в присутствии катализатора иногда увеличивается в миллионы раз.
[c.256]
По современным взглядам на природу химических превращений такой ход реакций горения объясняется в большинстве случаев не только сильным влиянием температуры на скорость реакции, но и цепным xapaKTeipoM этих реакций, в изучении которых наибольшие заслуги принадлежат академику Н. Н. Семенову и его школе [Л. 8]. В этих реакциях переход к конечному состоянию осуществляется через ряд простейших и потому более вероятных промежуточных реакций. Скорость реакции зависит при этом от концентрации активных центров — химически активных частиц (атомов водорода Н, атомов кислорода О, гидроксильных радикалов ОН и других нестойких промежуточных соединений), генерируемых самой реакцией. [c.10]
[c.10]
Характер влияния температуры на скорость окисления металлов определяется температурной зависи-хмостью константы скорости химической реакции (при кинетическом контроле процесса окисления металлов) или коэффициента диффузии (при диффузионном контроле процесса), которая выражается одним и тем же экспоненциальным законом. Таким образом, повышение температуры должно влиять на скорость окисления металлов по аналогичному экспоненпиальному закону. [c.46]
В смесях (507о Ш+10% Ог+40% N2 50% СО+20% О2+ +30% N2) нельзя установить влияние концентрации кислорода на скорость химических реакций ввиду крутого подъема температуры с увеличением кислорода. Такое влияние можно определить сравнением смесей, где кислород не является недостающим компонентом (20% С0+ 10% Ог+70% N2 [c.81]
Влияние температуры на интенсивность коррозии металла связано с характером температурной зависимости константы скорости химической реакции и коэффициента диффузии. Эти обе величины подчиняются экспоненциальным законам, подобным закону Аррениуса. Такая закономерность по молекулярно-кинетнче-ской теории вещества выражает зависимость относительного количества частиц от температуры, обладающих энергией выше некоторого порогового значения (энергия активации). Названная закономерность выражается зависимостью коэффициента Ах в формуле (2.21) от температуры следующим образом
[c.61]
Эти обе величины подчиняются экспоненциальным законам, подобным закону Аррениуса. Такая закономерность по молекулярно-кинетнче-ской теории вещества выражает зависимость относительного количества частиц от температуры, обладающих энергией выше некоторого порогового значения (энергия активации). Названная закономерность выражается зависимостью коэффициента Ах в формуле (2.21) от температуры следующим образом
[c.61]
В статье описаны методика процесса нанесения металлических п карбидных покрытий из парогазовой фазы и аппаратура. Исс.ледованы условия образования покрытий в заВиспмостп от скорости подачи компонентов, длительности процесса, температуры и концентрации компонентов реакции. Показано, что процесс осаждения покрытий в зависимости от условий протекает как в кинетической, так и в диффузионной области и определяется либо скоростью химической реакции на поверхности, либо скоростью диффузии углерода. Изучено влияние добавок метана в парогазовую смесь на процесс образования карбида ниобия. Найдены кинетические параметры процесса, а также энергия активации и значения предэкспонеициальиых множителей. Библ. — 9 назв., рис. — 4.
[c.337]
Найдены кинетические параметры процесса, а также энергия активации и значения предэкспонеициальиых множителей. Библ. — 9 назв., рис. — 4.
[c.337]
Рассмотрим кратко влияние температуры на толщину слоев отдельных фаз. Допустим, что интенсивность взаимодействия среды с обрабатываемым материалом существенно не меняется при измененйи температуры. Если с повышением температуры скорости химических реакций и коэффициенты диффузии во всех фазах возрастают примерно одинаково и концентрации на границах фаз не меняются, то повышение температуры не должно существенно влиять на соотношение толщин отдельных фаз. Общая толщина покрытия возрастает в основном за счет увеличения слоя твердого раствора. [c.99]
На рис. 15-6 приведены кривые для случая, когда температура поступающего реагента равна температуре рубашки реактора. Если температура поступающего реагента пиже температуры рубашки, то химическая реакция обычно не идет до тех пор, пока Г не будет равно Груб максимальные температуры в этом случае будут почти такими же, как и в рассмотренных выше случаях. Если реагент предварительно нагревается выше температуры рубашки и затем подается в реактор, то значение X должно быть ближе к единице, для того чтобы удержать то же значение У или иметь ту же чувствительность к возмущениям. Точное влияние температуры нагрева реагентов было изучено Барклеем [Л. 15], который рассчитал температурные профили для различных сочетаний температуры нагрева реагентов, порядков реакции и скорости реакции. Параметр Барклея SlN в нгших обозначениях представляет собой Х/е
[c.425]
Если реагент предварительно нагревается выше температуры рубашки и затем подается в реактор, то значение X должно быть ближе к единице, для того чтобы удержать то же значение У или иметь ту же чувствительность к возмущениям. Точное влияние температуры нагрева реагентов было изучено Барклеем [Л. 15], который рассчитал температурные профили для различных сочетаний температуры нагрева реагентов, порядков реакции и скорости реакции. Параметр Барклея SlN в нгших обозначениях представляет собой Х/е
[c.425]
Необходимо обратить внимание па следующие в , жные обстоятельства. Как уже отмечалось в гл. 1, с развитием энергетики существенно изменялись виды и особенности коррозионных повреждений, причем наибольшее влияние на эти изменения оказали рост параметров, интенсификация теплопередачи, новые методы водоподготовки, качество металла. Так, рост температуры рабочей среды привел к интенсификации коррозионных процессов, поскольку в соответствии с известным положением Вант-Гоффа при повышении температуры на каждые 10°С скорость химической реакции увеличивается примерно в 2—4 раза. Кроме того, с ростом температуры возрастает степень диссоциации воды и облегчаются коррозионные процессы в связи с образованием повышенных концентраций ионов водорода [1]. Увеличение температуры среды приводит также к снижению растворимости ряда веществ, присутствующих в котловой воде (например, карбонатов и сульфатов кальция и фосфатов натрия и др.), способных ускорять процессы коррозии. Приведем характерный пример, отражающий роль температуры среды в изменении характера внутрн-котловой коррозии водородное охрупчивание металла экранных труб, не отмечавшееся на котлах среднего давления, проявилось на котлах высокого и особенно сверхвысокого давления, поскольку для протекания процесса водородной коррозии углеродистой стали в котловой воде требуется, в частности, температурный уровень более 300 °С.
[c.31]
Кроме того, с ростом температуры возрастает степень диссоциации воды и облегчаются коррозионные процессы в связи с образованием повышенных концентраций ионов водорода [1]. Увеличение температуры среды приводит также к снижению растворимости ряда веществ, присутствующих в котловой воде (например, карбонатов и сульфатов кальция и фосфатов натрия и др.), способных ускорять процессы коррозии. Приведем характерный пример, отражающий роль температуры среды в изменении характера внутрн-котловой коррозии водородное охрупчивание металла экранных труб, не отмечавшееся на котлах среднего давления, проявилось на котлах высокого и особенно сверхвысокого давления, поскольку для протекания процесса водородной коррозии углеродистой стали в котловой воде требуется, в частности, температурный уровень более 300 °С.
[c.31]
Скорость химических реакций, как указывалось выше, зависит в первую очередь, сог. асно закону действия масс, от концентрации реагирующих веществ, так как чем больше количество молекул этих вешеств в данном объеме, тем больше вероятность их встречи (столкновения) и взаимодействия друг с другом.
 Кроме того, на скорость реакции оказывает влияние также и температура реагирующих веществ, так как с ее повышением возрастает скорость движения молекул, что в свою очередь увеличивает вероятность столкновения между ними. Согласно опытным данным известно, что скорость большинства химических реакций, при повышении температуры на каждые 10° увеличивается примерно в два раза. Увеличение скорости реакции, очевидно, способствует также тщательное перемешивание реагирующих веществ.
[c.130]
Кроме того, на скорость реакции оказывает влияние также и температура реагирующих веществ, так как с ее повышением возрастает скорость движения молекул, что в свою очередь увеличивает вероятность столкновения между ними. Согласно опытным данным известно, что скорость большинства химических реакций, при повышении температуры на каждые 10° увеличивается примерно в два раза. Увеличение скорости реакции, очевидно, способствует также тщательное перемешивание реагирующих веществ.
[c.130]Горение представляет собой совокупность сложных процессов, состоящих из химических реакций соединения элементов топлива с окислителем, сопровождающихся значительным выделением тепла и резким 1ЮБышением температуры, и ряда физических процессов, одновременно протекающих с химическими реакциями и оказывающих на них большое влияние. Такими физическими процессами являются процессы тепло-и массообмена, в свою очередь зависящие от характера течения газовоздушного потока. Важнейшими задачами теории горения является изучение основных химических закономерностей, которым подчиняется протекание реакций горения, и влияния, оказываемого на скорость и полноту протекания этих реакций вышеуказанными физическими процессами. [c.74]
[c.74]
Температура воды влияет на скорость коррозии несколькими путями. Во-первых, скорость коррозии, как и всех химических реакций, увеличивается при повышении температуры. Во-вторых, более важно влияние температуры на природу и растворимость продуктов коррозии. Например, возрастание температуры часто приводит к разрушению карбонатной окалииы, а кроме того, ускоряет диффузию кислорода через воду, правда, понижая при этом растворимость его в воде. Некоторые из перечисленных эффектов антагонистичны, вследствие чего при определенных лабораторных условиях кривая температурной зависимости скорости коррозии стали в воде проходит через максимум до температуры кипения. Например, в экспериментах Фриенда [30] максимум достигался при 80° С. [c.14]
Физико-химический процесс проявления можно в основном разбить па две стадии диффузия веществ к месту реакции и сама химическая реакция (кинетическая стадия). Когда константа скорости химической реакции много меньше константы скорости диффузии к , т. е. скоростью химическо реакции. Если к к , то процесс протекает в диффузионной области и определяется только скоростью диффузии. При к .1=ик мы имеем дело с промежуточным случаем, когда процесс проявления зависит как от скорости химической реакции, так и от скорости диффузии [90]. Поэтому скорость процесса проявления фотослоя и отдельного зерна зависит как от факторов кинетической стадии [концентрация проявляющего вещества, сульфита натрия и бромистого калия, степень диссоциации (pH раствора), природа проявляющего и проявляемого вещества, температура проявления и т. д.], так и от параметров, определяющих массоперенос вещества из раствора к центрам скрытого изображения (коэффициент диффузии, вязкость раствора, его перемешивание, природа фотослоя — задубленность, набухаемость и др.). Зависимость процесса от перечисленных факторов можно истолковывать влиянием на химические и на диффузионные процессы, причем если влияние значительно, то существует прямая связь варьируемого параметра с регулирующим процессом, а если влияние невелико, то мы имеем дело с процессом, идущим по смешанной диффузионно-химической кинетике [90].
е. скоростью химическо реакции. Если к к , то процесс протекает в диффузионной области и определяется только скоростью диффузии. При к .1=ик мы имеем дело с промежуточным случаем, когда процесс проявления зависит как от скорости химической реакции, так и от скорости диффузии [90]. Поэтому скорость процесса проявления фотослоя и отдельного зерна зависит как от факторов кинетической стадии [концентрация проявляющего вещества, сульфита натрия и бромистого калия, степень диссоциации (pH раствора), природа проявляющего и проявляемого вещества, температура проявления и т. д.], так и от параметров, определяющих массоперенос вещества из раствора к центрам скрытого изображения (коэффициент диффузии, вязкость раствора, его перемешивание, природа фотослоя — задубленность, набухаемость и др.). Зависимость процесса от перечисленных факторов можно истолковывать влиянием на химические и на диффузионные процессы, причем если влияние значительно, то существует прямая связь варьируемого параметра с регулирующим процессом, а если влияние невелико, то мы имеем дело с процессом, идущим по смешанной диффузионно-химической кинетике [90]. [c.544]
[c.544]
Обратное влияние неравновесной колебательной релаксации на протекание химических реакций учитывается домножением констант диссоциации молекул О2 и N1 на некоторые функции Р(Т2, Т), Р(Т , Т), приведенные в [12-15]. Ввиду малости концентраций заряженных компонентов дальних следов за телами, входящими в плотные слои атмосферы со скоростями К , 8 км/с, пренебрегается неравновесностью возбуждения колебательных степеней свободы ионов. Считается, что возможно отсутствие термического равновесия между электронами и тяжелыми частицами, т.е. возможен отрыв температуры Т , от Т. При этом константы скоростей приведенных выше химических реакций с участием электронов предполагаются зависящими от температуры электронов [10, И]. Предполагается также, что след является квази-нейтральным, электрический ток отсутствует (диффузия заряженных компонентов имеет амбиполярный характер). [c.155]
Известно, что достаточно быстрая химическая реакция, протекающая на поверхности пленки жидкости, обтекаемой потоком газа, часто вызывает увеличение температуры поверхности и, следовательно, увеличение потока теплоты через поверхность раздела газ—жидкость. Рассмотрим задачу о влиянии химической реакции первого порядка на процесс тепломассопереноса в турбулентной пленке жидкости. Для описания процесса массопере-носа в такой пленке воспользуемся результатами решения аналогичной задачи, полученными в разд. 7.3 без учета теплопереноса. Сформулируем основные предположения. Будем считать, что скорость стекания пленки жидкости и является постоянной вели-
[c.328]
Рассмотрим задачу о влиянии химической реакции первого порядка на процесс тепломассопереноса в турбулентной пленке жидкости. Для описания процесса массопере-носа в такой пленке воспользуемся результатами решения аналогичной задачи, полученными в разд. 7.3 без учета теплопереноса. Сформулируем основные предположения. Будем считать, что скорость стекания пленки жидкости и является постоянной вели-
[c.328]
Во всех теплотехнических установках стремятся к проведению процессов горения с наибольшей скоростью, потому что это позволяет создать малогабарит ные машины и аппараты и получить в них наибольшую производительность. Процессы горения в существующих установках протекают с большой скоростью с выделением при сгорании топлива большого количества тепла и с развитием высоких температур. Для лучшего понимания влияния разкых факторов на скорость горения ниже рассмотрены элементы кинетики химических реакций. [c.224]
Почему важно исследовать влияние температуры на скорость химических реакций?.

Температура оказывает заметное влияние на сложные биологические и химические процессы, протекающие в растениях и организмах животных. В качестве примера укажем на влияние температуры на скорость дыхания, которое имеет важное значение в медицине. Во время некоторых хирургических операций тело пациента подвергают охлаждению, чтобы замедлить протекание метаболических процессов, понизить скорость циркуляции крови и частоту дыхания.
Температура оказывает также заметное влияние на биохимические процессы, протекающие в пище при ее хранении или в ходе ее приготовления. Скорость порчи пищевых продуктов может быть понижена разными способами, включая замораживание (рис. 9.10), использование консервантов, как, например, сорбиновой кислоты, диоксида серы или нитритов, а также соблюдением надлежащих условий хранения. Так, свежесть и аромат чая зависят от содержания в нем ряда химических веществ, принадлежащих к группе флавинов. При хранении чая содержание в нем флавинов постепенно уменьшается. Скорость разрушения флавинов в чае приблизительно в равной мере зависит от влажности и температуры.
При хранении чая содержание в нем флавинов постепенно уменьшается. Скорость разрушения флавинов в чае приблизительно в равной мере зависит от влажности и температуры.
Оптимальная эффективность многих технологических химических процессов тоже зависит от температуры. В качестве примера укажем на вторую стадию контактного процесса получения серной кислоты (см. разд. 7.2)
2SO2 (г.) + O2 (г.) =. 2SO3 (г.),
Поскольку эта реакция экзотермична, выход триоксида серы можно повысить, понижая температуру. Однако понижение температуры приводит к замедлению процесса. Поэтому необходимо найти оптимальный баланс между выходом и скоростью реакции. Это достигается путем проведения данной стадии процесса при температуре от 450 до 500 0C и использовании катализатора — оксида ванадия (V).
При проведении некоторых операций на сердце и нейрохирургических операций пациентов подвергают охлаждению, чтобы снизить скорость протекания в организме метаболических процессов. Скорость разложения пищевых продуктов замедляется при их охлаждении и замораживании.
Температура влияет не только на скорость химических реакций; она может влиять и на путь протекания реакции. Например, при нагревании нитрата аммония не выше 200 0C происходит следующая реакция, которая протекает с умеренной скоростью
Nh5NO3(TB.) =N2O (г.) + 2h3O (г.)
Эта реакция часто используется для получения N2O в лабораторных условиях. Однако, если нагревать нитрат аммония до высоких температур в замкнутом объеме, происходит следующая взрывная реакция
2Nh5NO3 (тв.)= 2N2 (г.) + 4h3O (г.) + O2 (г.)
Таким образом, термическое разложение нитрата аммония может протекать, в зависимости от температуры, двумя совершенно различными путями. В следующем разделе будет показано, как экспериментальное определение скоростей реакцт позволяет предсказать путь протекания химической реакции.
Оглавление:
Effect of Temperature on Reaction Rate, Arrhenius Equation and Collision Theory | Chemistry
13.
 7: Зависимость температуры от скорости реакции
7: Зависимость температуры от скорости реакцииТеория столкновения
Атомы, молекулы или ионы должны столкнуться, прежде чем они смогут взаимодействовать друг с другом. Атомы должны быть близки друг к другу, чтобы образовывать химические связи. Эта предпосылка является основой теории, которая объясняет множество наблюдений относительно химической кинетики, включая факторы, влияющие на скорость реакции.
Теория столкновений основана на постулатах, что (i) скорость реакции пропорциональна скорости столкновений реагент, (II) столкновение участники реакции в ориентации, позволяющей контактировать между атомами, которые соединяются в продукте, и (iii) столкновение происходит с достаточной энергией, чтобы разрешить взаимное проникновение участники реакции’ валентные оболочки, чтобы электроны могли перегруппировать и сформировать новые связи (и новые химические виды).
Например, при газовой фазовой реакции между угарным газом и кислородом, возникающей при высокой температуре и давлении, первым шагом является столкновение между двумя молекулами.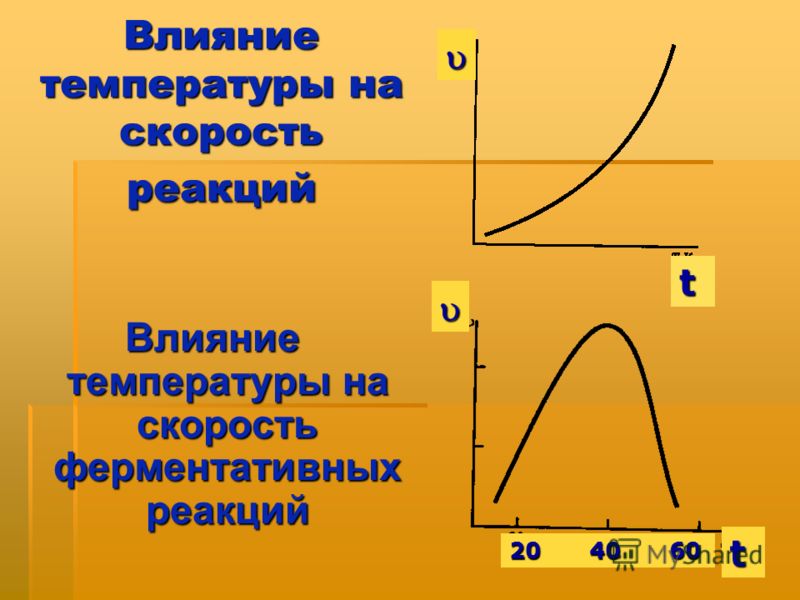
Однако может быть много различных относительных ориентаций, в которых сталкиваются две молекулы. Следовательно, ориентация сталкивающихся молекул имеет большое значение при частичном определении осуществимости реакции, происходящей между ними.
В одном случае кислородная сторона молекулы окиси углерода может столкнуться с молекулой кислорода. В другом случае углеродистая сторона молекулы окиси углерода может столкнуться с молекулой кислорода. Второй случай, скорее всего, приведет к образованию диоксида углерода, с центральным атомом углерода, связанным с двумя атомами кислорода (O = C = O).
Тем не менее, даже если столкновение действительно происходит в правильной ориентации, гарантия того, что реакция будет продолжать образовывать углекислый газ, ограничена. Это связано с тем, что в дополнение к правильной ориентации столкновение также должно происходить с достаточной энергией, называемой энергией активации, чтобы привести к образованию продукта. Когда виды реагент сталкиваются как с правильной ориентацией, так и с достаточной энергией активации, они объединяются, чтобы сформировать нестабильный вид, называемый активированным комплексом или переходным состоянием. Эти виды недолговечны и обычно не поддаются обнаружению большинством аналитических инструментов. В некоторых случаях сложные спектральные измерения могут наблюдать за переходными состояниями.
Когда виды реагент сталкиваются как с правильной ориентацией, так и с достаточной энергией активации, они объединяются, чтобы сформировать нестабильный вид, называемый активированным комплексом или переходным состоянием. Эти виды недолговечны и обычно не поддаются обнаружению большинством аналитических инструментов. В некоторых случаях сложные спектральные измерения могут наблюдать за переходными состояниями.
Теория столкновений объясняет, почему большая часть скоростей реакции увеличивается по мере повышения температуры; при повышении температуры частота столкновений увеличивается. Чем больше столкновений, тем быстрее скорость реакции, если энергия столкновений достаточна.
Энергия активации
Минимальная энергия, необходимая для формирования продукта во время столкновения между реагенты, называется энергией активации (EA). Разница в требуемой энергии активации и кинетической энергии, обеспечиваемой столкновением молекул реагент, является основным фактором, влияющим на скорость химической реакции. Если энергия активации намного больше, чем средняя кинетическая энергия молекул, реакция будет происходить медленно, так как только несколько быстро движущихся молекул будут иметь достаточно энергии для реакции. Если энергия активации значительно меньше, чем средняя кинетическая энергия молекул, большая часть молекул будет достаточно энергичной, и реакция будет быстро продолжаться.
Если энергия активации намного больше, чем средняя кинетическая энергия молекул, реакция будет происходить медленно, так как только несколько быстро движущихся молекул будут иметь достаточно энергии для реакции. Если энергия активации значительно меньше, чем средняя кинетическая энергия молекул, большая часть молекул будет достаточно энергичной, и реакция будет быстро продолжаться.
Диаграммы реакции широко используются в химической кинетике для иллюстрации различных свойств интересующей реакции. Она показывает, как меняется энергия химической системы при ее реакции, превращая реагенты в продукты.
Например, рассмотрим следующую схему реакции для экзотермической реакции: A + B → C + D;
Схема показана слева направо. Изначально система состоит только из реагенты (A + B). После столкновения молекул реагент с достаточной энергией они образуют высокоэнергетический активированный комплекс или переходное состояние. Затем нестабильное переходное состояние распашется для получения стабильных продуктов (C + D).
На диаграмме показана энергия активации реакции, EA, как разность между энергией реагенты и состоянием перехода. Разность между энергией реагенты и продуктами соответствует изменению энтальпии реакции (ΔH). В этом случае реакция является экзотермической (ΔH
Уравнение Аррениуса
Уравнение Аррениуса, k = AE—EA/RT соотносит энергию активации и константу скорости, k, для многих химических реакций.
В этом уравнении R — идеальная газовая константа, которая имеет значение 8.314 Дж/моль·к, T — температура в кельвине, EA — энергия активации в джоулях на моль, e — константа 2.7183, а A — константа, называемая частотным коэффициентом, которая связана с частотой столкновений и ориентацией реагирующих молекул. Уравнение Аррениуса прекрасно подходит для постулатов теории столкновений. Коэффициент частоты A отражает, насколько хорошо условия реакции благоприятствуют правильно ориентированным столкновениям между молекулами реагент. Повышенная вероятность столкновения с эффективной ориентацией приводит к увеличению значений для более высокой скорости реакции.
Повышенная вероятность столкновения с эффективной ориентацией приводит к увеличению значений для более высокой скорости реакции.
Экспоненциальный термин e-EA/RT описывает влияние энергии активации на скорость реакции. Согласно молекулярно-кинетической теории, температура вещества является мерой средней кинетической энергии составляющих его атомов или молекул — более низкая энергия активации приводит к более значительной доле адекватно заряженных молекул и более быстрой реакции.
Экспоненциальный термин также описывает влияние температуры на скорость реакции. Более высокая температура представляет собой соответственно большую долю молекул, обладающих достаточной энергией (RT) для преодоления активационного барьера (EA). Это дает более высокое значение для постоянной скорости и соответственно более высокую скорость реакции.
Распределение молекулярной энергии, показывающее количество молекул с энергиями, превышающими две разные энергии активации при заданной температуре, и заданной энергии активации при двух разных температурах.
Этот текст адаптирован из Openstax, Химия 2е изд., раздел 12.5: Теория столкновений.
Как влияет температура на скорость химических реакций? Приведите график. Правило Вант Гоффа, его математическая запись
Напишите мне в whatsapp, пришлите ссылку на эту страницу в чат, оплатите и получите файл! |
Закажите у меня новую работу, просто написав мне в whatsapp! |
Описание заказа и 38% решения ( + фото):
Как влияет температура на скорость химических реакций? Приведите график. Правило Вант Гоффа, его математическая запись
Решение:
При повышении температуры скорость большинства реакций увеличивается. Зависимость скорости реакции от температуры можно изобразить на графике (рисунок 3): Рисунок 3. Зависимость скорости химической реакции от температуры Зависимость скорости реакции от температуры можно выразить с помощью приближенного правила Вант-Гоффа, которое гласит: При повышении температуры на каждые скорость большинства реакций увеличивается в 2 – 4 раза, то есть: где скорость реакции при температуре скорость реакции при температуре то есть на больше; температурный коэффициент скорости реакции (он показывает во сколько раз возрастает скорость реакции (или константа скорости) при повышении температуры на Если температура повысилась не на а изменилась с до то правило Вант-Гоффа записывается так: Отсюда: Правило Вант-Гоффа – приближенное правило. Точную зависимость константы скорости реакции от температуры выражает уравнение Аррениуса: постоянная величина для данной реакции; основание натурального логарифма; газовая постоянная; энергия активации реакции.
Точную зависимость константы скорости реакции от температуры выражает уравнение Аррениуса: постоянная величина для данной реакции; основание натурального логарифма; газовая постоянная; энергия активации реакции.
Похожие готовые решения по химии:
- Для указанной в варианте реакции: А. Записать выражение константы равновесия указать, как смещается равновесие реакции
- Определите среднюю теплоту испарения и температуру кипения воды при давлении 6000 Па, если известно, что при температуре давление
- Хватит ли 100 г поваренной соли, чтобы при добавлении к 4 кг воды кристаллизация (замерзание) воды началась при температуре
- Как влияют на адсорбцию природа растворителя, природа и пористость адсорбента? Почему гидрофобные вещества (уголь, графит) лучше адсорбируют
- Как определить изменение энтропии в процессе фазового превращения (испарение, плавление, возгонка)? Напишите также математическое
- На основе правила фаз Гиббса определите количество степеней свободы у воды при температуре а) кристаллизации; б) сублимации.

- Начертите графики, которыми необходимо воспользоваться; для графического расчета истинной и средней теплоты испарения воды, напишите
- Почему давление насыщенного пара растворителя над раствором всегда меньше, чем над чистым растворителем? Объясните причину положительных
© Преподаватель Анна Евкова
При копировании любых материалов с сайта evkova.org обязательна активная ссылка на сайт www.evkova.org
Сайт создан коллективом преподавателей на некоммерческой основе для дополнительного образования молодежи
Сайт пишется, поддерживается и управляется коллективом преподавателей
Правовые документы
Whatsapp и логотип whatsapp являются товарными знаками корпорации WhatsApp LLC.
Cайт носит информационный характер и ни при каких условиях не является публичной офертой, которая определяется положениями статьи 437 Гражданского кодекса РФ. Анна Евкова не оказывает никаких услуг.
Помощь студентам в учёбе от Людмилы Фирмаль
Здравствуйте!
Я, Людмила Анатольевна Фирмаль, бывший преподаватель математического факультета Дальневосточного государственного физико-технического института со стажем работы более 17 лет. На данный момент занимаюсь онлайн обучением и помощью по любыми предметам. У меня своя команда грамотных, сильных бывших преподавателей ВУЗов. Мы справимся с любой поставленной перед нами работой технического и гуманитарного плана. И не важно: она по объёму на две формулы или огромная сложно структурированная на 125 страниц! Нам по силам всё, поэтому не стесняйтесь, присылайте.
На данный момент занимаюсь онлайн обучением и помощью по любыми предметам. У меня своя команда грамотных, сильных бывших преподавателей ВУЗов. Мы справимся с любой поставленной перед нами работой технического и гуманитарного плана. И не важно: она по объёму на две формулы или огромная сложно структурированная на 125 страниц! Нам по силам всё, поэтому не стесняйтесь, присылайте.
Срок выполнения разный: возможно онлайн (сразу пишите и сразу помогаю), а если у Вас что-то сложное – то от двух до пяти дней.
Для качественного оформления работы обязательно нужны методические указания и, желательно, лекции. Также я провожу онлайн-занятия и занятия в аудитории для студентов, чтобы дать им более качественные знания.
Моё видео:
Как вы работаете?
Вам нужно написать сообщение в WhatsApp . После этого я оценю Ваш заказ и укажу срок выполнения. Если условия Вас устроят, Вы оплатите, и преподаватель, который ответственен за заказ, начнёт выполнение и в согласованный срок или, возможно, раньше срока Вы получите файл заказа в личные сообщения.
После этого я оценю Ваш заказ и укажу срок выполнения. Если условия Вас устроят, Вы оплатите, и преподаватель, который ответственен за заказ, начнёт выполнение и в согласованный срок или, возможно, раньше срока Вы получите файл заказа в личные сообщения.
Стоимость заказа зависит от задания и требований Вашего учебного заведения. На цену влияют: сложность, количество заданий и срок выполнения. Поэтому для оценки стоимости заказа максимально качественно сфотографируйте или пришлите файл задания, при необходимости загружайте поясняющие фотографии лекций, файлы методичек, указывайте свой вариант.
Какой срок выполнения заказа?Минимальный срок выполнения заказа составляет 2-4 дня, но помните, срочные задания оцениваются дороже.
Как оплатить заказ?Сначала пришлите задание, я оценю, после вышлю Вам форму оплаты, в которой можно оплатить с баланса мобильного телефона, картой Visa и MasterCard, apple pay, google pay.
В течение 1 года с момента получения Вами заказа действует гарантия. В течении 1 года я и моя команда исправим любые ошибки в заказе.
Качественно сфотографируйте задание, или если у вас файлы, то прикрепите методички, лекции, примеры решения, и в сообщении напишите дополнительные пояснения, для того, чтобы я сразу поняла, что требуется и не уточняла у вас. Присланное качественное задание моментально изучается и оценивается.
Теперь напишите мне в Whatsapp или почту и прикрепите задания, методички и лекции с примерами решения, и укажите сроки выполнения. Я и моя команда изучим внимательно задание и сообщим цену.
Если цена Вас устроит, то я вышлю Вам форму оплаты, в которой можно оплатить с баланса мобильного телефона, картой Visa и MasterCard, apple pay, google pay.
Мы приступим к выполнению, соблюдая указанные сроки и требования. 80% заказов сдаются раньше срока.
80% заказов сдаются раньше срока.
После выполнения отправлю Вам заказ в чат, если у Вас будут вопросы по заказу – подробно объясню. Гарантия 1 год. В течении 1 года я и моя команда исправим любые ошибки в заказе.
youtube.com/embed/g4ioDc7sLwU» frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>
youtube.com/embed/zW5JhiZ4140″ frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>
Можете смело обращаться к нам, мы вас не подведем. Ошибки бывают у всех, мы готовы дорабатывать бесплатно и в сжатые сроки, а если у вас появятся вопросы, готовы на них ответить.
Ошибки бывают у всех, мы готовы дорабатывать бесплатно и в сжатые сроки, а если у вас появятся вопросы, готовы на них ответить.
В заключение хочу сказать: если Вы выберете меня для помощи на учебно-образовательном пути, у вас останутся только приятные впечатления от работы и от полученного результата!
Жду ваших заказов!
С уважением
Пользовательское соглашение
Политика конфиденциальности
Теоретическая кинетика. Влияние температуры на скорость реакции. Правило Вант-Гоффа
Теоретическая кинетика.Влияние температуры на скорость реакции.
Правило Вант-Гоффа.
Для большинства химических реакций скорость реакции
увеличивается с ростом температуры. Экспериментально
установлено, что при увеличении температуры на десять
градусов скорость гомогенной реакции возрастает в 2 4 раза.
Эта закономерность называется правилом Вант-Гоффа.
Число, показывающее, во сколько раз возрастает константа
скорости при повышении температуры на десять градусов,
называется температурным коэффициентом константы
скорости, обозначается .

kT 10
2 4
kT
kT2
kT1
Якоб Хендрик
Вант-Гофф
(1852 –1911)
Т
10
Правило Вант-Гоффа — приближенное, так как температурный
коэффициент сохраняет постоянное значение только в узкой
температурной области.
2. Энергия активации. Теория Аррениуса.
Более точную зависимость скорости химическойреакции от температуры экспериментально установил
Аррениус, предложивший уравнение:
dlnK
E
dT
RT 2
где Е — энергия активации; К — константа скорости.
кДж
Еакт
моль
Еакт — некоторое избыточное количество энергии
(по сравнению со средней), необходимое для
вступления молекул в реакцию.
Сванте-Август
Аррениус
19.02.1859
Еакт =80 – 240 кДж/моль — для
Еакт
элементарных химических реакций
участием атомов и радикалов
Еакт зависит от природы реагирующих веществ и служит
характеристикой каждой реакции
Понятие «энергия активации» было введено Аррениусом в
теории активных столкновений (ТАС), сущность которой состоит в
следующем: химическое взаимодействие осуществляется только при
взаимодействии активных частиц, которые обладают достаточной
энергией для преодоления потенциального барьера реакции и
ориентированы в пространстве относительно друг друга.
 В ТАС
В ТАСсчитается, что акт превращения начальных веществ в конечные
продукты совершается в момент столкновения активных молекул и
протекает мгновенно. Источники активации молекул могут быть
различными:
температура,
наличие
катализатора,
действие
электрических разрядов, удары электронов, -частиц, нейтронов и т.д.
Введение стерического множителя в ТАС не позволяет
полностью раскрыть его физический смысл, не дает путей расчета,
ограничиваясь лишь приближенным значением величины .
Поэтому на основе теории ТАС была выдвинута теория
активированного комплекса (ТАК). Основное положение ТАК
химических реакций заключается в том, что всякий элементарный
химический
акт
протекает
через
переходное
состояние
(активированный комплекс), когда в реагирующей системе исчезают
отдельные связи в исходных молекулах и возникают новые связи,
характерные для продуктов реакции. То есть начальная конфигурация
атомов в исходных молекулах переходит в конечную у продуктов
реакции при непрерывном изменении межатомных расстояний:
A
A B
B
A
B
| |
C D
C D
C
D
Исходные вещества Активированный комплекс
Продукты реакции
Рассматривая путь реакции через активированный комплекс, ТАК дает
уравнение:
G *
k T RT
K
e
h
или, зная, что
G H T S
*
*
*
k T
K
e
h
S *
R
e
H *
RT
где — трансмиссионный множитель, учитывающий долю активных
молекул, превращающихся в конечный продукт реакции, для
большинства реакций он равен единице, и в приближенных расчетах его
можно не учитывать;
k — постоянная Больцмана, 1,38 10-23;
h — постоянная Планка, 6,626 10-34;
G* — изменение изобарно-изотермического потенциала активации;
S* — изменение энтропии в процессе образования активированного
комплекса;
Н* — изменение энтальпии активации.

Энергия активации с изменением энтальпии реакции связана
уравнением:
E H * RT ,
где — число реагирующих молекул.
Полагая, что
E H * получаем
k T
P Z0
h
S *
e R
,
отсюда стерический фактор называют энтропийным множителем или
вероятностным фактором, так как он определяет энтропию при
образовании активированного комплекса.
Стерический фактор Р
определяет эффективность химического взаимодействия частиц
A Pz
к Ae
Уравнение Аррениуса
Eакт
RT
z — число эффективных столкновений
между частицами
Р — фактор вероятности (стерический
множитель) Р 1
ln k
E
tg
R
Логарифмическая форма уравнения Аррениуса
E
ln k ln A
RT
ln A
d ln K
E
KT 2 E 1 1
RT1T2 KT 2
ln
E
ln
dT
RT 2
KT 1 R T1 T2
T2 T1 KT 1
1/T
Распределение частиц по энергиям.
N*
e
N
E а кт
RT
Уравнение Больцмана
N* — число активных частиц
N — общее число частиц
N*
z
10 10 10 20
N
если
Людвиг Больцман
1844 –1906
N*
10 10 то реакция идет мгновенно
N
Связь Еакт с тепловым эффектом реакции.

Е
Е
К
К
Е1
Е1
Е2
Н
Н
Ход реакции
Н 0
Е1
реакция экзотермическая
Е2
Ход реакции
Н 0
Е1
реакция эндотермическая
Точка К — активированный комплекс
положительный
отрицательный
(ингибирование)
1.Гомогенный
2.гетерогенный
3.Кислотнощелочной
С
В пищевых технологиях широко применяются 1, 3 и 4
катализаторы. Это перспективное направление, при котором
из непищевого сырья получают пищевое. Катализаторы:
С0
h3SO4, Ch4COOH,HCl, фосфаты, сульфаты, аллюмосиликаты
3
Ср
4.Ферментативный
2 1
t2
t1
t3
t
1 – реакция протекает без
катализатора
2 – положительный катализ
3 – ингибирование реакции
В основе лежит гидролиз в водной среде в присутствии Н и ОН- субстрата
(шкуры, ботва свеклы, подсолнечник, лапы, клювы)
S+H A SH + A , SH +h3O П + h4O
, где S- сульфат, а П — продукт
Автокатализ – ускорение реакции за счет конечных или промежуточных
продуктов
Требования к
катализатору:
-должен обладать каталитической активностью,
которая зависит от рН и температуры.

-должен быть 1. специфичным
2.селективным
3. механически прочным
4.термостойким
5.способным к регенерации.
Промоторы(от лат promoveo – продвигаю) – вещества, добавление которых к
катализаторам повышает их активность и избирательность, а иногда и
устойчивость. Пример:реакция 3Н2+N2=2Nh4, катализатор:Fe, промоторы:Al2O3,
K2O
каталитические яды: Pb, Hg, h3S, CO, h3O
Ферментативный катализ.
Ферменты – биологические катализаторы – превосходят по активности
химические катализаторы. Это продукты жизнедеятельности живых
организмов. Известно 2 тысячи ферментов. Они бывают двух типов :
протее (белки) и сложные(белок+небелковые вещества)
1 моль фермента сахарозы за 1 с способен расщепить 1 000 молей
свекольного сахара
1 г кристаллов пепсина расщепляет 50 кг яичного белка, он разлагает
белки, но не влияет на скорость окислительных процессов. Фермент
катализа разлагает перокстид водорода, но не действует на белки
1 г кристаллов ренина свертывает 72 т молока
Название субстрата(вещества, подвергающиеся превращению под
действием фермента) + «аза»
Ферменты протеазы расщепляют протеины (белки)
Ферменты липазы расщепляют липиды (жиры)
Количественно кинетика ферментативных реакций описывается уравнением
Михаэлиса.

Каталитическая активность ферментов
Молекулярная активность фермента – число молекул данного
субстрата, превращаемых за 1 минуту одной молекулой фермента при
оптимальной концентрации субстрата
Ферменты обладают специфичностью (избирательностью)
абсолютная специфичность
стереохимическая
специфичность
Ферменты в ходе реакции инактивируются- утрачивают свою
активность и разрушаются.
Состав ферментов
Ферменты в своем составе имеют белковую и небелковую часть
Однокомпонентные ферменты
Двухкомпонентные ферменты
Особенности работы ферментов:
1) Узкий температурный интервал
(313-333 К для растительных ферментов и
313-323 для животных)
2) Определенный диапазон рН
Направления ферментативного катализа:
1. Для хранения и переработки сырья
( овощей, фруктов, мяса, зерна. О2 + жиры
прогоркание)
2. Для улучшения вкуса (появление специфических органолептических показателей)
3. Для произведения технологических процессов в хлебопечении, сыроделании,
виноделии, пивоварении, пастеризации молока.

14. Механизмы химических реакций в биосистемах
Химические реакции в биосистемах – сложные реакции,состоящие
из
нескольких
элементарных
стадий,
с
лимитирующими стадиями, которые определяют скорость всего
сложного процесса.
1) Обратимые
2) Параллельные
К1
А → В
К2 ↓
С
К1
А
↔
В
К2
3) Последовательные
А→В→С
К1≈К2
4) Сопряженные
A+B→M, ∆G
(1)
A+C→N, ∆G>0
(2)
} A+B+C→M+N
(гидролиз эфиров и полисахаридов, В — индуктор реакции (2)
крекинг углеводородов)
Реакция (2) термодинамически
невыгодна, она может протекать
только в присутствии [B], который
участвует в реакции (1),
термодинамически выгодной.
Пример сопряженной реакции:
Реакция метаболического окисления глюкозы:
С6Н12О6+О2→СО2+Н2О ∆G = – 2886 кДж/моль
С этой реакцией сопряжена реакция синтеза АТФ:
АДФ + Ф → АТФ ∆G= 36 кДж/моль
Реакция лежит в основе окисления продуктов питания в процессе переваривания пищи.

5) Цепные – характеризуются
возникновением активной частицы, в
каждом элементарном акте возникает
цепь последовательных повторяющихся
реакций (Н.Н.Семенов):
а) зарождение цепи;
б) рост цепи;
в) обрыв цепи.
7) Радиационно-химические
В пищевой промышленности
используются для пастеризации и
обеззараживания продуктов.
6) Фотохимические (hν),
(плазмохимические) – загар кожи,
фотосинтез → 2 закона фотохимии
(люминисценция, фосфоросценция
+ сенсебилизаторы).
8) Цепные радикальные реакции –
окислительная порча жиров,
появление токсинов, изменение
окраски вина.
Скорость реакции
Скорость реакцииСкорость реакции
Скорость реакции
Химические реакции требуют различной продолжительности для завершения, в зависимости от характеристик реагентов и продуктов и условий, в которых протекает реакция. Химическая кинетика изучает скорость реакции, то, как скорость реакции изменяется в различных условиях и по какому механизму протекает реакция.
Какие факторы влияют на скорость реакции?
- Концентрация реагентов.Чем больше концентрация, тем выше скорость (обратите внимание, что в некоторых случаях скорость может не зависеть от концентрации конкретного реагента при условии, что он присутствует в минимальной концентрации). Помните, что для газов повышение давления просто увеличивает концентрацию, так что это то же самое.
- Температура. Обычно реакции ускоряются с повышением температуры («рост на 100°С удваивает скорость»).
- Физическое состояние реагентов. Порошки реагируют быстрее, чем блоки — площадь поверхности больше, и поскольку реакция происходит на поверхности, мы получаем более высокую скорость.
- Наличие (и концентрация/физическая форма) катализатора (или ингибитора). Катализатор ускоряет реакцию, ингибитор замедляет. Проверьте свои конспекты занятий — там должен быть график действия различных катализаторов при разложении перекиси водорода; нарисуйте его ниже.

- Свет. Свет определенной длины волны также может ускорить реакцию
Как температура влияет на скорость химической реакции? Когда два химических вещества реагируют, их молекулы должны столкнуться друг с другом с достаточной энергией, чтобы реакция произошла.Это теория столкновений. Две молекулы будут реагировать только в том случае, если у них достаточно энергии. Нагревая смесь, вы повысите энергетические уровни молекул, участвующих в реакции. Повышение температуры означает, что молекулы движутся быстрее. Это кинетическая теория. Если ваша реакция происходит между атомами, а не между молекулами, вы просто замените «атом» на «молекулу» в своем объяснении.
Как катализаторы влияют на скорость реакции? Катализаторы ускоряют химические реакции.Для резкого изменения скорости реакции требуются лишь очень незначительные количества катализатора. Дело в том, что в присутствии катализатора реакция протекает по другому пути. Добавление дополнительного катализатора ничего не изменит. На этом сайте есть целая страница, посвященная катализаторам.
Добавление дополнительного катализатора ничего не изменит. На этом сайте есть целая страница, посвященная катализаторам.
Как концентрация влияет на скорость реакции? Увеличение концентрации реагентов увеличит частоту столкновений между двумя реагентами.Итак, это снова теория столкновений. Когда происходят столкновения, они не всегда приводят к реакции. Если две сталкивающиеся молекулы обладают достаточной энергией, они вступят в реакцию. Если реакция происходит между веществом в растворе и твердым телом, вы просто меняете концентрацию раствора. Эксперимент прост. Если реакция происходит между двумя растворами, у вас небольшая проблема. Изменяете ли вы концентрацию одного из реагентов или изменяете концентрацию обоих? Вы можете обнаружить, что скорость реакции ограничена концентрацией более слабого раствора, и увеличение концентрации другого не имеет значения.Что вам нужно сделать, так это установить избыточную концентрацию одного из реагентов. Теперь вы можете увеличить концентрацию другого раствора, чтобы увеличить скорость реакции.
Как площадь поверхности влияет на химическую реакцию? Если один из реагентов является твердым веществом, площадь поверхности твердого вещества будет влиять на скорость реакции. Это связано с тем, что два типа молекул могут столкнуться друг с другом только на границе жидкости и твердого тела, то есть на поверхности твердого тела.Таким образом, чем больше площадь поверхности твердого тела, тем быстрее будет протекать реакция. Более мелкие частицы имеют большую площадь поверхности, чем более крупные частицы при той же массе твердого вещества. Есть простой способ визуализировать это. Возьмите буханку хлеба и нарежьте ее ломтиками. Каждый раз, когда вы отрезаете новый ломтик, вы получаете дополнительную поверхность, на которую можно намазывать масло и джем. Чем тоньше вы нарежете ломтики, тем больше ломтиков получится и тем больше масла и варенья вы сможете на них положить. Это «Теория хлеба с маслом». Вы должны были встретить эту идею на уроках биологии.Пережевывая пищу, вы увеличиваете площадь поверхности, чтобы пищеварение могло идти быстрее.
Какое влияние оказывает давление на реакцию между двумя газами? Вы уже должны знать, что атомы или молекулы в газе очень разбросаны. Чтобы два химических вещества вступили в реакцию, между их молекулами должно произойти столкновение. Увеличивая давление, вы сжимаете молекулы вместе, что увеличивает частоту столкновений между ними. Это снова теория столкновений.В дизельном двигателе сжатие газообразной смеси воздуха и дизельного топлива также увеличивает температуру, достаточную для воспламенения. Повышение давления также приводит к повышению температуры. В бензиновом двигателе недостаточно произвести сгорание, поэтому бензиновым двигателям нужна свеча зажигания. Когда смесь бензина с воздухом сжата, искра от свечи воспламеняет смесь. В обоих случаях реакция (горение) протекает очень быстро. Это связано с тем, что как только реакция началась, выделяется тепло, и это заставит ее идти еще быстрее.
факторов, влияющих на скорость реакций — Введение в химию — 1-е канадское издание
Джесси А. Ки
Ки
- Для понимания теории столкновений.
- Получить представление о четырех основных факторах, влияющих на скорость реакции.
Кинетика реакций — это изучение скорости химических реакций, а скорости реакций могут сильно различаться в большом диапазоне временных масштабов. Некоторые реакции могут протекать со взрывоопасной скоростью, например взрыв фейерверков (рис. 17.1 «Ночной фейерверк над рекой»), в то время как другие могут возникать вяло в течение многих лет, например, ржавчина колючей проволоки, подвергающейся воздействию стихии (рис. 17.2 «Ржавая колючая проволока»).
Рисунок 17.1 «Ночной фейерверк над рекой». Химическая реакция в фейерверках происходит со взрывной скоростью. Рисунок 17.2 «Ржавая колючая проволока». Ржавление колючей проволоки происходит в течение многих лет. Чтобы понять кинетику химических реакций и факторы, влияющие на кинетику, мы должны сначала изучить, что происходит во время реакции на молекулярном уровне. Согласно теории реактивности столкновения реакции происходят, когда молекулы реагентов «эффективно сталкиваются». Чтобы произошло «эффективное столкновение», молекулы реагентов должны быть правильно ориентированы в пространстве, чтобы облегчить разрыв и образование связей, а также перегруппировку атомов, приводящую к образованию молекул-продуктов (см. рис. 17.3 «Визуализация столкновений»).
Согласно теории реактивности столкновения реакции происходят, когда молекулы реагентов «эффективно сталкиваются». Чтобы произошло «эффективное столкновение», молекулы реагентов должны быть правильно ориентированы в пространстве, чтобы облегчить разрыв и образование связей, а также перегруппировку атомов, приводящую к образованию молекул-продуктов (см. рис. 17.3 «Визуализация столкновений»).
Во время молекулярного столкновения молекулы также должны обладать минимальным количеством кинетической энергии, чтобы произошло эффективное столкновение. Эта энергия различается для каждой реакции и известна как энергия активации ( E a ) (рис. 17.4 «Потенциальная энергия и энергия активации»). Следовательно, скорость реакции зависит от энергии активации; более высокая энергия активации означает, что меньшее количество молекул будет иметь достаточную энергию для эффективного столкновения.
На скорость химической реакции могут влиять четыре основных фактора:
- Концентрация реагента. Повышение концентрации одного или нескольких реагентов часто увеличивает скорость реакции. Это происходит потому, что более высокая концентрация реагента приведет к большему количеству столкновений этого реагента за определенный период времени.
- Физическое состояние реагентов и площадь поверхности. Если молекулы реагентов существуют в разных фазах, как в гетерогенной смеси, скорость реакции будет ограничена площадью поверхности контактирующих фаз. Например, если смешать твердый металлический реагент и газообразный реагент, только молекулы, находящиеся на поверхности металла, могут столкнуться с молекулами газа. Следовательно, увеличение площади поверхности металла путем растирания его до плоской формы или разрезания на множество частей увеличит скорость его реакции.

- Температура . Повышение температуры обычно увеличивает скорость реакции. Повышение температуры увеличивает среднюю кинетическую энергию молекул реагентов. Следовательно, большая часть молекул будет иметь минимальную энергию, необходимую для эффективного столкновения (рис. 17.5 «Температура и скорость реакции»).
Рисунок 17.5 «Температура и скорость реакции». Влияние температуры на распределение кинетической энергии молекул в образце - Наличие катализатора .Катализатор — это вещество, которое ускоряет реакцию, участвуя в ней, но не расходуясь. Катализаторы обеспечивают альтернативный путь реакции для получения продуктов. Они имеют решающее значение для многих биохимических реакций. Они будут рассмотрены далее в разделе «Катализ».
- Реакции происходят, когда эффективно сталкиваются две молекулы реагентов, каждая из которых имеет минимальную энергию и правильную ориентацию.
- Концентрация реагента, физическое состояние реагентов, площадь поверхности, температура и наличие катализатора — четыре основных фактора, влияющих на скорость реакции.

Атрибуция СМИ
6.2.2: Изменение скорости реакции в зависимости от температуры
Подавляющее большинство реакций зависит от термической активации, поэтому основным фактором, который следует учитывать, является доля молекул, обладающих достаточной кинетической энергией для реакции при данной температуре. Согласно кинетической молекулярной теории, популяция молекул при данной температуре распределяется по множеству кинетических энергий, что описывается законом распределения Максвелла-Больцмана.
Здесь показаны два графика распределения для более низкой температуры T 1 и более высокой температуры T 2 . Площадь под каждой кривой представляет собой общее количество молекул, энергия которых попадает в определенный диапазон. Заштрихованные области указывают количество молекул, которые обладают достаточной энергией для удовлетворения требований, диктуемых двумя показанными значениями E и .
Из этих графиков видно, что доля молекул, кинетическая энергия которых превышает энергию активации, довольно быстро увеличивается с повышением температуры.Это является причиной того, что практически все химические реакции (и все элементарные реакции) протекают быстрее при более высоких температурах.
Температура считается основным фактором, влияющим на скорость химической реакции. Он считается источником энергии для химической реакции. Сванте Аррениус, шведский химик, считал, что реагенты в химической реакции должны получить небольшое количество энергии, чтобы стать продуктами. Он назвал этот тип энергии энергией активации.Известно, что количество энергии, используемой в реакции, больше энергии активации реакции. Аррениус вывел уравнение, показывающее, что константы скорости различных видов химических реакций меняются в зависимости от температуры. Это уравнение указывает константу скорости, которая пропорциональна температуре. Например, по мере увеличения константы скорости обычно увеличивается и температура химической реакции. Результат приведен ниже:
Результат приведен ниже:
\[\ln \frac{k_2}{k_1} = \frac{E_a}{R}\left(\frac{1}{T_1} — \frac{1}{T_2}\ справа) \]
Это уравнение известно как уравнение Аррениуса.T 1 и T 2 — температурные переменные, выраженные в градусах Кельвина. T 1 может быть выражена как начальная или более низкая температура реакции, тогда как T 2 является конечной или более высокой температурой реакции. Константы скорости k 1 и k 2 , являются значениями при T 1 и T 2 . E a представляет собой энергию активации, выраженную в (Джоули/моль)=(Дж/моль). R — газовая постоянная, выраженная как 8,3145 (Дж/моль × Кельвин) = (Дж/моль × К)
Некоторые могут спросить, как температура на самом деле влияет на скорость химической реакции.{-\frac{E_a}{RT}} \]
Некоторые интересные примеры:
- Соль или пищевой краситель добавляют в холодную воду, воду комнатной температуры и горячую воду.
 Когда вещество смешивается с горячей водой, высокие температуры позволяют ему стать однородной смесью. Это связано с тем, что молекулы воды движутся быстрее при более высокой температуре и ускоряют реакцию растворения.
Когда вещество смешивается с горячей водой, высокие температуры позволяют ему стать однородной смесью. Это связано с тем, что молекулы воды движутся быстрее при более высокой температуре и ускоряют реакцию растворения. - Другой формой энергии является свет. Одним из примеров влияния температуры на скорость химической реакции является использование светящихся палочек или светящихся палочек.Световая палочка подвергается химической реакции, которая называется хемилюминесценцией; но эта реакция не требует и не выделяет тепла. Однако на его скорость влияет температура. Если лайтстик поместить в холодную среду, химическая реакция замедлится, что позволит ему излучать свет дольше. Если лайтстик находится в горячей среде, реакция ускоряется, в результате чего свет изнашивается быстрее. (Этот пример взят из статьи How Things Work—Lightsticks с сайта chemistry.about.com)
ВЛИЯНИЕ ТЕМПЕРАТУРЫ НА СКОРОСТЬ РЕАКЦИИ На этой странице описывается и объясняется, как изменение температуры влияет на скорость реакции. | ||
Примечание: Если вы еще не читали страницу о теории столкновений, сделайте это, прежде чем продолжить. Используйте кнопку НАЗАД в браузере, чтобы вернуться на эту страницу, или вернитесь через меню показателей реакции. | ||
Факты Что происходит? При повышении температуры скорость реакции увеличивается.В грубом приближении для многих реакций, протекающих при комнатной температуре, скорость реакции удваивается при повышении температуры на каждые 10 °C. Будьте осторожны и не воспринимайте это слишком буквально. Это относится не ко всем реакциям. Даже если это приблизительно верно, может случиться так, что скорость удваивается каждые 9°C или 11°C или что-то еще. Количество градусов, необходимое для удвоения скорости, также будет постепенно меняться по мере повышения температуры. | ||
Примечание: Вы найдете влияние температуры на скорость, изученное немного более математическим способом на отдельной странице. | ||
Примеры Некоторые реакции протекают практически мгновенно — например, реакция осаждения, включающая соединение ионов в растворе с образованием нерастворимого твердого вещества, или реакция между ионами водорода из кислоты и ионами гидроксида из щелочи в растворе. Таким образом, нагревание одного из них не окажет заметного влияния на скорость реакции. Почти любая другая реакция, которую вы хотите назвать, произойдет быстрее, если вы ее нагреете — либо в лаборатории, либо в промышленности. Объяснение Увеличение частоты столкновений Частицы могут реагировать только при столкновении. Если вы нагреваете вещество, частицы движутся быстрее и поэтому сталкиваются чаще. Это кажется довольно простым объяснением, пока вы не посмотрите на цифры! Оказывается, частота столкновений двух частиц в газах пропорциональна квадратному корню из температуры по Кельвину.Если вы увеличите температуру с 293 К до 303 К (от 20°C до 30°C), вы увеличите частоту столкновений в: раз.Это увеличение на 1,7% при повышении на 10°. Скорость реакции, вероятно, удвоится при таком повышении температуры, другими словами, увеличится примерно на 100%. Влияние увеличения частоты столкновений на скорость реакции весьма незначительно. Важным эффектом является совсем другое. . . Ключевое значение энергии активации Столкновения приводят к реакции только в том случае, если частицы сталкиваются с достаточной энергией, чтобы запустить реакцию.Эта минимальная необходимая энергия называется энергией активации реакции. | ||
Примечание: Далее предполагается, что у вас есть разумное представление об энергии активации и ее связи с распределением Максвелла-Больцмана.  Это описано на вводной странице о теории столкновений. Это описано на вводной странице о теории столкновений. Если вы не уверены в этом, перейдите по этой ссылке и используйте кнопку НАЗАД в браузере, чтобы вернуться на эту страницу. | ||
Вы можете отметить положение энергии активации на распределении Максвелла-Больцмана, чтобы получить такую диаграмму: Только частицы, представленные областью справа от энергии активации, будут иметь достаточную энергию для реакции при столкновении.Подавляющему большинству не хватает энергии, и они просто отскочат друг от друга. Если в любой момент времени имеется очень мало частиц с достаточной энергией, то реакция будет медленной. | ||
Важно: Я уже прокомментировал это на вводной странице о теории столкновений. Важно понимать, что хотя форма этого графика постоянна при данной температуре, в какой его части находится отдельная частица, постоянно меняется.  Одни частицы будут приобретать энергию при случайных столкновениях, а другие терять энергию. Одни частицы будут приобретать энергию при случайных столкновениях, а другие терять энергию. Просто случайно каждая частица в какой-то момент окажется с достаточной энергией, чтобы отреагировать, если она совершит успешное столкновение. Таким образом, хотя в любой момент может присутствовать лишь относительно небольшое количество частиц с достаточной энергией, с течением времени все частицы будут реагировать, если реагирующие пропорции правильны. | ||
Чтобы ускорить реакцию, нужно увеличить количество очень энергичных частиц, присутствующих в каждый конкретный момент времени — тех, энергия которых равна или превышает энергию активации.Повышение температуры имеет именно такой эффект — изменяет форму графика. На следующей диаграмме график, обозначенный T , соответствует исходной температуре. График, обозначенный T+t , находится при более высокой температуре. Если вы теперь отметите положение энергии активации, вы увидите, что, хотя кривая в целом не очень сильно сдвинулась, произошло такое большое увеличение числа очень энергичных частиц, что многие другие теперь сталкиваются с достаточной энергией. Помните, что площадь под кривой дает количество частиц. На последней диаграмме площадь под высокотемпературной кривой справа от энергии активации, по-видимому, увеличилась по крайней мере вдвое, следовательно, по крайней мере удвоилась скорость реакции. Сводка Повышение температуры увеличивает скорость реакции из-за непропорционально большого увеличения числа столкновений с высокой энергией.Только эти столкновения (имеющие 90 259 по крайней мере 90 260 энергии активации реакции) приводят к реакции.
В меню скорости реакции. В меню «Физическая химия» . . . В главное меню . . . © Джим Кларк, 2002 г. (последнее изменение: октябрь 2018 г.) | ||
Chem4Kids.com: Реакции: Скорость реакции
Скорость реакции – это скорость, с которой происходит химическая реакция. Если реакция имеет низкую скорость, это означает, что молекулы объединяются с меньшей скоростью, чем реакция с высокой скоростью.Некоторые реакции длятся сотни, а то и тысячи лет, в то время как другие могут произойти менее чем за одну секунду. Если вы хотите представить себе очень медленную реакцию, подумайте о том, сколько времени требуется растениям и древним рыбам, чтобы стать окаменелостями (карбонизация). Скорость реакции также зависит от типа соединяющихся молекул. При низких концентрациях эссенциального элемента или соединения реакция будет медленнее.
Существует еще одна большая идея для скоростей реакции, называемая теорией столкновений .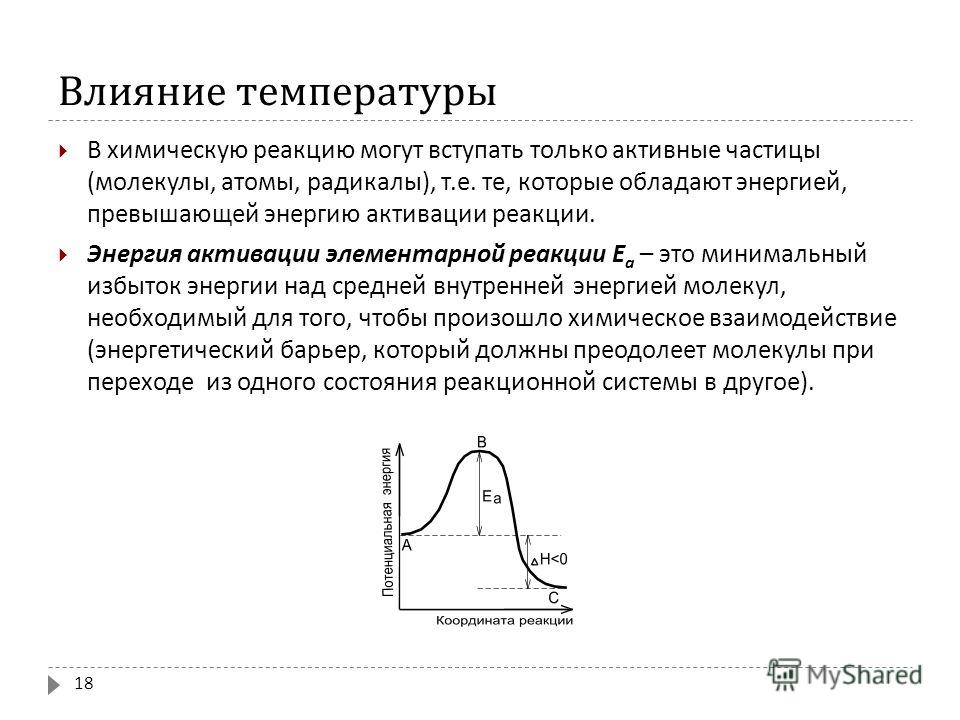 Теория столкновений утверждает, что чем больше столкновений происходит в системе, тем больше будет на комбинаций молекул, отскакивающих друг от друга. Чем больше возможных комбинаций, тем выше вероятность того, что молекулы завершат реакцию. Реакция будет происходить быстрее, что означает, что скорость этой реакции увеличится.
Теория столкновений утверждает, что чем больше столкновений происходит в системе, тем больше будет на комбинаций молекул, отскакивающих друг от друга. Чем больше возможных комбинаций, тем выше вероятность того, что молекулы завершат реакцию. Реакция будет происходить быстрее, что означает, что скорость этой реакции увеличится.
Подумайте о том, как медленно движутся молекулы меда по сравнению с газировкой, несмотря на то, что они оба жидкие. В меде меньше столкновений из-за более сильных межмолекулярных сил (сил между молекулами).Большие силы означают, что мед имеет более высокую вязкость, чем газированная вода.
Реакции случаются — несмотря ни на что. Химические вещества всегда объединяются или разрушаются. Реакции происходят снова и снова, но не всегда с одинаковой скоростью. Несколько вещей влияют на общую скорость реакции и количество столкновений, которые могут произойти. Температура: Когда вы повышаете температуру системы, молекулы подпрыгивают намного больше. У них больше энергии .Чем больше они подпрыгивают, тем выше вероятность столкновения. Этот факт означает, что они также с большей вероятностью будут сочетаться. Когда вы понижаете температуру, молекулы двигаются медленнее и меньше сталкиваются. Падение температуры снижает скорость реакции. В химлабораторию! Иногда вы будете смешивать растворы со льдом, чтобы температура системы оставалась низкой, а скорость реакции снижалась.
У них больше энергии .Чем больше они подпрыгивают, тем выше вероятность столкновения. Этот факт означает, что они также с большей вероятностью будут сочетаться. Когда вы понижаете температуру, молекулы двигаются медленнее и меньше сталкиваются. Падение температуры снижает скорость реакции. В химлабораторию! Иногда вы будете смешивать растворы со льдом, чтобы температура системы оставалась низкой, а скорость реакции снижалась.
Концентрация: Чем больше вещества в системе, тем выше вероятность столкновения молекул и увеличения скорости реакции.Если чего-то меньше, будет меньше столкновений и реакция, вероятно, будет происходить с меньшей скоростью. Иногда, когда вы находитесь в химической лаборатории, вы будете добавлять один раствор к другому. Если вы хотите, чтобы скорость реакции была ниже, вы будете добавлять только несколько капель за раз, а не весь стакан.
Давление: Давление: Давление влияет на скорость реакции, особенно когда вы смотрите на газы. Когда вы увеличиваете давление, молекулы имеют меньше пространства, в котором они могут двигаться.Эта большая плотность молекул увеличивает число столкновений. Когда вы уменьшаете давление, молекулы реже сталкиваются друг с другом, и скорость реакции снижается.
Когда вы увеличиваете давление, молекулы имеют меньше пространства, в котором они могут двигаться.Эта большая плотность молекул увеличивает число столкновений. Когда вы уменьшаете давление, молекулы реже сталкиваются друг с другом, и скорость реакции снижается.
Давление также связано с концентрацией и объемом. Уменьшая объем, доступный молекулам газа, вы увеличиваете концентрацию молекул в определенном пространстве. Вы также должны помнить, что изменение давления в системе хорошо работает только для газов. Как правило, скорость реакции для твердых и жидких веществ не зависит от повышения давления.
Как работает NIF (Lawrence Livermore Nat’l Labs)
Объяснение урока: Влияние температуры и концентрации на скорость реакций
В этом толкователе мы научимся описывать и объяснять влияние температуры и концентрации на скорость химических реакций.
Скорость, с которой протекает химическая реакция, называется скоростью
реакция. Обычно скорость реакции описывает, как изменяется некоторая переменная
в течение определенного периода времени.Обычный способ измерения скорости химического вещества
реакция состоит в том, чтобы измерить, как концентрации реагентов и продуктов
изменяться в течение определенного периода времени.
Обычно скорость реакции описывает, как изменяется некоторая переменная
в течение определенного периода времени.Обычный способ измерения скорости химического вещества
реакция состоит в том, чтобы измерить, как концентрации реагентов и продуктов
изменяться в течение определенного периода времени.
Определение: Скорость реакции
Скорость реакции измеряет изменение концентраций реагентов или продуктов в единицу времени.
На скорость химической реакции могут влиять многие факторы. Путем изменения некоторых из этих факторов скорость реакции может увеличиваться или уменьшаться.
Факторы, влияющие на скорость реакции, включают площадь поверхности, температура, концентрация и добавление катализаторов.Мы сосредоточимся на температура и концентрация.
Чтобы две частицы вступили в реакцию, они должны сначала столкнуться. Кроме того, частицы должны иметь определенное количество энергии, когда они сталкиваются.
Любой фактор, который может увеличить частоту столкновений или энергию
частиц, вероятно, увеличит скорость реакции.
Пример 1. Определение того, в какой ячейке с частицами будет наибольшее количество столкновений
В приведенных ниже ячейках представлена химическая реакция между красным и синие частицы.В каком поле будет число столкновений самый большой?
Ответ
Химическая реакция происходит, когда реагенты сталкиваются друг с другом. То чем больше число столкновений, тем вероятнее реакция произойти и тем выше скорость реакции.
Существует несколько факторов, влияющих на скорость реакции. Тем не мение, из вопроса и схемы видно, что нам дано четыре ящика каждый из которых содержит разное количество частиц.Размер коробки тоже самое в каждом случае.
Если частицы движутся хаотично, то чем их больше, тем тем больше может быть столкновений.
Из диаграммы видно, что коробка А содержит наибольшее количество
частицы. Поэтому количество столкновений, вероятно, будет наибольшим в
box A.
Ответ: box A.
Одним из способов увеличить количество столкновений является повышение температуры.При повышении температуры частицы набирают энергию и движутся быстрее. То чем быстрее движутся частицы, тем больше вероятность того, что они столкнутся друг с другом. разное.
На приведенной ниже диаграмме чем больше стрелка, тем быстрее движется частица. При более высоких температурах частицы имеют большую энергию и, следовательно, большую стрелку.
Влияние температуры на скорость реакции можно легко продемонстрировать в лабораторном эксперименте. В этом эксперименте одна шипучая таблетка помещают в колбу с горячей водой, а вторую таблетку помещают в другая фляга, которая содержит холодную воду.
Таблетка вступает в реакцию с водой с образованием углекислого газа. То экспериментальная установка показана ниже.
Путем измерения объема газа, произведенного в каждом эксперименте, скорости
реакцию можно определить и сравнить.
Результаты этого эксперимента показаны на графике ниже:
При более высокой температуре частицы имеют больше энергии и перемещаются Быстрее. Это увеличивает количество столкновений между частицами и увеличивает скорость реакции.
Более высокая скорость реакции увеличивает объем газа, образующегося в начале реакции, что приводит к более крутой линии на графике. Однако, поскольку масса таблетки и объем воды остаются постоянными, конечное количество произведенный газ одинаков.
Пример 2: отношение температуры к частоте столкновений между молекулами
Каждая ячейка ниже содержит равное количество молекул реагентов. Ящики нагреваются до разных температур.В какой коробке будет наибольшая частота столкновений между молекулами?
Ответ
Чтобы две молекулы реагентов вступили в реакцию, они должны столкнуться. Там
Есть несколько факторов, которые могут увеличить количество столкновений между
молекулы реагентов. Одним из них является температура.
Одним из них является температура.
Нам говорят, что в каждом ящике содержится одинаковое количество молекул реагентов, поэтому частота столкновений не будет зависеть от другого количество молекул.Тем не менее, температура каждой коробки отличается, и так, основное влияние на частоту столкновений будет оказывать изменение в температуре.
При повышении температуры молекулы реагентов приобретают энергию и движутся Быстрее. Чем быстрее движутся молекулы, тем больше вероятность того, что они сталкиваются, и тем больше будет частота столкновений.
Чем выше температура, тем больше частота столкновений между молекулами.Глядя на схему, мы видим, что коробка с самая высокая температура — ящик D. Следовательно, ответ — ящик D.
Температура — очень важный фактор для контроля скорости реакций
в еде. Размещение продуктов в прохладном месте, например в холодильнике или морозильной камере,
замедляет химические реакции, которые портят пищу.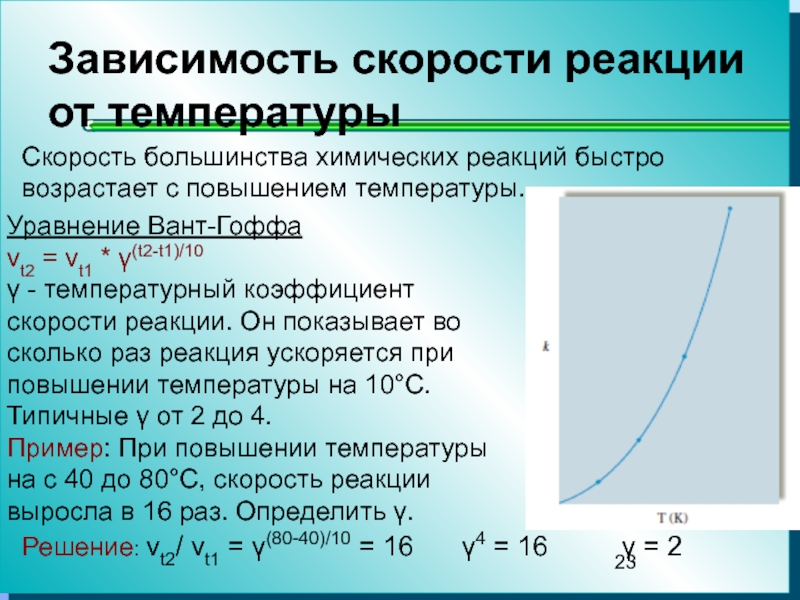 В результате пища может
сохраниться и прослужить дольше.
В результате пища может
сохраниться и прослужить дольше.
При приготовлении пищи часто используются высокие температуры. Чем выше температура увеличивает скорость реакции и помогает готовить пищу быстрее и лучше тщательно.
Влияние концентрации на скорость реакции можно объяснить глядя на частоту столкновений.
Рассмотрим реакцию между фиолетовыми частицами А и зелеными частицами. B показано на диаграмме ниже.
Если концентрация B увеличивается, то количество частиц B настоящее увеличивается. Это показано на диаграмме ниже.
Увеличение количества частиц приведет к увеличению количество столкновений.Большее количество столкновений приводит к увеличению скорость реакции.
Можно продемонстрировать влияние концентрации на скорость реакции используя реакцию железной ваты и кислорода.
Железная вата, также известная как стальная вата, может сжигаться в присутствии кислорода. Однако скорость и интенсивность этой реакции изменяются при
изменяется концентрация кислорода.
При сжигании на горелке Бунзена железная вата сжигается на воздухе.Воздуха содержит 21% кислорода, концентрация от средней до низкой. Скорость реакции довольно низкий, и железная вата горит относительно медленно.
Однако при сжигании в чистом кислороде реакция протекает намного быстрее и интенсивный. Концентрация чистого кислорода составляет ~100%, что намного больше, чем в воздухе. Увеличение концентрации кислорода увеличивает скорость реакции и приводит к более бурной и быстрой реакции.
Эти два эксперимента показаны на изображении ниже.
Пример 3: Объяснение различных скоростей горения на воздухе по сравнению с чистым кислородом
Почему алюминий сгорает на воздухе медленнее, чем в чистом кислород?
- Температура кислорода в воздухе выше, чем в чистый кислород.
- Температура чистого кислорода выше температуры воздуха.
- Концентрация кислорода в воздухе меньше, чем в чистом кислороде.

- Концентрация кислорода в воздухе больше, чем в чистом кислороде.
Ответ
Под процессом горения обычно понимают реакцию вещества с кислород. Здесь алюминий взаимодействует с кислородом при двух различных условия.
Сжигание алюминия на воздухе, скорее всего, осуществляется с помощью газовой горелки Бунзена. горелка. Воздух обычно содержит около 21% кислорода, что является относительно небольшим количеством кислорода. кислород.
Горение алюминия с чистым кислородом, скорее всего, связано с условиями где есть ∼100% кислорода.Мы видим, что разница между сжиганием в воздухе и в чистом кислороде количество или концентрация кислорода настоящее время.
Отсюда можно сделать вывод, что разница в скорости горения составляет из-за разной концентрации кислорода. Поэтому наш ответ может быть либо C, либо D.
Концентрация может влиять на скорость реакции, изменяя количество
присутствуют молекулы реагентов.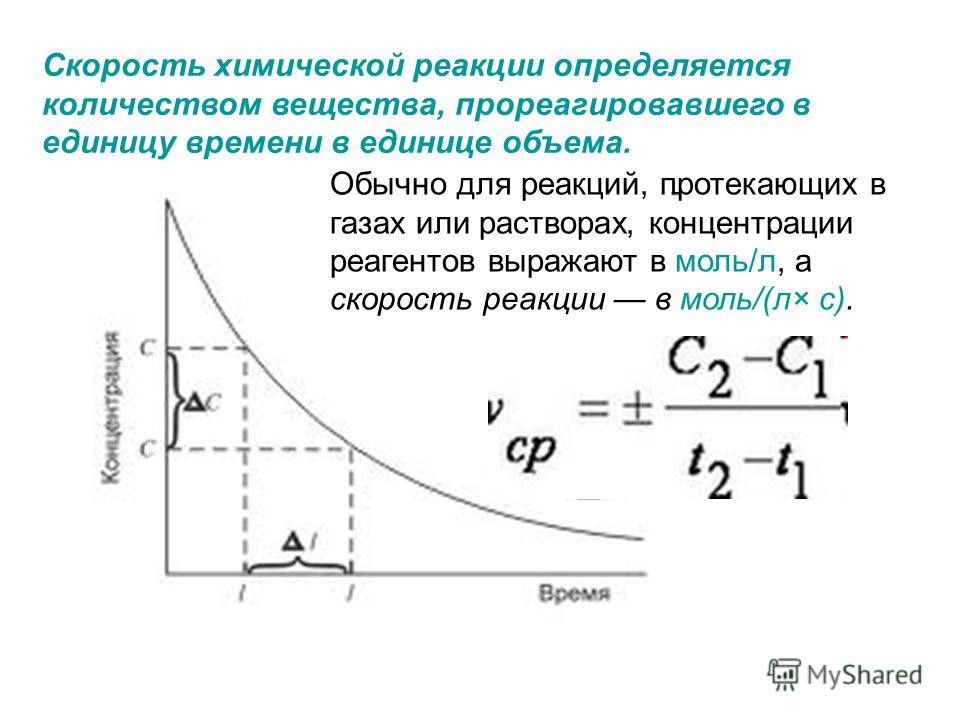 Чем больше молекул реагентов, тем
чем больше количество столкновений, которые произойдут между ними, тем быстрее
скорость реакции есть.
Чем больше молекул реагентов, тем
чем больше количество столкновений, которые произойдут между ними, тем быстрее
скорость реакции есть.
По мере увеличения концентрации скорость реакции увеличивается.
Горение алюминия на воздухе происходит медленнее из-за концентрации кислорода ниже, чем в чистом кислороде. Это утверждение соответствует варианту C, и поэтому наш ответ C.
Другой эксперимент, показывающий влияние концентрации на скорость реакция представляет собой реакцию магния с соляной кислотой.
В этом эксперименте одна коническая колба содержит разбавленную соляную кислоту и в другой колбе находится концентрированная соляная кислота.В каждую коническую В колбу помещают идентичный кусок магния того же размера и массы.
Химическое уравнение реакции между магнием и соляной кислота Mg()+2HCl()MgCl()+H()saqaqg22
Таким образом, измеряя объем газообразного водорода, произведенного с течением времени, любой
можно определить изменение скорости реакции.
Установка этого эксперимента показана на изображении ниже:
Построив график зависимости объема произведенного газообразного водорода от времени, скорости реакции для каждого эксперимента могут быть определены.График, показывающий показана скорость реакции для разбавленной и концентрированной соляной кислоты ниже:
График показывает, что больший объем газообразного водорода производится за короткий период времени при использовании концентрированной соляной кислоты. Этот показывает, что скорость реакции увеличивается с увеличением концентрации.
По мере увеличения концентрации соляной кислоты количество кислоты присутствующих частиц увеличивается. В результате появляется большее количество столкновения между кислотой и частицами магния, и поэтому это увеличение скорости реакции.
Пример 4. Упорядочивание экспериментов с различной концентрацией по скорости их реакции
Химик проводит серию экспериментов, чтобы определить влияние
концентрация на скорости реакции. Они наливают равное количество
соляной кислоты разной концентрации в четыре пробирки,
затем они помещают идентичный кусок магниевой ленты в каждую из
пробирки. Схема эксперимента показана ниже.
Они наливают равное количество
соляной кислоты разной концентрации в четыре пробирки,
затем они помещают идентичный кусок магниевой ленты в каждую из
пробирки. Схема эксперимента показана ниже.
Каков вероятный порядок скорости реакции в четырех экспериментах от самой медленной к самой быстрой?
- C, A, B, D
- C, D, B, A
- A, C, D, B
- B, C, A, D
- D, C, A, B
Ответ
Существует несколько факторов, влияющих на скорость реакции. Эти включают концентрацию и площадь поверхности. В эксперименте объем используемая соляная кислота остается прежней. Идентичный кусок магния также используется, поэтому площадь поверхности и масса остаются прежними.
Единственным изменяющимся фактором является концентрация соляной кислоты кислота. Концентрация наибольшая в эксперименте D и наименьшая в эксперимент B.
Чтобы произошла реакция, молекулы реагентов должны столкнуться с каждой
разное. Увеличение количества столкновений увеличивает скорость
реакция.
Увеличение количества столкновений увеличивает скорость
реакция.
При увеличении концентрации количество присутствующих кислотных частиц в растворе увеличивается. Увеличенное количество кислотных частиц будет приводит к большему количеству столкновений и, следовательно, более высокой скорости реакция.
Если скорость реакции увеличивается с увеличением концентрации, то порядок скорости реакции от самой медленной к самой быстрой будет соответствовать порядке от наименьшей к наибольшей концентрации.
От самого медленного к самому быстрому, вероятный порядок — B, C, A, D, что соответствует варианту ответа D. Следовательно, правильный ответ — D.
Пример 5. Определение набора условий, обеспечивающих наибольшую скорость реакции
В серии экспериментов студент меняет концентрацию и температура.Показаны условия для каждого эксперимента. ниже. В какой конической колбе скорость реакции может быть наибольший?
Ответ
На скорость реакции влияют как температура, так и концентрация. Чтобы произошла реакция, частицы реагентов должны столкнуться друг с другом. Любой фактор, который увеличивает количество столкновений, вероятно, увеличится.
скорость реакции.
Чтобы произошла реакция, частицы реагентов должны столкнуться друг с другом. Любой фактор, который увеличивает количество столкновений, вероятно, увеличится.
скорость реакции.
По мере повышения температуры частицы получают больше энергии и могут двигайся быстрее.В результате, вероятно, будет большее количество столкновения и ускорение реакции. Следовательно, скорость реакции увеличивается по мере повышения температуры.
По мере увеличения концентрации количество частиц реагента увеличивается. При большем количестве присутствующих частиц, вероятно, быть большее количество столкновений и более высокая скорость реакции. Следовательно, скорость реакции увеличивается с увеличением концентрации.
Из двух приведенных выше утверждений мы можем заключить, что скорость реакции вероятно, будет самым высоким, когда и температура, и концентрация являются самыми большими.
На диаграмме выше мы видим, что самая высокая температура
50∘C, а самая высокая концентрация
2 моль/л, что происходит в
эксперимент C.
Таким образом, скорость реакции, вероятно, будет самой высокой для эксперимента C.
Ключевые моменты
- Скорость реакции измеряет концентрацию реагентов или продуктов. изменение в единицу времени.
- Чтобы произошла химическая реакция, частицы реагента должны столкнуться с друг с другом.
- Как правило, по количеству столкновений между частицами реагентов увеличивается, скорость реакции увеличивается.
- При повышении температуры частицы приобретают больше энергии и число столкновений увеличивается, в результате чего скорость реакции увеличивать.
- Можно увидеть влияние температуры на скорость реакции экспериментально путем взаимодействия шипучих таблеток с водой и измерения объем добытого газа.
- Увеличение концентрации увеличивает количество присутствующих частиц. Число столкновений больше, а значит, скорость реакции увеличивается.
- Сгорание таких веществ, как железная вата, в чистом кислороде происходит быстрее
чем в воздухе, потому что концентрация кислорода в воздухе ниже.

- Можно увидеть влияние концентрации на скорость реакции экспериментально путем взаимодействия магния с различными концентрациями соляной кислоты и измерения объема образовавшегося газа.
Как температура влияет на скорость химической реакции?
Повышение температуры обычно увеличивает константу скорости и тем самым увеличивает скорость химической реакции. Это можно объяснить, используя распределения Максвелла-Больцмана молекулярных энергий в газе при двух разных температурах. Зависимость константы скорости от температуры дается уравнением Аррениуса.
Реакция включает столкновение молекул реагентов.Однако реакция может протекать только при столкновении молекул реагентов, имеющих определенное минимальное количество энергии. Энергии, которой уже обладают молекулы реагентов, может оказаться недостаточно для того, чтобы столкновение было продуктивным. Минимальное избыточное количество энергии, которое требуется молекулам реагентов, чтобы их столкновение могло привести к продуктам, известно как энергия активации ({eq}\rm E_a{/eq}).
Повышение температуры увеличивает количество молекул, обладающих энергией, равной или превышающей энергию активации.Максвеллово-Больцмановское распределение молекулярных энергий представляет собой график зависимости числа молекул от кинетической энергии, которой обладают молекулы, при постоянной температуре T . На следующем рисунке показаны распределения Максвелла-Больцмана при двух разных температурах: {eq}\rm T_1{/eq} и {eq}\rm T_2{/eq} ({eq}\rm T_2 > T_1{/eq}). Энергия активации ({eq}\rm E_a{/eq}) отмечена на оси энергии маленькой вертикальной линией.
На приведенном выше рисунке при температуре {eq}\rm T_1{/eq} энергия большинства молекул ниже энергии активации ({eq}\rm E_a{/eq}).Небольшая часть молекул имеет энергию, равную или превышающую {eq}\rm E_a{/eq}. При повышении температуры до {eq}\rm T_2{/eq} энергия молекул увеличивается.




 Когда вещество смешивается с горячей водой, высокие температуры позволяют ему стать однородной смесью. Это связано с тем, что молекулы воды движутся быстрее при более высокой температуре и ускоряют реакцию растворения.
Когда вещество смешивается с горячей водой, высокие температуры позволяют ему стать однородной смесью. Это связано с тем, что молекулы воды движутся быстрее при более высокой температуре и ускоряют реакцию растворения. Предполагается, что вы уже знакомы с основными идеями теории столкновений и с распределением энергий молекул Максвелла-Больцмана в газе.
Предполагается, что вы уже знакомы с основными идеями теории столкновений и с распределением энергий молекул Максвелла-Больцмана в газе.
 Это ускорит скорость реакции.
Это ускорит скорость реакции. реагировать.
реагировать. . .
. . 
