8 сильнейших кислот, известных нам
Что делает кислоту сильной или слабой? Чтобы ответить на этот вопрос, нам сначала нужно взглянуть на определение кислоты. Это химическое соединение, которое принимает электроны и / или отдает (диссоциирует) ионы водорода, также известные как протоны.
Следовательно, уровни кислотности кислоты зависят от ее способности диссоциировать ионы водорода, т.е. чем больше число ионов водорода, продуцируемых кислотой в растворе, тем более кислым он является. Теперь, прежде чем мы перейдем к списку сильнейших кислот на Земле, есть определенные термины и определения, с которыми вам необходимо ознакомиться.
Константа диссоциации кислоты (Ka): иногда известная как константа ионизации кислоты или просто кислотная константа — это количественно выраженная сила кислоты в водном растворе. С одной стороны, когда pH или «мощность водорода» определяют уровень основности или, в этом случае, кислотность любого раствора, константа диссоциации кислоты говорит нам о концентрации ионов водорода [H +] или ионов гидрония [h4O +] в растворе.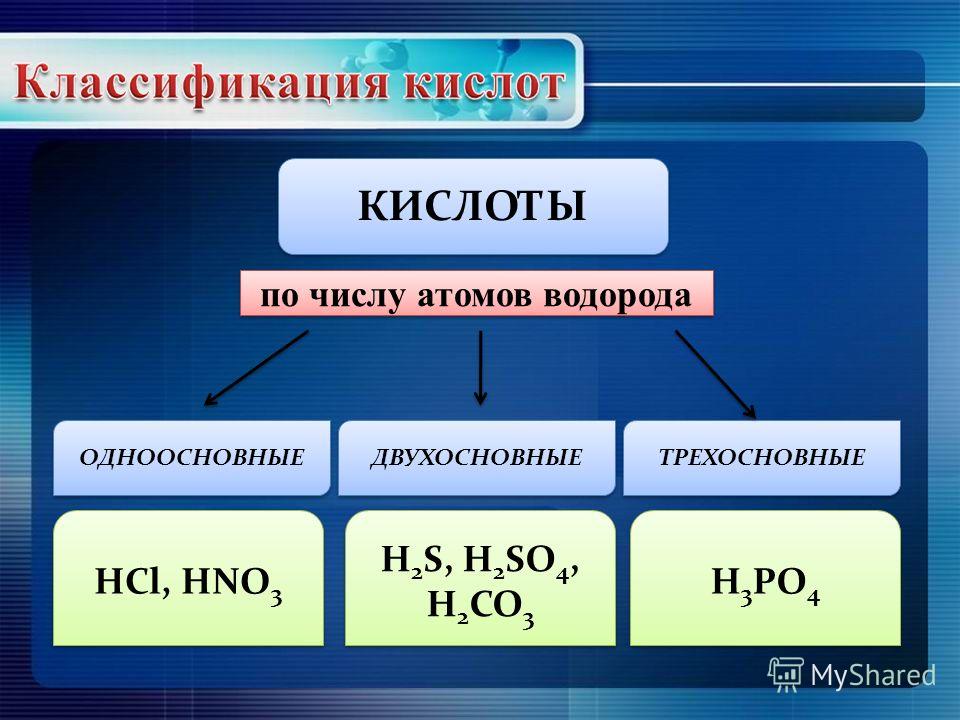
Это подводит нас к другому связанному и важному показателю кислотности pKa. Это в основном отрицательный целочисленный логарифм Ka.
pKa = -log10Ka.
Чем сильнее кислота, тем ниже значения pKa.
Уксусная кислота отдает протон (в зеленом цвете) воде, чтобы произвести ион гидрония и ион ацетата. (Кислород в красном, водород в белом и углерод в черном)Функция кислотности Гаммета: (H o) Всем нам известна шкала pH, которая обычно используется для измерения уровней кислотности или основности химических веществ, но когда речь идет о суперкислотах, она просто становится бесполезной, поскольку их уровни кислотности в миллион раз больше, чем серная и соляная кислоты.
Таким образом, чтобы измерить суперкислоты на основе их уровней кислотности, исследователи придумали функцию кислотности Гаммета. Первоначально он был предложен американским физическим химиком Луи Плаком Гаммет.
Суперкислота.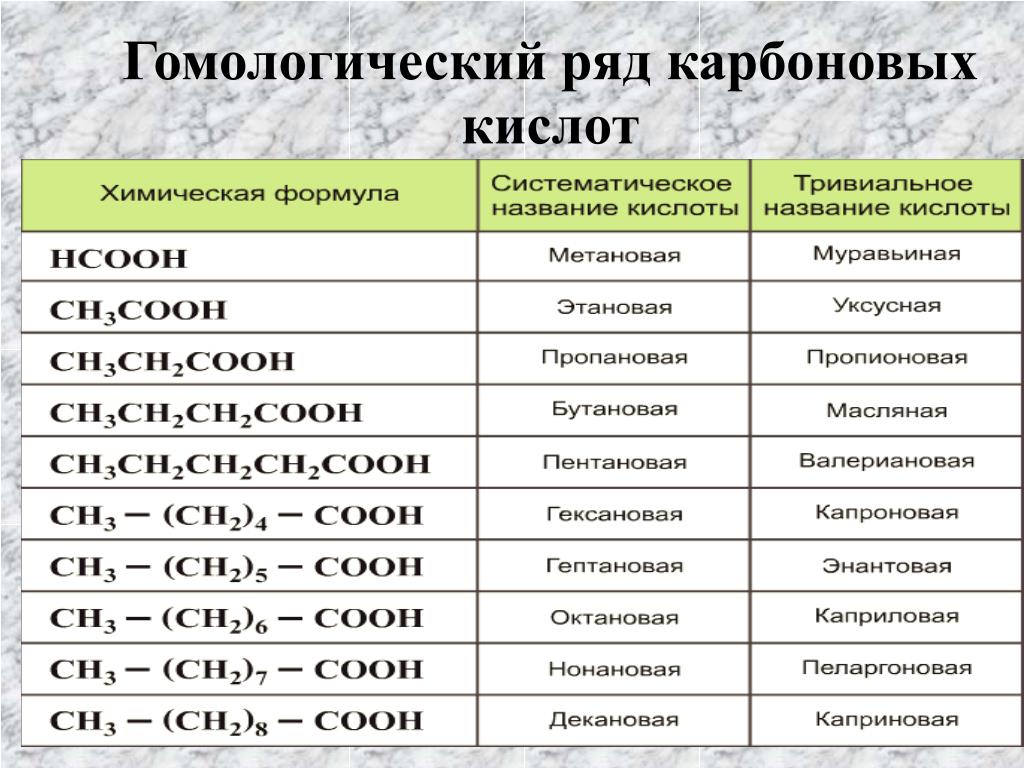 Суперкислота — это просто кислота с уровнем кислотности более 100% -ной серной кислоты с функцией кислотности Гаммета ниже -12. В более технических терминах его можно определить как среду, в которой химический потенциал протона выше, чем в чистой серной кислоте.
Суперкислота — это просто кислота с уровнем кислотности более 100% -ной серной кислоты с функцией кислотности Гаммета ниже -12. В более технических терминах его можно определить как среду, в которой химический потенциал протона выше, чем в чистой серной кислоте.
8. Серная кислота
Серная кислота (98%) на листе бумагиХимическая формула: H2SO4
pKa значение: -3
Ho значение: 12
Серная кислота или купорос не нуждаются в формальном введении. Он не имеет запаха, цвета и вызывает интенсивную экзотермическую реакцию при смешивании с водой. Серная кислота является важным химическим веществом, которое необходимо для многих отраслей промышленности, таких как сельское хозяйство, очистка сточных вод и нефтепереработка. Она также используется в кислотах аккумулятора и чистящих средствах.
Она также играет важную роль в изучении кислот в целом. Серная кислота служит базовым эталоном для сравнения уровней кислотности суперкислот или кислот. Хотя существует несколько способов получения серной кислоты, обычно используют контактный процесс и влажный процесс серной кислоты.
Хотя существует несколько способов получения серной кислоты, обычно используют контактный процесс и влажный процесс серной кислоты.
H 2 SO 4 может нанести значительный ущерб коже человека при прямом контакте. Это также очень разъедает многие металлы. Химическое вещество гораздо более агрессивно и опасно, когда присутствует в высокой концентрации, благодаря своим превосходным окислительным и дегидратирующим свойствам.
7. Соляная кислота
Химическая формула: HCl
pK A значение: -5,9
Подобно серной кислоте, соляная кислота также является важным химическим веществом, которое широко используется в лабораториях и различных отраслях промышленности. Соляная кислота была обнаружена где-то около 800 г. н.э. иранским ученым-эрудитом по имени Джабир ибн Хайян.
Те, кто задаются вопросом, почему соляная кислота сильнее серной кислоты, несмотря на то, что последняя является контрольной точкой для суперкислот, причина этого заключается в том, что серная кислота является дипротоновой кислотой, которая обычно не полностью диссоциирует.
Другими словами, HCl сильнее серной кислоты, поскольку ее ионы водорода (HCl) легко отделяются от хлорида по сравнению с сульфат-ионом из серной кислоты. Так или иначе, соляная кислота в основном используется в тяжелой промышленности для удаления ржавчины с железа и стали перед дальнейшей обработкой. Кроме того, это жизненно важный компонент в производстве органических (винилхлорид используется для ПВХ) и многих неорганических соединений.
6. Трифторметансульфоновая кислота
Трифторметансульфоновая кислотаХимическая формула: CF 3 SO 3 H
pK A значение: -14,7
Трифторметансульфоновая кислота, наиболее известная как трифликовая кислота, была впервые синтезирована / обнаружена Робертом Хазелдином, британским химиком, еще в 1954 году. Она известна своей замечательной химической и термической стабильностью. В то время как другие сильные кислоты, такие как азотная и хлорная кислоты, подвержены окислению, трифликовая кислота — нет.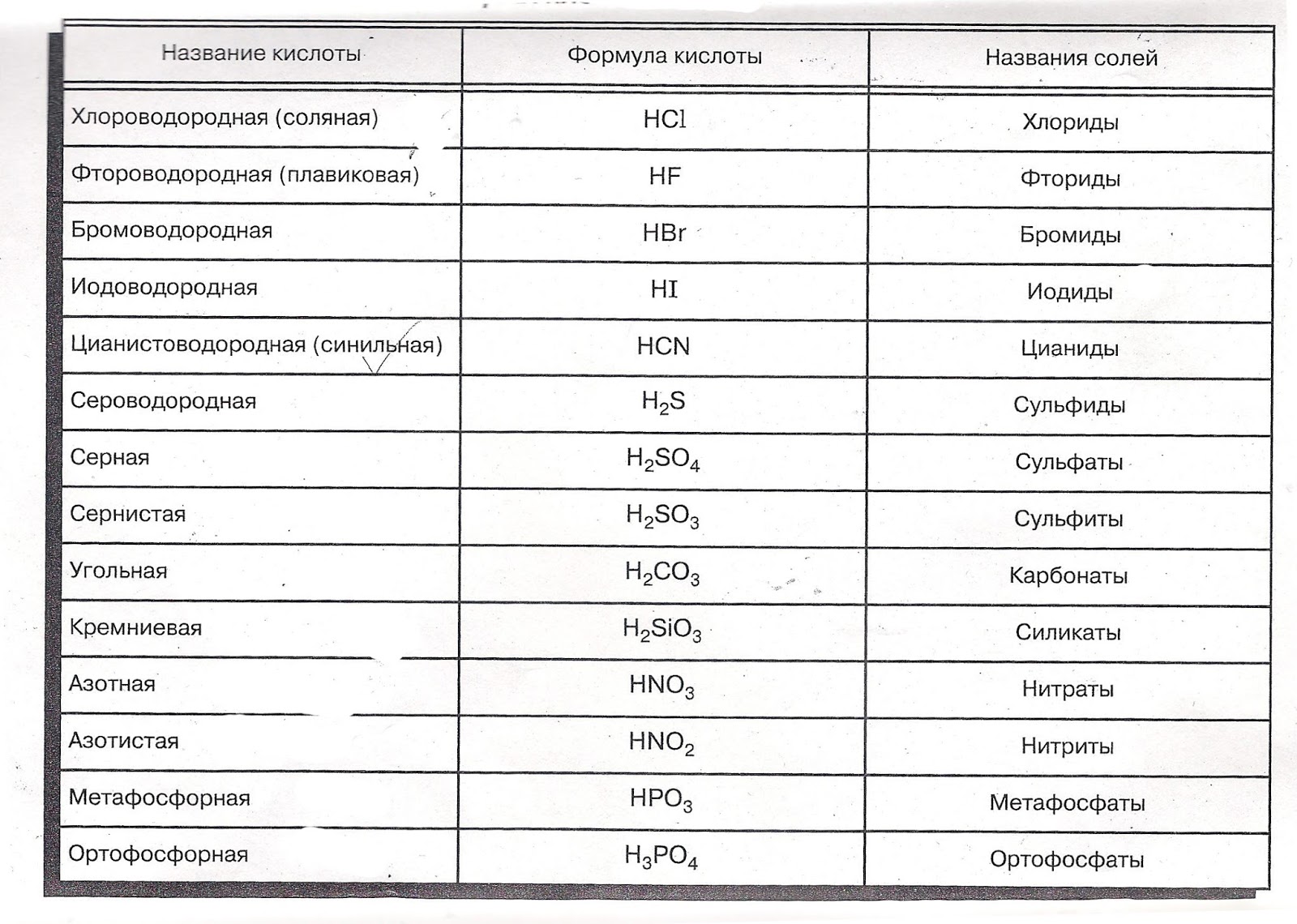
Трифликовая кислота используется во многих протонированиях и титрованиях (количественный анализ химического состава). Важная причина, по которой трифликовая кислота является предпочтительной в определенных случаях, заключается в том, что она не сульфонирует другие вещества, что характерно для хлорсульфоновой кислоты и серной кислоты.
Излишне говорить, что это чрезвычайно опасно. Любой контакт кожи с кислотой может вызвать серьезные ожоги и может привести к незначительному повреждению тканей. Это может также вызвать отек легких и судороги и другие критические условия при вдыхании.
5. Фторсульфоновая кислота
Химическая формула: HSO 3 F
H O значение: -15.1
pK A значение: -10
Фторосерная кислота или серно-фтористоводородная кислота (официальное название) является второй сильнейшей однокомпонентной кислотой, доступной сегодня. Это желтый на вид и, конечно, очень едкий / токсичный. HSO 3 F обычно получают путем взаимодействия фтористого водорода с триоксидом серы, и в сочетании с пентафторидом сурьмы он образует «волшебную кислоту», гораздо более сильную кислоту и протонирующий агент.
HSO 3 F обычно получают путем взаимодействия фтористого водорода с триоксидом серы, и в сочетании с пентафторидом сурьмы он образует «волшебную кислоту», гораздо более сильную кислоту и протонирующий агент.
Кислота может быть использована для алкилирования углеводородов (с алкенами) и изомеризации алканов, а также для травления стекла (художественное стекло). Это обычный фторирующий агент в лабораториях.
4. Хлорная кислота
Химическая формула: HClO 4
pK A значение: -10, -15.2
Хлорная кислота является одной из самых сильных кислот Бренстеда-Лоури, которые обладают сильными окислительными свойствами и обладают высокой коррозионной активностью. Традиционно ее получают обработкой перхлората натрия соляной кислотой (HCl), которая также создает хлорид натрия.
NaClO4 + HCl → NaCl + HClO4
В отличие от других кислот, хлорная кислота не подвержена гидролизу. Это также одна из самых регулируемых кислот в мире. Еще в 1947 году в Лос-Анджелесе, штат Калифорния, около 150 человек получили ранения и 17 человек погибли в результате химического взрыва, в котором содержалось почти 75% хлорной кислоты (по объему) и 25% ангидрида уксусной кислоты. Также было повреждено более 250 близлежащих зданий и транспортных средств.
Еще в 1947 году в Лос-Анджелесе, штат Калифорния, около 150 человек получили ранения и 17 человек погибли в результате химического взрыва, в котором содержалось почти 75% хлорной кислоты (по объему) и 25% ангидрида уксусной кислоты. Также было повреждено более 250 близлежащих зданий и транспортных средств.
Несмотря на взрывную природу, хлорная кислота широко используется и даже предпочтительна в некоторых типах синтеза. Это также важный компонент перхлората аммония, который используется в современном ракетном топливе.
3. Фторированная карборановая кислота
Общая структура карбоновой кислотыХимическая формула: H (CHB 11 F 11)
H o значение: -18
pK a значение: -20
Карборановые кислоты являются одной из самых сильных групп суперкислот, известных человеку, немногие из которых, как считается, имеют значение функции кислотности Гамметта, равное -18, что более чем в миллион раз выше уровня кислотности, чем чистая (100%) серная кислота.
Одним из таких членов этой группы является фторированная карборановая кислота. Хотя о существовании такого химического вещества первоначально сообщалось в 2007 году, исследователи смогли в полной мере изучить его природу только в 2013 году. До его открытия корона сильнейшей кислоты Бренстеда перешла к сильно хлорированной версии этого семейства суперкислот.
Фторированный карборан является единственной известной кислотой, которая может протонировать (переносить ион водорода) диоксид углерода с образованием катионов, соединенных водородом. В отличие от этого, CO 2 не подвергается какой-либо заметной протонации при обработке другими суперкислотами, такими как магическая кислота и HF-SbF5.
2. Волшебная кислота
Химическая формула: FSO 3 H · SbF 5
H o значение: -23
FSO 3 H · SbF 5, наиболее известный как магическая кислота, получают смешением фторсерной кислоты и пентафторида сурьмы в молярном соотношении 1: 1.
Его довольно причудливое название было установлено после официального события в 1966 году, когда сотрудник лаборатории Олаха продемонстрировал протонирование углеводородов, в котором парафиновая свеча «волшебным образом» растворилась и превратилась в раствор трет-бутильного катиона после того, как она была помещена в то, что сейчас известно как волшебная кислота.
Хотя Волшебная кислота обычно используется для стабилизации ионов углерода в растворах, она имеет несколько других важных промышленных применений. Например, он может ускорить изомеризацию насыщенных углеводородов и даже протоната метана, ксенона и галогенов, которые все являются слабыми основаниями.
1. Фтороантимоновая кислота
Химическая формула: H 2 FSbF 6
H o значение: -15 (в чистом виде), -28 (с> 50 мол. %)
%)
Фторантимоновая кислота является, пожалуй, самой сильной из всех известных суперкислот, основанных на значениях функции кислотности Гаммета. Его получают путем смешивания фтористого водорода с пентафторидом сурьмы, как правило, в соотношении 2: 1. Эта реакция носит экзотермический характер.
Этот суперкислота имеет несколько важных применений в химическом машиностроении и нефтехимической промышленности. Например, его можно использовать для отделения метана и Н 2 от неопентана и изобутана (оба алкана) соответственно.
Неудивительно, что H 2 FSbF 6 чрезвычайно агрессивен и может подвергаться сильному гидролизу при контакте с водой. Как и большинство суперкислот, фторантимоновая кислота может питаться прямо через стекло, поэтому она должна храниться в контейнерах из политетрафторэтилена.
Теперь, большинство из вас, возможно, наткнулись на карбоновые кислоты (либо хлорированная карбоновая кислота, либо фторированная карборановая кислота), когда искали «самые сильные кислоты в мире».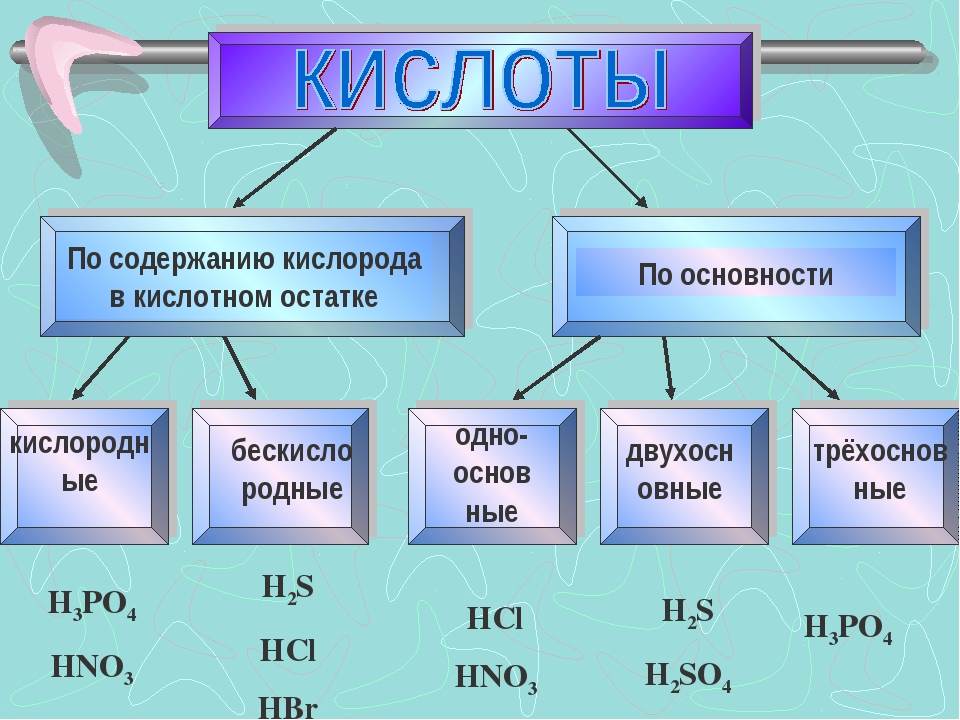 Ну, технически они верны, так как карбоновые кислоты являются самыми сильными известными однокомпонентными кислотами на Земле, гораздо более кислыми, чем подобные хлорной и трифликовой кислотам (фтороантимоновая кислота на самом деле является смешанной кислотой).
Ну, технически они верны, так как карбоновые кислоты являются самыми сильными известными однокомпонентными кислотами на Земле, гораздо более кислыми, чем подобные хлорной и трифликовой кислотам (фтороантимоновая кислота на самом деле является смешанной кислотой).
100 к 1 . Какая кислота бывает? — 4 info
100 к 1 . Какая кислота бывает?
40 баллов даст предсказуемый ответ серная;
80 баллов за добавленную лимонную;
120 баллов за стандартную соляную;
160 баллов не могла не получить и уксусная;
200 баллов вырвала себе и аскорбиновая;
240 баллов дают за полезную борную;
280 баллов начисляют за муравьиную;
320 баллов вслед за ней идет молочная.
Это вопрос для химиков или людей сходных профессий. Но опрошенные, не подкачали, показали свои хорошие знания курса химии и дали такие варианты ответов:
40 баллов — соляная
80 баллов — серная
120 баллов — азотная
160 баллов — уксусная
200 баллов — аскорбиновая
240 баллов — борная
280 баллов — муравьиная
320 баллов — молочная
Такие ответы помогут набрать максимальное количество баллов в игре.
Вот такими будут ответы на вопрос Какая кислота бывает в игре «Сто к одному» мобильная версия :
Серная 40 баллов ,
Лимонная 80 баллов ,
Соляная 120 баллов ,
Уксусная 160 баллов ,
Аскорбиновая 200 баллов ,
Борная 240 баллов ,
Муравьиная 280 баллов ,
Молочная 320 баллов ,
Ответив таким образом , вы заработаете в этом задании максимальное количество баллов .
Желаю Вам удачи в дальнейшей игре !!!
Конечно же кислота может быть разная но я больше знакома с лимонной кислотой которую все знают а ещ я знакома с муравьиной кислотой потому что одно время покупала е в аптеке для мамы которая ею лечилась а игроки перечислили следующие названия:
Кислота бывает лимонная,а ещ игроки предложили такие варианты ответов:
- 40 очков положено за ответ —Серная;
- 80 очков причитается —Лимонная;
- 120 очков начислят за —Соляная;
- 160 очков заработаете —Уксусная;
- 200 очков получите —Аскорбиновая;
- 240 очков подарит ответ —Борная;
- 280 очков даст —Муравьиная;
- 320 очков оценивается —Молочная.

Бывает кислая а бывает и не кислая, зависит от того кто как химию учил. Ну вот например
Пикриновая кислота( С6Н2ОН(NО2)3), желтое кристаллическое сухое вещество, широко использовавшееся в качестве ВЗРЫВЧАТОГО ВЕЩЕСТВА до Первой мировой войны и во время нее. Сейчас применяется в производстве красок и красителей. А уксусной кислотой мы пользуемся в гастрономических целях, соляная помогает нам переваривать еду, серная — для аккумуляторов, плавиковой кислотой можно сделать рисунок на стекле, Стеариновая кислота одна из наиболее распространнных в природе жирных кислот……
Какая кислота бывает:
- Соляная кислота.
- Серная кислота.
- Азотная кислота.
- Муравьиная кислота.
- Лимонная кислота.
- Фосфорная кислота.
- Уксусная кислота.
- Борная кислота.
- Аскорбиновая кислота.
- Молочная кислота.
- Синильная кислота.
- Бывает кислота серная. Ответ в 40 баллов.

- Бывает лимонная, это 80 баллов.
- Соляная кислота — ответ в 120 очков.
- Уксусная кислота. Уже 160 баллов, по нарастающей.
- Аскорбиновая кислота бывает, за ответ 200 баллов.
- Борная бывает кислота, и это 240 баллов.
- Кислота бывает муравьиная. Ответ даст 280 баллов игроку.
- Молочная. Самый выгодный ответ в игре на вопрос «Какая бывает кислота?»
Если обратиться к школьному курсу химии, то можно вспомнить кислоты, о которых наиболее часто рассказывал на уроках учитель. Практически сразу на ум приходят наименования следующих кислот: лимонная (80 б.), серная (40 б.), соляная (120 б.), аскорбиновая (200 б.), муравьиная (280 б.), борная (240 б.), уксусная (160 б.), молочная (320 б.).
насколько я помню из курса химии, кислота бывает органическая и неорганическая, жирная, основная и неосновная…
На вопрос про кислоту, в сегодняшней игре большинство игроков ответили так
Серная кислота- 40
Лимонная- 80
Соляная- 120
Уксусная- 160
Аскорбиновая- 200
Борная- 240
Муравьиная- 280
Молочная- 320
Правильные ответы выручат игроков и помогут набрать самое большее количество очков в игре.
Физические свойства кислот — урок. Химия, 8–9 класс.
Агрегатное состояние
При нормальных условиях (при температуре 0°C) кислоты могут быть как твёрдыми веществами, так и жидкостями.
Твёрдым веществом являются ортофосфорная h4PO4, кремниевая h3SiO3, уксусная Ch4COOH, борная h4BO3 и также лимонная кислота.
В жидком агрегатном состоянии находятся серная h3SO4 и азотная кислота HNO3.
Некоторые кислоты вообще не существуют в чистом виде, а представляют собой водные растворы.
Например, при растворении в воде соответствующих газов образуются плавиковая HF, соляная HCl, бромоводородная HBr, иодоводородная HI и сероводородная кислота h3S. В виде разбавленных водных растворов существует сернистая кислота h3SO3.
Цвет
Запах
Некоторые кислоты являются летучими и в концентрированном виде имеют резкий запах.
Например, резкий характерный запах имеют концентрированная азотная и концентрированная соляная кислота. Наверное, ни с чем другим невозможно перепутать характерный запах уксусной кислоты.
Сероводородная кислота h3S имеет специфический «аромат» сероводорода, напоминающий запах тухлых яиц.
Растворимость кислот в воде
В подавляющем большинстве кислоты хорошо растворяются в воде. Практически нерастворимой является кремниевая кислота h3SiO3. Плохо растворяется в воде борная кислота h4BO3.
Правила безопасности при работе с кислотами
Серная, соляная, уксусная кислоты могут вызывать сильные ожоги, разрушать ткани. Поэтому при работе с кислотами необходимо соблюдать особые меры предосторожности.
Обрати внимание!
Если кислота попала на одежду или на поверхность тела, то её необходимо очень быстро смыть большим количеством проточной воды или же нейтрализовать разбавленным нашатырным спиртом.
Если кислота попала на деревянную, металлическую или на другую поверхность, её нейтрализуют известью, мелом или содой.
Кислоты необходимо хранить в хорошо укупоренной посуде и в недоступном для детей месте. Обязательно на таре должна быть этикетка с названием кислоты.
Рис. \(1\). Серная кислота
Серная кислота является более сильной кислотой, чем соляная. Концентрированная серная кислота обугливает сахар, дерево, хлопок, шерсть и вызывает очень глубокие ожоги кожи. При её разбавлении водой выделяется очень большое количество теплоты.
Обрати внимание!
При приготовлении раствора серной кислоты необходимо следовать следующему правилу: кислоту льют в воду тонкой струйкой по стенке стеклянной посуды, но не наоборот.
Рис. \(2\). Правила приготовления раствора серной кислоты
Подагра: симптомы и признаки, диагностика, рекомендации по питанию, лечение подагры при обострении | Сдать анализы на подагру, какой врач ставит диагноз, мочевая кислота при подагре
Подагра – хроническое воспалительное заболевание суставов с периодическими приступами острой боли. Патология связана с отложением солей мочевой кислоты, которые кристаллизируются в тканях и влияют на поражение суставов при подагре. Болезнь характерна для возрастных пациентов, чаще всего подагрой страдают мужчины. В зону поражения попадают суставы пальцев, локтей, кистей, коленей, ступней.
Факторы риска
Среди пациентов, у которых наблюдается симптоматика заболевания, выделяются носители определенных факторов риска. Это:
- наследственная предрасположенность,
- гипертоническая болезнь,
- сахарный диабет,
- злоупотребление вредными привычками, алкоголем,
- чрезмерное употребление нездоровых продуктов питания, переедание.
В последние десятилетия количество пациентов, страдающих подагрой, возросло. Это связано с неправильным питанием, содержанием в рационе продуктов, богатых пуринами, и отсутствием ограничения вредных привычек. Заболевание часто называют «болезнью образа жизни».
Причины подагры
Основная причина заболевания – высокий уровень мочевой кислоты в крови пациента, который носит постоянный устойчивый характер. Образовавшиеся кристаллы откладываются в суставах, органах и тканях, это приводит к медленному разрушению сустава. Большое количество мочевой кислоты обосновано некорректной работой почек, которые либо не справляются с повышенными объемами, либо просто не в силах полноценно ее выводить.
Симптоматика
Подагра часто поражает суставы ног, как правило, сустав большого пальца. Пораженный сустав краснеет и отекает, в нем появляется острая нарастающая боль. Кроме того, существует ряд сопутствующих симптомов:
- лихорадочные явления,
- озноб,
- общее недомогание.
Если заболевание не лечить, острая фаза отступает через несколько дней, однако через какое-то время все возобновляется. Боль и отечность при подагре возникают и исчезают спонтанно. Приступы приходят чаще в ночное время. При отсутствии лечения приступы учащаются, а их длительность увеличивается. Артрит распространяется на новые, еще не пораженные суставы, захватывая ранее здоровые области и ткани. Внешний вид сустава также может претерпевать деформационные изменения.
Диагностика заболевания
Диагноз ставится на основании клинических и лабораторных обследований. В зависимости от выраженности симптоматики, специалист может назначить:
- анализы мочи и крови,
- УЗИ почек,
- рентгенографическое исследование,
- микроскопию синовиальной жидкости,
- КТ области поражения.
При неясной клинической картине назначается сцинтиграфия с пирофосфатом технеция, введение которого и последующее сканирование тканей организма позволяет максимально достоверно определить локализацию воспалительного процесса.
Лечение подагры
Лечение заболевания направлено на предупреждение повторяющихся приступов, препятствие отложению уратов и стимулирование их рассасывания и выведения. Важнейшей частью лечения считается соблюдение специальной диеты, исключающей употребление жирной и жареной пищи. В рационе должны остаться только белое диетическое мясо и рыба, которые готовятся способом варки или тушения. Алкогольные напитки, крепкий чай и кофе полностью исключаются.
Современные препараты позволяют купировать болевой синдром при приступах подагры, при обострении заболевания врач назначает:
- физиолечение,
- ЛФК,
- массажи,
- обезболивающие препараты,
- средства, нормализующие содержание в крови мочевой кислоты.
В особенно запущенных случаях рекомендовано хирургическое лечение – удаление солевых отложений, ограничивающих функциональность суставов.
Важно знать
Поставить правильный диагноз может только профессиональный специалист. Эффективность лечения зависит от того, насколько своевременно проведена диагностика заболевания. Выбор методов лечения и лекарственных препаратов обоснован индивидуальными особенностями пациента и наличием сопутствующих патологий.
Проконсультироваться со специалистом и записаться на прием вы можете, позвонив в нашу клинику или через форму на сайте.
УЗНАТЬ ЦЕНЫ
Почему кофе бывает кислотным
С одной стороны, кислотность — это нормальная характеристика для кофе, так же как и для остальных тропических фруктов и ягод. С другой — кислотность есть не в каждом кофе и из-за этого непонятно, почему в одном кофе кислотность яркая, в другом её вовсе нет и от чего это зависит.
Интенсивность кислотностиИнтенсивность кислотности зависит от четырёх факторов: высоты произрастания кофе, способа обработки зёрен, степени обжарки и приготовления. Теперь по порядку:
Высота произрастания. Чем выше растёт кофе, тем больше перепад дневных и ночных температур и меньше уровень кислорода, из-за этого кофе дольше созревает, в ягоде накапливается больше органических кислот, а само зерно становится плотнее.
В арабике яркая кислотность заложена от природы. В робусте кислоты присутствуют в очень небольших количествах. Такая разница связана с генетическими особенностями самих деревьев, а также с тем, что робуста растёт значительно ниже арабики.
Способ обработки. Кофе мытой обработки получается кислотнее, чем кофе, который обработали натуральным способом. Так происходит потому, что, во-первых, при натуральной обработке больше сахаров из клейковины успевают перейти в зерно, а во-вторых, при разных типах обработки, ферментация бактериями протекает по-разному и это влияет на вкус.
Способы обработки хани, полумытый, вет-халл и палп-нэчурал по влиянию на интенсивность кислотности находятся между мытым и натуральным — кофе получается с умеренной кислотностью.
Степень обжарки. Все вкусоароматические компоненты появляются в кофе в результате химических реакций, которые происходят во время обжарки. Кислотность изначально присутствует в зёрнах, но в не сформированном виде.
Во время обжарки она изменяется, но это происходит не линейно. От старта обжарки и до начала изменения цвета количество кислот увеличивается, затем они развиваются, становятся более комплексными, сложными и сладкими. Начиная со светлой и средней обжарки органические кислоты начинают разрушаться и чем темнее становится обжарка, тем меньше кислотности остаётся в кофе, но повышается его насыщенность и крепость.
Важно обжарить кофе так, чтобы кислотность была сладкой, а не агрессивной и все дескрипторы были максимально раскрыты. При тёмной обжарке разница между дорогим и дешёвым кофе теряется: сложные «энзимные» дескрипторы уходят, остаются только вкусы обжарки и карамелизации. Поэтому, если берут качественное зерно без дефектов и стараются раскрыть его вкусы, кофе обжаривают достаточно светло, а это раскрывает и кислотность.
Приготовление. Компоненты кофе во время приготовления растворяются не одновременно. Первыми растворяются фруктовые и органические кислоты. Затем — лёгкие компоненты, которые придают кофе вкус шоколада, ванили и карамели. В конце растворяются тяжёлые компоненты: табак, солод, дерево и другие.
Если, например, уменьшить время приготовления, увеличить помол или снизить температуру — уменьшить общий процент экстракции, то кислотность проявится ярче. Из-за этого в эспрессо кофе всегда получается с более выраженной кислотностью, и чтобы сделать напиток более сбалансированным, кофе для эспрессо обжаривают чуть темнее и по другим профайлам. Такой кофе в нашем каталоге отмечен голубыми наклейками, а кофе, подходящий для всех остальных способов приготовления, — зелёными.
Виды и качество кислотностиКислотность — это основа вкусового богатства кофе. Но во вкусе важна не интенсивность кислотности, а её качество. Кислотность бывает четырёх типов:
- ортофосфорная,
- уксусная,
- яблочная,
- цитрусовая.
Чаще всего в кофе присутствуют все четыре типа кислотности в разных пропорциях, кроме ортофосфорной. Она встречается в робусте и некоторых типах арабик, которые растут на почвах с высоким содержанием фосфатов. Например, в Кении.
Уксусная кислота для кофе — это не очень хорошо. Часто она возникает из-за неправильной, слишком долгой ферментации кофе.
Яблочная и цитрусовая кислоты — это как раз основа сложного вкусового букета. Эти кислоты отвечают за вкус яблок, ягод, апельсина и других фруктов.
Если на каппинге кофе ставят высокую оценку, это необязательно значит, что этот кофе самый кислотный. Оценивают именно её сложность и качество. Она может напоминать джем из смородины, сладкий апельсин или спелое зелёное яблоко.
В итогеКислотность — совершенно нормальная характеристика вкуса. Её интенсивность зависит от высоты плантации, способа обработки и степени обжарки.
Если вы и обнаружили, что ваш кофе кислотный, постарайтесь его распробовать и найти в нём знакомые вкусы. Если делать так регулярно, ваш вкусовой опыт будет расти, и каждый раз вы будете находить всё новые и новые ноты.
Главное, чтобы в кофе не было ярко выраженной горечи. Кофе должен быть сладким и кислотным.
менее 1 года: 0,35 — 2,0, 1 — 4 года: 4 — 8 лет: 8 — 14 лет: >14 лет: | ммоль/сутки | Причины повышенной концентрации мочевой кислоты в моче: Причины пониженной концентрации мочевой кислоты в моче: Что может влиять на результат? Ложнозавышенному результату способствуют: К ложнозаниженному результату могут приводить: |
Влияние золедроновой кислоты на частоту костных осложнений у больных с костными метастазами
РАЗ В 3 МЕСЯЦА – НОВЫЙ РЕЖИМ ВВЕДЕНИЯ ЗОЛЕДРОНОВОЙ КИСЛОТЫ У БОЛЬНЫХ С КОСТНЫМИ МЕТАСТАЗАМИ?
03.01.2017 – В течении 2-х лет введение Золедроновой кислоты раз в 3 месяца равноэффективно (=) ежемесячному введению [Andrew L. Himelstein et al. – JAMA, 2017].
26.01.2017 — Поддерживающий режим Золедроновой кислоты 1 раз в 3 месяца равноэффективен (=) ежемесячному, у больных получающим терапию бисфосфонатами в течении года и более [Gabriel N. Hortobagyi et al. – JAMA, 2017 ].
ВВЕДЕНИЕ ЗОЛЕДРОНОВОЙ КИСЛОТЫ РАЗ В 3 МЕСЯЦА РАВНОЭФФЕКТИВНО ЕЖЕМЕСЯЧНОМУ ВВЕДЕНИЮ
Влияние золедроновой кислоты на частоту костных осложнений у больных с костными метастазами при стандартном режиме и назначении каждые 12 недель (Andrew L. Himelstein et al. – JAMA, 2017).
В рандомизированное исследование включено 1822 больных метастатическим РМЖ, метастатическим раком предстательной железы и множественной миеломой, из них 795 больных получали Золедроную кислоту в течение 2-х лет и завершили исследование.
Среди 29,5% пациентов, получавших золедроновую кислоту (ЗК) каждые 4 недели, и 28,6% пациентов, получавших ЗК каждые 12 недель, выявлено, по меньшей мере, одно костное осложнение, что доказывает отсутствие преимущества более частого назначения ЗК.
Актуальность: Золедроновая кислота относится к 3-му поколению аминобисфосфонатов и предназначена для снижения частоты костных осложнений, в том числе, болевого синдрома. Однако, оптимальный интервал длительного применения однозначно не определен.
Целью исследования являлось выявление преимуществ назначения золедроновой кислоты (ЗК) при введении 1 раз в 12 недель и 1 раз в 4 недели.
Материал и методы:
- Исследование проводилось в 269 клинических центрах США в период с мая 2009 года по апрель 2012 года; наблюдение проводилось до апреля 2014 года.
- Включено 1822 пациента с костными метастазами РМЖ, рака предстательной железы и множественной миеломой.
- Пациенты были рандомизированы в 2 группы: первой вводили внутривенно ЗК каждые 4 недели (n=911), во второй – 1 раз в 12 недель (n=911).
- Продолжительность терапии ЗК составила 2 года.
- Первичной конечной точкой являлась доля пациентов, по крайней мере, с одним костным осложнением на фоне лечения.
- Межгрупповая разница в 7% определялась как показатель преимущества.
- Вторичные конечные точки — доля пациентов с болевым синдромом, функциональный статус ECOG (диапазон 0-4), частота остеонекроза челюсти, нарушение функции почек, костные осложнения (среднее количество костных осложнений за год), подавление метаболизма костной ткани.
- Среди 1822 пациентов рандомизированных (средний возраст 65 лет) — 980 (53,8%) женщин.
- Через 2 года из 1822 больных (855 больных РМЖ, 689 больных раком простаты и 278 больных с множественной миеломой) — 795 больных завершили исследование.
Результаты:
- По меньшей мере, одно костное осложнение в течении 2-х лет отмечалось у 29,5% (260 пациентов) в группе 12-недельного назначения ЗК и у 28,6% (253 пациентов) в группе 4-недельного назначения ЗК, (р<0,001)
- Частота боли, ухудшение функционального статуса, частота остеонекроза челюсти, нарушение функции почек достоверно не отличались между группами. Прогрессирование в костях также численно не различалось, однако, метаболизм костной ткани был выше у пациентов, получавших ЗК раз в 12 недель.
У больных костными метастазами рака молочной железы, раком предстательной железы и множественной миеломой, применение золедроновой кислоты каждые 12 недель по сравнению со стандартным интервалом в 4 недели в течение 2-х лет не приводило к увеличению риска костных осложнений. По мнению авторов длительность интервала введения золедроновой кислоты в 12 недель может быть приемлемым вариантом лечения.
ПОДДЕРЖИВАЮЩИЙ РЕЖИМ ЗОЛЕДРОНОВОЙ КИСЛОТЫ 1 РАЗ В 3 МЕСЯЦА РАВНОЭФФЕКТИВЕН ЕЖЕМЕСЯЧНОМУ У БОЛЬНЫХ, ПОЛУЧАЮЩИМ ТЕРАПИЮ БИСФОСФОНАТАМИ В ТЕЧЕНИИ ГОДА И БОЛЕЕ
Рандомизированное клиническое исследование OPTIMIZE-2:
«Сравнение эффективности введения Золедроновой кислотой каждые 12 недель или каждые 4 недели у больных с костными метастазами РМЖ, получающим терапию бисфосфонатами в течении года и более» (Gabriel N. Hortobagyi et al. – JAMA, 2017).
- В данном рандомизированном клиническом исследовании, включающим сведения о 416 больных с костными метастазами РМЖ, получающим терапию бисфосфонатами в течении года и более, дальнейшее введение золедроновой кислоты каждые 12 недель не уступало по эффективности ежемесячному введению.
Актуальность: Золедроновая кислота назначается пациентам с костными метастазами для снижения риска осложнений со стороны костной системы. Однако в последнее время возникают опасения по поводу ее длительного назначения, обусловленными вероятностью осложнений терапии бисфосфонатами, включая остеонекроз челюсти.
Целью исследования являлось сравнение эффективности золедроновой кислоты при введении 1 раз в 12 недель и 1 раз в 4 недели у больных метастатическим РМЖ с метастазами в кости, получающих длительную терапию бисфосфонатами.
Материалы и методы:
- OPTIMIZE-2 — проспективное, рандомизированное, двойное слепое, многоцентровое исследование 3 фазы.
- Рандомизация 1: 1 — в первой группе назначалась золедроновая кислота 4,0 мг в/в каждые 4 недели, второй группе — каждые 12 недель с плацебо каждые 4 недели; длительностью 1 год.
- Исследование проводилось в 102 клинических центрах США с 3 марта 2006 года по 25 июля 2013 г.
- Анализ данных проводился с 7 октября 2013 г. по 24 марта 2014 г.
- В исследование было включено 416 женщин (≥18 лет) с костными метастазами РМЖ, которые ранее получали 9 или более доз золедроновой кислоты и / или памидронат в течение первых 10 — 15 месяцев терапии.
- Первичной конечной точкой являлась доля пациентов с одним или более костными осложнениями.
- Вторичными конечными точками — время до первого костного осложнения или прогрессирование в костях.
Результаты:
- Рандомизировано в общей сложности 416 женщин: 200 больных получали золедроновую кислоту каждые 4 недели (средний возраст 59,2 лет; 173 [86,5%] — европеидной расы), 203 пациента — каждые 12 недель (средний возраст 58.6 лет; 178 [87,7%]- европеидной расы), и 13 пациентов получали плацебо (средний возраст 60,8 лет; 13 [100%]- европеоидной расы). Исходные характеристики обеих групп были сопоставимыми.
- Через год наблюдения, костные осложнения произошли у 44 пациентов (22,0%) в первой группе и у 47 пациентов (23,2%) во второй.
- Время до первого нежелательного явления, связанного с метастазами в костях, статистически не отличалось между обеими группами (отношение рисков [ОР] 1,06; 95%ДИ 0.70-1.60; р=0,79).
- Среднее значение прогрессирования в костях составило 0,46 (1,06) в первой группе и 0,50 (1,50) случаев в год во второй (р=0,85).
- Профиль токсичности также был сопоставим, у 189 пациентов (95,5%) в первой группе отмечалась та или иная токсичность, и у 189 (93,5%) больных – во второй.
По мнению авторов ведение золедроновой кислоты в поддерживающем режиме 1 раз в 12 недель не уступает в эффективности и безопасности по сравнению с введением 1 раза в 4 недели у больных метастатическим РМЖ, получавших длительную терапию бисфосфонатами.
Источники:
- Andrew L. Himelstein et al. Effect of Longer-Interval vs Standard Dosing of Zoledronic Acid on Skeletal Events in Patients With Bone Metastases. JAMA. 2017;317(1):48-58.
- http://jamanetwork.com/journals/jama/article-abstract/2595526
- Gabriel N. Hortobagyi et al. Continued Treatment Effect of Zoledronic Acid Dosing Every 12 vs 4 Weeks in Women With Breast Cancer Metastatic to Bone. JAMA Oncol. Published online January 26, 2017.
- http://jamanetwork.com/journals/jamaoncology/article-abstract/2598744
Материал подготовила: Латипова Дилором Хамидовна, врач-онколог, к.м.н., научный сотрудник Научного отдела инновационных методов терапевтической онкологии и реабилитации.
10 Обычные кислоты и химические структуры
ThoughtCo / Хилари Эллисон
Вот список из десяти распространенных кислот с химическим строением. Кислоты — это соединения, которые диссоциируют в воде, отдавая ионы / протоны водорода или принимая электроны.
Уксусная кислота
Уксусная кислота также известна как этановая кислота. ЛАГУНА ДИЗАЙН / Getty Images Уксусная кислота: HC 2 H 3 O 2
Также известна как этановая кислота, Ch4COOH, AcOH.
Уксусная кислота содержится в уксусе. Уксус содержит от 5 до 20 процентов уксусной кислоты. Эта слабая кислота чаще всего встречается в жидкой форме. Чистая уксусная кислота (ледяная) кристаллизуется при температуре чуть ниже комнатной.
Борная кислота
Это химическая структура борной кислоты: бор (розовый), водород (белый) и кислород (красный). ЛАГУНА ДИЗАЙН / Getty Images Борная кислота: H 3 BO 3
Также известна как: acidum boricum, водород ортоборат.
Борная кислота может использоваться как дезинфицирующее средство или пестицид.Обычно это белый кристаллический порошок. Бура (тетраборат натрия) — знакомое родственное соединение.
Угольная кислота
Это химическая структура угольной кислоты. ЛАГУНА ДИЗАЙН / Getty Images Угольная кислота: CH 2 O 3
Также известна как: воздушная кислота, кислота воздуха, дигидрокарбонат, кигидроксикетон.
Растворы углекислого газа в воде (газированная вода) можно назвать угольной кислотой. Это единственная кислота, которая выделяется легкими в виде газа.Угольная кислота — слабая кислота. Он отвечает за растворение известняка с образованием геологических объектов, таких как сталагмиты и сталактиты.
Лимонная кислота
Лимонная кислота — это слабая кислота, которая содержится в цитрусовых и используется в качестве натурального консерванта и для придания кислого вкуса. Атомы представлены в виде сфер и имеют цветовую маркировку: углерод (серый), водород (белый) и кислород (красный). ЛАГУНА ДИЗАЙН / Getty ImagesЛимонная кислота: H 3 C 6 H 5 O 7
Также известна как: 2-гидрокси-1,2,3-пропантрикарбоновая кислота.
Лимонная кислота — это слабая органическая кислота, получившая свое название из-за того, что она является натуральной кислотой цитрусовых. Это химическое вещество является промежуточным звеном в цикле лимонной кислоты, который играет ключевую роль в аэробном метаболизме. Кислота широко используется в качестве ароматизатора и подкислителя в пищевых продуктах. Чистая лимонная кислота имеет острый терпкий вкус.
соляная кислота
Это химическая структура соляной кислоты: хлор (зеленый) и водород (белый). ЛАГУНА ДИЗАЙН / Getty ImagesСоляная кислота: HCl
Также известна как морская кислота, хлороний, солевой спирт.
Соляная кислота — это чистая, сильно коррозионная сильная кислота. Он находится в разбавленном виде как соляная кислота. Это химическое вещество имеет множество промышленных и лабораторных применений. Соляная кислота для промышленных целей обычно составляет от 20 до 35 процентов соляной кислоты, в то время как соляная кислота для бытовых целей составляет от 10 до 12 процентов соляной кислоты. HCl — это кислота, содержащаяся в желудочном соке.
Плавиковая кислота
Это химическая структура плавиковой кислоты: фтор (голубой) и водород (белый).ЛАГУНА ДИЗАЙН / Getty Images Плавиковая кислота: HF
Также известна как: фтористый водород, гидрофторид, монофторид водорода, фтористоводородная кислота.
Хотя фтористоводородная кислота очень агрессивна, она считается слабой кислотой, потому что она обычно не диссоциирует полностью. Кислота поедает стекло и металлы, поэтому HF хранится в пластиковых контейнерах. При попадании на кожу фтористоводородная кислота проходит через мягкие ткани и поражает кости. HF используется для производства соединений фтора, включая тефлон и прозак.
Азотная кислота
Это химическая структура азотной кислоты: водород (белый), азот (синий) и кислород (красный). ЛАГУНА ДИЗАЙН / Getty Images Азотная кислота: HNO 3
Также известна как: aqua fortis, азотовая кислота, гравировальная кислота, нитроспирт.
Азотная кислота — сильная минеральная кислота. В чистом виде это бесцветная жидкость. Со временем он приобретает желтый цвет в результате разложения на оксиды азота и воду. Азотная кислота используется для изготовления взрывчатых веществ и чернил, а также в качестве сильного окислителя для промышленного и лабораторного использования.
щавелевая кислота
Это химическая структура щавелевой кислоты. Тодд ХелменстайнЩавелевая кислота: H 2 C 2 O 4
Также известны как этандиовая кислота, оксалат водорода, этандионат, ацидум щавелевый, HOOCCOOH, оксировая кислота.
Свое название щавелевая кислота получила потому, что впервые была выделена в виде соли из щавеля ( Oxalis sp.). Кислоты относительно много в зеленой, листовой пище. Он также содержится в чистящих средствах для металла, антикоррозионных средствах и некоторых типах отбеливателей.Щавелевая кислота — слабая кислота.
фосфорная кислота
Фосфорная кислота также известна как ортофосфорная кислота или фосфорная (V) кислота. Бен Миллс Фосфорная кислота: H 3 PO 4
Также известна как ортофосфорная кислота, тригидрофосфат, ацидум фосфор.
Фосфорная кислота — это минеральная кислота, которая используется в бытовых чистящих средствах в качестве химического реагента, ингибитора ржавчины и зубного травителя. Фосфорная кислота также является важной кислотой в биохимии.Это сильная кислота.
Серная кислота
Это химическая структура серной кислоты. Серная кислота: H 2 SO 4
Также известна как: аккумуляторная кислота, кислота для окунания, матирующая кислота, Terra Alba, купоросное масло.
Серная кислота — это сильная минеральная кислота, вызывающая коррозию. Хотя обычно прозрачный или слегка желтоватый, он может быть окрашен в темно-коричневый цвет, чтобы привлечь внимание людей к его составу. Серная кислота вызывает серьезные химические ожоги, а также термические ожоги в результате экзотермической реакции дегидратации.Кислота используется в свинцовых батареях, очистителях стоков и химическом синтезе.
Ключевые моменты
- Кислоты обычны в повседневной жизни. Они находятся в клетках и пищеварительной системе, естественным образом встречаются в продуктах питания и используются во многих обычных химических реакциях.
- Общие сильные кислоты включают соляную кислоту, серную кислоту, фосфорную кислоту и азотную кислоту.
- Общие слабые кислоты включают уксусную кислоту, борную кислоту, фтористоводородную кислоту, щавелевую кислоту, лимонную кислоту и угольную кислоту.
Смотри: Узнайте о кислотных реакциях
Какая кислота у вас в желудке? | Здоровое питание
Кимберли Ансира Обновлено 14 декабря 2018 г.
Кислота в вашем желудке — это бесцветная водянистая пищеварительная жидкость, основная цель которой — расщепление пищи. С химической точки зрения это кислотный раствор с pH от 1 до 3, состоящий в основном из соляной кислоты или HCl. Во время процесса пищеварения желудочная кислота — или желудочная кислота — убивает бактерии и помогает расщеплять пищу на очень мелкие частицы питательных веществ и веществ, которые могут всасываться через стенки кишечника и, в конечном итоге, попадать в кровоток.
Желудочные соки
Проглоченная пища смешана с желудочными соками, содержащими ферменты, воду и HCl. В среднем желудок человека вырабатывает от 2 до 3 литров желудочного сока в день. Желудочный сок имеет высокую концентрацию HCl, которая вырабатывается париетальными клетками желудка. Сильно кислая среда в желудке заставляет белки пищи терять свою характерную складчатую структуру и становиться денатурированными, что обнажает их пептидные связи и облегчает их переваривание.
Основные функции HCI
В желудке основная функция HCl — поддерживать стерильную среду и инициировать превращение пепсиногена в пепсин. HCI активирует фермент пепсин, который помогает переваривать белки, разрывая аминокислотные связи, и разрушает соединительные ткани и стенки растительных клеток. Он также преобразует проглоченные ионы трехвалентного железа в ионы двухвалентного железа, которые используются для синтеза гемоглобина. А HCl способствует устойчивости к болезням, уничтожая большинство проглоченных патогенов и бактерий, содержащихся в продуктах, которые вы едите.
Защита от кислоты
Ваш желудок защищен тремя способами от резкой кислой и ферментативной среды, которую он создает. Он производит слизистую оболочку, густую и очень щелочную слизь, которая сопротивляется действию кислоты и ферментов. Плотные соединения между эпителиальными клетками препятствуют просачиванию желудочного сока между ними и перевариванию соединительной ткани. И, наконец, каждые три-шесть дней желудок быстро пополняет запасы эпителиальных клеток. Нарушение любой из этих защитных мер может привести к воспалению и язвенной болезни.
Низкое производство кислоты
Проблемы с пищеварением часто связаны с дефицитом продукции HCl или пищеварительных ферментов или того и другого. По словам зарегистрированного диетолога Джоан Ларсен, люди с гипогидрохлорией — меньшим, чем обычно, количеством кислоты — или ангидрохлорием — без кислоты — будут испытывать непереносимость некоторых продуктов, потому что им не хватает кислоты для химического переваривания пищи. Недостаток HCl в желудке приведет к неполному превращению белков в аминокислоты.Те, кому не хватает кислоты, могут испытывать такие симптомы, как изжога, газы, вздутие живота, запор и несварение желудка.
Кислоты — Вводная химия — 1-е канадское издание
Цели обучения
- Определить кислота .
- Назовите простую кислоту.
Есть еще одна важная для нас группа соединений — кислоты — и эти соединения обладают интересными химическими свойствами. Первоначально мы определим кислоту как ионное соединение катиона H + , растворенное в воде.(Мы расширим это определение в главе 12 «Кислоты и основания».) Чтобы указать, что что-то растворено в воде, мы будем использовать метку фазы (aq) рядом с химической формулой (где aq означает «водный», a слово, описывающее что-то растворенное в воде). Если в формуле нет этой метки, то соединение рассматривается как молекулярное соединение, а не как кислота.
Кислоты имеют собственную систему номенклатуры. Если кислота состоит только из водорода и еще одного элемента, ее имя будет гидро- + основа другого элемента + -ная кислота .Например, соединение HCl (водн.) Представляет собой соляную кислоту, а H 2 S (водн.) Представляет собой сероводородную кислоту. (Если бы эти кислоты не растворялись в воде, эти соединения назывались бы хлористым водородом и сероводородом соответственно. Оба эти вещества хорошо известны как молекулярные соединения; однако при растворении в воде они рассматриваются как кислоты.)
Если соединение состоит из ионов водорода и многоатомного аниона, то название кислоты происходит от основы названия многоатомного иона.Обычно, если название аниона заканчивается на -ат, название кислоты является основой названия аниона плюс -овая кислота ; если название связанного аниона оканчивается на -ite, название соответствующей кислоты является основой названия аниона плюс -лярная кислота . В Таблице 3.9 «Названия и формулы кислот» перечислены формулы и названия различных кислот, с которыми вам следует знать. Вы должны узнать большинство анионов в формулах кислот.
Таблица 3.9 Названия и формулы кислот
| Формула | Имя |
|---|---|
| HC 2 H 3 O 2 | уксусная кислота |
| HClO 3 | хлорная кислота |
| HCl | соляная кислота |
| HBr | кислота бромистоводородная |
| HI | иодоводородная кислота |
| HF | фтористоводородная кислота |
| HNO 3 | азотная кислота |
| H 2 C 2 O 4 | щавелевая кислота |
| HClO 4 | хлорная кислота |
| H 3 PO 4 | фосфорная кислота |
| H 2 SO 4 | серная кислота |
| H 2 SO 3 | сернистая кислота |
| Примечание. Метка «aq» опущена для ясности. | |
Пример 10
Назовите каждую кислоту, не консультируясь с таблицей 3.9 «Названия и формулы кислот».
- HBr
- H 2 SO 4
Решение
- Как бинарная кислота, название кислоты — гидро- + название основы + -овая кислота . Поскольку эта кислота содержит атом брома, она называется бромистоводородной кислотой.
- Поскольку эта кислота является производным сульфат-иона, название кислоты является основой названия аниона + -ic acid .Название этой кислоты — серная кислота.
Проверьте себя
Назовите каждую кислоту.
- HF
- HNO 2
Ответы
- плавиковая кислота
- азотистая кислота
Все кислоты обладают схожими свойствами. Например, кислоты имеют кислый вкус; Фактически, кислый вкус некоторых наших продуктов, таких как цитрусовые и уксус, вызван присутствием кислот в пище.Многие кислоты реагируют с некоторыми металлическими элементами с образованием ионов металлов и элементарного водорода. Кислоты заставляют определенные растительные пигменты менять цвет; действительно, созревание некоторых фруктов и овощей происходит из-за образования или разрушения избытка кислоты в растении. В главе 12 «Кислоты и основания» мы исследуем химическое поведение кислот.
Кислоты очень распространены в окружающем нас мире. Мы уже упоминали, что цитрусовые содержат кислоту; среди других соединений они содержат лимонную кислоту, H 3 C 6 H 5 O 7 (водн.).Щавелевая кислота, H 2 C 2 O 4 (водн.), Содержится в шпинате и других зеленолистных овощах. Соляная кислота не только содержится в желудке (желудочная кислота), но также может быть куплена в строительных магазинах в качестве очистителя для бетона и кирпичной кладки. Фосфорная кислота входит в состав некоторых безалкогольных напитков.
Основные выводы
- Кислота — это соединение иона H + , растворенное в воде. У
- Acids есть собственная система наименования.
- Кислоты обладают определенными химическими свойствами, которые отличают их от других соединений.
Упражнения
Приведите формулу каждой кислоты.
а) хлорная кислота
б) иодоводородная кислота
2. Приведите формулу каждой кислоты.
а) сероводородная кислота
б) фосфористая кислота
3. Назовите каждую кислоту.
а) HF (водн.)
б) HNO 3 (водн.)
c) H 2 C 2 O 4 (водн.)
4.Назовите каждую кислоту.
а) H 2 SO 4 (водн.)
б) H 3 PO 4 (водн.)
в) HCl (водн.)
5. Назовите кислоту, содержащуюся в пище.
6 Назовите некоторые общие свойства кислот.
ответы
1.
а) HClO 4 (водн.)
б) HI (водн.)
3.
а) фтористоводородная кислота
б) азотная кислота
в) щавелевая кислота
5.
щавелевая кислота (ответы могут быть разными)
Соляная кислота — обзор
8.1.2.2 Коррозия в присутствии газообразных соединений хлора
Присутствие соляной кислоты или молекулярного хлора в газовой фазе значительно увеличивает скорость коррозии стали. Скорость, обнаруженная в установках для сжигания отходов, достигает 1000 нм / ч. Исследования [17] доказывают, что при отсутствии HCl образуется прочный прочный защитный слой. По концентрации HCl 0.1% на поверхности Fe 2 O 3 (гематит) образуются пузырьки, которые, тем не менее, не влияют на целостность защитной оксидной окалины. Однако концентрация HCl в дымовых газах 0,8% полностью нарушает целостность слоя гематита, а слой магнетита (Fe 3 O 4 ) становится неравномерным и пористым. Приблизительно 2% соляной кислоты в дымовых газах разрушают оба слоя. Когда рассматриваются окислительные условия, эти явления часто называют активным окислением, катализируемым присутствием хлора.Влияние летучих соединений хлора на высокотемпературную коррозию различных сплавов было предметом ряда исследований [6,11,12,14,19,23]. Результаты исследований однозначно указывают на то, что летучие соединения хлора разрушают защитный оксидный слой и тем самым разрушают саму металлическую поверхность. Анализируемые механизмы основаны в основном на исследованиях HCl, Cl 2 и паров NaCl.
Газовая коррозия металлов может быть вызвана некоторыми соединениями, содержащими хлор, но чаще всего HCl и в меньшей степени Cl 2 .Первый преобладает в условиях котла, поскольку дымовой газ содержит водяной пар. Cl 2 , однако, может образовываться в восстановительных условиях при термическом разложении HCl [6].
Если сталь подвергается воздействию окислительной атмосферы, образуются стабильные оксиды, слой которых постепенно уменьшает диффузию кислорода к металлической поверхности. Таким образом, окисление происходит по так называемому параболическому закону (постепенное уменьшение интенсивности во времени).
Тем не менее, хлор демонстрирует способность проникать через защитный слой оксидов.Он диффундирует через слой, проходит через щели или поры слоя окалины, пока не достигнет поверхности металла, и вступает с ней в реакцию с образованием хлоридов. На границе окалины и металла очень низкий кислородный потенциал. Это соответствует низкому парциальному давлению O 2 , поскольку кислород расходуется на образование оксидов. Такие условия способствуют термической стабильности хлоридов FeCl 2 и CrCl 2 (рис. 8.1). Летучая HCl и Cl 2 реагируют с металлами с образованием хлоридов в соответствии с реакцией (8.9). Кроме того, металлы могут напрямую реагировать с HCl в соответствии с реакцией (8.10). Хлориды металлов демонстрируют высокие парциальные давления своих паров на границе окалина-поверхность металла, и поэтому их постоянная сублимация возможна в соответствии с реакцией (8.11)
(8.9) M (s) + Cl2 (g) → MCl2 (s)
(8,10) M (т) + 2HCl (г) → MCl2 (г) + h3 (г)
(8,11) MCl2 (т) → MCl2 (г)
где M = Fe, Cr, Ni и ( s), (g) обозначают твердую и газообразную фазы соответственно.
Образующиеся таким образом летучие хлориды металлов могут диффундировать от металлической поверхности к слою окалины.Концентрация кислорода, возрастающая по мере удаления от металлической поверхности, способствует снижению термодинамической стабильности хлоридов и их окислению в твердые оксиды. Тем не менее оксиды, выделяемые из газовых фаз, образуют очень рыхлый слой осаждения, который не защищает трубы от коррозии. В этом случае хлорная коррозия протекает по линейному правилу — линейное увеличение во времени.
(8,12) 3MCl2 (г) + 2O2 (г) → M3O4 (т) + 3Cl2 (г)
(8,13) 2MCl2 (г) + (3/2) O2 (г) → M2O3 (т) + 2Cl2 (g)
В результате реакций (8.12) и (8.13), хлор выделяется и диффундирует в дымовой газ или возвращается к металлической поверхности и запускает следующий цикл. Графическое изображение этого механизма показано на рис. 8.2 [18]. Цикл постепенно перемещает материал с металлической поверхности в зону повышенной концентрации кислорода, и конечный расход хлоридов остается низким. Конечная реакция проходит в соответствии с:
Рисунок 8.2. Схема коррозии от летучих соединений хлора [18].
(8.14) 4M (s) + 3O2 (g) → 2M2O3 (s)
Было также обнаружено, что газообразные соединения хлора могут проникать по границам зерен стали, что называется межкристаллитной коррозией.
В восстановительной среде, где оксиды отсутствуют или нестабильны, хлориды металлов могут образовываться непосредственно на поверхности трубы в соответствии с формулой. (8.9). Скорость хлорной коррозии сильно (экспоненциально) зависит от температуры и теоретически [19] может возрасти примерно в 80 раз при повышении температуры с 300 до 450 ° C.В действительности такой сильной коррозии не наблюдается, поскольку хлоридная коррозия определяется не только кинетикой реакции, но также в большей степени газовой диффузией через зазоры в отложениях и окалине. Поэтому свойства отложений могут иметь большее значение, чем градиенты температуры и парциального давления. Кроме того, скорость коррозии зависит от процесса испарения хлоридов металлов, который также является функцией температуры.
Вышеупомянутые процессы настолько сложны, что, несмотря на ряд исследований, нет единого подхода в их описании.Хлорная коррозия — это сложное взаимодействие реакций, которые регулируются кинетикой, диффузией и фазовым переходом, включая конденсацию, плавление, сублимацию и испарение. Согласно исх. Согласно [20] скорость коррозии определяется зависимостью между скоростью химической реакции и скоростью испарения образующихся хлоридов. При температурах дымовых газов ниже 500 ° C образуется защитный слой хлорида железа, скорость коррозии регулируется параболическим законом и со временем уменьшается. Для более высоких температур скорость коррозии сначала следует параболическому закону, а затем линейному правилу.Это происходит в результате повышения температуры, так как отложения хлоридов становятся более толстыми. Следовательно, достигается определенная толщина, при которой скорости осаждения и испарения находятся в равновесии, и осадок не растет. При температурах, превышающих 800 ° C, увеличения слоя хлоридов недостаточно для покрытия испарения, и скорость коррозии подчиняется линейному закону.
Усиление коррозии железа может быть вызвано образованием легкоплавкого хлорида железа FeCl 3 по реакции:
(8.15) FeCl2 + HCl + (1/4) O2 → FeCl3 + (1/2) h3O
В восстановительной атмосфере HCl может реагировать с CO и H 2 , поражая оксидный слой [9]:
(8.16) Fe2O3 + 2 HCl + CO → FeO + FeCl2 + h3O + CO2
(8.17) Fe3O4 + 2 HCl + CO → 2FeO + FeCl2 + h3O + CO2
Дополнительным источником разрушения, которое происходит при образовании твердых хлоридов, является механическое напряжение связано с увеличением объема FeCl 2 по сравнению с объемом железа.
HCl и Cl 2 из-за повреждения защитных слоев могут ускорить другие виды газовой коррозии, например.грамм. коррозия, вызванная серой.
Типичная картина коррозии газообразными соединениями хлора выглядит следующим образом: темный многослойный осадок оксидов, слабо приставший к трубке. Его толщина составляет около 0,1-0,3 мм. При удалении открывается тонкий коричневатый слой, который непосредственно прилипает к поверхности трубки. В конкретном случае испарителя слой отложений обычно тонкий, однако он может быть толще, если коррозия такого рода происходит на трубках пароперегревателя.
Из лабораторных исследований, приведенных в [5].[21], можно сделать вывод, что быстрый рост оксидного слоя из-за воздействия хлора может также происходить, когда соединения хлора отсутствуют на металлической поверхности. Поэтому всегда следует учитывать воздействие хлора и хлоридов, если накипь на трубках отслоилась и отслоилась.
Что такое соляная кислота? Это опасно?
Кислота получает плохую репутацию — когда мы слышим это слово, мы часто представляем себе чан с плотоядной лимонно-зеленой жидкостью. Но кислоты всех видов, включая соляную, имеют массу практических применений, и не только для суперзлодеев! Домовладельцы, кожевники и даже производители жемчуга ежедневно используют соляную кислоту.
Это руководство расскажет, что такое соляная кислота, некоторые ее общие применения и способы безопасного обращения.
Соляная кислота отлично подходит для чистящих средств в тяжелых условиях.
Что такое соляная кислота?
Неудивительно, что соляная кислота является разновидностью кислоты. Кислоты — это не просто опасные жидкости, с которыми нужно работать в толстых перчатках (хотя некоторые таковы!) — технически кислота — это что-нибудь с pH 7 или ниже. Сюда входят уксус и все цитрусовые, а также некоторые знакомые кислоты, о которых вы, возможно, слышали, например, соляная кислота или щавелевая кислота, которые содержатся в разрыхлителе и некоторых отбеливателях.
Кислоты имеют множество практических применений, в том числе для уборки дома или для придания вкуса еде или напиткам. Coca Cola имеет pH около 2,5, что делает ее гораздо более кислой, чем вы ожидаете от того, что мы потребляем ежедневно! И хотя основания и кислоты могут использоваться для противодействия друг другу, потребление основания может быть столь же опасным, как потребление кислоты ; щелок, очиститель канализации и нашатырный спирт — все это основания, которые могут быть довольно опасными.
Так как насчет соляной кислоты? Соляная кислота — это форма соляной кислоты, pH которой составляет примерно от 1 до 2. Единственная разница между соляной кислотой и соляной кислотой заключается в чистоте — соляная кислота разбавлена примерно до 14,5–29 процентов и часто содержит примеси. как железо. Эти примеси делают соляную кислоту более желтой, чем чистая соляная кислота.
Хотя соляная кислота по-прежнему обладает высокой коррозионной активностью, она мягче, чем соляная кислота, и поэтому больше подходит для домашнего использования.
При pH от 1 до 2 соляная кислота может быть такой же кислой, как желудочная кислота (которая также частично состоит из соляной кислоты) или лимонный сок. Однако уровень pH не является единственным фактором, определяющим его коррозионную активность.
Несмотря на то, что иногда он имеет такую же кислотность, как лимонный сок, нанесение соляной кислоты на кожу всегда опаснее, чем лимонный сок. Лимонный сок содержит от пяти до шести процентов лимонной кислоты, тогда как соляная кислота может содержать от 14 до 31 процента кислоты. Таким образом, помимо того, что соляная кислота имеет более низкий pH и, следовательно, более кислый состав, она также более концентрирована, чем лимонный сок. — поэтому соляная кислота может легко обжечь голую кожу, а лимонный сок — вряд ли.
Вот почему всегда важно использовать защитное снаряжение, если вы работаете с соляной кислотой, даже если она разбавлена, но не столько с лимонами.
Возможно, вы не захотите использовать соляную кислоту для повседневной очистки, но это может быть полезно!
Каковы виды использования соляной кислоты?
Соляная кислота имеет множество применений, многие из которых являются промышленными. Как кислота, многие из ее применений заключаются в очистке или удалении одного вещества с другого.Некоторые распространенные применения соляной кислоты:
- Обработка кожевенного сырья
- Удаление железа и ржавчины со стали
- Удаление внешней части жемчуга
- Бытовая уборка (подвалы и туалеты с минеральными пятнами)
- Очистка кирпичей
- Очистка забитых стоков
Хотя он может быть не таким концентрированным, как некоторые кислоты, при работе с соляной кислотой все же необходимо защитное снаряжение.
Как безопасно использовать соляную кислоту
Несмотря на бесчисленное множество практических применений, важно помнить, что соляная кислота по-прежнему является производным соляной кислоты, потенциально опасного вещества при неправильном обращении. Всегда соблюдайте правила техники безопасности при использовании соляной кислоты, например:
Носить защитную одежду
Соляная кислота может быть менее концентрированной, чем соляная кислота, но она все еще способна вызывать ожоги кожи и глаз. Всегда надевайте защитную одежду при работе с соляной кислотой, включая длинные рукава, брюки, перчатки и защитные очки или очки. Независимо от того, для чего вы используете соляную кислоту, брызги или ветер могут вызвать попадание жидкости на вашу кожу, поэтому одевайтесь соответствующим образом.
Добавьте кислоту в воду
Если вы еще больше разбавляете соляную кислоту, всегда вливайте кислоту в воду, а не наоборот . Добавление воды к кислоте может вызвать химическую реакцию, в результате которой жидкость будет пузыриться и разбрызгиваться во многих направлениях, что может привести к травмам, если попадет на кожу или в глаза.
Не смешивать
Соляная кислота сама по себе является эффективным чистящим средством, и ее не следует смешивать с такими химическими веществами, как отбеливатель или перманганат калия. При смешивании этих химикатов образуется газообразный хлор, который может вызвать проблемы с дыханием и даже смерть.
Полная надлежащая утилизация
Соляную кислоту необходимо нейтрализовать, добавив в нее пищевую соду. Не сливайте соляную кислоту в канализацию без ее нейтрализации, так как это может вызвать коррозию и причинить вред окружающей среде. Раствор должен быть в соотношении 1:50, то есть вы должны промыть соляную кислоту и пищевую соду большим количеством воды, чтобы убедиться, что она правильно разбавлена.
Если возможно, утилизируйте соляную кислоту, поместив ее в пластиковое ведро и отправив в утилизацию опасных отходов.
Используйте надлежащую изоляцию
Соляную кислоту следует хранить в пластиковых или стеклянных емкостях , а не в металлических, которые могут вызвать коррозию.
Что дальше?
Хотите расширить свои знания о кислотах и щелочах? Эти уроки естествознания в старшей школе могут быть именно тем, что нужно!
Есть много забавных научных занятий, которыми вы можете заниматься дома (и не для всего этого требуется защитное снаряжение), например, изготовление слизи!
Что нужно знать о том, что вы будете изучать по химии AP? Это руководство по программам AP по химии поможет вам спланировать учебный год так, чтобы он был еще более эффективным!
Может ли кислота растворять тело? | Мнение
Аррениус, Бренстед-Лоури, Льюис… У химиков есть много способов определить и отличить кислоты от оснований.У судебных экспертов есть свой собственный способ — как эти вещества разрушают мягкие ткани, волосы, ногти, зубы и кости. 1-3 Этот интерес связан не только с телешоу, разрушающим мифы, таким как Во все тяжкие , главные герои которого использовали плавиковую кислоту, чтобы избавиться от трупа; он также служит практическим целям при тщательном изучении того, как убийцы пытаются замести следы.
Летопись преступлений наполнена ужасающими историями об использовании химикатов для утилизации трупов.В середине-конце 1940-х годов один из самых известных убийц в Англии, Джон Хей, использовал серную кислоту для уничтожения трупов по меньшей мере шести жертв — метод, который привел к тому, что его окрестили «убийцей в кислотной ванне». Организация Ареллано-Феликс, реальный картель, вдохновивший сюжет фильма 2000 года « Traffic », использовала гидроксид натрия для уничтожения трупов соперников. В 2003 году американский биохимик Лариса Шустер использовала соляную кислоту, чтобы избавиться от мужа. Благодаря работе судебных экспертов мы можем точно собрать воедино, что произошло при этих попытках извлечь труп.
Супер база
Когда дело доходит до мягких тканей, выберите кислоты и основания — обычно H 2 SO 4 , HCl, NaOH и KOH — вызывают разрушение посредством гидролиза крупных биомолекул (таких как белки, липиды, углеводы и нуклеиновые кислоты), с возможным дальнейшим сносом более мелких единиц. Считается, что щелочной гидролиз имеет преимущество перед методами с использованием кислоты (и предпочтителен при законной утилизации туш животных) *, скорее всего, из-за повышенного расщепления дисульфидных связей, которые являются ключевыми для структурной целостности белков.
Это лучшее расщепление также объясняет, почему основания разрушают волосы и ногти быстрее, чем кислоты. Волосы в основном состоят из белков кератина, которые содержат аминокислоту цистеин и, следовательно, имеют обширные дисульфидные связи. Они способствуют прочности и стабильности кератина и помогают противостоять солюбилизации растворителями, которые легко растворяют другие белки. Однако дисуфидные связи становятся жертвами щелочного гидролиза: волосы растворяются в течение нескольких минут в отбеливателе или NaOH (что знает любой, у кого есть заблокированная раковина или душ).Ногти также полны кератина; Как и в случае с волосами, исследователи обнаружили, что они более подвержены разрушению основаниями, чем кислотами. 1
Кислоты при очень низком pH превосходят основания, когда дело доходит до разрушения костей и зубов, 1-5 , скорее всего, из-за большей растворимости апатитов кальция в кислых условиях. Однако разрушение кости в кислых условиях — задача не из легких; 1-3 при комнатной температуре и атмосферном давлении может потребоваться почти день — или больше, в зависимости от кислоты — для растворения кости при полном погружении.Команда под руководством Кристины Каттанео из Миланского университета, Италия, изучила влияние погружения в кислоту и основание на кости свиней макроскопически, микроскопически и химически. 2-3 Они отметили различия во внешнем виде (макро- и микроскопическом) и степени повреждения между кислотами и основаниями, использованными в их исследовании. По сути, в то время как кислоты лучше растворяют кость, высококонцентрированные и сильные основания все же наносят значительный ущерб. Группа Каттанео описала последствия использования щелочных растворов для лечения костей в журнале Journal of Forensic Science следующим образом: «На первый взгляд, кость казалась структурно неповрежденной, но чрезвычайно хрупкой, поскольку полное и немедленное разрушение произошло простым прикосновением». 2 Я описываю это как ощущение, похожее на рассыпчатое песочное печенье, и такое же легкое.
Утилизация своими руками
Откуда мне знать? Потому что я сам наблюдал за процессом, используя легкодоступные запасы щелочи и кислоты, купленные в местном магазине DIY. Основа представляла собой гранулированный щелок (NaOH), продаваемый для очистки забитых труб, в то время как кислота была соляной кислотой (HCl), используемой для уравновешивания pH пула. Как и другие исследователи, я использовал образцы свиней — в данном случае свиные ребра и шейные кости свинины. В течение рабочей недели я наблюдал за деструктивными процессами, отмечая разный внешний вид кислотных и основных растворов.Оба проделали пугающую работу по деградации тестируемых образцов — в этом вы сами можете убедиться на видео выше.
Если бы мои поступки были гнусными, мне бы это сошло с рук? Вероятно, нет — как и все преступники, упомянутые ранее. При покупке расходных материалов я был записан на видео службы безопасности магазина, и в магазине есть записи о моей покупке. Такие видео- или бумажные следы часто обнаруживаются во время расследований и являются одной из основных причин проведения исследований по утилизации химических веществ; если исследователи знают, использовалась ли кислота или щелочь, они могут проверить, кто приобрел такие химические вещества или имел к ним доступ.
Действительно, если использовать химию для уничтожения трупа, вполне вероятно, что произойдет только частичное разрушение. Даже с небольшими образцами, которые я обрабатывал в течение нескольких дней, все еще оставался материал для анализа. Как отмечает команда Каттанео: «… вполне возможно, что возможная попытка уничтожить все тело… является задачей, совершенно отличной от уничтожения небольших образцов». 2
Шустер усвоил этот урок на собственном горьком опыте. Она поместила тело мужа в бочку с HCl и хранила ужасный контейнер в шкафчике для хранения вещей.Следователи легко обнаружили объект с помощью свидетеля и бумажного следа и легко опознали останки. В 2008 году ее приговорили к пожизненному заключению без права досрочного освобождения.
И даже если уничтожение будет успешным, как в случае с Хэем, работа полиции все равно может раскрыть преступление. Настойчивые следователи обнаружили 28 фунтов человеческого жира, часть ступни и зубной протез на территории собственности Хэя, после чего он признался в преступлении. Повешен в 1949 году.
Возможно, Джеффри Чосер был прав в фильме « Кентерберийские рассказы» — убийство раскрыто.
* Законная утилизация туш животных посредством щелочного гидролиза часто осуществляется при высокой температуре и давлении для ускорения процесса, для чего требуется специальное оборудование. Такие устройства не всегда доступны, и их приобретение или несанкционированное использование может вызвать тревогу. Щелочной гидролиз как альтернатива захоронению или кремации человеческих останков («зеленая кремация») является спорным и широко не доступным.
Ссылки
1 К. М. Хартнетт, Л. К. Фульгинити и Ф. Ди Модика, J.Судебная медицина. , 2011, 56, 954 (DOI: 10.1111 / j.1556-4029.2011.01752.x)
2 A Amadasi et al , J. Forensic Sci. , 2017, DOI: 10.1111 / 1556-4029.13429
3 A Amadasi et al , Leg. Med. (Токио) , 2015, 17, 503 (DOI: 10.1016 / j.legalmed.2015.10.006)
4 М. Кокс и С. Мэйс, Остеология человека В археологии и судебной медицине , 439, Cambridge University Press, 2000
5 C Dawes, J. Can.Вмятина. Доц. , 2003, 69, 722 (www.cda-adc.ca/jcda/vol-69/issue-11/722.pdf)
Соляная кислота | Соляная кислота
Использование и преимущества
Соляная кислота — сильная коррозионная кислота, которую можно использовать в промышленности для обработки стали, используемой в строительстве. Он используется в химической промышленности при крупномасштабном производстве винилхлорида, используемого для изготовления поливинилхлоридного (ПВХ) пластика, и является одним из химикатов, используемых для производства пенополиуретана и хлорида кальция.
Соляная кислота также используется для производства многих других химикатов, а также в качестве дезинфицирующего средства и слизи, химического вещества, которое предотвращает рост слизи в бумажной массе.
Другие распространенные конечные применения соляной кислоты включают бытовые чистящие средства, обслуживание бассейнов и производство продуктов питания.
Производство стали
Соляная кислота используется в операциях травления для удаления ржавчины и других примесей с углеродистой, легированной и нержавеющей стали, для подготовки стали к окончательному применению в строительных проектах, а также в таких продуктах, как кузова автомобилей и бытовая техника.Он также используется при травлении алюминия и очистке металлов.
Бытовые чистящие средства
Соляная кислота может входить в состав бытовых чистящих средств, таких как чистящие средства для унитазов, чистящие средства для плитки для ванных комнат и другие чистящие средства для фарфора, из-за ее коррозионных свойств, которые помогают удалять стойкие пятна.
Очистка бассейна
Соляная кислота используется в качестве химиката для обработки плавательных бассейнов, чтобы поддерживать оптимальный pH в воде.
Производство и обработка пищевых продуктов
В пищевой промышленности соляная кислота используется для обработки различных пищевых продуктов, таких как кукурузные сиропы, используемые в безалкогольных напитках, печенье, крекерах, кетчупе и крупах.Соляная кислота также используется в качестве подкислителя в соусах, овощных соках и консервированных продуктах, чтобы улучшить вкус и уменьшить порчу.
Производство хлорида кальция
Когда соляная кислота смешивается или реагирует с известняком, образуется хлорид кальция, тип соли, используемый для удаления льда с дорог.

