гидроксиды с ионной, молекулярной, полимерной структурой.
Гидроксиды образованы атомами некоторого элемента (кроме фтора и кислорода) и гидроксогруппами OH— Э(OH)n (n = 1 — 6)
При n > 2 существуют орто— и мета-формы гидроксидов:
|
Орто-гидроксиды переходят в мета-форму при отщеплении молекул воды.
Кислотные и оснóвные гидроксиды
Кислотные гидроксиды (кислородсодержащие кислоты) всегда содержат атомы водорода, способные замещаться на атомы металла. Большинство типично кислотных гидроксидов находятся в
мета-форме.При записи формулы кислотного гидроксида атомы водорода ставят на первое место, учитывая его электролитическую диссоциацию в воде:
SO2(OH)2 → H2SO4 PO(OH)3 → H3PO4 NO2(OH) → HNO3 CO(OH)2 → H2CO3
Оснóвные гидроксиды содержат гидроксогруппы ОН−, способные замещаться на кислотные остатки. Примеры:
NaOH, LiOH, Ba(OH)2, Cu(OH)2 , La(OH)3.
Реакция нейтрализации
Важнейшим химическим свойством основных и кислотных гидроксидов является их взаимодействие их между собой с образованием солей (
Ca(OH)2 + H2SO4 = CaSO4 + 2H2O Ca(OH)2 + 2H2SO4 = Ca(HSO4)2 + 2H2O 2Ca(OH)2 + H2SO4 = Ca2SO4(OH)2 + 2H2O
Кристаллич. решетки Г. щелочных и щел.-зем. металлов содержат ионы ОН—, к-рые легко обнаруживаются по широкой полосе в ИК-спектре при 3600 см
-1. Щелочи при растворении в воде подвергаются электролитич. диссоциации с образованием гидратированных ионов ОН » и аквакатионов металла. В конц. неводных р-рах Г. щелочных металлов возможно образование ионных пар, напр. (К + *ОН—), c включением в их состав молекул р-рителя. Г. щелочных металлов хорошо раств. в воде, Г. остальных металлов мало растворимы и часто выделяются из водного р-ра в виде гелей переменного состава, содержащих молекулы воды.К амфотерным Г. относят Ве(ОН)2, Zn(OH)2, A1(OH)3, Ga(OH)3, Sn(OH)2, Pb(OH)2, СrO(ОН) и нек-рые др. При взаимод. с к-тами они образуют

Г. многих металлов, особенно элементов FVб гр. периодич. системы, склонны к поликонденсации в результате процесса оляции-образования мостиковых групп ОН (см. Гидроксокомплексы). При этом Г. прсвращ. в сложные нестехиометрич. соед.-многоядерные гидроксоаквакомплексы, содержащие такие, напр., фрагменты:

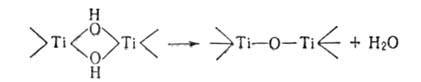
Образованию этих соед. способствует повышение т-ры, концентрации р-ра и водородного показателя (рН). При старении осадка многоядерных гидроксоаквакомплексов гидроксогруппы необратимо превращ. в оксогруппы (процесс оксоляцииХ напр.:
Многие Г. и их водные р-ры поглощают СО2 из воздуха с образованием карбонатов, с к-тами дают соли. При нагр. Г. щелочных металлов, кроме LiOH, плавятся, а остальные, в т.ч. и LiOH, разлагаются на оксид металла и воду, напр.: Сu(ОН)2 -> СuО + Н2О. Гидроксиды Cu(I), Ag(I), Au(I) разлагаются на воду и оксид в процессе их образования.
Г. щелочных металлов получают: электролизом водных р-ров солей, чаще всего хлоридов; методом ионного обмена с использованием анионитов в ОН-форме; иногда по обменным р-циям, напр.: Li2SO4 + Ва(ОН)2 -> 2L1OH + BaSO4. Г. остальных металлов получают в осн. по обменным р-циям. В отдельных случаях Г. щел.-зем.
Г. встречаются в природе в в.иде минералов, напр. ги-драргиллита А1(ОН)3, брусита Mg(OH)2. Среди орг. в-в также известны Г., напр. тетраалкиламмо-нийгидроксиды (NR4)OH, где R = CH3, C2H5; они хорошо раств. в воде относ. к классу оснований.
studfile.net
ГИДРОКСИДЫ — это… Что такое ГИДРОКСИДЫ?
неорг. соед. металлов общей ф-лы М(ОН)n, где и-степень окисления металла М. Являются основаниями или амфотерными соединениями. Г. щелочных, щел.-зем. металлов и Тl(I) наз. щелочами,
Кристаллич. решетки Г. щелочных и щел.-зем. металлов содержат ионы ОН —, к-рые легко обнаруживаются по широкой полосе в ИК-спектре при 3600 см -1
. Щелочи при растворении в воде подвергаются электролитич. диссоциации с образованием гидратированных ионов ОН » и аквакатионов металла. В конц. неводных р-рах Г. щелочных металлов возможно образование ионных пар, напр. (К + *ОН —), c включением в их состав молекул р-рителя. Г. щелочных металлов хорошо раств. в воде, Г. остальных металлов мало растворимы и часто выделяются из водного р-ра в виде гелей переменного состава, содержащих молекулы воды. К амфотерным Г. относят Ве(ОН)2, Zn(OH)2, A1(OH)3, Ga(OH)3, Sn(OH)2, Pb(OH)2, СrO(ОН) и нек-рые др. При взаимод. с к-тами они образуют соли, с сильными основаниями -гидроксокомплексы, Напр., Г цинка может реагировать как с к-той, так и с основанием: 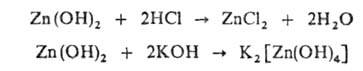
Г. многих металлов, особенно элементов FVб гр. периодич. системы, склонны к поликонденсации в результате процесса оляции-образования мостиковых групп ОН (см.

Образованию этих соед. способствует повышение т-ры, концентрации р-ра и водородного показателя (рН). При старении осадка многоядерных гидроксоаквакомплексов гидроксогруппы необратимо превращ. в оксогруппы (процесс оксоляцииХ напр.: 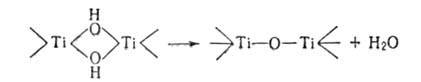
Многие Г. и их водные р-ры поглощают СО 2 из воздуха с образованием карбонатов, с к-тами дают соли. При нагр. Г. щелочных металлов, кроме LiOH, плавятся, а остальные, в т. ч. и LiOH, разлагаются на оксид металла и воду, напр.: Сu(ОН)2 -> СuО + Н 2 О. Гидроксиды Cu(I), Ag(I), Au(I) разлагаются на воду и оксид в процессе их образования.
Г. щелочных металлов получают: электролизом водных р-ров солей, чаще всего хлоридов; методом ионного обмена с использованием анионитов в ОН-форме; иногда по обменным р-циям, напр.: Li2SO4 + Ва(ОН)2 -> 2L1OH + BaSO4. Г. остальных металлов получают в осн. по обменным р-циям. В отдельных случаях Г. щел.-зем. металлов синтезируют взаимод. их оксидов с водой, напр.: СаО + Н 2 О -> Са(ОН)2.
Г. встречаются в природе в в. иде минералов, напр. ги-драргиллита А1(ОН)3, брусита Mg(OH)2. Среди орг. в-в также известны Г., напр. тетраалкиламмо-нийгидроксиды (NR4)OH, где R = CH3, C2H5; они хорошо раств. в воде относ. к классу оснований . Б. Д. Степин.
Химическая энциклопедия. — М.: Советская энциклопедия. Под ред. И. Л. Кнунянца. 1988.
dic.academic.ru
Гидроксиды Википедия
Гидрокси́ды (гидроо́киси, водокиси) — неорганические соединения, содержащие в составе гидроксильную группу −OH{\displaystyle {\ce {-OH}}}. Известны гидроксиды почти всех химических элементов; некоторые из них встречаются в природе в виде минералов. Гидроксиды щелочных и щёлочноземельных металлов, а также аммония являются растворимыми и называются щелочами.
Классификация[ | ]
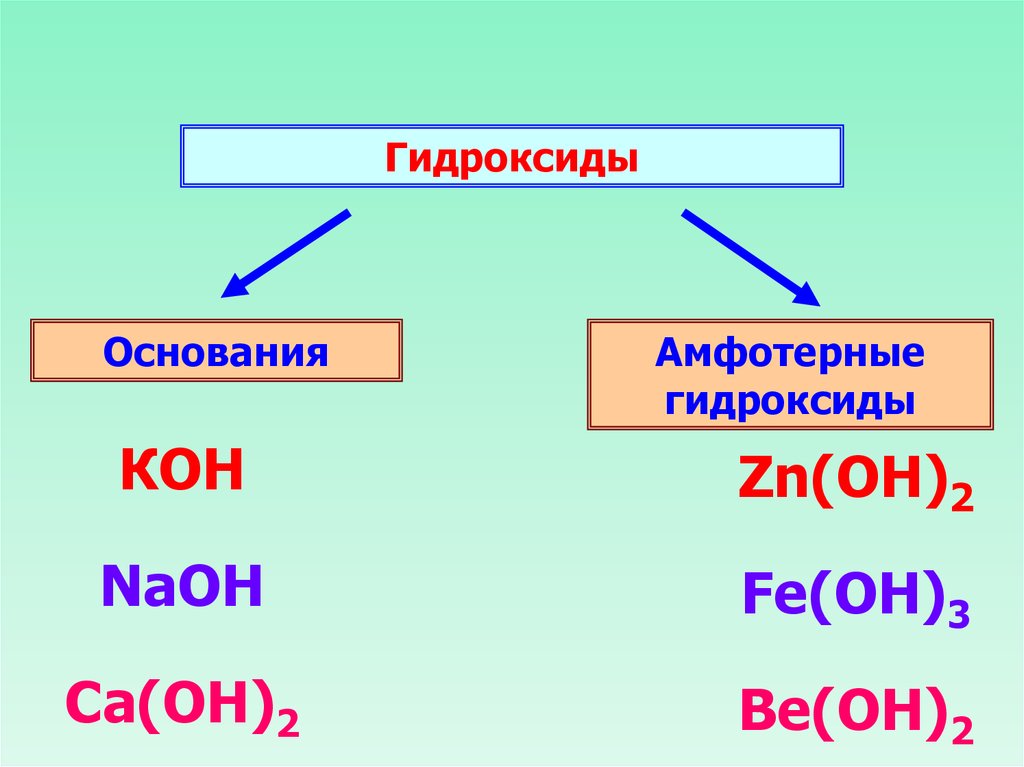
В зависимости от того, является ли соответствующий оксид основным, кислотным или амфотерным, соответственно различают:
- основные гидроксиды (основания) — только гидроксиды металлов со степенью окисления +1, +2, проявляющие основные свойства (например, гидроксид кальция Ca(OH)2{\displaystyle {\ce {Ca(OH)2}}}, гидроксид калия KOH{\displaystyle {{\ce {KOH}}}}, гидроксид натрия NaOH{\displaystyle {\ce {NaOH}}} и др.) При реакциях и диссоциации отщепляется группа −OH{\displaystyle {\ce {-OH}}}.
- кислотные гидроксиды (кислородсодержащие кислоты) — гидроксиды неметаллов и металлов со степенью окисления +5, +6, проявляющие кислотные свойства (например, азотная кислота HNO3{\displaystyle {\ce {HNO3}}}, серная кислота h3SO4{\displaystyle {\ce {h3SO4}}}, сернистая кислота h3SO3
ru-wiki.ru
ГИДРОКСИДЫ — это… Что такое ГИДРОКСИДЫ?
ГИДРОКСИДЫ — химические соединения оксидов с водой. Гидроксиды многих металлов основания, а неметаллов кислоты. Гидроксиды, проявляющие как основные, так и кислотные свойства, называются амфотерными. Обычно термин гидроксид относится только к основаниям. См.… … Большой Энциклопедический словарь
ГИДРОКСИДЫ — ГИДРОКСИДЫ, неорганические химические соединения, содержащие ион ОН , проявляющие свойства ОСНОВАНИЙ (веществ, присоединяющих протоны и реагирующих с кислотой, образующих при этом соль и воду). Сильные неорганические основания, такие как… … Научно-технический энциклопедический словарь
ГИДРОКСИДЫ — хим. соединения (см.) с водой. Г. многих металлов (см.), а неметаллов (см.). В формуле основания на первом месте ставится хим. символ металла, на втором кислорода и на последнем водорода (гидроксид калия КОН, гидроксид натрия NaOH и др.). Группа… … Большая политехническая энциклопедия
Гидроксиды — (гидроокиси) соединения оксидов химических элементов с водой. Известны гидроксиды почти всех химических элементов; некоторые из них встречаются в природе в виде минералов. Гидроксиды щелочных металлов называются щелочами. Классификация В… … Википедия
гидроксиды — химические соединения оксидов с водой. Гидроксиды многих металлов основания, а неметаллов кислоты. Гидроксиды, проявляющие как основные, так и кислотные свойства, называются амфотерными. Обычно термин «гидроксиды» относится только к основаниям … Энциклопедический словарь
ГИДРОКСИДЫ — неорг. соед. металлов общей ф лы М(ОН)n, где и степень окисления металла М. Являются основаниями или амфотерными соединениями. Г. щелочных, щел. зем. металлов и Тl(I) наз. щелочами, Кристаллич. решетки Г. щелочных и щел. зем. металлов содержат… … Химическая энциклопедия
ГИДРОКСИДЫ — неорганич. соединения, содержащие одну или неск. групп ОН. Могут быть основаниями или амфотерными соединениями (см. Амфотерность). Г. встречаются в природе в виде минералов, например гидраргиллит А1(ОН)3, брусит Mg(OH)2 … Большой энциклопедический политехнический словарь
ГИДРОКСИДЫ — хим. соед. оксидов с водой. Г. мн. металлов основания, а неметаллов кислоты. Г., проявляющие как основные, так и кислотные свойства, наз. амфотерными. Обычно термин Г. относится только к основаниям. См. также Щёлочи … Естествознание. Энциклопедический словарь
гидроксиды — гидрокс иды, ов, ед. ч. с ид, а … Русский орфографический словарь
гидроксиды — мн., Р. гидрокси/дов; ед. гидрокси/д (2 м) … Орфографический словарь русского языка
dic.academic.ru
Что такое гидроксиды? Свойства гидроксидов
Многие оксиды активных металлов, например, окислы калия, натрия или лития, могут взаимодействовать с водой. В этом случае в продуктах реакции обнаруживаются соединения, относящиеся к гидроксидам. Свойства этих веществ, особенности протекания химических процессов, в которых участвуют основания, обусловлены присутствием в их молекулах гидроксильной группы. Так, в реакциях электролитической диссоциации основания расщепляются на ионы металла и анионы OH—. Как основания взаимодействуют с оксидами неметаллов, кислотами и солями, мы и рассмотрим в нашей статье.

Номенклатура и строение молекулы
Чтобы правильно назвать основание, требуется к названию металлического элемента прибавить слово гидроксид. Приведем конкретные примеры. Основание алюминия относится к амфотерным гидроксидам, свойства которых мы рассмотрим в статье. Обязательное присутствие в молекулах оснований гидроксильной группы, связанной с катионом металла ионным типом связи, можно определить с помощью индикаторов, например, фенолфталеина. В водной среде избыток ионов OH—определяется по изменению цвета раствора индикатора: бесцветный фенолфталеин становится малиновым. Если металл проявляет несколько валентностей, он может образовывать несколько оснований. Например, железо имеет два основания, в которых валентность металла равна 2 или 3. Первое соединение характеризуется признаками основных гидроксидов, второе — амфотерных. Поэтому свойства высших гидроксидов отличаются от соединений, в которых металл имеет низшую степень валентности.
Физическая характеристика
Основания – это твердые вещества, устойчивые к нагреванию. По отношению к воде они делятся на растворимые (щелочи) и нерастворимые. Первая группа образована активными в химическом отношении металлами – элементами первой и второй групп. Нерастворимые в воде вещества состоят из атомов других металлов, чья активность уступает натрию, калию или кальцию. Примерами таких соединений могут служить основания железа или меди. Свойства гидроксидов будут зависеть от того, к какой группе веществ они относятся. Так, щелочи являются термически прочными и не разлагаются при нагревании, тогда, как нерастворимые в воде основания под действием высокой температуры разрушаются, образуя оксид и воду. Например, основание меди разлагается следующим образом:
Cu(OH)2 = CuO + H2O

Химические свойства гидроксидов
Взаимодействие между собой двух важнейших групп соединений – кислот и оснований – именуют в химии реакцией нейтрализации. Такое название можно объяснить тем, что химически агрессивные гидроксиды и кислоты образуют нейтральные продукты – соли и воду. Являясь, по сути, обменным процессом между двумя сложными веществами, нейтрализация характерна как для щелочей, так и для нерастворимых в воде оснований. Приведем уравнение реакции нейтрализации между едким калием и хлоридной кислотой:
KOH + HCl = KCl + H2O
Важное свойство оснований щелочных металлов является их способность реагировать с кислотными оксидами, в результате можно получить соль и воду. Например, пропуская через гидроксид натрия углекислый газ, можно получить его карбонат и воду:
2NaOH + CO2 = Na2CO3 + H2O
К реакциям ионного обмена относится взаимодействие между щелочами и солями, идущее с образованием нерастворимых гидроксидов или солей. Так, приливая по каплям раствор едкого натра в раствор сернокислой меди, можно получить голубой желеобразный осадок. Это основание меди, нерастворимое в воде:
CuSO4 + 2NaOH = Cu(OH)2 + Na2 SO4
Химические свойства гидроксидов, нерастворимых в воде, отличаются от щелочей тем, что они при небольшом нагревании теряют воду – дегидратируются, переходя в форму соответствующего основного окисла.
Основания, проявляющие двойственные свойства
Если элемент или сложное вещество может реагировать и с кислотами, и с щелочами – его называют амфотерным. К таковым относятся, например, цинк, алюминий и их основания. Свойства амфотерных гидроксидов позволяют записывать их молекулярные формулы как в виде оснований, выделяя при этом гидроксогруппу, так и в виде кислот. Представим несколько уравнений реакций основания алюминия с хлоридной кислотой и гидроксидом натрия. Они иллюстрируют особые свойства гидроксидов, относящихся к амфотерным соединениям. Вторая реакция проходит с распадом щелочи:
2Al(OH)3 + 6HCl = 2AlCl3 + 3H2O
Al(OH)3 + NaOH = NaAlO2 + 2H2O
Продуктами процессов будут вода и соли: хлорид алюминия и алюминат натрия. Все амфотерные основания не растворяются в воде. Добывают их в результате взаимодействия соответствующих солей и щелочей.
Способы получения и применение
В промышленности, требующей больших объемов щелочей, их получают электролизом солей, содержащих катионы активных металлов первой и второй группы периодической системы. Сырьем для добычи, например, едкого натрия, служит раствор поваренной соли. Уравнение реакции будет таким:
2NaCl + 2H2O = 2NaOH + H2 + Cl2
Основания малоактивных металлов в лаборатории получают взаимодействием щелочей с их солями. Реакция относится к типу ионного обмена и заканчивается выпадением осадка основания. Простой способ получения щелочей – это реакция замещения, проходящая между активным металлом и водой. Она сопровождается разогреванием реагирующей смеси и относится к экзотермическому типу.
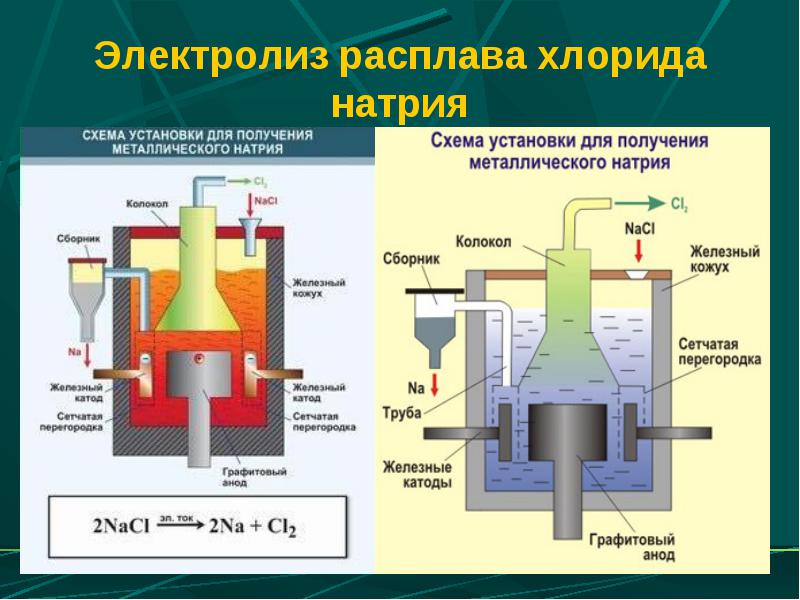
Свойства гидроксидов используют в промышленности. Особую роль здесь играют щелочи. Их применяют в качестве очистителей керосина и бензина, для получения мыла, обработки натуральной кожи, а также в технологиях производства искусственного шелка и бумаги.
fb.ru
XuMuK.ru — ГИДРОКСИДЫ — Химическая энциклопедия
ГИДРОКСИДЫ, неорг. соед. металлов общей ф-лы М(ОН)n, где и-степень окисления металла М. Являются основаниями или амфотерными соединениями. Гидроксиды щелочных, щел.-зем. металлов и Тl(I) наз. щелочами,
Кристаллич. решетки гидроксидов щелочных и щел.-зем. металлов содержат ионы ОН—, к-рые легко обнаруживаются по широкой полосе в ИК-спектре при 3600 см-1. Щелочи при растворении в воде подвергаются электролитич. диссоциации с образованием гидратированных ионов ОН » и аквакатионов металла. В конц. неводных р-рах гидроксидов щелочных металлов возможно образование ионных пар, напр. (К + *ОН—), c включением в их состав молекул р-рителя. Гидроксиды щелочных металлов хорошо раств. в воде, гидроксиды остальных металлов мало растворимы и часто выделяются из водного р-ра в виде гелей переменного состава, содержащих молекулы воды.
К амфотерным гидроксидам относят Ве(ОН)2, Zn(OH)2, A1(OH)3,
Ga(OH)3, Sn(OH)2, Pb(OH)2, СrO(ОН) и нек-рые
др. При взаимод. с к-тами они образуют соли, с сильными основаниями -гидроксокомплексы,
Напр., гидроксид цинка может реагировать как с к-той, так и с основанием:
Гидроксиды многих металлов, особенно элементов FVб гр. периодич. системы, склонны
к поликонденсации в результате процесса оляции-образования мостиковых групп
ОН (см. Гидроксокомплексы). При этом гидроксиды прсвращ. в сложные нестехиометрич.
соед.-многоядерные гидроксоаквакомплексы, содержащие такие, напр., фрагменты:
Образованию этих соед. способствует повышение т-ры, концентрации р-ра
и водородного показателя (рН). При старении осадка многоядерных гидроксоаквакомплексов
гидроксогруппы необратимо превращ. в оксогруппы (процесс оксоляцииХ напр.:
Многие гидроксиды и их водные р-ры поглощают СО2 из воздуха с образованием карбонатов, с к-тами дают соли. При нагр. гидроксидов щелочных металлов, кроме LiOH, плавятся, а остальные, в т.ч. и LiOH, разлагаются на оксид металла и воду, напр.: Сu(ОН)2 -> СuО + Н2О. Гидроксиды Cu(I), Ag(I), Au(I) разлагаются на воду и оксид в процессе их образования.
Гидроксиды щелочных металлов получают: электролизом водных р-ров солей, чаще всего хлоридов; методом ионного обмена с использованием анионитов в ОН-форме; иногда по обменным р-циям, напр.: Li2SO4 + Ва(ОН)2 -> 2L1OH + BaSO4. Гидроксиды остальных металлов получают в осн. по обменным р-циям. В отдельных случаях гидроксиды щел.-зем. металлов синтезируют взаимод. их оксидов с водой, напр.: СаО + Н2О -> Са(ОН)2.
Гидроксиды встречаются в природе в в.иде минералов, напр. ги-драргиллита А1(ОН)3, брусита Mg(OH)2. Среди орг. в-в также известны гидроксиды, напр. тетраалкиламмо-нийгидроксиды (NR4)OH, где R = CH3, C2H5; они хорошо раств. в воде относ. к классу оснований. Б. Д. Степин.
===
Исп. литература для статьи «ГИДРОКСИДЫ»: нет данных
Страница «ГИДРОКСИДЫ» подготовлена по материалам химической энциклопедии.
www.xumuk.ru