Твердые вещества и их строение в зависимости от типа кристаллической решетки
Твердые вещества состоят из прочно связанных между собой атомов, молекул и ионов. Свойства твердых тел зависят от прочности химических связей внутри их.
Большинство твердых веществ имеют кристаллическую структуру. Их частицы — молекулы, атомы или ионы — расположены в строгом порядке. Такая регулярная структура называется пространственной, или кристаллической, решеткой.
Тип кристиаллической решетки твердых веществ
Тип решетки зависит от того, какие частицы находятся в узлах решетки. Существует 4 основных типа пространственных решеток — ионная, молекулярная, атомная и металлическая.
Частицы в кристаллических решетках не подвижны, или постоянно совершают колебательные движения.
С повышением температуры энергия колебаний частиц твердого вещества увеличивается, и когда она превышает энергию межмолекулярного притяжения, кристаллическая решетка разрушается — происходит плавление.
Ионная структура
Вещества с ионной структурой, например хлорид натрия, обычно имеют довольно высокие температуры плавления. Это свойство вытекает из сильного взаимодействия между противоположно заряженными ионами решетки. В тоже время ионные вещества достаточно хрупкие. Силой, приложенной кристаллу извне, можно сместить слои ионов, так что одинаково заряженные ионы окажутся друг напротив друга. Они начнут отталкиваться, слои раздвигаться, и кристаллическая решетка в этом месте разрушится. Растворы и расплавы таких соединений хорошо проводят электрический ток.

На рисунке пространственная модель кубической решетки кристалла хлорида натрия. Здесь показаны относительные размеры двух типов ионов и их расположение в пространстве.
Молекулярная структура твердых веществ
В узлах атомной решетки находятся атомы. Молекулы состоят из атомов, связанных прочной ковалентной связью. Например, молекулы йода состоит из двух атомов, связанных одинаковой ковалентной связью. Связи между молекулами и твердых веществ не столь прочны.
Молекула йода I2. Твердый йод состоит из молекул йода, связанных в регулярную кристаллическую решетку. Каждая молекула йода состоит из 2 прочно связанных между собой атомов йода.

Йод в твердом состоянии достаточно мягкий элемент, поскольку связи между его молекулами слаб.

Твердые вещества с молекулярной структурой плавятся, как правило, при низких температурах. При плавлении ковалентные связи не рвутся, разрушаются только связи между слабо взаимодействующими друг с другом молекулами.
Атомная структура
Свободный углерод известен в двух модификациях — алмаз и графит. И алмаз и графит состоит только из атомов углерода, однако эти два вещества имеют совершенно разные структуры. В графите атом углерода соединен с 3 другими атомами короткими прочными ковалентными связями. 4-ый электрон остается свободным, что обусловливает электропроводность графита. Шестиугольные кольца образуют плоские слои.
Связи между слоями довольно слабые, и слои могут скользить один относительно другого. Именно поэтому графит используют как твердый смазочный материал. В алмазе каждый атом углерода соединен прочными ковалентными связями с 4 другими атомами. Миллиарды атомов связаны в трехмерную кристаллическую решетку необычной прочности, что делает алмаз самым твердым из известных веществ.

Несомненно, алмаз встречается намного реже, чем графит, и гораздо ценнее его. И алмаз и графит состоят только из атомов углерода, однако эти 2 вещества имеют совершенно разные структуры, и следовательно, совершенно разные своства. На рисунке показана структура кристаллической решетки алмаза.
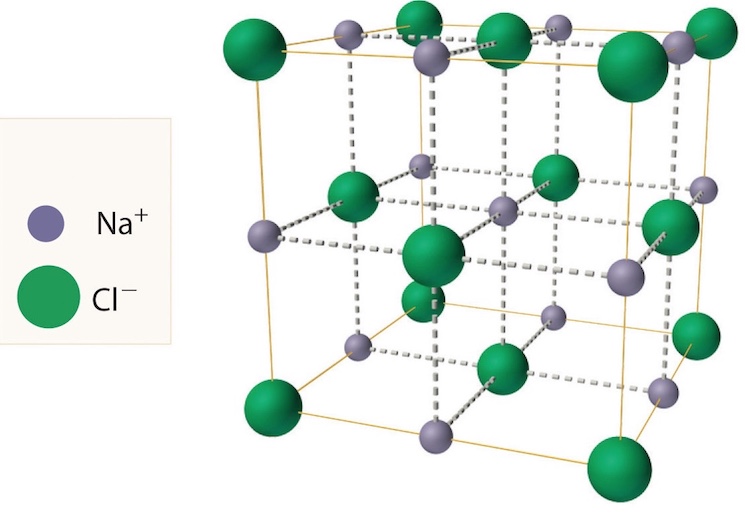
Кристаллы из поваренной соли состоят из ионов натрия и хлорид ионов. На рисунке атомы показаны в виде шариков. Шарики условно разнесены, чтобы усло была видна трехмерная структура кристалла.
Карандашный грифель сделан из графита. Слабые силы притяжения между слоями атомов углерода позволяют слоям скользить относительно друг-друга, вот поэтому на бумаге и остается графитовый след.
Металлическая структура твердых веществ
В узлах веществ с металлической решеткой находятся положительные ионы и атомы металлов, а между узлами — электроны. Атомы плотно упакованы слоями, причем атомы одного слоя приходятся на углубление соседнего слоя. Взаимодействия между атомами в такой структуре довольно сильны, и большинство металлов имеют высокие температуры плавления.
Множество электронов могут свободно перемещаться по всему кристаллу металла, и поэтому называются свободными электронами. Свободные электроны имеют отрицательный заряд и притягивают катионы металлов, в результате чего кристаллическая решетка металлов является устойчивой. Свободные электроны могут свободно переносить теплоту и электричество, поэтому они являются причиной главных физических свойств, отличающих металлы от неметаллов, — высокой электро- и теплопроводности.
В отличие от ионных веществ металлы являются пластичными и ковкими — слои металлов могут скользить друг относительно друга, не разрушая при этом пространственную решетку.
Атомы металла в твердом состоянии плотно упакованы. Внешние электроны свободно передвигаются и равномерно распределены между всеми атомами. Единое электронное облако прочно связывает атомы друг с другом.
При прохождении электрического тока через металл суммарный поток электронов имеет определенное направление — от отрицательного полюса к положительному.
Проводимость графита — редкий пример проводника неметалла
Электрический ток — это направленный поток заряженных частиц. Такими заряженными частицами могут быть ионы или электроны, способные свободно передвигаться. В некоторых случаях способность материала проводить или не проводить электрический ток позволяет судить о его структуре.
Графит — редкий пример проводника — неметалла. На практике его используют в качестве токопроводящих «щеток» в электроинструменте.
Графит проводит ток, поскольку каждый атом углерода в его структуре соединен ковалентно только с 3 другими атомами. Таким образом, 1 (4-ы) электрон у каждого атома остается относительно свободным, принимая участия в образовании связи, «размазанной» по всему слою атомов. Такая связь называется делокализованной. Она является источников электронов, способных свободно передвигаться по слоям графита проводить электрический ток.
Интересное видео, в котором наглядно показана не только проводимость графита, но и образование электрической дуги между графитовыми стержнями.
Когда вещества с ионными связями (соли) расплавлены или растворены в воде, кристаллическая решетка разрушается, ионы становятся свободными и могут проводить электричество. Это явление помогло в свое время ученым понять, что ионные вещества состоят из заряженных частиц.
Интересные опыты с диоксидом углерода или твердым льдом
На видео проведен эксперимент, в котором 90 сухого льда высыпают в надувной бассейн.
При -78,5 0С твердый диоксид углерода (сухой лед) превращается в углекислый газ, минуя жидкое состояние. Если бросить сухой лед в воду, он начнет испаряться. Смесь сухого льда и воды используют для сценических эффектов (густой туман).
Ответы Mail.ru: Как по формуле вещества понять, какая у него кристаллическая решётка: атомная или молекулярная?
КРИСТАЛЛИЧЕСКИЕ РЕШЁТКИ.. Вещества, находящиеся в твёрдом состоянии образуют кристаллические решётки.
Кристаллические решётки веществ-это упорядоченное расположение частиц (атомов, молекул, ионов) в строго определённых точках пространства. Точки размещения частиц называют узлами кристаллической решётки.
В зависимости от типа частиц, расположенных в узлах кристаллической решётки, и характера связи между ними различают 4 типа кристаллических решёток: ионные, атомные, молекулярные, металлические.
ИОННЫЕ
Ионными называют кристаллические решетки, в узлах которых находятся ионы. Их образуют вещества с ионной связью. Ионные кристаллические решётки имеют соли, некоторые оксиды и гидроксиды металлов.
Связи между ионами в кристалле очень прочные и устойчивые. Поэтому вещества с ионной решёткой обладают высокой твёрдостью и прочностью, тугоплавки и нелетучи.
АТОМНЫЕ
Атомными называют кристаллические решётки, в узлах которых находятся отдельные атомы, которые соединены очень прочными ковалентными связями.
В природе встречается немного веществ с атомной кристаллической решёткой. К ним относятся бор, кремний, германий, кварц, алмаз. Вещества с АКР имеют высокие температуры плавления, обладают повышенной твёрдостью. Алмаз-самый твёрдый природный материал.
МОЛЕКУЛЯРНЫЕ
Молекулярными называют кристаллические решётки, в узлах которых располагаются молекулы. Химические связи в них ковалентные, как полярные, так и неполярные. Связи в молекулах прочные, но между молекулами связи не прочные.
Вещества с МКР имеют малую твёрдость, плавятся при низкой температуре, летучие, при обычных условиях находятся в газообразном или жидком состоянии
МЕТАЛЛИЧЕСКИЕ
Металлическими называют решётки, в узлах которых находятся атомы и ионы металла.
Для металлов характерны физические свойства: пластичность, ковкость, металлический блеск, высокая электро- и теплопроводность
Вывод: чтобы определить тип кристаллической решётки вещества, необходимо использовать знания о типе частиц, расположенных в узлах кристаллической решётки и характере связи между ними.
Решётка Браве — Википедия
Материал из Википедии — свободной энциклопедии
У этого термина существуют и другие значения, см. Решётка.Решётка Браве́ — понятие для характеристики кристаллической решётки относительно сдвигов. Названа в честь французского физика Огюста Браве. Решёткой или системой трансляций Браве называется набор элементарных трансляций или трансляционная группа, которыми может быть получена вся бесконечная кристаллическая решётка. Все кристаллические структуры описываются 14 решётками Браве, число которых ограничивается симметрией.
Разделяют двухмерные и трёхмерные решётки Браве.
- Пять двухмерных решёток Браве
| Решётка | Элементарная ячейка | |
|---|---|---|
| Косоугольная | Параллелограмм; a≠b,φ≠90∘{\displaystyle a\not =b,\varphi \not =90^{\circ }} | 2 |
| Квадратная | Квадрат; a=b,φ=90∘{\displaystyle a=b,\varphi =90^{\circ }} | 4mm{\displaystyle 4mm} |
| Гексагональная | 60∘{\displaystyle 60^{\circ }} ромб; a=b,φ=120∘{\displaystyle a=b,\varphi =120^{\circ }} | 6mm{\displaystyle 6mm} |
| Примитивная прямоугольная | Прямоугольник; a≠b,φ=90∘{\displaystyle a\not =b,\varphi =90^{\circ }} | 2mm{\displaystyle 2mm} |
| Центрированная прямоугольная | Прямоугольник; a≠b,φ=90∘{\displaystyle a\not =b,\varphi =90^{\circ }} | 2mm{\displaystyle 2mm} |
Обозначение mm{\displaystyle mm} указывает на наличие двух видов плоскостей зеркального отражения, которые не переводятся одна в другую путем действия поворотных осей 2,4 или 6.
- Четырнадцать трёхмерных решёток Браве обычно подразделяются на семь систем, в соответствии с семью различными типами элементарных ячеек: триклинной, моноклинной, ромбической, тетрагональной, кубической, тригональной и гексагональной. Каждая из систем характеризуется своим соотношением осей a,b,c и углов α,β,γ{\displaystyle \alpha ,\beta ,\gamma }.
Решётка Браве является математической моделью, отражающей трансляционную симметрию кристалла. В общем случае, решётка Браве не совпадает с реальным кристаллом, а узлы не соответствуют атомам (поскольку кристаллическая решётка может содержать более одного атома в элементарной ячейке). Поэтому следует отличать кристаллическую решётку и решётку Браве. Термин теории групп «решётки в евклидовом пространстве» соответствует именно решёткам Браве.
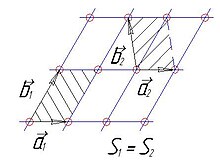 Неоднозначность выбора трансляционных векторов. Площадь элементарных ячеек одинакова
Неоднозначность выбора трансляционных векторов. Площадь элементарных ячеек одинаковаПонятие решётки Браве связано с основными трансляционными векторами. Основным трансляционным вектором называется минимальный в данном направлении вектор перехода из данной точки в ближайшую эквивалентную. В трёхмерном случае таких некомпланарных векторов будет три (обозначим a→1{\displaystyle {\vec {a}}_{1}}, a→2{\displaystyle {\vec {a}}_{2}}, a→3{\displaystyle {\vec {a}}_{3}}).
Задав нулевую точку, строим совокупность точек по правилу: a→=n1a→1+n2a→2+n3a→3{\displaystyle {\vec {a}}=n_{1}{\vec {a}}_{1}+n_{2}{\vec {a}}_{2}+n_{3}{\vec {a}}_{3}}, где n1{\displaystyle n_{1}}, n2{\displaystyle n_{2}}, n3{\displaystyle n_{3}} — произвольные целые числа. Получившаяся решётка — решётка Браве.
Элементарная ячейка решётки Браве — параллелепипед, построенный на основных векторах трансляции. Выбор этих векторов неоднозначен (см. рис.), но объём элементарной ячейки Ω=(a→1⋅[a→2×a→3]){\displaystyle \Omega =\left({\vec {a}}_{1}\cdot \left[{\vec {a}}_{2}\times {\vec {a}}_{3}\right]\right)} не зависит от выбора трансляционных векторов. Это связано с инвариантностью получающегося определителя относительно сложения и вычитания строк.
На элементарную ячейку решётки Браве приходится один узел.
Элементарную ячейку можно задать и другими способами. Например, в форме ячейки Вигнера-Зейтца наглядно видно, что на ячейки приходится один узел.
Элементарная ячейка обратной решётки в форме ячейки Вигнера-Зейтца в обратном пространстве — первая зона Бриллюэна.
По симметрии элементарной ячейки выделяют сингонии в кристаллографии и физике твёрдого тела.
Кристаллы — Википедия

Криста́ллы (от греч. κρύσταλλος первоначально — «лёд», в дальнейшем — «горный хрусталь; кристалл») — твёрдые тела, в которых частицы (атомы и молекулы) расположены закономерно, образуя трёхмерно-периодическую пространственную укладку — кристаллическую решётку.
Кристаллы — твёрдые вещества, имеющие естественную внешнюю форму правильных симметричных многогранников, основанную на их внутренней структуре, то есть на одном из нескольких определённых регулярных расположений составляющих вещество частиц (атомов, молекул, ионов).
Современное определение кристалла дано Международным союзом кристаллографов: материал представляет собой кристалл, если он имеет преимущественно острую дифракционную картину[1].
В 2000 году самые крупные природные кристаллы были обнаружены в Пещере кристаллов в шахтовом комплексе Найка, в мексиканском штате Чиуауа[2]. Некоторые из найденных там кристаллов гипса достигают 15 метров в длину, а в ширину — 1 метр. Известен своими гигантскими, метровыми, кристаллами сподумен[3]. В 1914 году было опубликовано сообщение, что в руднике Этта[en], Южная Дакота некогда был найден кристалл сподумена длиной 42 фута (12,8 м) и весом 90 тонн[4].
Морфология кристаллов — наука, изучающая как происходит развитие естественных граней кристалла, размещение этих граней в пространстве. Представляет собой отрасль кристаллографии.
Большинство природных кристаллов имеют гладкие кристаллические грани, в малогабаритных формах; грани кристаллов оптически плоские и обычно дают чёткие отражения окружения (как в оконном стекле). У больших кристаллов отражения бывают более размытыми и, следовательно, сами грани не идеально плоские.
Плоские грани у кристаллов свидетельствуют о правильности внутреннего расположения атомов, характеризующего кристаллическое состояние вещества.
Знание морфологии драгоценных материалов необходимо для распознания таких камней в необработанном состоянии, а также для лучшей огранки того или иного кристалла.
Кристаллическая структура — это расположение частиц (атомов, молекул, ионов) в кристалле. Будучи индивидуальной для каждого вещества, кристаллическая структура относится к основным физико-химическим свойствам этого вещества. Кристаллическую структуру с трёхмерной периодичностью называют кристаллической решёткой[5].
Составляющие данное твёрдое вещество частицы образуют кристаллическую решётку. Если кристаллические решётки стереометрически (пространственно) одинаковы или сходны (имеют одинаковую симметрию), то геометрическое различие между ними заключается, в частности, в разных расстояниях между частицами, занимающими узлы решётки. Сами расстояния между частицами называются параметрами решётки. Параметры решётки, а также углы геометрических многогранников определяются физическими методами структурного анализа, например, методами рентгеновского структурного анализа.
Часто твёрдые вещества образуют (в зависимости от условий) более чем одну форму кристаллической решётки; такие формы называются полиморфными модификациями. Например, среди простых веществ известны:
Следует разделить идеальный и реальный кристаллы.
- Идеальный кристалл является математическим объектом, лишённым любых дефектов строения, а также имеющим полную, свойственную ему симметрию, идеализированно ровные гладкие грани.
- Реальный кристалл всегда содержит различные дефекты внутренней структуры решётки, искажения и неровности на гранях и имеет пониженную симметрию многогранника вследствие специфики условий роста, неоднородности питающей среды, повреждений и деформаций. Необязательно обладает кристаллографическими гранями и правильной формой, но у него сохраняется главное свойство — закономерное положение атомов в кристаллической решётке.
Многим кристаллам присуще свойство анизотропии, то есть зависимость их свойств от направления, тогда как в изотропных веществах (большинстве газов, жидкостей, аморфных твёрдых телах) или псевдоизотропных (поликристаллы) телах свойства от направлений не зависят. Процесс неупругого деформирования кристаллов всегда осуществляется по вполне определённым системам скольжения, то есть лишь по некоторым кристаллографическим плоскостям и лишь в некотором кристаллографическом направлении. В силу неоднородного и неодинакового развития деформации в различных участках кристаллической среды между этими участками возникает интенсивное взаимодействие через эволюцию полей микронапряжений.
В то же время существуют кристаллы, в которых анизотропия отсутствует.
В физике мартенситной неупругости накоплен богатый экспериментальный материал, особенно по вопросам эффектов памяти формы и пластичности превращения. Экспериментально доказано важнейшее положение кристаллофизики о преимущественном развитии неупругих деформаций почти исключительно посредством мартенситных реакций. Однако принципы построения физической теории мартенситной неупругости неясны. Аналогичная ситуация имеет место в случае деформации кристаллов механическим двойникованием.
Значительные успехи достигнуты в изучении дислокационной пластичности металлов. Здесь не только понятны основные структурно-физические механизмы реализации процессов неупругой деформации, но и созданы эффективные способы расчёта явлений.
Физические науки, изучающие кристаллы[править | править код]
Вообще, изучением свойств реальных кристаллов занимается огромная научная отрасль; достаточно сказать, что все полупроводниковые свойства некоторых кристаллов (на основе которых создаётся точная электроника и, в частности, компьютеры) возникают именно за счёт дефектов.
- Агафонов В. К. Краткое наставление для приготовления моделей кристаллов // Программы и наставления для наблюдений и собирания коллекций по геологии, почвоведению, метеорологии, гидрологии, нивелировке, ботанике и зоологии, сельскому хозяйству и фотографии. [5-е изд.] СПб.: изд. Имп. СПб. О-ва Естествоисп. 1902. С. 30—35.
- Зоркий П. М. Симметрия молекул и кристаллических структур. М.: изд-во МГУ, 1986. — 232 с.
- Лихачёв В. А., Малинин В. Г. Структурно-аналитическая теория прочности. — СПб: Наука. — 471 с.
- Савельев И. В. Курс общей физики. М.: Астрель, 2001. ISBN 5-17-004585-9.
- Шаскольская М. П.. Кристаллы. М.: Наука, 1985. 208 с.
- Шретер В., Лаутеншлегер К.-Х., Бибрак Х. и др. Химия: Справ. изд. М.: Химия, 1989.
- Шубников А. В., Флинт Е. А., Бокий Г. Б., Основы кристаллографии, М.— Л., 1940.
- Шаскольская М., Кристаллы, М., 1959; Костов И., Кристаллография, пер. с болг., М., 1965.
- Банн Ч., Кристаллы, пер. с англ., М., 1970;
- Най Дж., Физические свойства кристаллов и их описание при помощи тензоров и матриц, пер. с англ., 2 изд., М., 1967.
- Чередов В. Н. Дефекты в синтетических кристаллах флюорита. СПб: Наука. — 1993. — 112 c.