Химическое вещество — это… Что такое Химическое вещество?
Вещество́ — форма материи, в отличие от поля, обладающая массой покоя. Вещество состоит из частиц, среди которых чаще всего встречаются электроны, протоны и нейтроны. Последние два образуют атомные ядра, а все вместе — атомы, молекулы, кристаллы и т. д.
В биологии Вещество́ — форма материи, образующая ткани организмов, входящая в состав органелл клеток.
Различие между веществом и полем
Поле, в отличие от веществ, характеризуется непрерывностью, известны электромагнитное и гравитационное поля, поле ядерных сил, волновые поля различных элементарных частиц.
Современное естествознание нивелирует различие между веществом и полем, считая, что и вещества, и поля состоят из различных частиц, обладающих корпускулярно-волновой (двойственной) природой. Выявление тесной взаимосвязи между полем и веществом привело к углублению представлений о единстве всех форм и структуры материального мира.
Однородное вещество характеризуется плотностью — отношением массы вещества к его объёму:
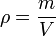
где ρ — плотность вещества, m — масса вещества, V — объём вещества.
Физические поля такой плотностью не обладают.
Свойства вещества
Каждому веществу присущ набор специфических свойств — объективных характеристик, которые определяют индивидуальность конкретного вещества и тем самым позволяют отличить его от всех других веществ. К наиболее характерным физико-химическим свойствам относятся константы — плотность, температура плавления, температура кипения, термодинамические характеристики, параметры кристаллической структуры. К основным характеристикам вещества принадлежат его химические свойства.
Разнообразие веществ
Число веществ в принципе неограниченно велико; к известному числу веществ всё время добавляются новые вещества, как открываемые в природе, так и синтезируемые искусственно.
Индивидуальные вещества и смеси
В химии принято разделять все объекты изучения на индивидуальные вещества (иначе — соединения) и их смеси. Под индивидуальным веществом понимают абстрактное понятие, обозначающее набор атомов, связанных друг с другом по определённому закону. Граница между индивидуальным веществом и смесью веществ довольно расплывчата, так как существуют вещества непостоянного состава, для которых, вообще говоря, нельзя предложить точной формулы. Кроме того, индивидуальное вещество остаётся абстракцией в силу того, что практически достижима лишь конечная чистота вещества. Это значит, что любой конкретный, реально существующий образец представляет собой смесь веществ, пусть и с подавляющим преобладанием одного из них. Несмотря на кажущуюся надуманность этого ограничения, зачастую чистота вещества играет ключевую роль в его свойствах. Так, знаменитая прочность титана проявляется только после того, как он очищен от кислорода до определённого предела (менее сотых долей процента).
Агрегатные состояния
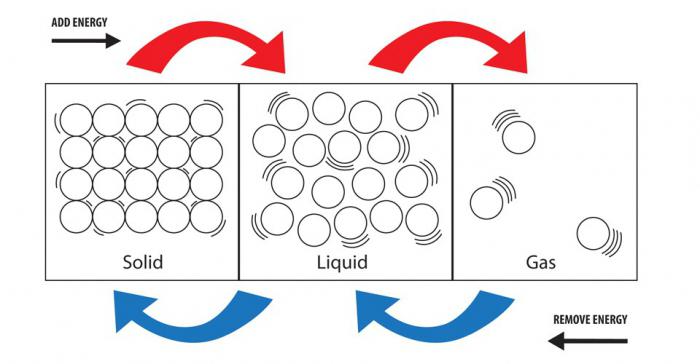
Все вещества в принципе могут существовать в трёх агрегатных состояниях — твёрдом, жидком и газообразном. Так, лёд, жидкая вода и водяной пар — это твёрдое, жидкое и газообразное состояния одного и того же вещества — воды H2O. Твёрдая, жидкая и газообразная формы не являются индивидуальными характеристиками веществ, а соответствуют лишь различным, зависящим от внешних физических условий состояниям существования веществ. Поэтому нельзя приписывать воде только признак жидкости, кислороду — признак газа, а хлориду натрия — признак твёрдого состояния. Каждое из этих (и всех других веществ) при изменении условий может перейти в любое другое из трёх агрегатных состояний.
При переходе от идеальных моделей твёрдого, жидкого и газообразного состояний к реальным состояниям вещества обнаруживается несколько пограничных промежуточных типов, общеизвестными из которых являются аморфное (стеклообразное) состояние, состояние жидкого кристалла и высокоэластичное (полимерное) состояние. В связи с этим часто пользуются более широким понятием «фаза».
В физике рассматривается четвёртое агрегатное состояние вещества — плазма, частично или полностью ионизированное состояние, в котором плотность положительных и отрицательных зарядов одинакова (плазма электронейтральна).
Кристаллы
Кристаллы — это твёрдые вещества, имеющие естественную внешнюю форму правильных симметричных многогранников, основанную на их внутренней структуре, то есть на одном из нескольких определённых регулярных расположений составляющих вещество частиц (атомов, молекул, ионов). Кристаллическая структура, будучи индивидуальной для каждого вещества, относится к основным физико-химическим свойствам. Составляющие данное твёрдое вещество частицы образуют кристаллическую решётку. Если кристаллические решётки стереометрически (пространственно) одинаковы или сходны (имеют одинаковую симметрию), то геометрическое различие между ними заключается, в частности, в разных расстояниях между частицами, занимающими узлы решётки. Сами расстояния между частицами называются параметрами решётки. Параметры решётки, а также углы геометрических многогранников определяются физическими методами структурного анализа, например методами рентгеновского структурного анализа.
Часто твёрдые вещества образуют (в зависимости от условий) более чем одну форму кристаллической решётки; такие формы называются полиморфными модификациями. Например, среди простых веществ известны ромбическая и моноклинная сера, графит и алмаз, которые являются гексагональной и кубической модификациями углерода, среди сложных веществ — кварц, тридимит и кристобалит представляют собой различные модификации диоксида кремния.
Неорганические вещества
Органические вещества
Литература
- Химия: Справ. изд./ В. Шретер, К.-Х. Лаутеншлегер, Х. Бибрак и др.: Пер. с нем. — М.: Химия, 1989
См. также
Wikimedia Foundation. 2010.
dic.academic.ru
Какие бывают вещества? Какие бывают вещества в природе?
Еще в младших классах в школе детям рассказывают, что такое вещества, приводят простые примеры и объясняют, какие бывают вещества.
Определение слова «вещество»

Попросту говоря, веществом можно назвать все то, из чего состоит любое тело. В более старших классах веществом называют материю, из которой состоит физическое тело, и она имеет определенные физические и химические свойства. Веществом также называют совокупность атомов или молекул, которые находятся в определенном агрегатном состоянии. Все вещества составляют определенное тело. В основном мы пересекаемся с его твердым состоянием, в котором частицы могут держать форму и не растекаться. Но в нём могут находиться жидкие и газообразные вещества. То есть какие бывают вещества и тела в плане происхождения? Тела могут быть созданы природой и благодаря человеческому вмешательству.
 Обычный камень, который валяется в горах, создала природа, а выращенный в лаборатории минерал, вставленный в оправу – это уже дело рук человека, искусственное тело. А вот все вещества, которые являются простыми (об этом поговорим далее), созданы природой. Разные их смеси уже могли создать и люди, но основной базис заложен именно ею. Отвечая на вопрос, какие бывают вещества и тела, можно сказать, что они разделяются на естественные и искусственно созданные.
Обычный камень, который валяется в горах, создала природа, а выращенный в лаборатории минерал, вставленный в оправу – это уже дело рук человека, искусственное тело. А вот все вещества, которые являются простыми (об этом поговорим далее), созданы природой. Разные их смеси уже могли создать и люди, но основной базис заложен именно ею. Отвечая на вопрос, какие бывают вещества и тела, можно сказать, что они разделяются на естественные и искусственно созданные.Виды веществ по взаимодействию частиц, или по агрегатному состоянию
Вещество разделяют на несколько групп по разным характеристикам. Так, можно охарактеризовать, какие бывают вещества в зависимости от взаимодействия частиц. Сильное взаимодействие частиц характерно для твердых веществ. Газам свойственно практически абсолютное отсутствие взаимодействия. Жидкие вещества находится посредине между твердым и газообразным материалом – частицы взаимодействуют, но не так сильно, как в твердых телах. Это свойство объясняется тем, что между частицами, которые составляют материал, есть промежутки, и в твердых материалах эти промежутки очень маленькие, а в газообразных они огромные. На такие же группы вещества разделяются кинетической энергией, имеющейся в частицах, и потенциальной энергией взаимодействия. В жидкостях эти энергии практически сравнимы. В твердых телах преобладает потенциальная энергия, в газах, наоборот, кинетическая. Ответом на вопрос, какие бывают вещества в природе, может стать любой из этих вариантов. Любые из выше перечисленных состояний или характеристик встречаются как в объектах, созданных природой, так и в вещах, появившихся в результате деятельности человека.
Интересно, что одно вещество может находиться в разных состояниях. Так, самый простой пример – это вода. При пониженных температурах жидкость превращается в лед, в твердое тело. При повышении температуры до 100 градусов Цельсия и выше вода из жидкости превращается в газ.
Разделение веществ в химическом плане
В химии принято распределять вещества на две основные категории – это индивидуальные вещества и смеси. То есть какие бывают вещества в химии? Чистыми ранее, а теперь индивидуальными веществами называются такие, которые нельзя разделить на более простые части, они неделимы. Смеси же являются материалами, имеющие в своём составе несколько компонентов. По факту выходит, что смесь может состоять из нескольких индивидуальных веществ.
В свою очередь, индивидуальное вещество может быть простым или сложным. Простое – это такое вещество, которое состоит из атомов только лишь одного химического элемента, сложное – из нескольких: двух или более. Простое еще называют элементарным, а сложное вещество — соединением.
Как было сказано ранее, смесь состоит из нескольких чистых веществ, и в этом плане их подразделяют на однородные и неоднородные, или растворы и механические смеси. Простой пример того, какие бывают вещества типа раствора – это обычный чай. Он состоит из двух или трех компонентов — вода, заварка и сахар. Сахар однородно размещается по воде и его невозможно обнаружить, кроме как на вкус.
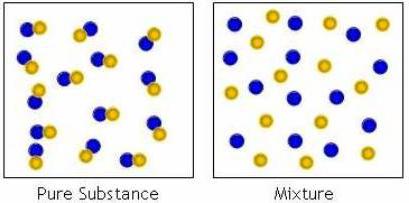 А вот если в чай насыпать много сахара, и он не растворится полностью, то это уже будет механическая смесь. Часть сахара растворится, а часть будет лежать на дне. Из-за этого и пробы чая в верхних слоях будут немного отличаться, внизу он будет более сладкий, а верху – менее. Смесью также будет элементарное смешение песка и сахара. Частицы будут перемешаны, их будет трудно разделить, но они останутсясь при своих свойствах, а не создадут новые соединения.
А вот если в чай насыпать много сахара, и он не растворится полностью, то это уже будет механическая смесь. Часть сахара растворится, а часть будет лежать на дне. Из-за этого и пробы чая в верхних слоях будут немного отличаться, внизу он будет более сладкий, а верху – менее. Смесью также будет элементарное смешение песка и сахара. Частицы будут перемешаны, их будет трудно разделить, но они останутсясь при своих свойствах, а не создадут новые соединения.Органические и неорганические вещества
На вопрос, какие бывают вещества в природе, можно ответить: органические и неорганические. Неорганическим является любое вещество, которое может образоваться без участия живого организма и составляет неживую природу. Органическое вещество диаметрально противоположно – оно образуется только при участии живого организма и входит в состав этого самого живого организма. Примером неорганического вещества опять-таки является всем известная, доступная и такая необходимая для жизни вода, также воздух, а именно кислород, различные минеральные соли. К органическим веществам относятся жиры, углеводы, пигменты, белки. Забавно, что раздел по данному типу был произведен из мнения ученых о живых существах как об особых органических соединениях, а все остальные объекты неживой природы были зачислены к неорганическим. Как позже выяснилось, в организме человека достаточно много неорганических веществ, как, впрочем, и в организме любого животного на нашей планете.
Отличительной чертой органических веществ можно считать то, что почти во всех из них имеется углерод. Большинство неорганических веществ имеют высокую температуру плавления и кипения, органические – наоборот.
Разделение по пожарным нормам
 Интересно, что на вопрос, какие бывают вещества и материалы, пожарник, скорее всего ответит – горючие и негорючие. Между ними еще имеются трудновоспламеняемые вещества, которые способны загореться, если присутствует постоянное воздействие пламени, но если убрать источник, оно тухнет. Соответственно, горючее вещество или материал способны гореть при воздействии источника, а также могут даже самовоспламеняться. Негорючее вещество не способно гореть в воздухе. Более подробно об этом все дети узнают на уроках охраны труда или безопасности жизнедеятельности.
Интересно, что на вопрос, какие бывают вещества и материалы, пожарник, скорее всего ответит – горючие и негорючие. Между ними еще имеются трудновоспламеняемые вещества, которые способны загореться, если присутствует постоянное воздействие пламени, но если убрать источник, оно тухнет. Соответственно, горючее вещество или материал способны гореть при воздействии источника, а также могут даже самовоспламеняться. Негорючее вещество не способно гореть в воздухе. Более подробно об этом все дети узнают на уроках охраны труда или безопасности жизнедеятельности.Влияние на организм человека
Все вещества, имеющиеся в природе, можно разделить на опасные и безопасные. К опасным можно причислить те, которые уже были упомянуты выше – горящие. В чем состоит опасность? Они могут навредить здоровью человека, который будет находиться в очаге возгорания. Это будет физическое воздействие на кожу: ожоги или воздействие на внутренние органы через дыхательные пути. Кстати, таким же образом негативное воздействие происходит во время курения. Курение не только табачных изделий, в которых содержится много известных вредных для человеческого организма веществ, но и наркотических средств.
Какие бывают наркотические вещества
 Не все из наркотиков принимаются посредством курения, некоторые из них вкалывают в вену, вдыхают в качестве порошка через нос или же съедают как таблетку. Но все из них имеют побочные эффекты, несмотря на то, что перед этим могли принести ощущение радости и счастья, приподнятое настроение или еще какой-то положительный эффект. Все эти эффекты кратковременны, а вот то, что вред от них однозначно будет длиться намного дольше, знают все.
Не все из наркотиков принимаются посредством курения, некоторые из них вкалывают в вену, вдыхают в качестве порошка через нос или же съедают как таблетку. Но все из них имеют побочные эффекты, несмотря на то, что перед этим могли принести ощущение радости и счастья, приподнятое настроение или еще какой-то положительный эффект. Все эти эффекты кратковременны, а вот то, что вред от них однозначно будет длиться намного дольше, знают все.Выводы
Если попросить ребенка: «Скажи, какие бывают вещества и материалы, приведи примеры», то у него будет много разных вариантов ответа. Важно дать понять школьнику, что одно и тоже вещество может принадлежать к нескольким видам, которые были перечислены выше, различаться по определенным характеристикам. С самого малого возраста знания о том, какие бывают вещества, будут расширяться по мере изучения школьных наук.
fb.ru
Какие есть вещества?
Понятие вещества изучается сразу несколькими науками. Вопрос о том, какие есть вещества, мы разберём с двух точек зрения — с позиции химической науки и с позиции физики.
Вещество в химии и физике
Химики понимают вещество, как физическую субстанцию с определённым набором химических элементов. В современной физике вещество рассматривается как вид материи, который состоит из фермионов или вид материи, содержащий в себе фермионы, бозоны, обладает массой покоя. По обыкновению, вещество должно состоять из частиц, по большей части электронов, протонов и нейтронов. Протоны и нейтроны образуют атомные ядра, а все вместе эти элементы образуют атомы (атомное вещество).
Свойства вещества
Практически каждое из веществ имеет свой уникальный набор свойств. Под свойствами понимают характеристики, указывающие на индивидуальность вещества, которая в свою очередь демонстрирует его отличия от всех остальных веществ. Характерными физико-химическими свойствами являются константы — плотность, различные типы температур, термодинамика, показатели кристаллической структуры.
Химическая классификация веществ
В химии разделяют вещества на соединения и их смеси. Кроме того, следует сказать органические вещества Соединение — это есть набор атомов, которые связаны друг с другом с учётом определённых закономерностей. При этом следует отметить, что границу между соединением и смесью веществ определить чётко довольно сложно. Это обусловлено тем, что науке известны вещества непостоянного состава. Для них составить точную формулу невозможно. Кроме того, соединение — это по большому счёту абстракция, так как в практическом смысле может быть достигнута только лишь конечная чистота изучаемого вещества. Любой существующий в реальной жизни образец — это смесь веществ, но с преобладанием одного вещества из всей группы. Кроме того, следует сказать, какие есть органические вещества. Эта группа сложных веществ имеет в составе углерод (белки, углеводы).
Простые и сложные вещества
Простые вещества(O2, O3, h3, Cl2) — это те вещества, которые состоят только из атомов одного химического элемента. Эти вещества — есть форма существования элементов в свободном виде. Другими словами, эти химические элементы, которые не связаны с другими элементами, образуют простые вещества. Таких веществ науке известно более чем 400 разновидностей. Простые вещества классифицируют по типу связи между атомами. Так, простые вещества разделяют на металлы(Na, Mg, Al, Bi и др.) и неметаллы (H2, N2, Br2, Si и др).
Сложные вещества — химические соединения, которые состоят из связанных друг с другом атомов двух и более элементов. Простые вещества также имеют право называться химическими соединениями, если их молекулы будут состоять из атомов, соединённых ковалентной связью (азот, кислород, бром, фтор,). А вот инертные (благородные) газы и атомарный водород называть химическими соединениями будет ошибкой.
Физическая классификация веществ
С точки зрения физики вещества существуют в нескольких агрегатных состояниях — тело, жидкость и газ. О том, какие твердые вещества, например, видно невооружённым взглядом. Тоже самое можно сказать и о другом агрегатном состоянии. Какие жидкие вещества есть в природе мы со школы знаем. Примечательно, что такое вещество как вода может существовать сразу в трёх состояния — как лёд, жидкая вода и пар. Три агрегатных состояния вещества не считаются индивидуальными характеристиками веществ, но соответствуют разным, зависимым от внешних условий существования веществ. При переходе от состояний агрегатных состояний к реальным состояниям химического вещества можно выявить ряд промежуточных типов, которые в науке получили название аморфных или стеклообразных состояний, а также состояния жидкого кристалла и полимерного состояние. В связи с этим учёные часто используют понятие «фаза».
Помимо прочих в физике рассматривают ещё и четвёртое агрегатное состояние химического вещества. Это плазма, то есть состояние, полностью или частично ионизированное, а плотность положительных и отрицательных зарядов в этом состоянии одинакова, иными словами плазма электронейтральна. В целом, веществ в природе множество, но теперь вы знаете, какие бывают вещества, а это гораздо важнее.elhow.ru
Вещество — это… Что такое Вещество?
Вещество в химии — физическая субстанция со специфическим химическим составом. В философском словаре Григория Теплова в 1751 году словом вещество переводился латинский термин Substantia.
Вещество в современной физике как правило понимается как вид материи, состоящий из фермионов или содержащий фермионы наряду с бозонами; обладает массой покоя, в отличие от некоторых типов полей, как например электромагнитное[1]. Обычно (при сравнительно низких температурах и плотностях) вещество состоит из частиц, среди которых чаще всего встречаются электроны, протоны и нейтроны. Последние два образуют атомные ядра, а все вместе — атомы (атомное вещество), из которых — молекулы, кристаллы и т. д. В некоторых условиях, как например в нейтронных звездах, могут существовать достаточно необычные виды вещества.
Вещество в биологии — материя, образующая ткани организмов, входящая в состав органелл клеток.
Различие между веществом и полем
Исторически в физике делалось фундаментальное различие между веществом и полем. Поле, в отличие от вещества, мыслилось непрерывным и проницаемым, в то время как частицы вещества представлялись дискретными, или по крайней мере достаточно локализованными. Известные в классической физике поля, такие как электромагнитное и гравитационное, противопоставлялись массивным и иногда электрически заряженным частицам вещества.
Современная физика нивелирует различие между веществом и полем, считая, что все частицы (в том числе и частицы вещества, равно как и частицы, относящиеся к классическим полям) есть квантовые возбуждения различных фундаментальных полей, и так или иначе все частицы проявляют такие типично полевые свойства, как делокализованность и подчинение уравнениям движения по сути не отличающимся от полевых (о чем можно говорить как о волновых свойствах всех частиц, в том числе и частиц вещества). Выявление тесной взаимосвязи между полем и веществом привело к углублению представлений о единстве всех форм и структуры физической картины мира.
Впрочем в контексте задач, относящихся к классической физике, а иногда и несколько шире, бывает иногда довольно удобно пользоваться и старой терминологией, хотя в контексте физики в целом она уже и выглядит анахронизмом. Например, если речь идет о взаимодействии заряженных частиц с электромагнитным полем, довольно удобно, следуя традиции называть одно «полем», а другое «веществом», особенно если вещество рассматривается или чисто классически, или — если квантово — то в терминах волновых функций (что позволяет избежать чисто терминологически неудобного пересечения понятий).
Свойства вещества
Каждому веществу присущ набор специфических свойств — объективных характеристик, которые определяют индивидуальность конкретного вещества и тем самым позволяют отличить его от всех других веществ. К наиболее характерным физико-химическим свойствам относятся константы — плотность, температура плавления, температура кипения, термодинамические характеристики, параметры кристаллической структуры. К основным характеристикам вещества принадлежат его химические свойства.
Классификация веществ
Основная статья: Классификация веществ
Число веществ в принципе неограниченно велико; к известному числу веществ всё время добавляются новые вещества, как открываемые в природе, так и синтезируемые искусственно.
Химическая классификация
Индивидуальные вещества и смеси
В химии принято разделять все объекты изучения на индивидуальные вещества (иначе — соединения) и их смеси. Под индивидуальным веществом понимают абстрактное понятие, обозначающее набор атомов, связанных друг с другом по определённому закону. Граница между индивидуальным веществом и смесью веществ довольно расплывчата, так как существуют вещества непостоянного состава, для которых, вообще говоря, нельзя предложить точной формулы. Кроме того, индивидуальное вещество остаётся абстракцией в силу того, что практически достижима лишь конечная чистота вещества. Это значит, что любой конкретный, реально существующий образец представляет собой смесь веществ, пусть и с подавляющим преобладанием одного из них. Несмотря на кажущуюся надуманность этого ограничения, зачастую чистота вещества играет ключевую роль в его свойствах. Так, знаменитая прочность титана проявляется только после того, как он очищен от кислорода до определённого предела (менее сотых долей процента).
Неорганические вещества
Органические вещества
Физическая классификация
Агрегатные состояния
Все химические вещества в принципе могут существовать в трёх агрегатных состояниях — твёрдом, жидком и газообразном. Так, лёд, жидкая вода и водяной пар — это твёрдое, жидкое и газообразное состояния одного и того же химического вещества — воды H2O. Твёрдая, жидкая и газообразная формы не являются индивидуальными характеристиками химических веществ, а соответствуют лишь различным, зависящим от внешних физических условий состояниям существования химических веществ. Поэтому нельзя приписывать воде только признак жидкости, кислороду — признак газа, а хлориду натрия — признак твёрдого состояния. Каждое из этих (и всех других веществ) при изменении условий может перейти в любое другое из трёх агрегатных состояний.
При переходе от идеальных моделей твёрдого, жидкого и газообразного состояний к реальным состояниям вещества обнаруживается несколько пограничных промежуточных типов, общеизвестными из которых являются аморфное (стеклообразное) состояние, состояние жидкого кристалла и высокоэластичное (полимерное) состояние. В связи с этим часто пользуются более широким понятием «фаза».
В физике рассматривается четвёртое агрегатное состояние вещества — плазма, частично или полностью ионизированное состояние, в котором плотность положительных и отрицательных зарядов одинакова (плазма электронейтральна).
При некоторых условиях (обычно достаточно отличающихся от обычных) те или иные вещества могут переходить в такие особые состояния, как сверхтекучее и сверхпроводящее.
Примечания
- ↑ Это различие было в прошлом одним из признаков классификации физических объектов на вещество и «поля», однако на настоящий момент такая классификация устарела: в основе вещества также лежат квантованные поля, а разделение фундаментальных полей на основные классы (сопоставимые со старым делением на вещество и поле) происходит в основном по признаку спина; хотя можно признать, что на некотором глубинном уровне все бозонные фундаментальные поля безмассовы, однако в итоге некоторые из них (например, поле-переносчик слабого взаимодействия) всё же приобретают массу, а механизм же приобретения массы фермионными полями недостаточно ясен, что мешает сделать массивность или безмассовость основой какой-то содержательной классификации, особенно учитывая что вопрос о наличии массы у нейтрино был долгое время открыт и решен лишь экспериментально.
Литература
- Химия: Справ. изд./ В. Шретер, К.-Х. Лаутеншлегер, Х. Бибрак и др.: Пер. с нем. — М.: Химия, 1989
См. также
 | В этой статье не хватает ссылок на источники информации. Информация должна быть проверяема, иначе она может быть поставлена под сомнение и удалена. Вы можете отредактировать эту статью, добавив ссылки на авторитетные источники. Эта отметка установлена 13 мая 2011. |
dic.academic.ru
Вещество в химии — это что? Свойства веществ. Классы веществ
Основной вопрос, на который должен знать ответ человек для правильного понимания картины мира – что такое вещество в химии. Данное понятие формируется ещё в школьном возрасте и направляет ребёнка в дальнейшем развитии. Приступая к изучению химии важно найти точки соприкосновения с ней на бытовом уровне, это позволяет наглядно и доступно разъяснить те или иные процессы, определения, свойства и т.д.
К сожалению, в силу неидеальности системы образования, многие упускают некоторые фундаментальные азы. Понятие «вещество в химии» – это своего рода краеугольный камень, своевременное усвоение данного определения даёт человеку правильный старт в последующем развитии в области естествознания.

Формирование понятия
Перед тем как перейти к понятию вещества, необходимо определить, чем является предмет химии. Вещества – это то, что непосредственно изучает химия, их взаимные превращения, строение и свойства. В общем понимании вещество – это то, из чего состоят физические тела.
Итак, что такое вещество в химии? Сформируем определение путём перехода от общего понятия к чисто химическому. Вещество – это определённый тип материи, обязательно имеющий массу, которую можно измерить. Данная характеристика отличает вещество от другого вида материи – поля, которое массы не имеет (электрическое, магнитное, биополе и т.д.). Материя, в свою очередь, – это то, из чего созданы мы и всё, что нас окружает.
Несколько другая характеристика материи, определяющая то, из чего конкретно она состоит – это уже предмет химии. Вещества сформированы атомами и молекулами (некоторые ионами), а значит любая субстанция, состоящая из этих формульных единиц, и есть вещество.
Простые и сложные вещества
После усвоения базового определения можно перейти к его усложнению. Вещества бывают различных уровней организации, то есть простые и сложные (или соединения) – это самое первое деление на классы веществ, химия имеет множество последующих разделений, подробных и более сложных. Эта классификация, в отличие от многих других, имеет строго определённые границы, каждое соединение можно чётко отнести к одному из видов, взаимоисключающих друг друга.

Простое вещество в химии – это соединение, состоящее из атомов только одного элемента из периодической таблицы Менделеева. Как правило, это бинарные молекулы, то есть состоящие из двух частиц, соединённых посредством ковалентной неполярной связи – образования общей неподелённой электронной пары. Так, атомы одного и того же химического элемента имеют идентичную электроотрицательность, то есть способность удерживать общую электронную плотность, поэтому она не смещена ни к одному из участников связи. Примеры простых веществ (неметаллы) — водород и кислород, хлор, йод, фтор, азот, сера и т.д. Из трёх атомов состоит молекула такого вещества, как озон, а из одного – всех благородных газов (аргона, ксенона, гелия и т.д.). В металлах (магнии, кальции, меди т.д.) существует свой собственный тип связи – металлический, осуществляющийся за счёт обобществления свободных электронов внутри металла, а образования молекул как таковых не наблюдается. При записи вещества металла указывается просто символ химического элемента без каких-либо индексов.
Простое вещество в химии, примеры которого были приведены выше, отличается от сложного качественным составом. Химические соединения образованы атомами разных элементов, от двух и более. В таких веществах имеет место ковалентный полярный или ионный тип связывания. Так как разные атомы имеют отличающуюся электроотрицательность, то при образовании общей электронной пары происходит её сдвиг в сторону более электроотрицательного элемента, что приводит к общей поляризации молекулы. Ионный тип – это крайний случай полярного, когда пара электронов полностью переходит к одному из участников связывания, тогда атомы (или их группы) превращаются в ионы. Чёткой границы, между этими типами нет, ионную связь можно интерпретировать как ковалентную сильно полярную. Примеры сложных веществ — вода, песок, стекло, соли, оксиды и т.д.

Модификации веществ
Вещества, именуемые простыми, на самом деле имеют уникальную особенность, которая не присуща сложным. Некоторые химические элементы могут образовывать несколько форм простого вещества. В основе всё так же лежит один элемент, но количественный состав, строение и свойства кардинально отличают такие образования. Эта особенность имеет название аллотропии.
Кислород, сера, углерод и другие элементы имеют несколько аллотропных модификаций. Для кислорода – это О2 и О3, углерод даёт четыре типа веществ – карбин, алмаз, графит и фуллерены, молекула серы бывает ромбической, моноклинной и пластической модификации. Такое простое вещество в химии, примеры которого не ограничены вышеперечисленными, имеет огромное значение. В частности, фуллерены используются как полупроводники в технике, фоторезисторы, добавки для роста алмазных плёнок и в других целях, а в медицине это мощнейшие антиоксиданты.
Что происходит с веществами?
Каждую секунду внутри и вокруг происходит превращение веществ. Химия рассматривает и объясняет те процессы, которые идут с качественным и/или количественным изменением состава реагирующих молекул. Параллельно, часто взаимосвязано протекают и физические превращения, которые характеризуются лишь изменением формы, цвета веществ или агрегатного состояния и некоторых других характеристик.
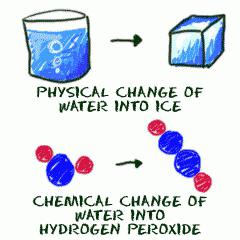
Химические явления – это реакции взаимодействия различных видов, например, соединения, замещения, обмена, разложения, обратимые, экзотермические, окислительно-восстановительные и т.д., в зависимости от изменения интересующего параметра. К физическим явлениям относят: испарение, конденсацию, сублимацию, растворение, замерзание, электропроводимость и т.д. Часто они сопровождают друг друга, например, молния во время грозы – это физический процесс, а выделение под её действием озона – химический.
Физические свойства
Вещество в химии – это материя, которой присущи определённые физические свойства. По их наличию, отсутствию, степени и интенсивности можно спрогнозировать, как вещество поведёт себя в тех или иных условиях, а также объяснить некоторые химические особенности соединений. Так, например, высокие температуры кипения органических соединений, в которых есть водород и электроотрицательный гетероатом (азот, кислород и т.д.), свидетельствуют о том, что в веществе проявляется такой химический тип взаимодействия, как водородная связь. Благодаря знанию о том, какие вещества имеют наилучшую способность проводить электрический ток, кабеля и провода электропроводки изготавливаются именно из определённых металлов.

Химические свойства
Установлением, исследованием и изучением другой стороны медали свойств занимается химия. Свойства веществ с её точки зрения – это их реакционная способность к взаимодействию. Некоторые вещества крайне активны в этом смысле, например, металлы или любые окислители, а другие, благородные (инертные) газы, при нормальных условиях в реакции практически не вступают. Химические свойства можно активировать или пассивировать при необходимости, иногда это не связано с особыми трудностями, а в некоторых случаях приходится нелегко. Учёные проводят многие часы в лабораториях, методом проб и ошибок добиваясь поставленных целей, иногда и не достигают их. Изменяя параметры окружающей среды (температуру, давление и т.д.) или применяя специальные соединения – катализаторы или ингибиторы — можно повлиять на химические свойства веществ, а значит и на ход реакции.
Классификация химических веществ
В основе всех классификаций лежит разделение соединений на органические и неорганические. Главный элемент органики – это углерод, соединяясь друг с другом и гидрогеном, атомы карбона образуют углеводородный скелет, который после заполняется другими атомами (кислородом, азотом, фосфором, серой, галогенами, металлами и другими), замыкается в циклы или разветвляется, обосновывая тем самым большое разнообразие органических соединений. На сегодняшний день науке известны 20 миллионов таких веществ. В то время как минеральных соединений всего лишь полмиллиона.
Каждое соединение индивидуально, но имеет и множество похожих черт с другими в свойствах, строении и составе, на этой основе происходит группировка в классы веществ. Химия имеет высокий уровень систематизации и организации, это точная наука.
Неорганические вещества
1. Оксиды – бинарные соединения с кислородом:
а) кислотные – при взаимодействии с водой дают кислоту;
б) основные – при взаимодействии с водой дают основание.
2. Кислоты – вещества, состоящие из одного или нескольких протонов водорода и кислотного остатка.
3. Основания (щёлочи) – состоят из одной или нескольких гидроксильных групп и атома металла:
а) амфотерные гидроксиды – проявляют свойства и кислот и оснований.
4. Соли – результат реакции нейтрализации между кислотой и щелочью (растворимым основанием), состоят из атома металла и одного или нескольких кислотных остатков:
а) кислые соли – анион кислотного остатка имеет в составе протон, результат неполной диссоциации кислоты;
б) основные соли – с металлом связана гидроксильная группа, результат неполной диссоциации основания.

Органические соединения
Классов веществ в органике великое множество, такой объём информации сложно сразу запомнить. Главное, знать основные разделения на алифатические и циклические соединения, карбоциклические и гетероциклические, предельные и непредельные. Также углеводороды имеют множество производных, в которых атом гидрогена замещён на галоген, кислород, азот и другие атомы, а так же функциональные группы.
Вещество в химии — это основа сущестования. Благодаря органическому синтезу человек на сегодняшний день имеет огромное количество искусственных веществ, заменяющих натуральные, а также не имеющих аналогов по своим характеристикам в природе.
fb.ru
Простые вещества — это… Что такое Простые вещества?

Простые вещества — вещества, состоящие исключительно из атомов одного химического элемента (из гомоядерных молекул)[1][2], в отличие от сложных веществ. Являются формой существования химических элементов в свободном виде[1][3]; или, иначе говоря, элементы, не связанные химически ни с каким другим элементом, образуют простые вещества[3]. Известно свыше 400 разновидностей простых веществ[2].
В зависимости от типа химической связи между атомами простые вещества могут быть металлами (Na, Mg, Al, Bi и др.) и неметаллами (H2, N2, Br2, Si и др.)[2].
Примеры простых веществ: молекулярные (O2, O3, H2, Cl2) и атомарные (He, Ar) газы; различные формы углерода, иод (I2), металлы (не в виде сплавов).
Аллотропные модификации
 Схемы строения различных модификаций углерода
Схемы строения различных модификаций углеродаa: алмаз, b: графит, c: лонсдейлит
d: фуллерен — букибол C60, e: фуллерен C540, f: фуллерен C70
g: аморфный углерод, h: углеродная нанотрубка
Один и тот же химический элемент зачастую может образовывать несколько типов простых веществ (аллотропия), называемых аллотропными модификациями. Явление аллотропии может быть обусловлено либо различным составом молекул данного элемента (аллотропия состава), либо различным строением молекул и способом размещения молекул (атомов) в кристаллах (аллотропия формы). Способность элемента к образованию соответствующих аллотропных модификаций обусловлена строением атома, которое определяет тип химической связи, строение молекул и кристаллов[2].
Различные аллотропные модификации могут переходить друг в друга. Для данного химического элемента его аллотропные модификации всегда различаются по физическим свойствам и химической активности (например, озон активнее кислорода, температура плавления алмаза больше, чем фуллерена)[4].
При нормальных условиях соответствующие простые вещества для 11 элементов являются газами (H, He, N, O, F, Ne, Cl, Ar, Kr, Xe, Rn), для 2 — жидкостями (Br, Hg), для остальных элементов — твёрдыми телами.
При комнатной температуре (либо близкой к ней) 5 металлов находятся в жидком либо полужидком состоянии, так как их температура плавления близка к комнатной:
Отношение понятий
Понятия «атом», «химический элемент» и «простое вещество» не следует смешивать. «Атом» — конкретное понятие, так как атомы существуют реально. «Химический элемент» — это собирательное, абстрактное понятие; в природе химический элемент существует в виде свободных или химически связанных атомов, то есть простых и сложных веществ.
Также нужно различать свойства (характеристики) простого вещества (совокупности частиц) и свойства (характеристики) химического элемента (изолированного атома определенного вида), см. таблицу ниже[4]:
Названия химических элементов и соответствующих простых веществ совпадают в большинстве случаев. Однако существуют и исключения. Например, названия аллотропных модификаций кислорода — кислород (дикислород O2) и озон; углерода — алмаз, графит, карбин, фуллерен.
Каждый химический элемент имеет свое условное обозначение — химический знак (символ). В ряде случаев химический знак может также выражать состав простого вещества (Zn, B, C, Ar). Однако, например, символ O обозначает только химический элемент, простое вещество «кислород» имеет формулу O2.
См. также
Примечания
- ↑ 1 2 Редкол.:Кнунянц И. Л. (гл. ред.) Химическая энциклопедия: в 5 т. — Москва: Советская энциклопедия, 1988. — Т. 1. — С. 361. — 623 с. — 100 000 экз.
- ↑ 1 2 3 4 Ахметов Н.С. Общая и неорганическая химия. — 4 изд., испр. — Москва: Высшая школа, Издательский центр «Академия», 2001. — С. 253-269. — 743 с. — 15 000 экз. — ISBN 5-06-003363-5, 5-7695-0704-7
- ↑ 1 2 Глинка Н.Л. Общая химия. — 24 изд., испр. — Ленинград: Химия, 1985. — С. 18-19. — 702 с.
- ↑ 1 2 Врублевский А.И. Химия: базовый школьный курс. — Минск: Юнипресс, 2009. — С. 11-12. — 576 с. — 3 100 экз. — ISBN 978-985-507-813-6
Литература
- Ахметов Н.С. Общая и неорганическая химия. — 4 изд., испр. — Москва: Высшая школа, Издательский центр «Академия», 2001. — 743 с. — 15 000 экз. — ISBN 5-06-003363-5, 5-7695-0704-7.
- Врублевский А.И. Химия: базовый школьный курс. — Минск: Юнипресс, 2009. — 576 с. — 3 100 экз. — ISBN 978-985-507-813-6.
Ссылки
biograf.academic.ru
Химические вещества: примеры, свойства :: SYL.ru
Элементарными частицами физической материи на нашей планете являются атомы. В свободном виде они могут существовать только при очень высоких температурах. В обычных условиях элементарные частицы стремятся к объединению между собой при помощи химических связей: ионной, металлической, ковалентной полярной или неполярной. Таким способом образуются вещества, примеры которых мы и рассмотрим в нашей статье.
Простые вещества
Процессы взаимодействия между собой атомов одного и того же химического элемента заканчиваются образованием химических веществ, называемых простыми. Так, уголь образован только атомами углерода, газ водород – атомами гидрогена, а жидкая ртуть состоит из частиц ртути. Понятие простое вещество не нужно отождествлять с понятием химического элемента. Например, углекислый газ состоит не из простых веществ углерода и кислорода, а из элементов карбона и оксигена. Условно соединения, состоящие из атомов одного и того же элемента, можно разделить на металлы и неметаллы. Рассмотрим некоторые примеры химических свойств таких простых веществ.

Металлы
Исходя из положения металлического элемента в периодической системе, можно выделить следующие группы: активные металлы, элементы главных подгрупп третьей – восьмой групп, металлы побочных подгрупп четвертой – седьмой групп, а также лантаноиды и актиноиды. Металлы – простые вещества, примеры которых мы приведем далее, имеют следующие общие свойства: тепло- и электропроводность, металлический блеск, пластичность и ковкость. Такие характеристики присущи железу, алюминию, меди и другим. С увеличением порядкового номера в периодах возрастают температуры кипения, плавления, а также твердость металлических элементов. Это объясняется сжатием их атомов, то есть уменьшением радиуса, а также накоплением электронов. Все параметры металлов обусловлены внутренним строением кристаллической решетки данных соединений. Ниже рассмотрим химические реакции, а также приведем примеры свойств веществ, относящихся к металлам.
Особенности химических реакций
Все металлы, имеющие степень окисления 0, проявляют только свойства восстановителей. Щелочные и щелочноземельные элементы взаимодействуют с водой с образованием химически агрессивных оснований – щелочей:
Типичная реакция металлов – окисление. В результате соединения с атомами кислорода, возникают вещества класса оксидов:
Это бинарные соединения, относящиеся к сложным веществам. Примерами основных окислов являются оксиды натрия Na2O, меди CuO, кальция CaO. Они способны ко взаимодействию с кислотами, в результате в продуктах обнаруживается соль и вода:

Вещества классов кислот, оснований, солей относятся к сложным соединениям и проявляют разнообразные химические свойства. Например, между гидроксидами и кислотами происходит реакция нейтрализации, приводящая к появлению соли и воды. Состав солей будет зависеть от концентрации реагентов: так, при избытке в реагирующей смеси кислоты, получаются кислые соли, например, NaHCO3 – гидрокарбонат натрия, а высокая концентрация щелочи вызывает образование основных солей, таких как Al(OH)2Cl – дигидроксохлорид алюминия.
Неметаллы
Наиболее важные неметаллические элементы находятся в подгруппах азота, карбона, а также относятся к группам галогенов и халькогенов периодической системы. Приведем примеры веществ, относящихся к неметаллам: это сера, кислород, азот, хлор. Все их физические особенности противоположны свойствам металлов. Они не проводят электрический ток, плохо пропускают тепловые лучи, имеют низкую твердость. Взаимодействуя с кислородом, неметаллы образуют сложные соединения – кислотные оксиды. Последние, реагируя с кислотами, дают кислоты:
Типичная реакция, характерная для кислотных окислов – это взаимодействие со щелочами, приводящее к появлению соли и воды.
Химическая активность неметаллов в периоде усиливается, это связано с увеличением способности их атомов притягивать электроны от других химических элементов. В группах наблюдаем обратное явление: неметаллические свойства ослабевают вследствие раздувания объема атома за счет добавления новых энергетических уровней.

Итак, мы рассмотрели виды химических веществ, примеры, иллюстрирующие их свойства, положение в периодической системе.
www.syl.ru