Незаменимые пищевые вещества — Википедия
Материал из Википедии — свободной энциклопедии
Незамени́мые пищевы́е вещества́ (эссенциальные пищевые вещества) — это вещества, необходимые для нормальной жизнедеятельности человека или животного, но не синтезируемые его организмом или синтезируемые в недостаточном количестве. Получить незаменимые вещества (например, ниацин или холин) человек или животное может только с пищей[1][2][3].
Необходимые для человека вещества и факторы, которые обычно не считают пищевыми[править | править код]
Перечень незаменимых пищевых веществ[править | править код]
Незаменимые пищевые вещества различны для разных видов живых организмов. Например, большинство видов млекопитающих способно синтезировать в организме аскорбиновую кислоту, полностью покрывая потребности метаболизма в ней без внешних дополнительных источников. Следовательно, она не считается незаменимой для этих животных. Но она является незаменимым элементом в пище людей, которые нуждаются во внешних источниках аскорбиновой кислоты (в контексте питания известной как витамин C).
Потребности организма человека колеблются широко. Так, человек массой 70 кг содержит 1,0 кг кальция, но только 3 мг кобальта
К незаменимым пищевым веществам для человека относят следующие четыре категории:[3]
Незаменимые жирные кислоты[править | править код]
Незаменимые аминокислоты для взрослых людей[править | править код]
Незаменимые аминокислоты для детей, не для взрослых[править | править код]
Витамины[править | править код]
- биотин (витамин B7, витамин H),
- холин (витамин B4),
- фолат (фолиевая кислота, витамин B9, витамин M),
- ниацин (витамин B3, витамин P, витамин PP),
- пантотеновая кислота (витамин B5),
- рибофлавин (витамин B2, витамин G),
- тиамин (витамин B1),
- витамин A (ретинол),
- витамин B6 (пиридоксин, пиридоксамин или пиридоксаль),
- витамин B12 (кобаламин),
- витамин C (аскорбиновая кислота),
- витамин D (эргокальциферол или холекальциферол),
- витамин E (токоферол),
- витамин K (нафтохиноны).
Незаменимые минеральные соли[править | править код]
Минеральные соли в составе пищи — это химические элементы, которые должны содержаться в пище живых организмов помимо четырёх основных химических элементов: углерода, водорода, азота и кислорода, присутствующих в обычных органических молекулах[8]. Термин «минеральные соли» подчёркивает именно ионное состояние этих элементов, а не нахождение их в форме химических соединений или природных ископаемых минералов
Важность получения «минеральных солей» с пищей вызвана тем фактом, что эти элементы входят в состав ферментов и других необходимых организму веществ — участников биохимических реакций[10]. Следовательно, для сохранения оптимального здоровья требуются соответствующие уровни потребления определённых химических элементов.
По мнению специалистов по питанию, эти требования удовлетворяются просто обычным сбалансированным суточным рационом. Иногда рекомендуется потребление минеральных солей в составе определённых продуктов, богатых требуемыми элементами, в других случаях минеральные соли поступают в организм в виде добавок к пище — наиболее часто это йод в йодированной соли[3][11].
Точное количество незаменимых солей неизвестно. Некоторые авторы утверждают, что для поддержания биохимических процессов человека требуется шестнадцать элементов, играющих структурные и функциональные роли в организме [12]. Иногда делают различие между этой категорией и более общим понятием микроэлементов в составе пищи. Большинство незаменимых минеральных солей имеет относительно низкий атомный вес. Следующие химические элементы играют доказанные важные роли в биологических процессах:
| H | He | |||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Li | Be | B | C | N | O | F | Ne | |||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |
| Cs | Ba | La | * | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| Fr | Ra | Ac | ** | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | |||||||
| * | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | ||||
| ** | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | ||||
| Четыре основных биогенных элемента | Количественно определяемые элементы | Незаменимые элементы в микроконцентрации | Присутствующие элементы с неидентифицированной биологической функцией у человека |
| Элемент | РСД-рекомендуемая суточная доза/АП-адекватный приём | Количественное содержание | Категория | Недостаточность | Избыточность |
|---|---|---|---|---|---|
| Калий (K) | 4700 мг | Количественное содержание | является системным электролитом, незаменим при регулировании АТФ с натрием. Источники в рационе включают бобовые, картофель, томаты и бананы. | гипокалиемия | гиперкалиемия |
| Хлориды (Cl−) | 2300 мг | Количественное содержание | требуются для выработки соляной кислоты в желудке и при функционировании клеточного насоса. Столовая соль — основной источник в рационе. | гипохлоремия | гиперхлоремия |
| Натрий (Na) | 1500 мг | Количественное содержание | является системным электролитом, незаменим при регулировании АТФ с калием. Источники рациона столовая соль (натрия хлорид, основной источник), морские водоросли, молоко, шпинат. | гипонатриемия | гипернатриемия |
| Кальций (Ca) | 1000 мг | Количественное содержание | требуется для мышц, здоровья сердца и пищеварительной системы, необходимый элемент костей, поддерживает синтез и функцию клеток крови. Источники кальция в рационе включают молочные продукты, консервированную рыбу с костями (лосось, сардины), зелёные листовые овощи, орехи и семена. | гипокальцемия | гиперкальцемия |
| Фосфор (P)[13] | 700 мг | Количественное содержание | компонент костей (апатит), выработки энергии и многих других функций.[14] В биологическом контексте обычно в виде фосфата.[15] | гипофосфатемия | гиперфосфатемия |
| Магний (Mg) | 420 мг | Количественное содержание | требуется для реакций с АТФ и для костей. Источники в рационе включают орехи, соевые бобы и какао. | недостаточность магния | гипермагнеземия |
| Цинк (Zn)[16] | 11 мг | Следы | требуется для нескольких ферментов, таких как карбоксипептидаза, алкогольная дегидрогеназа печени, углеродная ангидраза. | недостаточность цинка | отравление цинком |
| Железо (Fe) | Следы | требуется для многих белков и ферментов, особенно гемоглобина. Источники в рационе включают красное мясо, зелёные листовые овощи, рыбу (тунец, лосось), сухофрукты, бобы, виноград, цельные и обогащённые зёрна. | анемия | нарушение обмена железа | |
| Марганец (Mn)[17] | 2,3 мг | Следы | является кофактором при функционировании ферментов. | недостаточность марганца | отравление марганцем |
| Медь (Cu)[18] | 900 мкг | Следы | требуемый компонент многих окислительно-восстановительных реакций, включая цитохром C оксидазу. | недостаточность меди | отравление медью |
| Йод (I) | 150 мкг | Следы | требуется для биосинтеза тироксина. | недостаточность йода | отравление йодом |
| Селен (Se)[19] | 55 мкг | Следы | кофактор, существенный для активности антиоксидантных ферментов, таких как глутатионпероксидаза. | недостаточность селена | селеноз |
| Молибден (Mo) | 45 мкг | Следы | оксидазы: ксантиноксидаза, альдегидоксидаза и сульфитоксидаза[20] | недостаточность молибдена |
Другие химические элементы с предполагаемой или известной ролью в здоровье человека[править | править код]
В различное время в отношении многих элементов предполагали роль в сохранении здоровья человека, заявлялось также и об их необходимости. Ни для одного из этих элементов не идентифицирован специфический белок или комплекс, и обычно такие притязания не подтверждались. Явным и точным доказательством биологического эффекта служит характеристика биомолекулы, содержащей этот микроэлемент, с идентифицируемой и проверяемой метаболической функцией[21]. Для элементов, присутствующих в следовых количествах, выделение и изучение таких молекул сопряжено с огромными трудностями в связи с их низкой концентрацией. С другой стороны, недостаточность этих микроэлементов трудно воспроизвести, так как они постоянно присутствуют в окружающей среде и организме, что вызывает сложности с доказательством биологического эффекта их отсутствия
- Сера (S) выступает во многих ролях[22]. Требуются относительно высокие количества её, но рекомендуемой суточной потребности нет,[23] поскольку сера входит в состав аминокислот и, следовательно, её количество будет адекватным в любом рационе, содержащем достаточное количество белка.
- Кобальт (Co) (как часть витамина B12). Для синтеза витамина B12 требуется кобальт, но по причине того, что в человеческом организме этот витамин не синтезируется (его производят бактерии), обычно рассматривается недостаточность витамина B12, а не собственно недостаточность кобальта.
- Хром (Cr)[24]. Иногда хром описывается как необходимый элемент[25][26]. Он подозревается в участии в углеводном обмене человека, что привело к возникновению рынка биологически активной добавки хрома пиколината, но решающего биохимического доказательства его физиологической функции не представлено[27].
- Фтор описан как условно необходимый, его классификация зависит от важности, придаваемой предупреждению кариеса и остеопороза[28].[29]
- Есть исследования, подтверждающие необходимость никеля (Ni),[30] но до настоящего времени не выработано рекомендуемой суточной потребности[24].
- Значение мышьяка (As), бора (B), брома, кадмия, кремния (Si)[24], вольфрама и ванадия установлено, по крайней мере, по специализированным биохимическим ролям структурных или функциональных кофакторов у других организмов. Похоже, что эти микроэлементы не необходимы для человека.
- ↑ Пища // Большая советская энциклопедия : [в 30 т.] / гл. ред. А. М. Прохоров. — 3-е изд. — М. : Советская энциклопедия, 1969—1978.
- ↑ 1 2 Hausman, P, 1987, The Right Dose. Rodale Press, Emaus, Pennsylvania. ISBN 0-87857-678-9
- ↑ 1 2 3 Pauling, L. (1986). How to Live Longer and Feel Better. New York NY 10019: Avon Books Inc.. ISBN 0-380-70289-4.
- ↑ Человек. Большая советская энциклопедия
- ↑ Pauling, L. (1986). How to Live Longer and Feel Better. New York NY 10019: Avon Books Inc. ISBN 0-380-70289-4.
- ↑ Скальный А., Рудаков И. Биоэлементы в медицине.2004,Изд. МИР, ОНИКС
- ↑ Pauling, L. (1986). How to Live Longer and Feel Better. New York NY 10019: Avon Books Inc.. ISBN 0-380-70289-4. Page 24.
- ↑ Биогенные элементы. Большая советская энциклопедия
- ↑ Элементы химические. Большая советская энциклопедия
- ↑ 1 2 Lippard, Stephen J.; Jeremy M. Berg (1994). Principles of Bioinorganic Chemistry. Mill Valley, CA: University Science Books. pp. 411. ISBN 0-935702-72-5.
- ↑ R. Bruce Martin «Metal Ion Toxicity» in Encyclopedia of Inorganic Chemistry, Robert H. Crabtree (Ed), John Wiley & Sons, 2006. DOI: 10.1002/0470862106.ia136
- ↑ Nelson, David L.; Michael M. Cox (2000-02-15). Lehninger Principles of Biochemistry, Third Edition (3 Har/Com ed.). W. H. Freeman. pp. 1200. ISBN 1-57259-931-6.
- ↑ Hausman P, 1987, The Right Dose. р. 470. Rodale Press, Emaus, Pennsylvania. ISBN 0-87857-678-9
- ↑ Corbridge, D. E. C. (1995-02-01). Phosphorus: An Outline of Its Chemistry, Biochemistry, and Technology (5th ed.). Amsterdam: Elsevier Science Pub Co. pp. 1220. ISBN 0-444-89307-5.
- ↑ Linus Pauling Institute at Oregon State University». [1]. Retrieved 2008-11-29.
- ↑ Hausman P, 1987, The Right Dose. р. 395. Rodale Press, Emaus, Pennsylvania. ISBN 0-87857-678-9
- ↑ Hausman, P, 1987, The Right Dose. р.469. Rodale Press, Emaus, Pennsylvania. ISBN 0-87857-678-9
- ↑ Hausman, P, 1987, The Right Dose. р.467. Rodale Press, Emaus, Pennsylvania. ISBN 0-87857-678-9
- ↑ Hausman P, 1987, The Right Dose. р.432. Rodale Press, Emaus, Pennsylvania. ISBN 0-87857-678-9
- ↑ Sardesai VM (December 1993). «Molybdenum: an essential trace element». Nutr Clin Pract 8 (6): 277-81. doi:10.1177/0115426593008006277. PMID 8302261.
- ↑ Микроэлементы. Большая советская энциклопедия
- ↑ Nelson, D. L.; Cox, M. M. «Lehninger, Principles of Biochemistry» 3rd Ed. Worth Publishing: New York, 2000. ISBN 1-57259-153-6.
- ↑ NSC 101 Chapter 8 Content». http://www.nutrition.arizona.edu/nsc101/chap08/ch08.htm Архивная копия от 30 сентября 2009 на Wayback Machine. Retrieved 2008-12-02.
- ↑ 1 2 3 Mertz, W. 1974. The newer essential trace elements, chromium, tin, vanadium, nickel and silicon. Proc. Nutr. Soc. 33 p. 307.
- ↑ Linus Pauling Institute Micronutrient Information Center (Oregon State University), Chromium Retrieved 2008-11-29.
- ↑ Eastmond DA, Macgregor JT, Slesinski RS (2008). «Trivalent chromium: assessing the genotoxic risk of an essential trace element and widely used human and animal nutritional supplement». Crit. Rev. Toxicol. 38 (3): 173-90. doi:10.1080/10408440701845401. PMID 18324515.
- ↑ Stearns DM (2000). «Is chromium a trace essential metal?». Biofactors 11 (3): 149-62. doi:10.1002/biof.5520110301. PMID 10875302.
- ↑ Cerklewski FL (May 1998). «Fluoride—essential or just beneficial». Nutrition 14 (5): 475-6. PMID 9614319. http://linkinghub.elsevier.com/retrieve/pii/S0899900798000239.
- ↑ Linus Pauling Institute at Oregon State University». http://lpi.oregonstate.edu/infocenter/minerals/fluoride/. Retrieved 2008-11-29.
- ↑ Anke M, Groppel B, Kronemann H, Grün M (1984). «Nickel—an essential element». IARC Sci. Publ. (53): 339-65. PMID 6398286.
| Название | Формула | Температура кипения, °C | Температура плавления, °C | Примечания |
|---|---|---|---|---|
| Гелий-4 | 4He | −268.928 | не затвердевает при обычном давлении | |
| Водород | H2 | −252.879 | −259.16 | есть орто- и пара-формы с разными температурами кипения |
| Неон | Ne | −246.046 | −248.59 | |
| Азот | N2 | −195.795 | −210.0 | |
| Угарный газ | CO | −191.5 | −205.02 | |
| Фтор | F2 | −188.11 | −219.67 | |
| Аргон | Ar | −185.848 | −189.34 | |
| Кислород | O2 | −182.962 | −218.79 | |
| Метан | CH4 | −182.5 | −164.00 | |
| Криптон | Kr | −153.415 | −157.37 | |
| Оксид азота(II) | NO | −151.74 | −163.6 | |
| Дифторид кислорода | F2O | −144.3 | −223.8 | |
| Трифторид азота | NF3 | −128.74 | −206.79 | |
| Тетрафторметан[1] | CF4 | −128,0 | −183.6 | |
| Моносилан[2] | SiH4 | −111.9 | −185 | |
| транс-Дифтордиазин | N2F2 | −111.45 | −172 | |
| Озон | O3 | −111.35 | −193 | |
| Ксенон | Xe | −108.099 | −111.75 | |
| цис-Дифтордиазин | N2F2 | −105.75 | ||
| этилен | CH2=CH2 | −103.7 | −169.2 | |
| Фторид фосфора(III) | PF3 | −101.8 | −151.5 | |
| Фторид хлора(I) | ClF | −101.1 | −155.6 | |
| Трифторид бора | BF3 | −99.9 | −126.8 | |
| Фторсилан | SiH3F | −98.6 | ||
| Трифторсилан | SiHF3 | −95 | −131 | |
| Трифторметилгипофторит[3] | CF3OF | −95 | ||
| Оксид азота(I) (Веселящий газ) | N2O | −88,48 | −90,86 | |
| Фосфин | PH3 | −87,75 | −133,8 | |
| Трифторид-оксид азота | NOF3 | −87,5 | −161 | |
| Тетрафторсилан | SiF4 | −86 | −90,2 | |
| 1,1-Дифторэтилен | CF2=CH2 | −85,5 | −144 | |
| Хлороводород | HCl | −85 | −114,17 | |
| Азидотрифторметан[4] | CF3N3 | −85 | −152 | |
| Фторид фосфора(V) | PF5 | −84,6 | −93,8 | |
| Карбонилфторид | COF2 | −84,5 | −111,2 | |
| Нитрозотрифторметан (трифторнитрозометан)[5] | CF3NO | −84 | −196,6 | |
| Трифторметан[1] | CHF3 | −82,2 | −155,15 | |
| Трифторхлорметан[1] | CClF3 | −81,5 | −181,0 | |
| Диоксид углерода | CO2 | −78,46 | сублимирует | |
| Фторметан[6] | CH3F | −78,4 | −137,8 | |
| Гексафторэтан[7] | CF3CF3 | −78,1 | −100 | |
| Пентафторметиламин[8] | CF3NF2 | −78 | −130 | |
| Дифторсилан | SiH2F2 | −77,8 | −122 | |
| Тетрафторэтилен | CF2=CF2 | −76 | −131,14 | |
| Фторацетилен[9] | FCCH | −74 | −196 | |
| Тетрафторгидразин | N2F4 | −74 | −164,5 | |
| Фторид нитрила | NO2F | −72,4 | −166 | |
| Фторэтилен[10] | CH2=CHF | −72 | −160,5 | |
| Трифторхлорсилан[11] | SiClF3 | −70 | −138 | |
| Трифторацетонитрил[5] | CF3CN | −68,8 | ||
| Дифторхлорамин[12] | NClF2 | −67 | −195 | |
| Бромоводород | HBr | −66,38 | −86,80 | |
| Бис(фторокси)дифторметан[3] | CF2(OF)2 | −64 | ||
| Гексафторид серы (элегаз)[13] | SF6 | −63,8 | сублимирует | |
| Арсин | AsH3 | −62,5 | −166 | |
| Радон | Rn | −61,7 | −71 | |
| Пентафтор-O-метилгидроксиламин[14] | CF3ONF2 | −60 | экстраполяция | |
| Фторид нитрозила | NOF | −59,9 | −132,5 | |
| Сероводород | H2S | −59,55 | −85,5 | |
| Трифторацетилфторид[15] | CF3COF | −59 | −159,5 | |
| Гексафтордиметиловый эфир[15] | CF3OCF3 | −59 | ||
| Бромтрифторметан[1] | CF3Br | −57,75 | −167,78 | |
| Метилсилан | CH3SiH3 | −57,5 | −156,5 | |
| Диоксидифторид | O2F2 | −57 | −163,5 | кипит с разложением на кислород и фтор |
| Сульфурилфторид | SO2F2 | −55,4 | −135,8 | |
| Фтордихлорсилан | SiHCl2F | −54,3 | ||
| Транс-1,2-дифторэтилен[16] | CHF=CHF | −53,1 | ||
| Трифторэтилен[10] | CF2=CHF | −53 | ||
| Пентафторид мышьяка | AsF5 | −52,8 | −79,8 | |
| Сульфид-трифторид фосфора | PSF3 | −52,25 | −148,8 | |
| Дифторметан (фреон-32) | CH2F2 | −52 | −136 | |
| Дифторкарбамоилфторид | F2NCOF | −52 | −152,2 | |
| Пентафторэтилгипофторит (пентафторфтороксиэтан)[3] | C2F5OF | −52 | −136 | |
| Станнан | SnH4 | −51,8 | −146 | |
| Тетрафторпропин | CF3C≡CF | −50,39 | ||
| Оксид-сульфид углерода (карбонилсульфид) | COS | −50,2 | −138,8 | |
| Кетен | CH2=C=O | −49,7 | −151 | |
| Оксид-тетрафторид серы(VI) | SOF4 | −48,5 | −99,6 | |
| Пентафторэтан | CF3CHF2 | −48,5 | −99,6 | |
| 3,3,3-Трифторпропин | CF3C≡CH | −48,1 | −100,6 | |
| Пропен | CH3CH=CH2 | −47,6 | −185,2 | |
| Дифторид-хлорид фосфора(III) | PClF2 | −47,3 | −164,8 | |
| Оксид-фторид-хлорид углерода | COClF | −47,2 | −148 | |
| 1,1,1-Трифторэтан | CH3CF3 | −47 | −111,8 | |
| Трифторметилгипохлорит | CF3OCl | −47 | −164 | |
| Перхлорилфторид | ClO3F | −46,75 | −147 | |
| Гексафторид селена | SeF6 | −46,6 | сублимирует | |
| Фторциан | FCN | −46 | −82 | |
| Нитрат фтора | FNO3 | −46 | −175 | |
| Нитрозопентафторэтан | C2F5NO | −45,7 | ||
| Цис-1,2-дифторэтилен | FCH=CHF | −45 | ||
| 1,1-Дифторпропен | CH3CH=CF2 | −44 | ||
| Трифторметил(фтор)силан | CF3SiH2F | −44 | ||
| Тионилфторид | SOF2 | −43,8 | −110,5 | |
| Тетрафторид-хлорид фосфора(V) | PF4Cl | −43,4 | −132 | |
| Метилдиборан | CH3B2H5 | −43 | ||
| Трифторметилдифторфосфин | CF3PF2 | −43 | ||
| N,N,1,1-Тетрафторметиламин | CHF2NF2 | −43 | ||
| Пропан | C3H8 | −42,25 | −187,7 | |
| Трифторметилтрифторсилан | CF3SiF3 | −42 | ||
| Бромтрифторсилан | SiF3Br | −41,7 | −70,5 | |
| Селеноводород | H2Se | −41,25 | −65,73 | |
| Дифторхлорметан | CHF2Cl | −40,7 | −175,42 | |
| Тетрафторид серы | SF4 | −40,45 | −125 | |
| Цис-гексафтордиазометан | CF3NNCF3 | −40 | −127 | |
| Оксид-трифторид фосфора | POF3 | −39,7 | Сублимирует | |
| Пентафторхлорэтан | CF3CF2Cl | −39,1 | −99 | |
| Трифторметилтетрафторфосфоран | CF3PF4 | −39 | −113 | |
| Гексафторид теллура | TeF6 | −38,9 | Сублимирует | |
| Винилдифторборан | CH2=CHBF2 | −38,8 | −133,4 | |
| (Трифторметил)силан | CF3SiH3 | −38,3 | −124 | |
| Гептафторэтиламин | CF3CF2NF2 | −38,1 | −183 | |
| Тетрафтораллен | CF2=C=CF2 | −38 | ||
| Гексафтороксетан | C3F6O | −38 | ||
| Трифторметантиол | CF3SH | −37,99 | −157,11 | |
| Фторэтан | CH3CH2F | −37,7 | −143,2 | |
| Бис(трифторметил)пероксид | CF3OOCF3 | −37 | ||
| Пентафторпропионитрил | CF3CF2CN | −37 | ||
| Гептафтордиметиламин | (CF3)2NF | −37 | ||
| Октафторпропан | CF3CF2CF3 | −36,8 | −147,7 | |
| Тетрафторид германия | GeF4 | −36,5 | ||
| Циклопропен | C3H4 | −36 | ||
| Трифторметилфторформиат | CF3C(O)F | −36 | −120 | |
| Трифторметилизоцианат | CF3NCO | −36 | ||
| Тетрафтор-1,2-диазетидин | C2F4N2H2 | −36 | ||
| Иодоводород | HI | −35,5 | −50,76 | |
| Гипофторит-пентафторид серы(VI) | SOF6 | −35,1 | −86 | |
| Трифторметил дифторметиловый эфир | CF3OCHF2 | −35,0 | −157 | |
| Пропадиен (Аллен) | CH2=C=CH2 | −34,8 | −136 | |
| Хлор | Cl2 | −34,04 | −101,5 | |
| Трифторметилфторформиат | FCOOCF3 | −34 | ||
| Тетрафтордиборан | B2F4 | −34 | −56 | |
| Аммиак | NH3 | −33,33 | −77,73 | |
| Нитротрифторметан | CF3NO2 | −32 | ||
| Дифтордихлорсилан | SiCl2F2 | −32 | −44 | |
| Дифтораминодифторацетонитрил | F2NCF2CN | −32 | ||
| Дифторметилен-бис-дифторамин | CF2(NF2)2 | −31,9 | −161,9 | |
| Транс-гексафтордиазометан | CF3NNCF3 | −31,1 | ||
| Циклопропан | C3H6 | −31 | −127,6 | |
| Монохлорсилан | SiHCl3 | −30,4 | −118 | |
| Гексафторпропилен | CF3CF=CF2 | −30,2 | −156,6 | |
| Хлорацетилен | CH≡CCl | −30 | −126 | |
| Метилтрифторсилан | CH3SiF3 | −30 | −73 | |
| Дифтордихлорметан | CCl2F2 | −29,8 | −157,7 | |
| Тетрафтордиазиридин | CF4N2 | −29 | ||
| Селена(VI) гипофторит-пентафторид | SeF5OF | −29 | ||
| Тетрафтороксетан | C2F4O | −28,6 | −117 | |
| Трифторхлорэтилен | C2F3Cl | −28,3 | −158,14 | |
| 2,3,3,3-Тетрафторпропен | CF3CF=CH2 | −28,3 | −152,2 | |
| Метилдифторфосфин | CH3PF2 | −28 | −110 | |
| Гексафторацетон | CF3COCF3 | −27,4 | −125,45 | |
| Трифтор(трифторметил)оксиран | CF3C2F3O | −27,4 | ||
| Тиазилтрифторид | N≡SF3 | −27,1 | −72,6 | |
| Трифторацетилхлорид | CF3COCl | −27 | −146 | |
| 3,3,3-Трифторпропен | CF3CH=CH2 | −27 | ||
| Формилфторид | HCOF | −26,5 | −142,2 | |
| 1,1,1,2-Тетрафторэтан | CF3CH2F | −26,1 | −103,3 | |
| Перфторметилвиниловый эфир | CF3OCF=CF2 | −26 | ||
| Метилтрифторметиловый эфир | CF3OCH3 | −25,2 | −149,1 | |
| Бис(трифторметил)нитроксил | (CF3)2NO | −25 | −70 | |
| Дифторхлорметилгипофторит[3] | CClF2OF | −25 | ||
| Серы(VI) пентафторид-цианид | SF5CN | −25 | −107 | |
| Диметиловый эфир | CH3OCH3 | −24,8 | −141,49 | |
| Оксид серы(IV) (Сернистый газ) | SO2 | −10,01 | −75,5 | |
| Фтордихлорметилгипофторит[3] | CFCl2OF | 0 | ||
| Гептафторид иода | IF7 | +4,8 | ||
| Фосген | COCl2 | +8.3 | −118 | |
| 2-Фторбутан | CH3CHFCH2CH3 | +25 | −121 |
Материя (физика) — Википедия
Материал из Википедии — свободной энциклопедии
У этого термина существуют и другие значения, см. Материя.Мате́рия (от лат. māteria «вещество») — одно из основных понятий физики, общий термин, определяющийся множеством всего содержимого пространства-времени и влияющее на его свойства.
Является объектом изучения физики, где рассматривается в качестве не зависящей от разума объективной реальности.
Понятие материи в разных областях физики[править | править код]
Определение материи расширялось с развитием различных областей науки. Раньше это были объекты, которые можно было описать классическими свойствами (масса, температура, делимость и т. п.), и в представлениях Ньютона об абсолютности пространства и времени, рассматриваемые независимо; с развитием оптики, а за ней специальной и общей теории относительности это понятие дополнилось его связями с гравитацией и волнами; а современные квантовая физика, астрофизика и физика высоких энергий установили это понятие в современном [уточнить] смысле и активно занимаются поиском новых видов материи.
- Вещество:
- Адронное вещество — его структурой является множество составных частиц: адронов.
- Антивещество — состоит из античастиц.
- Нейтронное вещество — состоит преимущественно из нейтронов и лишено атомного строения. Основной компонент нейтронных звёзд, существенно более плотный, чем обычное вещество, но менее плотный, чем кварк-глюонная плазма.
- Другие виды веществ, имеющих атомоподобное строение (например, вещество, образованное мезоатомами с мюонами).
- Кварк-глюонная плазма — сверхплотная форма вещества, существовавшая на ранней стадии эволюции Вселенной до объединения кварков в классические элементарные частицы (до конфайнмента).
- Гипотетические докварковые сверхплотные материальные образования, составляющие которых — струны и другие объекты, c которыми оперируют теории великого объединения (см. теория струн, теория суперструн). Основные формы материи, предположительно существовавшие на ранней стадии эволюции Вселенной. Струноподобные объекты в современной физической теории претендуют на роль наиболее фундаментальных материальных образований, к которым можно свести все элементарные частицы, то есть в конечном счёте, все известные формы материи. Данный уровень анализа материи, возможно, позволит объяснить с единых позиций свойства различных элементарных частиц. Принадлежность к «веществу» здесь следует понимать условно, поскольку различие между вещественной и полевой формами материи на данном уровне стирается.
Поле, в отличие от вещества, не имеет внутренних пустот, обладает абсолютной плотностью.
- Поле (в классическом смысле):
- Квантовые поля различной природы. Согласно современным представлениям квантовое поле является универсальной формой материи, к которой могут быть сведены как вещества, так и классические поля, при этом существует нечёткое разделение на вещественные поля (лептонные и кварковые поля фермионной природы) и поля взаимодействий (глюонные сильные, промежуточные бозонные слабые и фотонное электромагнитное поля бозонной природы, сюда же относят пока гипотетическое поле гравитонов). Особняком среди них стоит поле Хиггса, которое сложно отнести однозначно к любой из этих категорий.
- Материальные объекты неясной физической природы:
Эти объекты были введены в научный обиход для объяснения ряда астрофизических и космологических явлений.
Классическое вещество может находиться в одном из нескольких агрегатных состояний: газообразном, жидком, твёрдом кристаллическом, твердом аморфном или в виде жидкого кристалла. Кроме того, выделяют высокоионизованное состояние вещества (чаще газообразного, но, в широком смысле, любого агрегатного состояния), называемое плазмой. Известны также состояния вещества, называемые конденсат Бозе — Эйнштейна и кварк-глюонная плазма.
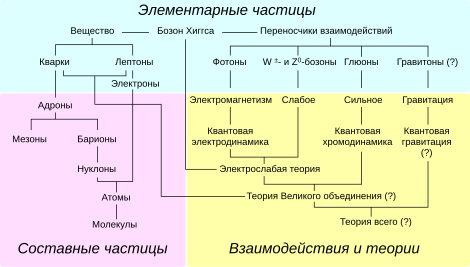
Среди элементарных частиц, составляющих вещества и поля, выделяют фермионы и бозоны, а также частицы, обладающие и не обладающие массой покоя (безмассовые частицы), могут различаться электрическим и другими зарядами. Кроме того, отдельно выделяют виртуальные частицы, которые можно рассматривать как частицы, возникающие в промежуточных состояниях взаимодействия «реальных» элементарных частиц, отличающихся тем, что они могут наблюдаться в долгоживущем состоянии в итоге эксперимента (в принципе, частицы одного и того же вида, например, фотоны или электроны, могут в одних ситуациях участвовать как виртуальные, а в других — как реальные). Отличие виртуальных частиц в том, что они рождаются и уничтожаются (поглощаются) в процессе взаимодействия и не присутствуют в эксперименте в начальном и конечном состоянии. Виртуальные частицы определяют свойства физического вакуума, который, таким образом, в современной физике также приобретает атрибуты материальной среды.
Материя в специальной и общей теории относительности[править | править код]
Материя и излучение, согласно специальной теории относительности, являются только особыми формами энергии, распределенной в пространстве; таким образом, весомая масса теряет своё особое положение и является лишь особой формой энергии.
Согласно укоренившейся терминологии материальными полями в общей теории относительности называют все поля, кроме гравитационного.
Различия между аморфными и кристаллическими веществами — урок. Химия, 8–9 класс.
Любое вещество может существовать в трёх агрегатных состояниях: твёрдом, жидком и газообразном. Всем известно, что жидкая при комнатной температуре вода становится твёрдой при охлаждении до \(0\) °С, а при нагревании до \(100\) °С превращается в пар.
Твёрдые вещества делят на аморфные и кристаллические.
Отличие аморфных и кристаллических веществ заключается в степени упорядоченности их внутреннего строения.
В кристаллических веществах все частицы располагаются в определённом порядке.
В аморфных веществах этот порядок относительный.

Кристаллическими называют вещества, в которых частицы располагаются в строгом порядке.
Примеры кристаллических веществ: алмаз, сахар, металлы, соли, щёлочи, большинство оксидов и простых веществ.

Кристаллы медного купороса

Кристаллы кварца
Аморфными называют вещества, у которых нет строгого порядка в расположении частиц.
К аморфным веществам относятся: стекло, смола, воск, янтарь, пластилин, жевательная резинка, большинство пластмасс.

Пластилин

Янтарь
Кристаллические и аморфные вещества различаются свойствами.
При ударе кристаллические вещества распадаются на мелкие кристаллики определённой формы.
Аморфные вещества при разрушении образуют осколки неопределённой формы.Слово «аморфный» переводится с греческого языка как «бесформенный».

Осколки стекла
Кристаллические вещества имеют определённую температуру плавления, при которой они сразу становятся жидкими. Например, алюминий плавится при температуре \(660\) °С, а алмаз — при \(3827\) °С.
Если нагревать стекло, то оно сначала размягчается и превращается в пластичную массу.
Аморфные вещества не имеют точной температуры плавления — при нагревании они постепенно размягчаются и переходят в вязкое состояние. Способность аморфных веществ становиться вязкими при нагревании позволяет придавать им любую форму.Источники:
Габриелян О. С. Химия. 8 класс. Учебник для общеобразовательных учреждений. М.: Дрофа, 2013. — 133 с.
Что такое вещество в физике и химии?
Изучая в рамках школьного или вузовского курса различные направления науки, несложно заметить, что они очень часто оперируют понятием вещества.
Но что такое вещество в физике и химии, в чём разница между определениями этих двух наук? Постараемся рассмотреть подробнее.
Что такое вещество в физике?
Классическая физика учит, что материя, из которой состоит Вселенная, находится в одном из двух основных состояний – в виде вещества и в виде поля. Веществом в физике называют материю, состоящую из элементарных частиц (по большей части это нейтроны, протоны и электроны), образующих атомы и молекулы, которые обладают массой покоя, отличной от нуля.
Вещество представлено различными физическими телами, обладающими рядом параметров, которые поддаются объективным измерениям. В любой момент можно измерить удельный вес и плотность исследуемого вещества, его упругость и твёрдость, электропроводность и магнитные свойства, прозрачность, теплоёмкость и т.д.
В зависимости от вида вещества и внешних условий, эти параметры могут изменяться в достаточно широких пределах. В то же время каждому типу вещества свойственен определённый набор постоянных характеристик, отражающих его качественные показатели.
Агрегатные состояния веществ
Все существующие во Вселенной вещества могут пребывать в одном из агрегатных состояний:
— в виде газа;
— в виде жидкости;
— в твёрдом состоянии;
— в виде плазмы.
При этом многим веществам свойственны переходные, или пограничные состояния. Наиболее распространёнными из них являются:
— аморфное, или стеклообразное;
— жидкокристаллическое;
— высокоэластичное.
Кроме того, некоторые вещества при особых внешних условиях могут переходить в состояния сверхтекучести и сверхпроводимости.
Что такое вещество в химии?
Химическая наука изучает вещества, состоящие из атомов, а также законы, по которым происходят преобразования веществ, называемые химическими реакциями. Вещества могут пребывать в виде атомов, молекул, ионов, радикалов, а также их смесей.
Химия делит вещества на простые, т.е. те, которые состоят из атомов одного вида, и сложные, состоящие из разных видов атомов. Простые вещества называют химическими элементами: из них, как из кирпичиков, состоят все вещества в мире.
В ходе химической реакции вещества взаимодействуют друг с другом, обмениваясь атомами и атомными группами, в результате чего образуются новые вещества. В то же время химия не рассматривает процессы, при которых происходят изменения в атомарной структуре: количество и виды атомов, участвующих в реакции, всегда остаются неизменными.
Все простые вещества сведены в так называемую периодическую таблицу элементов, которая была создана русским учёным Д.И. Менделеевым. В этой таблице простые вещества расставлены в порядке возрастания их атомных масс и сгруппированы по свойствам, что существенно упрощает их дальнейшее изучение.
Органические и неорганические вещества
В современной химии принято разделение всех веществ на две основные группы: неорганические и органические. К неорганическим веществам относятся:
— оксиды – соединения химических элементов с кислородом;
— кислоты – соединения, состоящие из атомов водорода и так называемого кислотного остатка;
— соли – вещества, состоящие из атомов металла и кислотного остатка;
— основания, или щёлочи – соединения, состоящие из металла и гидроксильной группы или нескольких групп;
— амфотерные гидроксиды – вещества, обладающие свойствами оснований и кислот.
Существуют и более сложные соединения неорганических элементов. Всего насчитывается до полумиллиона разновидностей неорганических веществ.
Органические вещества – это соединения углерода с гидрогеном и другими химическими элементами. По большей части они представляют собой сложные молекулы, состоящие из большого количества атомов. Существует множество разновидностей органических веществ, в зависимости от их состава и молекулярного строения. Всего на текущий момент науке известно более 20 миллионов разновидностей органических веществ.
Вещество — это… Что такое Вещество?
Вещество в химии — физическая субстанция со специфическим химическим составом. В философском словаре Григория Теплова в 1751 году словом вещество переводился латинский термин Substantia.
Вещество в современной физике как правило понимается как вид материи, состоящий из фермионов или содержащий фермионы наряду с бозонами; обладает массой покоя, в отличие от некоторых типов полей, как например электромагнитное[1]. Обычно (при сравнительно низких температурах и плотностях) вещество состоит из частиц, среди которых чаще всего встречаются электроны, протоны и нейтроны. Последние два образуют атомные ядра, а все вместе — атомы (атомное вещество), из которых — молекулы, кристаллы и т. д. В некоторых условиях, как например в нейтронных звездах, могут существовать достаточно необычные виды вещества.
Вещество в биологии — материя, образующая ткани организмов, входящая в состав органелл клеток.
Различие между веществом и полем
Исторически в физике делалось фундаментальное различие между веществом и полем. Поле, в отличие от вещества, мыслилось непрерывным и проницаемым, в то время как частицы вещества представлялись дискретными, или по крайней мере достаточно локализованными. Известные в классической физике поля, такие как электромагнитное и гравитационное, противопоставлялись массивным и иногда электрически заряженным частицам вещества.
Современная физика нивелирует различие между веществом и полем, считая, что все частицы (в том числе и частицы вещества, равно как и частицы, относящиеся к классическим полям) есть квантовые возбуждения различных фундаментальных полей, и так или иначе все частицы проявляют такие типично полевые свойства, как делокализованность и подчинение уравнениям движения по сути не отличающимся от полевых (о чем можно говорить как о волновых свойствах всех частиц, в том числе и частиц вещества). Выявление тесной взаимосвязи между полем и веществом привело к углублению представлений о единстве всех форм и структуры физической картины мира.
Впрочем в контексте задач, относящихся к классической физике, а иногда и несколько шире, бывает иногда довольно удобно пользоваться и старой терминологией, хотя в контексте физики в целом она уже и выглядит анахронизмом. Например, если речь идет о взаимодействии заряженных частиц с электромагнитным полем, довольно удобно, следуя традиции называть одно «полем», а другое «веществом», особенно если вещество рассматривается или чисто классически, или — если квантово — то в терминах волновых функций (что позволяет избежать чисто терминологически неудобного пересечения понятий).
Свойства вещества
Каждому веществу присущ набор специфических свойств — объективных характеристик, которые определяют индивидуальность конкретного вещества и тем самым позволяют отличить его от всех других веществ. К наиболее характерным физико-химическим свойствам относятся константы — плотность, температура плавления, температура кипения, термодинамические характеристики, параметры кристаллической структуры. К основным характеристикам вещества принадлежат его химические свойства.
Классификация веществ
Основная статья: Классификация веществ
Число веществ в принципе неограниченно велико; к известному числу веществ всё время добавляются новые вещества, как открываемые в природе, так и синтезируемые искусственно.
Химическая классификация
Индивидуальные вещества и смеси
В химии принято разделять все объекты изучения на индивидуальные вещества (иначе — соединения) и их смеси. Под индивидуальным веществом понимают абстрактное понятие, обозначающее набор атомов, связанных друг с другом по определённому закону. Граница между индивидуальным веществом и смесью веществ довольно расплывчата, так как существуют вещества непостоянного состава, для которых, вообще говоря, нельзя предложить точной формулы. Кроме того, индивидуальное вещество остаётся абстракцией в силу того, что практически достижима лишь конечная чистота вещества. Это значит, что любой конкретный, реально существующий образец представляет собой смесь веществ, пусть и с подавляющим преобладанием одного из них. Несмотря на кажущуюся надуманность этого ограничения, зачастую чистота вещества играет ключевую роль в его свойствах. Так, знаменитая прочность титана проявляется только после того, как он очищен от кислорода до определённого предела (менее сотых долей процента).
Неорганические вещества
Органические вещества
Физическая классификация
Агрегатные состояния
Все химические вещества в принципе могут существовать в трёх агрегатных состояниях — твёрдом, жидком и газообразном. Так, лёд, жидкая вода и водяной пар — это твёрдое, жидкое и газообразное состояния одного и того же химического вещества — воды H2O. Твёрдая, жидкая и газообразная формы не являются индивидуальными характеристиками химических веществ, а соответствуют лишь различным, зависящим от внешних физических условий состояниям существования химических веществ. Поэтому нельзя приписывать воде только признак жидкости, кислороду — признак газа, а хлориду натрия — признак твёрдого состояния. Каждое из этих (и всех других веществ) при изменении условий может перейти в любое другое из трёх агрегатных состояний.
При переходе от идеальных моделей твёрдого, жидкого и газообразного состояний к реальным состояниям вещества обнаруживается несколько пограничных промежуточных типов, общеизвестными из которых являются аморфное (стеклообразное) состояние, состояние жидкого кристалла и высокоэластичное (полимерное) состояние. В связи с этим часто пользуются более широким понятием «фаза».
В физике рассматривается четвёртое агрегатное состояние вещества — плазма, частично или полностью ионизированное состояние, в котором плотность положительных и отрицательных зарядов одинакова (плазма электронейтральна).
При некоторых условиях (обычно достаточно отличающихся от обычных) те или иные вещества могут переходить в такие особые состояния, как сверхтекучее и сверхпроводящее.
Примечания
- ↑ Это различие было в прошлом одним из признаков классификации физических объектов на вещество и «поля», однако на настоящий момент такая классификация устарела: в основе вещества также лежат квантованные поля, а разделение фундаментальных полей на основные классы (сопоставимые со старым делением на вещество и поле) происходит в основном по признаку спина; хотя можно признать, что на некотором глубинном уровне все бозонные фундаментальные поля безмассовы, однако в итоге некоторые из них (например, поле-переносчик слабого взаимодействия) всё же приобретают массу, а механизм же приобретения массы фермионными полями недостаточно ясен, что мешает сделать массивность или безмассовость основой какой-то содержательной классификации, особенно учитывая что вопрос о наличии массы у нейтрино был долгое время открыт и решен лишь экспериментально.
Литература
- Химия: Справ. изд./ В. Шретер, К.-Х. Лаутеншлегер, Х. Бибрак и др.: Пер. с нем. — М.: Химия, 1989
См. также
 | В этой статье не хватает ссылок на источники информации. Информация должна быть проверяема, иначе она может быть поставлена под сомнение и удалена. Вы можете отредактировать эту статью, добавив ссылки на авторитетные источники. Эта отметка установлена 13 мая 2011. |