Хромовый ангидрид
%D
%d.%M.%y
%h~:~%m
Хромовый ангидрид (триоксид хрома, трёхокись хрома, оксид хрома IV), CrO3 — соединение хрома с кислородом, тёмно-красные кристаллы, хорошо растворимые в воде. Ангидрид хромовой и дихромовой кислот.
Физические свойства
Чёрно-красные с фиолетовым оттенком кристаллы — пластины или иголки. Гигроскопичен, расплывается на воздухе.
tпл=196 °C, при атмосферном давлении разлагается ниже температуры кипения.
Плотность 2,8 г/см³; Растворимость в воде — 166 г/100 г (15 °C), 199 г/100 г (100 °C).
Химические свойства
CrO3 — кислотный оксид. При его растворении в воде образуется хромовая кислота (при недостатке CrO3):
CrO3 (недост.) + H2O → H2CrO4,
или дихромовая кислота (при избытке CrO
2CrO3 + H2O → H2Cr2O7.
При взаимодействии CrO3 со щелочами образуются хроматы:
CrO3 + 2KOH → K2CrO4 + H2O.
При нагревании выше 250 °C разлагается с образованием оксида хрома(III) и кислорода:
4CrO3 → 2Cr2O3 + 3O2↑.
Как и все соединения Cr(VI), CrO3 является сильным окислителем (восстанавливается до Cr2O3). Например этанол, ацетон и многие другие органические вещества самовоспламеняются или даже взрываются при контакте с ним (хотя некоторые справочники указывают «растворим в спирте и эфире»). Окисляет иод, серу, фосфор, уголь, например:
4CrO3 + 3S → 2Cr2O3 + 3SO2↑.
Получение
Получают действием H
2SO4 на дихромат натрия Na2Cr2O7 (реже дихромат калия K2Cr2O7).Na2Cr2O7 + H2SO4 → 2CrO3 + Na2SO4 + H2O
Применение
Используется для получения хрома электролизом, электролитического хромирования; хроматирования оцинкованных деталей, в качестве сильного окислителя, изредка в пиросоставах.
Применяют также, как окислитель в органической химии (в производстве изатина, индиго и т. д.).
В смеси с кизельгуром применяется для очистки ацетилена под названием «эпурит».
Растворы хромового ангидрида (или, чаще, дихромата калия) в серной кислоте широко используются в лабораторной практике для очистки посуды от органических загрязнений (хромовая смесь).
Токсичность
Оксид хрома(VI) очень ядовит, как и многие другие соединения шестивалентного хрома. Летальная доза для человека при попадании внутрь 0,08 г/кг.
Техника безопасности
Хромовый ангидрид — весьма химически активное вещество, способен вызвать при соприкосновении с органическими веществами возгорания и взрывы. Воспламеняет бензин при комнатной температуре и используется в качестве воспламенителя топлива в ракетной технике. При попадании на кожу вызывает сильные раздражения, экземы и дерматиты, а также может спровоцировать развитие рака кожи. Даже при своевременном удалении с кожных покровов оставляет пятна коричневого цвета. Весьма опасно вдыхание паров хромового ангидрида, хотя он и малолетуч.
Весьма опасно вдыхание паров хромового ангидрида, хотя он и малолетуч.
Для хранения его применяется стеклянная или пластиковая герметичная посуда, необходимо исключение контакта с органическими веществами. Работа с ним требует применения спецодежды и средств индивидуальной защиты.
Ангидрид хромовый
Окси́д хро́ма(VI) (триоксид хрома, трёхокись хрома, хромовый ангидрид), CrO3 — соединение хрома с кислородом, тёмно-красные кристаллы, хорошо растворимые в воде. Ангидрид хромовой и дихромовой кислот.
Свойства
Физические свойства
Чёрно-красные с фиолетовым оттенком кристаллы — пластины или иголки. Гигроскопичен, расплывается на воздухе.
tпл=196 °C, при атмосферном давлении разлагается ниже температуры кипения.
Плотность 2,8 г/см³; Растворимость в воде — 166 г/100 г (15 °C), 199 г/100 г (100 °C).
Химические свойства
CrO3 — кислотный оксид. При его растворении в воде образуется хромовая кислота (при недостатке CrO3):
или дихромовая кислота (при избытке CrO3):
При взаимодействии CrO3 со щелочами образуются хроматы:
При нагревании выше 250 °C разлагается с образованием оксида хрома(III) и кислорода:
Как и все соединения Cr(VI), CrO3 является сильным окислителем (восстанавливается до Cr
 Например этанол, ацетон и многие другие органические вещества самовоспламеняются или даже взрываются при контакте с предварительно измельченным до состояния порошка оксидом хрома VI (хотя некоторые справочники указывают «растворим в спирте и эфире»). Без тщательного измельчения кристаллов хромового ангидрида добиться воспламенения спиртов и кетонов при контакте с ним невозможно. Окисляет иод, серу, фосфор, уголь, например:
Например этанол, ацетон и многие другие органические вещества самовоспламеняются или даже взрываются при контакте с предварительно измельченным до состояния порошка оксидом хрома VI (хотя некоторые справочники указывают «растворим в спирте и эфире»). Без тщательного измельчения кристаллов хромового ангидрида добиться воспламенения спиртов и кетонов при контакте с ним невозможно. Окисляет иод, серу, фосфор, уголь, например:Комплекс триоксида хрома с пиридином используется для окисления спиртов в соответствующие карбонильные соединения (реакция Саретта).
Получение
Получают действием H2SO4 на дихромат натрия Na2Cr2O7 (реже дихромат калия K2Cr2O7).
Применение
Используется для получения хрома электролизом, электролитического хромирования; хроматирования оцинкованных деталей, в качестве сильного окислителя, изредка в пиросоставах.
Применяют также, как окислитель в органической химии (в производстве изатина, индиго и т. д.).
д.).
В смеси с кизельгуром применяется для очистки ацетилена под названием «эпурит».
Растворы хромового ангидрида (или, чаще, дихромата калия) в серной кислоте широко используются в лабораторной практике для очистки посуды от органических загрязнений (хромовая смесь).
%d1%85%d1%80%d0%be%d0%bc%d0%be%d0%b2%d1%8b%d0%b9%20%d0%b0%d0%bd%d0%b3%d0%b8%d0%b4%d1%80%d0%b8%d0%b4 — с русского на все языки
Все языкиРусскийАнглийскийИспанский────────Айнский языкАканАлбанскийАлтайскийАрабскийАрагонскийАрмянскийАрумынскийАстурийскийАфрикаансБагобоБаскскийБашкирскийБелорусскийБолгарскийБурятскийВаллийскийВарайскийВенгерскийВепсскийВерхнелужицкийВьетнамскийГаитянскийГреческийГрузинскийГуараниГэльскийДатскийДолганскийДревнерусский языкИвритИдишИнгушскийИндонезийскийИнупиакИрландскийИсландскийИтальянскийЙорубаКазахскийКарачаевскийКаталанскийКвеньяКечуаКиргизскийКитайскийКлингонскийКомиКомиКорейскийКриКрымскотатарскийКумыкскийКурдскийКхмерскийЛатинскийЛатышскийЛингалаЛитовскийЛюксембургскийМайяМакедонскийМалайскийМаньчжурскийМаориМарийскийМикенскийМокшанскийМонгольскийНауатльНемецкийНидерландскийНогайскийНорвежскийОрокскийОсетинскийОсманскийПалиПапьяментоПенджабскийПерсидскийПольскийПортугальскийРумынский, МолдавскийСанскритСеверносаамскийСербскийСефардскийСилезскийСловацкийСловенскийСуахилиТагальскийТаджикскийТайскийТатарскийТвиТибетскийТофаларскийТувинскийТурецкийТуркменскийУдмуртскийУзбекскийУйгурскийУкраинскийУрдуУрумскийФарерскийФинскийФранцузскийХиндиХорватскийЦерковнославянский (Старославянский)ЧеркесскийЧерокиЧеченскийЧешскийЧувашскийШайенскогоШведскийШорскийШумерскийЭвенкийскийЭльзасскийЭрзянскийЭсперантоЭстонскийЮпийскийЯкутскийЯпонский
Все языкиРусскийАнглийскийИспанский────────АлтайскийАрабскийАрмянскийБаскскийБашкирскийБелорусскийВенгерскийВепсскийВодскийГреческийДатскийИвритИдишИжорскийИнгушскийИндонезийскийИсландскийИтальянскийКазахскийКарачаевскийКитайскийКорейскийКрымскотатарскийКумыкскийЛатинскийЛатышскийЛитовскийМарийскийМокшанскийМонгольскийНемецкийНидерландскийНорвежскийОсетинскийПерсидскийПольскийПортугальскийСловацкийСловенскийСуахилиТаджикскийТайскийТатарскийТурецкийТуркменскийУдмуртскийУзбекскийУйгурскийУкраинскийУрумскийФинскийФранцузскийЦерковнославянский (Старославянский)ЧеченскийЧешскийЧувашскийШведскийШорскийЭвенкийскийЭрзянскийЭсперантоЭстонскийЯкутскийЯпонский
Триоксид хрома — обзор
Хромовая кислота (H
2 CrO 4 ) Хромовая кислота образуется при реакции триоксида хрома с водой. Триоксид хрома имеет кристаллическую форму, светло-красного или коричневого цвета, растворяется в воде и полностью растворяется. Хромовая кислота — очень слабая кислота, и ее соли могут диссоциировать даже уксусной кислотой. Он обладает сильным окислительным действием и сам восстанавливается до CrO 3 ; из-за этого его никогда не следует использовать в сочетании с алкоголем или формалином.Однако в ряде фиксирующих жидкостей хромовая кислота используется вместе с формалином — восстанавливающее действие медленное, фиксация завершается до того, как кислота полностью восстановится. Это сильный осадитель белка (Baker, 1966), но Берг (1927) обнаружил, что это очень слабый осадитель нуклеина. Диссоциация хромовой кислоты в воде может привести к образованию ионов H + и HCrO 4 — или 2H + и CrO 4 — . Согласно Берг (1927), белок подвергается денатурации и осаждению под действием первичной хромовой кислоты, а вторичное действие приводит к затвердеванию.
Триоксид хрома имеет кристаллическую форму, светло-красного или коричневого цвета, растворяется в воде и полностью растворяется. Хромовая кислота — очень слабая кислота, и ее соли могут диссоциировать даже уксусной кислотой. Он обладает сильным окислительным действием и сам восстанавливается до CrO 3 ; из-за этого его никогда не следует использовать в сочетании с алкоголем или формалином.Однако в ряде фиксирующих жидкостей хромовая кислота используется вместе с формалином — восстанавливающее действие медленное, фиксация завершается до того, как кислота полностью восстановится. Это сильный осадитель белка (Baker, 1966), но Берг (1927) обнаружил, что это очень слабый осадитель нуклеина. Диссоциация хромовой кислоты в воде может привести к образованию ионов H + и HCrO 4 — или 2H + и CrO 4 — . Согласно Берг (1927), белок подвергается денатурации и осаждению под действием первичной хромовой кислоты, а вторичное действие приводит к затвердеванию. Он считает, что ион HCrO 4 — отвечает за вторичное действие. Вероятно, происходит химическая реакция между белком и хромовой кислотой, но точные стадии точно не известны. Однако основное сродство хрома имеет к карбоксильной и гидроксильной группам (Bowes, Kenten, 1949; Strakov, 1951). Грин (1953) предположил, что координаты с –OH и –NH 2 образуются после реакции с карбоксильными группами. Белки, на которые действует хромовая кислота, устойчивы к действию пепсина и трипсина.Хромовая кислота медленно проникает в ткани, и затвердевание, вызванное этой кислотой, делает ткань устойчивой к затвердеванию этанолом при последующей обработке. Не вызывает чрезмерной усадки ткани.
Он считает, что ион HCrO 4 — отвечает за вторичное действие. Вероятно, происходит химическая реакция между белком и хромовой кислотой, но точные стадии точно не известны. Однако основное сродство хрома имеет к карбоксильной и гидроксильной группам (Bowes, Kenten, 1949; Strakov, 1951). Грин (1953) предположил, что координаты с –OH и –NH 2 образуются после реакции с карбоксильными группами. Белки, на которые действует хромовая кислота, устойчивы к действию пепсина и трипсина.Хромовая кислота медленно проникает в ткани, и затвердевание, вызванное этой кислотой, делает ткань устойчивой к затвердеванию этанолом при последующей обработке. Не вызывает чрезмерной усадки ткани.
Материалы, зафиксированные в этой кислоте, требуют тщательной промывки водой, по крайней мере, в течение ночи, в противном случае отложение хромовых кристаллов не только затрудняет окрашивание, но и затрудняет наблюдение за хромосомами. Из-за ее небольшого отвердения трудно использовать эту жидкость в качестве фиксатора для приготовления тыкв, если она не смягчена какой-либо сильной кислотой, которая может препятствовать окрашиванию. Его никогда не следует использовать отдельно, так как при этом образуются тяжелые преципитаты, вызывающие усыхание ядра и цитоплазмы. Материалы, обработанные хромовой кислотой, не следует хранить под сильным солнечным светом из-за вероятности разрушения белков. Основные красители плотно прилегают к ткани, закрепленной в хромовой кислоте.
Его никогда не следует использовать отдельно, так как при этом образуются тяжелые преципитаты, вызывающие усыхание ядра и цитоплазмы. Материалы, обработанные хромовой кислотой, не следует хранить под сильным солнечным светом из-за вероятности разрушения белков. Основные красители плотно прилегают к ткани, закрепленной в хромовой кислоте.
В целом хромовая кислота считается важным ингредиентом некоторых фиксирующих смесей. Он придает ткани лучшую консистенцию и лучше помогает окрашиванию, чем четырехокись осмия.
12.12: Окисление спиртов — Chemistry LibreTexts
На этой странице рассматривается окисление спиртов с использованием подкисленного раствора дихромата натрия или калия (VI). Эта реакция используется для получения альдегидов, кетонов и карбоновых кислот, а также как способ различения первичных, вторичных и третичных спиртов.
Окисление различных типов спиртов
Окислитель, используемый в этих реакциях, обычно представляет собой раствор дихромата натрия или калия (VI), подкисленный разбавленной серной кислотой. {3+} + 7H_2O \]
{3+} + 7H_2O \]
Окислители
K 2 C r 2O 7 Дихромат калия
CrO3 Триоксид хрома
Оба они используются вместе с
H 2 SO 2 SO 2 4 , H 2 O
1 o спирт → Карбоновая кислота
2 o спирт → Кетон
3 o спирт → Нет реакции
Первичные спирты
Первичные спирты могут быть окислены до любого альдегиды или карбоновые кислоты в зависимости от условий реакции.В случае образования карбоновых кислот спирт сначала окисляется до альдегида, который затем окисляется до кислоты.
Полное окисление до карбоновых кислот
Необходимо использовать избыток окислителя и следить за тем, чтобы альдегид, образовавшийся в виде промежуточного продукта, оставался в смеси. Спирт нагревают с обратным холодильником с избытком окислителя. По окончании реакции карбоновую кислоту отгоняют. Полное уравнение окисления этанола до этановой кислоты:
\ [3CH_3CH_2OH + 2Cr_2O_7 ^ {2-} + 16H + \ rightarrow 3CH_3COOH + 4Cr ^ {3+} + 11H_2O \]
Более обычная упрощенная версия выглядит так это:
\ [CH_3CH_2OH + 2 [O] \ rightarrow CH_3COOH + H_2O \]
В качестве альтернативы вы можете написать отдельные уравнения для двух стадий реакции — образования этаналя и его последующего окисления.
\ [CH_3CH_2OH + [O] \ rightarrow CH_3CHO + H_2O \]
\ [CH_3CHO + [O] \ rightarrow CH_3COOH \]
Вот что происходит на второй стадии:
Вторичные спирты
Вторичные спирты окисляются до кетонов — и все. Например, если вы нагреете пропан-2-ол вторичного спирта с раствором дихромата натрия или калия (VI), подкисленным разбавленной серной кислотой, вы получите пропанон. Изменение условий реакции не имеет никакого значения для продукта.Используя простую версию уравнения и демонстрируя взаимосвязь между структурами:
Если вы посмотрите на вторую стадию реакции первичного спирта, вы увидите, что кислород «вставлен» между углеродом и водородом в альдегидная группа для получения карбоновой кислоты. В данном случае такого водорода нет — и дальше реакции некуда.
Третичные спирты
Третичные спирты не окисляются подкисленным раствором дихромата натрия или калия (VI) — никакой реакции не происходит.Если вы посмотрите, что происходит с первичными и вторичными спиртами, вы увидите, что окислитель удаляет водород из группы -OH и водород из атома углерода, присоединенного к -OH. Третичные спирты не имеют атома водорода, присоединенного к этому углероду.
Третичные спирты не имеют атома водорода, присоединенного к этому углероду.
Вам необходимо удалить эти два конкретных атома водорода, чтобы образовалась двойная связь углерод-кислород.
Механизм
Использование этих реакций в качестве теста для различных типов алкоголя
Сначала вы должны убедиться, что вы действительно получили алкоголь, проверив группу -ОН.Вам нужно будет показать, что это нейтральная жидкость, не содержащая воды, и что она реагирует с твердым хлоридом фосфора (V), образуя выброс кислых паров хлористого водорода. Затем вы должны добавить несколько капель спирта в пробирку, содержащую раствор дихромата калия (VI), подкисленный разбавленной серной кислотой. Трубку нагревали на горячей водяной бане.
Выделение третичного спирта
В случае первичного или вторичного спирта оранжевый раствор становится зеленым.У третичного спирта изменение цвета не происходит. После нагревания:
Различие между первичными и вторичными спиртами
Вам необходимо произвести достаточное количество альдегида (из окисления первичного спирта) или кетона (из вторичного спирта), чтобы можно было их проверить. Есть разные вещи, которые делают альдегиды, а кетоны — нет. К ним относятся реакции с реактивом Толленса, раствором Фелинга и раствором Бенедикта, и они описаны на отдельной странице.
Есть разные вещи, которые делают альдегиды, а кетоны — нет. К ним относятся реакции с реактивом Толленса, раствором Фелинга и раствором Бенедикта, и они описаны на отдельной странице.
Эти тесты может быть немного хлопотно проводить, и результаты не всегда так однозначны, как говорится в книгах. Гораздо более простой, но достаточно надежный тест — использовать реактив Шиффа . Реагент Шиффа представляет собой краситель фуксин, обесцвеченный путем пропускания через него диоксида серы. В присутствии даже небольшого количества альдегида он становится ярко-пурпурным.
Однако его следует использовать абсолютно холодным, потому что кетоны очень медленно реагируют с ним, давая такой же цвет. Если нагреть его, очевидно, что изменение происходит быстрее — и это может сбивать с толку.Пока вы нагреваете реакционную смесь на горячей водяной бане, вы можете пропустить любые образующиеся пары через реагент Шиффа.
- Если реактив Шиффа быстро становится пурпурным, значит, вы производите альдегид из первичного спирта.

- Если нет изменения цвета в реактиве Шиффа или есть только след розового цвета в течение минуты или около того, значит, вы не производите альдегид и, следовательно, не получаете первичный спирт.
Из-за изменения цвета подкисленного раствора дихромата калия (VI) вам необходим вторичный спирт.Вы должны проверить результат, как только раствор дихромата калия (VI) станет зеленым — если вы оставите его слишком долго, реактив Шиффа может начать менять цвет и в случае вторичного спирта.
Образование альдегидов с использованием PCC
Хлорхромат пиридиния (PCC) представляет собой более мягкую версию хромовой кислоты.
PCC окисляет спирты на одну ступень лестницы окисления, от первичных спиртов до альдегидов и от вторичных спиртов до кетонов. В отличие от хромовой кислоты PCC не окисляет альдегиды до карбоновых кислот.Подобно или то же самое, что: \ (CrO_3 \) и пиридин (реагент Коллинза) также окисляют первичные спирты до альдегидов. Вот два примера работы PCC.
- Если вы добавите один эквивалент PCC к любому из этих спиртов, вы получите окисленную версию. Побочные продукты (выделены серым цветом) — это Cr (IV), а также гидрохлорид пиридиния.
- Необходимо соблюдать осторожность с количеством воды, присутствующей в реакции. Если бы вода присутствовала, она могла присоединиться к альдегиду с образованием гидрата, который, если бы он присутствовал, мог бы быть дополнительно окислен вторым эквивалентом PCC.Это не проблема кетонов, поскольку H не связан напрямую с C.
Как это работает? Подобные реакции окисления на самом деле являются своего рода реакцией отщепления. Мы переходим от одинарной связи углерод-кислород к двойной связи углерод-кислород. Реакция элиминирования может происходить из-за того, что мы помещаем в кислород хорошую уходящую группу, а именно хром, который будет вытеснен, когда соседняя связь C-H будет разорвана с помощью основания.
Первым шагом является воздействие кислорода на хром с образованием связи Cr-O. Во-вторых, протон на (теперь положительном) ОН передается одному из атомов кислорода хрома, возможно, через посредство соли пиридиния. Затем ион хлорида замещается в реакции, напоминающей реакцию 1,2-элиминирования, с образованием так называемого сложного эфира хромовой кислоты.
Во-вторых, протон на (теперь положительном) ОН передается одному из атомов кислорода хрома, возможно, через посредство соли пиридиния. Затем ион хлорида замещается в реакции, напоминающей реакцию 1,2-элиминирования, с образованием так называемого сложного эфира хромовой кислоты.
Двойная связь C-O образуется, когда основание удаляет протон на углероде, прилегающем к кислороду. [в сторону: я нарисовал основу как Cl (-), хотя, безусловно, есть и другие виды, которые также могут действовать здесь как основания (например, спирт).Здесь также возможно использование пиридина в качестве основания, хотя в этих кислых условиях будут присутствовать только очень низкие концентрации депротонированной формы.] Электроны от связи CH перемещаются, чтобы сформировать связь CO, и в процессе разрываются связь O-Cr, и Cr (VI) в процессе превращается в Cr (IV) (обозначенный здесь как O = Cr (OH) 2).
Заметки из реальной жизни: если вы в конечном итоге используете PCC в лаборатории, не забудьте добавить молекулярные сита или целит или другое твердое вещество на дно колбы, потому что в противном случае вы получите неприятную коричневую смолу, которая является серьезной проблемой. боль убрать.Токсичность и беспорядок, связанные с хромом, стимулировали разработку других альтернатив, таких как TPAP, IBX, DMP и множество других удобных реагентов, о которых вы обычно не узнаете до аспирантуры.
боль убрать.Токсичность и беспорядок, связанные с хромом, стимулировали разработку других альтернатив, таких как TPAP, IBX, DMP и множество других удобных реагентов, о которых вы обычно не узнаете до аспирантуры.
Органическая химия с биологическим акцентом, Тим Содерберг (Университет Миннесоты, Моррис)
Джеймс Эшенхерст (MasterOrganicChemistry.com)
Триоксид хрома, хромовая кислота — Sandvik Materials Technology
Эти данные о коррозии в основном основаны на результатах общих лабораторных испытаний на коррозию, проведенных с чистыми химическими веществами и водными растворами, почти насыщенными воздухом (скорость коррозии может быть совершенно иной, если раствор не содержит кислорода).
Все концентрации даны в% по массе, а растворителем является вода, если не указано иное. Данные по коррозии относятся ко всем отожженным материалам с нормальной микроструктурой и чистыми поверхностями.
Разъяснение символов
Конц. CrO 3 % CrO 3 % | 2 | 2 | 5 | 5 | 10 | 10 | 20 | 20 | 20 | 40 | 40 | 50 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Темп.° С | 75 | 100 = БП | 80 | 100 = БП | 40 | Б.П. | 20 | 50 | Б.П. | 20 | 40 | 20 |
| Марка или тип сплава: | ||||||||||||
| Углеродистая сталь | 2 | 2 | 0 | 2 | 0 | 2 | 2 | 0 | 1 | 1 | ||
| 13 Cr | 2 | 2 | 0 | 2 | 2 | 2 | 2 | 2 | ||||
| Sandvik 1802 | 2 | 2 | 0 | 2 | 1 | 2 | 2 | 2 | ||||
| Sandvik 3R12 | 0 | 2 | 0 | 1 | 0 | 2 | 0 | 1 | 2 | 1 | 2 | 2 |
| Sandvik 3R60 | 0 | 2 | 0 | 2 | 0 | 2 | 0 | 1 | 2 | 1 | 2 | 2 |
18Cr13Ni3Mo 1) | 0 | 2 | 0 | 2 | 0 | 2 | 0 | 1 | 2 | 2 | 2 | |
17Cr14Ni4Mo 2) | 0 | 2 | 1 | 2 | 0 | 2 | 1 | 2 | 2 | 2 | ||
| Sandvik 2RK65 (‘904L’) | 0 | 2 | 0 | 1 | 0 | 2 | 0 | 1 | 2 | 2 | 2 | |
| Sanicro 28 | 0 | 0 | 0 | 1 | 0 | 2 | 1 | 2 | 1 | 2 | 2 | |
| 254 СМО | 0 | 0 | 0 | 1 | 0 | 2 | 1 | 2 | 1 | 2 | 2 | |
| 654 СМО | ||||||||||||
| Sandvik SAF 2304 | 0 | 0 | 0 | 1 | 0 | 2 | 1 | 2 | 1 | 2 | 2 | |
| Sandvik SAF 2205 | 0 | 0 | 1 | 2 | 0 | 2 | 2 | 2 | 2 | 2 | 2 | |
| Sandvik SAF 2507 | 0 | 0 | 1 | 2 | 0 | 2 | 2 | 2 | 2 | 2 | 2 | |
| Титан (CP Ti) | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
1) ASTM 317L, e. г. Sandvik 3R64
г. Sandvik 3R64
2) EN 1.4439, например Sandvik 3R68
Пояснение к символам
В этих таблицах коррозии используется ряд символов, имеющих следующие значения:
| Символ | Описание |
|---|---|
| 0 | Скорость коррозии менее 0,1 мм / год. Материал устойчив к коррозии. |
| 1 | Скорость коррозии 0,1… 1,0 мм / год.Материал не устойчив к коррозии, но в определенных случаях может пригодиться. |
| 2 | Скорость коррозии более 1,0 мм / год. Серьезная коррозия. Материал непригоден для использования. |
| п, п.н. | Риск (серьезный риск) точечной и щелевой коррозии. |
| c, C | Риск (высокий риск) щелевой коррозии. Используется, когда есть риск локальной коррозии, только при наличии щелей. В более тяжелых условиях, когда также существует риск точечной коррозии, вместо этого используются символы p или P. В более тяжелых условиях, когда также существует риск точечной коррозии, вместо этого используются символы p или P. |
| с, S | Риск (высокий риск) коррозионного растрескивания под напряжением. |
| иг | Риск межкристаллитной коррозии. |
| БП | Кипящий раствор. |
| ND | Нет данных. (Используется только при отсутствии фактических данных для оценки риска локальной коррозии вместо p или s). |
Заявление об ограничении ответственности: Лабораторные испытания не могут быть полностью сопоставимы с фактическими условиями эксплуатации.Соответственно, Sandvik не дает никаких гарантий, явных или подразумеваемых, и не принимает на себя никаких обязательств, компенсационных или косвенных, за работу различных материалов в отдельных приложениях, которые могут быть основаны на информации, представленной в этой публикации.
Хромовая кислота, h3CrO4 — Master Organic Chemistry
H 2 CrO 4 (Хромовая кислота, также известная как протонированная форма K 2 Cr 2 O 7 / Na 2 Cr40003 2 O 7 / K 2 CrO 4 / Na 2 CrO 4 ) В качестве реагента в органической химии
В явной пробке для Руководства по реагентам каждую пятницу в обозримом будущем здесь I будет профилировать другой реагент, который обычно встречается в Org 1 / Org 2.
Хромовая кислота (H
2 CrO 4 ) эквивалентна K 2 Cr 2 O 7 + H 2 SO 4 (среди других комбинаций) всех реагентов Я сталкиваюсь в качестве репетитора по органической химии, я не уверен, что есть такой, который заставляет меня рвать волосы больше, чем хромовая кислота. У меня не так много волос, поэтому я не говорю это легкомысленно.
Дело не в том, что это особо хитрый реагент. На самом деле, после расшифровки это довольно просто.
Что делает его сложным, так это огромное количество различных способов, которыми учебники (и инструкторы) показывают его использование в реакции.
Вот в чем дело: Хромовая кислота, H 2 CrO 4 , является сильной кислотой и реагентом для окисления спиртов до кетонов и карбоновых кислот. По довольно банальным причинам, главным образом из-за безопасности и удобства, хромовая кислота, как правило, производится в реакционном сосуде по мере необходимости (путем добавления кислоты к источнику хрома), а не из бутылки.
И вот тут-то и начинаются проблемы. Выбор источника хрома для производства H 2 CrO 4 очень похож на выбор любимой марки бутилированной воды. Помимо упаковки, они почти все одинаковые. Однако в зависимости от того, какой у вас учебник или инструктор, вы можете увидеть несколько разных способов сделать это, и это может сбивать с толку.
Ключевым моментом является то, что Na 2 CrO 4 (хромат натрия), Na 2 Cr 2 O 7 (дихромат натрия), K 2 CrO 4 (хромат калия), K 2 Cr 2 O 7 (дихромат калия) и CrO 3 (триоксид хрома) одинаковы в одном решающем отношении: когда они объединяются с водной кислотой, каждый из них образует H 2 CrO 4 , и, в конечном итоге, именно H 2 CrO 4 выполняет важную химию.К сожалению, я редко вижу объяснение этого момента в учебниках. Я помню, что это вызывало у меня некоторое замешательство, когда я проходил курс. Присутствующие ионы K или Na — просто зрители.
H
2 CrO 4 В качестве реагента для окисления спиртов После образования H 2 CrO 4 его реакции довольно просты: он превращает первичные спирты (и альдегиды) в карбоновые кислоты и вторичные спирты к кетонам.
Окисление первичных спиртов до карбоновых кислот с помощью хромовой кислоты: как это работает
Это происходит за счет добавления кислорода спирта к хрому, что делает его хорошей уходящей группой; основание (наиболее вероятной причиной является вода) может затем удалить протон из углерода, образуя новую π-связь и разрывая связь O-Cr.
Я хотел бы сказать вам, что преодоление этой путаницы в конечном итоге полезно из-за огромной полезности H 2 CrO 4 в качестве реагента. Фактически, из-за своей высокой токсичности хромовая кислота, как правило, очень мало используется в лаборатории органической химии за пределами студенческих лабораторий. Существуют гораздо более полезные реагенты для проведения этих преобразований.
П.С. Вы можете прочитать о химии хромовой кислоты и более чем 80 других реагентах в бакалавриате по органической химии в руководстве по реагентам для органической химии, доступном здесь в виде загружаемого PDF-файла .
(Advanced) Ссылки и дополнительная литература
Основными окислителями, используемыми для этого преобразования, являются Cr (VI) и Mn (VII), как показано ниже. В первых двух ссылках используется KMnO 4 .
- Синтез модельного депсипептидного сегмента лузопептинов (BBM 928), сильнодействующих противоопухолевых и антиретровирусных антибиотиков
Марко А. Чуфолини и Шанкар Сваминатан
Tetrahedron Letters Volume 30, Issue 1989–30 23, 9018
DOI: 10.1016 / S0040-4039 (00) 99393-6
Стадия f в синтезе ( Схема 1 ) представляет собой окисление первичного спирта до карбоновой кислоты с использованием KMnO 4 . - Стереоконтролируемое добавление к эквиваленту пенальдовой кислоты: асимметричная -β-гидрокси-L-глутаминовая кислота
Филип Гарнер
Tetrahedron Letters Том 25, Выпуск 51, 1984 5
DOI : 10. 1016 / S0040-4039 (01) 81703-2
1016 / S0040-4039 (01) 81703-2
Заключительная стадия ( г , 6 -> 7) в синтезе в этой статье представляет собой окисление первичного спирта до карбоновой кислоты с использованием KMnO 4 .Окисление Джонса с использованием хромовой кислоты (CrO 3 в H 2 SO 4 ) является распространенным методом окисления первичных спиртов до карбоновых кислот. Недостатком, конечно же, является производство стехиометрических количеств хромовых отходов. - Исследования ацетиленовых соединений. Часть XIV. Исследование реакций легкодоступного этинилэтиленового спирта, пент-2-ен-4-ин-1-ола
Сэр Ян Хейлброн, Э. Р. Х. Джонс и Ф. Сондхаймер
J.Chem. Soc., , , 1947, , 1586-1590, ,
, DOI: , 10.1039 / JR9470001586, , - . Улучшенная методика окисления алкинолов до алкиновых кислот.
C. Holland, N. W. Gilman
Synth. Commun. 1974 , 4 , 203-210
DOI: 10. 1080 / 00397917408062073
1080 / 00397917408062073 - Полезные методики окисления спиртов с участием дихромата пиридиния в апротонных средах
E.J. Кори, Грег Шмидт
Tetrahedron Letters Том 20, выпуск 5, 1979 , 399-402
DOI : 10.1016 / S0040-4039 (01) 93515-4
Нобелевский лауреат профессор Э. Дж. Кори (Гарвард) показывает, что PDC (дихромат пиридиния) в ДМФА можно использовать для окисления первичных спиртов до карбоновых кислот.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно.Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie.
 Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie. - Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом.Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в cookie-файлах может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта.Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
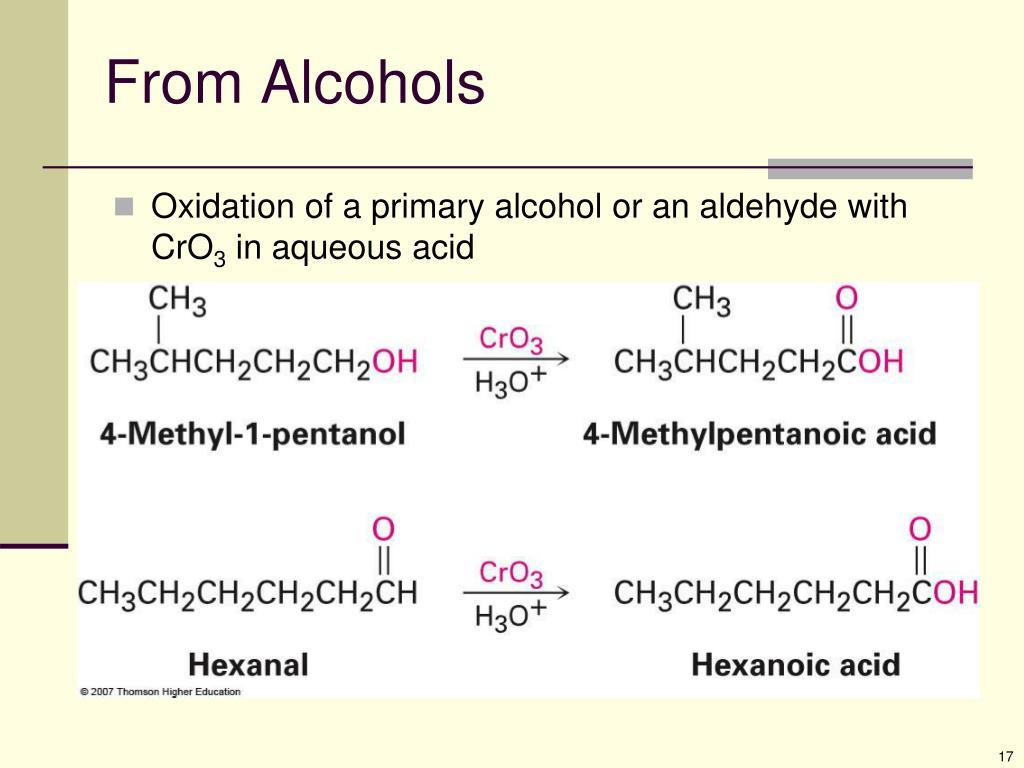
Окисление Джонса (CrO3 + h3SO4)
Окисление Джонса позволяет относительно недорого превратить вторичные спирты в кетоны и большинство первичных спиртов в карбоновые кислоты.
 Реагент Джонса представляет собой смесь хромового ангидрида и разбавленной серной кислоты (CrO 3 + H 2 SO 4 + H 2 O) в ацетоне.Он используется при окислении вторичных спиртов, которые не содержат чувствительных к кислоте групп, до соответствующих кетонов, а также при окислении первичных аллиловых и бензиловых спиртов с образованием альдегидов.
Реагент Джонса представляет собой смесь хромового ангидрида и разбавленной серной кислоты (CrO 3 + H 2 SO 4 + H 2 O) в ацетоне.Он используется при окислении вторичных спиртов, которые не содержат чувствительных к кислоте групп, до соответствующих кетонов, а также при окислении первичных аллиловых и бензиловых спиртов с образованием альдегидов. Джонс впервые описал удобную и безопасную процедуру окисления на основе хрома (VI), которая проложила путь для некоторых дальнейших разработок, таких как реакция Коллинза и дихромат пиридиния, который также позволяет окислять первичные спирты до альдегидов.
Реагент Джонса представляет собой смесь триоксида хрома или дихромата натрия в разбавленной серной кислоте, которая на месте образует хромовую кислоту.
Спирт и хромовая кислота образуют сложный эфир хромовой кислоты, который реагирует внутримолекулярно или межмолекулярно в присутствии основания (воды) с образованием соответствующего карбонильного соединения.
Альдегиды, которые могут образовывать гидраты в присутствии воды, дополнительно окисляются до карбоновых кислот.
Некоторые спирты, такие как бензиловые и аллиловые спирты, дают альдегиды, которые не образуют гидратов в значительных количествах; поэтому они могут быть избирательно окислены немодифицированным реактивом Джонса с образованием альдегидов.Хотя реагент очень кислый, субстрат в ацетоне по существу титруется раствором окислителя, и несовместимы только очень чувствительные к кислоте группы. Например, сложные эфиры, даже трет, -бутиловые эфиры, остаются неизменными. Концентрация серной кислоты может быть уменьшена для минимизации побочных реакций, хотя окислительная способность также увеличивается.
Реагент окисления получают растворением 70 г. (0,70 моль) триоксида хрома в 100 мл. воды в 500 мл. стакан.Стакан погружают в ледяную баню на 112 г. (61 мл, 1,10 моль) концентрированной (18 М) серной кислоты, а затем 200 мл. воды добавляется осторожно при ручном перемешивании. Раствор охлаждают до 0–5 ° С.
Раствор охлаждают до 0–5 ° С.
 порции петролейного эфира 30–60 ° C. Экстракты объединяют, промывают последовательно двумя порциями по 50 мл. порции насыщенного хлорида натрия, две порции по 50 мл. порции насыщенного раствора бикарбоната натрия по 50 мл. насыщенного раствора хлорида натрия и сушат над сульфатом магния. Растворитель удаляют перегонкой через короткую колонку, содержащую стеклянные спирали, а остаток перегоняют при пониженном давлении, получая 85–95 г. (79–88%) нортрицикланона, т.кип. 103–105 ° (77 мм) .—————————————— ————————————————— —————
порции петролейного эфира 30–60 ° C. Экстракты объединяют, промывают последовательно двумя порциями по 50 мл. порции насыщенного хлорида натрия, две порции по 50 мл. порции насыщенного раствора бикарбоната натрия по 50 мл. насыщенного раствора хлорида натрия и сушат над сульфатом магния. Растворитель удаляют перегонкой через короткую колонку, содержащую стеклянные спирали, а остаток перегоняют при пониженном давлении, получая 85–95 г. (79–88%) нортрицикланона, т.кип. 103–105 ° (77 мм) .—————————————— ————————————————— —————Окислительный реагент хромовой кислоты получают растворением 67 г.триоксида хрома в 125 мл. дистиллированной воды. К этому раствору добавляли 58 мл концентрированной серной кислоты (удельная масса 1,84) и соли, выпавшие в осадок, растворяли добавлением минимального количества дистиллированной воды; общий объем раствора обычно не превышает 225 мл.
Раствор 64 г. (0,5 моль) циклооктанола в 1,25 л. ацетона добавляют к 2-л. трехгорлая колба, снабженная капельной воронкой с длинным штоком, термометром и мощной механической мешалкой (примечание 2).Энергично перемешиваемый раствор охлаждают на водяной бане примерно до 20 ° C. Окисляющий реагент хромовой кислоты добавляют из капельной воронки в виде медленного потока, и скорость добавления регулируют так, чтобы температура реакционной смеси не поднималась выше 35 °. Добавление продолжают до тех пор, пока характерный оранжевый цвет реагента не сохраняется в течение примерно 20 минут. Объем добавляемого реагента составляет около 120 мл. Мешалку снимают, смесь декантируют в 2 л. круглодонную колбу, а остатки зеленых солей промывают двумя порциями по 70 мл.порции ацетона. Промывки добавляют к основному раствору ацетона и при необходимости добавляют дополнительный окислитель для обеспечения полной реакции. Заменяют мешалку и по каплям добавляют изопропиловый спирт до тех пор, пока избыток хромовой кислоты не разрушится. Небольшими порциями и с осторожностью добавляли 63 г.
ацетона добавляют к 2-л. трехгорлая колба, снабженная капельной воронкой с длинным штоком, термометром и мощной механической мешалкой (примечание 2).Энергично перемешиваемый раствор охлаждают на водяной бане примерно до 20 ° C. Окисляющий реагент хромовой кислоты добавляют из капельной воронки в виде медленного потока, и скорость добавления регулируют так, чтобы температура реакционной смеси не поднималась выше 35 °. Добавление продолжают до тех пор, пока характерный оранжевый цвет реагента не сохраняется в течение примерно 20 минут. Объем добавляемого реагента составляет около 120 мл. Мешалку снимают, смесь декантируют в 2 л. круглодонную колбу, а остатки зеленых солей промывают двумя порциями по 70 мл.порции ацетона. Промывки добавляют к основному раствору ацетона и при необходимости добавляют дополнительный окислитель для обеспечения полной реакции. Заменяют мешалку и по каплям добавляют изопропиловый спирт до тех пор, пока избыток хромовой кислоты не разрушится. Небольшими порциями и с осторожностью добавляли 63 г. бикарбоната натрия, и суспензию интенсивно перемешивают до тех пор, пока pH реакционной смеси не станет нейтральным. Суспензию фильтруют и осадок на фильтре промывают 25 мл.ацетона. Фильтрат концентрируют перегонкой через 75 см. длины колонны Вигре до тех пор, пока температура в емкости не поднимется до 80 ° и в нижних частях дистилляционной колонны не начнет образовываться водная пленка. Остывший горшечный остаток (около 110 мл.) Переносят в 1 л. делительная воронка, 500 мл. насыщенного раствора хлорида натрия и смесь экстрагируют двумя порциями по 150 мл. порции эфира. Эфирные экстракты объединяют, промывают всего 25 мл. воду несколькими порциями, сушили над безводным сульфатом магния, фильтровали и эфир перегоняли при атмосферном давлении.Остаток перегоняют при пониженном давлении, т.кип. 76–77 ° (10 мм.). Выход циклооктанона составляет 58–60 г. (92–96%), т.пл. 40–42 °. Дополнительные 2,2 г. (4%) циклооктанона можно получить добавлением 250 мл. воды до зеленых солей, образующихся в ходе реакции, экстракция смеси эфиром, отгонка эфира и добавление 12 мл.
бикарбоната натрия, и суспензию интенсивно перемешивают до тех пор, пока pH реакционной смеси не станет нейтральным. Суспензию фильтруют и осадок на фильтре промывают 25 мл.ацетона. Фильтрат концентрируют перегонкой через 75 см. длины колонны Вигре до тех пор, пока температура в емкости не поднимется до 80 ° и в нижних частях дистилляционной колонны не начнет образовываться водная пленка. Остывший горшечный остаток (около 110 мл.) Переносят в 1 л. делительная воронка, 500 мл. насыщенного раствора хлорида натрия и смесь экстрагируют двумя порциями по 150 мл. порции эфира. Эфирные экстракты объединяют, промывают всего 25 мл. воду несколькими порциями, сушили над безводным сульфатом магния, фильтровали и эфир перегоняли при атмосферном давлении.Остаток перегоняют при пониженном давлении, т.кип. 76–77 ° (10 мм.). Выход циклооктанона составляет 58–60 г. (92–96%), т.пл. 40–42 °. Дополнительные 2,2 г. (4%) циклооктанона можно получить добавлением 250 мл. воды до зеленых солей, образующихся в ходе реакции, экстракция смеси эфиром, отгонка эфира и добавление 12 мл. ацетона. К раствору ацетона добавляют реагент окисления хромовой кислоты в количестве, достаточном для сохранения оранжевого цвета реагента, и смесь обрабатывают, как указано выше.
ацетона. К раствору ацетона добавляют реагент окисления хромовой кислоты в количестве, достаточном для сохранения оранжевого цвета реагента, и смесь обрабатывают, как указано выше.————————————————- ———————————————
Добавляется 1,06 грамма CrO3. до 0,92 мл h3SO4 и добавляют дистиллированную воду, чтобы довести общий объем до 4 мл. 2 грамма псевдоэфедрина растворяют в 20 мл ацетона и охлаждают на ледяной бане. Реагент Джонса медленно добавляют к псевдоэфедрину по каплям и при перемешивании. Смесь становится красновато-коричневой. Реакция будет протекать медленно, но очень плавно по мере добавления точных молей (мягкие условия).Размешайте теплый раствор в течение ночи. Примерно через 12-18 часов реакция завершается, цвет становится очень темно-зеленым. Добавьте около 20 мл воды и охладите на ледяной бане. По каплям и при перемешивании добавить около 1 грамма NaOH в растворе с минимальным количеством воды (высококонцентрированным). Регулярно проверяйте pH и остановитесь на pH = 12. Теперь основной раствор экстрагируют толуолом (3 х 50 мл), фильтруют, если образуются эмульсии. Объедините три экстракта толуола и выпаривайте, чтобы получить нечистый кетон псевдоэфедрина, также известный как меткатинион или эфедрон.Очистка: его очищают, добавляя толуол, достаточный для его повторного растворения. Толуол фильтруют для удаления любых дополнительных частиц, выливают обратно в делительную воронку и встряхивают с равным количеством дистиллированной воды. Это удаляет небольшое количество растворимых в воде веществ. Толуол помещают в чистую колбу RB и снова перегоняют. Примеси более растворимы в ацетоне, чем в эфедроне, поэтому добавляется очень небольшое количество ацетона, которое разбрызгивается. Отфильтруйте это, и полученные твердые частицы будут немного более 1 грамма (выход около 60%) относительно чистого, слегка не совсем белого меткатинона.Примечание. Приведенный пример — псевдоэфедрин или эфедрин на меткатинон — предназначен только для иллюстративных целей.
Регулярно проверяйте pH и остановитесь на pH = 12. Теперь основной раствор экстрагируют толуолом (3 х 50 мл), фильтруют, если образуются эмульсии. Объедините три экстракта толуола и выпаривайте, чтобы получить нечистый кетон псевдоэфедрина, также известный как меткатинион или эфедрон.Очистка: его очищают, добавляя толуол, достаточный для его повторного растворения. Толуол фильтруют для удаления любых дополнительных частиц, выливают обратно в делительную воронку и встряхивают с равным количеством дистиллированной воды. Это удаляет небольшое количество растворимых в воде веществ. Толуол помещают в чистую колбу RB и снова перегоняют. Примеси более растворимы в ацетоне, чем в эфедроне, поэтому добавляется очень небольшое количество ацетона, которое разбрызгивается. Отфильтруйте это, и полученные твердые частицы будут немного более 1 грамма (выход около 60%) относительно чистого, слегка не совсем белого меткатинона.Примечание. Приведенный пример — псевдоэфедрин или эфедрин на меткатинон — предназначен только для иллюстративных целей. Окисляющие таблетки от простуды являются незаконными и в любом случае создают паршивое лекарство. Запомните реакции с Реагентом Джонса:
Окисляющие таблетки от простуды являются незаконными и в любом случае создают паршивое лекарство. Запомните реакции с Реагентом Джонса:Вторичные спирты окисляются до соответствующих кетонов в реакции Джонса.
Первичные спирты окисляются до карбоновых кислот через альдегиды с помощью реактива Джонса.
Бензиловый спирт может окисляться до бензальдегида. Дальнейшее окисление до бензойной кислоты невозможно, поскольку бензальдегид не может образовывать стабильные гидраты в воде.
В реакции Джонса аллиловые спирты также избирательно окисляются до альдегидов. В этой реакции двойные связи не нарушаются.
- Диспропорционирование и перенос одного электрона приводят к кислоте хрома (V) и стабильному гидроксиду Cr (III). Хромовая (V) кислота способствует двухэлектронному окислению спирта и превращается в Cr (III). Любые остатки токсичных соединений Cr (V) и Cr (VI) могут быть уничтожены добавлением избытка 2-пропанола после завершения предполагаемой реакции.
 На образование Cr (III) указывает изменение цвета на зеленый.
На образование Cr (III) указывает изменение цвета на зеленый. - Для синтеза альдегидов подходящим выбором может быть реакция Коллинза или использование более современных, хотя и более дорогих, реагентов на основе хрома (VI), таких как PCC и PDC.
- Доступны некоторые новые протоколы, в которых каталитическое количество CrO3 в водном растворе используется в тандеме с сильным стехиометрическим окислителем, который способен повторно окислять Cr (IV), но не мешает органическим соединениям.
- Реагент Джонса готовят путем добавления хромового ангидрида к разбавленной серной кислоте в ацетоне и добавляют к спирту при 0-25 ° C.
- Окрашенный в оранжевый или желтый цвет Cr (VI) восстанавливается до сине-зеленых разновидностей Cr (III) во время окисления.
- Убедитесь, что реакционная масса слегка кислая для протекания.
Купить качественные хлопья хромовой кислоты cro3 по выгодным ценам
Хлопья хромовой кислоты cro3 , продаваемые на Alibaba. com, являются неизбежными химическими катализаторами и промежуточными продуктами, широко используемыми в красителях, фотографии, деревообрабатывающей, нефтяной и текстильной промышленности.Хлопья хромовой кислоты cro3 , экстрагированные из одного или нескольких неорганических соединений, являются оксокислотами или не содержат кислорода. Приобретите самый большой ассортимент хлопьев хромовой кислоты cro3 , созданный для сохранения стабильности при стандартных температурах и оригинальности в течение многих лет использования.
com, являются неизбежными химическими катализаторами и промежуточными продуктами, широко используемыми в красителях, фотографии, деревообрабатывающей, нефтяной и текстильной промышленности.Хлопья хромовой кислоты cro3 , экстрагированные из одного или нескольких неорганических соединений, являются оксокислотами или не содержат кислорода. Приобретите самый большой ассортимент хлопьев хромовой кислоты cro3 , созданный для сохранения стабильности при стандартных температурах и оригинальности в течение многих лет использования.
Найдите водорастворимые и нерастворимые в растворителях хлопья хромовой кислоты Cro3 , такие как соляная, серная и азотная кислоты, подходящие для лабораторных применений. Откройте для себя доступные по цене и эффективные хлопья хромовой кислоты Cro3 , доступные в разбавленных или концентрированных концентрациях, чтобы эффективно завершить ваши проекты предварительной обработки.Если вы ищете высококонцентрированные и сверхпрочные хлопья хромовой кислоты , cro3 или слабые, вы найдете сотни высококачественных продуктов премиум-класса, которые удовлетворят ваши потребности.
Купите хлопья хромовой кислоты cro3 Разработанные в соответствии со всеми отраслевыми стандартами безопасности, качества и надежности, продукты обеспечивают качественные результаты при использовании в агрохимии, промышленности и фармацевтике. На Alibaba.com найдите хлопьев хромовой кислоты cro3 в безводном, газообразном и водном форматах, каждая из которых достаточно прочна для различных проектов синтеза.Хлопья хромовой кислоты Cro3 , полученные от мировых лидеров в области химического производства, обладают различными свойствами и активностью.
Вы искали различные хлопья хромовой кислоты cro3 для хранения в розничном или оптовом магазине, но безрезультатно или с минимальным успехом? Просмотрите Alibaba.com, чтобы увидеть невероятно большую коллекцию продуктов, созданных для обеспечения безопасности, экологичности и устойчивости. Благодаря ценам и составам, подходящим для уникальных применений, найдите продукты, подходящие для ваших проектов.

 1016 / S0040-4039 (01) 81703-2
1016 / S0040-4039 (01) 81703-2  1080 / 00397917408062073
1080 / 00397917408062073 Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie. На образование Cr (III) указывает изменение цвета на зеленый.
На образование Cr (III) указывает изменение цвета на зеленый.