Константа диссоциации кислоты — Википедия
Материал из Википедии — свободной энциклопедии
У этого термина существуют и другие значения, см. Константа.Константа диссоциации кислоты (Ka) — константа равновесия реакции диссоциации кислоты на катион водорода и анион кислотного остатка. Для многоосновных кислот, диссоциация которых проходит в несколько стадий, оперируют отдельными константами для разных стадий диссоциации, обозначая их как Ka1, Ka2 и т. д. Чем больше значение Ka, тем больше молекул диссоциирует в растворе и, следовательно кислота более сильная.
Одноосновная кислота[править | править код]
- HA↽−−⇀A−+H+{\displaystyle {\ce {HA <=> A^- + H^+}}}
- Ka=[A−][H+][HA]{\displaystyle K_{{\ce {a}}}={\frac {[{\ce {A^-}}][{\ce {H+}}]}{{\ce {[HA]}}}}}
где A — условное обозначение аниона кислоты, [HA] — равновесная концентрация в растворе частицы HA.
Двухосновная кислота[править | править код]
h3A=H++HA−{\displaystyle H_{2}A=H^{+}+HA^{-}}
Ka1=[H+][HA−][h3A]{\displaystyle K_{a1}={\left[H^{+}\right]\left[HA^{-}\right] \over \left[H_{2}A\right]}}
HA−=H++A2−{\displaystyle HA^{-}=H^{+}+A^{2-}}
Ka2=[H+][A2−][HA−]{\displaystyle K_{a2}={\left[H^{+}\right]\left[A^{2-}\right] \over \left[HA^{-}\right]}}
Фигурирующая в выражениях концентрация [HA] — это равновесная концентрация недиссоциировавшей кислоты, а не изначальная концентрация кислоты до её диссоциации.
Величины pK и pH[править | править код]
Прологарифмируем равенство:
- log10Ka=log10([H+][A−][HA]){\displaystyle \log _{10}K_{\mathrm {a} }=\log _{10}\left(\mathrm {\frac {[H^{+}][A^{-}]}{[HA]}} \right)}
- log10Ka=log10[H+]+log10([A−][HA]){\displaystyle \log _{10}K_{\mathrm {a} }=\log _{10}[H^{+}]+\log _{10}\left(\mathrm {\frac {[A^{-}]}{[HA]}} \right)}
Чаще вместо самой константы диссоциации K используют величину pK, которая определяется как отрицательный десятичный логарифм самой константы Ka{\displaystyle K_{\mathrm {a} }}, выраженной в моль/л. Аналогично может быть выражен водородный показатель pH.
- pKa=−log10(Ka){\displaystyle \mathrm {p} K_{\mathrm {a} }=-\log _{10}\left(K_{\mathrm {a} }\right)}
- pH=−log10[H+]{\displaystyle {\ce {pH}}=-\log _{10}[{\ce {H+}}]}, тогда:
- −pKa=−pH+log10([A−][HA]){\displaystyle -\mathrm {p} K_{\mathrm {a} }=-{\ce {pH}}+\log _{10}\left(\mathrm {\frac {[A^{-}]}{[HA]}} \right)}
Преобразованием получим уравнение Гендерсона-Хассельбаха в общем виде:
- pH=pKa+log10([A−][HA]){\displaystyle {\ce {pH}}=\mathrm {p} K_{\mathrm {a} }+\log _{10}\left(\mathrm {\frac {[A^{-}]}{[HA]}} \right)}
Селенистая кислота — Википедия
Материал из Википедии — свободной энциклопедии
Селе́нистая кислота́ — неорганическое химическое соединение селена, кислота. Химическая формула H2SeO3.
Является аналогом сернистой и теллуристой кислот.
Селенистая кислота — одна из двух основных оксикислот селена (вторая из них — селеновая кислота H2SeO4)
Токсична.
Белые ромбические кристаллы. Очень гигроскопична. Хорошо растворима в воде и этаноле. При растворении происходит сильное поглощение тепла[источник не указан 626 дней]. Неустойчивая кислота, при нагревании выше 70 °C распадается на воду и диоксид селена SeO2.
- Слабая кислота. Образует два ряда солей — кислые и средние соли — биселениты и селениты в результате реакций нейтрализации щелочей (и кислые, и средние), или сплавления с оксидами металлов (средние).
- Является окислителем средней силы, проявляет окислительно-восстановительную двойственность:
- реагирует с концентрированным растворами галогеноводородных кислот (кроме фтороводородной), окисляя их до галогенов. В результате этой реакции элементарный селен выпадает в осадок;
- может быть окислена сильными окислителями (хлор и бром в щелочной среде, озон в сильнокислой среде, пероксид водорода) до селеновой кислоты.
- В результате электролиза водного раствора на катоде выделяется водород, а на аноде — селеновая кислота.
Селенистую кислоту получают из оксида селена(IV) SeO2, растворяемого в воде, либо окислением селена разбавленной азотной кислотой.
Селенистую кислоту обычно применяют для травления металлов, например меди или магния, для оксидирования стали в процессе холодного воронения стали, в основном деталей огнестрельного оружия.
Применяется для получения глиоксаля окислением ацетальдегида.
Основной компонент в реактиве на некоторые наркотические вещества
[1].Также из селенистой кислоты окислением либо электролизом получают селеновую кислоту H2SeO4.
Селенистая кислота как и другие соединения селена H2SeO3 в больших дозах токсична для человека. При попадании на кожу вызывает раздражение и химические ожоги.
Иодная кислота — Википедия
Материал из Википедии — свободной энциклопедии
Иодная кислота | |
|---|---|
 | |
Общие | |
| Хим. формула | H₅IO₆ |
Физические свойства | |
| бесцветные кристаллы | |
| Молярная масса | 227,941 г/моль |
Термические свойства | |
| Т. плав. | 122 ℃ |
| 130–140 ℃ | |
Классификация | |
| Номер CAS | 10450-60-9 |
| PubChem | 25289 |
| ChemSpider | 23622 |
| Номер EINECS | 233-937-0 |
| ChEBI | 29150 |
OI(=O)(O)(O)(O)O | |
1S/H5IO6/c2-1(3,4,5,6)7/h(H5,2,3,4,5,6,7) | |
| Приводятся данные для стандартных условий (25 ℃, 100 кПа), если не указано иное. | |
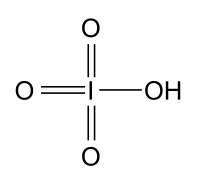
Иодная кислота HIO4 (гексаоксоиодат (VII) водорода, периодат Н5IO6)— слабая кислота, гигроскопичное кристаллическое вещество.
Иодная кислота хорошо растворима в воде. В водном растворе Н5IO6 — слабая кислота (Ka1 = 2,45⋅10−2, pKa1=1,61; Ka2 = 4,3⋅10−9,pKa2=8,37; Ka3 = 10−15, pKa3 = 15 ; при температуре 25 ℃)[1].
В растворах существует ряд гидратов состава mHIO4•nН2О, которые можно рассматривать как представителей ряда многоосновных кислот H3IO5, H4I2O9, H
Кислотные свойства НIO4 выражены несравненно слабее, чем у HClO4, в то время, как она проявляет более сильные окислительные свойства(E0(HIO4/HIO3) = 1,64 В.). Отвечающий ей ангидрид неизвестен. При нагревании НIO4 разлагается по уравнению:
- 2HIO4→h3O+I2O5+O2{\displaystyle {\mathsf {2HIO_{4}\rightarrow H_{2}O+I_{2}O_{5}+O_{2}}}}
- 2HClO4+I2→2HIO4+Cl2{\displaystyle {\mathsf {2HClO_{4}+I_{2}\rightarrow 2HIO_{4}+Cl_{2}}}}
В зависимости от условий реакции (концентрация, рН) иодная кислота образует ряд солей, содержащих ионы, IO
65−, IO53−, IO4— и I2O94− — соответственно орто-, мезо-, мета- и дипериодаты.Соли иодной кислоты (периодаты) являются сильными окислителями, при нагревании разлагаются с выделением кислорода и иодида:
- NaIO4→NaI+2O2{\displaystyle {\mathsf {NaIO_{4}\rightarrow NaI+2O_{2}}}}
Периодаты могут быть получены окислением иодатов в щелочной среде сильными окислителями, например хлором:
- NaIO3+2NaOH+Cl2→NaIO4+2NaCl+h3O{\displaystyle {\mathsf {NaIO_{3}+2NaOH+Cl_{2}\rightarrow NaIO_{4}+2NaCl+H_{2}O}}}
Иодная кислота и её соли применяются в аналитической химии как окислители и при анализе структуры углеводов.
Иодную кислоту или её соли используют для окислительного расщепления вицинальных диолов до альдегидов. Последовательная обработка алкенов OsO4 и NaIO4 (реакция Малапрада) применяется в современном органическом синтезе для окисления алкенов до альдегидов (на первой стадии образуется вицинальный диол, на второй он расщепляется).
- ↑ И.Т. Гороновский, Ю.П. Назаренко, Е.Ф. Некряч. Краткий справочник по Химии. — Киев, 1987. — С. 348. — 828 с.
- Некрасов Б. В. Основы общей химии. — 3-е изд. — М.: Химия, 1973. — Т. 2. — 656 с.
Винная кислота — Википедия
Материал из Википедии — свободной энциклопедии
| Винная кислота | |||
|---|---|---|---|
| |||
| Традиционные названия | Винная кислота | ||
| Хим. формула | НООССН(ОН)СН(ОН)СООH | ||
| Молярная масса | 150,1 г/моль | ||
| Плотность |
| ||
| Температура | |||
| • плавления |
| ||
| Константа диссоциации кислоты pKa{\displaystyle pK_{a}} | при 25 °C: D,L- pKa1 = 2,95, pKa2=4,25 мезо- pKa1 = 3,22 pKa2=4,85 | ||
| Растворимость | |||
| • в воде | |||
| Рег. номер CAS | 87-69-4 L-(+), | ||
| PubChem | 875 | ||
| Рег. номер EINECS | 610-885-0 | ||
| SMILES | |||
| InChI | |||
| ChEBI | 15674 | ||
| ChemSpider | 852 | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
 Медиафайлы на Викискладе Медиафайлы на Викискладе | |||
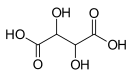
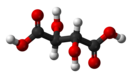
Ви́нная кислота́ (диоксиянтарная кислота, тартаровая кислота, 2,3-дигидроксибутандиовая кислота) HOOC−CH(OH)−CH(OH)−COOH{\displaystyle {\ce {HOOC-CH(OH)-CH(OH)-COOH}}} — двухосновная оксикислота. Соли и анионы винной кислоты называют тартратами.
Известны три стереоизомерные формы винной кислоты: D-(−)-энантиомер (слева вверху), L-(+)-энантиомер (справа вверху) и мезо-форма (мезовинная кислота):
Рацемическая смесь энантиомерных винных кислот известна как виноградная кислота.
Винная кислота — распространённое природное соединение. В значительном количестве она содержится в кислом соке многих фруктов, например, в виноградном соке. D-винную кислоту получают действием минеральных кислот на её кислую калиевую соль (винный камень), образующуюся при брожении виноградного сока. При пиролизе D-винная кислота декарбоксилируется с образованием пировиноградной Ch4(CO)COOH{\displaystyle {\ce {Ch4(CO)COOH}}} и пировинной (метилянтарной) HOOCCH(Ch4)Ch3COOH{\displaystyle {\ce {HOOCCH(Ch4)Ch3COOH}}} кислот. Она восстанавливается до янтарной кислоты, восстанавливает аммиачный раствор AgNO3{\displaystyle {\ce {AgNO3}}} до Ag{\displaystyle {\ce {Ag}}}; в щелочной среде растворяет Cu(OH)2{\displaystyle {\ce {Cu(OH)2}}} с образованием прозрачного ярко-синего раствора — реактива Фелинга.
Применяется в пищевой промышленности (пищевая добавка Е334), в медицине, в аналитической химии для обнаружения альдегидов, сахаров и др., в химической и фармакологической промышленности для разделения рацематов органических веществ на изомеры. Соли винной кислоты (тартраты) используются в медицине, при крашении тканей и др.
- ↑ 1 2 3 K. Peter C. Vollhardt: Organische Chemie, VCH Weinheim, 1. korrigierter Nachdruck der 1. Auflage, 1990, S. 166, ISBN 3-527-26912-6.
Незаменимые жирные кислоты — Википедия
Материал из Википедии — свободной энциклопедии
Незаменимые жирные кислоты — ряд полиненасыщенных[⇨] жирных кислот, которые принимают значительное участие в метаболизме животных и человека. Организм способен преобразовывать кислоты одного класса в другой, но не способен синтезировать оба класса из более простых веществ[1][2][3][4], поэтому они обязательно должны присутствовать в пище, подобно микроэлементам; это было показано ещё в 1930 году[5].
Существует также условный[6] или устаревший[7] термин «витамин F», под которым понимается общность нескольких незаменимых жирных кислот: олеиновой, арахидоновой[~ 1], линолевой и линоленовой[6][9][8], некоторые авторы[10] включают в эту общность только линолевую и линоленовую кислоту. Эту группу веществ могут относить к витаминоподобным жирорастворимым веществам[9][10] или к веществам с сомнительными витаминными свойствами[11]; используется также термин «эссенциальные жирные кислоты»[9][10][11][8]. Ранее некоторые авторы относили «витамин F» к витаминам[11].
Когда оба семейства полиненасыщенных жирных кислот были впервые обнаружены в 1923 году, они были отнесены к витаминам и названы «витамин F». В 1930 году было показано, что оба семейства относятся к жирам, а вовсе не к витаминам[12][5].
Незаменимые жирные кислоты важны для сердечно-сосудистой системы: препятствуют развитию атеросклероза, улучшают кровообращение, обладают кардиопротекторным и антиаритмическим действием. Полиненасыщенные жирные кислоты уменьшают воспалительные процессы в организме, улучшают питание тканей[13]. Суточная потребность человека оценивается в 5-10 граммов[9].
По данным исследований, употребление эйкозапентаеновой кислоты и докозагексаеновой кислоты предположительно улучшает состояние при клинической депрессии[14]. Полиненасыщенные жирные кислоты участвуют в синаптогенезе и синтезе нейромодуляторов, препятствуют синтезу регуляторных молекул, связанных с болезнью Альцгеймера и шизофренией[15].
Источники[править | править код]
Природными источниками витамина F являются растительные масла из зародышей пшеницы, семени льна, рыжиковое масло, горчичное масло, масло подсолнечника, соевых бобов, арахиса, а также грецкий орех, миндаль, семечки подсолнуха, рыбий жир и рыба жирных и полужирных видов (лосось, макрель, сельдь, сардины, форель, тунец и др.) и моллюски[13].
Жирные кислоты представляют собой длинные цепочки углеродных атомов с кислотной группой (COOH) на конце. Ненасыщенные вещества содержат двойную связь между атомами в цепочке, а «полиненасыщенные» — две или больше таких связей.
Полиненасыщенные жирные кислоты классифицируют по месту нахождения двойной связи в цепочке. При этом используется не химическая система нумерации (от соседнего с кислотной группой альфа-атома α), а обратная — потому что физиологические свойства этих кислот зависят от положения двойных связей относительно противоположного конца молекулы, от омега-атома ω.
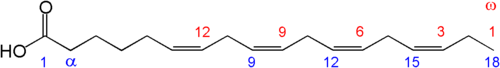
Омега-3[править | править код]
К Омега-3 кислотам принято относить одиннадцать полиненасыщенных жирных кислот, основными из которых являются:[источник не указан 2341 день]
Омега-6[править | править код]
К Омега-6 кислотам принято относить одиннадцать полиненасыщенных жирных кислот, основными из которых являются:[источник не указан 2341 день]
- Комментарии
- Источники
- ↑ Modern Nutrition in Health and Disease 6th Ed. (1980) Robert S. Goodhart and Maurice E. Shils. Lea and Febinger. Philadelphia. ISBN 0-8121-0645-8. pp. 134—138.
- ↑ Whitney Ellie and Rolfes SR Understanding Nutrition 11th Ed, California, Thomson Wadsworth, 2008 p.154.
- ↑ Enig Mary G. Know your Fats Bethesda Press 2005 p.249
- ↑ Burr, G.O., Burr, M.M. and Miller, E. «On the nature and role of the fatty acids essential in nutrition» (неопр.). J Biol Chem. Volume 86, Issue 587 (1930). Дата обращения 23 мая 2011. Архивировано 18 октября 2012 года.
- ↑ 1 2 Burr, G.O., Burr, M.M. and Miller, E. On the nature and role of the fatty acids essential in nutrition (англ.) // J. Biol. Chem. : journal. — 1930. — Vol. 86, no. 587.
- ↑ 1 2 Овчинников Ю. А. Биоорганическая химия. — М.: Просвещение, 1987. — С. 687. — 815 с.
- ↑ Gerald F. Combs, Jr. The Vitamins. — 3. — Academic Press, 2007. — С. 517. — P. 608. — ISBN 0080561306, 9780080561301.
- ↑ 1 2 3 Silke K. Schagen, Vasiliki A. Zampeli, Evgenia Makrantonaki and Christos C. Zouboulis. Discovering the link between nutrition and skin aging (англ.) // Dermatoendocrinol. — 2012. — Iss. 4. — No. 3. — P. 298—307. — DOI:10.4161/derm.22876.
- ↑ 1 2 3 4 Строев Е. А. Биологическая химия. — М.: Высшая школа, 1986. — С. 340, 352. — 479 с.
Витамин F представляет собой сумму ненасыщенных жирных кислот, которые не могут быть синтезированы в тканях организма и необходимы для его жизнедеятельности.
- ↑ 1 2 3 Биологическая химия / Таганович А. Д.. — Минск: БИНОМ, 2008. — С. 126—127. — 688 с. — ISBN 978-5-9518-0261-3.
- ↑ 1 2 3 Wilhelm Friedrich. Vitamins. — Walter de Gruyter, 1988. — С. 55—56. — 1058 с. — ISBN 3110102447, 9783110102444.
Compounds with questionable vitamin character.
Some authors used to include the essential fatty acids («vitamin F»), […] among the vitamins.
- ↑ Whitney Ellie and Rolfes S. R. Understanding Nutrition (неопр.). — 11th. — California: Thomson Wadsworth (англ.)русск., 2008. — С. 154.
- ↑ 1 2 Handbook of Essential Fatty Acid Biology Biochemistry, Physiology, and Behavioral Neurobiology // Mostofsky, David I.; Yehuda, Shlomo (Eds.) // 1st ed. Softcover of orig. ed. 1997, 1997, 480 p. // A product of Humana Press ISBN 978-0-89603-365-8
- ↑ Servan-Schreiber D. The Instinct to Heal: Curing Depression, Anxiety and Stress Without Drugs and Without Talk Therapy (англ.). — Rodale Books (англ.)русск., 2004. — P. 141. — ISBN 1-57954-902-0.
- ↑ Nabarun Chakraborty, Seid Muhie, Raina Kumar, Aarti Gautam, Seshamalini Srinivasan. Contributions of polyunsaturated fatty acids (PUFA) on cerebral neurobiology: an integrated omics approach with epigenomic focus // The Journal of Nutritional Biochemistry. — 2017-01-05. — Т. 42. — С. 84—94. — ISSN 1873-4847. — DOI:10.1016/j.jnutbio.2016.12.006.
Борная кислота — Википедия
| Борная кислота | |||
|---|---|---|---|
| |||
 ( ({{{изображение}}}) | |||
| Систематическое наименование | Ортоборная кислота | ||
| Хим. формула | H3BO3 | ||
| Состояние | твёрдое | ||
| Молярная масса | 61,83 г/моль | ||
| Плотность | 1,435 (15 °C) | ||
| Температура | |||
| • плавления | 170.9 °C, 444 K, 340 °F | ||
| • кипения | 300 °C, 573 K, 572 °F °C | ||
| Константа диссоциации кислоты pKa{\displaystyle pK_{a}} | 9,24 (I), 12,74 (II), 13,80 (III) | ||
| Растворимость | |||
| • в воде | 2.52 (0 °C) 4.72 (20 °C) г/100 мл | ||
| Рег. номер CAS | 10043-35-3 | ||
| PubChem | 7628 | ||
| Рег. номер EINECS | 233-139-2 | ||
| SMILES | |||
| InChI | |||
| Кодекс Алиментариус | E284 | ||
| RTECS | ED4550000 | ||
| ChEBI | 33118 | ||
| ChemSpider | 7346 | ||
| NFPA 704 |  | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
 Медиафайлы на Викискладе Медиафайлы на Викискладе | |||
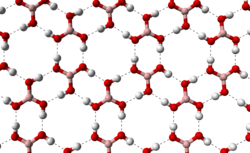 Структура плоского слоя в ортоборной кислоте
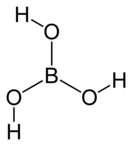
Структура плоского слоя в ортоборной кислотеБо́рная кислота́ (ортоборная кислота или лат. acidum Boricum) — слабая, одноосновная кислота Льюиса, часто используемая в качестве инсектицида, антисептика, огнезащитного состава, поглотителя нейтронов или предшественника для получения иных химических составов. Имеет химическую формулу H3BO3 (или B(OH)3).
Бесцветное кристаллическое вещество в виде чешуек без запаха, имеет слоистую триклинную решётку, в которой молекулы кислоты соединены водородными связями в плоские слои, слои соединены между собой межмолекулярными связями, длина которых составляет 272пм. Расстояние между соседними слоями — 318пм.
Метаборная кислота (HBO2) также представляет собой бесцветные кристаллы. Она существует в трёх модификациях — наиболее устойчивой γ-НВО2 с кубической решёткой, β-НВО2 с моноклинной решёткой и α-НВО2 с ромбической решёткой.
При нагревании ортоборная кислота теряет воду и сначала переходит в метаборную кислоту, затем в тетраборную H2B4O7. При дальнейшем нагревании обезвоживается до борного ангидрида.
Водные растворы борной кислоты являются смесью полиборных кислот общей формулы Н3m-2nВmО3m-n. В природе встречается в виде минерала сассолина.
В природе свободная борная кислота встречается в виде минерала сассолина, в горячих источниках и минеральных водах.
Борная кислота может быть получена путём смешения буры (Тетрабората натрия) с минеральной кислотой, например, соляной:
- Na2B4O7⋅10h3O+2HCl→4h4BO3+2NaCl+5h3O{\displaystyle {\mathsf {Na_{2}B_{4}O_{7}\cdot 10H_{2}O+2HCl\rightarrow 4H_{3}BO_{3}+2NaCl+5H_{2}O}}}
Также является продуктом гидролиза диборана или тригалогенидов бора[1]:
- B2H6+6h3O→2h4BO3+6h3{\displaystyle {\mathsf {B_{2}H_{6}+6H_{2}O\rightarrow 2H_{3}BO_{3}+6H_{2}}}}
- BCl3+3h3O→h4BO3+3HCl{\displaystyle {\mathsf {BCl_{3}+3H_{2}O\rightarrow H_{3}BO_{3}+3HCl}}}
Борная кислота проявляет очень слабые кислотные свойства. Она сравнительно мало растворима в воде. Её кислотные свойства обусловлены не отщеплением протона Н+, а присоединением гидроксильного аниона:
- B(OH)3+h3O→H[B(OH)4]{\displaystyle {\mathsf {B(OH)_{3}+H_{2}O\rightarrow H[B(OH)_{4}]}}}
- Ka = 5.8⋅10−10 моль/л; pKa = 9.24.
Она легко вытесняется из растворов своих солей большинством других кислот. Соли её, называемые боратами, производятся обычно от различных полиборных кислот, чаще всего — тетраборной Н2В4О7, которая является значительно более сильной кислотой, чем ортоборная.
Очень слабые признаки амфотерности B(OH)3 проявляет, образуя малоустойчивый гидросульфат бора В(HSO4)3.
При нейтрализации ортоборной кислоты щелочами в водных растворах не образуются ортобораты, содержащие ион (ВО3)3−, поскольку ортобораты гидролизуются практически полностью, вследствие слишком малой константы образования [В(ОН)4]−. В растворе образуются тетрабораты, метабораты или соли других полиборных кислот:
- 2NaOH+4h4BO3⟶Na2B4O7+7h3O{\displaystyle {\mathsf {2NaOH+4H_{3}BO_{3}\longrightarrow Na_{2}B_{4}O_{7}+7H_{2}O}}}
- Избытком щелочи они могут быть переведены в метабораты:
- 2NaOH+Na2B4O7⟶4NaBO2+h3O{\displaystyle {\mathsf {2NaOH+Na_{2}B_{4}O_{7}\longrightarrow 4NaBO_{2}+H_{2}O}}}
Мета- и тетрабораты гидролизуются, но в меньшей степени (реакции, обратные приведённым).
В подкисленных водных растворах боратов устанавливаются следующие равновесия:
- 3H[B(OH)4]⇄H++[B3O3(OH)4]−+5h3O{\displaystyle {\mathsf {3H[B(OH)_{4}]\rightleftarrows H^{+}+[B_{3}O_{3}(OH)_{4}]^{-}+5H_{2}O}}}
- [B3O3(OH)4]−+OH−⇄[B3O3(OH)5]2−{\displaystyle {\mathsf {[B_{3}O_{3}(OH)_{4}]^{-}+OH^{-}\rightleftarrows [B_{3}O_{3}(OH)_{5}]^{2-}}}}
При нагревании борная кислота растворяет оксиды металлов, образуя соли.
Со спиртами в присутствии концентрированной серной кислоты образует эфиры:
- h4BO3+ 3Ch4OH⟶ 3h3O+ B(OCh4)3{\displaystyle {\mathsf {H_{3}BO_{3}+\ 3CH_{3}OH\longrightarrow \ 3H_{2}O+\ B(OCH_{3})_{3}}}}
Образование борнометилового эфира В(ОСН3)3 является качественной реакцией на Н3ВО3 и соли борных кислот, при поджигании борнометиловый эфир горит красивым ярко-зелёным пламенем.
Борный спирт (лат. Solutio Acidi borici spirituosa) — раствор борной кислоты в этиловом спирте (как правило, в 70 % этаноле).
Спиртовые растворы борной кислоты в концентрации 0,5 %, 1 %, 2 %, 3 %, 5 % готовятся на 70 % этиловом спирте и применяются в качестве антисептика и как противозудное средство при обтирании здоровых участков кожи вокруг очагов пиодермии, а также в качестве ушных капель.
Борная кислота может быть опасна только при бесконтрольном приёме внутрь. Опасная концентрация в организме человека (а особенно ребёнка) может возникнуть при регулярном применении. Смертельная доза при отравлении через рот для взрослого человека составляет 15-20 г, для детей — 4-5 г [2].
Борная кислота применяется в медицине с 1860-х годов как антисептическое средство, не раздражающее ран и не имеющее вкуса, запаха и цвета. В современной медицине противомикробная эффективность борной кислоты считается низкой.
Использование борной кислоты в качестве антисептического средства для детей, а также беременных и кормящих женщин было запрещено 2 февраля 1987 года Министерством здравоохранения СССР по рекомендации Фармакологического комитета с формулировкой: «…запретить использование борной кислоты в качестве антисептического средства у детей грудного возраста, а также у женщин в период беременности и лактации в связи с её низкой активностью и высокой токсичностью»[3].
- В ядерных реакторах в качестве поглотителя нейтронов, растворённого в теплоносителе.
- Борное удобрение.
- В лабораториях применяют для приготовления буферных растворов.
- В медицине — как самостоятельное дезинфицирующее средство для взрослых, а также в виде 2%-го раствора — для промывки кожи после попадания щелочей.
- Также на основе борной кислоты производятся различные комбинированные препараты (группа АТХ D08AD), например паста Теймурова.
- В фотографии — в составе мелкозернистых проявителей и кислых фиксажей для создания слабой кислотной среды.
- В пищевой промышленности зарегистрирована как пищевая добавка E284 (на территории России эта добавка не входит в список разрешённых к применению[4]).
- В ювелирном деле — как основа флюсов для пайки золотосодержащих сплавов.
- В литейном производстве — связующее при кислой футеровке печей, компонент защиты струи от окисления при разливке магниевых сплавов.
- В быту — уничтожение тараканов, муравьёв, клопов.
- В производстве керамики, оптоволокна, стекловолокна, стекла[5],
- В качестве антипирена для защиты древесины,
- В составе электролитов для меднения и никелирования.
- Как люминофор или в качестве компонента люминофора для учебных экспериментов по люминесценции веществ.[6][7][8]
- Карапетьянц М. Х. Дракин С. И. Общая и неорганическая химия. М.: Химия 1994
- Реми Г. «Курс неорганической химии» М.: Иностранная литература, 1963
- М. Д. Машковский. Лекарственные средства. — М.: ООО «Новая волна», 2002. — Т. 2. — 608 с. — 25 000 экз. — ISBN 5-7864-0129-4.
 (
(
 (
(