Химические свойства кислот, химия 8 класс
Общие свойства кислот. Классификация
Кислоты — класс сложных химических веществ, состоящих из атомов водорода и кислотных остатков.
В первую очередь кислоты делятся на:
- органические или карбоновые и
- неорганические или минеральные.
Свойства карбоновых кислот подробно разбираются в статье Карбоновые кислоты (ссылка на статью)
В зависимости от количества атомов водорода, которые могут замещаться в химических реакциях различают:
- одноосновные кислоты
- двухосновные кислоты
- трехосновные кислоты.
Не смотря на то, что в уксусной кислоте четыре атома водорода, три из них принадлежат кислотному остатку и в реакциях замещения не участвуют. Соответственно, уксусная кислота — одновалентная.
Свойства неорганических кислот также зависят от наличия в их составе кислорода и делятся на
- бескислородные
- кислородсодержащие.

Растворы кислот способны диссоциировать и проводить электрический ток т.е. являются электролитами. В зависимости от степени диссоциации делятся на:
- сильные
- слабые электролиты.
Химия. 8 класс. Учебник
Учебник написан преподавателями химического факультета МГУ им. М. В. Ломоносова. Отличительными особенностями книги являются простота и наглядность изложения материала, высокий научный уровень, большое количество иллюстраций, экспериментов и занимательных опытов, что позволяет использовать её в классах и школах с углублённым изучением естественно-научных предметов.
КупитьХимические свойства кислот
1. Диссоциация
При диссоциации кислот образуются катионы водорода и анионы кислотного остатка.
HNO3 → H+ + NO—3
HCl → H+ + Cl—
Многоосновные кислоты диссоциируют ступенчато.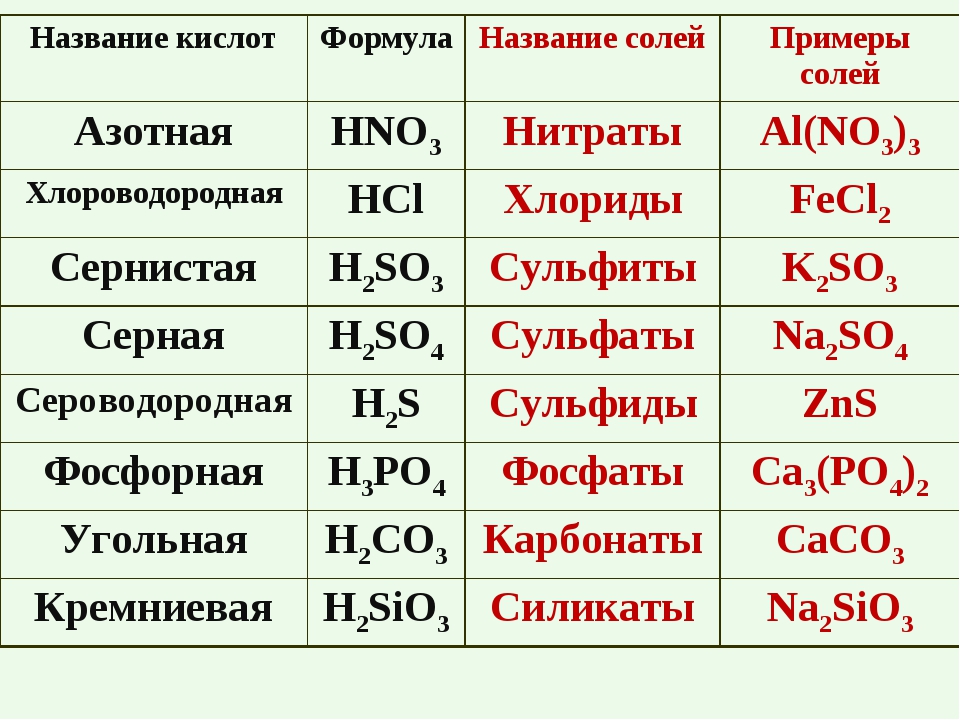
Н3РО4 ↔ Н+ + Н2РО—4 (первая ступень)
Н2РО—4 ↔ Н+ + НРO2-4 (вторая ступень)
НРО2-4 ↔ Н+ + PОЗ-4 (третья ступень)
2. Разложение
Кислородсодержащие кислоты разлагаются на оксиды и воду.
H2CO3 → H2O + CO2↑
Бескислородные на простые вещества
3. Реакция с металлами
Кислоты реагируют лишь с теми металлами, что стоят в ряду активности до кислорода. В результате взаимодействия образуется соль и выделяется водород.
Mg + 2HCl → MgCl2 + H2↑
Найти ряд активности можно на последней странице электронного учебника
«Химия 9 класс» под редакцией В. В. Еремина.
В. Еремина.
Бдительные ученики могут сказать: «Золото стоит в ряду активности металлов после водорода, а с „царской водкой“ реагирует. Как же так?»
Из всех правил есть исключения.
Поскольку в состав азотной кислоты входит азот со степенью окисления +5, а в состав серной — сера со степенью окисления +6, то с металлами реагируют не ионы водорода, а более сильные окислители. Образуется соль, но не происходит выделения водорода.
Au + HNO3 + 4HCl → HAuCl4 + NO + 2H2O.
4. Реакции с основаниями
В результате образуются соль и вода, происходит выделение тепла.
Na2CO3 + 2CH3 — COOH → 2CH3 — COONa + H2O + CO2↑.
Реакции такого типа называются реакциями нейтрализации. Простейшая реакция, которую можно провести на собственной кухне — гашение соды столовым уксусом или 9%раствором уксусной кислоты.
5. Реакции кислот с солями
Вспомним, когда мы разбирали ионные уравнения ( ссылка на статью), одним из условий протекания реакций было образование в ходе взаимодействия нерастворимой соли, выделение летучего газа или слабо диссоциирующего вещества — например, воды. Те же условия сохраняются и для реакций кислот с солями.
BaCl2 + H2SO4 → BaSO4↓ + 2HCl↑
6. Реакция кислот с основными и амфотерными оксидами
В ходе реакции образуется соль и происходит выделение воды.
K2O + 2HNO3 → 2KNO3 + H2O
7. Восстановительные свойства бескислородных кислот
Если в окислительных реакциях первую скрипку играет водород, то в восстановительных реакциях основная роль принадлежит анионному остатку. В результате реакций образуются свободные галогены.
4HCl + MnO2 → MnCl2 + Cl2↑ + 2H2O
Физические свойства кислот
При нормальных условиях (Атмосферное давление = 760 мм рт. ст. Температура воздуха 273,15 K = 0°C) кислоты чаще жидкости, хотя встречаются и твердые вещества: например ортофосфорная H3PO4 или кремниевая H2SiO3.
ст. Температура воздуха 273,15 K = 0°C) кислоты чаще жидкости, хотя встречаются и твердые вещества: например ортофосфорная H3PO4 или кремниевая H2SiO3.
Некоторые кислоты представляют собой растворы газов в воде: фтороводородная-HF, соляная-HCl, бромоводородная-HBr.
Кислотные свойства кислот в ряду HF → HCl → HBr → HI усиливаются.
Для некоторых кислот (соляная, серная, уксусная) характерен специфический запах.
Благодаря наличию ионов водорода в составе, кислоты обладают характерным кислым вкусом.
Химическая лаборатория не ресторан, и в целях безопасности существует жесткий запрет на опробование на вкус химических веществ.
Как же можно определить кислота в пробирке или нет?
В 1300 году был открыт лакмус, и с тех пор алхимикам и химикам не пришлось рисковать своим здоровьем, пробуя на вкус содержимое пробирок. Запомните, что лакмус в кислой среде краснеет.
Запомните, что лакмус в кислой среде краснеет.
Вторым широко используемым индикатором является фенолфталеин.
Простой мнемонический стишок поможет запомнить, как ведут себя индикаторы в разных средах.
Индикатор лакмус — красный
Кислоту укажет ясно.
Щёлочь здесь — не будь разиней,
Когда ж нейтральная среда,
Он фиолетовый всегда.
Фенолфталеиновый — в щелочах малиновый
Но несмотря на это в кислотах он без цвета. Что ещё почитать?
Неметаллы
Биография Д.И. Менделеева. Интересные факты из жизни великого химика
Карбоновые кислоты
Массовая доля вещества
18HBr + 2KMnO4 →2KBr + 2MnBr2 + 8H2O + 5Br2
14НI + K2Cr2O7 →3I2↓ + 2Crl3 + 2KI + 7H2O
#ADVERTISING_INSERT#Кислоты: состав, свойства, получение.
 Химия, 8–9 класс: уроки, тесты, задания.
Химия, 8–9 класс: уроки, тесты, задания.| 1. | Меры предосторожности при работе с кислотами Сложность: лёгкое | 1 |
| 2. |
Классификация кислот
Сложность: лёгкое |
1 |
3.
|
Расчёт массовой доли элемента в кислоте
Сложность: лёгкое |
1 |
| 4. |
Массовая доля растворённого вещества в растворе
Сложность: среднее |
2 |
5.
|
Взаимодействие кислот с металлами
Сложность: среднее |
2 |
| 6. |
Взаимодействие кислот с основаниями
Сложность: среднее |
2 |
7.
|
Взаимодействие кислот с солями
Сложность: сложное |
3 |
| 8. |
Взаимодействие кислот со смесью металлов
Сложность: сложное |
3 |
9.
|
Вычисления, связанные со сливанием двух растворов
Сложность: сложное |
3 |
| 10. |
Получение кислот
Сложность: среднее |
2 |
11.
|
Свойства кислот
Сложность: среднее |
2 |
Общая характеристика кислот — урок. Химия, 8–9 класс.
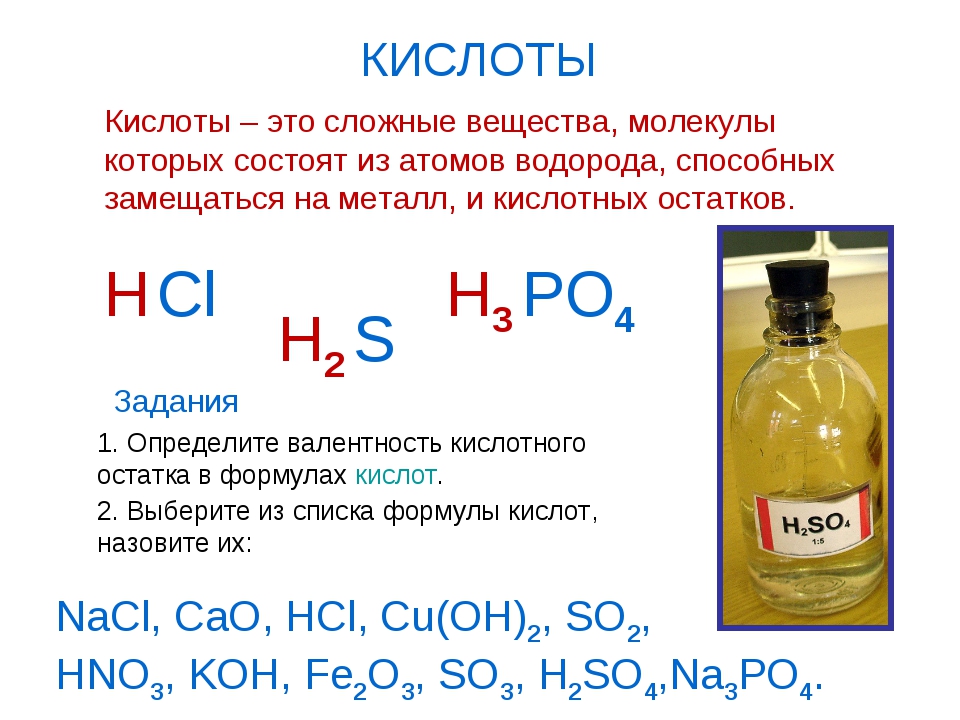
Кислотами называют сложные вещества, состоящие из атомов водорода, способных замещаться металлами, и кислотных остатков.
Кислотным остатком называют часть молекулы кислоты, соединённую с атомами водорода.
При замещении водорода в кислотах металлами в состав образующихся солей кислотные остатки переходят в неизменном виде. Если кислотный остаток в кислоте соединён с одним атомом водорода, то он одновалентен, если с двумя — двухвалентен, если с тремя — трёхвалентен и т. д.
д.
Валентность кислотного остатка определяется количеством атомов водорода, способных замещаться металлами.
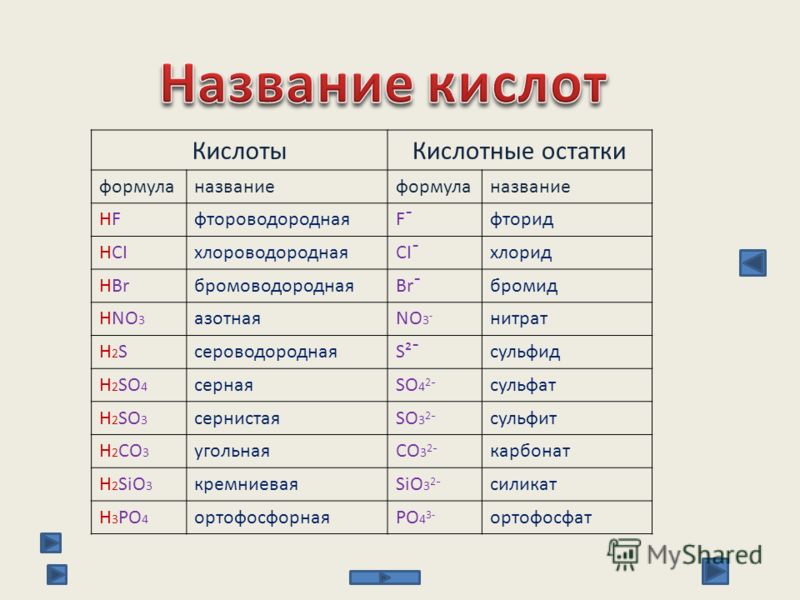
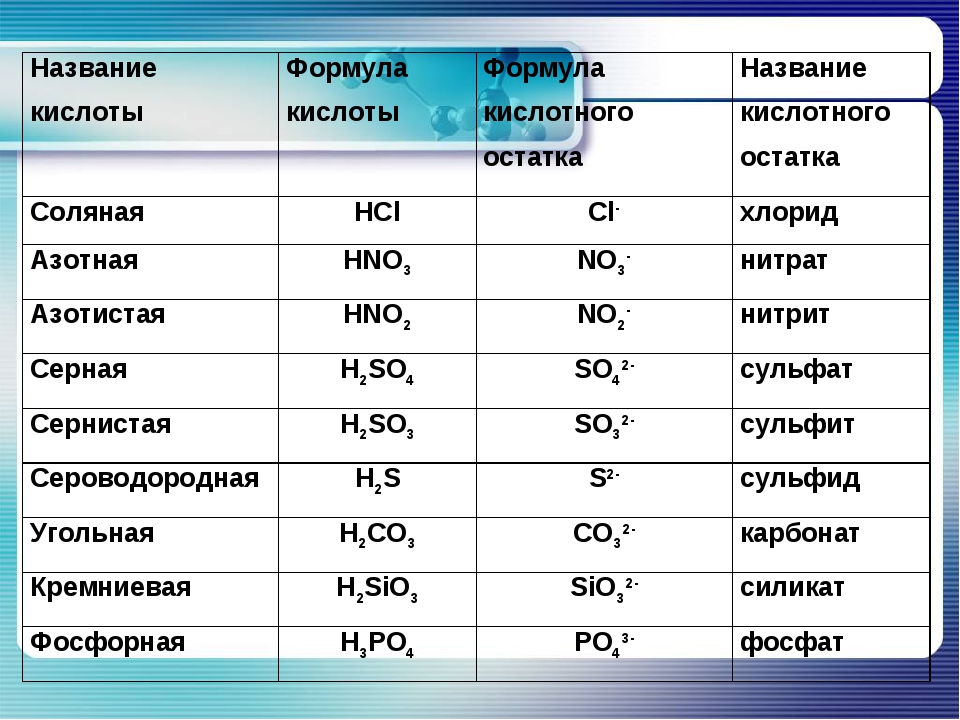
Формулы и названия некоторых кислот приведены в таблице.
Важнейшие неорганические кислоты
Название кислоты | Формула кислоты | Формула кислотного остатка | Название соли этой кислоты |
| Фтороводородная (плавиковая) | HF | −F | Фторид |
| Хлороводородная (соляная) | HCl | −Cl | Хлорид |
| Бромоводородная | HBr | −Br | Бромид |
| Угольная | h3CO3 | =CO3 | Карбонат |
| Кремниевая | =SiO3 | Силикат | |
| Азотная | HNO3 | −NO3 | Нитрат |
Ортофосфорная (фосфорная) | h4PO4 | ≡PO4 | Ортофосфат (фосфат) |
| Серная | h3SO4 | =SO4 | Сульфат |
| Сернистая | h3SO3 | Сульфит | |
| Сероводородная | h3S | =S | Сульфид |
Представителем органических кислот является уксусная кислота Ch4COOH. Хотя в молекуле этой кислоты — четыре атома водорода, только один из них (входящий в состав группы СООН) может быть замещён металлом. Поэтому кислотный остаток уксусной кислоты является одновалентным.
Хотя в молекуле этой кислоты — четыре атома водорода, только один из них (входящий в состав группы СООН) может быть замещён металлом. Поэтому кислотный остаток уксусной кислоты является одновалентным.
Классификация и характерные химические свойства кислот.
Классификация кислот
Кислоты можно классифицировать исходя из разных критериев:
1) Наличие атомов кислорода в кислоте
| Кислородсодержащие | Бескислородные |
| H3PO4,HNO3,HNO2,H2SO4,H3PO4,H2CO3,H2CO3, HClO4 все органические кислоты (HCOOH, CH3COOH и т.д.) | HF, HCl, HBr, HI, H2S |
2) Основность кислоты
Основностью кислоты называют число «подвижных» атомов водорода в ее молекуле, способных при диссоциации отщепляться от молекулы кислоты в виде катионов водорода H+, а также замещаться на атомы металла:
| одноосновные | двухосновные | трехосновные |
| HBr, HCl, HNO3, HNO2, HCOOH, CH3COOH | H2SO4, H2SO3, H2CO3, H2SiO3 | H3PO4 |
3) Летучесть
Кислоты обладают различной способностью улетучиваться из водных растворов.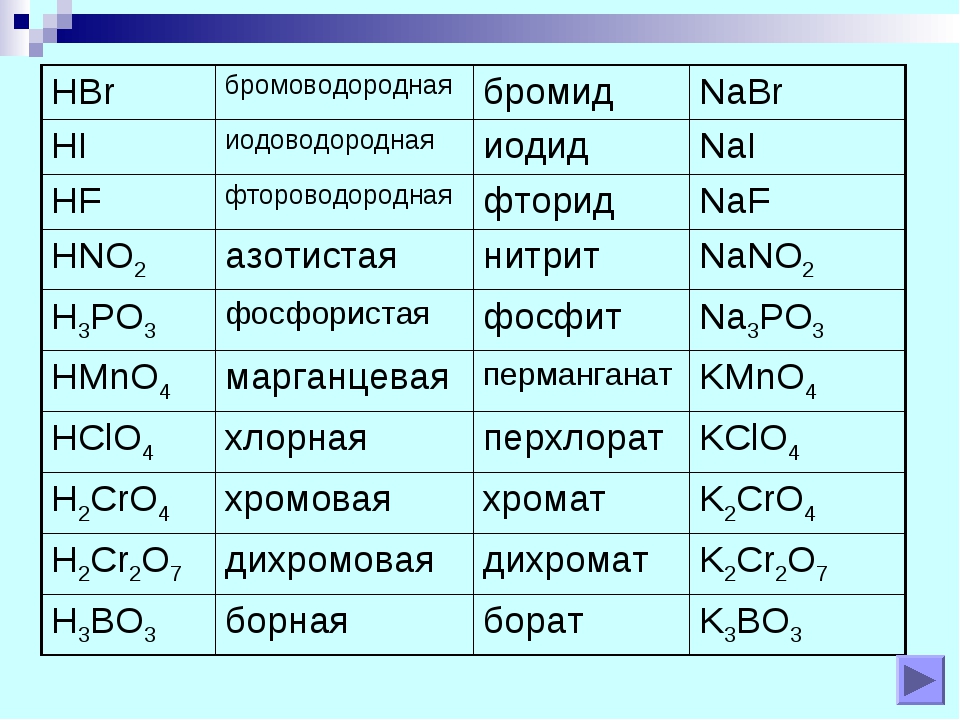
| Летучие | Нелетучие |
H2S, HCl, CH3COOH, HCOOH | H3PO4, H2SO4, высшие карбоновые кислоты |
4) Растворимость
| Растворимые | Нерастворимые |
| HF, HCl, HBr, HI, H2S, H2SO3, H2SO4, HNO3, HNO2, H3PO4, H2CO3, CH3COOH, HCOOH | H2SiO3, высшие карбоновые кислоты |
5) Устойчивость
| Устойчивые | Неустойчивые |
| H2SO4, H3PO4, HCl, HBr, HF | H2CO3, H2SO3 |
6) Способность к диссоциации
хорошо диссоциирующие (сильные) | малодиссоциирующие (слабые) |
H2SO4, HCl, HBr, HI, HNO3, HClO4 | H2CO3, H2SO3, H2SiO3 |
7) Окисляющие свойства
слабые окислители (проявляют окислительные свойства за счет катионов водорода H+) | сильные окислители (проявляют окислительные свойства за счет кислотообразующего элемента) |
практически все кислоты кроме HNO3 и H2SO4 (конц. | HNO3 любой концентрации, H2SO4 (обязательно концентрированная) |
Химические свойства кислот
1. Способность к диссоциации
Кислоты диссоциируют в водных растворах на катионы водорода и кислотные остатки. Как уже было сказано, кислоты делятся на хорошо диссоциирующие (сильные) и малодиссоциирующие (слабые). При записи уравнения диссоциации сильных одноосновных кислот используется либо одна направленная вправо стрелка (), либо знак равенства (=), что показывает фактически необратимость такой диссоциации. Например, уравнение диссоциации сильной соляной кислоты может быть записано двояко:
либо в таком виде: HCl = H+ + Cl—
либо в таком: HCl → H+ + Cl—
По сути направление стрелки говорит нам о том, что обратный процесс объединения катионов водорода с кислотными остатками (ассоциация) у сильных кислот практически не протекает.
В случае, если мы захотим написать уравнение диссоциации слабой одноосновной кислоты, мы должны использовать в уравнении вместо знака две стрелки . Такой знак отражает обратимость диссоциации слабых кислот — в их случае сильно выражен обратный процесс объединения катионов водорода с кислотными остатками:
Такой знак отражает обратимость диссоциации слабых кислот — в их случае сильно выражен обратный процесс объединения катионов водорода с кислотными остатками:
CH3COOH CH3COO— + H+
Многоосновные кислоты диссоциируют ступенчато, т.е. катионы водорода от их молекул отрываются не одновременно, а по очереди. По этой причине диссоциация таких кислот выражается не одним, а несколькими уравнениями, количество которых равно основности кислоты. Например, диссоциация трехосновной фосфорной кислоты протекает в три ступени с поочередным отрывом катионов H+ :
H3PO4 H+ + H2PO4—
H2PO4— H+ + HPO42-
HPO42- H+ + PO43-
Следует отметить, что каждая следующая ступень диссоциации протекает в меньшей степени, чем предыдущая. То есть, молекулы H3PO4 диссоциируют лучше (в большей степени), чем ионы H2PO4— , которые, в свою очередь, диссоциируют лучше, чем ионы HPO42-. Связано такое явление с увеличением заряда кислотных остатков, вследствие чего возрастает прочность связи между ними и положительными ионами H+.
Связано такое явление с увеличением заряда кислотных остатков, вследствие чего возрастает прочность связи между ними и положительными ионами H+.
Из многоосновных кислот исключением является серная кислота. Поскольку данная кислота хорошо диссоциирует по обоим ступеням, допустимо записывать уравнение ее диссоциации в одну стадию:
H2SO4 2H+ + SO42-
2. Взаимодействие кислот с металлами
Седьмым пунктом в классификации кислот мы указали их окислительные свойства. Было указано, что кислоты бывают слабыми окислителями и сильными окислителями. Подавляющее большинство кислот (практически все кроме H2SO4(конц.) и HNO3) являются слабыми окислителями, так как могут проявлять свою окисляющую способность только за счет катионов водорода. Такие кислоты могут окислить из металлов только те, которые находятся в ряду активности левее водорода, при этом в качестве продуктов образуется соль соответствующего металла и водород. Например:
Например:
H2SO4(разб.) + Zn ZnSO4 + H2
2HCl + Fe FeCl2 + H2
Что касается кислот-сильных окислителей, т.е. H2SO4 (конц.) и HNO3, то список металлов, на которые они действуют, намного шире, и в него входят как все металлы до водорода в ряду активности, так и практически все после. То есть концентрированная серная кислота и азотная кислота любой концентрации, например, будут окислять даже такие малоактивные металлы, как медь, ртуть, серебро. Более подробно взаимодействие азотной кислоты и серной концентрированной с металлами, а также некоторыми другими веществами из-за их специфичности будет рассмотрено отдельно в конце данной главы.
3. Взаимодействие кислот с основными и амфотерными оксидами
Кислоты реагируют с основными и амфотерными оксидами. Кремниевая кислота, поскольку является нерастворимой, в реакцию с малоактивными основными оксидами и амфотерными оксидами не вступает:
H2SO4 + ZnO ZnSO4 + H2O
6HNO3 + Fe2O3 2Fe(NO3)3 + 3H2O
H2SiO3 + FeO ≠
4.
 Взаимодействие кислот с основаниями и амфотерными гидроксидами
Взаимодействие кислот с основаниями и амфотерными гидроксидамиHCl + NaOH H2O + NaCl
3H2SO4 + 2Al(OH)3 Al2(SO4)3 + 6H2O
5. Взаимодействие кислот с солями
Данная реакция протекает в случае, если образуется осадок, газ либо существенно более слабая кислота, чем та, которая вступает в реакцию. Например:
H2SO4 + Ba(NO3)2 BaSO4↓ + 2HNO3
CH3COOH + Na2SO3 CH3COONa + SO2↑ + H2O
HCOONa + HCl HCOOH + NaCl
6. Специфические окислительные свойства азотной и концентрированной серной кислот
Как уже было сказано выше, азотная кислота в любой концентрации, а также серная кислота исключительно в концентрированном состоянии являются очень сильными окислителями. В частности, в отличие от остальных кислот они окисляют не только металлы, которые находятся до водорода в ряду активности, но и практически все металлы после него (кроме платины и золота).
Так, например, они способны окислить медь, серебро и ртуть. Следует однако твердо усвоить тот факт, что ряд металлов (Fe, Cr, Al) несмотря на то, что являются довольно активными (находятся до водорода), тем не менее, не реагируют с концентрированной HNO3 и концентрированной H2SO4 без нагревания по причине явления пассивации — на поверхности таких металлов образуется защитная пленка из твердых продуктов окисления, которая не позволяет молекулами концентрированной серной и концентрированной азотной кислот проникать вглубь металла для протекания реакции. Однако, при сильном нагревании реакция все таки протекает.
В случае взаимодействия с металлами обязательными продуктами всегда являются соль соответствующего метала и используемой кислоты, а также вода. Также всегда выделяется третий продукт, формула которого зависит от многих факторов, в частности, таких, как активность металлов, а также концентрация кислот и температура проведения реакций.
Высокая окислительная способность концентрированной серной и концентрированной азотной кислот позволяет им реагировать не только практическим со всеми металлами ряда активности, но даже со многими твердыми неметаллами, в частности, с фосфором, серой, углеродом. Ниже в таблице наглядно представлены продукты взаимодействия серной и азотной кислот с металлами и неметаллами в зависимости от концентрации:
7. Восстановительные свойства бескислородных кислот
Все бескислородные кислоты (кроме HF) могут проявлять восстановительные свойства за счет химического элемента, входящего в состав аниона, при действии различных окислителей. Так, например, все галогеноводородные кислоты (кроме HF) окисляются диоксидом марганца, перманганатом калия, дихроматом калия. При этом галогенид-ионы окисляются до свободных галогенов:
4HCl + MnO2 MnCl2 + Cl2↑ + 2H2O
16HBr + 2KMnO4 2KBr + 2MnBr2 + 8H2O + 5Br2
14НI + K2Cr2O7 3I2↓ + 2Crl3 + 2KI + 7H2O
Среди всех галогеноводородных кислот наибольшей восстановительной активностью обладает иодоводородная кислота. В отличие от других галогеноводородных кислот ее могут окислить даже оксид и соли трехвалентного железа.
В отличие от других галогеноводородных кислот ее могут окислить даже оксид и соли трехвалентного железа.
6HI + Fe2O3 2FeI2 + I2↓ + 3H2O
2HI + 2FeCl3 2FeCl2 + I2↓ + 2HCl
Высокой восстановительной активностью обладает также и сероводородная кислота H2S. Ее может окислить даже такой окислитель, как диоксид серы:
2H2S + SO2 3S↓+ 2H2O
Влияние золедроновой кислоты на частоту костных осложнений у больных с костными метастазами
РАЗ В 3 МЕСЯЦА – НОВЫЙ РЕЖИМ ВВЕДЕНИЯ ЗОЛЕДРОНОВОЙ КИСЛОТЫ У БОЛЬНЫХ С КОСТНЫМИ МЕТАСТАЗАМИ?
03.01.2017 – В течении 2-х лет введение Золедроновой кислоты раз в 3 месяца равноэффективно (=) ежемесячному введению [Andrew L. Himelstein et al. – JAMA, 2017].
26.01.2017 — Поддерживающий режим Золедроновой кислоты 1 раз в 3 месяца равноэффективен (=)
ежемесячному, у больных получающим терапию бисфосфонатами в течении года и более [Gabriel N. Hortobagyi
et al. – JAMA, 2017 ].
Hortobagyi
et al. – JAMA, 2017 ].
ВВЕДЕНИЕ ЗОЛЕДРОНОВОЙ КИСЛОТЫ РАЗ В 3 МЕСЯЦА РАВНОЭФФЕКТИВНО ЕЖЕМЕСЯЧНОМУ ВВЕДЕНИЮ
Влияние золедроновой кислоты на частоту костных осложнений у больных с костными метастазами при стандартном режиме и назначении каждые 12 недель (Andrew L. Himelstein et al. – JAMA, 2017).
В рандомизированное исследование включено 1822 больных метастатическим РМЖ, метастатическим раком предстательной железы и множественной миеломой, из них 795 больных получали Золедроную кислоту в течение 2-х лет и завершили исследование.
Среди 29,5% пациентов, получавших золедроновую кислоту (ЗК) каждые 4 недели, и 28,6% пациентов,
получавших ЗК каждые 12 недель, выявлено, по меньшей мере, одно костное осложнение, что
доказывает отсутствие преимущества более частого назначения ЗК.
Актуальность: Золедроновая кислота относится к 3-му поколению аминобисфосфонатов и предназначена для снижения частоты костных осложнений, в том числе, болевого синдрома. Однако, оптимальный интервал длительного применения однозначно не определен.
Целью исследования являлось выявление преимуществ назначения золедроновой кислоты (ЗК) при введении 1 раз в 12 недель и 1 раз в 4 недели.
Материал и методы:
- Исследование проводилось в 269 клинических центрах США в период с мая 2009 года по апрель 2012 года; наблюдение проводилось до апреля 2014 года.
- Включено 1822 пациента с костными метастазами РМЖ, рака предстательной железы и
множественной миеломой.

- Пациенты были рандомизированы в 2 группы: первой вводили внутривенно ЗК каждые 4 недели (n=911), во второй – 1 раз в 12 недель (n=911).
- Продолжительность терапии ЗК составила 2 года.
- Первичной конечной точкой являлась доля пациентов, по крайней мере, с одним костным осложнением на фоне лечения.
- Межгрупповая разница в 7% определялась как показатель преимущества.
- Вторичные конечные точки — доля пациентов с болевым синдромом, функциональный статус ECOG (диапазон 0-4), частота остеонекроза челюсти, нарушение функции почек, костные осложнения (среднее количество костных осложнений за год), подавление метаболизма костной ткани.
- Среди 1822 пациентов рандомизированных (средний возраст 65 лет) — 980 (53,8%) женщин.

- Через 2 года из 1822 больных (855 больных РМЖ, 689 больных раком простаты и 278 больных с множественной миеломой) — 795 больных завершили исследование.
Результаты:
- По меньшей мере, одно костное осложнение в течении 2-х лет отмечалось у 29,5% (260 пациентов) в группе 12-недельного назначения ЗК и у 28,6% (253 пациентов) в группе 4-недельного назначения ЗК, (р<0,001)
- Частота боли, ухудшение функционального статуса, частота остеонекроза челюсти, нарушение функции почек достоверно не отличались между группами. Прогрессирование в костях также численно не различалось, однако, метаболизм костной ткани был выше у пациентов, получавших ЗК раз в 12 недель.
У больных костными метастазами рака молочной железы, раком предстательной железы и множественной миеломой, применение золедроновой кислоты каждые 12 недель по сравнению со стандартным интервалом в 4 недели в течение 2-х лет не приводило к увеличению риска костных осложнений. По мнению авторов длительность интервала введения золедроновой кислоты в 12 недель может быть приемлемым вариантом лечения.
ПОДДЕРЖИВАЮЩИЙ РЕЖИМ ЗОЛЕДРОНОВОЙ КИСЛОТЫ 1 РАЗ В 3 МЕСЯЦА РАВНОЭФФЕКТИВЕН ЕЖЕМЕСЯЧНОМУ У БОЛЬНЫХ, ПОЛУЧАЮЩИМ ТЕРАПИЮ БИСФОСФОНАТАМИ В ТЕЧЕНИИ ГОДА И БОЛЕЕ
Рандомизированное клиническое исследование OPTIMIZE-2:
«Сравнение эффективности введения Золедроновой кислотой каждые 12 недель или каждые 4 недели у больных с костными метастазами РМЖ, получающим терапию бисфосфонатами в течении года и более» (Gabriel N. Hortobagyi et al. – JAMA, 2017).
- В данном рандомизированном клиническом исследовании, включающим сведения о 416 больных с костными метастазами РМЖ, получающим терапию бисфосфонатами в течении года и более, дальнейшее введение золедроновой кислоты каждые 12 недель не уступало по эффективности ежемесячному введению.
Актуальность: Золедроновая кислота назначается пациентам с костными метастазами для снижения риска осложнений со стороны костной системы. Однако в последнее время возникают опасения по поводу ее длительного назначения, обусловленными вероятностью осложнений терапии бисфосфонатами, включая остеонекроз челюсти.
Целью исследования являлось сравнение эффективности золедроновой кислоты при введении 1 раз в 12 недель и 1 раз в 4 недели у больных метастатическим РМЖ с метастазами в кости, получающих длительную терапию бисфосфонатами.
Материалы и методы:
- OPTIMIZE-2 — проспективное, рандомизированное, двойное слепое, многоцентровое исследование 3 фазы.
- Рандомизация 1: 1 — в первой группе назначалась золедроновая кислота 4,0 мг в/в каждые 4 недели, второй группе — каждые 12 недель с плацебо каждые 4 недели; длительностью 1 год.
- Исследование проводилось в 102 клинических центрах США с 3 марта 2006 года по 25 июля 2013 г.
- Анализ данных проводился с 7 октября 2013 г. по 24 марта 2014 г.
- В исследование было включено 416 женщин (≥18 лет) с костными метастазами РМЖ, которые ранее получали 9 или более доз золедроновой кислоты и / или памидронат в течение первых 10 — 15 месяцев терапии.
- Первичной конечной точкой являлась доля пациентов с одним или более костными осложнениями.
- Вторичными конечными точками — время до первого костного осложнения или прогрессирование в костях.
Результаты:
- Рандомизировано в общей сложности 416 женщин: 200 больных получали золедроновую кислоту каждые 4 недели (средний возраст 59,2 лет; 173 [86,5%] — европеидной расы), 203 пациента — каждые 12 недель (средний возраст 58.6 лет; 178 [87,7%]- европеидной расы), и 13 пациентов получали плацебо (средний возраст 60,8 лет; 13 [100%]- европеоидной расы). Исходные характеристики обеих групп были сопоставимыми.
- Через год наблюдения, костные осложнения произошли у 44 пациентов (22,0%) в первой группе и у 47 пациентов (23,2%) во второй.
- Время до первого нежелательного явления, связанного с метастазами в костях, статистически не отличалось между обеими группами (отношение рисков [ОР] 1,06; 95%ДИ 0.70-1.60; р=0,79).
- Среднее значение прогрессирования в костях составило 0,46 (1,06) в первой группе и 0,50 (1,50) случаев в год во второй (р=0,85).
- Профиль токсичности также был сопоставим, у 189 пациентов (95,5%) в первой группе отмечалась та или иная токсичность, и у 189 (93,5%) больных – во второй.
По мнению авторов ведение золедроновой кислоты в поддерживающем режиме 1 раз в 12 недель не уступает в эффективности и безопасности по сравнению с введением 1 раза в 4 недели у больных метастатическим РМЖ, получавших длительную терапию бисфосфонатами.
Источники:
- Andrew L. Himelstein et al. Effect of Longer-Interval vs Standard Dosing of Zoledronic Acid on Skeletal Events in Patients With Bone Metastases. JAMA. 2017;317(1):48-58.
- http://jamanetwork.com/journals/jama/article-abstract/2595526
- Gabriel N. Hortobagyi et al. Continued Treatment Effect of Zoledronic Acid Dosing Every 12 vs 4 Weeks in Women With Breast Cancer Metastatic to Bone. JAMA Oncol. Published online January 26, 2017.
- http://jamanetwork.com/journals/jamaoncology/article-abstract/2598744
Материал подготовила: Латипова Дилором Хамидовна, врач-онколог, к.м.н., научный сотрудник Научного отдела инновационных методов терапевтической онкологии и реабилитации.
Свойства кислот, получение кислот
Свойства кислот
Кислоты — это сложные химические вещества, которые содержат атомы водорода, способные замещаться на атомы металлов и образовывать соли.
Кислоты различаются по основности: Основность определяется количеством атомов водорода, входящим в их состав. Например, серная — H2SO4 — двухосновная, так как в её состав входит 2 атома водорода.
Кислоты разделяют также на кислородосодержащие и не содержащие кислород. Например, соляная — HCl — не содержит атомов кислорода, а H2СO3 — угольная — содержит 3 атома кислорода и является кислородосодержащей.
Теперь разберём подробнее свойства кислот и их химическое взаимодействие c простыми и сложными веществами.
Основные химические свойства кислот:
— взаимодействие с металлами:
H2SO4 +Zn → ZnSO4 + H2 — Образуется соль и выделяется водород
В зависимости от концентрации самой кислоты получаются различные продукты химической реакции. Например,
2H2SO4 + Cu → CuSO4 + SO2 +2H2O — в этом случае серная кислота — концентрированная. Разбавленная — на медь (Cu) никак не действует.
— взаимодействие с основными оксидами и амфотерными оксидами:
CuO + H2SO4 → CuSO4 + H2O — образуется соль и вода;
SnO + HCl → SnCl2 + H2O (оксид олова — SnO — амфотерный оксид)
— взаимодействие с основаниями и щелочами:
HCl + KOH → KCl + H2O — эту реакцию ещё называют реакцией нейтрализации — образуется соль и вода;
Cu(OH)2 + 2HCl → CuCl2 + 2H2O
— взаимодействие с солью:
При химических реакциях кислот с солью обязательно надо учитывать основные признаки химических реакций, а именно, химическая реакция пройдёт, если будет выделяться газ, выпадет осадок, и т.д.
N2CO3 + 2HCl → 2NaCl + CO2 + H2O — выделяется углекислый газ CO2. Конечно, если говорить точно, то образуется слабая угольная кислота (H2CO3), которая сразу же распадается на углекислый газ и воду. При этих реакциях образуется соль и другая кислота (более слабая, чем та, которая вступала в реакцию).
Теперь рассмотрим основным способы получения кислот
Получение кислот
Получение кислот производят с помощью следующих химических реакций:
— при взаимодействии кислотных оксидов с водой:
SO3 + H2O → H2SO4;
CO2 + H2O → H2CO3;
— при взаимодействии кислоты с солью:
NaCl + H2SO4(конц.) → HCl + Na2SO4 — при этой химической реакции образуется новая более слабая кислота (более слабая, чем серная, но тоже сильная) и другая соль;
— при взаимодействии неметаллов с водородом с последующим растворением их в воде:
H2 + Cl2 → HCl (Надо помнить, что само по себе данное химическое соединение — газ хлороводород HCl кислотой не является. Для её образования необходимо полученный газ HCl растворить в воде). Аналогичным образом поступают с газом сероводородом:
H2 + S → H2S;
— при окислении некоторых простых веществ:
P + 5HNO3 +2H2O → 3H3PO4 + 5NO (в этой химической реакции происходит окисление фосфора (P) азотной кислотой (HNO3) до ортофосфорной кислоты (H3PO4) с выделением оксида азота (NO)
Кислоты и основания — Электронный учебник K-tree
После прочтения статьи Вы сможете разделять вещества на соли, кислоты и основания. В статье описано, что такое pH раствора, какими общими свойствами обладают кислоты и основания.
Простым языком, кислота — это всё что с H, а основание — c OH. НО! Не всегда. Что бы отличать кислоту от основания необходимо… запомнить их! Сожалею. Что бы хоть как то облегчить жизнь, три наших друга, Аррениус и Бренстед с Лоури, придумали две теории, которые зовутся их именем.
Как металлы и неметаллы, кислоты и основания — это разделение веществ по схожим свойствам. Первая теория кислот и оснований принадлежала швецкому учёному Аррениусу. Кислота по Аррениусу — это класс веществ, которые в реакции с водой диссоциируют (распадаются), образовывая катион водорода H+. Основания Аррениуса в водном растворе образуют анионы OH—. Следующая теория в 1923 году была предложена учёными Бренстедом и Лоури. Теория Бренстеда-Лоури определяет кислотами вещества, способные в реакции отдавать протон (протоном в реакциях называют катион водорода). Основания, соответственно, — это вещества, способные принять протон в реакции. Актуальная на данный момент теория — теория Льюиса. Теория Льюиса определяет кислоты как молекулы или ионы, способные принимать электронные пары, тем самым формируя аддукты Льюиса (аддукт — это соединение, образующееся соединением двух реагентов без образования побочных продуктов).
В неорганической химии, как правило, под кислотой имеют ввиду кислоту Бренстеда-Лоури, то есть вещества, способные отдать протон. Если имеют ввиду определение кислоты по Льюису, то в тексте такую кислоту называют кислотой Льюиса. Данные правила справедливы для кислот и оснований.
Диссоциация
Диссоциация – это процесс распада вещества на ионы в растворах или расплавах. Например, диссоциация соляной кислоты — это распад HCl на H+ и Cl—.
Свойства кислот и оснований
Кислоты, содержащие водород, в водном растворе выделяют катионы водорода. Основания, содержащие гидроксид-ион, в водном растворе выделяют анион OH—.
Основания, как правило, мыльные на ощупь, кислоты, в большинстве своём, имеют кислый вкус.
При реакции основания со многими катионами формируется осадок. При реакции кислоты с анионами, как правило, выделяется газ.
Часто используемые кислоты:
H2O, H3O+, CH3CO2H, H2SO4, HSO4−, HCl, CH3OH, NH3
Часто используемые основания:
OH−, H2O, CH3CO2−, HSO4−, SO42−, Cl−
Сильные и слабые кислоты и основания
Сильные кислоты
Такие кислоты, которые полностью диссоциируют в воде, производя катионы водорода H+ и анионы. Пример сильной кислоты — соляная кислота HCl:
HCl(р-р) + H2O(ж) → H3O+(р-р) + Cl—(р-р)
Примеры сильных кислот: HCl, HBr, HF, HNO3, H2SO4, HClO4
Список сильных кислот
- HCl — соляная кислота
- HBr — бромоводород
- HI — йодоводород
- HNO3 — азотная кислота
- HClO4 — хлорная кислота
- H2SO4 — серная кислота
Слабые кислоты
Растворяются в воде только частично, например, HF:
HF(р-р) + h3O(ж) → h4O+(р-р) + F—(р-р) — в такой реакции более 90% кислоты не диссоциирует:
[H3O+]=[F—] < 0,01M для вещества 0,1М
Сильную и слабую кислоту можно различить измеряя проводимость растворов: проводимость зависит от количества ионов, чем сильнее кислота тем она более диссоциирована, поэтому чем сильнее кислота тем выше проводимость.
Список слабых кислот
- HF фтороводородная
- H3PO4 фосфорная
- H2SO3 сернистая
- H2S сероводородная
- H2CO3 угольная
- H2SiO3 кремниевая
Сильные основания
Сильные основания полностью диссоциируют в воде:
NaOH(р-р) + H2O ↔ NH4
К сильным основаниям относятся гидроксиды металлов первой (алкалины, щелочные металы) и второй (алкалинотеррены, щёлочноземельные металлы) группы.
Список сильных оснований
- NaOH гидроксид натрия (едкий натр)
- KOH гидроксид калия (едкое кали)
- LiOH гидроксид лития
- Ba(OH)2 гидроксид бария
- Ca(OH)2 гидроксид кальция (гашеная известь)
Слабые основания
В обратимой реакции в присутствии воды образует ионы OH—:
NH3 (р-р) + H2O ↔ NH+4 (р-р) + OH—(р-р)
Большинство слабых оснований — это анионы:
F—(р-р) + H2O ↔ HF(р-р) + OH—(р-р)
Список слабых оснований
- Mg(OH)2 гидроксид магния
- Fe(OH)2 гидроксид железа (II)
- Zn(OH)2 гидроксид цинка
- NH4OH гидроксид аммония
- Fe(OH)3 гидроксид железа (III)
Реакции кислот и оснований
Сильная кислота и сильное основание
Такая реакция называется нейтрализацией: при количестве реагентов достаточном для полной диссоциации кислоты и основания, результирующий раствор будет нейтральным.
Пример:
H3O+ + OH— ↔ 2H2O
Слабое основание и слабая кислота
Общий вид реакции:
Слабое основание(р-р) + H2O ↔ Слабая кислота(р-р) + OH—(р-р)
Сильное основание и слабая кислота
Основание полностью диссоциирует, кислота диссоциирует частично, результирующий раствор имеет слабые свойства основания:
HX(р-р) + OH—(р-р) ↔ H2O + X—(р-р)
Сильная кислота и слабое основание
Кислота полностью диссоциирует, основание диссоциирует не полностью:
NH3 (р-р) + H+ ↔ NH4
Диссоциация воды
Диссоциация — это распад вещества на составляющие молекулы. Свойства кислоты или основания зависят от равновесия, которое присутствует в воде:
H2O + H2O ↔ H3O+(р-р) + OH—(р-р)
Kc = [H3O+][OH—]/[H2O]2
Константа равновесия воды при t=25°: Kc = 1.83⋅10-6, также имеет место следующее равенство: [H3O+][OH—] = 10-14, что называется константой диссоциации воды. Для чистой воды [H3O+] = [OH—] = 10-7, откуда -lg[H3O] = 7.0.
Данная величина (-lg[h3O]) называется pH — потенциал водорода. Если pH < 7, то вещество имеет кислотные свойства, если pH > 7, то вещество имеет основные свойства.
Способы определения pH
Инструментальный метод
Специальный прибор pH-метр — устройство, трансформирующее концентрацию протонов в растворе в электрический сигнал.
Индикаторы
Вещество, которое изменяет цвет в некотором интервале значений pH в зависимости от кислотности раствора, используя несколько индикаторов можно добиться достаточно точного результата.
Соль
Соль — это ионное соединение образованное катионом отличным от H+ и анионом отличным от O2-. В слабом водном растворе соли полностью диссоциируют.
Что бы определить кислотно-щелочные свойства раствора соли, необходимо определить, какие ионы присутствуют в растворе и рассмотреть их свойства: нейтральные ионы, образованные из сильных кислот и оснований не влияют на pH: не отдают ионы ни H+, ни OH— в воде. Например, Cl—, NO—3, SO2-4, Li+, Na+, K+.
Анионы, образованные из слабых кислот, проявляют щелочные свойства (F—, CH3COO—, CO2-3), катионов с щелочными свойствами не существует.
Все катионы кроме металлов первой и второй группы имеют кислотные свойства.
Буфферный раствор
Растворы, которые сохраняют уровень pH при добавлении небольшого количества сильной кислоты или сильного основания, в основном состоят из:
- Смесь слабой кислоты, соответствующей соли и слабого основания
- Слабое основание, соответствующая соль и сильная кислота
Для подготовки буфферного раствора определённой кислотности необходимо смешать слабую кислоту или основание с соответствующей солью, при этом необходимо учесть:
- Интервал pH в котором буфферный раствор будет эффективен
- Ёмкость раствора — количество сильной кислоты или сильного основания, которые можно добавить не повлияв на pH раствора
- Не должно происходить нежелаемых реакций, которые могут изменить состав раствор
Тест:
Что такое кислота в химии? — Определение и обзор — Видео и стенограмма урока
Как работают кислоты
Шкала pH — это шкала, которая используется для представления уровня кислотности в растворе. Раствор с pH 7 является нейтральным, раствор с pH ниже 7 является кислотой, а раствор с pH выше 7 является основанием. Кислота диссоциирует или распадается и отдает протоны или ионы водорода в водном растворе, в то время как основание отдает ионы гидроксида в растворе.Вода, например, нейтральна с pH 7. Когда добавляются кислоты, они выделяют больше ионов водорода в раствор, и это вызывает падение pH раствора. Повторяю: больше ионов водорода равняется более низкому pH и более кислому раствору.
Слабые и сильные кислоты
Все кислоты выделяют ионы водорода в растворы. Количество ионов, которые высвобождаются из расчета на одну молекулу, определяет, является ли кислота слабой или сильной. Слабые кислоты — это кислоты, которые частично высвобождают присоединенные атомы водорода. Эти кислоты, таким образом, могут понижать pH за счет диссоциации ионов водорода, но не полностью. Слабые кислоты включают уксусную кислоту , которая представляет собой уксус, и лимонную кислоту , содержащуюся в апельсинах и лимонах.
Сильные кислоты , с другой стороны, полностью диссоциируют и высвобождают ВСЕ свои атомы водорода. Это означает, что сильные кислоты, как правило, более эффективно снижают pH раствора.Есть только 7 сильных кислот, включая соляную кислоту , которую можно найти в желудке, и серную кислоту , коррозионную кислоту, содержащуюся в таких вещах, как автомобильные аккумуляторы и удобрения.
Многие молекулы могут действовать как кислоты, даже если они в основном не используются как кислоты. Например, аденозинтрифосфат , или АТФ, представляет собой молекулу, используемую в организме для получения энергии. Но при добавлении в раствор АТФ также выделяет ионы водорода, что означает, что он также может считаться кислотой.Точно так же аминокислот , которые являются строительными блоками белков, также выделяют небольшое количество ионов водорода в водные растворы.
Кислоты и человеческое тело
Один из самых интересных способов взглянуть на кислоты — это их использование в организме человека. Многие процессы, происходящие в организме, требуют кислоты для их поддержания. Примеры включают:
- Соляная кислота , которая вырабатывается в желудке для улучшения пищеварения.
- Жирные кислоты , которые высвобождаются, когда организм расщепляет жиры для получения энергии.
- Аминокислоты , которые используются для производства белков в организме.
- Нуклеиновые кислоты , которые отвечают за нашу генетическую структуру.
Другие общие характеристики кислот
Существуют и другие распространенные способы, которыми характеристики кислот проявляются в повседневной жизни и в химии. Например:
1) Они меняют синюю лакмусовую бумагу на красную
2) Они имеют кислый привкус в водных растворах
3) Они могут образовывать соли в результате реакций с некоторыми металлами и основаниями
Краткое содержание урока
Кислоты являются химическими агентами которые выделяют ионы водорода при добавлении в воду.Шкала pH используется для отображения уровня кислотности данного раствора. При использовании шкалы pH большее количество ионов водорода соответствует более низкому pH и более кислому раствору. Кислоты можно разделить на слабые и сильные, в зависимости от количества ионов водорода, которые диссоциируют при помещении кислоты в воду. Уксусная кислота является примером слабой кислоты, а соляная кислота , которая содержится в желудке, классифицируется как сильная кислота.
Кислоты также играют важную роль в организме человека, например, в построении белков, которые состоят из аминокислот .Кислоты являются ключевой характеристикой практически всех растворов. Это включает в себя кислые на вкус растворы, использование лакмусовой бумаги для проверки кислотности и кислотные реакции, которые приводят к образованию солей.
Определения кислот и оснований и роль воды
Определения
кислот и оснований
и роль воды
Свойства кислот и Основания согласно Boyle
В 1661 году Роберт Бойль резюмировал свойства кислот следующим образом: следует.
1. Кислоты имеют кислый вкус.
2. Кислоты едкие.
3. Кислоты изменяют цвет некоторых растительных красителей, например лакмус, от синего до красного.
4. Кислоты теряют кислотность при сочетании с щелочи.
Название «кислота» происходит от латинского acidus , что означает «кислый» и относится к резкому запаху и кисловатый вкус многих кислот.
Примеры: уксус кислый на вкус, потому что это разбавленный раствор. уксусной кислоты в воде.Лимонный сок кислый на вкус, потому что он содержит лимонную кислоту. Молоко скисает, когда портится, потому что образуется молочная кислота, и неприятный кисловатый запах гнилого мясо или масло можно отнести к таким соединениям, как масляная кислоты, образующиеся при порче жира.
В 1661 году Бойль резюмировал свойства щелочей следующим образом: следует.
- Щелочи кажутся скользкими.
- Щелочи меняют цвет лакмусовой бумажки с красного на синий.
- Щелочи становятся менее щелочными при сочетании с кислоты.
По сути, Бойль определил щелочи как вещества, которые потребляют, или нейтрализовать кислоты. Кислоты теряют свойственный кислый вкус и способность растворять металлы при их смешивании со щелочами. Щелочи даже обращают вспять изменение цвета, которое происходит, когда лакмусовая контактирует с кислотой. Со временем стали известны щелочи. как базы , потому что они служат «базой» для делая определенные соли.
Аррениус Определение кислот и оснований
В 1884 году Сванте Аррениус предположил, что соли, такие как NaCl диссоциируют, когда они растворяются в воде, давая частицы, которые он называется ионов .
| H 2 O | ||
| NaCl ( с ) | Na + ( водн. ) + Cl — ( водн. ) |
Три года спустя Аррениус расширил эту теорию, предложив что кислоты — нейтральные соединения, которые ионизируют , когда они растворяются в воде с образованием ионов H + и соответствующего отрицательный ион.Согласно его теории, хлористый водород — это кислоты, потому что она ионизируется, когда растворяется в воде, чтобы дать ионы водорода (H + ) и хлорида (Cl —) в виде показано на рисунке ниже.
| H 2 O | ||
| HCl ( г ) | H + ( водн. ) + Cl — ( водн. ) |
Аррениус утверждал, что основания — это нейтральные соединения, которые либо диссоциируют или ионизируют в воде с образованием ионов OH — и положительный ион.NaOH является основанием Аррениуса, потому что он диссоциирует в вода с образованием гидроксида (OH —) и натрия (Na + ) ионы.
| H 2 O | ||
| NaOH ( с ) | Na + ( водн. ) + OH — ( водн. ) |
Аррениусовая кислота — это любое вещество, которое ионизируется при растворении в воде с образованием H + , или водород, ион.
Основание Аррениуса — это любое вещество, которое дает ОН —, или гидроксид, ион, когда он растворяется в воде.
Кислоты Аррениуса включают такие соединения, как HCl, HCN и H 2 SO 4 которые ионизируются в воде с образованием иона H + . Аррениус основания включают ионные соединения, которые содержат OH — ион, такой как NaOH, KOH и Ca (OH) 2 .
Эта теория объясняет, почему кислоты обладают схожими свойствами: характерные свойства кислот возникают из-за присутствия ион H + , образующийся при растворении кислоты в воде.Это также объясняет, почему кислоты нейтрализуют основания и наоборот. Кислоты предоставить ион H + ; базы обеспечивают ОН — ион; и эти ионы объединяются, образуя воду.
H + ( водн. ) + OH — ( водн. ) H 2 O ( л )
Теория Аррениуса имеет несколько недостатков.
- Может применяться только к реакциям, протекающим в воде. потому что он определяет кислоты и основания с точки зрения того, что происходит, когда соединения растворяются в воде.
- Это не объясняет, почему некоторые соединения, в которых водород имеет степень окисления +1 (например, HCl) растворяется в вода для получения кислых растворов, тогда как другие (например, CH 4 ) нет.
- Только соединения, содержащие ион OH — можно отнести к базам Аррениуса. Аррениус теория не может объяснить, почему другие соединения (например, Na 2 CO 3 ) обладают характерными свойствами оснований.
Роль H + и OH — Ионы в химии водных растворов
КислородBecuase ( EN = 3,44) гораздо более электроотрицателен чем водород ( EN = 2,20), электроны в HO связи в воде не разделяются поровну между водородом и кислородом. атомы.Эти электроны притягиваются к атому кислорода в центре молекулы и вдали от атомов водорода на любом конец. В результате молекула воды полярная . Кислород атом несет частичный отрицательный заряд (-), а атомы водорода несут частичный положительный заряд (+).
Когда они диссоциируют с образованием ионов, молекулы воды образуют положительно заряженный ион H + и отрицательно заряженный OH — ион .
Возможна и обратная реакция. Ионы H + могут объединяться с ионами OH — с образованием нейтральные молекулы воды.
Тот факт, что молекулы воды диссоциируют с образованием H + и ионы OH — , которые затем могут рекомбинировать с образованием воды молекул, указывается следующим уравнением.
До какой степени Вода диссоциирует с образованием ионов?
При 25 ° C плотность воды составляет 0,9971 г / см 3 , или 0,9971 г / мл. Следовательно, концентрация воды составляет 55,35 моль.
Концентрация ионов H + и OH — образованных диссоциацией нейтральных молекул H 2 O при эта температура всего 1.0 x 10 -7 моль / л. Соотношение концентрации иона H + (или OH — ) концентрации нейтральных молекул H 2 O составляет поэтому 1,8 x 10 -9 .
Другими словами, только около 2 частей на миллиард (ppb) молекулы воды диссоциируют на ионы при комнатной температуре. В На рисунке ниже показана модель из 20 молекул воды, одна из которых диссоциировал с образованием пары H + и OH — ионы.Если бы эта иллюстрация была фотографией с очень высоким разрешением структуры воды мы бы встретили пару H + и OH — ионов в среднем только один раз на каждые 25 миллион таких фотографий.
Операционный Определение кислот и оснований
Тот факт, что вода диссоциирует с образованием H + и OH — ионов в обратимой реакции является основой для оперативного определение кислот и оснований, более мощное, чем определения, предложенные Аррениусом.В оперативном смысле кислота любое вещество, повышающее концентрацию H + ион при растворении в воде. A base — любое вещество что увеличивает концентрацию иона OH — при растворяется в воде.
Эти определения связывают теорию кислот и оснований с простой лабораторный тест на кислоты и щелочи. Чтобы решить, будет ли соединение представляет собой кислоту или основание, мы растворяем его в воде и тестируем решение, чтобы узнать, является ли H + или OH — концентрация ионов увеличилась.
Типичные кислоты и Основания
Свойства кислот и оснований являются результатом различий между химией металлов и неметаллов, как видно из химии этих классов соединений: водород, оксиды и гидроксиды.
Соединения, содержащие водород, связанный с неметаллом, называются гидриды неметаллов . Поскольку они содержат водород в +1 степень окисления, эти соединения могут действовать как источник H + ион в воде.
Гидриды металлов , с другой стороны, содержат водород привязан к металлу. Поскольку эти соединения содержат водород в -1 степень окисления, они диссоциируют в воде с образованием H — (или гидридный) ион.
Ион H — с его парой валентных электронов может абстрагировать ион H + из молекулы воды.
Поскольку удаление ионов H + из молекул воды является одним способ увеличения концентрации ионов OH — в раствор, гидриды металлов являются основаниями.
Аналогичный образец можно найти в химии оксидов. образованный металлами и неметаллами. Оксиды неметаллов растворяются в воде с образованием кислот. CO 2 растворяется в воде с образованием угольная кислота, SO 3 дает серную кислоту, а P 4 O 10 реагирует с водой с образованием фосфорной кислоты.
Оксиды металлов , напротив, являются основаниями.Металл оксиды формально содержат ион O 2-, который реагирует с вода с образованием пары ионов OH — .
Таким образом, оксиды металлов соответствуют рабочему определению база.
Мы видим ту же закономерность в химии соединений, которые содержат ОН, или гидроксид, группа. Гидроксиды металлов , такие как LiOH, NaOH, KOH и Ca (OH) 2 , являются основаниями.
Гидроксиды неметаллов , такие как хлорноватистая кислота (HOCl), кислоты.
В таблице ниже обобщены тенденции, наблюдаемые в этих трех категории соединений. Гидриды металлов, оксиды металлов и металл гидроксиды — основания. Гидриды неметаллов, оксиды неметаллов и гидроксиды неметаллов — кислоты.
Типичные кислоты и основания
| Кислоты | Основания |
| Гидриды неметаллов HF, HCl, HBr, HCN, HSCN, H 2 S | Гидриды металлов HI, LiH, NaH, KH, MgH 2 , CaH 2 |
| Неметаллические оксиды CO 2 , SO 2 , SO 3 , НЕТ 2 , П 4 O 10 | Оксиды металлов Li 2 O, Na 2 O, K 2 O, MgO, CaO |
| Гидроксиды неметаллов HOCl, HONO 2 , O 2 S (OH) 2 , OP (OH) 3 | Гидроксиды металлов LiOH, NaOH, KOH, Ca (OH) 2 , Ba (OH) 2 |
Кислые атомы водорода в гидроксидах неметаллов в таблице выше не связаны с азотом, серой или атомы фосфора.В каждом из этих соединений кислый водород присоединен к атому кислорода. Таким образом, все эти соединения примеры оксикислот.
Структуры скелета для восьми оксикислот приведены на рисунке. ниже. Как правило, кислоты, содержащие кислород, имеют скелет. структуры, в которых кислые водороды присоединены к кислороду атомы.
Почему металл Гидроксидные основы и неметаллические гидроксиды кислоты?
Чтобы понять, почему гидроксиды неметаллов являются кислотами и металлами гидроксиды являются основаниями, мы должны смотреть на электроотрицательность атомов в этих соединениях.Начнем с типичного металла гидроксид: гидроксид натрия
Разница между электроотрицательностями натрия и кислород очень большой ( EN = 2,5). В результате электроны в NaO облигации не делятся поровну электроны тянутся к более электроотрицательному атому кислорода. Таким образом, NaOH диссоциирует с образованием Na + и OH —. ионы при растворении в воде.
Мы получаем совсем другой узор, когда применяем тот же процедура для хлорноватистой кислоты, HOCl, типичного неметалла гидроксид.
Здесь разница электроотрицательностей атомы хлора и кислорода малы ( EN = 0,28). В результате электроны в ClO связь распределяется между двумя атомами более или менее поровну. ОН связь, с другой стороны, является полярной ( EN = 1,24) электроны в этой связи тянутся к более электроотрицательным атом кислорода. Когда эта молекула ионизируется, электроны в OH связь остается с атомом кислорода, а OCl — и H + образуются ионы.
Нет резкого перехода от металла к неметаллу в ряду или вниз по столбцу периодической таблицы. Поэтому мы должны ожидайте найти соединения, которые лежат между крайностями металла и оксиды неметаллов, или гидроксиды металлов и неметаллов. Эти соединения, такие как Al 2 O 3 и Al (OH) 3 , называются амфотерными (буквально «либо, либо оба «), потому что они могут действовать как кислоты или основания.Al (OH) 3 , например, действует как кислота, когда реагирует с основанием.
И наоборот, он действует как основание, когда реагирует с кислотой.
Br nsted Определение кислот и оснований
Модель Брнстеда или Брнстеда-Лоури основана на простом предположение: Кислоты отдают ионы H + другой ион или молекула, которая действует как основание .В диссоциация воды, например, включает перенос H + ион от одной молекулы воды к другой с образованием H 3 O + и OH — ионов.
Согласно этой модели, HCl не диссоциирует в воде до образуют ионы H + и Cl + . Вместо этого H + ион передается от HCl к молекуле воды с образованием H 3 O + и ионов Cl — , как показано на рисунке ниже.
Поскольку это протон, ион H + составляет несколько порядков величины меньше самого маленького атома. В результате заряд изолированного иона H + распределяется по такому небольшое пространство, которое привлекает этот ион H + к любому источнику отрицательного заряда, который существует в растворе. Таким образом, момент образования иона H + в водный раствор, он связывается с молекулой воды.Брнстед модель, в которой ионы H + переносятся от одного иона или молекулы к другому, поэтому имеет больше смысла, чем Теория Аррениуса, которая предполагает, что ионы H + существуют в водный раствор.
Даже модель Брнстеда наивна. Каждый ион H + , который Кислота, отданная воде, на самом деле связана с четырьмя соседними молекулы воды, как показано на рисунке ниже.
Более реалистичная формула вещества, производимого при кислота теряет ион H + , следовательно, H (H 2 O) 4 + , или H 9 O 4 + .Для всех практических однако это вещество может быть представлено как H 3 O + ион.
Реакция между HCl и водой является основой для понимание определений кислоты Бренстеда и кислоты Бренстеда база. Согласно этой теории ион H + является передается от молекулы HCl к молекуле воды, когда HCl диссоциирует в воде.
HCl действует как донор ионов H + в этой реакции, а H 2 O действует как акцептор ионов H + .Кислота Бренстеда является поэтому любое вещество (например, HCl), которое может отдавать H + ион к основанию. Основание Брнстеда — это любое вещество (например, H 2 O), который может принимать ион H + из кислота.
Ион H + можно назвать двумя способами. Некоторый химики называют это ионом водорода; другие называют это протоном. Как В результате кислоты Бренстеда известны как ионно-водородные доноров или доноров протонов .Основания Бренстеда водород-ионные. акцепторы или акцепторы протонов .
С точки зрения модели Брнстеда, реакции между кислоты и основания всегда подразумевают перенос H + ион от донора протона до акцептора протона. Кислоты могут быть нейтральные молекулы.
Они также могут быть положительными ионами
или отрицательные ионы.
Таким образом, теория Брнстеда расширяет число потенциальных кислоты.Это также позволяет нам решить, какие соединения являются кислотами из их химические формулы. Любое соединение, содержащее водород с степень окисления +1 может быть кислотой. Кислоты Бренстеда включают HCl, H 2 S, H 2 CO 3 , H 2 PtF 6 , NH 4 + , HSO 4 — и HMnO 4 .
базы Брнстеда могут быть идентифицированы по их структурам Льюиса. Согласно модели Брнстеда, основанием является любой ион или молекула который может принимать протон.Чтобы понять последствия этого определения, посмотрите, как прототипная база, OH — ион, принимает протон.
Единственный способ принять ион H + — это сформировать ковалентная связь с ним. Для образования ковалентной связи с H + иона, не имеющего валентных электронов, база должна обеспечивать оба электроны, необходимые для образования связи.Таким образом, только соединения, которые имеют пары несвязывающих валентных электронов, могут действовать как H + -ион акцепторы, или базы Бренстеда.
Следующие ниже соединения, например, могут действовать как Brnsted оснований, потому что все они содержат несвязывающие пары электронов.
Модель Брнстеда расширяет список потенциальных баз до включают любой ион или молекулу, которая содержит одну или несколько пар несвязывающие валентные электроны.Брнстедское определение базы применимо к такому количеству ионов и молекул, что почти легче подсчитывать вещества, такие как следующие, которые нельзя Бренстед основания, потому что у них нет пар несвязывающей валентности электроны.
Роль воды в Теория Брнстеда
Теория Брнстеда объясняет роль воды в кислотно-щелочном реакции.
- Вода диссоциирует с образованием ионов путем передачи H + ион от одной молекулы, действующий как кислота к другой молекула, выступающая в качестве основы.
| H 2 O ( л ) | + | H 2 O ( л ) | H 3 O + ( водн. ) | + OH — ( водн. ) | |
| кислота | база |
- Кислоты реагируют с водой, отдавая ион H + к нейтральной молекуле воды с образованием H 3 O + ион.
| HCl ( г ) | + | H 2 O ( л ) | H 3 O + ( водн. ) | + Cl — ( водн. ) | ||
| кислота | база |
- Основания реагируют с водой, принимая ион H + из молекулы воды с образованием иона OH — .
| NH 3 ( водн. ) | + | H 2 O ( л ) | NH 4 + ( водн. ) | + OH — ( водн. ) | |
| основание | кислота |
- Молекулы воды могут действовать как промежуточные соединения в кислотно-основных реакции с получением ионов H + из кислоты
| HCl ( г ) | + | H 2 O ( л ) | H 3 O + ( водн. ) | + Cl — ( водн. ) |
, а затем теряет эти ионы H + на основание.
| NH 3 ( водн. ) | + | H 3 O + ( водн. ) | NH 4 + ( водн. ) | + H 2 O ( л ) |
Модель Брнстеда может быть расширена на кислотно-основные реакции в другие растворители.Например, в жидкости наблюдается небольшая тенденция аммиак для переноса иона H + из одного NH 3 молекулы к другой с образованием NH 4 + и NH 2 — ионы.
| 2 NH 3 | NH 4 + | + NH 2 — |
По аналогии с химией водных растворов делаем вывод что кислоты в жидком аммиаке включают любой источник NH 4 + ион и эти основания включают любой источник NH 2 — ион.
Модель Брнстеда может быть расширена даже на реакции, которые не встречаются в растворе. Классический пример газовой фазы кислотно-щелочная реакция встречается, когда открытые емкости с концентрированная соляная кислота и водный раствор аммиака друг другу. Вскоре образуется белое облако хлорида аммония, газообразный HCl, выходящий из одного раствора, вступает в реакцию с NH 3 газ от другого.
| HCl ( г ) | + NH 3 ( г ) | NH 4 Cl ( s ) |
Эта реакция включает перенос иона H + от HCl до NH 3 и, следовательно, является кислотно-основным реакция, даже если она происходит в газовой фазе.
Кислоты и Основания
Определение Бронстеда-Лоури (1923) — Определение кислот и оснований с участием ионов водорода и гидроксида соответственно слишком ограничивает. Более широкое определение было предложено Бронстедом. и Лоури в 1923 году. Главный эффект определения — увеличение количество веществ, выступающих в роли оснований.
| Кислота | База | |
| Отдает ионы водорода | Принимает ионы водорода. | |
| HCl + | HOH —> | H 3 O + + Класс — |
| HOH + | NH 3 —> | NH 4 + + OH — |
Определение вещества как кислоты Бренстеда-Лоури или основание можно сделать только наблюдая за реакцией.В случае HOH это основание в первом случае и кислота в второй случай.
Ссылка на звонок анимация переноса иона аммония в воду — Джереми Харви, Бристольский университет, Англия
См. Пример на рисунке слева:
Чтобы определить, является ли вещество кислотой или основанием, посчитайте водороды в каждом веществе до и после реакции.Если количество атомов водорода уменьшилось, это вещество является кислота (отдает ионы водорода). Если количество водородов увеличено, что вещество является основой (принимает ионы водорода). Эти определения обычно применяются к реагентам на оставил.
Если смотреть в обратном порядке, новая кислота и основание могут быть идентифицированным. Вещества в правой части уравнения называются сопряженной кислотой и сопряженным основанием по сравнению с теми налево.
Также обратите внимание, что исходная кислота превращается в сопряженное основание после того, как реакция закончится.
SD-фон
| ||||||||||||||
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности.Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки вашего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Разница между кислотами и основаниями
Разница в классификации
Кислоты
Кислоты классифицируются как:
- Сильные кислоты, такие как азотная кислота (HNO 3 ), серная кислота (H 2 SO 4 ) и соляная кислота (HCl) соответственно.
- Сильные кислоты Льюиса, такие как AlCl 3 (безводный хлорид алюминия) и BF 3 (трифторид бора).
- Концентрированные слабые кислоты, такие как уксусная кислота (CH 3 COOH) и муравьиная кислота (CH 2 O 2 ).
- кислоты Льюиса, например, с удельной реакционной способностью; растворы Z n Cl 2 (хлорид цинка).
- Суперкислоты — чрезвычайно сильные кислоты.
Базы
Базы классифицируются как:
- Щелочи или щелочи, такие как NaOH (гидроксид натрия) и KOH (гидроксид калия).
- Концентрированные слабые основания, такие как NH 3 (аммиак) в концентрированном растворе.
- Щелочные металлы в металлической форме (то есть элементарный натрий) и гидриды щелочных и щелочноземельных металлов, то есть NaH (гидрид натрия), которые действуют как сильные гидраты и основания для образования каустиков.
- Супероснования, которые являются чрезвычайно сильными основаниями, такими как амиды металлов, алкоксиды (например, NaNH 2 — амид натрия) и C4H9Li (бутиллитий), которое является металлоорганическим основанием.
Разница в химической формуле
Кислоты
Химическая формула большинства кислот начинается с H. Например, азотная кислота (HNO 3 ), угольная кислота в безалкогольных напитках (H 2 CO 3 ), борная кислота (H 3 BO 3 ), Соляная кислота (HCl), щавелевая кислота (H 2 C 2 O 4 ), лимонная кислота или 2-гидрокси-1,2,3-пропантрикарбоновая кислота (H 3 C 6 H5O 7 ) и серной кислоты (H 2 SO 4 ).Однако есть исключения, такие как уксусная кислота (CH 3 COOH).
Базы
В химической формуле большинства оснований (соединений) на конце стоит ОН. Например, гидроксид кальция или гашеная известь, Ca (OH) 2 (бумага, флокулянт), гидроксид магния (Mg (OH) 2 ) или молоко магнезии, гидроксид натрия (NaOH) или каустическая сода (чистящее средство, регулятор pH), гидроксид аммония (NH 4 OH) или аммиачная вода и KOH (гидроксид калия).
Разница в pH
Кислоты
Кислоты имеют pH менее 7.0.
Базы
Основания имеют pH выше 7,0 и даже могут доходить до 14, если основания очень сильные.
Сила кислот и оснований
Кислоты
Сила кислот зависит от концентрации ионов гидроксония (Уманский, 1991).
Базы
Прочность оснований зависит от концентрации гидроксид-ионов.
Различия в физических характеристиках
И кислоты, и основания различаются по своим физическим свойствам .
Кислоты
При растворении в воде кислоты
- липкие
- Есть ощущение жжения
- Замена синей лакмусовой бумаги на красную
- Кислые на вкус
- Реагировать с основаниями для нейтрализации их свойств
- Провести электричество
- Реагировать с активными металлами с выделением H (водорода)
- Остается бесцветным при добавлении фенолфталеина в раствор.
Базы
При растворении в воде основания
- Горькие на вкус
- Ар (кроме аммиака)
- Замена красной лакмусовой бумаги на синюю
- Скользкие на ощупь
- Реагировать с кислотами для нейтрализации их соответствующих свойств
- Розовеет при добавлении фенолфталеина в раствор.
12,1 Кислоты
12.1.1 Опасности кислот
Кислоты являются донорами протонов. Они разъедают глаза, кожу и слизистые оболочки. Кислотная коррозия или ожог ткани зависит как от pH, так и от способности определенных анионов соединяться с белком. В отличие от ожогов от сильных щелочей, кислотные ожоги вызывают немедленную болезненность отчасти из-за образования белкового слоя, препятствующего дальнейшему проникновению кислоты. Диапазон pH кислот составляет от 0 до 6.9 (вода = 7,0 = нейтральный).
pH примерно от 0 до 3 представляет собой сильную кислоту . Некоторые неорганические кислоты попадают в этот диапазон. Слабые кислоты (pH от 3 до 7) включают разбавленные растворы уксусной кислоты и борную кислоту. Слабые кислоты раздражают кожу при непродолжительном контакте и могут вызвать ожоги при длительном контакте. См. Раздел 12.3, Коррозионные вещества.
Хромовая, соляная, азотная, пикриновая, хлорная и серная кислоты являются опасными кислотами, которые обсуждаются отдельно в сводках по химической безопасности .
12.1.2 Процедуры обращения с кислотами
При работе с сильными кислотами используйте перчатки из материала, подходящего для используемой кислоты. Для окисляющих кислот используйте 4H или неопреновые перчатки. Бутилкаучук можно использовать с большинством органических и минеральных кислот. Также необходимо использовать защитную маску, защитные очки и лабораторный халат. При работе с концентрированными кислотами поверх лабораторного халата следует надевать фартук из неопрена.
12.1.3 Хранение кислот
Кислоты хранятся в двух группах:
Группа 3: Окисляющие кислоты (азотная, серная, хлорная и фосфорная кислоты), которые должны иметь двойную изоляцию и храниться в шкафу безопасности отдельно от других кислот.
Группа 4: Органические и минеральные кислоты следует хранить в шкафу безопасности отдельно от окисляющих кислот.
12.1.4 Удаление кислот
Некоторые кислоты (такие как соляная кислота, серная кислота и уксусная кислота) могут быть нейтрализованы в соответствии с процедурами, изложенными в главе VI , Справочник по опасным отходам. После нейтрализации эти кислоты могут улавливаться. Другие кислоты, такие как хромовая или азотная, должны быть маркированы и собраны EH&S.
12.1.5 Действия в чрезвычайных ситуациях: Облучение
Кожа: Снимите пораженную одежду и промойте открытые ткани обильным количеством воды в течение 15 минут. Если область ожога, обратитесь в отделение неотложной помощи больницы для лечения.
Глаза / лицо: Промыть глаза жидкостью для глаз в течение 15 минут, удерживая веки открытыми. Если глаза были открыты, обратитесь к врачу для оценки.
Как можно скорее заполните форму отчета о несчастном случае и отправьте ее по электронной почте в EH&S по адресу J3-200.
12.1.6 Действия в чрезвычайных ситуациях: разливы
Надев защитные очки, перчатки и лабораторный халат, осторожно добавьте впитывающие полотенца в небольшие пролитые органические кислоты, разбавьте водой и трижды промойте область. В случае больших разливов (> 200 мл) обратитесь в EH&S для очистки.

 )
)