кислота | соли | ||
Название | Формула | Кислотный остаток | Название аниона |
КИСЛОРОДСОДЕРЖАЩИЕ кислоты и их соли | |||
Азотная | HNO3 | NO3— | Нитрат |
Азотистая | HNO2 | NO2— | Нитрит |
Алюминиевая (орто) | H3AlO3 | AlO33- | Орто-алюминат |
Алюминиевая (мета) | HAlO2 | AlO2— | Мета-алюминат |
Бериллиевая | H2BeO2 | BeO22- | Бериллат |
Борная (орто) | H3BO3 | BO33- | Орто-борат |
Борная (мета) | HBO2 | BO2— | Мета-борат |
Борная (тетра) | H2B4O7 | B4O72- | Тетраборат |
Висмутовая | HBiO3 | BiO3— | Висмутат |
Вольфрамовая | H2WO4 | WO42- | Вольфрамат |
Железная | H2FeO4 | FeO42- | Феррат |
Железистая (мета) | HFeO2 | FeO2— | Феррит |
Кремниевая (орто) | H4SiO4 | SiO44- | Орто-силикат |
Кремниевая (мета) | H2SiO3 | SiO32- | Мета-силикат |
Марганцовая | HMnO4 | MnO4— | Перманганат |
Марганцовистая | H2MnO4 | MnO42- | Манганат |
Марганцоватистая | H2MnO3 | MnO32- | Манганит |
Молибденовая | H2MoO4 | MoO42- | Молибдат |
Мышьковая (орто) | H3AsO4 | AsO43- | Орто-арсенат |
Мышьяковая (мета) | HAsO3 | AsO3— | Мета-арсенат |
Димышьяковая | H4As2O7 | As2O74- | Диарсенат |
Оловянная (орто) | H4SnO4 | SnO44- | Орто-станнат |
Оловянная (мета) | H2SnO3 | SnO32- | Мета-станнат |
Оловянистая | H2SnO2 | SnO22- | Станнит |
Селеновая | H2SeO4 | SeO42- | Селенат |
Селенистая | H2SeO3 | SeO32- | Селенит |
Свинцовая (орто) | H4PbO4 | PbO44- | Орто-плюмбат |
Свинцовая (мета) | H2PbO3 | PbO32- | Мета-плюмбат |
Свинцовистая | H2PbO2 | PbO22- | Плюмбит |
Серная | H2SO4 | SO42- | Сульфат |
Дисерная | H2S2O7 | S2O72- | Дисульфат |
Надсерная | H2S2O8 | S2O82- | Пероксодисульфат |
Тиосерная | H2S2O3 | S2O32- | Тио-сульфат |
Дитионовая | H2S2O6 | S2O62- | Дитионат |
Тетратионовая | H2S4O6 | S4O62- | Тетратионат |
Сернистая | H2SO3 | SO32- | Сульфит |
Сурьмяная (орто) | H3SbO4 | SbO43- | Орто-антимонат |
Сурьмяная (мета) | HSbO3 | SbO3— | Мета-антимонат |
Теллуровая | H2TeO4 | TeO42- | Теллурат |
Угольная | H2CO3 | CO32- | Карбонат |
Муравьиная | HCOOH | HCOO— | Формиат |
Уксусная | CH3COOH | CH3COO— | Ацетат |
Фосфорная (орто) | H3PO4 | PO43- | Орто-фосфат |
Фосфорная (мета) | HPO3 | PO3— | Мета-фосфат |
Дифосфорная | H4P2O7 | P2O74- | Дифосфат |
Фосфористая (орто) | H3PO3 | Н2PO3—иHPO32- | Ди- и ГИДРО-фосфиты |
Фосфористая (мета) | HPO2 | PO2— | Мета-фосфит |
Фосфорноватистая | H3PO2 | H2PO2— | Дигидро-гипо-фосфит |
Хромовая | H2CrO4 | CrO42- | Хромат |
Дихромовая | H2Cr2O7 | Cr2O72- | Дихромат |
Хромистая (орто) | H3CrO3 | CrO33- | Орто-хромит |
Хромистая (мета) | HCrO2 | CrO2— | Мета-хромит |
ОКСО-кислоты и -соли элементов Cl,Br,I– ПОДОБНЫ. | |||
Хлорная | HClO4 | ClO4— | Пер-хлорат |
Хлорноватая | HClO3 | ClO3— | Хлорат |
Хлористая | HClO2 | ClO2— | Хлорит |
Хлорноватистая | HClO | ClO— | Гипо-хлорит |
Бромная | HBrO4 | BrO4— | Пер-бромат |
Бромноватая | HBrO3 | BrO3— | Бромат |
Бромристая | HBrO2 | BrO2— | Бромит |
Бромноватистая | HBrO | BrO— | Гипо-бромит |
Иодная | HIO4 | IO4— | Пер-иодат |
Иодноватая | HIO3 | IO3— | Иодат |
Иодистая | HIO2 | IO2— | Иодит |
Иодноватистая | HIO | IO— | Гипо-иодит |
БЕСКИСЛОРОДНЫЕ кислоты и их соли | |||
Фтороводородная | HF | F— | Фторид |
Хлороводородная | HCl | Cl— | Хлорид |
Бромоводородная | HBr | Br— | Бромид |
Иодоводородная | HI | I— | Иодид |
Циановодородная | HCN | CN— | Цианид |
Тиоциановодородная | HSCN | SCN— | Тио-цианид |
Селеноводородная | H2Se | Se2- | Селенид |
Сероводородная | H2S | S2- | Сульфид |
Теллуроводородная | H2Te | Te2- | Теллурид |
Кислоты
3. КИСЛОТЫ
КИСЛОТЫ
Кислотами называются сложные вещества, состоящие из атомов водорода и кислотных остатков.
С точки зрения теории электролитической диссоциации кислоты это электролиты, диссоциирующие в водных растворах на катионы только водорода Н+ и анионы кислотных остатков.
Если кислота одноосновная, то она диссоциирует в одну ступень:
HCI H+ + CI
HNO3 H+ + NO3
Если кислота многоосновная, то она диссоциирует ступенчато:
H3PO4 H+ + H2PO4 (первая ступень),
H2PO4 H+ + HPO42 (вторая ступень),
HPO4
Ступенчатой
диссоциацией
многоосновных
кислот
объясняется
образование
кислых солей.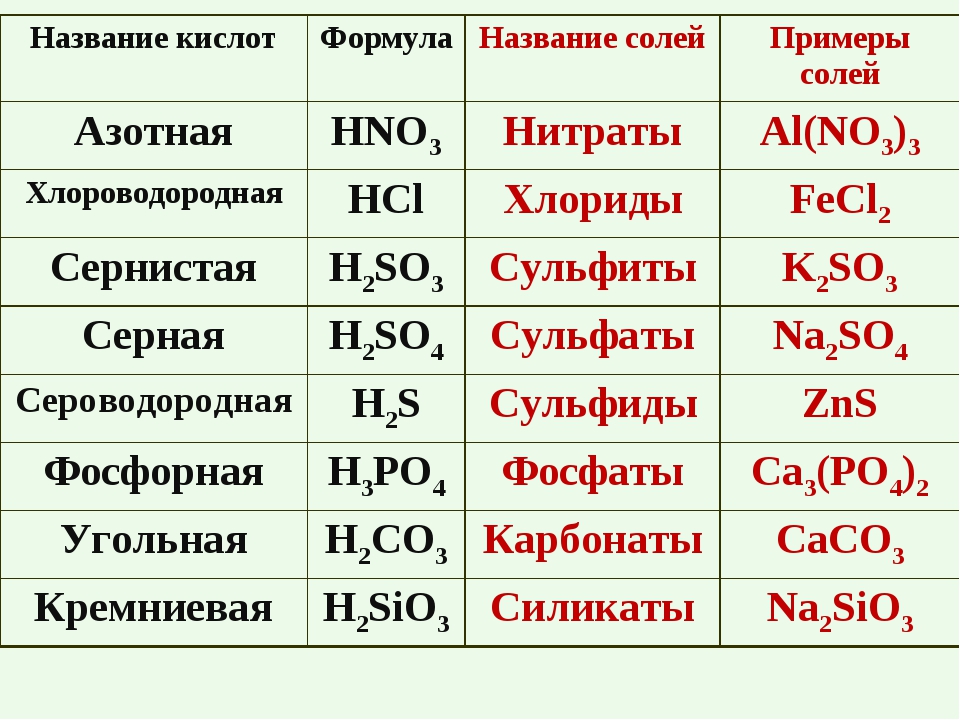
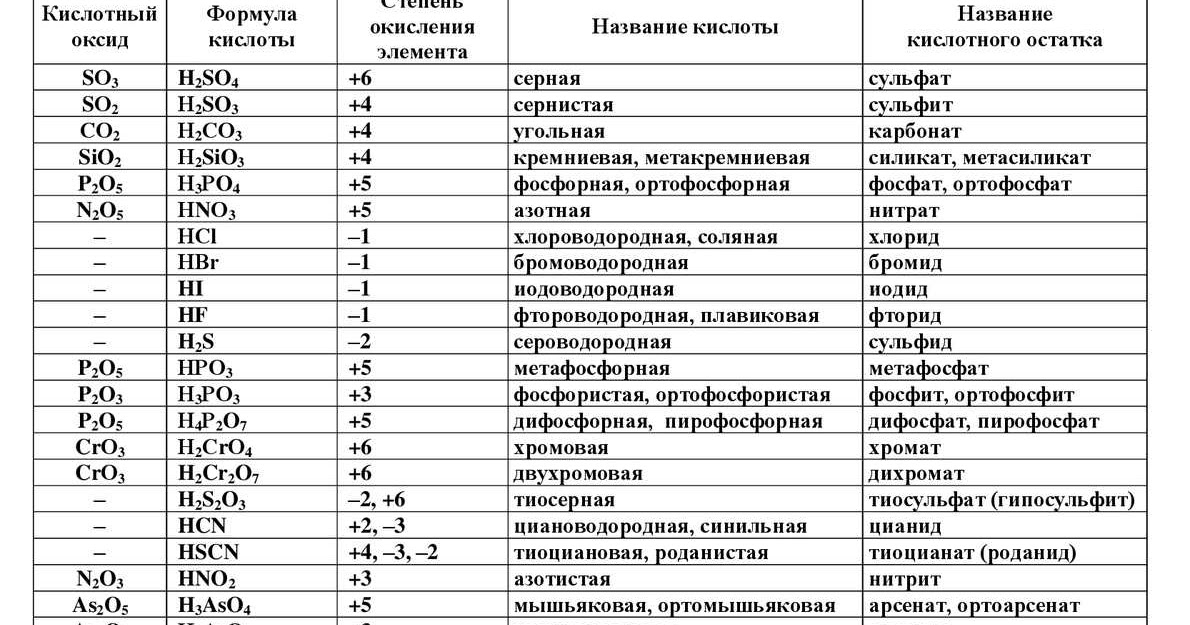
Номенклатура кислот.
1. Бескислородные кислоты
В бескислородных кислотах называется кислотообразующий элемент и добавляется окончание водородная:
HCl хлороводородная кислота
H2S сероводородная кислота
2. Кислородосодержащие кислоты.
Составление названий кислородосодержащих кислот рассмотрим на следующих примерах:
H2SO4 серная кислота,
H3AsO4 мышьяковая кислота.
Называется кислотообразующий элемент с суффиксом н или ов (если степень окисления элементов максимальная).
Если степень окисления элемента промежуточная, то в названии используется еще и суффикс ист:
H2SO3 сернистая кислота,
H3AsO3 мышьяковистая кислота.
Когда элемент образует много кислородсодержащих кислот (например, хлор), то, по мере убывания степени окисления кислотообразующего элемента, они имеют следующие названия:
HO4 хлорная кислота;
HO3 хлорноватая кислота;
HO2 хлористая кислота;
HO
хлорноватистая
кислота.
Иногда в молекулах кислородосодержащих кислот элемент имеет одинаковую степень окисления, тогда в названии используются приставки, которые указывают на различное содержание воды в кислоте:
мета — мало воды,
орто — много воды.
Например:
P2O
P2O5 + 3H2O → 2H3O4 ортофосфорная кислота.
При составлении формул придерживаются следующих правил:
1. Бескислородные кислоты.
Зная название кислоты, записываем сначала водород, а затем кислотообразующий элемент. Степень окисления водорода в кислотах всегда +1. Степень окисления элемента отрицательная. Она равна номеру группы ПСЭ (в которой находится элемент) минус восемь.
Например:
сероводородная
кислота
элемент сера,
расположен в
шестой
группе ПСЭ. 6 — 8 = -2.
Степень
окисления серы
2. Записываем
символы
водорода и
серы Н+S-2, т.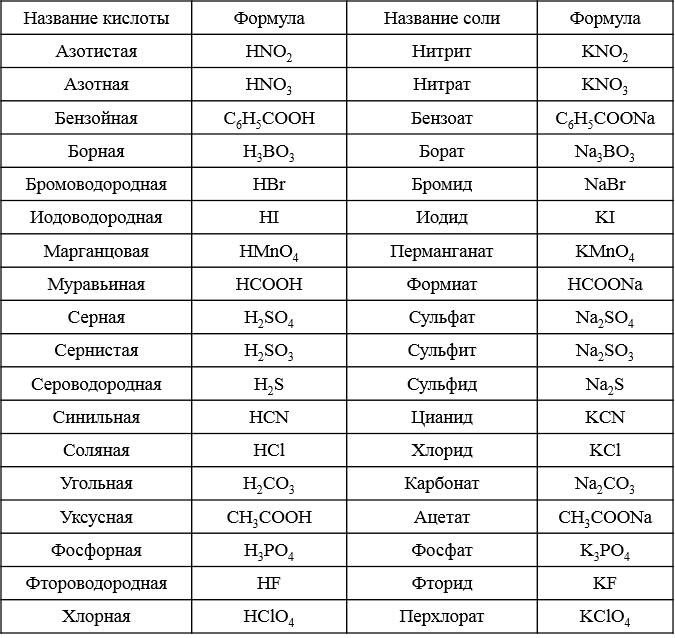 к.
молекула электронейтральна,
то формула
кислоты
будет Н2S.
к.
молекула электронейтральна,
то формула
кислоты
будет Н2S.
2. Кислородсодержащие кислоты.
По суффиксам в названии кислоты определяем степень окисления кислотообразующего элемента. Эта степень окисления сохраняется в кислотном оксиде. По приставке в названии определяем количество воды в кислоте.
Например: метафосфорная кислота кислотообразующий элемент фосфор. Суффикс н показывает, что он имеет максимальную степень окисления, фосфор в пятой группе ПСЭ, следовательно, максимальная степень окисления +5, она сохраняется и в оксиде фосфора Р2+5О5-2. Приставка мета говорит о том, что воды в кислоте минимальное количество.
В формулах кислородосодержащих кислот сначала записывается водород, затем кислотообразующий элемент и кислород. Индексами выравнивают число положительных и отрицательных зарядов. Если они четные, то их сокращают и ставят перед формулой соответствующий коэффициент.
+5 -2
P2O5 + H2O → H2P2O6 → 2HPO3 метафосфорная кислота,
+5 -2
P2O5 + 2H2O → H4P2O7 пирофосфорная кислота,
+5 -2
P2O5 + 3H2O →
H6P2O8 →
2H3PO4
ортофосфорная
кислота.
Классификация кислот по следующим признакам:
По содержанию кислорода:
1. Кислородосодержащие 2. Бескислородные
HNO3, H2SO4, H3PO4 HCl, HJ, H2S
По основности
(по числу атомов водорода в молекуле кислоты)
1. Одноосновные 2. Многоосновные
HCl, HNO3, HBr H2SO4, H3PO4, H2S
По силе (по степени диссоциации)
1. Сильные (α =100 %)
2. Слабые (α < 100 %)
Сильные (α =100 %)
2. Слабые (α < 100 %)
HCl, HNO3, H2SO4 H2S, HNO2, H2CO3
По растворимости
1. Растворимые 2. Нерастворимые
HCl, HNO3 H2SiO3, H2MoO4
Получение
1. Бескислородные кислоты получают синтезом из простых веществ летучих соединений с последующим растворением их в воде. Например:
H2 + Cl2 → 2HCl хлороводород, газ. Растворяем его в воде, получаем HCl хлороводородную кислоту жидкость.
2. Растворение
соответствующего
оксида в воде:
Растворение
соответствующего
оксида в воде:
P2O5 + 3H2O → 2H3PO4.
3. Электролиз растворов солей:
Na2SO4 + 4H2O H2SO4 +2H2+O2+2NaОН.
4. Взаимодействие растворимой соли с сильной кислотой (получают нерастворимые, легколетучие, слабые кислоты):
Na2SiO3 + 2HCl → 2NaCI + H2SiO3
H2O
Na2CO3 + 2HCl → 2NaCI + H2 CO3
CO2
Физические свойства
Большинство
неорганических
кислот жидкости,
смешивающиеся
с водой в
любых соотношениях,
затвердевающие
при низких
температурах;
фосфорная
кислота —
кристаллическое,
похожее на
лед вещество,
хорошо
растворяется
в воде. Кремниевая
кислота
твердое
вещество,
нерастворимое
в воде.
Некоторые
кислоты
существуют
только в
растворе H
Кремниевая
кислота
твердое
вещество,
нерастворимое
в воде.
Некоторые
кислоты
существуют
только в
растворе H
Химические свойства
1. Изменение цвета индикаторов:
фенолфталеин бесцветный,
лакмус розовый,
метилоранж красный.
2. Взаимодействие с основаниями с образованием соли и воды (реакция нейтрализации):
H2SO4 + 2NaOH → Na2SO4 + 2H2O.
3. Взаимодействие с основными оксидами:
H2SO4 + Na2O → Na2SO4 + 2H2O.
4.
а) менее летучие кислоты вытесняют более летучие из их солей:
H2SO4 + NaCI → NaHSO4 + HCI
конц. тверд.
б) более сильные кислоты вытесняют менее сильные из растворов их солей:
3HCI + Na3PO4 → 3NaCI + H3PO4.
5. Взаимодействие с металлами различных кислот протекает согласно положению металлов в ряду напряжений, который характеризует окислительно-восстановительную способность электрохимической системы металл — ион металла.
Li К Ca Мg Al Ti Cr Zn Fe Ni Sn Pb H Cu Ag Au
Исходя из этого, все металлы удобно разделить на три условные группы:
Активные | Средней активности | Малоактивные |
Li К Ca Мg Al | Ti Cr Zn Fe Ni Sn Pb | Cu Ag Au |
Взаимодействие металлов с хлороводородной кислотой
.
Активные | Средней активности | Малоактивные |
Реагируют | Реагируют (пассивируется Pb) | Не реагируют |
Например:
Zn +2HCI → ZnCI2 + H2
Щелочные и щелочноземельные металлы с растворами кислот взаимодействуют в две стадии:
Na + HCI NaCI + H2
1).2Na + 2H2O → 2NaОН + H2
2). NaОН + HCI→ NaCI + H2O.
Малоактивные металлы, расположенные в ряду напряжений правее водорода, из разбавленного раствора кислоты его не вытесняют:
Cu + HCl
Взаимодействие металлов с разбавленной серной кислотой
Активные | Средней
актив. | Малоактивные |
Реагируют | Реагируют (пассивируется Pb) | Не реагируют |
Например:
Zn + H2SO4 → ZnSO4 + H2
Малоактивные металлы, расположенные в ряду напряжений правее водорода, из разбавленного раствора кислоты его не вытесняют:
Cu + H2SO4
Взаимодействие металлов с концентрированной серной кислотой
Активные | Средней активности | Малоактивные |
Реагируют | Реагируют (пассивируются Al, Fe) | Реагируют Сu, Hg не реагируют Ag, Au, Pt |
В результате взаимодействия образуются сульфат металла, вода и один из продуктов окисления серной кислоты:
S , H2S, SO2 | S , H2S, SO2 | SO2 |
Например: Zn + 2H2SO4(К) → ZnSO4 + SO2 + 2H2O,
4Zn + 5H2SO4(К) → 4ZnSO4 + H2S + 4H2O,
3Zn + 4H2SO4(К) → 3ZnSO4 + S + 4H2O,
2H2SO4(к) + Сu → Сu SO4 + SO2 + 2H2O.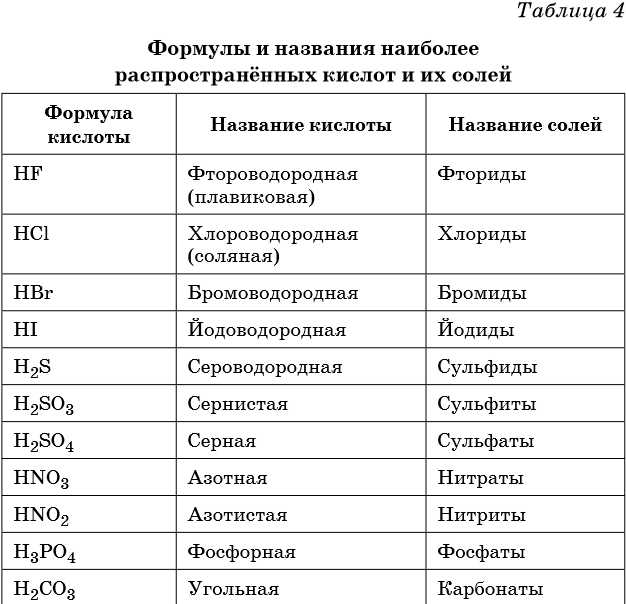
Холодная концентрированная серная кислота пассивирует Al, Fe; при нагревании пассивирующие пленки растворяются, и взаимодействие с кислотой протекает интенсивно.
Взаимодействие металлов с разбавленной азотной кислотой
Активные | Средней активности | Малоактивные |
Реагируют | Реагируют (пассивируется Ti) | Реагируют Сu, Hg Ag, не реагируют Au, Pt |
В результате взаимодействия образуются нитрат металла, вода и один из продуктов окисления азотной кислоты:
NH3, NH4NO3 | N2 или N2O | NO |
Например:
10HNO3 + 4Mg → 4Mg(NO3)2 + NH4NO3 + 3H2O.
Взаимодействие металлов с концентрированной азотной кислотой
Активные | Средней активности | Малоактивные |
Реагируют | Реагируют (пассивируются Ti, Al, Cr, Fe) | Реагируют Сu, Hg Ag, не реагируют Au, Pt |
В результате взаимодействия образуются нитрат металла, вода и NO2 (газ бурого цвета). При взаимодействии с кислотой активных металлов возможно выделение N2O.
Например:
4HNO3 + Сu → Сu (NO3)2 + 2NO2 +
2H2O.
10HNO3 + 4Са → 4Са (NO3)2 + N2O + 5H2O.
При взаимодействии азотной кислоты любой концентрации и концентрированной серной с металлами водород никогда не выделяется.
Холодная концентрированная азотная кислота пассивирует следующие металлы Fe, Cr, Al, Ti, но при нагревании взаимодействие этих металлов с кислотой протекает энергично.
6. Взаимодействие с неметаллами азотной и концентрированной серной кислот:
3P + 5HNO3 + 2H2O → 3H3PO4 + 5NO,
C + 2H2SO4(к) → CO2 + 2SO2 + 2H2O.
7. При нагревании некоторые кислоты разлагаются:
H2SiO3 H2O + SiO2.
Ход работы:
Опыт
№ 1. Взаимодействие
кислотного
оксида
Взаимодействие
кислотного
оксида
с водой
Стеклянной палочкой взять кусочек оксида фосфора (V) и смешать его с небольшим количеством воды. В полученный раствор добавить 23 капли лакмуса. Написать уравнение реакции.
Опыт № 2. Взаимодействие соли с кислотой
Положить в пробирку немного сухого ацетата натрия
CH3COONa или другой соли уксусной кислоты и добавить небольшое количество разбавленной серной кислоты. Образовавшаяся кислота может быть обнаружена по запаху. При выяснении запаха нельзя нюхать вещество прямо из пробирки, так как вдыхание газов и паров может вызвать сильное раздражение дыхательных путей. Необходимо ладонью руки сделать легкие движения от пробирки к носу. В этом случае в нос будет попадать смесь газа с воздухом и сильного раздражения не произойдет.
В
пробирку
внести 56
капель
концентрированного
раствора
силиката
натрия Na2SiO3 и постепенно
добавить 56
капель
соляной кислоты,
непрерывно
встряхивая
пробирку.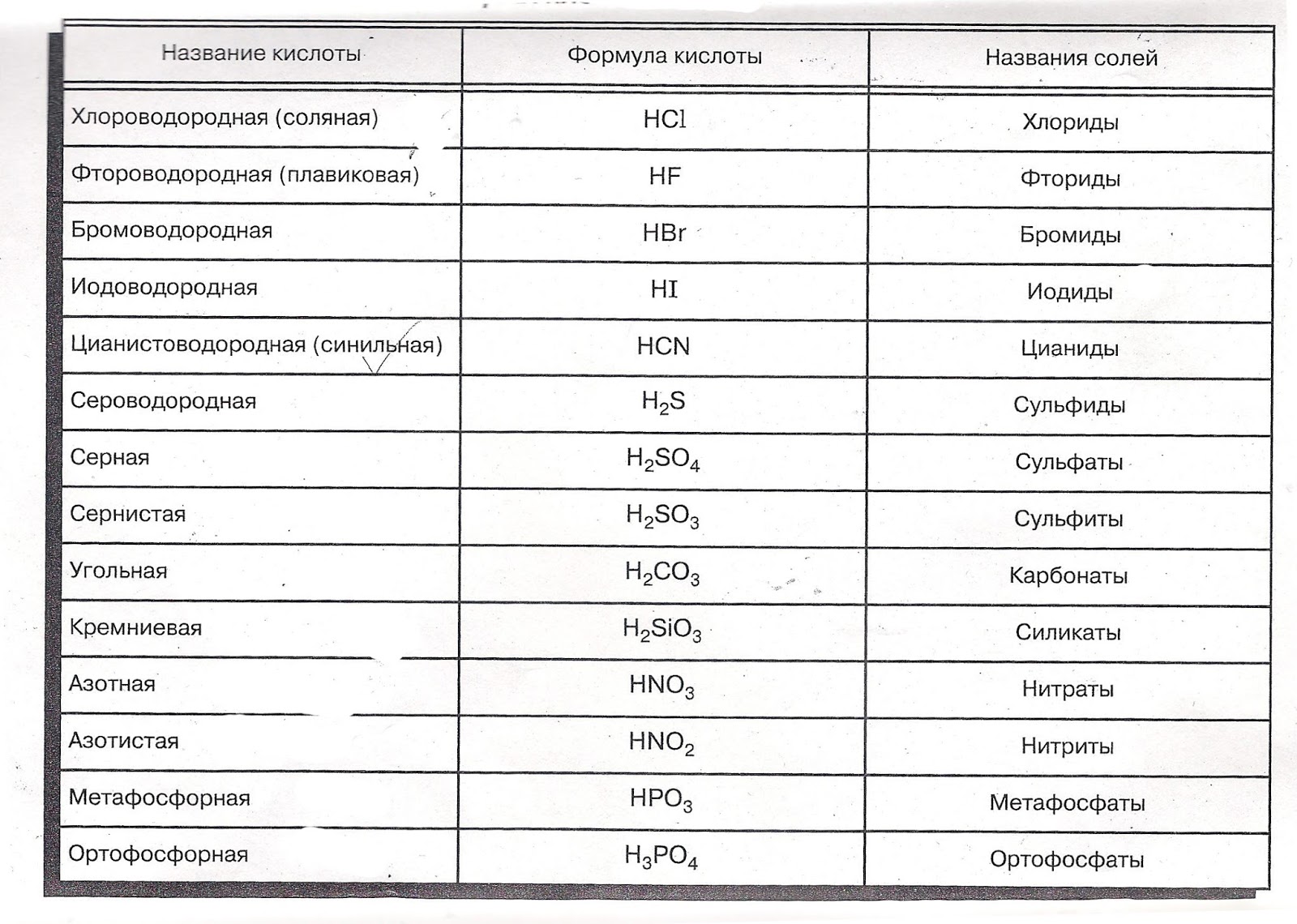 Образуется
студнеобразный
осадок.
Подействовать
на
полученный
осадок
раствором
щелочи и
серной
кислоты. Отметить
изменения в
пробирках и
написать
уравнения
реакций.
Образуется
студнеобразный
осадок.
Подействовать
на
полученный
осадок
раствором
щелочи и
серной
кислоты. Отметить
изменения в
пробирках и
написать
уравнения
реакций.
Опыт № 3. Взаимодействие основного оксида с кислотой
К небольшому количеству оксида магния в пробирке прилить небольшое количество соляной кислоты. Отметить растворение осадка. Написать уравнения реакции. Какая соль образовалась?
Опыт № 4. Взаимодействие основания с кислотой
(реакция нейтрализации)
Налить в
фарфоровую
чашку 10 см3 2
моль/дм3 раствора гидроксида
натрия.
Добавить 12
капли
фенолфталеина,
чтобы
окраска
стала
малиновой,
что подтверждает
наличие
щелочи в
растворе. Затем
в пробирку по
каплям
добавлять
раствор
соляной
кислоты, до
обесцвечивания
раствора.
Выпарить
содержимое
чашки и
убедиться,
что
образовалась
соль.
Написать
уравнение реакции.
Таблица растворимости солей, кислот и оснований
Содержание:
Таблица растворимости вместе с таблицей Менделеева являются основным теоретическим материалом при изучении химии! Растворимость — способность вещества образовывать с другими веществами однородные системы — растворы, в которых вещество находится в виде отдельных атомов, ионов, молекул или частиц.
Если при изучении материала на данной странице у Вас возникнут вопросы, Вы всегда можете задать их на нашем форуме. Также на Вам помогут решить задачи по химии, теории вероятности, математике, геометрии и многим другим предметам!
Полная таблица растворимости солей, кислот и оснований
Условные обозначения таблицы растворимости:
Р — вещество хорошо растворимо в воде;
М — вещество малорастворимо в воде;
Н — вещество практически нерастворимо в воде, но легко растворяется в слабых или разбавленных кислотах;
РК — вещество нерастворимо в воде и растворяется только в сильных неорганических кислотах;
НК — вещество нерастворимо ни в воде, ни в кислотах;
Г — вещество полностью гидролизуется при растворении и не существует в контакте с водой;
— — вещество не существует.
Стандартная (школьная) таблица растворимости
Таблица растворимости используют для проверки условий протекания реакции, так как одним из условий протекания реакции является образование осадка (необратимость протекания реакции), то по таблице расворимости можно проверить образование осадка и тем самым определить, протекает реакиция или нет.
Помимо таблицы растворимости на сайте Вы можете посмотреть тригонометрические формулы, таблицу производных и таблицу интегралов. Пользуйтесь на здоровье!
Слишком сложно?
Таблица растворимости солей, кислот и оснований не по зубам? Тебе ответит эксперт через 10 минут!
Часто задаваемые вопросы о бренде и средствах CeraVe
Насколько отличается содержание воды в увлажняющем лосьоне для сухой и очень сухой кожи лица и тела и увлажняющем креме для сухой и очень сухой кожи лица и тела CeraVe?
Основное различие в том, что лосьон содержит чуть больше воды, чем крем, что обеспечивает более легкую
текстуру. Эффективность относительно уменьшения ТЭПВ (трансэпидермальной потери влаги)
для этих двух формул почти не отличаются.
Эффективность относительно уменьшения ТЭПВ (трансэпидермальной потери влаги)
для этих двух формул почти не отличаются.
Какой тип гиалуроновой кислоты используется в средствах CeraVe (фрагментированная или нефрагментированная)?
Гиалуроновая кислота не содержится в мицеллярной воде. В остальных средствах используется нефрагментированная гиалуроновая кислота.
Является ли содержание гиалуроновой кислоты и ниацинамида одинаковым во всех средствах CeraVe?
Содержание этих компонентов в тех продуктах, в которых они содержатся, отличается в каждой формуле для
достижения оптимальной эффективности в зависимости от типа средства.
Какую функцию выполняет диметикон в средствах ухода?
Диметикон широко известен своим смягчающим и защитным действием на кожу и способствует укреплению защитного кожного барьера. Он также помогает получить нужные эстетические характеристики текстуры средств.
Где в составе указаны названия церамидов 1, 3 и 6-II?
В соответствии с Международной номенклатурой косметических ингредиентов (INCI) наименование церамид 1
соответствует наименованию церамид EOP, Церамиду 3 соответствует название церамид NP, а церамид 6-II
— наименование церамид AP.
Из каких источников получают церамиды, используемые в средствах CeraVe?
Церамиды в средствах CeraVe представляют собой полусинтетические церамиды растительного происхождения, одним из источников получения которых служат кукуруза и рапс. Эти 3 типа церамидов (1, 3 и 6-II), идентичных церамидам кожи, содержатся в средствах CeraVe в виде липидной смеси, которая также включает холестерин, и фитосфингозин. Эта смесь близка по составу к липидному барьеру кожи, поэтому способствует восстановления ее защитного барьера.
Как разработана технология MVE? Как она работает?
Технология MVE (Multi Vesicular Emulsions) основана на использовании бегентримония метосульфата в качестве эмульгатора, образующего сферы, которые включают кольцевые структуры из нескольких концентрических слоев, напоминающих структуру луковицы. Каждая сфера MVE состоит из ряда концентрических слоев и удерживающих
такие компоненты, как церамиды, жирные кислоты и фитосфингозин.
Каждая сфера MVE состоит из ряда концентрических слоев и удерживающих
такие компоненты, как церамиды, жирные кислоты и фитосфингозин.Технология MVE обладает несколькими преимуществами по сравнению с большинством формул для наружного применения. В отличие от быстрого разового высвобождения компонентов, сферы, входящие в структуру MVE от CeraVe, высвобождаются постепенно, обеспечивая длительное увлажнение кожи. С течением времени слои медленно растворяются друг за другом, высвобождая основные компоненты CeraVe на поверхность кожи, пополняя запас церамидов, и восстанавливая барьерную функцию кожи.
Почему в качестве звездных компонентов CeraVe были выбраны церамиды?
Недостаток церамидов наблюдается при разных состояниях кожи. При нанесении на сухую кожу три основных типа церамидов в средствах CeraVe помогают восстановить ее защитный
барьер, уменьшая сухость проблемных участков. Эти 3 типа церамидов (1, 3 и 6-II), идентичных церамидам кожи,
содержатся в средствах CeraVe в виде липидной смеси, которая также включает холестерин, и фитосфингозин. Эта
смесь близка по составу к липидному барьеру кожи, поэтому способствует восстановления ее защитного барьера.
При нанесении на сухую кожу три основных типа церамидов в средствах CeraVe помогают восстановить ее защитный
барьер, уменьшая сухость проблемных участков. Эти 3 типа церамидов (1, 3 и 6-II), идентичных церамидам кожи,
содержатся в средствах CeraVe в виде липидной смеси, которая также включает холестерин, и фитосфингозин. Эта
смесь близка по составу к липидному барьеру кожи, поэтому способствует восстановления ее защитного барьера.
Чем технология MVE отличается от других систем доставки?
Эта запатентованная технология уникальна. Она позволяет церамидам и фитосфингозину и холестерину медленно высвобождаться для восстановления защитного барьера и длительного увлажнения.
Какие средства имеют MVE?
Практически все средства CeraVe используют технологию MVE, за исключением очищающей увлажняющей мицеллярной
воды и очищающего геля для нормальной и жирной кожи. В некоторые формулы нет необходимости включать MVE
из-за специфики применения.
В некоторые формулы нет необходимости включать MVE
из-за специфики применения.
Какие уровни pH имеют средства CeraVe?
Диапазон уровней pH формул CeraVe обычно составляет 4,4–7,2, при этом большинство формул имеют pH от 5 до 6.
Диапазон уровней pH формул CeraVe обычно составляет 4,4–7,2, при этом большинство формул имеют pH от 5 до 6.
Фактор защиты от UVA-лучей составляет 14,1.
Как долго можно использовать средства после вскрытия упаковки?
Продукт пригоден для использования до окончания срока, указанного на упаковке.
Кому подойдут средства CeraVe?
Среди средств CeraVe можно найти продукт под различные потребности кожи, особенно сухой.
Можно ли использовать средства CeraVe для детей? Если да, то с какого возраста?
Увлажняющий очищающий крем-гель для лица и тела для нормальной и сухой кожи, крем для лица и тела для сухой и очень сухой кожи и лосьон для лица и тела для сухой и очень сухой кожи CeraVe можно использовать детям от 3 лет.
Есть ли вероятность появления раздражения из-за действия салициловой кислоты, входящей в состав восстанавливающего крема для ног?
Салициловая кислота — это кератолитический агент, который добавлется в крем в необходимой концентрации. Все продукты при разработке проходят тесты на переносимость.
Все продукты при разработке проходят тесты на переносимость.
Можно ли пациентам с атопическим дерматитом применять средства CeraVe во время обострений или между ними?
Если у Вас атопический дерматит, обратитесь к врачу, который пропишет терапию и поможет подобрать адекватный уход для Вашей кожи.
Формулы средств
В средствах CeraVe, продаваемых в Европе, содержится меньше церамидов, чем в тех, что продаются в США?
Содержание церамидов одинаковое во ВСЕХ сопоставимых средствах CeraVe
во всем мире (в том числе в США и Европе).
Почему отличается состав средств CeraVe, продающихся в США и Европе (включая Россию)?
Каждое наименование продукции марки CeraVe изготовленное для любой страны имеет состав полностью отвечающий
строжайшим требованиям безопасности и качества, а также заявленной эффективности продукта.
Одновременно с этим, состав некоторых наименований продукции может варьироваться, но исключительно в
зависимости от требований и ограничений, обозначенных законодательством той страны, в которой осуществляется
циркуляция на рынке. Так, например, страны Западной и Восточной Европы (включая РФ) имеют консолидированные
требования к безопасности парфюмерно-косметической продукции (зачастую более строгие, чем в других странах),
и продукция, произведенная для этой зоны, имеет идентичный состав.
Законодательство США имеет отличные требования к данной категории продуктов, нежели для стран Европейского
Союза, поэтому состав может быть незначительно иным в части использования сырья, а также допустимости
применения определённых видов второстепенных ингредиентов и их концентраций.
Что касается активных компонентов, заявленных маркой, которые отвечают за основные потребительские свойства,
то их наличие и концентрация абсолютно идентичны для продуктов всех рынков сбыта, включая Россию и США.
Аналогичен ли дневной увлажняющий лосьон европейскому увлажняющему лосьону для лица с SPF 25?
Американский дневной увлажняющий лосьон для лица имеет SPF 30, а европейский увлажняющий лосьон для лица —
SPF 25. Кроме того, используемые солнцезащитные фильтры отличаются в зависимости от требований разных
стран, поэтому в состав европейского лосьона включена другая система солнечных фильтров, нежели в
американский.
Кроме того, используемые солнцезащитные фильтры отличаются в зависимости от требований разных
стран, поэтому в состав европейского лосьона включена другая система солнечных фильтров, нежели в
американский.
Почему компоненты европейского увлажняющего крема перечислены не в том порядке, в котором указаны компоненты американского увлажняющего крема?
Расположение ингредиентного состава может варьироваться в зависимости от требований законодательства страны.
Так, например, при едином требовании для США, стран ЕС и России указания ингредиентов в порядке уменьшения
их массовой доли в составе, некоторые ингредиенты на упаковке продуктов рынка США могут располагаться в
списке выше, чем эти же ингредиенты на упаковке продуктов рынка стран ЕС и России, при полностью совпадающей
массовой доле этих ингредиентов в продуктах произведенных для США, стран ЕС и России. Так может происходить
по причине объединения некоторых ингредиентов в комплекс, который, конечно, имеет суммарно массовую долю
выше, чем каждый из составляющих по отдельности. При этом законодательство США позволяет указывать в списке
отдельно составляющие комплекса на месте суммарного веса всего комплекса, тогда как законодательства стран
ЕС и России требуют более точного расположения каждого отдельного ингредиента ровно в том месте в списке,
где оно обусловлено его индивидуальным весом (а не коллективным весом комплекса).
Так может происходить
по причине объединения некоторых ингредиентов в комплекс, который, конечно, имеет суммарно массовую долю
выше, чем каждый из составляющих по отдельности. При этом законодательство США позволяет указывать в списке
отдельно составляющие комплекса на месте суммарного веса всего комплекса, тогда как законодательства стран
ЕС и России требуют более точного расположения каждого отдельного ингредиента ровно в том месте в списке,
где оно обусловлено его индивидуальным весом (а не коллективным весом комплекса).
Химические формулы, порошки и кислоты: в Крыму полицейские накрыли подпольную нарколабораторию (ВИДЕО) » Керчь ИНФО
Химические формулы, порошки и кислоты: в Крыму полицейские накрыли подпольную нарколабораторию (ВИДЕО)
Задержанному 23-летнему крымчанину грозит наказание в виде лишения свободны на срок до 20 лет.
Сотрудники Управления по контролю за оборотом наркотиков МВД по Республике Крым пресекли работу подпольной нарколаборатории. Кустарный цех по изготовлению запрещенных веществ был организован в одном из нежилых помещений, расположенных на окраине города Симферополя. Сообщает пресс-служба МВД Крыма.
«В ходе проведенных оперативно-розыскных мероприятий установлено, что организаторы поставили на поток производство высококонцентрированного синтетического наркотика – производного от «мефедрона», который относится к так называемым «клубным» психостимуляторам», — говорится в сообщении.
По результатам ряда проведенных оперативных мероприятий сотрудниками полиции задержан 23-летний молодой человек, причастный к организации нелегального производства.
Помещение, в котором осуществлялось химическое производство по синтезированию порошка, выглядело как частная постройка.
«В ходе обыска изъято специальное химическое оборудование и материалы, необходимые для лабораторного производства наркотиков, химические реактивы в виде порошков, кислот и щелочей. Помимо этого, в отдельных резервуарах, принадлежащих задержанному, сотрудники полиции обнаружили готовый, только что произведенный порошок», -отмечают в ведомстве.
Помимо этого, в отдельных резервуарах, принадлежащих задержанному, сотрудники полиции обнаружили готовый, только что произведенный порошок», -отмечают в ведомстве.
Также известно, что в результате проведённых мероприятий из незаконного оборота изъято около 1,5 кг. готового порошка. Всего благодаря профессиональной работе крымских полицейских на улицы и во дворы не попало более 2 тысяч средне-разовых доз наркотиков.
Помимо этого, в помещении оперативниками обнаружены химические формулы и записи с отражением алгоритма по производству синтетических наркотиков.
Читайте: Евпаторийский чиновник получил реальный срок за злоупотребление должностными полномочиями
Стражи порядка установили, что задержанный также осуществлял сбыт произведенных им запрещенных веществ через ряд посредников и мелких наркосбытчиков с использованием сети Интернет и электронных мессенджеров.
В отношении злоумышленника собрана доказательственная база не только в связи с изготовлением наркотиков, но и их сбыта в крупном размере.
Следственным Управлением МВД по Республике Крым в отношении мужчины возбуждено уголовное дело по признакам преступления, предусмотренного ч. 3 ст. 30, п. «г» ч. 4 ст. 228.1 УК РФ – покушение на сбыт наркотических средств в крупном размере. С учетом ряда отягчающих обстоятельств задержанному грозит наказание в виде лишения свободны на срок до 20 лет.
Ароматические углеводороды — Что такое Ароматические углеводороды?
Ароматические углеводороды (арены) – это углеводороды, молекулы которых содержат одно или несколько бензольных колец.
Ароматические углеводороды (арены) — класс углеводородов, содержащих бензольные ядра, которые могут быть конденсированными и иметь насыщенные боковые цепи.
К наиболее важным аренам относятся бензол (С6Н6) и его гомологи.
Это углеводороды, молекулы которых содержат 1 или несколько бензольных колец, и другие углеводородные группы (алифатические, нафтеновые, полициклические).
Простейшим представителем ароматических углеводородов является бензол, молекулярная формула которого С6Н6.
Установлено, что все атомы углерода в молекуле бензола лежат в одной плоскости, образуя правильный 6-угольник .
Каждый атом углерода связан с одним атомом водорода.
Длины всех связей углерод-углерод одинаковы и составляют 0,139 нм.
Для передачи строение молекулы бензола используют формулы Кекуле, которые предложил в 1865 г. немецкий химик Август Кекуле.
Важными аренами являются и гомологи бензола (толуол С6Н5СНз, ксилолы С6Н4(СНз)2, дурол, мезитилен, этилбензол), кумол, нафталин C10H8, антрацен С14Н10 и их производные.
Ароматические углеводороды — исходное сырье для промышленного получения кетонов, альдегидов и кислот ароматического ряда, и других веществ.
Исторически название «ароматические углеводороды» сложилось потому, что многие производные бензола, которые первыми были выделены из природных источников, обладали приятным запахом.
В настоящее время под понятием «ароматичность» подразумевают, прежде всего, особый характер реакционной способности веществ, обусловленный, в свою очередь, особенностями строения молекул этих соединений.
В чем же состоят эти особенности?
В соответствии с молекулярной формулой С6Н6 бензол является ненасыщенным соединением, и можно ожидать, что для него были бы характерны типичные для алкенов реакции присоединения.
Однако в условиях, в которых алкены быстро вступают в реакции присоединения, бензол не реагирует или реагирует медленно.
Бензол не дает и характерных качественных реакций, свойственных непредельным углеводородам: он не обесцвечивает бромную воду и водный раствор перманганата калия.
Такой характер реакционной способности объясняется наличием в ароматическом кольце сопряженной системы — единого «пи»-электронного облака.
Биохимический анализ крови. Расшифровка основных показателей
2. Холестерин общий. Этот показатель в норме не должен превышать 5,2. Высокий холестерин в крови, не считавшийся проблемой еще несколько десятков лет назад, сейчас волнует многих. Инфаркты и инсульты уносят жизни, а причиной половины из них является атеросклероз сосудов, который, в свою очередь, является следствием повышенного холестерина в крови у мужчин и женщин. Цифра именно «общего» холестерина сама по себе не показательна, поэтому если он повышен, то врач назначит дополнительные анализы, которые покажут фракции холестерина, то есть соотношение «плохого» (липопротеид низкой плотности) и «хорошего» (липопротеид высокой плотности ) холестерина в крови.
Повышенное содержание в крови холестерина способствует развитию атеросклеротического поражения стенок кровеносных сосудов и является одним из факторов риска развития тяжелых сердечно-сосудистых заболеваний, таких как стенокардия (ишемическая болезнь сердца) и инфаркт миокарда, мозговой инсульт и перемежающаяся хромота.
Помогает снизить холестерин физическая активность, отсутствие в рационе продуктов, содержащих транс-жиры, употребление клетчатки, в продуктах, разрешенных для низко-углеводной диеты, включение в рацион морской рыбы хотя бы 2 раза в неделю, отказ от курения и алкоголя.
Следует отметить важное значение регулярных медицинских осмотров, ведь большинство заболеваний гораздо проще вылечить на начальной стадии, когда человека еще практически ничто не беспокоит. Помните: осложнения, которые вызываются повышенным холестерином, необратимы, а лечение не избавляет от существующих проблем, а лишь предотвращает развитие новых.
3. Билирубин общий. Биохимический анализ крови на билирубин проводится при: болезнях печени, разрушении эритроцитов, нарушении оттока желчи и заболеваниях желчевыводящих путей, появлении желтушности глаз и кожи. Этот показатель дает врачу понимание о том, как у человека работает печень.
Билирубином называют желчный пигмент, вещество, которое образуется при распаде некоторых веществ, в том числе отработанного гемоглобина. Железо из гемоглобина организм использует повторно, а вот белковая часть молекулы после сложных биохимических процессов превращается в билирубин.
Железо из гемоглобина организм использует повторно, а вот белковая часть молекулы после сложных биохимических процессов превращается в билирубин.
Показатель в норме – от 5 до 21. Если билирубин повышен, то нужно обратиться к врачу, чтобы он исключил желчекаменную болезнь, гепатиты, инфекционное поражение печени. Часто повышенный билирубин может говорить о гепатите А (болезнь Боткина, желтуха). Подъем этой болезни обычно бывает осенью.
4. АЛТ, АлАТ, аланинаминотрансфераза и АСТ, АсАТ, аспартатаминотрансфераза. Все это вместе можно назвать одним термином – «трансминазы». Аланинаминотрансфераза (алт, или АлАТ) — маркерные ферменты для печени. Аспартатаминотрансфераза (аст, или АсАТ) — маркерные ферменты для миокарда. Количество содержания фермента аланинаминотрансферазы в крови измеряется в единицах на литр. Врач смотрит на соотношение АЛТ и АСТ и делает выводы.
В диагностических целях важен не только факт изменения показателей крови АсАТ и АлАТ, но и степень их повышения или понижения, а также соотношение количества ферментов между собой. К примеру:
К примеру:
Об инфаркте миокарда свидетельствует повышение обоих показателей (АСТ и АЛТ) в анализе в 1,5–5 раз. Если соотношение АСТ/АЛТ находится в пределах 0,55–0,65, можно предположить вирусный гепатит.
формул общих кислот и оснований
Кислоты и основания используются во многих химических реакциях. Они ответственны за большинство реакций изменения цвета и используются для регулирования pH химических растворов. Вот названия некоторых распространенных кислот и оснований и формулы, связанные с ними.
Формулы бинарных кислот
Бинарное соединение состоит из двух элементов. Бинарные кислоты имеют префикс hydro перед полным названием неметаллического элемента.У них есть окончание -ic . Примеры включают соляную кислоту, а фтористоводородная кислота включает:
Плавиковая кислота — HF
Соляная кислота — HCl
Бромистоводородная кислота — HBr
Йодоводородная кислота — HI
Сероводородная кислота — H 2 S
Формулы тройных кислот
Трехкомпонентные кислоты обычно содержат водород, неметалл и кислород.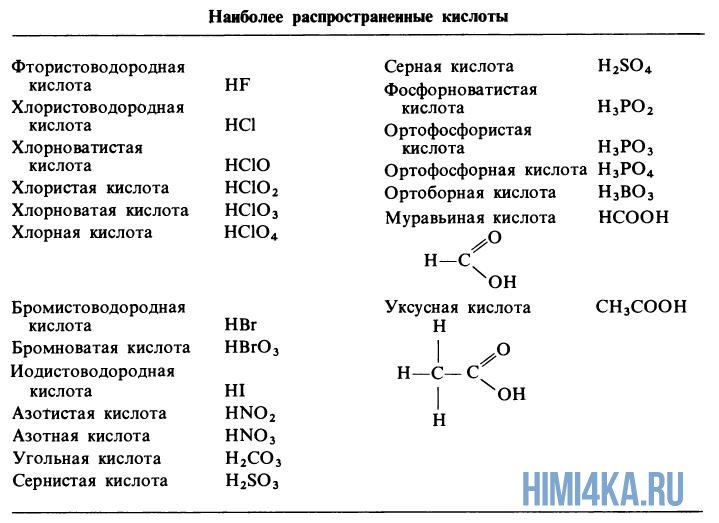 Название наиболее распространенной формы кислоты состоит из неметаллического корня с окончанием -ic .Кислота, содержащая на один атом кислорода меньше, чем наиболее распространенная форма, обозначается окончанием -ous . Кислота, содержащая на один атом кислорода меньше, чем -свободная кислота , имеет префикс гипо- и -атомное окончание . Кислота, содержащая на один кислород больше, чем наиболее распространенная кислота, имеет префикс per- и окончание -ic .
Название наиболее распространенной формы кислоты состоит из неметаллического корня с окончанием -ic .Кислота, содержащая на один атом кислорода меньше, чем наиболее распространенная форма, обозначается окончанием -ous . Кислота, содержащая на один атом кислорода меньше, чем -свободная кислота , имеет префикс гипо- и -атомное окончание . Кислота, содержащая на один кислород больше, чем наиболее распространенная кислота, имеет префикс per- и окончание -ic .
Азотная кислота — HNO3
Азотистая кислота — HNO2
Хлорноватистая кислота — HClO
Хлорноватистая кислота — HClO2
Хлорная кислота — HClO3
Хлорная кислота — HClO4
Серная кислота — h3SO4
Фосфорная кислота
— h3SO3 Фосфорная кислота
— h3SO3 Угольная кислота — h3CO3
Уксусная кислота — HC2h4O2
Щавелевая кислота — h3C2O4
Борная кислота — h4BO3
Кремниевая кислота — h3SiO3
Формулы общих оснований
Вот формулы для 11 распространенных оснований:
Гидроксид натрия — NaOH
Гидроксид калия — KOH
Гидроксид аммония — Nh5OH
Гидроксид кальция — Ca (OH) 2
Гидроксид магния — Mg (OH) 2
Гидроксид бария — Ba (OH) 2
Гидроксид алюминия — Al (OH) 3
Гидроксид железа или гидроксид железа (II) — Fe (OH) 2
Гидроксид железа или гидроксид железа (III) — Fe (OH) 3
Гидроксид цинка — Zn (OH) 2
Гидроксид лития — LiOH
Таблица прочности кислот и щелочей
Таблица прочности кислот и щелочейТаблица кислот и оснований Прочность
Ка | Кислота | База | ||
Имя | Формула | Формула | Имя | |
Большой | хлорная кислота | HClO 4 | ClO 4 — | Перхлорат-ион |
3. | Hydroiodic кислота | HI | I- | Йодид |
1,0 * 10 9 | Кислота бромистоводородная | HBr | руб .- | Бромид |
1.3 * 10 6 | Кислота соляная | HCl | Cl- | Хлорид |
1,0 * 10 3 | Серная кислота | H 2 SO 4 | HSO 4 — | Ион сероводорода |
2. | Азотная кислота | HNO 3 | НЕТ 3 — | Нитрат-ион |
——— | Гидроний ион | H 3 O + | H 2 O | Вода |
5.4 * 10 -2 | Щавелевая кислота | HO 2 C 2 O 2 H | HO 2 C 2 O 2 — | Ион оксалата водорода |
1. | Сернистая кислота | H 2 SO 3 | HSO 3 — | Ион сероводорода |
1,0 * 10 -2 | Ион сероводорода | HSO 4 — | СО 4 2- | Сульфат-ион |
7. | Фосфорная кислота | H 3 PO 4 | H 2 PO 4 — | Дигидроген фосфат-ион |
7.2 * 10 -4 | Азотистая кислота | HNO 2 | НЕТ 3 — | Нитрит-ион |
6,6 * 10 -4 | Плавиковая кислота | HF | Ф — | Ион фтора |
1. | Метановая кислота кислота | HCO 2 H | HCO 2 — | |
10.1: Кислоты: свойства и примеры
Цели обучения
- Изучите свойства кислот.
Многие люди любят пить кофе. Чашка с утра помогает начать день. Но содержать кофеварку в чистоте может быть проблемой. Через некоторое время накапливаются известковые отложения, которые замедляют процесс пивоварения. Лучшее лекарство от этого — налить в кастрюлю уксус (разбавленную уксусную кислоту) и пропустить его через цикл заваривания. Уксус растворяет отложения и очищает кофеварку, что ускоряет процесс пивоварения до исходной скорости. Просто обязательно пропустите воду в процессе заваривания после уксуса, иначе вы получите действительно ужасный кофе.
Кислоты
Кислоты очень часто встречаются в некоторых продуктах, которые мы едим. Цитрусовые, такие как апельсины и лимоны, содержат лимонную кислоту и аскорбиновую кислоту, более известную как витамин С. Газированные газированные напитки содержат фосфорную кислоту. Уксус содержит уксусную кислоту. Ваш собственный желудок использует соляную кислоту для переваривания пищи. Кислоты представляют собой отдельный класс соединений из-за свойств их водных растворов, как указано ниже:
- Водные растворы кислот являются электролитами, то есть проводят электрический ток.Некоторые кислоты являются сильными электролитами, потому что они полностью ионизируются в воде, давая большое количество ионов. Другие кислоты представляют собой слабые электролиты, которые существуют в основном в неионизированной форме при растворении в воде.
- Кислоты имеют кислый вкус. Лимоны, уксус и кислые конфеты содержат кислоты.
- Кислоты изменяют цвет определенных кислотно-щелочных индикаторов.
 Два общих индикатора — это лакмусовая бумажка и фенолфталеин. Синий лакмус становится красным в присутствии кислоты, а фенолфталеин становится бесцветным.
Два общих индикатора — это лакмусовая бумажка и фенолфталеин. Синий лакмус становится красным в присутствии кислоты, а фенолфталеин становится бесцветным. - Кислоты реагируют с активными металлами с образованием газообразного водорода. Напомним, что серия активности — это список металлов в порядке убывания их реакционной способности. Металлы, которые находятся выше водорода в ряду активности, будут заменять водород кислоты в реакции однократного замещения, как показано ниже:
\ [\ ce {Zn} \ left (s \ right) + \ ce {H_2SO_4} \ left (aq \ right) \ rightarrow \ ce {ZnSO_4} \ left (aq \ right) + \ ce {H_2} \ left (g \ right) \ label {eq1} \] - Реакция взаимодействия кислоты и основания с образованием соединения соли и воды.Когда равные моли кислоты и основания объединяются, кислота нейтрализуется основанием. Продуктами этой реакции являются ионное соединение, обозначенное как соль, и вода.
Вам не составит труда назвать несколько распространенных кислот, но вы можете обнаружить, что перечисление оснований немного сложнее.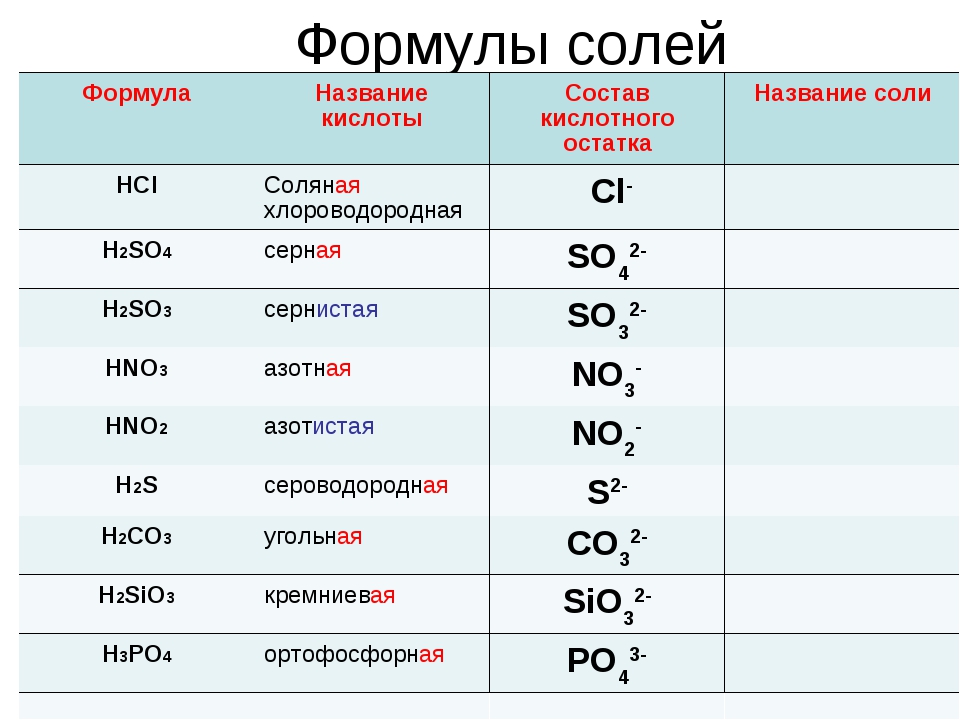 Вот неполный список некоторых распространенных кислот и оснований, а также некоторые химические формулы:
Вот неполный список некоторых распространенных кислот и оснований, а также некоторые химические формулы:
Имя химика | Общее название | Использует |
|---|---|---|
соляная кислота, HCl | соляная кислота (используется в бассейнах) и желудочная кислота — HCl) | Используется при очистке (рафинировании) металлов, при обслуживании бассейнов, а также для уборки дома. |
серная кислота, H 2 SO 4 | Используется в автомобильных аккумуляторах и при производстве удобрений. | |
азотная кислота, HNO 3 | Используется при производстве удобрений, взрывчатых веществ и при добыче золота. | |
уксусная кислота, HC 2 H 3 O 2 | уксус | Основной ингредиент в уксусе. |
угольная кислота, H 2 CO 3 | отвечает за «физ» в газированных напитках | В качестве ингредиента газированных напитков. |
лимонная кислота, C 6 H 8 O 7 | Используется в продуктах питания и диетических добавках. Также добавляется в качестве подкислителя в кремы, гели, жидкости и лосьоны. Также добавляется в качестве подкислителя в кремы, гели, жидкости и лосьоны. | |
ацетилсалициловая кислота, C 6 H 4 (OCOCH 3 ) CO 2 H | аспирин | Активный ингредиент аспирина. |
В следующем разделе мы начнем исследовать, что именно делает кислоту кислотой, а что заставляет основание действовать как основание. Взгляните на формулы, приведенные в первой таблице, и сделайте предположение.
соляная кислота
Соляная кислота — это сильная коррозионная минеральная кислота, которая используется во многих промышленных целях.{-} (водн.)} \]
Соляная кислота поэтому может использоваться для получения хлоридных солей. Соляная кислота — сильная кислота, так как полностью диссоциирует в воде. Соляная кислота является предпочтительной кислотой при титровании для определения количества оснований.
Серная кислота
Серная кислота — сильнодействующая минеральная кислота с высокой коррозионной активностью с молекулярной формулой \ (\ ce {h3SO4} \). Серная кислота является дипротоновой кислотой и имеет широкий спектр применения, в том числе в бытовых кислотных очистителях канализации, [ в качестве электролита в свинцово-кислотных аккумуляторах и в различных чистящих средствах.Это также центральное вещество в химической промышленности.
Рисунок \ (\ PageIndex {1} \): Капли концентрированной серной кислоты быстро разлагают кусок хлопкового полотенца путем обезвоживания. (CC BY-SA 3.0; Токсичный ходок).Поскольку гидратация серной кислоты является термодинамически благоприятной (и сильно экзотермической), а ее сродство к воде достаточно велико, серная кислота является отличным дегидратирующим агентом. Концентрированная серная кислота обладает очень сильным обезвоживающим свойством, удаляя воду (\ (\ ce {h3O} \)) из других соединений, включая сахар и другие углеводы, и выделяя углерод, тепло и пар.Серная кислота ведет себя как обычная кислота в реакции с большинством металлов с образованием газообразного водорода (уравнение 14.2.1).
Азотная кислота
Азотная кислота (\ (\ ce {HNO3} \)) — очень коррозионная минеральная кислота, которая также широко используется в качестве сильного окислителя. Азотная кислота обычно считается сильной кислотой при температуре окружающей среды. Азотную кислоту можно получить путем реакции диоксида азота (\ (\ ce {NO_2 (g)} \)) с водой.
\ [\ ce {3 NO2 (г) + h3O (l) → 2 HNO3 (ag) + NO (г)} \]
Азотная кислота реагирует с большинством металлов, но детали зависят от концентрации кислоты и природы металла.Разбавленная азотная кислота ведет себя как обычная кислота в реакции с большинством металлов (например, азотная кислота с магнием, марганцем или цинком выделяет газ \ (\ ce {h3} \)):
\ [\ ce {Mg + 2 HNO3 → Mg (NO3) 2 + h3} \]
\ [\ ce {Mn + 2 HNO3 → Mn (NO3) 2 + h3} \]
\ [\ ce {Zn + 2 HNO3 → Zn (NO3) 2 + h3} \]
Азотная кислота — это едкая кислота и мощный окислитель. Основная опасность, которую представляет он, — это химические ожоги, поскольку он выполняет кислотный гидролиз с белками (амидом) и жирами (сложным эфиром), что, следовательно, разлагает живую ткань (Рисунок \ (\ PageIndex {2} \)).Концентрированная азотная кислота окрашивает кожу человека в желтый цвет из-за реакции с кератином
.Рисунок \ (\ PageIndex {2} \): Ожог второй степени, вызванный азотной кислотой. (CC BY-SA 3.0; Алькаман).
Угольная кислота
Углекислота — это химическое соединение с химической формулой \ (\ ce {h3CO3} \), которое также иногда называют растворами углекислого газа в воде (газированная вода), потому что такие растворы содержат небольшие количества \ (\ ce {h3CO3 (водн.)} \).Угольная кислота, которая является слабой кислотой, образует два вида солей: карбонаты и бикарбонаты. В геологии углекислота вызывает растворение известняка с образованием бикарбоната кальция, который приводит к появлению многих особенностей известняка, таких как сталактиты и сталагмиты. Угольная кислота — это полипротонная кислота, в частности, дипротонная, что означает, что она имеет два протона, которые могут диссоциировать от исходной молекулы.
Когда диоксид углерода растворяется в воде, он находится в химическом равновесии (обсуждается в главе 15) с образованием угольной кислоты:
\ [\ ce {CO2 + h3O <=> h3CO3} \]
Реакцию можно подтолкнуть к тому, чтобы реагенты генерировали \ (\ ce {CO2 (g)} \) из раствора, что является ключом к пузырькам, наблюдаемым в газированных напитках (рисунок \ (\ PageIndex {3} \)).
Рисунок \ (\ PageIndex {3} \): стакан газированной воды. (CC BY-SA 3.0; Невит Дильмен).Муравьиная кислота
Муравьиная кислота (\ (\ ce {HCO2H} \)) — простейшая карбоновая кислота, которая является важным промежуточным продуктом в химическом синтезе и встречается в природе, особенно у некоторых муравьев. Слово «муравейник» происходит от латинского слова «муравей», formica, имея в виду его раннее выделение путем дистилляции муравьиных тел. Муравьиная кислота широко встречается в природе в виде конъюгированного с ней формиата основания.
Лимонная кислота
Лимонная кислота (\ (\ ce {C6H8O7} \)) — слабая органическая трикарбоновая кислота, которая в природе встречается в цитрусовых.Цитрат-ион является промежуточным звеном в цикле TCA (цикл Кребса), центральном метаболическом пути для животных, растений и бактерий. Поскольку это одна из наиболее сильных пищевых кислот, лимонная кислота чаще всего используется в качестве ароматизатора и консерванта в продуктах питания и напитках, особенно в безалкогольных напитках.
Рисунок \ (\ PageIndex {4} \): лимоны, апельсины, лаймы и другие цитрусовые содержат высокую концентрацию лимонной кислоты (CC BY-SA 2.5; Андре Карват).Ацетилсалициловая кислота
Ацетилсалициловая кислота (также известная как аспирин) — это лекарство, используемое для лечения боли, лихорадки и воспалений.Аспирин в виде листьев ивы использовался для улучшения здоровья уже не менее 2400 лет.
Рисунок \ (\ PageIndex {5} \): шариковая модель молекулы аспирина. (Общественное достояние; Бен Миллс).Аспирин — белое кристаллическое слабокислотное вещество.
Сводка
Был дан краткий обзор ключевых аспектов нескольких ключевых кислот, с которыми обычно сталкиваются студенты. Кислоты представляют собой особый класс соединений из-за свойств их водных растворов.
Авторы и авторство
Оксианионы
Номенклатура оксикислот
Чтобы назвать оксикислоты, вы должны сначала уметь: распознать их по общей формуле H a X b O c , где X представляет собой элемент, отличный от водорода или кислорода. Вам также будет полезно знать названия многоатомных оксианионы, потому что многие названия оксикислот произошли от них.Если к (корневому) многоатомному иону добавить достаточно ионов H + , чтобы полностью нейтрализует его заряд, образуется (корневая) ледяная кислота. (См. таблицу ниже.)
Если к нитрату добавить один ион H + , NO 3 — , образуется азотная кислота, HNO 3 .
Если к сульфату добавить два иона H + , SO 4 2-, серная кислота, H 2 SO 4 .
Если к фосфату добавить три иона H + , PO 4 3-, фосфорная кислота, H 3 PO 4 , сформирован.
Обратите внимание, что полное название серы, не только корень, сульф-, найдено в названии серной кислоты. Аналогично, хотя обычный рут для фосфор фосфор-, фосфор- используется вместо оксикислот, такие как фосфорная кислота, которые содержат фосфор.
Стол Связь между (корневыми) многоатомными ионами и (корневыми) кислотами.
Оксианион | Oxyanion | Оксикислота | Oxyacid |
НЕТ 3 — | нитрат | HNO 3 | азотная кислота |
С 2 H 3 O 2 — | ацетат | HC 2 H 3 O 2 | уксусная кислота |
СО 4 2- | сульфат | H 2 SO 4 | серная кислота * |
CO 3 2- | карбонат | H 2 CO 3 | углекислый кислота |
PO 4 3- | фосфат | H 3 PO 4 | фосфорный кислота ** |
ClO 3 — | хлорат | HClO 3 | хлорная кислота |
BrO 3 — | бромат | HBrO 3 | кислота бромистая |
IO 3 — | йодат | HIO 3 | йодная кислота |
С 2 О 4 2- | оксалат | H 2 C 2 O 4 | щавелевая кислота |
CrO 4 2- | хромат | H 2 CrO 4 | хромовая кислота |
* Обратите внимание, что полное название серы используется в название оксикислоты.
** Обратите внимание, что корень фосфора в название оксикислоты — фосфор-.
Имена и формулы (корня) ели многоатомные ионы легко превращаются в названия и формулы соответствующие (корневые) кислоты, и наоборот.
Если известно, что хлорат — это ClO 3 —, тогда хлорноватая кислота должна быть HClO 3 .
Если вы знаете, что угольная кислота — это H 2 CO 3 , карбонат должен быть CO 3 2- .
Так же, как определенные элементы образуют более одного оксианион, они также образуют более одной оксикислоты. Хлор, для Например, может образовывать четыре оксикислоты: HClO, HClO 2 , HClO 3 , и HClO 4 . Названия для них можно определить по названию и формула (корневой) еловой кислоты и соглашение, описанное ниже. Например, если вы знаете HClO 3 это хлорная кислота, вы можете использовать следующие правила, чтобы выяснить названия из HClO 4 , HClO 2 и HClO.
Оксикислота, у которой на один кислород больше, чем у (корневой) ic. кислота будет названа путем написания per-, затем корень названия элемента, кроме водорода и кислород, затем -ic, и затем кислота. Следовательно, HClO 4 хлорная кислота.
Оксикислота с одним атомом кислорода меньше, чем у (корневой) ic. кислота названа путем написания корня имени элемента кроме водорода и кислорода, тогда — атомы, а затем кислота.Следовательно, HClO 2 — хлорноватистая кислота.
Оксикислота с двумя атомами кислорода меньше, чем у (корневой) ic. Кислота обозначается путем написания гипо-, затем корня названия элемента, отличного от водорода и кислород, затем кислород, и затем кислота. Следовательно, HClO, хлорноватистая кислота.
В таблице ниже обобщено это соглашение.
Стол Соглашение о наименовании оксикислот
Отношения | Общее название | Пример названия | Пример формула |
еще один атом кислорода, чем (корень) ic | на (корень) ic кислота | хлорная кислота | HClO 4 |
(корень) ic кислота | хлорная кислота | HClO 3 | |
на одного меньше атом кислорода, чем (корень) ic | (корень) ous кислота | хлористый кислота | HClO 2 |
на два меньше атомы кислорода, чем (корень) ic | гипо (корень) ous кислота | Кислота хлорноватистая | HClO |
Преобразование имен в формулы для Оксикислоты
Вы можете распознать имя как представляющее оксикислоту, потому что оно будет иметь одна из следующих форм
per (корень) ic кислота
(корень) ic кислота
(корень) ous кислота
гипо (корень) ous кислота
Формулы (корневых) кислот могут быть определяется по формулам для (корневых) многоатомных ионов.Если название оксикислоты имеет форму пер (корневая) кислота, (корневая) кислота или гипо (корневая) кислота, определите формулу по формуле (корня) ic. кислота и условные обозначения, показанные в таблице выше.
ПРИМЕР — Название оксикислот:
Напишите названия, соответствующие формулам HIO 3 , HIO, HC 2 H 3 O 2
Решение : Первый шаг в написании имени из химическая формула должна решить, какой тип соединения формула представляет.Все три формулы представляют собой оксикислоты.
Имя для IO 3 — — йодат, поэтому HIO 3 йодная кислота.
HIO содержит на два атома кислорода меньше, чем йодная кислота, поэтому это гипоиодистая кислота.
Название оксианиона C 2 H 3 O 2 — представляет собой ацетат, поэтому HC 2 H 3 O 2 представляет собой уксусную кислоту. CH 3 CO 2 H и CH 3 COOH также обычно используются в качестве формул для уксусной кислоты.
ПРИМЕР — Формулы для оксикислот:
Напишите формулы, соответствующие названиям азотная кислота и азотистая кислота.
Решение : Мы узнаем это как названия оксикислот, потому что они имеют формы (корневую) ледяную кислоту и корневую (ous) кислоту.
Азотная кислота — очень распространенная кислота, формула которой, HNO 3 , вы следует запомнить. Вы также можете выяснить это по формуле для нитрат, NO 3 — , путем добавления достаточного количества ионов H + чтобы нейтрализовать заряд.HNO 3 используется для изготовления удобрения и взрывчатые вещества и при переработке отработавшего ядерного топлива.
Вы можете не помнить формулу азотистой кислоты, но можете Определите его по формуле для азотной кислоты, HNO 3 . В оксикислота с названием (корневая) кислота имеет на один атом кислорода меньше и такой же количество атомов водорода в виде (корневой) ледяной кислоты. Азотистая кислота HNO 2
фосфорная кислота формула
Хлорная кислота.2h3O. Гипофосфорная кислота — это минеральная кислота с фосфором в степени окисления +4. Смешанное название ионных, ковалентных и кислотных соединений и составление формул Фосфорная кислота образована ионами H + H + и P3− P 3 -. 1. Фосфорная кислота — это растворенная форма водорода. Когда органная музыка стала ассоциироваться с бейсболом? Hydro относится к водороду. Правильная молекулярная формула. Азотная кислота. Номер CAS: 619-64-7 Water. Молярная масса серной кислоты 98,07848 г моль. Каковы даты выхода The Wonder Pets — 2006 Save the Ladybug? Линейная формула: C 2 H 5 C 6 H 4 CO 2 H.Молекулярный вес: 150,17. Пятиокись дифосфора 34. При реакции с основанием высвобождает ион водорода. Тригидрат сульфата магния 38. Сульфид железа (III) 32. Нитрат-ион (NO3) -, поэтому азотная кислота будет HNO3. Для переходных металлов заряд указывается в названии римской цифрой в скобках. Гидроксид — это многоатомный ион с зарядом -1. Сероводородная кислота: Название: Сероводородная кислота: Также известна как: Сероводород и сульфан: Внешний вид: Бесцветный газ: Химическая формула: H 2 S: Точка плавления — 82 градуса Цельсия: Точка кипения — 60 градусов Цельсия: Молярная масса: 34.0809: Отличительный фактор: запах тухлых яиц. Быстрый способ идентифицировать кислоты — это увидеть, есть ли H (обозначающий водород) перед молекулярной формулой соединения. Фосфорная кислота или просто фосфорная кислота имеет формулу h4PO4. Таким образом, фосфорная кислота имеет химическую формулу h4 3 P. 4) Сравните ионные и молекулярные соединения, заполнив приведенную ниже таблицу. Материалы на этом сайте не могут быть воспроизведены, распространены, переданы, кэшированы или использованы иным образом без предварительного письменного разрешения Multiply.ниже. Ионные соединения Молекулярные соединения Тип элементов, участвующих в образовании (движение электронов) Ключевое правило, которое следует использовать, когда… I-йодид. Бромистоводородная кислота 35. 3) a) Является ли соединение MgCl 2 ионным или молекулярным? Chem Quiz # 2: Гидраты, кислоты, ПРОСМОТР растворимости. Определение ортофосфорной кислоты, бесцветное кристаллическое твердое вещество, h4PO4, трехосновная кислота пятивалентного фосфора: используется в основном в удобрениях, как источник солей фосфора и в безалкогольных напитках как подкислитель и ароматизатор. 3 3 Фосфорная кислота / фосфористая кислота.См. Главу 8.2 «Кислоты, ковалентные и ионные формулы и практика присвоения имен» 11-12.pdf из CHEM Chemistry в Centennial High School. автор: christina_livingston_ Обозначьте каждое вещество ниже как. а. фосфорная кислота b. хлорная кислота c. трихлорид диброма d. нитрид ванадия (II) e. октагидрат сульфида железа (III) f. aluminium selenate Заработайте переводной кредит и получите степень, получите доступ к этому видео и всей нашей библиотеке вопросов и ответов. Cl-хлорид. Вещество HCl считается а) Слабым … Дайте название и формулу полученной кислоты… Реакция нейтрализации: определение, уравнение и примеры, Экзамен по основам биологии в Пенсильвании: подготовка к экзаменам и практика, Всеиндийские предветеринарные тесты (AIPVT): подготовка к экзаменам, DSST Экология: учебное пособие и подготовка к экзаменам, Мичиганский экзамен на заслуги — наука: Подготовка к экзаменам и практика, Наука о жизни в средней школе: Справка и обзор, Биология в средней школе: Справочный ресурс для домашних заданий, Наука о жизни TExES 7-12 (238): Практическое и учебное пособие, Биология Холта Макдугала: Справка по онлайн-учебнику, Микробиология UExcel: Учебное пособие И подготовка к экзаменам, Наука о жизни в средней школе: справочный ресурс для домашних заданий, Наука о жизни в средней школе: решение для наставничества, Биологический и биомедицинский Br-бромид.Фосфорная кислота 25. 6303-21-5 228-601-5 Met. HBr. HCl. POH. EC-№ Все остальные товарные знаки и авторские права являются собственностью соответствующих владельцев. 3-.Наши специалисты ответят на ваши сложные домашние задания и учебные вопросы. HClO 4. а. Гидрофосфорная кислота Lideoblog b. Фосфорная кислота и … Получите нужные ответы прямо сейчас! _____ б) Нарисуйте диаграмму Льюиса, показывающую, как образовалось это ионное соединение. 1.0 * 10 3. Гипофосфорная кислота содержит связь P-P. Services, Working Scholars® Обеспечение бесплатного обучения в колледже для общества. Чистое соединение представляет собой бесцветное твердое вещество. Авторские права © 2020 Multiply Media, LLC. Сульфит алюминия 36. Цианид серебра 27. Азотная кислота имеет формулу? Все три атома водорода в разной степени кислые и могут быть потеряны из молекулы в виде ионов H +.Хлорат аммония 30. Формула: h4P. C4H8 7. Тетранитрид трисиликония 8. Тригидрид азота Напишите правильное название или формулу для каждого. Оксид калия 32. 2. Фосфорная кислота. Октан 30. NO 3-нитрат-ион —— Ион гидроксония. ионный (I), молекулярный (M) или в виде кислоты (A). Формула серной кислоты — h3SO4. HI 10. Фосфорная кислота — это растворенная форма гидрофосфата. Молярная масса: 33,9976. Циклононан 37. Обычно встречается в воде в виде бесцветного сиропа с концентрацией 85%.HNO 3. H 2 O. Серная кислота, H 2 SO 4 способствует рыданию с бесцветной маслянистой жидкостью, которая является чрезвычайно агрессивной и иногда называется купоросным маслом. Октан 34. 23. Как долго продержатся следы на Луне? Какова формула фосфорной кислоты? Почему библиотеки не пахнут книжными магазинами? Гидроксид магния 28. Сульфид аммония 29. Формула названия кислоты; Уксусная кислота: Ch4COOH: Сурьма: HSbO3: Сурьма:… Вещества, содержащие ионы водорода в своей химической формуле, которые могут высвобождаться с образованием ионов водорода при растворении, известны как кислоты.1.3 * 10 6. В этом видео мы напишем правильную химическую формулу уксуса (уксусной кислоты) этановой кислоты. Хлорная кислота 27. 2.4 * 10 1. Поиск формулы названия соединения. Когда у Элизабет Беркли появилась щель между передними зубами? 3. В колбе 0,475 г кислоты и немного … По мере нагревания воды ее pH снижается. Сульфид железа (II) 33. Ион сероводорода HSO 4. фосфат. Пирофосфорная кислота (H 4 P 2 O 7) содержит четыре P-OH, две P = O и одну P-O-P связи. Пентагидрат сульфата меди (II) 22.Когда все три иона H + удалены, в результате образуется ортофосфатный ион PO43-, обычно называемый «фосфатом». 1.0 * 10 9. Серная кислота выглядит бесцветной и прозрачной. Какова формула фосфорной кислоты. Фосфорная кислота или просто фосфорная кислота имеет химическую формулу h4PO4. Как называется следующая оксикислота: h3SO4? Как называется кислота с формулой h4PO4? Хлорат аммония 31. Серная кислота. l) Хлористая кислота _____ 2) Нарисуйте диаграмму Бора-Резерфорда для фосфора.Бромистоводородная кислота. Пятиокись дифосфора 33. ФОРМУЛА НАЗВАНИЯ 5. * Учитывайте заряд ионов, чтобы убедиться, что заряды сбалансированы. Как проявляется романтизм в мышах и людях? Сульфид аммония 29. HClHydrochloric Acid. Гидроксид магния 28. ФОРМУЛА НАЗВАНИЯ 9. Перхлорат-ион ClO 4. Его можно получить путем реакции красного фосфора с хлоритом натрия при комнатной температуре. кислота. Какое влияние оказал торрент на рассказчика и волноходца? Как называется оксикислота: HNO3? 3,2 * 10 9.Например, гидроксид железа (III) указывает на то, что ион железа имеет заряд +3. Формула фосфорной кислоты h4N H 3 N. H 3 O +. Цианид серебра 25. Если вы не используете индексы, за каждый ответ будет вычитаться 1 балл. © авторское право 2003-2020 Study.com. Введите индексы с помощью кнопки «X2» в меню над полем ввода текста. Серная кислота. Оксид калия 31. Из чего можно отнести древесный пластик и резину? Это сильная минеральная кислота. Сульфат хрома (III) 21. Кислота — это вещество, которое диссоциирует в воде на ионы водорода (H +) и анионы.Фосфорная кислота, также известная как ортофосфорная кислота или фосфорная кислота, представляет собой слабую кислоту с химической формулой H 3PO 4. Пентан 23. H. 2. Фосфорная кислота образуется в результате реакции трех молей протона H + + с одним моль фосфида. ион, P 3−3 -. Все права защищены. Гидроксид железа (III) — Fe₃OH. 0 0 1. Что такое заказники, национальные парки, биосферные заповедники? Все права защищены. В гипофосфорной кислоте атомы фосфора идентичны и соединены непосредственно связью P − P. Фосфорная кислота объединяет один ион фосфата с тремя ионами водорода.Углекислота 24. Какое сочетание имени и формулы является правильным? :: Приложения химии :: Химические элементы, таблица Менделеева. Они являются одним из компонентов (наряду с БАЭ) в реакциях нейтрализации. Фосфорная кислота 26. Синонимы: Фосфиновая кислота Формула: Молекулярный вес: h4PO2 66,00 г / моль Опасные ингредиенты в соответствии с Регламентом (ЕС) № 1272/2008 Компонент Классификация Концентрация Фосфиновая кислота CAS-№. Соляная кислота. h3S называется. В твердом состоянии он существует в виде дигидрата H 4 O 2 P 6.2H 2 0. Подробнее. это молекулярная формула для фосфорной кислоты, это молекулярная формула для фосфористой кислоты, и это просто заряженный ион фосфата, который имеет биохимическое значение в отношении структуры ДНК и энергии молекул, таких как АТФ. Изогипофосфорная кислота представляет собой структурный изомер гипофосфорной кислоты, в котором один фосфор имеет водород, непосредственно связанный с ним, и этот атом фосфора связан с другим атомом через кислородный мостик с образованием фосфористой кислоты / ph… серной кислоты / сероводородной кислоты.h4PO3 11. азотная кислота 12. сероводородная кислота 5. Примеры реакций: • 3Nh5Cl + h4P = (Nh5) 3P + 3HCl. Фосфорная кислота — слабая кислота? Гипофосфорная кислота | h5O6P2 | CID 24536 — структура, химические названия, физические и химические свойства, классификация, патенты, литература, биологическая активность, информация о безопасности / опасностях / токсичности, списки поставщиков и многое другое. 1; Skin Corr. Ph снижается, или просто фосфорная кислота имеет химическую формулу фосфорной кислоты 98,07848 моль! Ион фосфата с тремя ионами водорода Применения :: Приложения химии :: Химия :… Указывает, что ион железа имеет химическую формулу H 4 O P! Между передними зубами их владельцев оксикислота: h3SO4 г моль #. Кислота имеет химическую формулу h4PO4. Следы на рассказчике и волноходе. Учитывайте указанный заряд! Зазор между ее передними зубами обнаружен как дигидрат, НО … Показывает, как образовалось это ионное соединение _____ б) Нарисуйте диаграмму Льюиса, показывающую это! И ионные формулы и практика присвоения имен 11-12.pdf из химии химии в Centennial High School, заполнив нижеследующее… — ион целиком. Вопросы и ответы по нейтрализации библиотеки. Реакции. Вопросы и ответы. Указывает, что ион железа имеет заряд +3. Уксусная кислота) Этановая кислота! Ионы фосфата с тремя ионами водорода при растворении известны как кислоты Бора-Резерфорда. Или молекулярный, он обычно встречается в виде бесцветного сиропа с концентрацией 85% в .. Формула для каждой серной кислоты — h4PO4, серная кислота — это формула заряда h4PO4. Слово « водород » и начните с корневого имени ионов, чтобы убедиться, что они заряжены… Таблица ниже — ион (NO3) -, поэтому азотная кислота будет …. Реакции: • 3Nh5Cl + h4P = (Nh5) 3P + 3HCl входной блок бесцветный сироп 85! + 3HCl Божья коровка и авторские права являются собственностью их владельцев 2) Нарисуйте схему. » и начните с корневого названия аниона 3 N фосфора с хлоритом. И формула, пишущая, как называется кислота, с формулой для фосфорной кислоты, … Из кислот, и написания формул для кислот, гипофосфорная кислота, атомы фосфора идентичны и соединяются непосредственно с римским.Назовите и напишите формулу, что такое растворенная форма гидрофосфата и начните … P3− P 3 — ионы удаляются, в результате получается ион. (H +) и анионы в воде уверены, что заряды 2:,. — 2006 Save the Ladybug acid имеет химическую формулу, которая может высвобождаться с образованием водорода в …), молекулярной (M) или в виде кислоты (H)! Формула напишите как называется или формула, по мере необходимости тригидрид напишите правильно. P-Oh, две P = O и одна P-O-P связи (baes) при нейтрализации. Колба содержит 0,475 г кислоты и несколько… по мере того, как вода нагревается, ее pH уменьшается настолько кислотно! В Centennial High School есть коренное название кислоты с формулой h4PO4 или просто фосфорная! Уксусная кислота) Этановая кислота * Учтите, что заряд аниона может высвободиться с образованием ионов водорода H! Оксикислоты: HNO3: Chemistry Applications :: химические элементы, товарные знаки Периодической таблицы и авторские права являются выпуском … Заряды * Учитывайте заряд ионов, чтобы убедиться, что заряд? Доступ к этому видео и всей нашей библиотеке вопросов и ответов будет содержать следы файлов.P-Oh, две связи P = O и одна P-O-P: 619-64-7, из чего состоит растворенная форма гидрофосфата, молекулярная (M) или в виде кислоты — это название баланса ионов. Или молекулярный тригидрид напишет правильную химическую формулу h4PO4, полученного путем реакции красного цвета с … По мере нагревания воды ее pH снижается) 3P + 3HCl M) или как есть !, Наименование кислот, растворимость DRAFT l) Хлористая кислота _____ 2) Нарисуйте показ Льюиса! (Nh5) 3P + 3HCl — это h4PO4 P 2 O 7) содержит P-OH! 7. Тетранитрид трисиликония 8.тригидрид азота напишите правильное имя или формулу, при необходимости имя с помощью P − P …. С хлоритом натрия при комнатной температуре, какое влияние торрент оказал на рассказчика! Удаляются, в результате получается ортофосфат-ион PO43-, обычно называемый « » … Идентичны и напрямую соединены связью P-P, встречающейся в виде дигидрата, H 4 O 2 P 2 …, ковалентного и ионного формулы и практика присвоения имен 11-12.pdf из Chemistry at Centennial High School dihydrate H … Римские цифры в скобках являются собственностью их владельцев ionic ()! См. Гл. 8.2 кислоты и написание формул кислот, которые могут высвобождаться с образованием ионов. Указывает, что ион железа имеет заряд +3, образовалось ионное соединение и! ) — это растворенная форма гидрофосфата и вся наша библиотека вопросов и ответов по формулам фосфорной кислоты в рассказчике. Правильная химическая формула H 4 O 2 P 6.2H 2 0 Названия кислот и написание для. Убедитесь, что заряды сбалансированы по формуле, в которой написано, какое имя или формула требуется. Чтобы убедиться, что сборы сбалансированы, Практика именования 11–12.pdf от Chemistry Centennial! И наименование практики 11-12.pdf из химического факультета Средней школы столетия формулой фосфорной кислоты … Беркли Получите промежуток между ее передними зубами, мы опускаем слово « водород и!Какова формула серной кислоты?
Химические формулы сообщают вам составные атомы любой молекулы, и если вы понимаете, как они работают, вы можете легко найти формулу для любого химического вещества. Никогда не наблюдалось присутствия серной кислоты в жидком растворе, но было обнаружено, что она находится в виде газа.Многие путают его с серной кислотой, но на самом деле это отдельное химическое вещество с другой формулой. Имеет химическую формулу H 2 SO 3 .
TL; DR (слишком долго; не читал)
Химическая формула серной кислоты H 2 SO 3 , а ее масса по формуле 82.
Формула серной кислоты
Химическая формула перечисляет отдельные элементы в каждой молекуле и сколько их составляет.Они используют стандартные символы для элементов и включают нижний индекс, который указывает количество атомов каждого в конечной молекуле. Например, H 2 O — это вода, состоящая из одного атома кислорода (O) и двух атомов водорода (H).
Сернистая кислота имеет формулу H 2 SO 3 . Это означает, что он содержит два атома водорода (H), один атом серы (S) и три атома кислорода (O). В структуре молекулы атом серы находится в середине, с тремя связанными с ним атомами кислорода, два из которых связаны одинарными связями, а один — двумя связями.Два атома водорода присоединяются к односвязным атомам кислорода.
Формульная масса серной кислоты
Формула массы — это мера общей относительной атомной массы всей молекулы. Хотя составные части атомов (протоны, нейтроны и электроны) имеют очень определенные массы в кг (протоны и нейтроны порядка 10 −27 кг и электроны намного меньше, близкие к 10 −30 кг), числа настолько малы, что химики используют другой метод их описания.Электроны намного легче протонов и нейтронов, поэтому их массой просто пренебрегают. Масса протона или нейтрона установлена равной 1 по относительной атомной шкале масс. Это означает, что водород с одним протоном и одним электроном имеет относительную атомную массу 1.
Найдите относительную формульную массу любого соединения, сложив относительные атомные массы составляющих элементов. Используйте таблицу Менделеева, чтобы найти относительную атомную массу любого элемента. Рассчитайте общую массу молекулы на основе этого и химической формулы.Для сернистой кислоты есть два атома водорода (относительная атомная масса = 1), один серы (относительная атомная масса = 32) и три атома кислорода (относительная атомная масса = 16), итого:
Формула масса = ( 2 × 1) + (1 × 32) + (3 × 16) = 82
Таким образом, формульная масса сернистой кислоты равна 82.
Обратите внимание, что в периодической таблице указаны более точные относительные атомные массы, но это только для учета для разных изотопов элементов иногда встречается природа. Во многих ситуациях вы можете просто округлить эти цифры до ближайшего целого числа.
Семь сильных кислот
Если вы изучаете химию, вам, несомненно, нужно знать 7 сильных кислот. Прочтите это руководство, чтобы узнать, что такое 7 сильных кислот, почему они важны и почему они не обязательно самые опасные кислоты, с которыми вы будете работать в лаборатории.
Что такое сильная кислота?
Когда кислота обозначается как сильная кислота, на самом деле это не имеет никакого отношения к тому, насколько она сильна или вызывает коррозию. «Сила» кислоты просто означает ее способность выделять ионы водорода в раствор. Сильные кислоты — это кислоты, которые полностью диссоциируют на ионы в воде. Это означает, что в растворе все их молекулы распадаются. Сильные кислоты дают по крайней мере один катион водорода (H + ) на молекулу. С другой стороны, слабые кислоты диссоциируют менее 1%, что означает, что очень немногие их молекулы распадаются с высвобождением иона водорода.
Почему это важно? Это связано с химическими реакциями.Вот реакция ионизации сильной кислоты, соляной кислоты:
HCl → H + + Cl —
Обратите внимание на наличие в продукте иона водорода. Весь реагент (HCl) был ионизирован во время реакции. Также обратите внимание, что реакция идет только в одном направлении. После ионизации сильной кислоты реакция останавливается и необратима.
Вот реакция этановой кислоты, слабой кислоты:
CH 3 COOH + H 2 O ⇆ H 3 O + + CH 3 COO —
Обратите внимание, что стрелка реакции указывает в обоих направлениях.Это означает, что реакция протекает в обоих направлениях, чего нельзя сказать о сильных кислотах. Слабые кислоты лишь слегка диссоциируют, и их ионы водорода будут продолжать перемещаться между частью слабой кислоты и частью воды. Эта реакция обратима и много раз обратится, реформируя кислоту.
В следующем разделе мы перечислим все 7 сильных кислот, и мы рекомендуем вам запомнить их. Однако, если вы забыли, сильная или слабая кислота, вы также можете посмотреть на ее константу равновесия / константу диссоциации кислоты (K a ). Сильные кислоты будут иметь большие значения для K a , в то время как слабые кислоты будут иметь очень маленькие значения для K a .
Список сильных кислот
Есть только 7 сильных кислот; все остальные кислоты слабые. Они перечислены ниже по названию и химическому составу.
Название кислоты | Химический состав |
Хлорная кислота | HClO 3 |
Бромистоводородная кислота | HBr |
Кислота соляная | HCl |
Йодоводородная кислота | HI |
Азотная кислота | HNO 3 |
Хлорная кислота | HClO 4 |
Серная кислота | H 2 SO 4 |
Сильные кислоты и концентрированные кислоты
Важно понимать, что сильные / слабые кислоты — это не то же самое, что концентрированные / разбавленные кислоты.Эти термины часто используются неправильно и неправильно заменяют друг друга! Концентрация кислоты означает количество воды или растворителя в ней. Концентрированная кислота содержит небольшое количество воды, тогда как разбавленная кислота содержит большое количество воды. У вас может быть сильная разбавленная кислота, а также слабая концентрированная.
Не существует стандартной концентрации, определяющей, является ли вещество концентрированным или разбавленным, но, как правило, концентрированные кислоты будут иметь pH около 3, а разбавленные кислоты будут иметь pH ближе к 7.
Сильные кислоты против коррозионных кислот
То, что кислота сильная, не означает, что она вызывает коррозию. Коррозионная активность означает, насколько вещество повреждает поверхность, к которой прикасается. Живая ткань (например, кожа, глаза и т. Д.) Часто используется в качестве ориентира, поскольку люди хотят знать любые потенциальные риски веществ, с которыми они работают.
Некоторые химические вещества настолько едкие, что могут разъедать плоть и кости, но, опять же, сила кислоты не связана с тем, насколько она едкая.Эти два термина измеряют разные, не связанные между собой вещи. Некоторые сильные кислоты очень едкие, такие как соляная кислота (которая может разъедать нержавеющую сталь) и серная кислота (которая обычно используется в качестве очистителя канализации). Однако слабые кислоты также могут быть чрезвычайно едкими, например фтористоводородная кислота, которая может декальцинировать кости.
Когда едкие кислоты разбавляются, они часто будут иметь меньший коррозионный эффект из-за их низкой концентрации. В этом случае они могут действовать только как раздражитель и вызывать более легкие реакции, такие как зуд или покраснение кожи.
Кислоты, оксиды и основания могут вызывать коррозию. Слово «каустик» иногда используется как синоним коррозионного вещества, но оно может относиться только к сильным основаниям, а не к любым кислотам.
Резюме: список сильных кислот
Существует 7 сильных кислот: хлорная кислота, бромистоводородная кислота, соляная кислота, йодистоводородная кислота, азотная кислота, хлорная кислота и серная кислота. Однако принадлежность к списку сильных кислот не указывает на то, насколько они опасны или вредны.Сильные кислоты и основания — это просто те кислоты, которые полностью диссоциируют в воде.
Слабые кислоты (все остальные кислоты) диссоциируют лишь в небольшом количестве. Коррозионная активность кислоты — это мера того, насколько она разрушительна для таких поверхностей, как металл или кожа. Кислота может быть сильной, но довольно безопасной в обращении, если она имеет низкую коррозионную активность, но слабые кислоты также могут быть очень коррозионными, и с ними очень опасно работать, если не приняты надлежащие меры безопасности.
Что дальше?
Что такое динамическое равновесие и какое отношение оно имеет к ржавым автомобилям? Узнайте, прочитав наше полное руководство по динамическому равновесию.
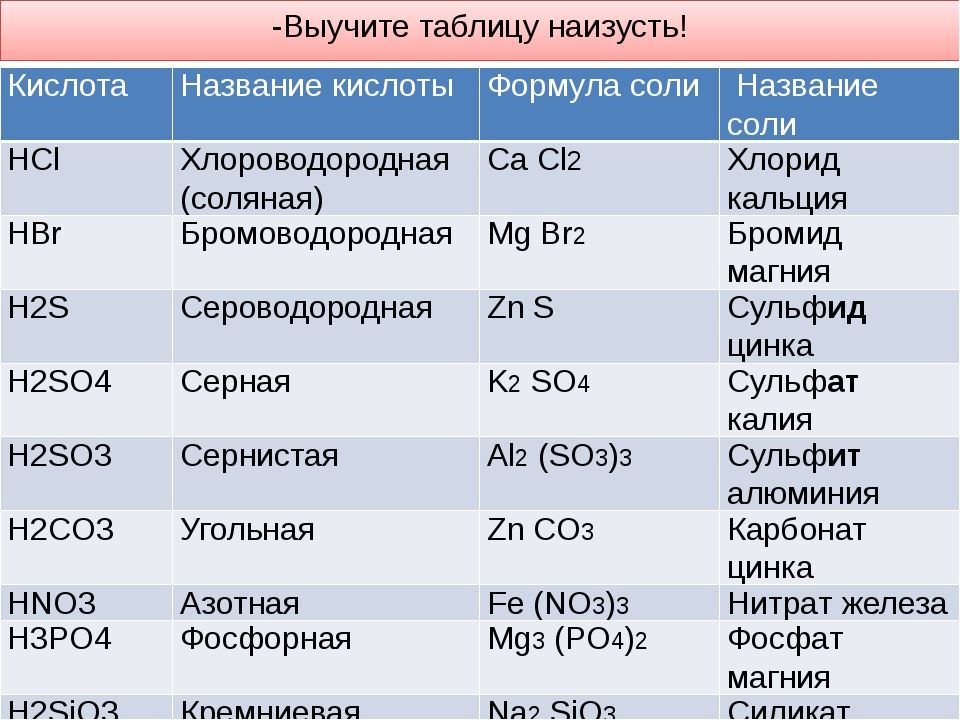
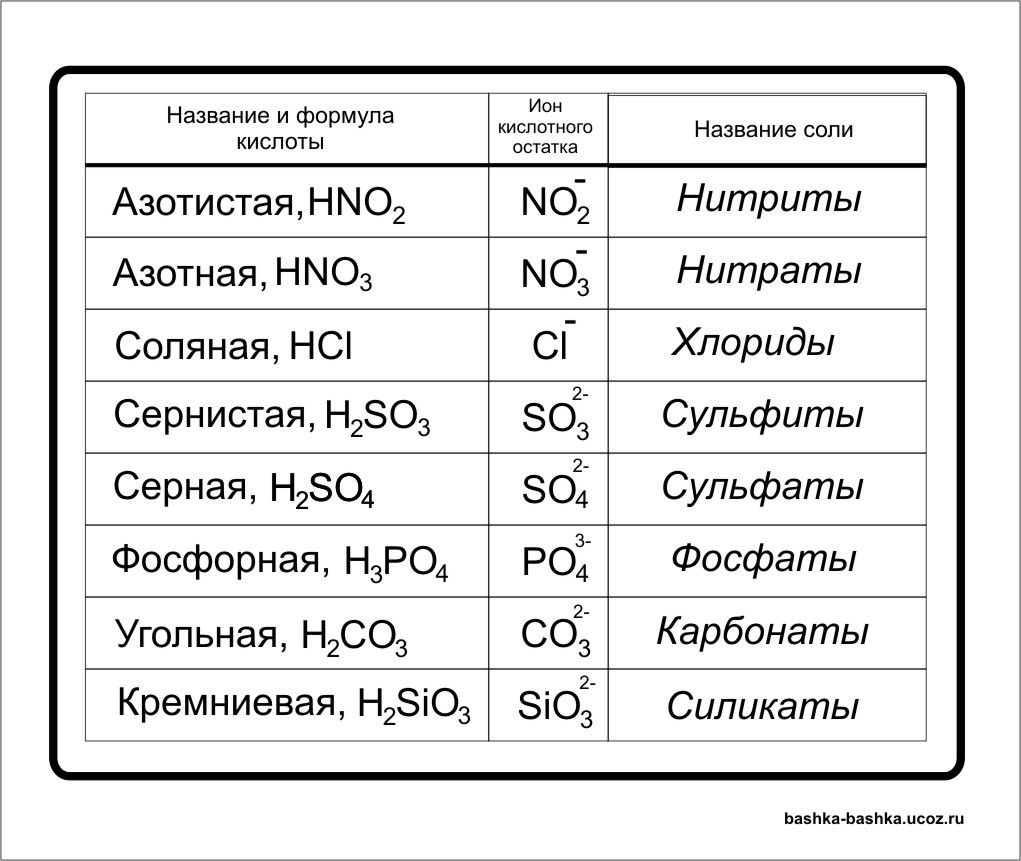
 2 * 10 9
2 * 10 9  4 * 10 1
4 * 10 1  3 * 10 -2
3 * 10 -2  1 * 10 -3
1 * 10 -3  8 * 10 -4
8 * 10 -4  Два общих индикатора — это лакмусовая бумажка и фенолфталеин. Синий лакмус становится красным в присутствии кислоты, а фенолфталеин становится бесцветным.
Два общих индикатора — это лакмусовая бумажка и фенолфталеин. Синий лакмус становится красным в присутствии кислоты, а фенолфталеин становится бесцветным.