Кислоты
Кислоты бывают:
бескислородные: хлороводородная (соляная) HCl, сероводородная H2S
кислородосодержащие: азотная HNO3, серная H2SO4 и т.д.
• По числу атомов водорода: одноосновные (HNO3), двухосновные (H2SO4) трехосновные (H3PO4).
• По растворимости: растворимые, нерстворимые (см. таблицу растворимости)
На рисунке слева представлена небольшая часть уже знакомой тебе таблицы растворимости. Под общим названием анионы расположены различные отрицательно заряженные ионы, кроме гидроксид иона ОН— все остальные – это ионы кислотных остатков.
При пересечении, например столбца иона водорода Н+
 Это значит, что соляная кислота HCl растворяется в воде. Так определяют растворимость кислот.
Это значит, что соляная кислота HCl растворяется в воде. Так определяют растворимость кислот.Запомни: Оксид, которому соответствует кислота называется кислотный оксид: S > SO3 > H2SO4 . Кслотный оксид SO3, ему соотвествует серная кислота.
Вопрос: Как составить формулу оксида соответствующего данной кислоте?
Пример: Для серной кислоты составим соответствующий оксид. Для этого:
1. Определим степень окисления элементов в кислоте.
H2SO4 — формула серной кислоты
 Подставим все степени окисления в формулу серной кислоты.
Подставим все степени окисления в формулу серной кислоты.H2+1SхO4-2 т.к. для химического соединения в сумме все степени окисления равны 0, можно составить уравнение:
+1 • 2 + х + (-2) • 4 = 0
решим его:
2 + х – 8 = 0
Х = +6
все степени окисления известны: H2+1S+6O4-2
2. Степень окисления серы в серной кислоте +6. Составим оксид соответствующий серной кислоте: S+6O3-2или SO3.
Таблица кислот и оксидов
Табл.1
В таблице представленны формулы кислот, их названия и оксиды, соответствующие данной кислоте.
* * *
.
Сериал «Во все тяжкие»: сколько в нем реальной науки?
Автор фото, AMC
Подпись к фото,Уолт Уитман, учитель химии и наркобарон
Известный американский телесериал Breaking Bad («Во все тяжкие») вступил в заключительную фазу — с 11 августа выходят в свет последние восемь эпизодов. Его обожатели строят сейчас предположения, чем закончится история школьного учителя из американской глубинки, который сделался сначала изготовителем метамфитамина, а затем главой преступной группировки. Но вот химика доктора Джонатана Хэйра интересует совсем другой вопрос — насколько достоверна научная подоплека этого незаурядного телеповествования.
«Химию нужно уважать», — говорит главный герой фильма Уолтер Уайт. Он в прошлом блестящий химик, которому по семейным обстоятельствам пришлось оставить научную карьеру и стать учителем химии в заурядной средней школе в городе Альбукерке в штате Нью-Мексико.
Обнаружив, что он болен неоперабельным раком легких, он решает обеспечить семью после своей смерти и принимается за изготовление опаснейшего наркотического средства — метамфетамина — в партнерстве со своим бывшим учеником Джесси Пинкманом.
Хотя отношения между ними поначалу настороженные, и Джесси весьма раздражает учительский тон Уолта, вскоре он убеждается, что его бывший учитель способен производить кристаллы метамфетамина высочайшего качества.
Уолт не может удержаться от учительского соблазна и превращает процесс изготовления или «варки» мефамфетамина в увлекательные уроки химии.
Насколько научно достоверными являются его уроки?
Голубые кристаллы
Изготовляемые Уолтом в походной лаборатории, укрытой в трейлере, кристаллы имеют необычный голубой оттенок и отличаются невероятной чистотой. Это увлекательная подробность, но обычно цвет кристалла не свидетельствует о его химической чистоте. Примеси в минералах типа кварца могут делать их розовыми или фиолетовыми (аметист), но обычно цвет является результатом взаимодействия электронов вещества с видимым светом и не является показателем беспримесности.
Примеси в минералах типа кварца могут делать их розовыми или фиолетовыми (аметист), но обычно цвет является результатом взаимодействия электронов вещества с видимым светом и не является показателем беспримесности.
Фосфиновый газ
Автор фото, AMCВ одной из первых сцен телесериала Уолт оказывается в своей передвижной лаборатории, укрытой в пустыне Нью-Мексико, под дулами пистолетов двух гангстеров. Он на ходу приходит к мысли покончить с ними, бросив порошок красного фосфора в колбу с кипятком. Уолту удается выскочить из автофургона и запереть в нем гангстеров, которые гибнут от образовавшегося в результате реакции фосфинового газа.
Красный фосфор может реагировать с водородом, но не с горячей водой. Так что это не очень правдоподобно с научной точки зрения. Правда, белый фосфор может дать такую реакцию, но только в сочетании с гидроксидом натрия, широко распространенном в быту. Но об этом Уолт ничего не рассказывает Джесси.
Ванна для растворения трупов
Автор фото, AMC
На самом деле от газа гибнет только один из гангстеров. Уолт убивает другого, но теперь ему надо избавиться от трупа. В жуткой сцене Джесси наполняет ванну фтористоводородной кислотой, чтобы растворить в ней тело. Эта кислота, которая еще называется плавиковой, обладает необычными химическими свойствами. Она растворяет стекло и хранить ее приходится в пластиковых емкостях.
Это очень едкая кислота, но ее едкость определяется ее химическими свойствами, а не концентрацией, как говорится в фильме. К сожалению, Джесси не следует настойчивыми указаниям Уолта о приобретении пластиковой бочки, а просто сливает кислоту в обычную чугунную эмалевую ванну. В результате кислота не только растворяет труп, но проедает чугун и бетонное перекрытие, и остатки ванны обрушиваются в подвал.
Самопальная батарея
В другом эпизоде Уолт и Джесс занимаются «варкой» метамфетамина в пустыне, но когда настает время возвращаться, оказывается, что аккумулятор древнего автофургона безнадежно разрядился и мотор не завести.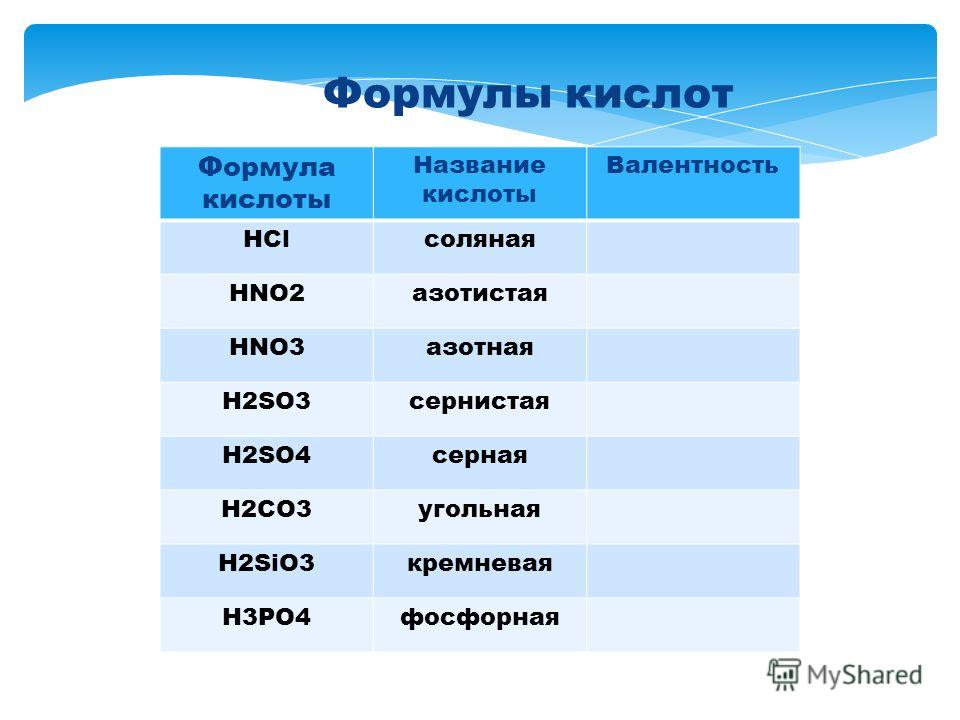
Все, кому в детстве делали ртутные пломбы, знают о странном ощущении, которое возникает, если взять в рот кусочек алюминиевой фольги. Это классический пример из урока электрохимии. Слюна выполняет роль электролита, так как является слабой кислотой. Объяснения Уолта вполне правдоподобны, но, к сожалению, изготовленная им батарея не могла дать тока достаточной силы, чтобы провернуть стартер.
Гремучая ртуть
Автор фото, AMC
Еще один эпизод — в нем Уолт решает раз и навсегда покончить с гангстером и убийцей Туко. Он приходит к нему в контору и предлагает ему порцию кристаллов метамфетамина, но при этом требует немедленной оплаты.
Гремучая ртуть или фульминат ртути действительно является весьма неустойчивым и взрывоопасным соединением, и в школьной химической лаборатории его можно изготовить без особого труда.
Но уже кристаллы с размерами более 3-5 мм являются крайне неустойчивыми и могут в любой момент взорваться. Пластиковый мешок, который Уолт вручает Туко, по виду содержит граммов 200 крупных кристаллов гремучей ртути. Такое количество должно взрываться от малейшего сотрясения, и у Уолта не было бы ни малейшего шанса донести его до места. Правда, если бы ему это каким-то чудом удалось, взрыв был бы действительно крайне мощным.
Термитная смесь
Уолт и Джесси выжигают замок в стальной двери, чтобы пробраться на склад с химикатами. Уолт рассказывает Джесси, что для этого он применил термитный заряд. Термит представляет собой смесь оксида железа с порошком алюминия или другого металла с высокой реактивной способностью. Температура их реакции обычно очень высока и термитная смесь широко используется при сварке железнодорожных рельсов, например, или при вскрытии сейфов. С научной точки зрения с этим эпизодом всё в порядке.
Уолт рассказывает Джесси, что для этого он применил термитный заряд. Термит представляет собой смесь оксида железа с порошком алюминия или другого металла с высокой реактивной способностью. Температура их реакции обычно очень высока и термитная смесь широко используется при сварке железнодорожных рельсов, например, или при вскрытии сейфов. С научной точки зрения с этим эпизодом всё в порядке.
Кислоты
3. КИСЛОТЫ
Кислотами называются сложные вещества, состоящие из атомов водорода и кислотных остатков.
С
точки зрения
теории
электролитической
диссоциации
кислоты это
электролиты, диссоциирующие
в водных
растворах
на катионы
только водорода
Н
Если кислота одноосновная, то она диссоциирует в одну ступень:
HCI H+ + CI
HNO3 H+ + NO3
Если кислота многоосновная, то она диссоциирует ступенчато:
H3PO4 H+ + H2PO4 (первая ступень),
H2PO4 H+ + HPO42 (вторая ступень),
HPO42 H+ + PO43
(третья
ступень).
Ступенчатой диссоциацией многоосновных кислот объясняется образование кислых солей.
Номенклатура кислот.
1. Бескислородные кислоты
В бескислородных кислотах называется кислотообразующий элемент и добавляется окончание водородная:
HCl хлороводородная кислота
H2S сероводородная кислота
2. Кислородосодержащие кислоты.
Составление названий кислородосодержащих кислот рассмотрим на следующих примерах:
H2SO4 серная кислота,
H3AsO4 мышьяковая кислота.
Называется кислотообразующий элемент с суффиксом н или ов (если степень окисления элементов максимальная).
Если степень окисления элемента промежуточная, то в названии используется еще и суффикс ист:
H2SO3 сернистая кислота,
H3AsO3 мышьяковистая
кислота.
Когда элемент образует много кислородсодержащих кислот (например, хлор), то, по мере убывания степени окисления кислотообразующего элемента, они имеют следующие названия:
HO4 хлорная кислота;
HO3 хлорноватая кислота;
HO2 хлористая кислота;
HO хлорноватистая кислота.
Иногда в молекулах кислородосодержащих кислот элемент имеет одинаковую степень окисления, тогда в названии используются приставки, которые указывают на различное содержание воды в кислоте:
мета — мало воды,
орто — много воды.
Например:
P2O5 + H2O → 2HO3 метафосфорная кислота,
P2O5 + 3H2O → 2H3O4 ортофосфорная кислота.
При составлении формул придерживаются следующих правил:
1. Бескислородные кислоты.
Зная
название
кислоты,
записываем
сначала
водород, а затем
кислотообразующий
элемент. Степень окисления
водорода в
кислотах
всегда +1. Степень
окисления
элемента
отрицательная.
Она равна
номеру
группы ПСЭ (в
которой
находится
элемент)
минус восемь.
Степень окисления
водорода в
кислотах
всегда +1. Степень
окисления
элемента
отрицательная.
Она равна
номеру
группы ПСЭ (в
которой
находится
элемент)
минус восемь.
Например: сероводородная кислота элемент сера, расположен в шестой группе ПСЭ. 6 — 8 = -2. Степень окисления серы 2. Записываем символы водорода и серы Н+S-2, т.к. молекула электронейтральна, то формула кислоты будет Н2S.
2. Кислородсодержащие кислоты.
По суффиксам в названии кислоты определяем степень окисления кислотообразующего элемента. Эта степень окисления сохраняется в кислотном оксиде. По приставке в названии определяем количество воды в кислоте.
Например:
метафосфорная
кислота
кислотообразующий
элемент
фосфор.
Суффикс н показывает,
что он имеет
максимальную
степень
окисления,
фосфор в
пятой группе
ПСЭ,
следовательно,
максимальная
степень
окисления +5,
она
сохраняется
и в оксиде
фосфора Р2+5О5-2.
Приставка
мета
говорит о
том, что воды
в кислоте
минимальное
количество.
В формулах кислородосодержащих кислот сначала записывается водород, затем кислотообразующий элемент и кислород. Индексами выравнивают число положительных и отрицательных зарядов. Если они четные, то их сокращают и ставят перед формулой соответствующий коэффициент.
+5 -2
P2O5 + H2O → H2P2O6 → 2HPO3 метафосфорная кислота,
+5 -2
P2O5 + 2H2O → H4P2O7 пирофосфорная кислота,
+5 -2
P2O5 + 3H2O → H6P2O8 → 2H3PO4 ортофосфорная кислота.
Классификация кислот по следующим признакам:
По содержанию кислорода:
1. Кислородосодержащие
2. Бескислородные
Бескислородные
HNO3, H2SO4, H3PO4 HCl, HJ, H2S
По основности
(по числу атомов водорода в молекуле кислоты)
1. Одноосновные 2. Многоосновные
HCl, HNO3, HBr H2SO4, H3PO4, H2S
По силе (по степени диссоциации)
1. Сильные (α =100 %) 2. Слабые (α < 100 %)
HCl, HNO3, H2SO4 H2S, HNO2, H2CO3
По растворимости
1. Растворимые
2. Нерастворимые
Растворимые
2. Нерастворимые
HCl, HNO3 H2SiO3, H2MoO4
Получение
1. Бескислородные кислоты получают синтезом из простых веществ летучих соединений с последующим растворением их в воде. Например:
H2 + Cl2 → 2HCl хлороводород, газ. Растворяем его в воде, получаем HCl хлороводородную кислоту жидкость.
2. Растворение соответствующего оксида в воде:
P2O5 + 3H2O → 2H3PO4.
3. Электролиз растворов солей:
Na2SO4 + 4H2O H2SO4 +2H2+O2+2NaОН.
4. Взаимодействие растворимой соли с сильной кислотой (получают нерастворимые, легколетучие, слабые кислоты):
Na2SiO3 + 2HCl → 2NaCI + H2SiO3
H2O
Na2CO3 + 2HCl → 2NaCI + H2 CO3
CO2
Физические свойства
Большинство
неорганических
кислот жидкости,
смешивающиеся
с водой в
любых соотношениях,
затвердевающие
при низких
температурах;
фосфорная
кислота —
кристаллическое,
похожее на
лед вещество,
хорошо
растворяется
в воде. Кремниевая
кислота
твердое
вещество,
нерастворимое
в воде.
Некоторые
кислоты
существуют
только в
растворе H2Cr2O7, HMnO4.
Их гидратированные
анионы
окрашены в
характерные
цвета: оранжевый,
фиолетовый.
Наконец,
такие
кислоты, как хлороводородная,
бромоводородная
летучие,
поэтому
обладают
резким
запахом. Кислоты
имеют кислый
вкус.
Кислоты
имеют кислый
вкус.
Химические свойства
1. Изменение цвета индикаторов:
фенолфталеин бесцветный,
лакмус розовый,
метилоранж красный.
2. Взаимодействие с основаниями с образованием соли и воды (реакция нейтрализации):
H2SO4 + 2NaOH → Na2SO4 + 2H2O.
3. Взаимодействие с основными оксидами:
H2SO4 + Na2O → Na2SO4 + 2H2O.
4. Взаимодействие с солями:
а) менее летучие кислоты вытесняют более летучие из их солей:
H2SO4 + NaCI → NaHSO4 + HCI
конц. тверд.
б) более сильные кислоты вытесняют менее сильные из растворов их солей:
3HCI + Na3PO4 → 3NaCI + H3PO4.
5. Взаимодействие с металлами различных кислот протекает согласно положению металлов в ряду напряжений, который характеризует окислительно-восстановительную способность электрохимической системы металл — ион металла.
Li К Ca Мg Al Ti Cr Zn Fe Ni Sn Pb H Cu Ag Au
Исходя из этого, все металлы удобно разделить на три условные группы:
Активные | Средней активности | Малоактивные |
Li К Ca Мg Al | Ti Cr Zn Fe Ni Sn Pb | Cu Ag Au |
Взаимодействие металлов с хлороводородной кислотой
.
Активные | Средней активности | Малоактивные |
Реагируют | Реагируют (пассивируется Pb) | Не реагируют |
Например:
Zn +2HCI → ZnCI2 + H2
Щелочные и щелочноземельные металлы с растворами кислот взаимодействуют в две стадии:
Na + HCI NaCI + H2
1).2Na + 2H2O → 2NaОН + H2
2). NaОН + HCI→ NaCI + H2O.
Малоактивные металлы, расположенные в ряду напряжений правее водорода, из разбавленного раствора кислоты его не вытесняют:
Cu + HCl
Взаимодействие металлов с разбавленной серной кислотой
Активные | Средней
актив. | Малоактивные |
Реагируют | Реагируют (пассивируется Pb) | Не реагируют |
Например:
Zn + H2SO4 → ZnSO4 + H2
Малоактивные металлы, расположенные в ряду напряжений правее водорода, из разбавленного раствора кислоты его не вытесняют:
Cu + H2SO4
Взаимодействие металлов с концентрированной серной кислотой
Активные | Средней активности | Малоактивные |
Реагируют | Реагируют (пассивируются Al, Fe) | Реагируют Сu, Hg не реагируют Ag, Au, Pt |
В результате взаимодействия образуются сульфат металла, вода и один из продуктов окисления серной кислоты:
S , H2S, SO2 | S , H2S, SO2 | SO2 |
Например: Zn + 2H2SO4(К) → ZnSO4 + SO2 + 2H2O,
4Zn + 5H2SO4(К) → 4ZnSO4 + H2S + 4H2O,
3Zn + 4H2SO4(К) → 3ZnSO4 + S + 4H2O,
2H2SO4(к) + Сu → Сu SO4 + SO2 + 2H2O.
Холодная концентрированная серная кислота пассивирует Al, Fe; при нагревании пассивирующие пленки растворяются, и взаимодействие с кислотой протекает интенсивно.
Взаимодействие металлов с разбавленной азотной кислотой
Активные | Средней активности | Малоактивные |
Реагируют | Реагируют (пассивируется Ti) | Реагируют Сu, Hg Ag, не реагируют Au, Pt |
В результате взаимодействия образуются нитрат металла, вода и один из продуктов окисления азотной кислоты:
NH3, NH4NO3 | N2 или N2O | NO |
Например:
10HNO3 + 4Mg → 4Mg(NO3)2 + NH4NO3 + 3H2O.
Взаимодействие металлов с концентрированной азотной кислотой
Активные | Средней активности | Малоактивные |
Реагируют | Реагируют (пассивируются Ti, Al, Cr, Fe) | Реагируют Сu, Hg Ag, не реагируют Au, Pt |
В результате взаимодействия образуются нитрат металла, вода и NO2 (газ бурого цвета). При взаимодействии с кислотой активных металлов возможно выделение N2O.
Например:
4HNO3 + Сu → Сu (NO3)2 + 2NO2 +
2H2O.
10HNO3 + 4Са → 4Са (NO3)2 + N2O + 5H2O.
При взаимодействии азотной кислоты любой концентрации и концентрированной серной с металлами водород никогда не выделяется.
Холодная концентрированная азотная кислота пассивирует следующие металлы Fe, Cr, Al, Ti, но при нагревании взаимодействие этих металлов с кислотой протекает энергично.
6. Взаимодействие с неметаллами азотной и концентрированной серной кислот:
3P + 5HNO3 + 2H2O → 3H3PO4 + 5NO,
C + 2H2SO4(к) → CO2 + 2SO2 + 2H2O.
7. При нагревании некоторые кислоты разлагаются:
H2SiO3 H2O + SiO2.
Ход работы:
Опыт № 1. Взаимодействие кислотного оксида
с водой
Стеклянной палочкой взять кусочек оксида фосфора (V) и смешать его с небольшим количеством воды. В полученный раствор добавить 23 капли лакмуса. Написать уравнение реакции.
Опыт № 2. Взаимодействие соли с кислотой
Положить в пробирку немного сухого ацетата натрия
CH3COONa или другой соли уксусной кислоты и добавить небольшое количество разбавленной серной кислоты. Образовавшаяся кислота может быть обнаружена по запаху. При выяснении запаха нельзя нюхать вещество прямо из пробирки, так как вдыхание газов и паров может вызвать сильное раздражение дыхательных путей. Необходимо ладонью руки сделать легкие движения от пробирки к носу. В этом случае в нос будет попадать смесь газа с воздухом и сильного раздражения не произойдет.
В пробирку внести 56 капель концентрированного раствора силиката натрия Na2SiO3 и постепенно добавить 56 капель соляной кислоты, непрерывно встряхивая пробирку. Образуется студнеобразный осадок. Подействовать на полученный осадок раствором щелочи и серной кислоты. Отметить изменения в пробирках и написать уравнения реакций.
Опыт № 3. Взаимодействие основного оксида с кислотой
К небольшому количеству оксида магния в пробирке прилить небольшое количество соляной кислоты. Отметить растворение осадка. Написать уравнения реакции. Какая соль образовалась?
Опыт № 4. Взаимодействие основания с кислотой
(реакция нейтрализации)
Налить в фарфоровую чашку 10 см3 2 моль/дм3 раствора гидроксида натрия. Добавить 12 капли фенолфталеина, чтобы окраска стала малиновой, что подтверждает наличие щелочи в растворе. Затем в пробирку по каплям добавлять раствор соляной кислоты, до обесцвечивания раствора. Выпарить содержимое чашки и убедиться, что образовалась соль. Написать уравнение реакции.
Роль жирных кислот в организме человека
Омега-3, омега-6, омега-9: что такое жирные кислоты и зачем они нужны
Что такое омега жирные кислоты? Жиры — природные органические соединения, представляющие собой полные сложные эфиры трехатомного спирта глицерина ижирных кислот. Все жирные кислоты имеют четное число атомов углерода, которые присоединены друг к другу по цепи. Некоторые из них имеют простые связи между атомами углерода и называются насыщенными жирами, другие же имеют двойные связи и считаются ненасыщенными. Омега-3, омега-6 и омега-9 — все эти типы естественных ненасыщенных жиров, которые большинство экспертов в области здорового питания считают значительно полезнее, чем насыщенные жиры.
Если обратиться к химической структуре — начало углеродной цепи называется «альфа», а ее конец — «омега». Омега-3 кислоты имеют тройку в названии, потому что первая молекула с двойной связью находится на три атома углерода от омега-конца (то же самое — с омега-6 и омега-9 жирными кислотами). Условно все жирные кислоты делят на две группы:
- мононенасыщенные — соседние атомы углерода имеют не более одной двойной связи (омега-9). Эти кислоты не относятся к группе незаменимых кислот.
- полиненасыщенные – здесь связей больше (омега-3 и омега-6).Полиненасыщенные жирные кислоты являются одним из очень важных базовых элементов здоровья человека и относятся к незаменимым факторам питания. Они не образуются в организме и должны поступать с пищей.
Наиболее изученными жирными кислотами являются:
из Омега -9:
- олеиновая кислота
- эруковая кислота
- эйкозеновая кислота
- мидовая кислота
- элаидиновая кислота
- нервоновая или селахолевая кислота
Источниками Омега- 9 являются: оливковое масло, арахис, авокадо, орехи и семечки, семена горчицы, льна, кунжута, а также лососевые рыбы.Некоторые из входящих в комплекс Омега -9 жирных кислот при чрезмерном и несбалансированном поступлении имеют свойство накапливаться в организме, что, разумеется, не очень хорошо для здоровья человека. Полезным в Омега -9 является то, что они повышают усвоение глюкозы и этим предупреждают развитие диабета и метаболического синдрома, предотвращают развитие рака молочной железы у женщин, а также участвуют в укреплении иммунитета. Кроме того, Омега -9 снижают уровень холестерина в крови и препятствуют оседанию холестериновых бляшек на стенках сосудов, снижая таким образом риск развития атеросклероза. Омега- 9 снижают риск развития хронических воспалений в организме за счет улучшения тканевого метаболизма. Суточная норма потребности организма человека в мононенасыщенных жирах Омега-9 колеблется в пределах 15-20% от общей калорийности пищевого рациона. В зависимости от общих показателей здоровья, возрастных особенностей и условий проживания, показатель суточной потребности может изменяться.
из Омега- 6:
- линолевая (ЛК, или, в англоязычном варианте, LA)
- арахидоновая (АРК или ARA)
Источники Омега-6 весьма обширны: в первую очередь это растительные масла — пальмовое, соевое, рапсовое, подсолнечное, энотеры, бораго, чёрной смородины, соевое, конопляное, кукурузное, хлопковое и сафлоровое. Кроме растительных масел, Омега- 6 много в мясе птицы, яйцах, подсолнечных и тыквенных семечках, авокадо, злаках и хлебе, орехах кешью, пекан и кокосовых. Омега-6 обеспечивает здоровье нашей коже и снижает уровень холестерина, улучшает свёртываемость крови, снимает воспаления, ослабляет боль. Потребность организма в Омега-6 индивидуальна для каждого человека и находится в пределах 4,5 – 8 граммов в день (5 – 8% от общей калорийности пищевого рациона).
При этом важно соблюдать соотношение Омега-3 и Омега-6 в рационе. Оптимальным соотношением Омега-3 и Омега- 6 является 1:4, но к сожалению в современном питании это соотношение иногда перекошено в пользу Омега-6 подчас в десятки раз.
из Омега- 3:
- эйкозапентаеновая (ЭПК или EPA)
- докозагексаеновая (ДГК, или DHA)
- альфа-линоленовая (АЛК или ALA)
Источником Омега -3 является, прежде всего, морская рыба. Больше всего Омега-3 содержит жирная и полужирная рыба (скумбрия, сардина, лосось, тунец и др.). Наибольшая польза от свежей рыбы, но есть жирные кислоты и в рыбных консервах в масле.
Из растений наибольшим содержанием Омега-3 могут похвастаться льняное семя и кунжут. Поэтому льняным и кунжутным маслом рекомендуется заправлять овощные салаты. Можно употреблять и порошок из семени льна, он хорош тем, что в нем еще и содержится клетчатка. Много Омега-3 в грецких орехах. Есть Омега-3 (хотя и в меньших количествах) в фасоли, цветной капусте, шпинате, брокколи.
Основная польза омега — 3 жирных кислот заключена в их способности укреплять структуру клеточных мембран. Попадая внутрь организма, кислоты улучшают клеточную деятельность, что естественным образом влияет на нормальное функционирование всех органов и систем организма.
Достаточное количество в организме омега- 3 жирных кислот позволяет достичь следующих результатов:
- улучшается работа мозга, сердечно — сосудистой системы и ЖКТ;
- нормализуется эмоциональное и психологическое состояние человека, после чего пропадает хроническая усталость, раздражение, депрессия;
- пропадают болевые ощущения и воспаление при артрозе и ревматизме;
- улучшается половая функция у мужчин;
- понижается уровень холестерина;
- улучшается работа нервной системы;
- стимулируются репродуктивная система;
- укрепляется иммунная система и выравнивается гормональный фон;
- повышается способность организма к регенерации, быстрому заживлению ран и повреждений внутренних органов;
- организм омолаживается естественным образом, повышается тонус и эластичность кожи, укрепляются ногти и волосяные луковицы;
- существенно снижается вероятность развития онкологических заболеваний.
Современные исследования установили, что на сегодняшний день среднестатистический человек потребляет этих полезных жиров непозволительно мало. Было установлено, что в рационе взрослого человека количество Омега-3 жиров составляет лишь 50-70% от жизненно необходимой нормы. Поэтому особое внимание следует уделять формированию своего пищевого рациона. Для этого необходимо знать, в каких продуктах можно найти эти необходимые Омега-3 жирные кислоты.
Оптимальное ежедневное потребление Омега-3 1 грамм в сутки. Именно такое количество необходимо для нормального функционирования клеток организма. Если перевести на пищевые продукты, то это (на выбор): 1 ст. ложка рапсового масла, 1 чайная ложка льняного семени, 5-10 штук не жареных орехов, 70 граммов лосося, 90 граммов консервированных сардин, 120 граммов тунца.
Противопоказаниями к употреблению омега- 3 являются:
- склонность к аллергии на любой вид морепродуктов;
- тяжёлые травмы, кровопотери;
- послеоперационный период;
- геморрой, болезни желчевыводящих путей, почек и печени;
- активная форма туберкулёза и некоторых заболеваниях щитовидной железы;
Но обычными последствиями, с которыми могут столкнуться здоровые люди при переизбытке омега- 3 в организме – это тошнота, диарея и другие проблемы с ЖКТ.
Для того чтобы Вы были здоровыми, бодрыми, энергичными, следует создавать свой пищевой рацион, сохраняя при этом оптимальный баланс жирных кислот.
Врач – диетолог
Л.В. Иванович
| Формула кислоты | Название кислоты | Формула кислотного остатка |
Название кислотного остатка |
| HNO2 | Азотистая | NO2- | Нитрит |
| HNO3 | Азотная | NO3- | Нитрат |
| HBr | Бромоводород (Бромистоводородная кислота) | Br— | Бромид |
| HVO3 | Ванадиевая | Ванадаты | |
| H2WO4 | Вольфрамовая | Вольфраматы | |
| H4P2O7 | Дифосфорная | Пирофосфаты или дифосфаты (по номенклатуре IUPAC) |
|
| H2Cr2O7 | Дихромовая | Cr2O72- | Дихромат |
| H2SiO3 | Кремниевая | SiO32- | Силикат |
| HMnO4 | Марганцовая | MnO4— | Перманганат |
| HCOOH | Метановая, Муравьиная | HCOO— | Формиат |
| H3AsO4 | Мышьяковая (Ортомышьяковая) | AsO43- | Арсенат |
| H3BO3 | Ортоборная (Борная кислота) | Бораты | |
| H3PO4 | Ортофосфорная (Фосфорная кислота) | PO43- | Фосфат |
| HNCS | Роданистоводородная (тиоциановая) | Тиоцианаты | |
| C7H6O3 | Салициловая | Салицилаты | |
| H2S | Сероводород (Сероводородная кислота) | S2- | Сульфид |
| H2SO3S | Тиосерная | Тиосульфаты | |
| HF | Фтороводород (Плавиковая кислота) | F— | Фторид |
| HCl | Хлороводород (Соляная кислота) | Cl— | Хлорид |
| HI | Йодоводород (Йодоводородная кислота) | I— | Йодид |
| HCN | Циановодород (Синильная кислота) | CN— | Цианид |
| H2SO3 | Сернистая | SO32- | Сульфит |
| H2SO4 | Серная | SO42- | Сульфат |
| H2CO3 | Угольная | CO32- | Карбонат |
| H2CrO4 | Хромовая | CrO42- | Хромат |
| HClO | Хлорноватистая | ClO- | Гипохлорит |
| HClO2 | Хлористая | ClO2— | Хлорит |
| HClO3 | Хлорноватая | ClO3— | Хлорат |
| HClO4 | Хлорная | ClO4— | Перхлорат |
| CH3COOH | Этановая, Уксусная | CH3COO— | Ацетат |
| H2C2O4 | Этандиовая, Щавельная | C2O42- | Оксалат |
| C4H6O5 | Яблочная (оксиянтарная, гидроксибутандиовая) | Малаты |
Формула кислоты | Название кислоты | Название соответствующей соли |
| HAlO2 | Метаалюминиевая | Метаалюминат |
| HBO2 | Метаборная | Метаборат |
| h4BO3 | Ортоборная | Ортоборат |
| HBr | Бромоводородная | Бромид |
| HCOOH | Муравьиная | Формиат |
| HCN | Циановодородная | Цианид |
| h3CO3 | Угольная | Карбонат |
| h3C2O4 | Щавелевая | Оксолат |
| h5C2O2 (Ch4COOH) | Уксусная | Ацетат |
| HCl | Хлороводородная | Хлорид |
| HClO | Хлорноватистая | Гипохлорит |
| HClO2 | Хлористая | Хлорит |
| HClO3 | Хлорноватая | Хлорат |
| HClO4 | Хлорная | Перхлорат |
| HCrO2 | Метахромистая | Метахромит |
| HCrO4 | Хромовая | Хромат |
| HCr2O7 | Двухромовая | Дихромат |
| HI | Иодоводородная | Иодид |
| HMnO4 | Марганцевая | Перманганат |
| h3MnO4 | Марганцовистая | Манганат |
| h3MoO4 | Молибденовая | Молибдат |
| HNO2 | Азотистая | Нитрит |
| HNO3 | Азотная | Нитрат |
| HPO3 | Метафосфорная | Метафосфат |
| HPO4 | Ортофосфорная | Ортофосфат |
| h5P2O7 | Двуфосфорная (Пирофосфорная) | Дифосфат (Пирофосфат) |
| h4PO3 | Фосфористая | Фосфит |
| h4PO2 | Фосфорноватистая | Гипофосфит |
| h3S | Сероводородная | Сульфид |
| h3SO3 | Сернистая | Сульфит |
| h3SO4 | Серная | Сульфат |
| h3S2O3 | Тиосерная | Тиосульфат |
| h3Se | Селеноводородная | Селенид |
| h3SiO3 | Кремниевая | Силикат |
| HVO3 | Ванадиевая | Ванадат |
| h3WO4 | Вольфрамовая | Вольфрамат |
Часто задаваемые вопросы о бренде и средствах CeraVe
Насколько отличается содержание воды в увлажняющем лосьоне для сухой и очень сухой кожи лица и тела и увлажняющем креме для сухой и очень сухой кожи лица и тела CeraVe?
Основное различие в том, что лосьон содержит чуть больше воды, чем крем, что обеспечивает более легкую текстуру. Эффективность относительно уменьшения ТЭПВ (трансэпидермальной потери влаги) для этих двух формул почти не отличаются.
Какой тип гиалуроновой кислоты используется в средствах CeraVe (фрагментированная или нефрагментированная)?
Гиалуроновая кислота не содержится в мицеллярной воде. В остальных средствах используется нефрагментированная гиалуроновая кислота.
Является ли содержание гиалуроновой кислоты и ниацинамида одинаковым во всех средствах CeraVe?
Содержание этих компонентов в тех продуктах, в которых они содержатся, отличается в каждой формуле для достижения оптимальной эффективности в зависимости от типа средства.
Какую функцию выполняет диметикон в средствах ухода?
Диметикон широко известен своим смягчающим и защитным действием на кожу и способствует укреплению защитного кожного барьера. Он также помогает получить нужные эстетические характеристики текстуры средств.
Где в составе указаны названия церамидов 1, 3 и 6-II?
В соответствии с Международной номенклатурой косметических ингредиентов (INCI) наименование церамид 1 соответствует наименованию церамид EOP, Церамиду 3 соответствует название церамид NP, а церамид 6-II — наименование церамид AP.
Из каких источников получают церамиды, используемые в средствах CeraVe?
Церамиды в средствах CeraVe представляют собой полусинтетические церамиды растительного происхождения, одним из источников получения которых служат кукуруза и рапс. Эти 3 типа церамидов (1, 3 и 6-II), идентичных церамидам кожи, содержатся в средствах CeraVe в виде липидной смеси, которая также включает холестерин, и фитосфингозин. Эта смесь близка по составу к липидному барьеру кожи, поэтому способствует восстановления ее защитного барьера.
Как разработана технология MVE? Как она работает?
Технология MVE (Multi Vesicular Emulsions) основана на использовании бегентримония метосульфата в качестве эмульгатора, образующего сферы, которые включают кольцевые структуры из нескольких концентрических слоев, напоминающих структуру луковицы. Каждая сфера MVE состоит из ряда концентрических слоев и удерживающих такие компоненты, как церамиды, жирные кислоты и фитосфингозин.Технология MVE обладает несколькими преимуществами по сравнению с большинством формул для наружного применения. В отличие от быстрого разового высвобождения компонентов, сферы, входящие в структуру MVE от CeraVe, высвобождаются постепенно, обеспечивая длительное увлажнение кожи. С течением времени слои медленно растворяются друг за другом, высвобождая основные компоненты CeraVe на поверхность кожи, пополняя запас церамидов, и восстанавливая барьерную функцию кожи.
Почему в качестве звездных компонентов CeraVe были выбраны церамиды?
Недостаток церамидов наблюдается при разных состояниях кожи. При нанесении на сухую кожу три основных типа церамидов в средствах CeraVe помогают восстановить ее защитный барьер, уменьшая сухость проблемных участков. Эти 3 типа церамидов (1, 3 и 6-II), идентичных церамидам кожи, содержатся в средствах CeraVe в виде липидной смеси, которая также включает холестерин, и фитосфингозин. Эта смесь близка по составу к липидному барьеру кожи, поэтому способствует восстановления ее защитного барьера.
Чем технология MVE отличается от других систем доставки?
Эта запатентованная технология уникальна. Она позволяет церамидам и фитосфингозину и холестерину медленно высвобождаться для восстановления защитного барьера и длительного увлажнения.
Какие средства имеют MVE?
Практически все средства CeraVe используют технологию MVE, за исключением очищающей увлажняющей мицеллярной воды и очищающего геля для нормальной и жирной кожи. В некоторые формулы нет необходимости включать MVE из-за специфики применения.
Какие уровни pH имеют средства CeraVe?
Диапазон уровней pH формул CeraVe обычно составляет 4,4–7,2, при этом большинство формул имеют pH от 5 до 6.
Диапазон уровней pH формул CeraVe обычно составляет 4,4–7,2, при этом большинство формул имеют pH от 5 до 6.
Фактор защиты от UVA-лучей составляет 14,1.
Как долго можно использовать средства после вскрытия упаковки?
Продукт пригоден для использования до окончания срока, указанного на упаковке.
Кому подойдут средства CeraVe?
Среди средств CeraVe можно найти продукт под различные потребности кожи, особенно сухой.
Можно ли использовать средства CeraVe для детей? Если да, то с какого возраста?
Увлажняющий очищающий крем-гель для лица и тела для нормальной и сухой кожи, крем для лица и тела для сухой и очень сухой кожи и лосьон для лица и тела для сухой и очень сухой кожи CeraVe можно использовать детям от 3 лет.
Есть ли вероятность появления раздражения из-за действия салициловой кислоты, входящей в состав восстанавливающего крема для ног?
Салициловая кислота — это кератолитический агент, который добавлется в крем в необходимой концентрации. Все продукты при разработке проходят тесты на переносимость.
Можно ли пациентам с атопическим дерматитом применять средства CeraVe во время обострений или между ними?
Если у Вас атопический дерматит, обратитесь к врачу, который пропишет терапию и поможет подобрать адекватный уход для Вашей кожи.
Формулы средств
В средствах CeraVe, продаваемых в Европе, содержится меньше церамидов, чем в тех, что продаются в США?
Содержание церамидов одинаковое во ВСЕХ сопоставимых средствах CeraVe во всем мире (в том числе в США и Европе).
Почему отличается состав средств CeraVe, продающихся в США и Европе (включая Россию)?
Каждое наименование продукции марки CeraVe изготовленное для любой страны имеет состав полностью отвечающий
строжайшим требованиям безопасности и качества, а также заявленной эффективности продукта.
Одновременно с этим, состав некоторых наименований продукции может варьироваться, но исключительно в
зависимости от требований и ограничений, обозначенных законодательством той страны, в которой осуществляется
циркуляция на рынке. Так, например, страны Западной и Восточной Европы (включая РФ) имеют консолидированные
требования к безопасности парфюмерно-косметической продукции (зачастую более строгие, чем в других странах),
и продукция, произведенная для этой зоны, имеет идентичный состав.
Законодательство США имеет отличные требования к данной категории продуктов, нежели для стран Европейского
Союза, поэтому состав может быть незначительно иным в части использования сырья, а также допустимости
применения определённых видов второстепенных ингредиентов и их концентраций.
Что касается активных компонентов, заявленных маркой, которые отвечают за основные потребительские свойства,
то их наличие и концентрация абсолютно идентичны для продуктов всех рынков сбыта, включая Россию и США.
Аналогичен ли дневной увлажняющий лосьон европейскому увлажняющему лосьону для лица с SPF 25?
Американский дневной увлажняющий лосьон для лица имеет SPF 30, а европейский увлажняющий лосьон для лица — SPF 25. Кроме того, используемые солнцезащитные фильтры отличаются в зависимости от требований разных стран, поэтому в состав европейского лосьона включена другая система солнечных фильтров, нежели в американский.
Почему компоненты европейского увлажняющего крема перечислены не в том порядке, в котором указаны компоненты американского увлажняющего крема?
Расположение ингредиентного состава может варьироваться в зависимости от требований законодательства страны. Так, например, при едином требовании для США, стран ЕС и России указания ингредиентов в порядке уменьшения их массовой доли в составе, некоторые ингредиенты на упаковке продуктов рынка США могут располагаться в списке выше, чем эти же ингредиенты на упаковке продуктов рынка стран ЕС и России, при полностью совпадающей массовой доле этих ингредиентов в продуктах произведенных для США, стран ЕС и России. Так может происходить по причине объединения некоторых ингредиентов в комплекс, который, конечно, имеет суммарно массовую долю выше, чем каждый из составляющих по отдельности. При этом законодательство США позволяет указывать в списке отдельно составляющие комплекса на месте суммарного веса всего комплекса, тогда как законодательства стран ЕС и России требуют более точного расположения каждого отдельного ингредиента ровно в том месте в списке, где оно обусловлено его индивидуальным весом (а не коллективным весом комплекса).
формул общих кислот и оснований
Кислоты и основания используются во многих химических реакциях. Они ответственны за большинство реакций изменения цвета и используются для регулирования pH химических растворов. Вот названия некоторых распространенных кислот и оснований и формулы, связанные с ними.
Формулы бинарных кислот
Бинарное соединение состоит из двух элементов. Бинарные кислоты имеют префикс hydro перед полным названием неметаллического элемента.У них есть окончание -ic . Примеры включают хлористоводородную кислоту, а фтористоводородная кислота включает:
Плавиковая кислота — HF
Соляная кислота — HCl
Бромистоводородная кислота — HBr
Йодоводородная кислота — HI
Сероводородная кислота — H 2 S
Формулы тройных кислот
Трехкомпонентные кислоты обычно содержат водород, неметалл и кислород. Название наиболее распространенной формы кислоты состоит из неметаллического корня с окончанием -ic .Кислота, содержащая на один атом кислорода меньше, чем наиболее распространенная форма, обозначается окончанием -ous . Кислота, содержащая на один атом кислорода меньше, чем -свободная кислота , имеет префикс гипо- и -атомное окончание . Кислота, содержащая на один кислород больше, чем наиболее распространенная кислота, имеет префикс per- и окончание -ic .
Азотная кислота — HNO3
Азотистая кислота — HNO2
Хлорноватистая кислота — HClO
Хлорноватистая кислота — HClO2
Хлорная кислота — HClO3
Хлорная кислота — HClO4
Серная кислота — h3SO4
Серная кислота
Фосфорная кислота
— h3SO3 Фосфорная кислота
— h3SO3 Угольная кислота — h3CO3
Уксусная кислота — HC2h4O2
Щавелевая кислота — h3C2O4
Борная кислота — h4BO3
Кремниевая кислота — h3SiO3
Формулы общих оснований
Вот формулы для 11 распространенных оснований:
Гидроксид натрия — NaOH
Гидроксид калия — KOH
Гидроксид аммония — Nh5OH
Гидроксид кальция — Ca (OH) 2
Гидроксид магния — Mg (OH) 2
Гидроксид бария — Ba (OH) 2
Гидроксид алюминия — Al (OH) 3
Гидроксид железа или гидроксид железа (II) — Fe (OH) 2
Гидроксид железа или гидроксид железа (III) — Fe (OH) 3
Гидроксид цинка — Zn (OH) 2
Гидроксид лития — LiOH
Что такое кислоты и основания?
Что такое кислоты и основания?
Хотя я уже говорил вам, что кислоты и основания не сложно понять, у меня плохие новости: для описания кислот и оснований используется не одно, а три общих определения: кислоты и основания Аррениуса, кислоты Бренстеда-Лоури. и основания, и кислоты и основания Льюиса.Хотя это звучит так, будто вам придется узнать о кислотах и основаниях трижды, хорошая новость заключается в том, что для многих практических целей эти три определения примерно эквивалентны.
Аррениусовские кислоты и основания
Еще в конце 1800-х наш старый друг Сванте Аррениус придумал определения кислот и оснований, работая над проблемами кинетики.
Согласно Аррениусу, кислоты — это соединения, которые распадаются в воде с выделением ионов гидроксония (H + ).Типичным примером кислоты Аррениуса является соляная кислота (HCl):
Формулы кислот обычно начинаются с водорода, хотя органические кислоты являются заметным исключением. Названия и формулы некоторых распространенных кислот приведены в таблице ниже:
| Название кислоты | Формула |
|---|---|
| соляная кислота | HCl |
| азотная кислота | HNO 3 |
| фосфорная кислота | H 3 PO 4 |
| серная кислота | H 2 SO 4 |
| уксусная кислота | C 2 H 4 O 2 |
Основания Аррениуса определяются как соединения, которые вызывают образование гидроксид-иона при помещении в воду.Одним из примеров основания Аррениуса является гидроксид натрия (NaOH):
Основания обычно содержат «ОН» в своих формулах, хотя есть исключения. Например, аммиак (NH 3 ) не содержит гидроксид-ионы, но образует их, когда вступает в реакцию с водой:
Названия и формулы некоторых распространенных оснований приведены в следующей таблице:
| Название основания | Формула |
|---|---|
| аммиак | NH 3 |
| гидроксид калия | KOH |
| бикарбонат натрия | NaHCO 3 |
| карбонат натрия | Na 2 CO 3 |
| гидроксид натрия | NaOH |
Некоторые оксиды образуют кислоты или основания при добавлении воды.Поскольку эти соединения не содержат ионов H + или OH —, если они не вступают в реакцию с водой, их называют «ангидридами». Обычно оксиды неметаллов представляют собой ангидриды кислот (они образуют кислоту при помещении в воду), а оксиды металлов — ангидриды оснований (образующие основание при помещении в воду).
Кислоты и основания Брнстеда-Лоури
В начале 1900-х годов Йоханнесом Брнстедом и Томасом Лоури было предложено альтернативное определение кислот и оснований, чтобы учесть тот факт, что аммиак может нейтрализовать кислотность HCl, даже если воды нет. .Это явление показало им, что аммиак является основанием, даже когда нет воды для образования гидроксид-ионов.
Крот говорит
Есть много разных названий и формул, используемых для описания иона гидроксония. Хотя формула была показана ранее как «H + », иногда ее записывают как «H 3 O», потому что это ион, образующийся при соединении H + с водой. Другой распространенный способ обозначать ионы гидроксония — просто назвать их «протонами». Это название происходит от того факта, что H + представляет собой атом водорода (один протон и один электрон), который потерял свой электрон, оставив после себя только голый протон.
Кислота Брнстеда-Лоури определяется как соединение, которое отдает ионы гидроксония другому соединению, например, соляная кислота отдает ионы H + соединениям, с которыми она взаимодействует. Основания Брнстеда-Лоури — это соединения, которые могут принимать ионы гидроксония — когда аммиак получает ион гидроксония из HCl, он образует ион аммония.
Следующее уравнение представляет реакцию кислоты Брнстеда-Лоури с основанием Брнстеда-Лоури:
В этой реакции азотная кислота ведет себя как кислота, потому что она отдает протон аммиаку.Аммиак действует как основание, потому что он принимает протон из азотной кислоты.
Однако, если вы посмотрите на другую сторону уравнения, мы найдем ионы нитрата и аммония. Поскольку нитрат-ион может принимать протоны от иона аммония (с образованием HNO 3 ), нитрат-ион является очень слабым основанием Брнстеда-Лоури. Поскольку ион аммония может отдать дополнительный протон (в данном случае нитрат-ион), это кислота Брнстеда-Лоури.
Нитрат-ион основан на молекуле азотной кислоты, поэтому мы говорим, что это конъюгат основания азотной кислоты.Аналогичным образом ион аммония представляет собой , сопряженную с кислотой аммиака. Вместе кислота с ее сопряженным основанием (например, HNO 3 и NO 3 —) или основание с сопряженной кислотой (например, NH 3 и NH 4 + ) относятся к в виде сопряженной пары кислота-основание.
Кислоты и основания Льюиса
В определении кислот и оснований Бренстеда-Лоури основание определяется как соединение, которое может принимать протон. Однако , как принимает протон?
Одна особенность, которая объединяет основания Брнстеда-Лоури, заключается в том, что они имеют неподеленную пару электронов.Когда ион гидроксония проходит мимо молекулы, иногда неподеленные пары протягивают руку и захватывают ее. Примером этого является случай, когда аммиак принимает протон в кислотном растворе:
Рисунок 23.1 Аммиак может захватить протон из азотной кислоты с помощью своей неподеленной пары электронов.
Один из способов взглянуть на этот процесс состоит в том, что атом аммиака отдает свою неподеленную пару протону. Поскольку неподеленные пары управляют этой химической реакцией, у нас есть новое определение кислотности и основности, которое называется «кислотность / основность по Льюису».«Основание Льюиса — это соединение, которое отдает электронную пару другому соединению (аммиак в нашем примере). Кислота Льюиса — это соединение, которое принимает электронную пару (ион H + в нашем примере).
Молекулярные значения
Основания Льюиса — это химические вещества, которые могут отдавать электронные пары. Кислоты Льюиса — химические вещества, которые могут их принимать. аммиак также может реагировать со многими другими соединениями.Например, аммиак может отдать свою неподеленную пару электронов BH 3 следующим образом:
Рисунок 23.2 Неподеленная пара на аммиаке присоединяется к BH 3 .
В этом процессе аммиак является основанием Льюиса, а BH 3 — кислотой Льюиса.
Как правило, определение кислот и оснований Льюиса является наиболее полезным, поскольку оно является наиболее всеобъемлющим из трех определений. Например, определение кислоты Брнстедом-Лоури включает HF, но не BH 3 , который не теряет протон при присоединении неподеленными парами на основании Льюиса.
Выдержка из Полное руководство идиота по химии 2003 Яна Гуча. Все права защищены, включая право на полное или частичное воспроизведение в любой форме. Используется по договоренности с Alpha Books , членом Penguin Group (USA) Inc.
Чтобы заказать эту книгу непосредственно у издателя, посетите веб-сайт Penguin USA или позвоните по телефону 1-800-253-6476. Вы также можете приобрести эту книгу на Amazon.com и Barnes & Noble.
7.3: Названия и формулы кислот
Кислоты
Кислота может быть определена несколькими способами.+} \ right) \) при растворении в воде.
Рисунок \ (\ PageIndex {1} \): (A) Уксус бывает разных типов, но все они содержат уксусную кислоту. (B) Цитрусовые, такие как грейпфрут, содержат лимонную и аскорбиновую кислоты.Это другой тип соединения, чем другие, которые мы видели до сих пор. Кислоты являются молекулярными, что означает, что в чистом виде они представляют собой отдельные молекулы и не принимают расширенные трехмерные структуры ионных соединений, таких как \ (\ ce {NaCl} \). Однако, когда эти молекулы растворяются в воде, химическая связь между атомом водорода и остальной частью молекулы разрывается, оставляя положительно заряженный ион водорода и анион.+} \) Катионов при растворении в воде \ (\ ce {H} \) кислоты записывается первым в формуле неорганической кислоты. Остаток кислоты (кроме \ (\ ce {H} \)) представляет собой анион после растворения кислоты. Органические кислоты также являются важным классом соединений, но здесь мы не будем их обсуждать.
Обозначение кислот
Поскольку все кислоты содержат водород, название кислоты основано на связанном с ней анионе. Эти анионы могут быть одноатомными или многоатомными.
Обозначение Бинарные кислоты (в водной форме)
Бинарная кислота представляет собой кислоту, состоящую из водорода и еще одного элемента.Наиболее распространенные бинарные кислоты содержат галоген. Название кислоты начинается с префикса hydro- . за которым следует базовое имя аниона, за которым следует суффикс -ic .
Обозначение оксикислот
Оксикислота — это кислота, состоящая из водорода, кислорода и третьего элемента. Третий элемент обычно неметалл.
а. Оксианионы с окончанием -ite .
Название кислоты — это корень аниона, за которым следует суффикс -ous .Приставки нет.
г. Оксианионы с окончанием -ate .
Название кислоты — это корень аниона, за которым следует суффикс -ic . Приставки нет.
Примечание
Базовое название серосодержащей оксикислоты — сера- вместо sulf- . То же верно и для фосфорсодержащей оксикислоты.+} \) ионы. Еще один способ подумать о написании правильной формулы — это использовать метод перекрещивания, показанный ниже для серной кислоты.
Формула: H 2 SO 4
Рисунок \ (\ PageIndex {2} \): Перекрестный подход к написанию формулы для серной кислоты.
Сводка
- Кислоты — это молекулярные соединения, выделяющие ионы водорода.
- Бинарная кислота состоит из водорода и еще одного элемента.
- Оксикислоты содержат водород, кислород и еще один элемент.
- Название кислоты основано на анионе, присоединенном к водороду.
Материалы и авторство
Эта страница была создана на основе содержимого следующими участниками и отредактирована (тематически или всесторонне) командой разработчиков LibreTexts в соответствии со стилем, представлением и качеством платформы:
Именование кислот и оснований | Введение в химию
Цель обучения
- Преобразование между структурой кислоты или основания и ее химическим названием
Ключевые моменты
- Кислоты названы на основе их аниона — иона, присоединенного к водороду.В простых бинарных кислотах один ион присоединен к водороду. Названия таких кислот состоят из приставки «гидро-», первого слога аниона и суффикса «-ic».
- Сложные кислотные соединения содержат кислород. Для кислоты с многоатомным ионом суффикс «-ат» от иона заменяется на «-ic».
- Многоатомные ионы с одним дополнительным кислородом (по сравнению с типичным многоатомным ионом) имеют префикс «per-» и суффикс «-ic».
- Многоатомные ионы с на один кислород меньше имеют суффикс «-ous»; ионы с двумя меньшими числами имеют приставку «гипо-» и суффикс «-ous».”
- Сильные основания с группами «-ОН» (гидроксид) называются ионными соединениями. Слабые основания называют молекулярными соединениями или органическими соединениями.
Срок
- многоатомный ион Заряженная разновидность (ион), состоящая из двух или более атомов, связанных ковалентной связью. Также известен как молекулярный ион.
Обозначение кислот
Кислоты названы по аниону, который они образуют при растворении в воде. В зависимости от того, к какому аниону присоединен водород, кислоты будут иметь разные названия.
Простые кислоты, известные как бинарные кислоты, содержат только один анион и один водород. Эти анионы обычно имеют окончание «-ид». Эти соединения называются кислотами, начиная с префикса «гидро-», затем добавляя первый слог аниона, а затем суффикс «-ic». Например, HCl, представляющий собой водород и хлор, называется соляной кислотой.
Номенклатура распространенных кислот В этой таблице представлена номенклатура некоторых распространенных анионов и кислотВ составе более сложных кислот есть кислород.Для этих кислот существует простой набор правил.
- Любой многоатомный ион с суффиксом «-ат» использует суффикс «-ic» как кислоту. Итак, HNO 3 будет азотной кислотой.
- Если у вас есть многоатомный ион, у которого на один кислород больше, чем у «-атного» иона, тогда ваша кислота будет иметь префикс «per-» и суффикс «-ic». Например, хлорат-ион — это ClO 3 —. Поэтому HClO 4 называется хлорной кислотой.
- Если у кислоты на один кислород меньше, чем у «-атного» иона, то у кислоты будет суффикс «-ous».Например, хлорноватистой кислотой является HClO 2 .
- Если у иона кислорода на два меньше, чем у иона «-ат», префикс будет «гипо-», а суффикс — «-ous». Например, вместо бромной кислоты HBrO 3 мы имеем бромистоводородную кислоту HBrO.
Именные базы
Наиболее сильные основания содержат гидроксид, многоатомный ион. Поэтому сильные основания называют в соответствии с правилами наименования ионных соединений. Например, NaOH — это гидроксид натрия, KOH — гидроксид калия, а Ca (OH) 2 — гидроксид кальция.Слабые основания, состоящие из ионных соединений, также называются с помощью ионной системы именования. Например, NH 4 OH — гидроксид аммония.
Слабые основания также иногда являются молекулярными соединениями или органическими соединениями, поскольку они имеют ковалентные связи. Поэтому их называют в соответствии с правилами для молекулярных или органических соединений. Например, метиламин (CH 3 NH 2 ) является слабым основанием. Некоторые слабые базы имеют «общие» имена. Например, NH 3 называется аммиаком; его название не происходит от какой-либо системы именования.
Показать источникиBoundless проверяет и курирует высококачественный контент с открытой лицензией из Интернета. Этот конкретный ресурс использовал следующие источники:
Таблица прочности кислот и щелочей
Таблица прочности кислот и щелочейТаблица кислот и оснований Прочность
Ка | Кислота | База | ||
Имя | Формула | Формула | Имя | |
Большой | хлорная кислота | HClO 4 | ClO 4 — | Перхлорат-ион |
3.2 * 10 9 | Hydroiodic кислота | HI | I- | Йодид |
1,0 * 10 9 | Кислота бромистоводородная | HBr | руб .- | Бромид |
1.3 * 10 6 | Кислота соляная | HCl | Cl- | Хлорид |
1,0 * 10 3 | Серная кислота | H 2 SO 4 | HSO 4 — | Ион сероводорода |
2.4 * 10 1 | Азотная кислота | HNO 3 | НЕТ 3 — | Нитрат-ион |
——— | гидроний ион | H 3 O + | H 2 O | Вода |
5.4 * 10 -2 | Щавелевая кислота | HO 2 C 2 O 2 H | HO 2 C 2 O 2 — | Ион оксалата водорода |
1.3 * 10 -2 | Сернистая кислота | H 2 SO 3 | HSO 3 — | Ион сероводорода |
1,0 * 10 -2 | Ион сероводорода | HSO 4 — | СО 4 2- | Сульфат-ион |
7.1 * 10 -3 | Фосфорная кислота | H 3 PO 4 | H 2 PO 4 — | Дигидроген фосфат-ион |
7.2 * 10 -4 | Азотистая кислота | HNO 2 | НЕТ 3 — | Нитрит-ион |
6,6 * 10 -4 | Плавиковая кислота | HF | Ф — | Ион фтора |
1.8 * 10 -4 | метановая кислота кислота | HCO 2 H | HCO 2 — | метаноат ион |
6,3 * 10 -5 | Бензойная кислота | С 6 H 5 COOH | С 6 В 5 СОО- | Бензоат-ион |
5.4 * 10 -5 | Ион оксалата водорода | HO 2 C 2 O 2- | O 2 C 2 O 2 2- | Ион оксалата |
1.8 * 10 -5 | Ethanoic кислота | CH 3 COOH | CH 3 COO | Ethanoate (ацетат) ион |
4,4 * 10 -7 | Угольная кислота | CO 3 2- | HCO 3 — | Ион карбоната водорода |
1.1 * 10 -7 | Сероводородная кислота | H 2 S | ГС- | Ион сероводорода |
6,3 * 10 -8 | Дигидроген фосфат-ион | H 2 PO 4 — | HPO 4 2- | Ион фосфата водорода |
6.2 * 10 -8 | Ион сероводорода | ГС — | S 2- | Сульфит-ион |
2,9 * 10 -8 | Хлорноватистая кислота | HClO | ClO — | Гипохлорит-ион |
6.2 * 10 -10 | Синильная кислота | HCN | CN — | Цианид-ион |
5,8 * 10 -10 | Ион аммония | NH 4 + | NH 3 | Аммиак |
5.8 * 10 -10 | Кислота борная | H 3 BO 3 | H 2 BO 3 — | Дигидроген карбонат-ион |
4,7 * 10 -11 | Ион карбоната водорода | HCO 3 — | CO 3 2- | Карбонат-ион |
4.2 * 10 -13 | Ион фосфата водорода | HPO 4 2- | PO 4 3- | Фосфат-ион |
1,8 * 10 -13 | Дигидроген борат-ион | H 2 BO 3 — | HBO 3 2- | Ион борат водорода |
1.3 * 10 -13 | Ион сероводорода | ГС- | S 2- | Сульфид-ион |
1,6 * 10 -14 | Ион борат водорода | HBO 3 2- | BO 3 3- | Борат-ион |
——— | вода | H 2 O | OH- | Гидроксид |
1.Сильные кислоты перечислены в верхнем левом углу.
стороны таблицы и имеют значения Ka> 1
2. Кислота со значениями меньше единицы считается слабой.
3. Сильные основания перечислены в правом нижнем углу таблицы и становятся слабее.
по мере продвижения к началу таблицы.
угольная кислота | Формула, применение и факты
Угольная кислота , (H 2 CO 3 ), соединение элементов водорода, углерода и кислорода.Он образуется в небольших количествах, когда его ангидрид, диоксид углерода (CO 2 ), растворяется в воде.
Подробнее по этой теме
Оксикислота: угольная кислота и карбонатные соли
Угольная кислота (h3CO3) образуется в небольших количествах, когда ее ангидрид, диоксид углерода (CO2), …
CO 2 + H 2 O ⇌ H 2 CO 3 Преобладающими видами являются просто слабогидратированные молекулы CO 2 .Угольная кислота может рассматриваться как дипротонная кислота, из которой могут быть образованы две серии солей, а именно гидрокарбонаты, содержащие HCO 3 —, и карбонаты, содержащие CO 3 2-. H 2 CO 3 + H 2 O ⇌ H 3 O + + HCO 3 —
HCO 3 — + H 2 O ⇌ H 3 O + + CO 3 2− Однако кислотно-основное поведение угольной кислоты зависит от различных скоростей некоторых участвующих реакций, а также от их зависимости от pH системы.Например, при pH менее 8 основные реакции и их относительная скорость следующие: CO 2 + H 2 O ⇌ H 2 CO 3 (медленный)
H 2 CO 3 + OH — ⇌ HCO 3 — + H 2 O (быстро) При pH выше 10 важны следующие реакции: CO 2 + OH — ⇌ HCO 3 — (медленный)
HCO 3 — + OH — ⇌ CO 3 2- + H 2 O (быстрый) Между значениями pH от 8 до 10 все вышеуказанные равновесные реакции значимы .
Углекислота играет роль в образовании пещер и пещерных образований, таких как сталактиты и сталагмиты. Самые большие и самые распространенные пещеры — это пещеры, образованные растворением известняка или доломита под действием воды, богатой углекислотой, полученной в результате недавних дождей. Кальцит в сталактитах и сталагмитах происходит из вышележащего известняка вблизи границы между коренными породами и почвой. Дождевая вода, проникая через почву, поглощает углекислый газ из богатой углекислым газом почвы и образует разбавленный раствор углекислоты.Когда эта кислая вода достигает основания почвы, она вступает в реакцию с кальцитом в известняковой породе и переводит часть его в раствор. Вода продолжает свой нисходящий поток через узкие стыки и трещины в ненасыщенной зоне с минимальной химической реакцией. Когда вода выходит из крыши пещеры, углекислый газ теряется в атмосферу пещеры, и часть карбоната кальция выпадает в осадок. Проникающая вода действует как насос кальцита, удаляя его из верхней части коренных пород и повторно откладывая в пещере внизу.
Углекислота важна для переноса углекислого газа в кровь. Углекислый газ попадает в кровь в тканях, потому что его местное парциальное давление больше, чем его парциальное давление в крови, протекающей через ткани. Когда углекислый газ попадает в кровь, он соединяется с водой с образованием угольной кислоты, которая диссоциирует на ионы водорода (H + ) и ионы бикарбоната (HCO 3 — ). Высвобождаемые ионы водорода минимально влияют на кислотность крови, поскольку белки крови, особенно гемоглобин, являются эффективными буферными агентами.(Буферный раствор сопротивляется изменению кислотности за счет объединения с добавленными ионами водорода и, по сути, их инактивации.) Естественное преобразование диоксида углерода в угольную кислоту — относительно медленный процесс; однако карбоангидраза, белковый фермент, присутствующий в эритроците, катализирует эту реакцию с достаточной скоростью, чтобы она завершилась всего за доли секунды. Поскольку фермент присутствует только внутри эритроцита, бикарбонат накапливается в эритроците в гораздо большей степени, чем в плазме.Способность крови переносить углекислый газ в виде бикарбоната усиливается системой переноса ионов внутри мембраны эритроцитов, которая одновременно перемещает ион бикарбоната из клетки в плазму в обмен на ион хлора. Одновременный обмен этими двумя ионами, известный как сдвиг хлоридов, позволяет использовать плазму в качестве места хранения бикарбоната без изменения электрического заряда плазмы или эритроцита. Только 26 процентов от общего содержания углекислого газа в крови существует в виде бикарбоната внутри красных кровяных телец, в то время как 62 процента существует в виде бикарбоната в плазме; однако основная масса ионов бикарбоната сначала вырабатывается внутри клетки, а затем переносится в плазму.Обратная последовательность реакций происходит, когда кровь достигает легких, где парциальное давление углекислого газа ниже, чем в крови.
Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчасКарбоновые кислоты — Органическая химия — OCR 21C — GCSE Chemistry (Single Science) Revision — OCR 21st Century
Карбоновые кислоты образуют гомологичный ряд. Как и все гомологические серии, карбоновые кислоты:
Функциональная группа
Функциональной группой в карбоновых кислотах является карбоксильная группа -COOH.
Он отвечает за типичные реакции карбоновых кислот, которые являются слабыми кислотами. Уксус — это разбавленный раствор этановой кислоты.
Общая формула
Общая формула карбоновых кислот: C n H 2n + 1 COOH (где n — число атомов углерода в молекуле, минус 1).
Помните, что атомы О не соединены друг с другом:
Рабочий пример
Декановая кислота — это карбоновая кислота.Его молекулы содержат 10 атомов углерода. Предскажите молекулярную формулу декановой кислоты и объясните свой ответ.
Формула будет C 9 H 19 COOH. Это потому, что n = (10 — 1) = 9. Итак, 2 n + 1 = (2 × 9) = 18 + 1 = 19.
- Вопрос
Гексановая кислота является карбоновой кислотой. Его молекулы содержат 6 атомов углерода. Предскажите молекулярную формулу гексановой кислоты.
- Показать ответ
Формула будет: C 5 H 11 COOH.
Структуры
В таблице показаны четыре карбоновые кислоты, их молекулярные, отображаемые и структурные формулы.
Кислотные свойства
Карбоновые кислоты обладают типичными свойствами кислот. Например, они:
- Posted in Разное
