Сильные и слабые кислоты ℹ️ список формул, как определить и отличить сильную кислоту от слабой, самая сильная кислота в химии, общее описание и свойства, реакция с основаниями, кривые титрования

На сильные и слабые эти субстанции подразделяются в зависимости от возможности отдавать ионы водорода во время взаимодействия с металлами.
Общие свойства
Все кислоты содержат атомы водорода, которые способны вступать в реакцию. Таким образом, кислота представляет собой сложное вещество, молекулы которого состоят из разного количества атомов водорода и кислотного остатка. Эти соединения обладают кислым и зачастую слегка металлическим вкусом. При контакте с ними индикаторы приобретают другой оттенок вплоть до кардинальной смены цвета.
Химические свойства, являющиеся общими для всех кислот:

- Все вещества, содержащие кислород, в процессе разложения образуют воду и кислотный оксид.
- Бескислородные соединения распадаются на простые элементы.
- Окислители вступают в реакцию со всеми расположенными слева от H металлами из ряда активности.
- Кислоты взаимодействуют с солями, образованными более слабым соединением.
Физические свойства веществ могут кардинально отличаться. Например, одни из них имеют запах, у других он отсутствует совершенно.
Кислоты могут быть жидкими, газообразными и твёрдыми. К твёрдым соединениям относятся, например, C2h304 и h4BO3.
Концентрация вещества
Зачастую химикам приходится решать задачи на определение количества чистой кислоты, находящейся в растворе, в процентах. В таких случаях искомым значением является концентрация.
Это величина, позволяющая определять количественный состав жидкого химического вещества. К примеру, для того, чтобы узнать, сколько чистой серной кислоты находится в разбавленном растворе, необходимо небольшое количество смеси налить в мерный стакан, взвесить и определить искомое значение по таблице плотности. Указанная таблица используется при вычислениях, так как плотность неразрывно связана с концентрацией.
Основная классификация
Чаще всего кислые вещества разделяют на кислородосодержащие и бескислородные. Состав последних соединений отличается тем, что в них нет кислорода, но есть водород. В связи с этим их названия всегда дополнены словом «водородная». Например, хлороводородная, сероводородная.
Кроме того, кислоты имеют классификацию по количеству атомов водорода.
Так, они подразделяются на следующие типы:
- одноосновные;
- двухосновные;
- трехосновные.
Но также существуют органические кислоты, то есть органические вещества, которые проявляют свойства, присущие кислотным соединениям. Из них наиболее известны уксусная, щавелевая, муравьиная, лимонная, молочная и яблочная.
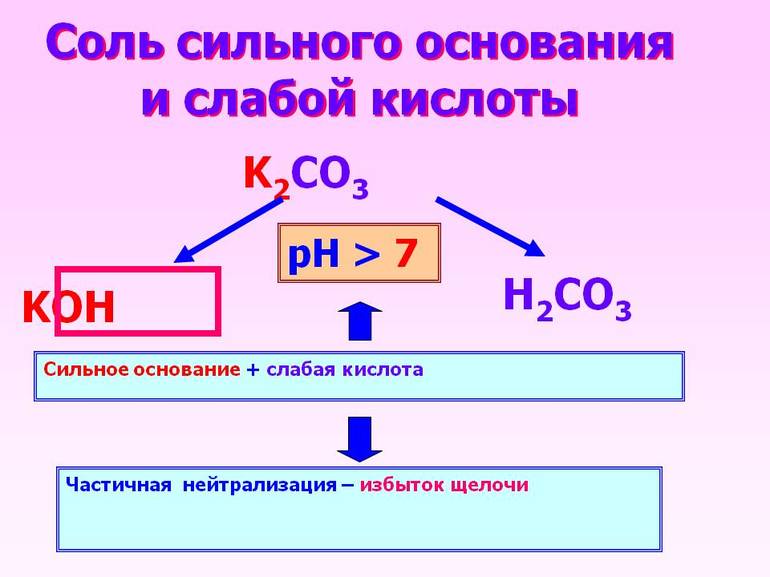
Все кислые вещества и основания подразделяются на сильные и слабые. Но необходимо понять, что эти понятия никак не связаны с концентрацией соединений. Сила кислоты определяется её способностью вступать в химическую реакцию, отдавая водородные ионы.
Так, вещество считается сильным, если этот процесс проходит легко.
Сильные и слабые реагенты
Если реагент в водном растворе полностью распадается на ионы, то есть диссоциирует, то оно является сильным, поскольку слабые химические соединения никогда не растворяются до конца.
Кроме того, отличить слабую кислоту можно посредством измерения её проводимости. Сильные соединения являются хорошими электролитами. Сильные основания при попадании в воду также распадаются. Следует отметить, что основания также называют гидроксидами или гидроокисями.
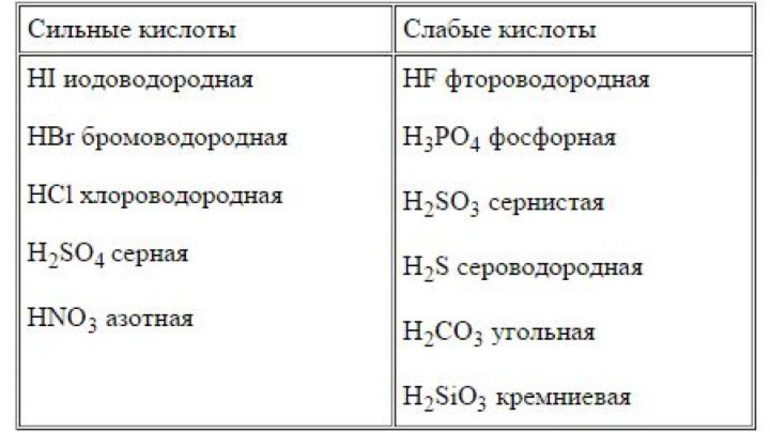
Существует специальные перечни слабых и сильных кислот и оснований. Таблица, приведённая ниже, также может использоваться для классификации реагентов.
| Сильная кислота | Слабая кислота | Сильное основание | Слабое основание |
|---|---|---|---|
| HCI соляная или хлороводородная | HF фтороводородная | NaOH гидроокись натрия | Mg(OH)2 гидроокись магния |
| HBr бромоводородная | Ch4COOH уксусная | KOH гидроокись калия | Fe(OH)2 гидроокись железа (II) |
| HI йодоводородная | h3SO3 сернистая | Ca(OH)2 гидроокись кальция | Zn(OH)2 гидроокись цинка |
| HNO3 азотная | h3S сероводородная | Ba(OH)2 гидроокись бария | Nh5OH гидроокись аммония |
| HClO4 хлорная | HNO2 азотистая | LiOH гидроокись лития | Fe(OH)3 гидроокись железа (III) |
| h3SO4 серная | h3SiO3 кремниевая |
А также следует отметить, что кислородсодержащая угольная (h3CO3) и ортофосфорная (h4PO4) или фосфорная кислоты — слабые. К сильным же необходимо добавить хромовую, которая является средней по силе.
Кроме того, нужно учитывать, что современная химия позволяет учёным создавать новые соединения. В связи с этим список кислот, как сильных, так и слабых, постоянно пополняется.
Химические реакции
При соединении сильной кислоты с таким же основанием получится нейтральный раствор. Произошедшая в этом случае химическая реакция называется

Второй компонент не распадается на ионы полностью.
Слабое основание лишь незначительно вступает в реакцию со слабой кислотой.
Когда кислотное соединение реагирует с сильным основанием, то первый реагент проходит частичную диссоциацию, второй же полностью диссоциирует.
Полученный в результате раствор обладает слабыми свойствами основания.
Водородный показатель
При проведении диссоциирующих реакций важно правильно определить уровень кислотности воды. Для его количественного выражения применяется величина pH, называющаяся силой, весом или потенциалом водорода. Она позволяет измерить активность ионов водорода. Если уровень pH превышает 7, то у вещества присутствуют кислотные свойства, если же этот показатель меньше 7, то свойства являются основными.
Способы определения
Результаты химических реакций, в которых участвует любое вещество, напрямую зависят от уровня его кислотности. А потому химики всегда измеряют этот показатель.
Существует несколько методов определения pH:
- Инструментальный способ. В этом случае применяется pH-метр. Этот прибор трансформирует концентрацию протонов в какой-либо жидкости в электрический сигнал.
- Индикаторы. Это вещества, изменяющие оттенок цвет в зависимости от показателя pH. Использование различных индикаторов позволяет получить довольно точные данные об уровне кислотности.
- Соль. Соль представляет собой соединение ионов, которое полностью диссоциирует в слабом водном растворе. Для определения кислотно-щелочных свойств соляного раствора, прежде всего, нужно установить и изучить свойства ионов, находящиеся в растворе.
Буферный раствор
Буферным раствором называется вещество, отличающееся наличием постоянной концентрации ионов водорода.

При добавлении сильной кислоты или такого же основания в небольших дозах эти растворы сохраняют изначальный уровень кислотности.
Для приготовления такой смеси нужно смешать слабое кислое вещество или основание с соответствующей солью.
При изготовлении буферного раствора необходимо учитывать следующие факторы:
- Интервал уровня кислотности, в котором вещество станет эффективным.
- Ёмкость раствора, то есть какой объём сильного кислотного соединения или основания можно добавить в смесь, не изменив её pH.
- При соединении веществ не должно быть реакций, способных повлиять на состав раствора.
Самые опасные кислотные соединения
На сегодняшний день самой сильной кислотой в мире считается пентафторид сурьмы фтористоводородной кислоты. Её химическая формула — HFSbF5. Не существует точных данных об активности этого соединения, но установлено, что его 55-процентный раствор почти в миллион раз сильнее концентрированной серной кислоты.
Следующим по силе является карборановое кислотное соединение. Это вещество разрешается хранить только в специальной ёмкости. Она также во много раз опаснее серной и растворяет даже стекло.
Ещё одной суперкислотой является плавиковая. Она не имеет цвета и, подобно предыдущему веществу, способна разъедать стекло. Для перевозки этого едкого соединения применяют полиэтилен. Вещество прекрасно вступает в реакцию с большинством металлов, но не взаимодействует с парафином. Соединение токсично, даже его пары опасны для здоровья. Кислота обладает эффектом наркотика.
Самое известное сильное вещество — серная кислота. Из-за больших производственных объёмов некоторые химики считают именно её самой опасной в мире. По мере того как увеличивается концентрация реагента, растёт и его опасность для здоровья человека, хотя даже растворы серного кислотного соединения могут нанести серьёзный вред. Это вещество окисляет металлы и является крайне едким, даже пары реагента очень опасны. При контакте происходит поражение кожи и слизистых оболочек, органов дыхания, а также внутренних органов человека.
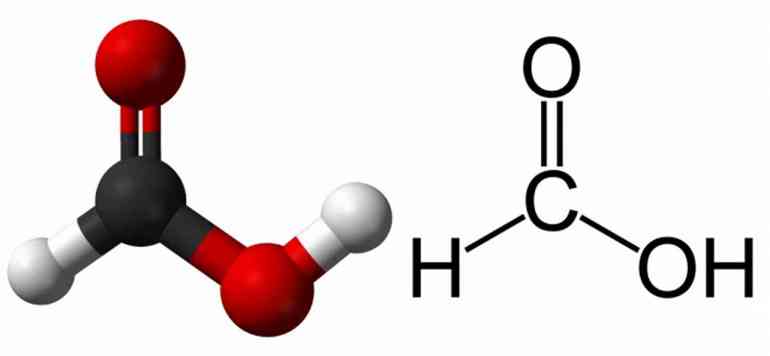
Часто используемая в быту муравьиная кислота тоже относится к ядовитым химикатам. Эта ситуация объясняется тем, что опасность возникает только при высокой концентрации вещества. В обычных условиях оно бесцветно, легко образует водные растворы, а также успешно растворяется в ацетоне.
При концентрации меньше 10% реагент вызывает только раздражение. Если же этот показатель повышен, то соединение может разъесть ткани и множество других веществ. Его пары повреждают глаза, слизистые оболочки и дыхательные пути. При попадании внутрь организма наступает серьёзное отравление. Но в минимальных концентрациях реагент успешно перерабатывается и выводится из организма. В небольших дозах оно присутствует во фруктах, выделениях насекомых, крапиве.
Мощным ядом является азотная кислота. В разных пропорциях она прекрасно смешивается с водой. Реагент крайне опасен для человека. Его пары наносят серьёзный вред органам дыхания и слизистым оболочкам. Кожный покров при попадании кислоты становится жёлтым, на нём остаются язвы. Пострадавшие места требуют длительного восстановительного процесса.
При воздействии высокой температуры или света азотная кислота распадается, превращаясь в довольно токсичный газ. У вещества не возникает химической реакции со стеклом, а потому этот материал применяют для хранения реагента. Создателем ядовитого соединения является алхимик Джабир.
Кривые титрования
Кривые титрования представляют собой график зависимости параметра вещества, который связан с концентрацией реагента, подвергающегося титрованию, титранта или продукта химической реакции, от степени протекания процесса. Если проходит кислотно-основная реакция, то показателем концентрации каждого её участка является уровень рН.

Существуют теоретические и экспериментальные кривые. Теоретические используются для того, чтобы обосновать выбор индикатора. Их расчёт осуществляется по уравнению реакции и данным об исходной концентрации соединений, вступающих в реакцию. Экспериментальные кривые позволяют определить точки эквивалентности. Их получают путём измерения одного из свойств системы в процессе титрования.
Протекание и результат химических реакций, в которые вступает любая кислота, напрямую зависят от того, является это вещество сильным или слабым. В специальных химических таблицах приведены наименования самых распространённых соединений, что позволяет безошибочно определить силу реагента.
nauka.club
Кислотный остаток — это… Что такое Кислотный остаток?
- Кислотный остаток
Кислотный остаток — это анион, который является второй частью формулы сложного химического соединения. Они способны замещать определенное количество атомов или групп атомов. Ни у одного кислотного остатка нет свободных реакциоспособных электронов. Как правило, кислотный остаток состоит из атомов неметаллов.
Таблица самых распространенных кислотных остатков
Кислотный остаток Валентность Название Тривиальное название кислоты -Cl I хлорид соляная кислота -NO3 I нитрат азотная кислота -SO4 II сульфат серная кислота -SO3 II сульфит сернистая кислота -S II сульфид сероводородная кислота -SiO3 II силикат кремниевая кислота -CO3 II карбонат угольная кислота -PO4 III ортофосфат ортофосфатная кислота -NO2 I нитрит нитритная кислота -F I фторид плавиковая кислота -I I иодид иодидная кислота -Br I бромид бромидная кислота
Wikimedia Foundation. 2010.
- Кислотные тесты
- Кислуха
Смотреть что такое «Кислотный остаток» в других словарях:
кислотный остаток — — [http://slovarionline.ru/anglo russkiy slovar neftegazovoy promyishlennosti/] Тематики нефтегазовая промышленность EN acid residue … Справочник технического переводчика
кислотный остаток — rūgšties liekana statusas T sritis chemija apibrėžtis Rūgšties anijonas. atitikmenys: angl. acid residue rus. кислотный остаток … Chemijos terminų aiškinamasis žodynas
кислотный остаток — кислотный радикал … Cловарь химических синонимов I
кислотный радикал — кислотный остаток … Cловарь химических синонимов I
Эфиры сложные — (хим.) представляют собой сочетания спиртов с кислотами, происходящие путем выделения воды за счет водных остатков этих соединений. Названия [В немецкой химической литературе сложные Э. весьма целесообразно названы, по предложению Гмелина, особым … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Число координатное — химических соединений — Термин введен в науку А. Вернером, который предполагает, что ему удалось открыть закономерность, определяющую состав гидратов, аммиакатов (ср. Кобальтиаковые соединения), двойных (и простых, кислородсодержащих) солей и вообще неорганических и… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Анион — Анион отрицательно заряженный ион. Характеризуется величиной отрицательного электрического заряда; например, Cl− однозарядный анион, а SO42− двузарядный анион. В электрическом поле анионы перемещаются к положительному… … Википедия
диазосоединения — органические соединения общей формулы RN2 (алифатические диазосоединения; R алкил) или ArN2X (ароматические диазосоединения; Ar арил, Х гидроксильная группа или кислотный остаток), из которых наиболее важны последние соли диазония.… … Энциклопедический словарь
ртутьорганические соединения — содержат в молекуле атом ртути, непосредственно связанный с углеродом. Известны ртутьорганические соединения типа R2Hg и RHgX, где R органический радикал, Х галоген, ОН, кислотный остаток. Применяются в органическом синтезе, как фунгициды.… … Энциклопедический словарь
соли — продукты замещения атомов водорода кислоты на металл или групп ОН основания на кислотный остаток. При полном замещении образуются средние, или нормальные, соли (NaCl, K2SO4 и др.), при неполном замещении атомов Н кислые (напр., NaHCO3), неполном … Энциклопедический словарь
dic.academic.ru
Ответы@Mail.Ru: Почему кислоты кислые???:З
потому что они в основном кислые на вкус. Например, из того что Вы пробовали — уксусная кислота, угольная кислота, щавелевая кислота, муравьиная кислота
Потому что зелёные!
Потому что в каждой кислоте содержатся атомы водорода…. которые окисляют эти вещества
кислоты не обязательно кислые) ) кислоты это группа химических соединений в общем случае способные принять электрон или отдать протон. вкус определяется реакцией в рецепторах языка если тебе это интерсно почитай: Вкус в физиологии — один из видов хеморецепции; ощущение, возникающее при действии различных веществ преимущественно на рецепторы вкуса (расположенные на вкусовых луковицах языка, а также задней стенки глотки, мягкого неба, миндалины, надгортанника) . Информация от рецепторов вкуса передается по афферентным волокнам лицевого, языкоглоточного и блуждающего черепных нервов к ядру одиночного тракта продолговатого мозга, затем переключение происходит в ядрах тала́муса и далее в постцентральную извилину и островок (лат. insula) коры больших полушарий, где формируется вкусовые ощущения. [1] По другим сведениям, корковый конец вкусовой системы расположен в парагиппокампа́льной извилине (лат. gyrus parahippocampalis) (устаревшее название крючковая извилина, лат. gyrus uncinatus) и в гиппока́мпе (лат. hippocampus)[2][3]. Кроме сладкого, горького, кислого, солёного вкуса современные люди в разных странах выделяют также умами, терпкий, жгучий, мятный, щелочной, металлический и др. вкусы. У человека ощущение вкуса развивается при непосредственном участии ветвей лицевого и языкоглоточного нервов, которые обеспечивают вкусовую чувствительность на передних 2/3 и задней 1/3 языка соответственно. Понятие аромат в большой степени связано с одновременным восприятием вкуса и запаха.
По определению (в частности — на вкус)
touch.otvet.mail.ru
Кислоты (кислотные гидроксиды) — Мегаобучалка
Кислоты — это гидроксиды, формула которых в общем виде может быть представлена как HхЭОу, либо НхЭ, где х и у — небольшие целые числа, а Э — кислотообразующий элемент, в качестве которого выступают либо неметаллы, либо металлы, находящиеся в высокой степени окисления. Например: HNO3, H2SO3, H2CrO4, HMnO4.
Кислоты типа НхЭ образуют только элементы-неметаллы VII A и VI A подгрупп, а именно: HF, HCl, HBr, HI и H2S, H2Se, H2Te.
Кислоты в водном растворе диссоциируют с образованием катионов водорода H+ и отрицательно заряженных анионов (кислотных остатков):
H2SO4 = 2H+ + SO42-;
HNO3 = H+ + NO3—.
Наличия ионов водорода в растворах кислот определяет кислую реакцию среды.
Составление формулы кислоты
Для кислот, имеющих общую формулу НхЭ, необходимо определить отрицательную степень окисления элемента (она определяется, как уже указывалось выше, путем вычитания числа 8 из номера группы) и присоединить необходимое количество ионов водорода. Например, неметалл Br находится в VII A подгруппе, минимальная отрицательная степень окисления брома равна (7 — 8) = -1, следовательно ион Br‾ присоединяет один ион водорода Н+, и образуется кислота НВr. Аналогично: Se (VI A подгруппа), низшая степень окисления равна (6 — 8) = -2, ион Se2-, кислота Н2Se.
Для кислот, имеющих общую формулу HхЭОу, самый простой способ образовать кислоту — чисто арифметический: прибавить к формуле оксида формулу воды. Например:
H2O + SO2 = H2SO3;
N2O3 + H2O = (H2N2O4) = 2HNO2 (кратные числа, как правило сокращаются).
Однако одному оксиду может соответствовать не одна, а несколько кислот, например:
SiO2 + H2O = H2SiO3;
SiO2 + 2H2O = H4SiO4
Кислоты, содержащие больше молекул воды, называются ортокислотами (H4SiO4 — ортокремниевая кислота). Кислоты, содержащие меньше молекул воды, называются метакислотами (H2SiO3 — метакремниевая кислота).
Ортокислоты склонны образовывать атомы элемента с большим радиусом, т.е. расположенные внизу Периодической таблицы, метакислоты — с меньшим радиусом, т.е. вверху таблицы. Например, для азота известна только HNO3 — метаазотная кислота, а для фосфора известны HPO3 -метафосфорная и Н3РО4 — ортофосфорная кислоты.
Если элемент образует несколько степеней окисления, то возможно образование других кислот. Так, азот (V A подгруппа) кроме азотной кислоты НNО3 образует азотистую кислоту НNО2, где он проявляет степень окисления +III. Сера (VI A подгруппа), кроме серной кислоты H2SO4, образует сернистую кислоту H2SO3, проявляя в ней степень окисления +IV.
Номенклатура кислот
Для кислот с общей формулой НхЭ названия складываются следующим образом: сначала называют элемент, образующий кислоту, с окончанием “о”, затем прибавляется слово “водородная”. Например: HBr — бромоводородная, H2S — сероводородная и т.д. Для двух кислот чаще применяют технические названия: HCl — соляная (хлороводородная), НF — плавиковая (фтороводородная).
Для кислородсодержащих кислот c общей формулой HхЭОуназвания производят от названия элемента, образующего кислоту. При этом, если элемент находится в высшей степени окисления, к названию элемента прибавляется “-ная” или “-овая” (H2SO4 — серная кислота, Н3РО4 — ортофосфорная кислота, H2CrO4 — хромовая кислота). Если элемент, образующий кислоту, находится в более низкой степени окисления, к названию элемента прибавляется “-истая” (H2SO3 — сернистая кислота, H3PO3 — ортофосфористая кислота).
Названия наиболее важных кислот, а также формулы и названия анионов (кислотных остатков) приведены в таблице 1.
Таблица 1
| Формула кислоты | Название кислоты | Формула аниона (кислотного остатка) | Название аниона |
| HF | фтороводородная (плавиковая) | F‾ | фторид |
| HCl | хлороводородная (соляная) | Cl‾ | хлорид |
| HBr | бромоводородная | Br‾ | бромид |
| HI | иодоводородная | I‾ | иодид |
| H2S | сероводородная | S2‾ | сульфид |
| H2CO3 | угольная | CO32‾ | карбонат |
| CH3COOH | уксусная | CH3COO— | ацетат |
| H2C2O4 | щавелевая | С2О42- | оксалат |
| H2SiO3 | метакремниевая | SiO32‾ | метасиликат |
| H4SiO4 | ортокремниевая | SiO44‾ | ортосиликат |
| HNO3 | азотная | NO3‾ | нитрат |
| HNO2 | азотистая | NO2‾ | нитрит |
| HPO3 | метафосфорная | PO3‾ | метафосфат |
| H3PO4 | ортофосфорная | PO4‾ | ортофосфат |
| H2SO4 | серная | SO42‾ | сульфат |
| H2SO3 | сернистая | SO32‾ | сульфит |
| HClO4 | хлорная | ClO4‾ | перхлорат |
| HClO3 | хлорноватая | ClO3‾ | хлорат |
| HClO2 | хлористая | ClO2‾ | хлорит |
| HClO | хлорноватистая | ClO‾ | гипохлорит |
| HCN | циановодородная (синильная) | CN— | цианид |
| HSCN | родановодородная | SCN— | роданид |
Методы получения кислот
Наиболее употребительны следующие методы получения кислот:
а) Растворение в воде кислотного оксида или водородного соединения (для бескислородных кислот):
SO3 + H2O → H2SO4;
P2O5 + 3 H2O → 2H3PO4;
HCl(газ) + aqua = HCl(раствор);
б) Вытеснение сильной кислотой более слабой кислоты из солей:
HCl + Na2SiO3 → H2SiO3↓ + NaCl.
Классификация кислот
а) По числу атомов водорода в молекуле кислоты делятся на однооснóвные (содержат один атом водорода) и многооснóвные (два и более атома водорода). Например, HCl, HNO3 — одноосновные кислоты; H2SO4 — двухосновная кислота; H3PO4 — трехосновная кислота.
б) По своему составу кислоты подразделяют на бескислородные (HF, HCl, HBr, H2S и т.д.) и кислородсодержащие (H2SO4, HNO3, H2SiO3, HClO4 и т.д.).
в) По способности диссоциировать в растворе на ионы кислоты делятся на сильные и слабые. Сильными являются кислоты HCl, HBr, HI, HNO3, H2SO4, HClO4, HMnO4 и др. К слабым относятся все органические кислоты, а также неорганические H2CO3, H2S, HNO2, HCN и др. Стоит отметить, что сильная кислота является одновременно и сильным электролитом, и наоборот.
в) По окислительно-восстановительным характеристикам среди кислот можно выделить сильные окислители (H2SO4(конц), HNO3(конц), HNO3(разб), HClO и др.) и сильные восстановители (HCl(конц), HBr, HI и др.).
Химические свойства кислот
Кислоты взаимодействуют с соединениями, проявляющими оснóвные свойства:
а) Взаимодействуют с основаниями и амфотерными гидроксидами с образованием соли и воды (реакция нейтрализации):
HClO4 + NaOH → H2O + NaClO4;
HCl + Zn(OH)2 → ZnCl2 + H2O;
б) Взаимодействуют с основными и амфотерными оксидами:
H2SO4 + FeO → H2O + FeSO4;
H2SO4 + ZnO → H2O + ZnSO4;
в) Взаимодействуют с основными солями (основные соли содержат гидроксильную группу в катионе):
HCl + MgOHCl → H2O + MgCl2;
HCl + BiOH(NO3)2 → H2O + BiCl3 + Bi(NO3)3;
г) Сильные кислоты вытесняют слабые кислоты из солей:
H2SO4 + Na2SiO3 → H2SiO3↓ + Na2SO4
д) Кислоты взаимодействуют с металлами, но характер взаимодействия зависит от вида металла и природы кислоты.
Кислоты — сильные окислители (H2SO4(конц), HNO3(конц), HNO3(разб) и др.) взаимодействуют с большинством металлов (независимо от положения в ряду напряжения). Окислителем при этом является элемент, образующий кислоту:
H2SO4(конц) + Сu → SO2↑ + CuSO4 + H2O;
HNO3(разб) + Ag → NO↑ + AgNO3 + H2O
Кислоты — несильные окислители (H2SO4(разб), HCl(разб) и др.) взаимодействуют только с металлами, стоящими в ряду напряжений до водорода, при этом выделяется водород:
HCl + Zn → H2↑ + ZnCl2;
H2SO4(разб) + Fe → H2↑ + FeSO4
Таким образом, при написании уравнения реакции взаимодействия металла с кислотой необходимо пользоваться рядом напряжения металлов:
Li, Rb, K, Ba, Sr, Ca, Na, Mg, Al, Zn, Fe, Ni, Sn, Pb, H2, Cu, Hg, Ag, Pt, Au
Амфотерные гидроксиды
Амфотерные гидроксиды, так же как и амфотерные оксиды, в зависимости от условий способны проявлять как оснóвные ( при взаимодействии с кислотами или кислотными оксидами), так и кислотные свойства (при взаимодействии с основаниями или основными оксидами), т.е. обладают двойственной химической функцией.
Амфотерные гидроксиды образуют элементы главных подгрупп, находящиеся в Периодической системе вблизи условной границы между металлами и неметаллами. Такими гидроксидами являются Be(OH)2, Al(OH)3, Ga(OH)3, Ge(OH)4, Sn(OH)4 и др. Некоторые элементы побочных подгрупп также образуют амфотерные гидроксиды: Zn(OH)2, Cr(OH)3, Ti(OH)4.
Запись формул амфотерных гидроксидов аналогична записи формул оснований. Например, гидроксид цинка записывается Zn(OH)2 — основная форма записи. Однако, поскольку в водном растворе амфотерные гидроксиды образуют одновременно и катионы водорода Н+ и анионы гидроксила ОН—, то формулу амфотерного гидроксида можно записать и в кислотной форме: H2ZnO2 — цинковая кислота.
Zn2+ + 2OH— ↔ Zn(OH)2↓ = H2ZnO2 ↔ 2H+ + ZnO22-
Амфотерным гидроксидам соответствуют амфотерные оксиды. Например, амфотерному гидроксиду Al(OH)3 соответствует амфотерный оксид Al2O3, гидроксиду олова (+IV) Sn(OH)4 — оксид SnO2 и т.д.
Химические свойства амфотерных гидроксидов
Амфотерные гидроксиды взаимодействуют как с кислотами, так и с растворенными в воде основаниями с образованием солей.
а) Взаимодействие с кислотами:
Al(OH)3(тв) + HCl → AlCl3 + H2O
б) Взаимодействие со щелочами с образованием комплексных соединений:
Al(OH)3(тв) + NaOH(раствор) → Na[Al(OH)4]
или
Al(OH)3(тв) + NaOH(раствор) → Na3[Al(OH)6]
Если реакция протекает при сплавлении реагентов в твердой фазе, то происходит отделение воды и образуется метаалюминат натрия:
Al(OH)3(тв) + NaOH(тв) → NaAlO2 + Н2О
Соли
Соли — сложные вещества, состоящие из положительно заряженных ионов (катионов) металлов и отрицательно заряженных ионов (анионов) остатков кислот. Примеры катионов: Ca2+, Na+, Fe2+, ZnOH+ и т.п. Примеры анионов: SO42-, Cl—, NO3—, HS— и т.п.
Классификация солей
а) По растворимости в воде соли подразделяются на растворимые, малорастворимые и практически нерастворимые. Данные о растворимости солей приводятся в таблице растворимости. Легко запомнить, что растворимыми всегда бывают соли, в составе которых есть нитрат-ион NO3—, или соли, в составе которых есть ионы щелочных металлов (Na+, K+, Rb+. Cs+), а также ион аммония NH4+.
б) По составу соли делятся на средние (нормальные), кислые и оснóвные. Такое деление обусловлено тем, что соли можно рассматривать как продукты замещения атомов водорода в молекуле кислоты на атомы металла или гидроксильных групп в молекуле основания на кислотный остаток.
Средние соли образуются при полном замещении атомов водорода в молекуле кислоты на атомы металла, а также при полном замещении гидроксильных групп в молекуле основания кислотными остатками.
Образование средних солей серной кислоты представлено уравнениями следующих реакций:
2NaOH + H2SO4 = Na2SO4 + 2H2O;
Ba(OH)2 + H2SO4 = BaSO4↓ + 2H2O.
При растворении средних солей в воде происходит их диссоциация под действием молекул растворителя на катионы металла и анионы кислотного остатка. Уравнение диссоциации можно записать так:
Na2SO4 → 2Na+ + SO42-
Кислые соли образуются при неполном замещении атомов водорода в молекуле кислоты на атомы металла. Незамещенный атом водорода остается в кислотном остатке.
NaOH + H2SO4 = NaHSO4 + Н2О
Кислые соли в реакции нейтрализации образуются в том случае, когда основания взято меньше, чем требуется для полной нейтрализации кислоты.
Диссоциация кислых солей протекает ступенчато:
NaHSO4 → Na+ + HSO4—
HSO4— → H+ + SO42-
В результате ступенчатой диссоциации кислых солей в их растворе присутствуют катионы металла, катионы водорода и анионы кислотного остатка. Кислые соли образуют только многоосновные кислоты, содержащие более одного атома водорода в молекуле.
Основные соли образуются при неполном замещении гидроксильных групп в молекуле основания на кислотные остатки. Незамещенная гидроксильная группа остается в катионе в виде гидроксо-иона.
Mg(OH)2 + HCl = (MgOH)Cl + H2O;
2Cu(OH)2 + H2SO4 = (CuOH)2SO4 + 2H2O
Диссоциация основных солей протекает ступенчато:
(MgOH)Cl → (MgOH)+ + Cl—;
(MgOH)+ → Mg+ + OH—
В растворе основной соли будут присутствовать катионы металла и гидроксо-катионы, анионы гидроксильной группы и анионы кислотного остатка.
Номенклатура солей
Название солей состоит из названия аниона (кислотного остатка) и названия катиона. Сначала называют анион в именительном падеже, затем — катион (металл) в родительном падеже с указанием, если необходимо, степени окисления металла. Например, KNO3 — нитрат калия, ZnCl2 — хлорид цинка, FeCl2 — хлорид железа (II).
Таким образом, название соли вытекает из названия кислоты, от которого она образована. В таблице 2 приведены названия некоторых кислот и названия соответствующих им солей.
Таблица 2
| Формулы и названия кислот | Название солей |
| HF фтороводородная (плавиковая) | фториды |
| HCl хлороводородная (соляная) | хлориды |
| HBr бромоводородная | бромиды |
| HI иодоводородная | иодиды |
| H2S сероводородная | сульфиды |
| H2CO3 угольная | карбонаты |
| H2SiO3 метакремниевая | метасиликаты |
| H4SiO4 ортокремниевая | ортосиликаты |
| HNO3 азотная | нитраты |
| HNO2 азотистая | нитриты |
| HPO3 метафосфорная | метафосфаты |
| H3PO4 ортофосфорная | ортофосфаты |
| H2SO4 серная | сульфаты |
| H2SO3 сернистая | сульфиты |
| HClO4 хлорная | перхлораты |
| HClO3 хлорноватая | хлораты |
| HClO2 хлористая | хлориты |
| HClO хлорноватистая | гипохлориты |
Названия кислых солей образуются так же как и средних. Присутствие атомов водорода в составе аниона обозначается словом “гидро”. Например, NaHSO4 — гидросульфат натрия, KH2PO4 — дигидроортофосфат калия. Если металл имеет переменную степень окисления, после названия соли ставится степень окисления металла: Pb(HSO4)2 — гидросульфат свинца (II).
В названиях основных солей перед названием катиона добавляют слово “гидроксо” с указанием числа гидроксильных групп ОН‾ в остатке основания. Например, AlOHSO4 — сульфат гидроксоалюминия, (ZnOH)2CO3 — карбонат гидроксоцинка, Fe(OH)2Cl — хлорид дигидроксожелеза (III).
Методы получения солей
Соли образуются при взаимодействии простых веществ (металлов с неметаллами) и всех классов неорганических соединений. Приведем некоторые способы получения солей.
а) Взаимодействие металлов с неметаллами:
Zn + S → ZnS (реакция протекает при нагревании)
б) Реакции нейтрализации или кислотно-основного взаимодействия. Сутью этих реакций является погашение (исчезновение) кислотных и основных свойств реагентов. Из двух реагирующих веществ одно всегда является “кислотным” реагентом (кислота, кислотный оксид, кислая соль, амфотерный оксид, амфотерный гидроксид), а второе — “основным” реагентом (основание, в том числе щелочь, основный оксид, основная соль, амфотерный оксид, амфотерный гидроксид).
Примеры уравнений реакций нейтрализации с получением солей:
| Са(OH)2 | + | H2SO4 | → | CaSO4 | + | H2O; |
| основание | кислота | соль | вода | |||
| СаO | + | H2SO4 | → | CaSO4 | + | H2O; |
| основный оксид | кислота | соль | вода | |||
| Са(OH)2 | + | SO3 | → | CaSO4 | + | H2O; |
| основание | кислотный оксид | соль | вода | |||
| СаO | + | SO3 | → | CaSO4; | (реакция протекает не в растворе) | |
| основный оксид | кислотный оксид | соль | ||||
| NaOH | + | Zn(OH)2 | → | Na2ZnO2 | + | H2O; |
| основание | амфотерный гидроксид | соль | вода | |||
| NaOH | + | ZnO | → | Na2ZnO2 | + | H2O; |
| основание | амфотерный оксид | соль | вода | |||
| H2SO4 | + | Zn(OH)2 | → | ZnSO4 | + | H2O; |
| кислота | амфотерный гидроксид | соль | вода | |||
| SO3 | + | Zn(OH)2 | → | ZnSO4 | + | H2O; |
| кислотный оксид | амфотерный гидроксид | соль | вода | |||
| H2SO4 | + | ZnO | → | ZnSO4 | + | H2O; |
| кислота | амфотерный оксид | соль | вода | |||
| SO3 | + | ZnO | → | ZnSO4; | (реакция протекает не в растворе) | |
| кислотный оксид | амфотерный оксид | соль | ||||
| Na2O | + | ZnO | → | Na2ZnO2 | (реакция протекает не в растворе) | |
| основный оксид | амфотерный оксид | соль |
в) Реакции обмена (или обменные), сутью которых является обмен катиона на другой катион и аниона на другой анион.
Примеры реакций обмена с получением солей:
| CaCl2 | + | Na2SO4 | → | CaSO4↓ | + | NaCl; |
| соль 1 | соль 2 | соль 3 | соль 4 | |||
| CaCl2 | + | Н2SO4 | → | CaSO4↓ | + | НCl; |
| соль 1 | кислота 1 | соль 2 | кислота 2 | |||
| FeSO4 | + | NaOH | → | Fe(OH)2↓ | + | Na2SO4 |
| соль 1 | щелочь 1 (основание 1) | основание 2 | соль 2 |
г) Окислительно-восстановительные реакции взаимодействия металлов с кислотами и солями с получением солей:
Zn + HCl → ZnCl2 + H2↑;
Fe + CuSO4 → Cu + FeSO4
Необходимо отметить, что приведенные методы не охватывают всех возможных способов получения солей, а также не всякую соль можно получить всеми перечисленными способами.
Химические свойства солей
Химические свойства солей обусловлены их отношением к металлам, щелочам, кислотам и солям. Взаимодействие солей с основаниями (в том числе со щелочами), кислотами и другими солями протекает по типу обменных реакций, а при взаимодействии солей с металлами протекает окислительно-восстановительная реакция.
Как было сказано выше, реакции обмена — это такие реакции, в которых исходные реагенты обмениваются своими ионами (катионами и анионами). Необходимо отметить, что в реакциях обмена степени окисления элементов не меняются. Кроме того, необходимо помнить также, что реакции обмена протекают до конца лишь в том случае, если хотя бы один из продуктов уходит из сферы реакции в виде осадка, газа, малодиссоциирующего соединения.
а) Реакция обмена соли со щелочью в молекулярном и в сокращенном ионном виде:
CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4;
Cu2+ + 2OH‾ = Cu(OH)2↓
б) Реакция обмена соли с кислотой в молекулярном и в сокращенном ионном виде:
CuSO4 + H2S → CuS↓ + H2SO4;
Cu2+ + Н2S → CuS↓ + 2Н+
в) Реакция обмена соли с другой солью в молекулярном и в сокращенном ионном виде:
BaCl2 + Na2SO4 → BaSO4↓ + NaCl
Ba2+ + SO42- → BaSO4↓
Как отмечалось выше, соли способны вступать в окислительно-восстановительные реакции с металлами. При этом реакции протекают только в том случае, если металл находится в ряду напряжений левее металла, образующего соль.
Zn + Cu(NO3)2 → Cu + Zn(NO3)2;
Zn + Cu2+ → Cu + Zn2+
Существуют и более сложные окислительно-восстановительные реакции, в которых соли могут быть окислителями (например, KMnO4, K2Cr2O7) или восстановителями (например: Na2S, KI). Существуют также соли, не проявляющие свойств ни окислителя, ни восстановителя (например, Na2SO4).
megaobuchalka.ru
Бескислородные кислоты и их кислотные остатки — Мегаобучалка
| Формула кислот | Название кислоты | Формула кислотного остатка | Название кислотного остатка |
| HF | Фтороводородная кислота | — F | фторид |
| HCl | Хлороводородная кислота | — Cl | хлорид |
| HBr | Бромоводородная кислота | — Br | бромид |
| HI | Иодоводородная кислота | — I | иодид |
| H2S | Сероводородная кислота | = S | сульфид |
| HCN | Циановодородная кислота | — CN | цианид |
Названия кислотных остатков всех бескислородных кислот имеют одинаковые окончания «ид».
Кислородсодержащие кислоты
Названия оксокислот (табл. 9) образуются из русских названий кислотообразующих элементов с добавлением различных суффиксов.
Названия кислотных остатков образуются; обычно из латинских названий кислотообразующих элементов с добавлением окончаний -am (для кислотных остатков с большей валентностью элемента) или -ит (с меньшей валенпностью). При образовании одним элементом более двух оксокислот названия: их кислотных остатков включают префиксы пер- (для кислотных остатков с наибольшей валентностью элемента) и гипо- (с наименьшей валентностью).
Таблица «Оксокислоты и их кислотные» остатки
| Формула | Название кислоты | Формула | Название |
| кислоты | кислотного | кислотного | |
| Н2СO3 | Угольная кислота | = СО3 | карбонат |
| H2SiO3 | Кремниевая кислота | = SiO3 | силикат |
| HNO3 | Азотная кислота | — NO3 | нитрат |
| HNO2 | Азотистая кислота | -no2 | нитрит |
| Н3РО4 | Фосфорная кислота | ≡PО4 | фосфат |
| Н3РО3 | Фосфористая кислота | = РО3 | фосфит |
| H2SO4 | Серная кислота | = so4 | сульфат |
| H2SO3 | Сернистая кислота | = so3 | сульфит |
| Н2СlO4 | Хромовая кислота | = СlO4 | хромат |
| Н2Сr2O7 | Дихромовая кислота | = Cr2O7 | дихромат |
| НС1O4 | Хлорная кислота | -СlO4 | перхлорат |
| НСlO3 | Хлорноватая кислота | -CIO3 | хлорат |
| НСlO2 | Хлористая кислота | -cio2 | хлорит |
| HClO | Хлорноватистая кислота | -ClO | гипохлорит |
| НМnO4 | Марганцовая кислота | -MnO4 | перманганат |
| Н2МnO4 | Марганцовистая кислота | = MnO4 | манганат |
Классификация кислот
Классифицировать кислоты можно по двум признакам:
1. По основности:
Основность кислоты — это число атомов водорода и молекуле кислоты, способных замещаться атомами металла.
Кислоты, молекулы которых содержат один атом водорода, способный замещаться атомами металла, называются одноосновными.
К ним относятся, например: НСl, HNO3
Примеры двухосновных кислот: H2S, H2SO3, H2SO4.
Трехосновных кислот: Н3РO4, Н3ВО3.
2. По составу кислотного остатка кислоты делятся на бескислородные и кислородсодержащие (оксокислоты).
Бескислородные кислоты состоят из атомов водорода и кислотного остатка, который не содержит атомов кислорода.
Оксокислоты в составе кислотного остатка содержат атомы кислорода.
Молекула любой оксокислоты содержит атомы водорода и кислорода, а также атом (или атомы) третьего элемента, который называется кислотообразующим элементом. Например, сера S является кислотообразующим элементом в кислотах H2SO4 и H2SO3, хром Сr — в кислотах Н2СrO4 и Н2Сr2O7 и т.д.
Валентность кислотообразующего элемента в молекуле оксокислоты равна разности между суммой валентностей атомов кислорода и суммой валентностей атомов водорода. Так, валентности серы в H2S03 и H2S04 равны:
х II I х II
| х = (2 • 4) — (1 • 2) Валентность серы равна VI |
| х = (2 • 3) — (1 • 2) = 4 Валентность серы равна IV |
H2SO3 h2so4
По агрегатному состоянию большинство кислот являются жидкостями (азотная кислота HNO3, серная кислота H2SO4, хлорная кислота HClO4 и др.). Некоторые жидкие кислоты представляют собой растворы газов в воде (соляная кислота НСl, сероводородная кислота H2S, угольная кислота Н2СОЗ и др.) Ортфосфорная кислота Н3РО4, борная кислота Н3ВО3, йодная кислота НIO4 — твердые вещества. Кислоты могут быть бесцветными (сернистая кислота H2SO3, бромоводородная кислота НВг) и окрашенными (хромовая кислота Н2СrO4 существует в виде раствора желтого цвета, а марганцовая кислота НМnO4 — в виде раствора фиолетово-красного цвета). По растворимости в воде почти все кислоты относятся к хорошо растворимым веществам, которые смешиваются с водой в любых соотношениях. Кремниевая кислота H2SiO3 не растворима в воде.
Химические свойства кислот
1. Кислоты диссоциируют с образованием катионов водорода:
НА→ Н+ + А’
Поэтому кислоты изменяют цвет индикаторов
2. Кислоты взаимодействуют с любыми основаниями (растворимыми и нерастворимыми) с образованием соли и воды (реакция нейтрализации):
Кислота + Основание = Соль +Н2O
HNO3 + КОН = KNO3 + Н2O
3. Кислоты вступают в реакцию с основными оксидами с образованием соли и воды:
Кислота + Основный оксид = Соль + Н20
H2SO4 + СаО = CaSO4 + Н2O
4. Кислоты взаимодействуют с амфотерными оксидами с образованием соли и воды:
Кислота + Aмфотерный оксид = Соль + Н2О
НС1 + ZnO = ZnC12 + Н2O
5. Кислоты взаимодействуют с амфотерными гидроксидами с образованием соли и воды:
Кислота + Aмфотерный гидроксид = Соль + Н2О
H2SO4 + Zn(OH)2 = ZnSO4 + 2Н2O
6. Кислоты взаимодействуют со среднимииосновными солями.
а) Взаимодействие с нормальными солями
При взаимодействии кислот с нормальной солью, образованной другой кислотой, образуется новая соль и новая кислота.
Кислота + Средняя = Новая средняя + Новая
Соль соль кислота
Реакция происходит только в том случае, если в результате получается нерастворимая соль (нерастворимая кислота) или если образующаяся кислота более слабая, чем кислота, образовавшая соль. Например:
H2SO4 + ВаСl2 = BaSO4↓ + 2НС1
2HNO3 + NaSiO3 = 2NaNO3 + H2SiO3↓
2НСl + СаСО3 = СаСl2+ Н2O + СO2
Н2СО3 (слабая кислота)
При взаимодействии кислоты со средней солью, образованной этой же кислотой, образуется только один продукт — кислая соль.
Кислота + Средняя соль → Кислая соль
H2S + Na2S = 2NaHS
б) Взаимодействие с основными солями
Кислоты вступают в реакцию с основными солями с образованием нормальных солей и воды:
Кислота + Основная соль = Средняя соль + Н2О
а. При взаимодействии кислоты с основной солью этой же кислоты образуется средняя соль и вода:
НСl + CuOHCl = CuCI2+ Н2O
б. При взаимодействии кислоты с основной солью другой кислоты, образуются две срелней соли и вода:
2HNO3 + 2CuOHCl = Cu(NO3)2 + Cu CI2 + 2Н2O
7. Кислоты взаимодействуют с металлами.
Кислота + Me = соль + разные продукты реакции
Продукты реакции между кислотой и металлом зависят: от кислоты, вступающей в реакцию; от активности металла (от его положения в электрохимическом ряду напряжений металлов)
Получение кислот
1. Взаимодействие неметалла с водородом и последующее растворение водородного соединения в воде:
Неметалл + Н2 = Водородное соединение неметалла
2. Взаимодействие солей бескислородных кислот с сильными кислотами.
3. Взаимодействие кислотных оксидов (кроме Si02)
Кислотный оксид + Н20 = Оксокислота
4. Взаимодействие солей с кислотами
Соль (1) + Кислота (1) = Соль (2) + Кислота (2)
При получении кислот этим способом исходная соль должна быть хорошо растворимой, а взятая для реакции кислота — более сильной или менее летучей, чем получаемая.
Например:
1) F2 + Н2 = 2HF
2) FeS + НС1 = FeCl2 + H2S↑
3) SO2 + Н2O = H2SO3
4) Na2SiO3 + H2SO4 = Na2SO4 + H2SiO3↓
Na2SiO3 + 2HC1 = 2NaCl + H2SO3
На холоду концентрированная серная кислота пассивирует хром и железо. При нагревании железо реагирует с концентрированной серной кислотой по уравнению:
t
2Fe + 6H2SO4 = Fe2(SO4)3 + 3SO2↑ + 6H2O
Например:
1) Zn + H2SO4 = ZnSO4 + H2↑
(разраб.)
Сu + H2SO4 не взаимодействует
(разраб.)
2) 2Ca + 2H2SO4 = CaSO4 + H2S↑ + 4 H2O
(конц.)
Сu + 2H2SO4 = CuSO4 + SO2 ↑ + 2 H2O
(конц.)
3) 4Ca + 10HNO3 = 3Ca(NO3)2 + NH4NO3 + 3H2O
(разб.)
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO↑ + 4H2O
(разб.)
4) 4Ca + 10HNO3 = 3Ca(NO3)2 + N2O ↑ + 5H2O
(конц.)
Сu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2H2O
(конц.)
megaobuchalka.ru