Урок химии в 8 классе по теме «Кислоты»
Приложение 1
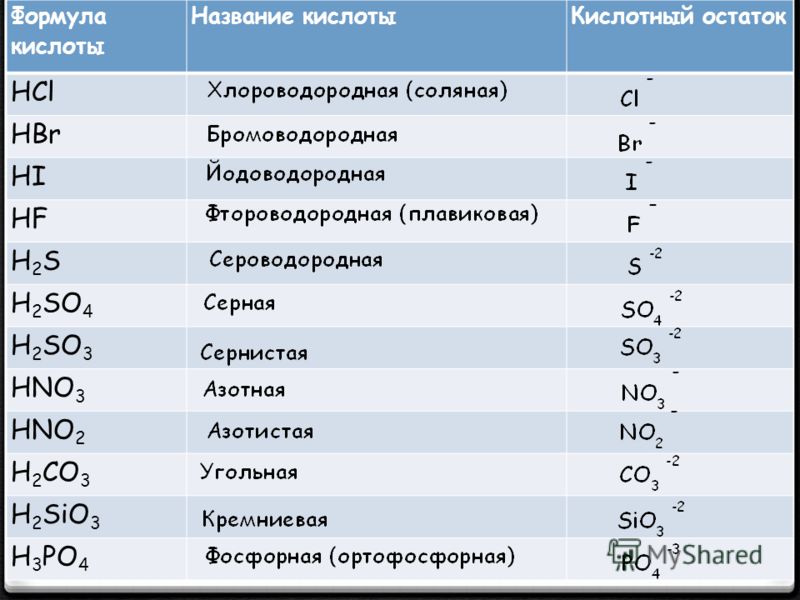
Таблица кислот
Формула соли
Фтороводородная кислота
( плавиковая)
HF
фторид
Хлороводородная кислота
( соляная)
HCl
хлорид
Бромоводородная кислота
HBr
бромид
Иодоводородная кислота
HI
иодид
Сероводородная кислота
H2S
сульфид
Серная кислота
H2SO4
сульфат
Сернистая кислота
H2SO3
Азотная кислота
HNO3
нитрат
Азотистая кислота
НNO2
нитрит
Фосфорная кислота
H3PO4
фосфат
Угольная кислота
H2CO3
карбонат
Кремниевая кислота
H2SiO3
силикат
Приложение 1
Таблица кислот
Формула соли
Фтороводородная кислота
( плавиковая)
HF
фторид
Хлороводородная кислота
( соляная)
HCl
хлорид
Бромоводородная кислота
HBr
бромид
Иодоводородная кислота
HI
иодид
Сероводородная кислота
H2S
сульфид
Серная кислота
H2SO4
сульфат
Сернистая кислота
H2SO3
сульфит
Азотная кислота
HNO3
нитрат
Азотистая кислота
НNO2
нитрит
Фосфорная кислота
H3PO4
фосфат
Угольная кислота
H2CO3
карбонат
Кремниевая кислота
H2SiO3
силикат
Приложение 2
«Почему кислоты получили такое название?»
Из своего жизненного опыта вы знаете, что многие продукты питания обладают кислым вкусом. Кислый вкус этим продуктам придают кислоты. Кислый вкус лимону придает лимонная кислота, яблоку – яблочная кислота, скисшему молоку – молочная кислота. Щавель имеет кислый вкус благодаря наличию в его листьях щавелевой кислоты.
Кислый вкус этим продуктам придают кислоты. Кислый вкус лимону придает лимонная кислота, яблоку – яблочная кислота, скисшему молоку – молочная кислота. Щавель имеет кислый вкус благодаря наличию в его листьях щавелевой кислоты.
«Правила техники безопасности при работе с кислотами»
Что нужно помнить при работе с кислотами?
1) Прежде всего: Кислоту надо приливать к воде, а не наоборот!
В связи с выделением большого количества теплоты при растворении концентрированной серной кислоты в воде нельзя вливать воду в кислоту. В этом случае вода, имеющая меньшую плотность, окажется на поверхности, закипит и её брызги вместе с кислотой могут обжечь руки и лицо.
2) Запомните: В случае попадания кислоты на кожу следует промыть её водой и 5% раствором соды.
3) Можно ли пробовать на вкус кислоты или другие вещества в лаборатории?
Ни один химик и ни один грамотный человек даже и не подумает пробовать и распознавать кислоты на вкус — это может быть смертельно опасно.
«Кислоты вокруг нас»
Кислоты постоянно присутствуют вокруг нас. Например, дождевая вода на первый взгляд кажется чистой. На самом деле в ней присутствует немало других веществ. За счет растворения углекислого газа из атмосферы она является раствором
Муравей впрыскивает в ранку яд, содержащий муравьиную кислоту. Муравьиной кислотой обусловлено жжение крапивы, ее выделяют некоторые гусеницы. Голожаберные моллюски в порядке самообороны выстреливают парами серной кислоты.
Мухоморы в качестве ядовитых токсинов «используют» иботеновую кислоту. Это вещество так ядовито, что мухомору незачем прятаться.
Значительная функция лишайниковых кислот в природе состоит в разрушении ими горных пород и образовании почвы.
Важна роль кислот и в человеческом организме:
аскорбиновая кислота – поставщик витамина С,
фолиевая кислота – витамин В9,
аминокислоты образуют множество белков,
соляная кислота – сильнейший бактерицид, находящийся у нас в желудке, помогает переваривать пищу,
ацетилсалициловая кислота – жаропонижающее средство,
молочная кислота образуется в мышцах при физической нагрузке,
гиалуроновая кислота входит в состав многих тканей (кожа, хрящи, стекловидное тело), используется в косметике, как составная часть средств ухода за кожей: кремов, губной помады, лосьонов и пр.
Приложение 2
«Почему кислоты получили такое название?»
Из своего жизненного опыта вы знаете, что многие продукты питания обладают кислым вкусом. Кислый вкус этим продуктам придают кислоты. Кислый вкус лимону придает лимонная кислота, яблоку – яблочная кислота, скисшему молоку – молочная кислота. Щавель имеет кислый вкус благодаря наличию в его листьях щавелевой кислоты.
«Правила техники безопасности при работе с кислотами»
Что нужно помнить при работе с кислотами?
1) Прежде всего: Кислоту надо приливать к воде, а не наоборот!
В связи с выделением большого количества теплоты при растворении концентрированной серной кислоты в воде нельзя вливать воду в кислоту. В этом случае вода, имеющая меньшую плотность, окажется на поверхности, закипит и её брызги вместе с кислотой могут обжечь руки и лицо.
2) Запомните: В случае попадания кислоты на кожу следует промыть её водой и 5% раствором соды.
3) Можно ли пробовать на вкус кислоты или другие вещества в лаборатории?
Ни один химик и ни один грамотный человек даже и не подумает пробовать и распознавать кислоты на вкус — это может быть смертельно опасно. \
«Кислоты вокруг нас»
Кислоты постоянно присутствуют вокруг нас. Например, дождевая вода на первый взгляд кажется чистой. На самом деле в ней присутствует немало других веществ. За счет растворения углекислого газа из атмосферы она является раствором
угольной кислоты. После летней грозы в ней оказывается еще и азотная кислота.Муравей впрыскивает в ранку яд, содержащий муравьиную кислоту. Муравьиной кислотой обусловлено жжение крапивы, ее выделяют некоторые гусеницы. Голожаберные моллюски в порядке самообороны выстреливают парами серной кислоты.
Мухоморы в качестве ядовитых токсинов «используют» иботеновую кислоту. Это вещество так ядовито, что мухомору незачем прятаться.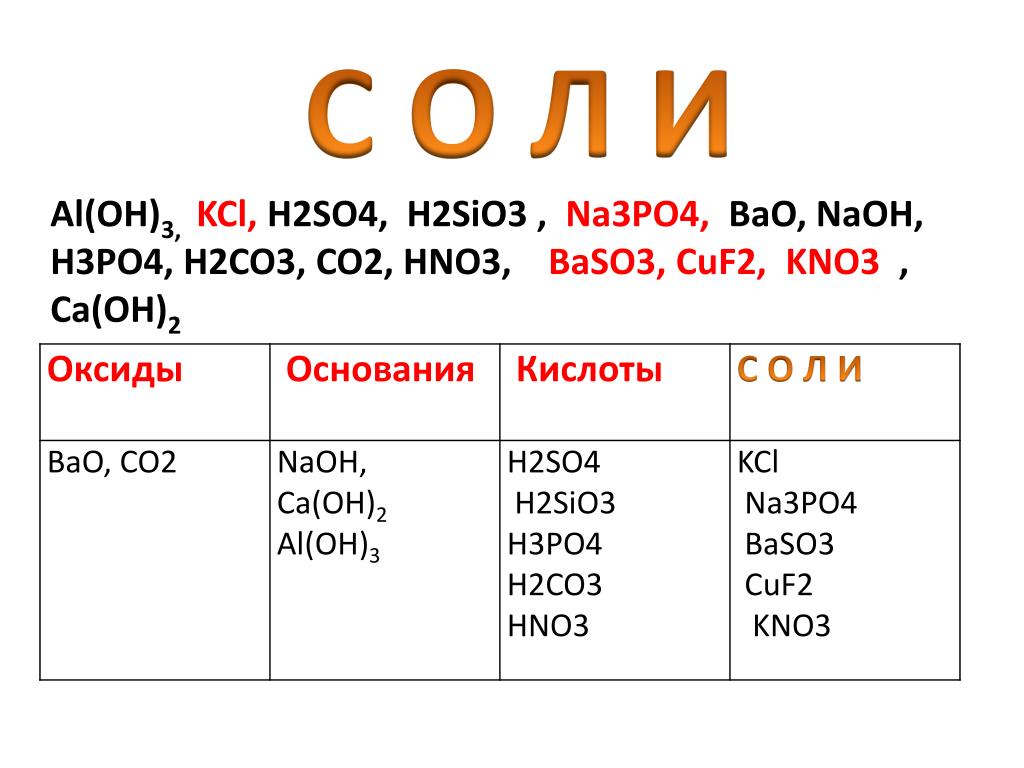
Значительная функция лишайниковых кислот в природе состоит в разрушении ими горных пород и образовании почвы.
Важна роль кислот и в человеческом организме:
аскорбиновая кислота – поставщик витамина С,
фолиевая кислота – витамин В9,
аминокислоты образуют множество белков,
соляная кислота – сильнейший бактерицид, находящийся у нас в желудке, помогает переваривать пищу,
ацетилсалициловая кислота – жаропонижающее средство,
молочная кислота образуется в мышцах при физической нагрузке,
гиалуроновая кислота входит в состав многих тканей (кожа, хрящи, стекловидное тело), используется в косметике, как составная часть средств ухода за кожей: кремов, губной помады, лосьонов и пр.
Оксид серы(VI), серная кислота, сульфаты — урок. Химия, 8–9 класс.
Оксид серы(\(VI\))
Oксид серы(VI) образуется при каталитическом окислении сернистого газа:
2SO2+O2⇄t,k2SO3.
При обычных условиях это жидкость, которая реагирует с водой с образованием серной кислоты:
SO3+h3O=h3SO4.
Эта реакция протекает даже с парами воды. Поэтому оксид серы(\(VI\)) дымит на воздухе.
Особенностью оксида серы(\(VI\)) является его способность растворяться в концентрированной серной кислоте с образованием олеума.
Оксид серы(\(VI\)) — типичный кислотный оксид. Он реагирует с основаниями и основными оксидами c образованием солей:
SO3+2NaOH=Na2SO4+h3O,
SO3+CaO=CaSO4.
Степень окисления серы в этом оксиде — \(+6\). Это максимальное значение для серы, поэтому в окислительно-восстановительных реакциях он может быть только окислителем.
Серная кислота
Серная кислота h3SO4 — важнейшее соединение серы. Чистая серная кислота представляет собой бесцветную вязкую маслянистую жидкость, котoрая почти в два раза тяжелее воды.
Чистая серная кислота представляет собой бесцветную вязкую маслянистую жидкость, котoрая почти в два раза тяжелее воды.
Серная кислота неограниченно смешивается с водой. Растворение серной кислоты сопровождается сильным разогреванием раствора, и может происходить его разбрызгивание. Поэтому серную кислоту растворяют осторожно: тонкой струйкой кислоту вливают в воду при постоянном перемешивании.
Рис. \(1\). Смешивание серной кислоты с водой
Серная кислота очень гигроскопична и используется для осушки разных веществ.
Химические свойства серной кислоты зависят от её концентрации.
Серная кислота любой концентрации реагирует:
- с основными и амфотерными оксидами и гидроксидами с образованием соли и воды:
h3SO4+CuO=CuSO4+h3O,
h3SO4+Zn(OH)2=ZnSO4+2h3O;
- с солями, если образуется газ или нерастворимое вещество:
h3SO4+CaCO3=CaSO4+h3O+CO2↑,
h3SO4+BaCl2=BaSO4↓+2HCl.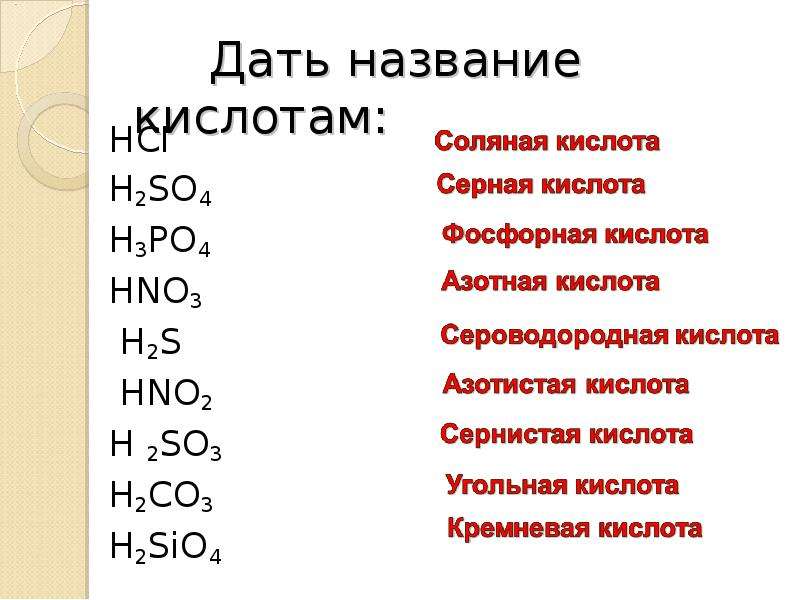
Разбавленная кислота реагирует только с металлами, расположенными в ряду активности до водорода. В реакции образуются сульфаты и выделяется водород. Окислительные свойства в этом случае проявляют атомы водорода:
h3+1SO4+Zn0=Zn+2SO4+h3↑0.
Концентрированная кислота реагирует:
- со всеми металлами, кроме золота и платины, за счёт сильных окислительных свойств атома серы:
2h3S+6O4+Cu0=Cu+2SO4+S+4O2+2h3O.
В реакциях с активными металлами продуктами реакции могут быть сернистый газ, сероводород или сера.
Обрати внимание!
При низкой температуре пассивирует железо и алюминий и с ними не реагирует.
- С твёрдыми солями других кислот:
h3SO4(к)+2NaNO3(тв)=Na2SO4+2HNO3.
- Со многими органическими веществами (происходит обугливание сахара, бумаги, древесины и т. д., так как отнимается вода):
Рис. \(2\). Обугливание сахара концентрированной серной кислотой
Соли серной кислоты
Серная кислота образует два ряда солей. Средние соли называются сульфатами (Na2SO4,CaSO4), а кислые — гидросульфатами (NaHSO4,Ca(HSO4)2).
Качественной реакцией на серную кислоту и её соли является реакция с растворимыми солями бария — выпадает белый осадок сульфата бария:
Na2SO4+BaCl2=BaSO4↓+2NaCl,SO42−+Ba2+=BaSO4↓.
Серная кислота — одно из важнейших химических веществ. Она используется:
- для получения других кислот;
- для производства минеральных удобрений;
- для очистки нефтепродуктов;
- в свинцовых аккумуляторах;
- в производстве моющих средств, красителей, лекарств.

Соли серной кислоты также находят применение. Медный купорос CuSO4⋅5h3O используется для борьбы с заболеваниями растений, гипс CaSO4⋅2h3O применяется в строительстве, сульфат бария BaSO4 — в медицине.
Источники:
Рис. 1. Смешивание серной кислоты с водой © ЯКласс
Рис. 2. Обугливание сахара концентрированной серной кислотой © ЯКласс
Урок химии по теме «Основные классы неорганических соединений». 8-й класс
Цель урока:
- формирование познавательных, коммуникативных, регулятивных универсальных учебных действий;
- обобщение и систематизация знаний обучающихся об основных классах неорганических веществ, их классификации, составе и номенклатуре.
Результаты обучения:
Предметные:
- Критический уровень:формулировать определения основных классов неорганических соединений, распознавать химические вещества по классам, давать названия веществам.

- Достаточный уровень: владеть критическим уровнем; знать классификацию веществ внутри класса, объяснять принадлежность веществ к определённому классу, уметь самостоятельно составлять простейшие химические формулы веществ.
- Творческий уровень: владеть достаточным уровнем, уметь самостоятельно решать экспериментальные задачи на идентификацию неорганических соединений.
Познавательные УУД.
- Критический уровень: ученик из указанного источника зафиксировал информацию и воспроизвёл её.
- Достаточный уровень: ученик из нескольких источников зафиксировал информацию, сделал вывод и привёл хотя бы один аргумент для его подтверждения.
- Творческий уровень: ученик самостоятельно организовал поиск информации, охарактеризовал основные источники, сделал вывод на основе анализа нескольких аргументов.
Коммуникативные УУД
- Критический уровень: ученик отвечает на вопросы с помощью товарищей или учителя по заданному алгоритму.

- Достаточный уровень: ученик самостоятельно дает односложные ответы по заданному алгоритму, взаимодействует с членами группы, договорившись о процедуре.
- Творческий уровень: ученик самостоятельно дает развернутый аргументированный ответ, обобщает результаты обсуждения в группе.
Регулятивные УУД
- Критический уровень: ученик понял цели и задачи деятельности, организовал свои действия с помощью товарищей или учителя, высказал своё мнение о проделанной работе.
- Достаточный уровень: ученик сформировал цели и задачи с помощью учителя, спланировал и организовал свою деятельность по готовому алгоритму, оценил результат и процесс деятельности.
- Творческий уровень: ученик самостоятельно сформировал цели и задачи деятельности, спланировал и организовал свою деятельность, сделал анализ результата и процесса деятельности.
Способы обучения: индивидуально-групповой способ, фронтальный способ.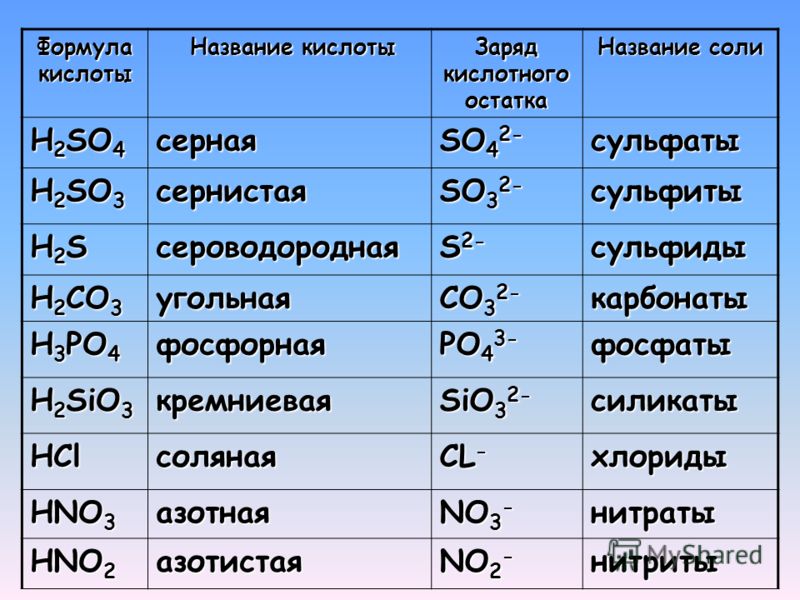
Средства обучения: медиа, ноутбук, карточки с заданиями, схемы, таблицы, ящики с лабораторным оборудованием и реактивами (штатив с пробирками, стеклянная палочка, колба с водой, стакан для слива, оксид меди (II), сажа, раствор серной кислоты, соляная кислота, гидроксид натрия, вода, сульфат натрия, раствор азотной кислоты и гидроксида калия, демонстрационный ящик с неорганическими веществами различных классов.
Ход урока
I. Исходная мотивация. Погружение в проблемуУчитель: Посмотрите, ребята, у меня на демонстрационном столе стоит много разных склянок. Что находится внутри каждой склянки?
Ученики: Химическое вещество.
Учитель: Мы с вами знаем, что по правилам техники безопасности каждая склянка должна быть подписана. Обратите внимание на этикетки склянок. Какой вывод мы можем сделать? Можно ли эти вещества каким-то образом рассортировать?
Ученики: Вещества относятся к разным классам неорганических веществ, мы можем, глядя на химическую формулу на этикетках распределить их на классы.
Учитель: Сколько классов веществ мы должны получить? Какие?
Ученики: 4; оксиды, основания, кислоты, соли.
Учитель: Следовательно, какая будет тема сегодняшнего урока?
Ученики: «Основные классы неорганических веществ».
Учитель: Мы уже изучили каждый класс веществ по отдельности. Что мы должны сделать на уроке сегодня?
Ученики: Обобщить знания обо всех четырёх классах неорганических веществ.
Учитель: Какие вопросы мы должны рассмотреть, чтобы достичь поставленной цели?
Ученики:
- Что такое оксиды, основания, кислоты, соли?
- Какие они бывают?
- Как правильно давать названия веществам разных классов?
- Как составлять химические формулы веществ?
- Как можно распознать вещества разных классов?
Учитель: Ребята, вначале урока, каждый из вас взял карточку с названием одного класса неорганических веществ (оксиды, основания, кислоты, соли), таким образом, у нас образовалось 4 группы, в которых вам сегодня предстоит поработать. У каждой группы на столах лежит лист с заданиями и различные источники информации (учебники, справочники, схемы, таблицы, ваши рабочие тетради). Также, я вам предлагаю алгоритм работы. Если у вас возникнут вопросы, вы всегда можете получить консультацию у меня.
У каждой группы на столах лежит лист с заданиями и различные источники информации (учебники, справочники, схемы, таблицы, ваши рабочие тетради). Также, я вам предлагаю алгоритм работы. Если у вас возникнут вопросы, вы всегда можете получить консультацию у меня.
Алгоритм работы для обучающихся.
- Прочитайте внимательно предложенные вам задания.
- Обсудите ход выполнение заданий, составьте план работы вашей группы.
- Выполните задания, оформите результат работы.
- Представьте свою работу (подумайте, кто из вас будет отвечать по каждому заданию).
- Дайте оценку своей работе в группе и работе группы в целом.
Обучающиеся самостоятельно выполняют задания, предложенные учителем, используя по своему усмотрению различные источники информации, а также, опираясь на ранее полученные знания. Оформляют результаты деятельности.
Задания для группы №1. Оксиды.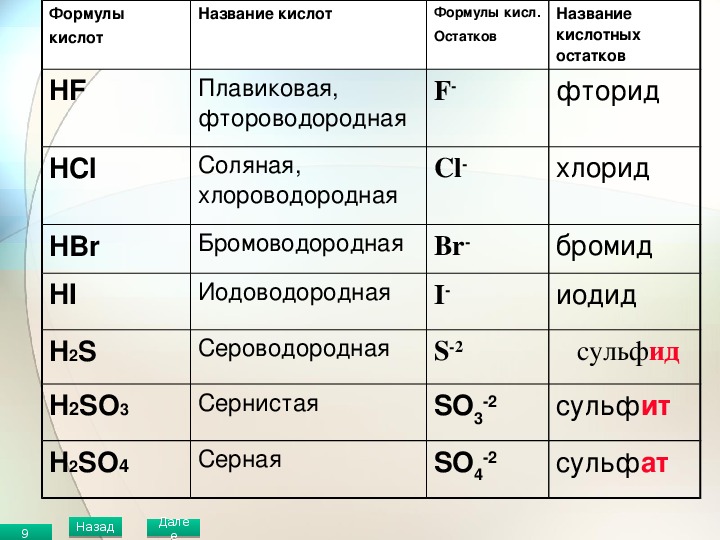
1. Проанализируйте предложенные вам формулы веществ и допишите определение, вставив пропущенные слова.
Оксиды – это _____ вещества, состоящие из _____ химических элементов, один из которых _____ , в степени окисления _____ .
Формулы: Na2O, CaO, SO2, P2O5, Al2O3.
2. Заполните схему, используя следующие понятия: «оксиды», «несолеобразующие оксиды», «кислотные оксиды», «основные оксиды», «солеобразующие оксиды». Приведите по три примера. Обоснуйте свой ответ.
3. Установите соответствие между формулами оксидов и их названиями.
Формулы оксидов | Названия оксидов |
1. P2O5 | А. Оксид серы (VI) |
Как даются названия веществам данного класса?
4. Составьте формулы:
1) оксидов железа, в которых металл проявляет степени окисления +2 и +3;
2) оксидов серы, в которых неметалл проявляет степени окисления +4 и +6.
5. В двух пронумерованных пробирках находятся оксид меди (II) и сажа. Как определить, в какой из пробирок находится оксид?
Задания для группы №2. Основания.
1. Даны формулы веществ, относящихся к классу оснований. Проанализируйте их, и допишите определения, вставив пропущенные слова.
Основания – это _____ вещества, состоящие из атомов _____ , связанных с одной или несколькими _____ .
Формулы: NaOH, Fe(OH)2, Ca(OH)2, KOH, Al(OH)3, Fe(OH)3
2. Записаны три ряда формул:
А. NaOH, Ba(OH)2, Cu(OH)2, KOH (таблица растворимости)
Б. Fe(OH)2, Pb(OH)2, LiOH, Ba(OH)2
В. LiOH, KOH, Al(OH)3, NaOH
LiOH, KOH, Al(OH)3, NaOH
В каждом ряду находиться одно лишнее основание. Определите его формулу, ответ обоснуйте.
3. Распределите формулы оснований, предложенных в первом задании, по соответствующим их названиям:
А. гидроксид кальция — …
Б. гидроксид железа (III) — …
В. гидроксид натрия — …
Г. гидроксид алюминия — …
Д. гидроксид железа (II) — …
Е. гидроксид калия — …
4. Пользуясь таблицей растворимости, составьте формулы трёх нерастворимых оснований и назовите их.
5. В трёх пробирках без этикеток находятся бесцветные растворы: №1 – соляная кислота, №2 – гидроксид натрия, №3 – вода. Как определить, в какой из них находится раствор щелочи?
Задания для группы №3. Кислоты.
1. Формулы: HCl, h3SO4, HNO3, h3CO3, h4PO4. Проанализируйте предложенные вам формулы веществ и допишите определение, вставив пропущенные слова:
Кислоты – это _____ вещества, молекулы которых состоят из атомов _____ и _____
2.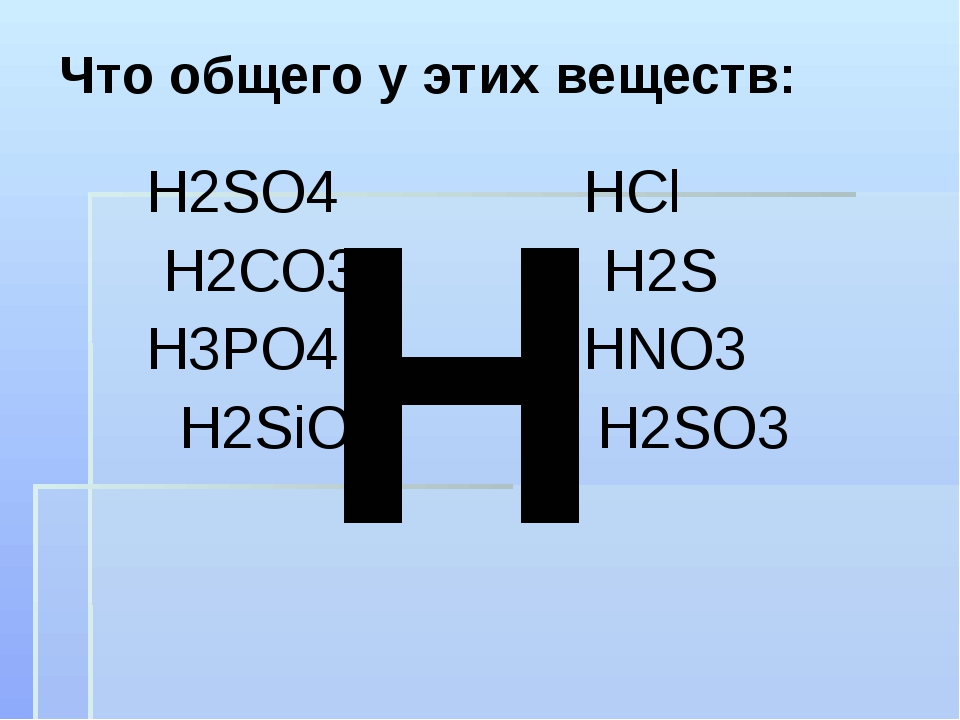 Даны формулы кислот: H2S, HCl, HNO3, H2SO4, H3PO4, H2CO3, H2SO3, HClO4. Распределите их по двум признакам на 2 и 3 группы соответственно. Ответ обоснуйте.
Даны формулы кислот: H2S, HCl, HNO3, H2SO4, H3PO4, H2CO3, H2SO3, HClO4. Распределите их по двум признакам на 2 и 3 группы соответственно. Ответ обоснуйте.
3. Верны ли утверждения?
А. Азотная кислота имеет формулу HNO3.
Б. Формула соляной кислоты H2S.
В. H3PO4 – это фосфорная кислота.
Г. Вещество H2SO3 называется серная кислота.
Д. H2CO3 – это угольная кислота.
Е. Кремниевая кислота имеет формулу H2SiO3.
Ж. Хлороводородная кислота имеет формулу HCl.
З. Соединение H2SO4 называется сероводородная кислота.
4. Установите соответствие между формулами кислот и их названиями:
Формулы кислот | Названия кислот |
1. | А. Фосфорная кислота |
5. В трех пробирках без этикеток находятся бесцветные растворы: №1 – серная кислота, №2 – гидроксид калия, №3 – вода. Как определить, в какой из них находится кислота?
Задания для группы №4. Соли.
1. Даны формулы веществ: NaCl, K2CO3, BaSO4, Li3PO4. Проанализируйте их и допишите определение, вставив пропущенные слова.
Соли – это _____ вещества, состоящие из атомов _____ и _____ .
2. А. Даны формулы солей: K2SO4, KHSO4, CuCl2, NaHCO3, CuOHCl, FeS, Al(NO3)3, Fe(OH)2CL, BaSO4. Распределите их на три классификационные группы.
Б. Приведите по два примера растворимых и нерастворимых солей.
Приведите по два примера растворимых и нерастворимых солей.
3. Составьте формулы солей, которые можно получить при взаимодействии кислот и металлов, обозначенных в таблице (в скобках указаны степени окисления металлов).
Кислоты | Металлы | Названия солей, содержащих атомы алюминия | ||
К (+1) | Mg(+2) | Al (+3) | ||
HNO3 |
|
|
|
|
H2SO4 |
|
|
|
|
H3PO4 |
|
|
|
|
4. В трех пробирках без этикеток находятся бесцветные растворы: №1 – соляная кислота, №2 – гидроксид натрия, №3 – сульфат натрия. Как определить, в какой из них находится соль?
В трех пробирках без этикеток находятся бесцветные растворы: №1 – соляная кислота, №2 – гидроксид натрия, №3 – сульфат натрия. Как определить, в какой из них находится соль?
По истечении времени, отведенного на данную работу, каждая группа представляет свои результаты. Учащиеся других групп слушают ответы, задают уточняющие вопросы.
Учитель строит беседу, опираясь на проблемные вопросы, которые ученики поставили перед собой вначале урока. Каждая группа поочереди отвечает на каждый вопрос.
Модельные ответы.
Что такое оксиды, основания, кислоты, соли?
Задание 1. I группа.
Оксиды – это сложные вещества, состоящие из двух химических элементов, один из которых кислород, в степени окисления -2 .
Задание 1. II группа.
Основания – это сложные вещества, состоящие из атомов металлов, связанных с одной или несколькими гидроксильными группами OH.
Задание 1. III группа.
Кислоты – это сложные вещества, молекулы которых состоят из атомов водорода и кислотного остатка.
Задание 1. IV группа.
Соли – это сложные вещества, состоящие из атомов металлов и кислотного остатка.
Какие они бывают? (классификация)
Задание 2. I группа.
Задание 2. II группа.
А. Cu(OH)2 – нерастворимое основание, остальные все растворимые (щелочи)
Б. LiOH – однокислотное основание, остальные – двухкислотные основания
В. Al(OH)3 – трехкислотное нерастворимое основание, остальные — однокислотные растворимые основания
Задание 2. III группа.
Бескислородные — H2S, HCl; кислородсодержащие — HNO3, H2SO4, h4PO4, H2CO3, H2SO3, HClO4.
Одноосновные — HCl, HNO3, HClO4; двухосновные — H2S, H2SO4, H2CO3, H2SO3; трехосновная — H3PO4 (по количеству атомов водорода).
Задание 2. IV группа.
А. Средние — K2SO4, CuCl2, FeS, Al(NO3)3, BaSO4; кислые — KHSO4, NaHCO3; основные – CuOHCl, Fe(OH)2CL.
Б. Растворимые соли — K2SO4, Al(NO3)3; нерастворимые соли — BaSO4, AgCl.
- Как правильно давать названия веществам разных классов?
- Как составлять химические формулы веществ?
Задание 3. I группа.
1. В
2. Г
3. Д
4. А
5. Б
Задание 3. II группа.
А. Ca(OH)2
Б. Fe(OH)3
В. NaOH
Г. Al(OH)3
Д. Fe(OH)2
Е. KOH
KOH
Задание 3. III группа.
А. Да
Б. Нет
В. Да
Г. Нет
Д. Да
Е. Да
Ж. Да
З. Нет
Задание 3. IV группа.
| Кислоты | Металлы | Названия солей, содержащих атомы алюминия | ||
К (+1) | Mg(+2) | Al (+3) | ||
HNO3 | KNO3 | Mg(NO3)2 | Al(NO3)3 | Нитрат алюминия |
H2SO4 | K2SO4 | MgSO4 | Al2(SO4)3 | Сульфат алюминия |
H3PO4 | K3PO4 | Mg3(PO4)2 | AlPO4 | Фосфат алюминия |
Задание 4. I группа.
I группа.
- FeO, Fe2O3
- SO4, SO3
Задание 4. II группа. (возможны другие варианты ответов)
- Al(OH)3 – гидроксид алюминия
- Cu(OH)2 – гидроксид меди (II)
- Fe(OH)2 – гидроксид железа (II)
Задание 4. III группа.
1. Г
2. В
3. Е
4. А
5. Б
6. Д
Как можно распознать вещества разных классов?
Задание 5. I группа.
В обе пробирки прилить раствор серной кислоты. С сажей кислота не взаимодействует, а в пробирке с оксидом меди (II) образуется голубой раствор.
CuO + H2SO4 → CuSO4 + H2O
Задание 5. II группа. (возможны другие варианты ответов)
Можно использовать универсальный индикатор: в кислоте он станет малинового цвета, в щелочи – синего, а в воде останется без изменений.
Задание 5. III группа. (возможны другие варианты ответов)
Можно использовать универсальный индикатор: в кислоте он станет малинового цвета, в щелочи – синего, а в воде останется без изменений.
Задание 4. IV группа.
Можно использовать универсальный индикатор: в кислоте он станет малинового цвета, в щелочи – синего, а в данной соли останется без изменений. Также можно использовать раствор хлорида бария: в пробирке, где находится соль выпадет белый порошкообразный осадок, в двух других ничего не произойдет.
Учитель: Теперь, ребята, давайте посмотрим, внимательно ли вы слушали друг друга. Задание для всех четырех групп: из перечисленных формул: H2S, K2SO4, NaOH, CO2, Fe(OH)3, Al2O3, Mg3(PO4)2, HNO3, CuCl2, Ba(OH)2, Na2O, H2CO3 выпишите последовательно формулы:
оксиды | основания | кислоты | соли |
|
|
|
|
Ответ:
| оксиды | основания | кислоты | соли |
CO2 | NaOH | H2S | K2SO4 |
Приложения
V. Рефлексия
РефлексияУчитель: Ребята, вы сегодня хорошо поработали, всем большое спасибо! В конце нашего урока, я предлагаю вам оценить свою работу и работу своих одноклассников. Для этого заполните, пожалуйста, таблицу, которая лежит у вас на столах и сдайте ее, а я посмотрю на результат.
Заполните только колонку 2, поставив х, там где вы считаете это нужно сделать.
1 | 2 | 3 |
я из указанного источника зафиксировал информацию и воспроизвёл её. |
|
|
я из нескольких источников зафиксировал информацию, сделал вывод и привёл хотя бы один аргумент для его подтверждения. |
|
|
я самостоятельно организовал поиск информации, охарактеризовал основные источники, сделал вывод на основе анализа нескольких аргументов. |
|
|
я ответил на вопросы с помощью товарищей или учителя по заданному алгоритму. |
|
|
я самостоятельно давал односложные ответы по заданному алгоритму, сотрудничал с членами группы, договорившись о процедуре. |
|
|
я самостоятельно дал развернутый аргументированный ответ, обобщил результаты обсуждения в группе. |
|
|
я понял цели и задачи деятельности, организовал свои действия с помощью товарищей или учителя, высказал своё мнение о проделанной работе. |
|
|
я сформировал цели и задачи с помощью учителя, спланировал и организовал свою деятельность по готовому алгоритму, оценил результат и процесс деятельности. |
|
|
я самостоятельно сформировал цели и задачи деятельности, спланировал и организовал свою деятельность, сделал анализ результата и процесса деятельности. |
|
|
Домашнее задание: повторить §18–21.
Список используемых ресурсов
- Габриелян О.С. Химия. 8 класс: учеб. для общеобразоват. учреждений / О.С.Габриелян. – 12-е изд., стереотип. – М.: Дрофа, 2011.
- Габриелян О.С. Химия. 8 кл.: рабочая тетрадь к учебнику О.С.Габриеляна «Химия. 8 класс» / О.С.Габриелян, А.В.Яшукова. – 13-е изд., стереотип. – М. : Дрофа, 2011. – 192 с.: ил.
- Рябов М.А. Тесты по химии. Введение. Атомы химических элементов. Простые вещества. Соединения химических элементов: 8 класс: к учебнику О.С.Габриеляна «Химия. 8 класс» / М.А. Рябов, Е.
 Ю. Невская. – 2-е изд., перераб. и доп. – М.: Издательство «Экзамен», 2011. – 125 с. (Серия «Учебно-методический комплект»).
Ю. Невская. – 2-е изд., перераб. и доп. – М.: Издательство «Экзамен», 2011. – 125 с. (Серия «Учебно-методический комплект»). - Химия 8, 9 класс. Мультимедийное приложение к учебнику О.С.Габриеляна. Электронное учебное издание. ООО «Дрофа», 2011.
- http://school-collection.edu.ru/
- http://nsportal.ru/shkola/obshchepedagogicheskie-tekhnologii/
- https://urok.1sept.ru/
ПРИМЕР Урока развивающего контроля (химия) // Урок развивающего контроля // ГБОУ Лицей № 410
ПРИМЕР Урока развивающего контроля (химия) // Урок развивающего контроля // ГБОУ Лицей № 410ПРИМЕР Урока развивающего контроля (химия)
УРОК _ХИМИИ
ТЕМА_«Основные классы соединений»
КЛАСС _8
ВИД И ТИП УРОКА: УРОК РАЗВИВАЮЩЕГО КОНТРОЛЯ
МЕТОДИЧЕСКОЕ ОБЕСПЕЧЕНИЕ: Учебник О.С. Габриелян «Химия. 8 класс.», М., Дрофа, 2010.
ТЕХНИЧЕСКОЕ ОБЕСПЕЧЕНИЕ: тексты заданий для проведения контрольной работы; вспомогательные алгоритмы, эталон контрольной работы, алгоритм исправления ошибок школьниками, система заданий для коррекции ошибок, задания, аналогичные к/р для выборочного выполнения школьниками, дополнительные задания для учащихся, которые без ошибок справились с работой – для проведения урока по анализу к/р.
ОБЩИЕ ЦЕЛИ УРОКА
Деятельностная цель: Формирование мотивации образовательной деятельности школьников на основе личностно-ориентированного подхода для контроля уровня усвоения материала по теме «Основные классы соединений». Формирование способности учащихся к осуществлению контрольной функции.
Развивающая цель: контроль и самоконтроль изученных понятий и алгоритмов.
Формы работы учащихся:
- Самостоятельная индивидуальная работа учащихся по выполнению контрольной работы, которая состоит из трёх заданий. Первое задание проверяет знание учащимися основных классов соединений и их названия. Второе – умение составлять формулы гидроксидов и оксидов по степени окисления элементов. Третье — расчётные задачи. Это позволяет проверить не только уровень специальных умений и навыков, но и степень овладения общеобразовательными компетенциями (методологические, логические умения; сравнение, сопоставление объектов по предложенным основаниям работа с информацией, представленной в разных формах и др.
 ).
). - Самоконтроль — эталонный вариант предлагается ученику для сравнения и самостоятельного оценивания собственного варианта. Для каждого задания прописаны критерии, по которым будет осуществляться контроль. Таким образом, учащиеся изначально владеют информацией о «стоимости» каждого задания и могут прогнозировать свою оценку за контрольную работу.
- Педагогический контроль – эталон находится у педагога. Способность к самооценке формируется путём согласования с учителем результата, на основе ранее установленных критериев и рефлексивного анализа допущенных ошибок.
Структура урока .
№ п/п | Этап урока | Деятельность учителя | Деятельность учащихся | УУД |
1 | Мотивация к контрольно-коррекционной деятельности. | Применяет прием «До-после», в ходе которого школьники сами формулируют цель урока, создаёт условия для возникновения внутренней потребности включения в контрольно- коррекционную деятельность («хочу»), актуализирует требования к ученику со стороны контрольно-коррекционной деятельности («надо»). Устанавливает тематические рамки и создает основу контрольно-коррекционных действий «могу». Организовывает повторение контролируемых способов действий, сопоставление учащимися своих работ по готовому образцу. | Принимают участие в диалоге с учителем, задают вопросы. | Регулятивные |
2 | Контроль и самопроверка знаний. Продолжительность 37-42 минуты. | Организует индивидуальную деятельность учащихся (написание контрольной работы). | Индивидуальная работа. (Приложение 1). Проверяют свою работу по эталону (Приложение 2.). | Регулятивные |
3 | Локализация индивидуальных затруднений. Продолжительность – 6-8 минут. | Применяет прием «З-Х-У», организует мотивирование учащихся к коррекционной деятельности. | Определяют цель урока. | Познавательные |
4 | Целеполагание и построение проекта коррекции выявленных затруднений. Продолжительность: 10-12 минут. | Применяет прием «Связующие Алгоритмы», организует процесс обсуждения учащимися целей коррекции, а также помогает выбрать необходимые средства и способы их достижения (Приложение 4) . | Формулируют индивидуальные цели и алгоритм коррекционных действий. | Регулятивные |
5 | Реализация построенного проекта. Продолжительность 7-8 минут. | Применяет прием «Мудрые совы», организует выполнение учащимися самостоятельной работы. | Коррекция учащимися своих ошибок (работа с эталоном) в контрольной работе и применение соответствующих способов действий. Выполняют самостоятельную работу. | Регулятивные |
6 | Обобщение затруднений во внешней речи | Применяет прием «Хочу спросить». Организует обсуждение типовых затруднений. | Задают вопросы, участвуют в выявлении типичных ошибок. | Коммуникативные |
7 | Самостоятельная работа с самопроверкой по эталону. | Применяет прием «Райтинг», Организует выполнение учащимися самостоятельной работы. | Выполняют самостоятельную работу. | Регулятивные |
8 | Включение в систему знаний и повторения. | Применяет прием «Мысли во времени», организует применение способов действий, вызвавших затруднения, повторение и закрепление ранее изученного материала и подготовка к изучению следующих разделов курса. | В течение 1 минуты учащиеся записывать свои мысли, которые «приходят в голову» и связаны со словом «Ошибка». | Регулятивные |
9 | Рефлексия. | Применяет прием «Рюкзак». Проговаривает механизм деятельности по контролю. | Принимают участие в игре, продолжая фразу «Я на уроке…» и передавая по цепочке импровизированный «рюкзак». | Познавательные |
Приложение 1.
Контрольная работа по теме
«Соединения химических элементов»
1. Из перечня формул выпишите отдельно формулы оксидов, оснований, кислот, солей и дайте им названия:
1 вариант – h3SO4, Na2O, CuSO4, KOH, SO3, h3S, Mg(OH)2, Al2(SO4)3, FeS, h3O, Fe(OH)3, HCl
2 вариант – Cr(OH)3, HNO3, MgCl2, LiOH, FeSO4, h3SO3, CO2, AgNO3, Na2O, HF, Fe2O3, Ca(OH)2
3 вариант– NaCl, Cu2O, Cu(OH)2, HNO2, Al2S3, h3, N2O5, Al(OH)3, FeO, BaSO4, AgOH, h3CO3.
Критерии оценки:
Правильно указаны оксиды – 1 б. Правильно указаны основания – 1б. Правильно указаны кислоты — 1б. Правильно указаны соли — 1б. | Правильно названы все оксиды – 1 б. |
ИТОГО | 8 б. |
2. Укажите заряды ионов и степени окисления элементов в формулах веществ. Для гидроксидов (кислоты и основания) запишите формулы соответствующих им оксидов, а для соли – формулы гидроксидов.
1 вариант – CaCO3, Cr(OH)3, h3SO4
2 вариант – Mg(OH)2, h3CO3, Na2SO4
3 вариант – NaOH, HNO3, Ba(NO3)2.
Критерии оценки:
Правильно указаны заряды всех ионов — 1б. Правильно указаны степени окисления всех элементов – 1б. Правильно записаны формулы оксидов для гидроксидов – 1 б. Правильно записаны формулы гидроксидов для соли – 1 б. |
ИТОГО 4 б. |
3. Решите задачу. Ответ запиши с точностью до сотых.
1 вариант –Сколько граммов сахара и сколько граммов воды надо взять для приготовления 250 г 12% раствора?
2 вариант – К 100 г 30 %-го раствора сахара добавили 10 г сахара. Какова массовая доля сахара в полученном растворе?
3 вариант – К 200 г 10 %-го раствора сахара добавили 100 г воды. Какова массовая доля сахара в полученном растворе?
Критерии оценки:
Правильно записано условие задачи — 1б.  Правильно записана формула для нахождения неизвестного – 1б. Правильно сделаны вычисления – 1 б. |
ИТОГО 3 б. |
Критерии оценки за контрольную работу
Количество баллов | 15-14 | 13-11 | 10-8 | 7-0 |
Оценка | «5» | «4» | «3» | «2» |
Рекомендации по проведению и проверке контрольной работы.
Контрольная работа представляется в четырёх вариантах. В каждом задании представлены критерии оценивания. Эти критерии необходимо заранее (перед началом работы) оговорить с учащимися. Ребята должны знать, какую оценку они могут получить и что для этого необходимо выполнить. Проверку контрольной работы можно организовать таким способом, чтобы учащиеся использовали другой цвет ручки. На этом этапе не предполагается выяснение причин своих ошибок и их исправление. Данный этап завершается фиксацией своих ошибок и выставлением самооценки и сдачей контрольной работы учителю. На этапе выполнения самостоятельной работы учащиеся выполняют аналогичные задания из другого варианта в контрольной работе.
Ребята должны знать, какую оценку они могут получить и что для этого необходимо выполнить. Проверку контрольной работы можно организовать таким способом, чтобы учащиеся использовали другой цвет ручки. На этом этапе не предполагается выяснение причин своих ошибок и их исправление. Данный этап завершается фиксацией своих ошибок и выставлением самооценки и сдачей контрольной работы учителю. На этапе выполнения самостоятельной работы учащиеся выполняют аналогичные задания из другого варианта в контрольной работе.
Данный формат контрольных работ позволяет учителю провести поэлементный анализ качества знаний по предложенной теме с целью дальнейшей коррекции содержания и методов обучения.
Приложение 2.
Контрольная работа по теме
«Соединения химических элементов»
Эталонный вариант
1. Из перечня формул выпишите отдельно формулы оксидов, оснований, кислот, солей и дайте им названия:
1 вариант –
Оксиды | Основания | Кислоты | Соли |
Na2O – оксид натрия | KOH – гидроксид калия | h3SO4 — серная | CuSO4 – сульфат меди (II) |
2 вариант –
Оксиды | Основания | Кислоты | Соли |
CO2 – оксид углерода (IV) | Cr(OH)3 — гидроксид хрома(III) | HNO3 — азотная | MgCl2 – хлорид магния |
3 вариант–
Оксиды | Основания | Кислоты | Соли |
Cu2O – оксид меди (II) | Cu(OH)2 — гидроксид меди (II) | HNO2 — азотистая | NaCl — хлорид натрия |
2. Укажите заряды ионов и степени окисления элементов в формулах веществ. Для гидроксидов (кислоты и основания) запишите формулы соответствующих им оксидов, а для соли – формулы гидроксидов.
Укажите заряды ионов и степени окисления элементов в формулах веществ. Для гидроксидов (кислоты и основания) запишите формулы соответствующих им оксидов, а для соли – формулы гидроксидов.
1 вариант – заряды ионов: Ca2+CO32-, Cr3+(OH)3-, H2+SO42-
степени окисления: Ca+2C+4O3-2, Cr3+(O-2H+1)3-, H2+1S+6O4-2
CaCO3→Ca(OH)2, Cr(OH)3 → Cr2O3, h3SO4→ SO3
h3CO3
2 вариант – заряды ионов: Na+2SO2-4, Mg2+ (OH) -2, H+2CO2-3
степени окисления: Na+12S+6O2-4, Mg2+ (O-2H+1)2, H+2C+4O2-3
Na2SO4→NaOH, Mg(OH)2 → MgO, h3CO3→ CO2
h3SO4
3 вариант – заряды ионов: Ba2+ (NO3) -2, Na+OH- , H+NO-3
степени окисления: Ba+2 (N+5O2-3) -2, Na+1 O-2H+1, H+1N+5O2-3
Ba(NO3) 2→Ba(OH)2, NaOH→ Na2O, HNO3→ N2O5
HNO3
3. Решите задачу.
Решите задачу.
1 вариант – Сколько граммов сахара и сколько граммов воды надо взять для приготовления 250 г 12% раствора?
Дано: Решение:
mр-ра= 250 г mр.в.= ω* mр-ра = 0,12*250 = 30 г
ω = 12% = 0,12 mр-ль = mр-ра — mр.в = 250 – 30 = 220 г
mр.в.= х г
mр-ль= у г Ответ: 30 г, 220 г
2 вариант – К 100 г 30 %-го раствора сахара добавили 10 г сахара. Какова массовая доля сахара в полученном растворе?
Дано: Решение:
m1 р-ра= 100 г m1р.в = ω1* m1 р-ра = 0,3 * 100 = 30 г
ω1 = 30% = 0,3
m р.в .= 10 г ω2= (m1р.в + m р.в )/ (m1 р-ра + m р.в ) = (30+10)/100+10 = 0,37
ω2 = x % Ответ: 37%
3 вариант – К 200 г 10 %-го раствора сахара добавили 100 г воды. Какова массовая доля сахара в полученном растворе?
Какова массовая доля сахара в полученном растворе?
Дано: Решение:
m1 р-ра= 200 г m1р.в = ω1* m1 р-ра = 0,1 * 200 = 20 г
ω1 = 10% = 0,1
m р-ль.= 100 г ω2= m1р.в / (m1 р-ра + m р-ль ) = 20/200+100= 0,07
ω2 = x % Ответ: 7%
Приложение 3.
Дополнительные задания
для учащихся, которые без ошибок справились с контрольной работой.
Вариант 1
- Составьте формулы следующих веществ: нитрита магния, бромида кальция, фосфата стронция, оксида мышьяка (V), фосфата калия, гидроксида свинца (II), оксида кремния (II), бромной кислоты (правильно составлены все формулы — 8 б.).
- Заполните таблицу по образцу (правильно составлены все формулы — 9 б.):
- Смешали 200 г 40 %-го и 100 г 30 %-го растворов азотной кислоты.
 Определите массовую долю кислоты в полученном растворе (правильно записано условие задачи, правильно записана формула для нахождения неизвестного, правильно сделаны вычисления – 3 б.).
Определите массовую долю кислоты в полученном растворе (правильно записано условие задачи, правильно записана формула для нахождения неизвестного, правильно сделаны вычисления – 3 б.).
Вариант 2.
- Составьте формулы следующих веществ: нитрата кальция, фторида алюминия, карбоната лития, оксида мышьяка (III), сульфита натрия, гидроксида железа (II), оксида меди (II), хлорной кислоты (правильно составлены все формулы — 8 б.).
- Заполните таблицу по образцу (правильно составлены все формулы — 9 б.):
- Смешали два раствора гидроксида натрия: 120 г 5 %-го раствора и 130 г 15 %-го раствора. Рассчитайте массовую долю гидроксида натрия в полученном растворе (правильно записано условие задачи, правильно записана формула для нахождения неизвестного, правильно сделаны вычисления – 3 б.).
Приложение 4.
Алгоритм исправления ошибок школьниками:
Приложение 5.
Алгоритм конструирования урока развивающего контроля.
- Определить форму и процедуру проведения контрольной работы.
- Составить список знаний – понятий, алгоритмов, правил, способов действий и т.д., которые требуют контроля усвоения. Подобрать соответствующие эталоны.
- В соответствии с принципом минимакса подобрать задания для контрольной работы на применение перечисленных знаний.
- Составить контрольную работу.
- Подобрать задания для этапа самостоятельной работы с самопроверкой.
- Определить критерии оценивания контрольной работы и форму его представления учащимся.
- Подготовить образцы и эталоны для самопроверки.
- Определить способы организации самопроверки контрольной и самостоятельной работ.
- Продумать форму организации этапа мотивации.
- Продумать форму организации актуализации знаний.

- Продумать организацию работы с алгоритмом исправления и, при необходимости, составить диалог для его коррекции на уроке.
- Спроектировать деятельность учащихся, зафиксировавших отсутствие затруднений (подобрать задания более высокого уровня сложности, продумать способ их предъявления и проверки, продумать возможность их включения в консультационную работу и пр.)
- Продумать формы организации работы в классе на каждом этапе урока.
- Продумать форму организации этапа рефлексии.
- Сконструировать диалоги для организации коллективной работы на всех этапах урока.
- В случае организации групповой работы, сформулировать задания и способы организации обратной связи по результатам работы групп.
- Подобрать задания для этапа повторения, продумать аргументацию выбора заданий.
- Составить технологическую карту урока.
- Провести анализ технологической карты. Внести корректировку.
Алгоритм подготовки урока развивающего контроля см. Приложение 5.
Приложение 5.
Обычное название h3SO4: A масло купороса B, соляная кислота, класс 11 по химии CBSE
Подсказка: Химическое название ${{H}_{2}}S{{O}_{4}}$ — серная кислота и это сильная минеральная кислота. Историческое название ${{H}_{2}}S{{O}_{4}}$ — купорос. ${{H}_{2}}S{{O}_{4}}$ — это густая коррозионная маслянистая жидкость, которая является одним из наиболее важных с коммерческой точки зрения химических веществ. Он также известен как король химических веществ. Полное пошаговое решение:
-Из уроков химии вы узнали о кислотах и о серной кислоте, имеющей химическую формулу ${{H}_{2}}S{{O}_{4}. }$.Кислоты определяются как вещества, которые выделяют ионы водорода или гидроксония, когда они растворяются в своих растворах.
— Поскольку мы знаем, что серная кислота состоит из таких элементов, как сера, кислород и водород, который представлен химической формулой ${{H}_{2}}S{{O}_{4}}$, является сильная минеральная кислота. Он также известен как король химикатов, потому что он имеет огромное применение в различных отраслях промышленности, особенно в тяжелой промышленности. Серная кислота представляет собой густую коррозионную маслянистую жидкость, которая является одним из наиболее важных с коммерческой точки зрения химических веществ.
Серная кислота представляет собой густую коррозионную маслянистую жидкость, которая является одним из наиболее важных с коммерческой точки зрения химических веществ.
— Серная кислота также известна как купоросное масло и матирующая кислота. В прошлом серная кислота производилась из зеленого купороса, и поэтому полученная серная кислота имеет маслянистый вид, поэтому ее называют купоросным маслом. Поскольку мы знаем, что химическое название ${{H}_{2}}S{{O}_{4}}$ — дигидросульфат или гидросульфат, потому что он содержит два атома водорода, один атом серы и четыре атомы кислорода. Поэтому общее название ${{H}_{2}}S{{O}_{4}}$ — купоросное масло.
Таким образом, правильный вариант будет (A).
Примечание: Слово купорос, которое мы использовали здесь, означает сульфаты. ${{H}_{2}}S{{O}_{4}}$ представляет собой бесцветную, вязкую жидкость без запаха, растворимую в воде, а серные кислоты синтезируются в тех реакциях, которые являются сильно экзотермическими. ${{H}_{2}}S{{O}_{4}}$ используется в производстве многих химических веществ, таких как азотная кислота, соляная кислота, синтетические моющие средства, красители и т. д.
${{H}_{2}}S{{O}_{4}}$ используется в производстве многих химических веществ, таких как азотная кислота, соляная кислота, синтетические моющие средства, красители и т. д.
Серная Кислотная формула и структура | Как производят серную кислоту?
Формула серной кислоты
Химическая формула серной кислоты, как упоминалось ранее, h3SO4. Эта формула показывает атомный состав этой молекулы и составляющих ее элементов. Каждая молекула серной кислоты содержит два атома водорода, один атом серы и четыре атома кислорода.
Структура серной кислоты
Молекула серной кислоты содержит две гидроксильные группы (ОН), присоединенные к атому серы одинарными связями. Этот атом серы также связан с двумя атомами кислорода двойными связями.
Как производится серная кислота?
Серная кислота производится в результате четырехстадийной реакции, называемой контактным процессом . Сырьем для этой реакции являются сера, кислород и вода.
На первом этапе путем сжигания серы в присутствии кислорода получают диоксид серы (SO2). Затем катализатор на основе пятиокиси ванадия (V2O5) используется для катализа окисления диоксида серы в триоксид серы (SO3).Этот этап происходит при высоких температурах (450 градусов Цельсия). Затем триоксид серы взаимодействует с серной кислотой (h3SO4) с образованием олеума (h3S2O7). Наконец, олеум взаимодействует с водой с образованием серной кислоты.
Химические уравнения для этих четырех стадий следующие:
- 1) S + O2 -> SO2
- 2) 2 SO2 + O2 -> 2 SO3 (с использованием катализатора V2O5 и температуры 450 градусов Цельсия)
- 3) SO3 + h3SO4 -> h3S2O7
- 4) h3S2O7 + h3O -> 2 h3SO4
В настоящее время подсчитано, что ежегодно во всем мире производится более 270 миллионов тонн серной кислоты, и прогнозируется увеличение этого количества в ближайшие годы.
Применение серной кислоты
Серная кислота считается одним из наиболее важных реагентов, и существует множество промышленных применений этого соединения. Вот некоторые примеры:
- Используется для производства сельскохозяйственных удобрений, таких как сульфат аммония и суперфосфат.
- Используется в контактном процессе для получения большего количества H3SO4.
- Используется в производстве химических красителей, пигментов и красок.
- Используется в процессе переработки нефти.
- Используется при обработке металлов.
- Производство искусственного шелка.
- В качестве ингредиента при производстве лекарств и мазей.
- Из-за низкой летучести он используется в производстве других кислот, таких как соляная кислота, фосфорная кислота и азотная кислота.
Опасности
Концентрированная серная кислота представляет собой высококоррозионное соединение, которое при неправильном обращении представляет различные риски для здоровья. При работе с этим веществом крайне важно носить соответствующие средства индивидуальной защиты (СИЗ).Соответствующие СИЗ включают защитные очки, резиновые перчатки, сапоги, лабораторный халат, респиратор и лицевой щиток.
При работе с этим веществом крайне важно носить соответствующие средства индивидуальной защиты (СИЗ).Соответствующие СИЗ включают защитные очки, резиновые перчатки, сапоги, лабораторный халат, респиратор и лицевой щиток.
Потенциальные опасности для здоровья, связанные с серной кислотой, включают:
- Химические ожоги при попадании на кожу,
- Слепота при попадании в глаза,
- Химические ожоги, повреждение органов и смерть при проглатывании и
- Ожоги, раздражение, повреждение тканей и эрозия зубов в результате воздействия/вдыхания аэрозоля.
Вне промышленных и лабораторных установок концентрированная серная кислота также может использоваться в домашних условиях в качестве кислотного очистителя канализации.Очень важно, чтобы такие чистящие средства хранились и обращались с особой осторожностью, чтобы предотвратить любую из вышеупомянутых проблем со здоровьем.
Краткий обзор урока
Серная кислота представляет собой высококоррозионное кислое соединение. Химическая формула серной кислоты: ·ч3SO4·. Физические свойства серной кислоты включают температуру плавления 10 градусов Цельсия, температуру кипения 337 градусов Цельсия и плотность 1,84 г/см3. Это густая, бесцветная и маслянистая жидкость при комнатной температуре и давлении.Химические свойства включают его сильную кислую природу и молярную массу 98 г/моль.
Химическая формула серной кислоты: ·ч3SO4·. Физические свойства серной кислоты включают температуру плавления 10 градусов Цельсия, температуру кипения 337 градусов Цельсия и плотность 1,84 г/см3. Это густая, бесцветная и маслянистая жидкость при комнатной температуре и давлении.Химические свойства включают его сильную кислую природу и молярную массу 98 г/моль.
Серная кислота производится с использованием четырехэтапного процесса, известного как контактный процесс . Это очень важный промышленный реагент, используемый в самых разных процессах. Некоторые примеры включают:
- Производство сельскохозяйственных удобрений,
- Контактный процесс,
- Производство химических красителей, пигментов и красок,
- Переработка нефти,
- Обработка металлов,
- Производство вискозы,
- Производство лекарств и мазей и
- Производство кислот.
Из-за своей очень кислотной и коррозионной природы серная кислота может вызывать проблемы со здоровьем при попадании на кожу, в глаза, при проглатывании или вдыхании. Важно хранить и обращаться с этим соединением с особой осторожностью и носить соответствующие средства индивидуальной защиты при работе с ним.
Важно хранить и обращаться с этим соединением с особой осторожностью и носить соответствующие средства индивидуальной защиты при работе с ним.
5.4 Названия кислот — Химия LibreTexts
Цели обучения
- Определить кислота .
- Назовите простую кислоту.
Есть еще одна важная для нас группа соединений — кислоты, и эти соединения обладают интересными химическими свойствами.Первоначально определим кислоту как ионное соединение катиона Н + , растворенное в воде. Чтобы указать, что что-то растворено в воде, мы будем использовать метку фазы (aq) рядом с химической формулой (где aq означает «водный», слово, описывающее что-то, растворенное в воде). Если в формуле нет этой метки, то соединение рассматривается как молекулярное соединение, а не как кислота.
Кислоты имеют собственную систему номенклатуры. Если кислота состоит только из водорода и еще одного элемента, то она называется гидро- + основа другого элемента + -кислота . Например, соединение HCl (водн.) представляет собой соляную кислоту, а H 2 S (водн.) представляет собой сероводородную кислоту. Если бы эти кислоты не растворялись в воде, соединения назывались бы соответственно хлороводородом и сероводородом. Оба этих вещества хорошо известны как молекулярные соединения; однако при растворении в воде они рассматриваются как кислоты.
Например, соединение HCl (водн.) представляет собой соляную кислоту, а H 2 S (водн.) представляет собой сероводородную кислоту. Если бы эти кислоты не растворялись в воде, соединения назывались бы соответственно хлороводородом и сероводородом. Оба этих вещества хорошо известны как молекулярные соединения; однако при растворении в воде они рассматриваются как кислоты.
Если соединение состоит из ионов водорода и многоатомного аниона, то название кислоты происходит от основы названия многоатомного иона.Как правило, если название аниона оканчивается на -ate, название кислоты представляет собой основу названия аниона плюс -ic acid ; если название родственного аниона оканчивается на -ite, название соответствующей кислоты представляет собой основу названия аниона плюс -ous acid . В таблице \(\PageIndex{1}\) перечислены формулы и названия различных кислот, с которыми вы должны быть знакомы. Вы должны узнать большинство анионов в формулах кислот.
| Формула | Имя |
|---|---|
| =»clarity.» data-th=»FormulaNote: The "aq" label is omitted for clarity.» for=»for» is=»is» label=»label» omitted=»omitted»> HC 2 H 3 O 2 | уксусная кислота |
| HClO 3 | хлорная кислота |
| HCl | » for=»for» is=»is» label=»label» omitted=»omitted»> соляная кислота |
| HBr | бромистоводородная кислота |
| Привет | иодистоводородная кислота |
| ВЧ | =»clarity.» data-th=»NameNote: The "aq" label is omitted for clarity.» for=»for» is=»is» label=»label» omitted=»omitted»> фтористоводородная кислота |
| HNO 3 | азотная кислота |
| Н 2 С 2 О 4 | щавелевая кислота |
| » for=»for» is=»is» label=»label» omitted=»omitted»> HClO 4 | хлорная кислота |
| H 3 Заказ на покупку 4 | фосфорная кислота |
| H 2 SO 4 | серная кислота |
| =»clarity.» data-th=»FormulaNote: The "aq" label is omitted for clarity.» for=»for» is=»is» label=»label» omitted=»omitted»> H 2 SO 3 | сернистая кислота |
| Примечание. Метка «aq» опущена для ясности. | |
Пример \(\PageIndex{1}\):
Назовите каждую кислоту, не обращаясь к таблице 3.9.
- HBr
- H 2 SO 4
Раствор
- Название бинарной кислоты: гидро- + основное название + — ic acid . Поскольку эта кислота содержит атом брома, ее называют бромистоводородной кислотой.
- Поскольку эта кислота получена из сульфат-иона, название кислоты является основой названия аниона + -ic acid .
 Название этой кислоты – серная кислота.
Название этой кислоты – серная кислота.
Упражнение \(\PageIndex{1}\)
Назовите каждую кислоту.
- ВЧ
- HNO 2
- Ответить на
фтористоводородная кислота
- Ответ б
азотистая кислота
Все кислоты имеют схожие свойства. Например, кислоты имеют кислый вкус; на самом деле кислый вкус некоторых наших продуктов, таких как цитрусовые и уксус, вызван присутствием в пище кислот.Многие кислоты реагируют с некоторыми металлическими элементами с образованием ионов металлов и элементарного водорода. Кислоты заставляют некоторые пигменты растений менять цвет; действительно, созревание некоторых фруктов и овощей вызывается образованием или разрушением избытка кислоты в растении. В главе 12 мы исследуем химическое поведение кислот.
Кислоты очень распространены в окружающем нас мире. Мы уже упоминали, что цитрусовые содержат кислоту; среди прочих соединений они содержат лимонную кислоту, H 3 C 6 H 5 O 7 (водн.).Щавелевая кислота, H 2 C 2 O 4 (водн.), содержится в шпинате и других зеленых листовых овощах. Соляная кислота не только содержится в желудке (желудочная кислота), но и может быть куплена в хозяйственных магазинах в качестве чистящего средства для бетона и кирпичной кладки. Фосфорная кислота входит в состав некоторых безалкогольных напитков.
Мы уже упоминали, что цитрусовые содержат кислоту; среди прочих соединений они содержат лимонную кислоту, H 3 C 6 H 5 O 7 (водн.).Щавелевая кислота, H 2 C 2 O 4 (водн.), содержится в шпинате и других зеленых листовых овощах. Соляная кислота не только содержится в желудке (желудочная кислота), но и может быть куплена в хозяйственных магазинах в качестве чистящего средства для бетона и кирпичной кладки. Фосфорная кислота входит в состав некоторых безалкогольных напитков.
Ключевые выводы
- Кислота представляет собой соединение иона H + , растворенное в воде.
- Кислоты имеют собственную систему наименования.
- Кислоты обладают определенными химическими свойствами, которые отличают их от других соединений.
Формулы названий кислот
Формулы названий кислот Полный список неорганических кислот Hyposulfurous кислота h3SO2 йодной кислоты иодистая кислота HIO2 марганцевый кислота h3MnO4 Metastannic кислота пероксодисерная кислота h3S2O8 Perphosphoric кислота h4PO5 надсерной кислота h3SO5 технециевая кислота HTcO4 Perxenic кислота h5XeO6 90 038 h3SO3 Теллурическая кислота H6TeO6 теллуристая кислота h3TeO3 Tetraboric кислота h3B4O7 Tetrathionic кислота h3S4O6| кислоты Имя | Формула |
|---|---|
| Уксусная кислота | Ch4COOH |
| сурьмяной кислоты | HSbO3 |
| сурьма кислота | h4SbO3 |
| Мышьяк кислота | h4AsO4 |
| Борная кислота | h4BO3 |
| бромная кислота | HBrO3 |
| бромистая кислота | HBrO2 |
| Углекислота | h3CO3 |
| углеродсодержащий кислота | h3CO2 |
| хлорноватая кислота | HClO3 |
| хлористая кислота | HClO2 |
| хромовая кислота | h3CrO4 |
| хром кислота | h3CrO3 |
| Лимонная кислота | C6H8O7 |
| синильной кислота | HCNO |
| дихромовая кислота | h3Cr2O7 |
| Disulfurous кислота | h3S2O5 |
| Dithionous кислота | h3S2O4 |
| Diuranic кислота | h3U2O7 |
| Ferricyanic кислота | H4 [F3 (CN) 6] |
| плавиковой кислоты | HFO3 |
| Fluorous кислота | HfO2 |
| Муравьиная кислота | НСООН |
| Hydroarsenic кислота | h4As |
| бромистоводородная кислота | НВг |
| Соляная кислота | HCl |
| синильной кислоты | HCN |
| кислоты плавиковой | ВЧ |
| иодистоводородная кислота | HI |
| Hydronitric кислота | HN3 |
| Hydrophosphoric кислота | H4P |
| Hydroselenic кислота | h3Se 900 40 |
| сероводородной кислота | h3S |
| бромноватистая кислота | HBrO |
| Hypocarbonous кислота | h3CO |
| хлорноватистой кислоты | HClO |
| Hypochromous кислота | h3CrO2 |
| Hypofluorous кислота | ТДТ |
| иодноватистая кислота | СМО |
| азотноватистая кислота | HNO |
| Hypooxalous кислота | h3C2O2 |
| фосфорноватая кислота | h5P2O6 |
| Hypophosphous кислота | h4PO2 |
| HIO3 | |
| h3SnO3 9004 0 | |
| молибденовой кислоты | h3MoO4 |
| Азотная кислота | HNO3 |
| азотистой кислоты | HNO2 |
| Щавелевая кислота | h3C2O4 |
| перугольных кислота | h3CO4 |
| хлорной кислота | HClO4 |
| Perchromic кислота | h3CrO5 |
| Perfluoric кислота | HFO4 |
| Периодическая кислота | HIO4 |
| марганцовой кислота | HMnO4 |
| Pernitric кислота | HNO4 |
| Фосфорная кислота | h4PO4 |
| Фосфорная кислота | h4PO3 |
| Pyroantimonic кислота | h5Sb2O7 |
| Пирофосфорная кислота | h5P2O7 |
| Pyrosulfuric кислота | h3S2O7 |
| селеновая кислота | h3SeO4 |
| селенистая кислота | h3SeO3 |
| Кремниевая кислота | h3SiO3 |
| Silicofluoric кислота | h3SiF6 |
| Silicous кислота | h3SiO2 |
| Серная кислота | h3SO4 |
| сернистая кислота | |
| тиоциановая кислота | HSCN |
| Thiosulfurous кислота | h3S2O2 |
| титановой кислота | h3TiO3 |
| вольфрамовая кислота | h3WO4 |
| урановая кислота | h3UO4 |
| ксеноновой кислота | h3XeO4 |
| кислоты Имя | Формула | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Уксусная кислота | Ch4COOH | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ацетилсалициловая кислота | HC9H7O4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Аскорбиновая кислота | HC6H7O6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| азелаиновая кислота | h3C9h24O4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| барбитуровой кислоты | HC4h4N2O3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Бензиловую кислота | HC14h21O3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| коричная кислота | C9H8O2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Лимонная кислота | h3C6H6O7 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Фолиевая кислота | C19h29N7O6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| фумаровая кислота | C4h5O4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| C6h22O7 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| HC5H8NO4 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Молочная кислота | HC3H5O3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| яблочная кислота | h3C4h5O5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| малоновой кислоты | Ch3 (СООН) 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Олеиновая кислота | HC18h43O2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| фталевой кислоты | h3C8h5O4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| пропиоловой кислота | HC2COOH | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| пропионовая кислота | Ch4Ch3COOH | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rosolic кислота | C19h24O3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| стеариновая кислота | C17h45COOH | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| дубильной кислоты | C76H53O46 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tartartic кислота | h3C4h5O6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Трифторуксусная кислота | C2HF3O2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Мочевая кислота | h3C5h3N4O3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Серная кислота — Sandvik Materials Technology Эти данные о коррозии в основном основаны на результатах общих лабораторных испытаний на коррозию, проведенных с использованием чистых химикатов и водных растворов, почти насыщенных воздухом (скорость коррозии может быть совершенно другой, если раствор не содержит кислорода). Все концентрации даны в % по массе, а растворителем является вода, если не указано иное. Данные о коррозии относятся к отожженным материалам с нормальной микроструктурой и чистыми поверхностями. Разъяснение символа
1) ASTM 317L, e.
1) ASTM 317L, e.
1) ASTM 317L, e.
1) ASTM 317L, e. 1) ASTM 317L, напр. Sandvik 3R64 1) ASTM 317L, напр. Sandvik 3R64 Разъяснение символаВ этих таблицах коррозии используется ряд символов, имеющих следующие значения:
Заявление об отказе от ответственности: Лабораторные испытания нельзя строго сравнивать с реальными условиями эксплуатации. Соответственно, Sandvik не дает никаких гарантий, явных или подразумеваемых, и не несет ответственности, компенсационной или косвенной, за характеристики различных материалов в отдельных приложениях, которые могут быть основаны на информации, представленной в данной публикации. «Джонни думал, что h3O — это h3SO4» (химическое стихотворение)Воду (h30) не следует путать с серной кислотой (h3SO4). Пособие по рифмованию было процитировано в 1894 году и долгое время пользовалось популярностью среди студентов-химиков старших классов и колледжей: Сегодня умер наш Вилли, Автор строк неизвестен. «Вилли» было заменено другими именами, такими как Джонни, Джимми, Томми и Тимми. Википедия: серная кислота Google Книги 1 февраля 1895 г., The Cosmos (Cedar Rapids, IA), pg. 54, кол. 2: Открытки Old Fulton NY Google Книги Хадст хоть и дал мальчика Вилли «Так будет лучше», — воскликнул дух Уилла; Даже если желудок ушел, Но и пищевод всегда обуглен Google Книги 1 ноября 1907 г., The Daily Echo (Средняя школа Шортриджа, Индианаполис, Индиана), стр. 1, кол. 3: Google Книги Google Книги «Относительно Уильяма Шора 19 сентября 1910 г., Айова-Сити (Айова) Гражданин , стр. 4, кол. 4: Google Книги 25 ноября 1913 г., Shortridge Daily Echo (Средняя школа Шортриджа, Индианаполис, Индиана), стр.3, кол. 2: Google Книги Google Книги У Вилли была ужасная жажда, 14 июля 1928 г., Бостон (Массачусетс) Herald , «Выборки из нашего почтового ящика», стр.14, кол. 8: «Джонни был сыном аптекаря, 11 июня 1929 г., Эдвардсвилль (Иллинойс) Intelligencer , «Side Talks» Рут Кэмерон, pg. 3, кол. 6: 18 марта 1930 г., Сан-Диего (Калифорния) Union , «Северо-восточный угол», стр. 6, кол. 6: «Джонни был химиком. Кто-нибудь из ведущих аптекарей расскажет нам, что это значит? Google Книги Джонни был химиком. Городской словарь Google Книги Ютуб Решения ICSE для химии класса 10 — серная кислотаРешения ICSE для химии класса 10 — серная кислотаICSE SolutionsSelina ICSE Solutions APlusTopper.com предоставляет решения ICSE для экзаменов ICSE Board по химии 10 класса. Загрузить справочник формул для классов 9 и 10 ICSE Краткие вопросы Вопрос 1: Говорят, что серная кислота является двухосновной кислотой. Что означает термин «двухосновный»? Вопрос 2: Некоторые бактерии получают энергию за счет окисления серы с образованием в качестве побочного продукта серной кислоты. В лаборатории или в промышленности первым этапом преобразования серы в серную кислоту является получение диоксида серы. Затем диоксид серы превращается в триоксид серы, который реагирует с водой с образованием серной кислоты. Вопрос 3: (i) Напишите сбалансированные уравнения для трех химических реакций, происходящих при превращении диоксида серы в серную кислоту в контактном процессе. Вопрос 4: (i) С помощью уравнений составьте схему производства серной кислоты контактным способом. Вопрос 5: (i) Какие два газа объединяются в процессе контакта? Вопрос 6: При разведении концентрированной серной кислоты кислота следует добавлять в воду а не вода в кислоту.Объяснять ? Вопрос 7: (i) Какое свойство серной кислоты используется для получения соляной и азотной кислоты соответственно. Вопрос 8: (i) (a) Назовите кислоту, образующуюся при растворении диоксида серы в воде. Вопрос 9: В каждом случае приведите по одной реакции, иллюстрирующей следующие свойства серной кислоты: Вопрос 10: Что происходит, когда конус, серная кислота реагирует с: Вопрос 11: Укажите, как вы можете получить: Вопрос 12: Какое свойство серной кислоты используется в следующем: Вопрос 13: Некоторые свойства серной кислоты перечислены ниже.Выберите свойство A, B, C или D, которое отвечает за реакции с (i) по (v). Некоторые свойства могут повторяться: Вопрос 14: A, B, C и D обобщают свойства серной кислоты в зависимости от того, является ли она разбавленный или концентрированный. Выберите свойство (A, B, C или D), в зависимости от того, которое относится к каждому из препаратов от (i) до (iii): Вопрос 15: Название из списка веществ, приведенного ниже, вещества, которые вы будете использовать для приготовления каждой из следующих солей, названных в частях (i) — (iv): Вопрос 16: Приведите примеры использования серной кислоты в качестве: Вопрос 17: Некоторые свойства шести чистых веществ, представленных A, B, C, D, E и F, приведены ниже: Вопросы, основанные на рисунках/таблицах Вопрос 1: (i) Скопируйте и заполните следующую таблицу: В колонке 3 указаны названия газов, которые необходимо приготовить с использованием вещества, указанного в колонке 1, а также разбавленной или концентрированной серной кислоты. как указано вами в колонке 2. Вопрос 2: Изучите приведенную ниже схему, иллюстрирующую производство серной кислоты. Вопрос 3: (i) Назовите катализатор, который способствует превращению диоксида серы в триоксид серы на стадии C. Вопрос 2: Для производства концентрированной серной кислоты триоксид серы не растворяется непосредственно в воде. Почему ? Вопрос 3: Примесь оксида мышьяка должна быть удалена перед пропусканием смеси диоксида серы и воздуха через каталитическую камеру в контактном процессе. Почему ? Вопрос 4: Почему концентрированную серную кислоту хранят в герметичных бутылях? Вопрос 5: Почему повышается уровень концентрированной серной кислоты, если ее оставить в открытом сосуде на неделю? Вопрос 6: Почему серная кислота при разбавлении водой ведет себя как кислота? Вопрос 7: Почему деревянные полки, на которых хранятся конусы, бутылки с серной кислотой, окрашены в черный цвет? Вопрос 8: При добавлении к сахару концентрированной серной кислоты образуется черная губчатая масса. Почему ? Вопрос 9: При добавлении голубых кристаллов сульфата меди (II) к концентрированной серной кислоте кристаллы становятся белыми. Почему ? Вопрос 10: Почему при добавлении H 2 SO 4 к карбонату натрия наблюдается сильное шипение? Химические испытания Вопрос: Балансировка/Написание химических уравнений Вопрос 1: Напишите сбалансированное химическое уравнение для следующего: |

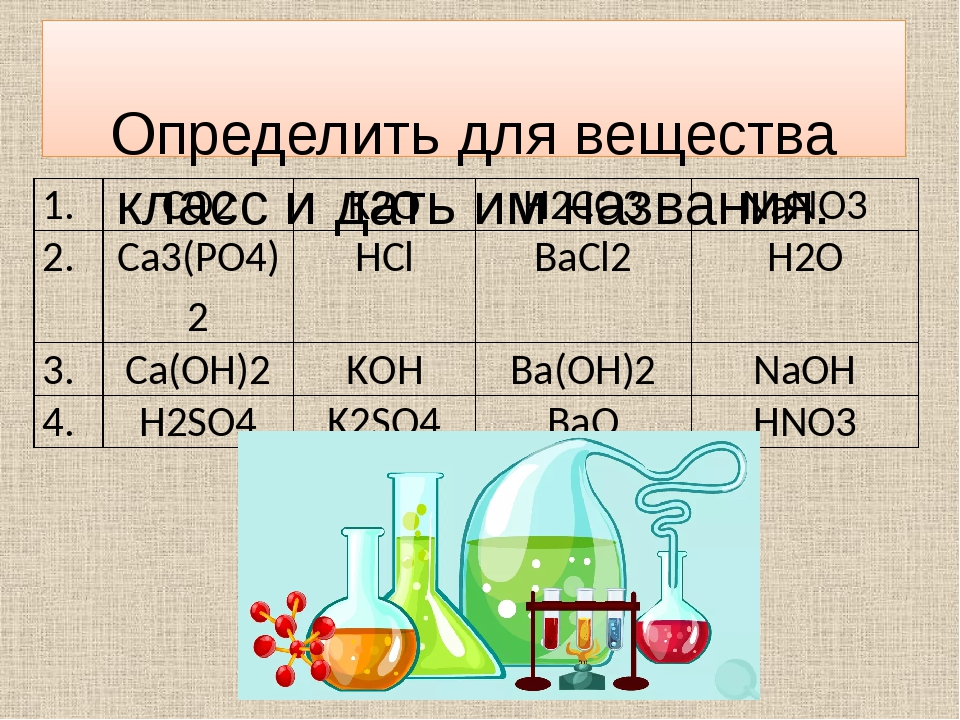

 Оксид фосфора (V)
Оксид фосфора (V) HNO3
HNO3

 Ю. Невская. – 2-е изд., перераб. и доп. – М.: Издательство «Экзамен», 2011. – 125 с. (Серия «Учебно-методический комплект»).
Ю. Невская. – 2-е изд., перераб. и доп. – М.: Издательство «Экзамен», 2011. – 125 с. (Серия «Учебно-методический комплект»). ).
). Продолжительность 2-3 минуты.
Продолжительность 2-3 минуты.




 Продолжительность 5-7 минут
Продолжительность 5-7 минут

 Определите массовую долю кислоты в полученном растворе (правильно записано условие задачи, правильно записана формула для нахождения неизвестного, правильно сделаны вычисления – 3 б.).
Определите массовую долю кислоты в полученном растворе (правильно записано условие задачи, правильно записана формула для нахождения неизвестного, правильно сделаны вычисления – 3 б.).

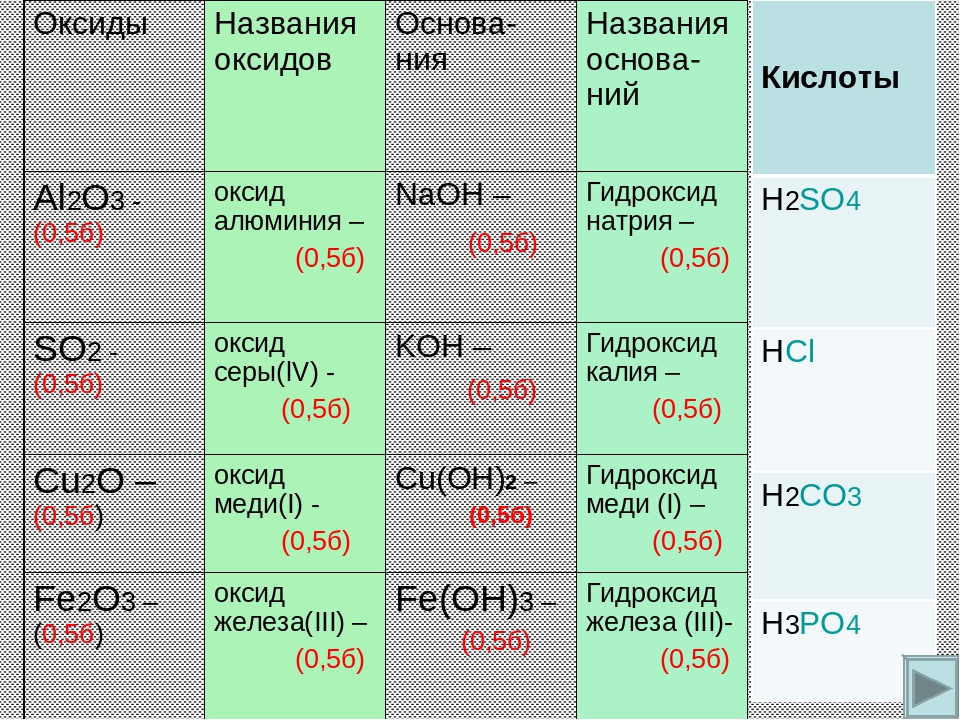 Название этой кислоты – серная кислота.
Название этой кислоты – серная кислота.
 г. Sandvik 3R64
г. Sandvik 3R64  г. Sandvik 3R64
г. Sandvik 3R64  г. Sandvik 3R64
г. Sandvik 3R64  г. Sandvik 3R64
г. Sandvik 3R64 


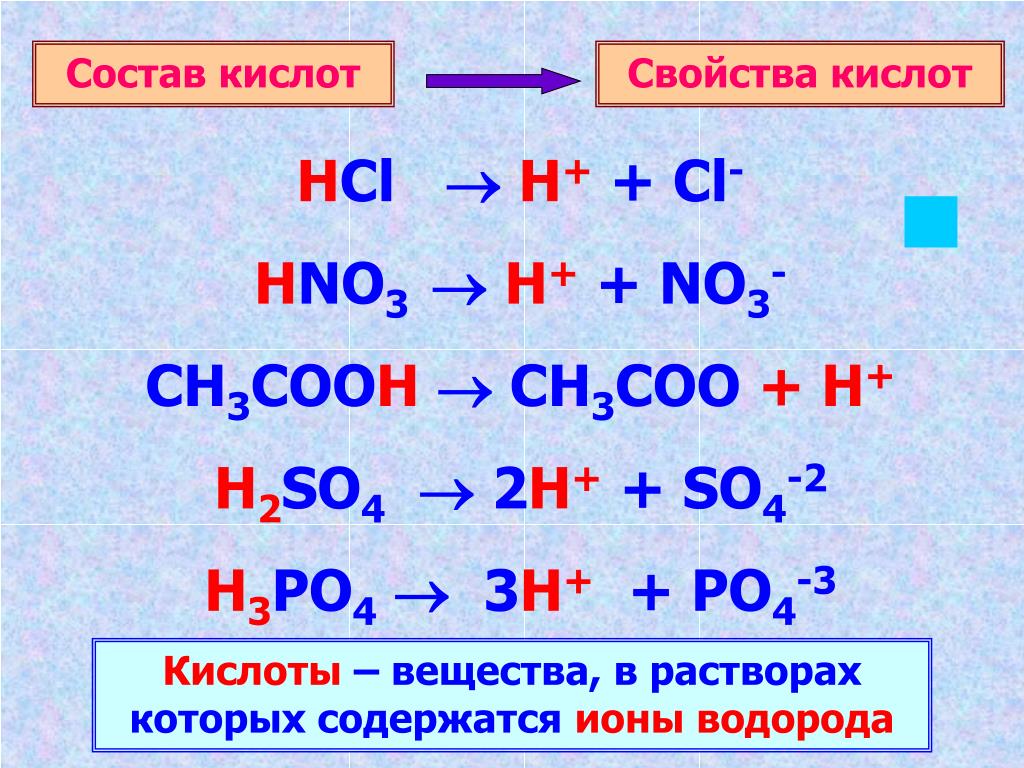 14, кол. 2:
14, кол. 2: 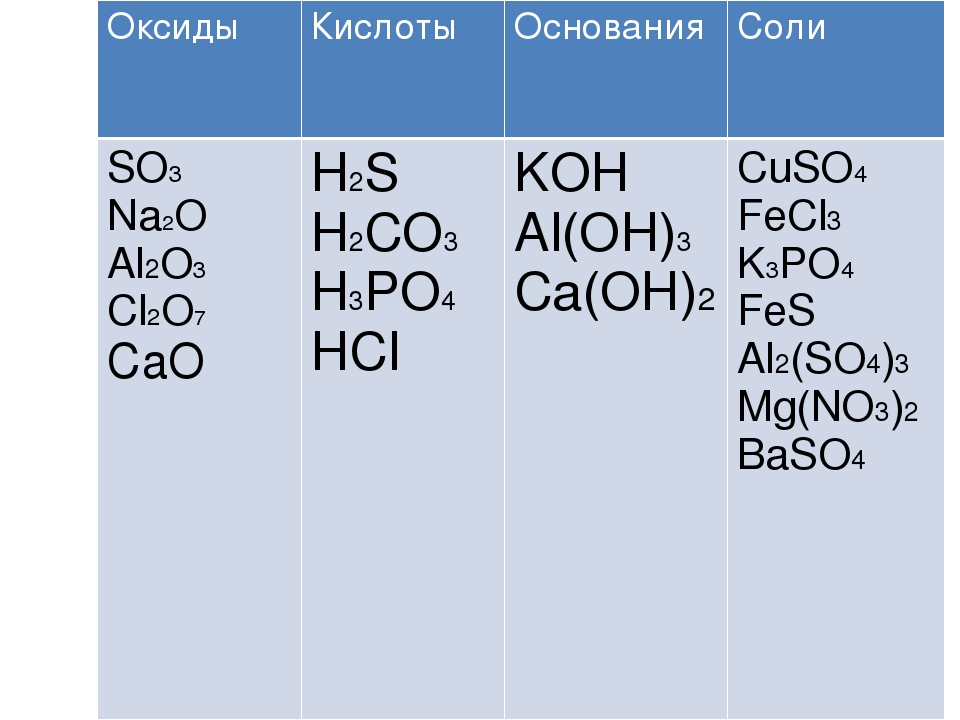
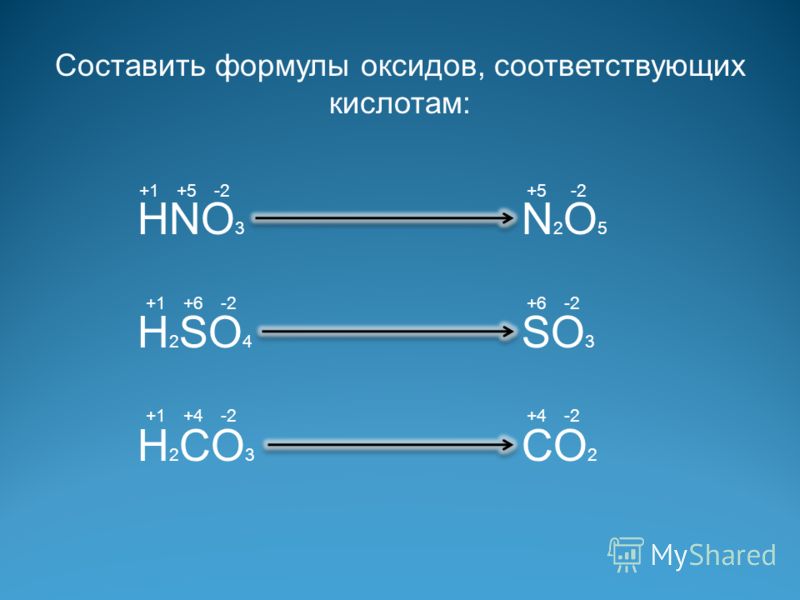

 ”
”
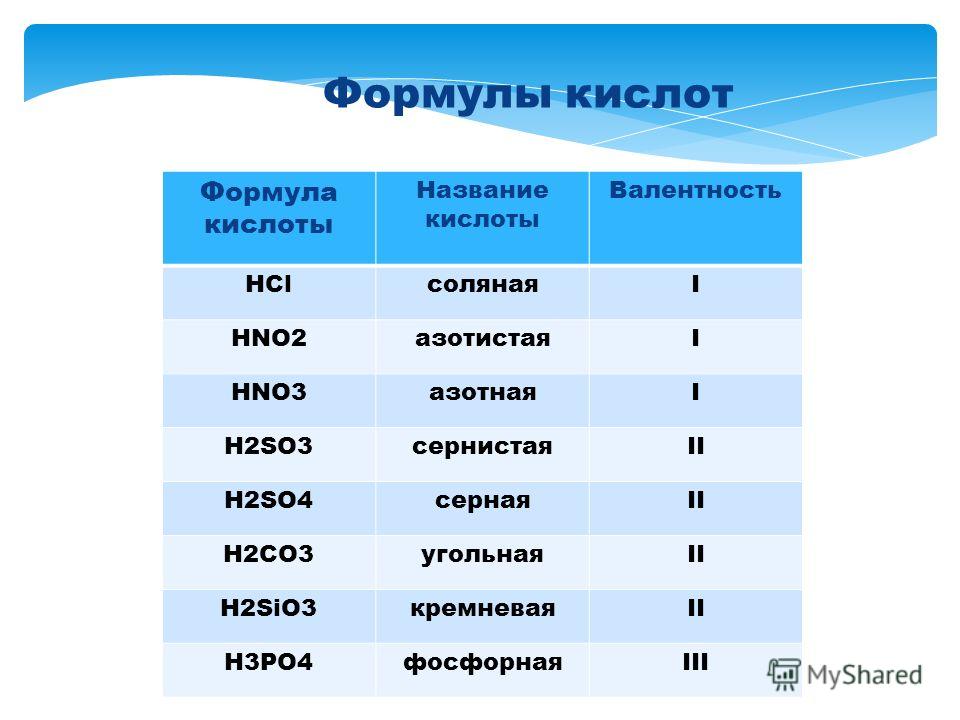 Глава 10. Серная кислота. Мы предоставляем пошаговые решения для ICSE Chemistry Class 10 Solutions Pdf. Вы можете скачать решения ICSE по химии для класса 10 с опцией бесплатной загрузки в формате PDF.
Глава 10. Серная кислота. Мы предоставляем пошаговые решения для ICSE Chemistry Class 10 Solutions Pdf. Вы можете скачать решения ICSE по химии для класса 10 с опцией бесплатной загрузки в формате PDF.

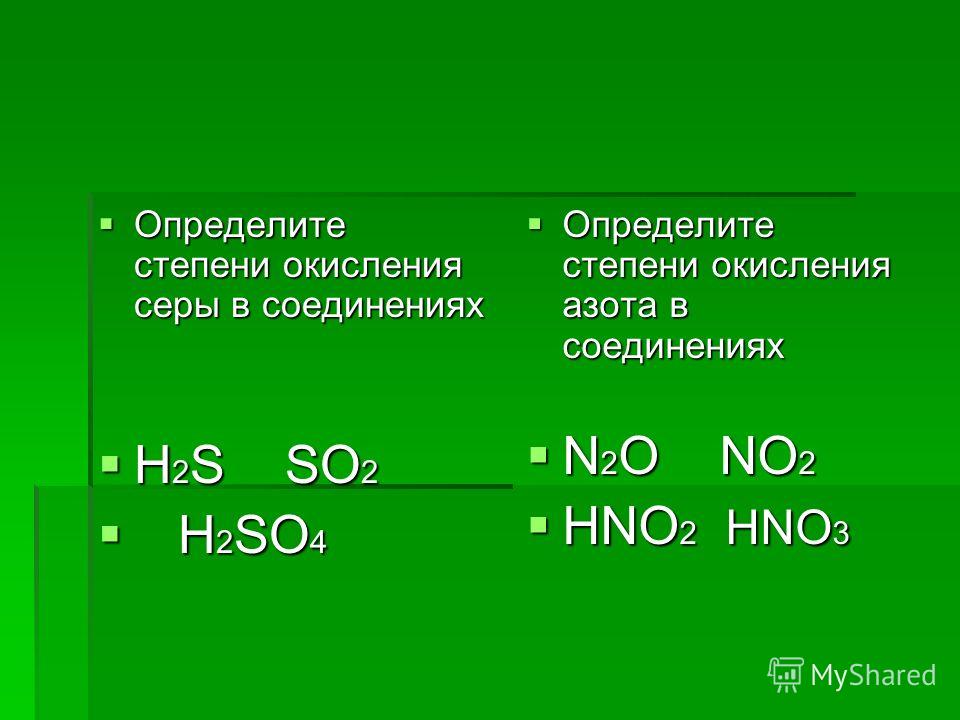 (b) Окислительные свойства.
(b) Окислительные свойства. Поэтому разбавление кислоты следует производить путем добавления небольшого количества кислоты в воду.
Поэтому разбавление кислоты следует производить путем добавления небольшого количества кислоты в воду. 
 (ii) В качестве окислителя.
(ii) В качестве окислителя. 

 д.
д.  Нелетучая кислота
Нелетучая кислота 


 е. углерода.
е. углерода. 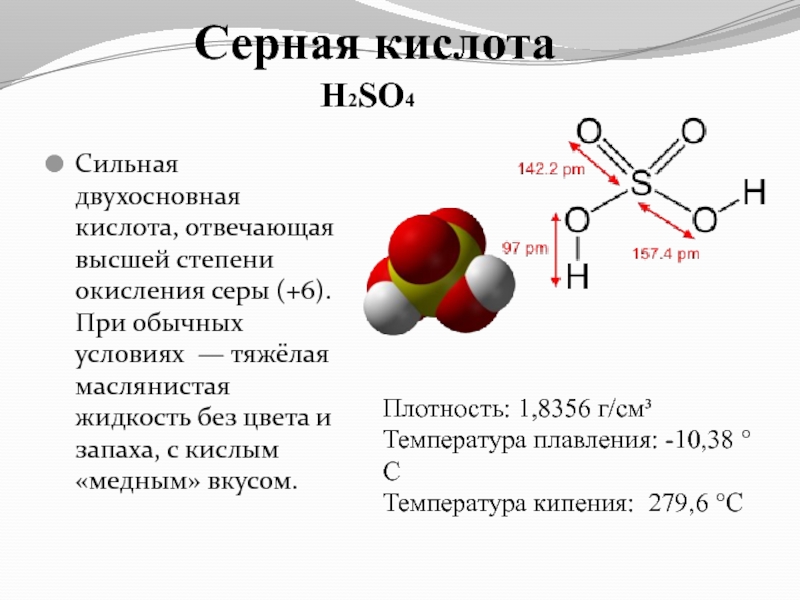
 купороса»?
купороса»? 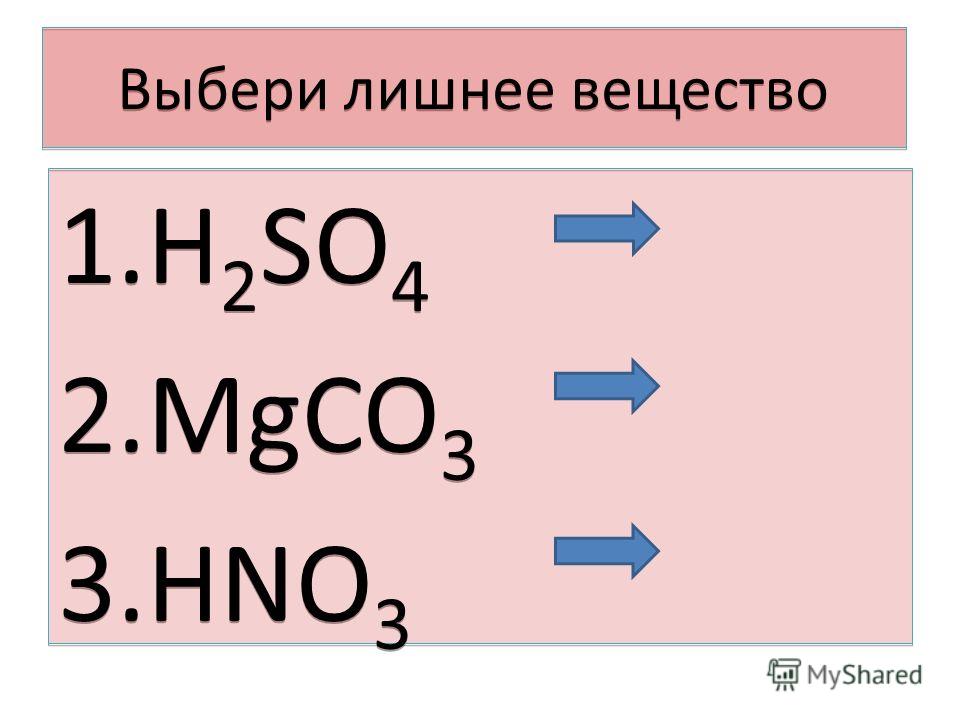 Следовательно, он хранится в герметичных бутылках.
Следовательно, он хранится в герметичных бутылках. Он удаляет атомы водорода и кислорода в форме воды из целлюлозы [(C 6 H 12 O 5 ) n ], оставляя после себя углерод. Это черный углерод, который проявляется в виде черных пятен.
Он удаляет атомы водорода и кислорода в форме воды из целлюлозы [(C 6 H 12 O 5 ) n ], оставляя после себя углерод. Это черный углерод, который проявляется в виде черных пятен. Гидратированный сульфат меди (II) синего цвета становится белым из-за потери кристаллизационной воды.
Гидратированный сульфат меди (II) синего цвета становится белым из-за потери кристаллизационной воды.
