Глицерин — Википедия
Глицери́н (от греч. γλυκερός — сладкий) — органическое соединение, простейший представитель трёхатомных спиртов с формулой C3H5(OH)3{\displaystyle {\ce {C3H5(OH)3}}}. Представляет собой вязкую прозрачную жидкость со сладким вкусом. Нетоксичен, в отличие например от простейших двухатомных спиртов.
Синонимы: глицерóл, пропантриол-1,2,3.
Бесцветная вязкая жидкость без запаха. Сладкий на вкус, отчего и получил своё название (греч. γλυκερός — сладкий). Имеет молярную массу 92,09 г/моль, относительную плотность d420{\displaystyle d_{4}^{20}} = 1,260, коэффициент преломления nD20{\displaystyle n_{D}^{20}} = 1,4740. Температура плавления составляет 17,9 °C, кипит при 290 °C, частично при этом разлагаясь. Гигроскопичен, поглощает воду из атмосферы в количестве до 40 % от собственной массы. С водой, метанолом, этанолом, ацетоном смешивается в любых пропорциях, но не растворим в эфире и хлороформе, хотя и способен растворяться в их смесях с этанолом[2].
При растворении глицерина в воде выделяется теплота и происходит контракция — уменьшение объёма раствора. Смеси глицерина с водой обладают температурой плавления значительно более низкой, чем каждое из веществ по отдельности, например, при массовом содержании глицерина в 66,7 % его смесь с водой будет замерзать при −46,5 °C[2].
Образует азеотропы с нафталином, его производными и рядом других веществ[2].
Химические свойства глицерина типичны для многоатомных спиртов.
Взаимодействие глицерина с галогеноводородами или галогенидами фосфора ведёт к образованию моно- и дигалогенгидринов.
Глицерин этерифицируется карбоновыми и минеральными кислородосодержащими кислотами с образованием соответствующих сложных эфиров. Так, с азотной кислотой глицерин образует тринитрат — нитроглицерин (получен в 1847 г. Асканио Собреро), использующийся в настоящее время в производстве бездымных порохов.
При дегидратации он образует токсичный акролеин:
- HOCh3CH(OH)−Ch3OH⟶h3C=CH−CHO+2h3O{\displaystyle {\ce {HOCh3CH(OH)-Ch3OH -> h3C=CH-CHO + 2h3O}}},
и окисляется до глицеринового альдегида Ch3OHCHOHCHO{\displaystyle {\ce {Ch3OHCHOHCHO}}}, дигидроксиацетона Ch3OHCOCh3OH{\displaystyle {\ce {Ch3OHCOCh3OH}}} или глицериновой кислоты Ch3OHCHOHCOOH{\displaystyle {\ce {Ch3OHCHOHCOOH}}}.
Сложные эфиры глицерина и высших карбоновых кислот — жиры являются важными метаболитами, существенное биологическое значение также имеют фосфолипиды — смешанные глицериды фосфорной и карбоновых кислот.
Глицерин впервые был получен в 1779 году Карлом Вильгельмом Шееле при омылении жиров в присутствии оксидов свинца [3]. Основную массу глицерина получают как побочный продукт при омылении жиров[4].
Большинство синтетических методов получения глицерина основано на использовании пропилена в качестве исходного продукта. Хлорированием пропилена при 450—500 °С получают аллилхлорид, при присоединении к последнему хлорноватистой кислоты образуются хлоргидрины, например, Ch3ClCHOHCh3Cl{\displaystyle {\ce {Ch3ClCHOHCh3Cl}}}, которые при омылении щёлочью превращаются в глицерин.
На превращениях аллилхлорида в глицерин через дихлоргидрин или аллиловый спирт основаны другие методы. Известен также метод получения глицерина окислением пропилена в акролеин; при пропускании смеси паров акролеина и изопропилового спирта через смешанный ZnO{\displaystyle {\ce {ZnO}}} — MgO{\displaystyle {{\ce {MgO}}}} катализатор образуется аллиловый спирт. Он при 190—270 °C в водном растворе перекиси водорода превращается в глицерин.
Глицерин можно получить также из продуктов гидролиза крахмала, древесной муки, гидрированием образовавшихся моносахаридов или гликолевым брожением сахаров. Также глицерин получается в качестве побочного продукта при производстве биотоплива.
Производные глицерина и их место в обмене веществ живых организмов[править | править код]
Глицериды[править | править код]
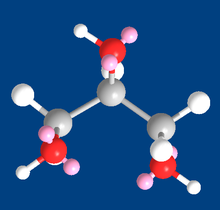 Глицерин (3D модель), показаны атомы и электронные пары при атомах кислорода (розовый цвет)
Глицерин (3D модель), показаны атомы и электронные пары при атомах кислорода (розовый цвет)Триглицериды являются производными глицерина и образуются при присоединении к нему высших жирных кислот. Триглицериды являются важными компонентами в процессе обмена веществ в живых организмах.
Жиры и масла гидрофобны и нерастворимы в воде, так как гидроксильные группы глицерина заменены малополярными остатками жирных кислот.
Область применения глицерина разнообразна: пищевая промышленность, табачное производство, электронные сигареты, медицинская промышленность, производство моющих и косметических средств, сельское хозяйство, текстильная, бумажная и кожевенная отрасли промышленности, производство пластмасс, лакокрасочная промышленность, электротехника и радиотехника (в качестве флюса при пайке).
Глицерин относится к группе стабилизаторов, обладающих свойствами сохранять и увеличивать степень вязкости и консистенции пищевых продуктов. Зарегистрирован как пищевая добавка Е422, и используется в качестве эмульгатора, при помощи которого смешиваются различные несмешиваемые смеси.
Поскольку глицерин хорошо поддается желированию и горит без запаха и чада, его используют для изготовления высококачественных прозрачных свечей и основы для жидкости, используемой в дым-машинах.
Также глицерин используется при изготовлении динамита[5].
В последние годы глицерин используется, наряду с пропиленгликолем, в качестве основного компонента для приготовления жидкости и картриджей для электронных сигарет.
Используется в криобиологии и крионике как основной компонент популярных проникающих криопротекторов для криоконсервирования анатомических препаратов, биологических тканей и организмов.

Глицерин — это… Что такое Глицерин?
Глицери́н (1,2,3-тригидроксипропан; 1,2,3-пропантриол) (гликос — сладкий) химическое соединение с формулой HOCH2CH(OH)-CH2OH или C3H5(OH)3. Простейший представитель трёхатомных спиртов. Представляет собой вязкую прозрачную жидкость.
Физические свойства
Глицерин — бесцветная, вязкая, гигроскопичная жидкость, неограниченно растворимая в воде. Сладкий на вкус, отчего и получил своё название (гликос — сладкий). Хорошо растворяет многие вещества.
Химические свойства
Химические свойства глицерина типичны для многоатомных спиртов.
Взаимодействие глицерина с галогеноводородами или галогенидами фосфора ведёт к образованию моно- и дигалогенгидринов.
Глицерин этерифицируется карбоновыми и минеральными кислотами с образованием соответствующих эфиров. Так, с азотной кислотой глицерин образует тринитрат — нитроглицерин (получен в 1847 г. Асканьо Собреро), использующийся в настоящее время в производстве бездымных порохов.
При дегидратации он образует токсичный акролеин:
- HOCH2CH(OH)-CH2OH H2C=CH-CHO + 2 H2O,
и окисляется до глицеринового альдегида СН2ОНСНОНСНО, дигидроксиацетона СН2ОНСОСН2ОН или глицериновой кислоты СН2ОНСНОНСООН.
Эфиры глицерина и высших карбоновых кислот — жиры являются важными метаболитами, важное биологическое значение играют также фосфолипиды — смешанные глицериды фосфорной и карбоновых кислот.
Получение
Глицерин впервые был получен в 1779 году Шееле при омылении жиров в присутствии окислов свинца. Основную массу глицерина получают как побочный продукт при омылении жиров.
Большинство синтетических методов получения глицерина основано на использовании пропилена в качестве исходного продукта. Хлорированием пропилена при 450—500° С получают аллилхлорид, при присоединении к последнему хлорноватистой кислоты образуются хлоргидрины, например, CH2ClCHOHCH2Cl, которые при омылении щёлочью превращаются в глицерин.
На превращениях аллилхлорида в глицерин через дихлоргидрин или аллиловый спирт основаны другие методы. Известен также метод получения глицерина окислением пропилена в акролеин; при пропускании смеси паров акролеина и изопропилового спирта через смешанный ZnO — MgO катализатор образуется аллиловый спирт. Он при 60—70 °C в водном растворе перекиси водорода превращается в глицерин.
Глицерин можно получить также из продуктов гидролиза крахмала, древесной муки, гидрированием образовавшихся моносахаридов или гликолевым брожением сахаров.
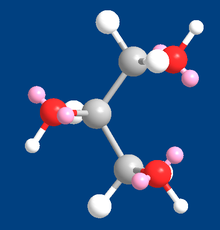 Глицерин (3D модель), показаны атомы и электронные пары при атомах кислорода (розовый цвет)
Глицерин (3D модель), показаны атомы и электронные пары при атомах кислорода (розовый цвет)Триглицериды являются производными глицерина и образуются при присоединении к нему высших жирных кислот. Триглицериды являются важными компонентами в процессе обмена веществ в живых организмах.
Жиры и масла гидрофобны и нерастворимы в воде, так как гидроксильные группы глицерина заменены малополярными остатками жирных кислот.
Применение
Область применения глицерина разнообразна: пищевая промышленность, табачное производство, медицинская промышленность, производство моющих и косметических средств, сельское хозяйство, текстильная, бумажная и кожевенная отрасли промышленности, производство пластмасс, лакокрасочная промышленность, электротехника и радиотехника.
Глицерин используется как пищевая добавка Е422 в производстве кондитерских изделий для улучшения консистенции, для предотвращения проседания шоколада, увеличения объёма хлеба.
Технический глицерин используется для заполнения виброустойчивых манометров типа ДМ8008ВУ, заполнения торцевых уплотнений мешалок и др.
 Реклама глицеринового зубного крема. 1906
Реклама глицеринового зубного крема. 1906См. также
Примечания
Ссылки
На русском и английском языках:
На русском языке:
На английском языке:
структурная формула, свойства и области применения :: SYL.ru
Это простейший трехатомный спирт. Химическая формула глицерина — C3H5(OH)3. Представляет собой прозрачную вязкую жидкость. Не имеет запаха, сладкий на вкус. Он не ядовит, поэтому находит широкое применение в быту, пищевой промышленности, косметике и медицине. Структурная формула глицерина представлена на рисунке. Но как добывают его?
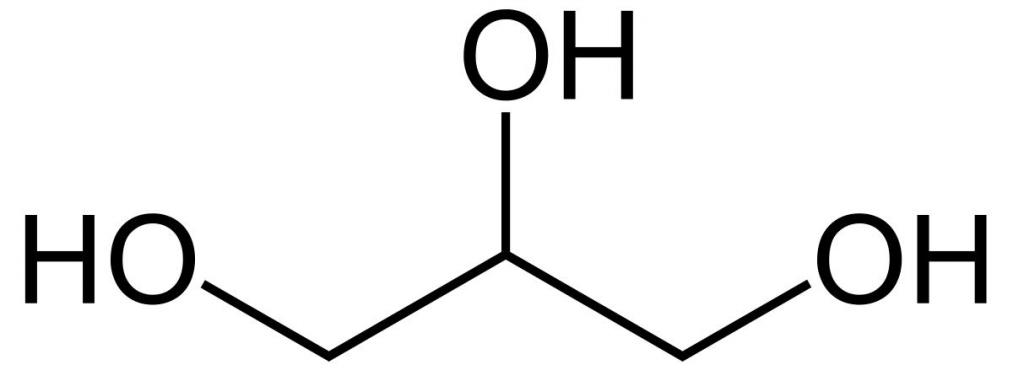
Способы получения глицерина
Почти весь глицерин в промышленности получают из жиров. Они с химической точки зрения как раз и представляют собой сложные эфиры глицерина. При омылении этих жиров (получении мыла) глицерин образуется как побочный продукт. Затем он очень просто выделяется из реакционной смеси.
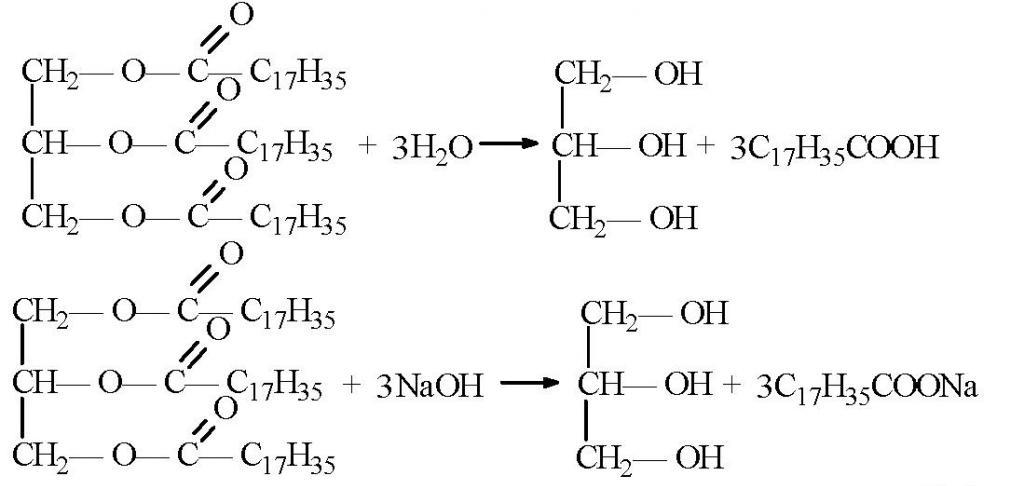
Синтезировать глицерин можно и другими способами. Например, из ацетона. В этом случае его восстанавливают водородом, чтобы получить изопропиловый спирт. На следующей стадии дегидратацией отщепляют молекулу воды, получая пропилен, который затем хлорируют. Полученный дихлорпропан хлорируют еще раз, для получения трихлорпропана. Последняя стадия получения глицерина — гидратация при нагревании. На этой стадии все три молекулы хлора заменяются на гидроксильные группы. Похожим способом сейчас в промышленности получают синтетическое вещество. Только в качестве сырья используют пропилен, который выделяется из побочных газов при перегонке нефти.
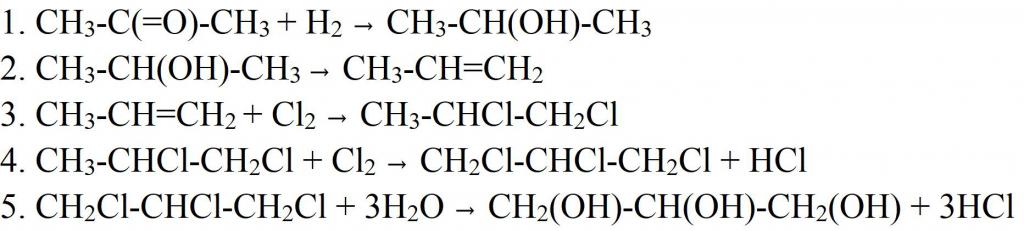
Но из пропилена получать глицерин можно и другим способом. Для этого пропилен окисляют в акролеин. Окисление ведется кислородом воздуха в присутствии катализатора (меди) и повышенной температуре. Далее к нему присоединяют перекись водорода, получая двухатомный спирт-альдегид. В качестве катализатора такой реакции используется оксид осмия (VIII). Альдегидную группу в полученном соединении гидрируют, превращая ее в третью гидроксильную. Так и получается глицерин.
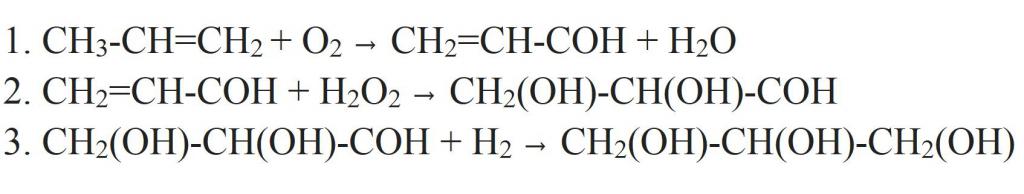
Другой вариант синтеза в свое время предложил Е. Е. Вагнер. Окисляя аллиловый спирт перманганатом калия в щелочной среде, можно в одну стадию получить глицерин.
Физические свойства
Глицерин — бесцветная жидкость без запаха со сладковатым вкусом. Обладает гигроскопичностью, то есть стремится поглощать воду. При температуре 20 °C плавится, а при температуре 290 °C кипит с частичным разложением. Смешивается с водой и спиртами в любых соотношениях. Это обусловлено химической формулой. Гидроксильные группы позволяют глицерину образовывать множество водородных связей с молекулами воды. Это и обеспечивает растворение.
Растворим глицерин также в ацетоне и некоторых других органических веществах. Нерастворим в бензоле и эфирах. Он и сам может является таковым для многих органических и неорганических соединений. Плотность его в жидком состоянии составляет 1,26 г/см3. Также стоит отметить, что глицерин — очень вязкая жидкость. Свойство это в 1474 раза больше, чем у воды.
Химические свойства
Исходя из структурной формулы, глицерин содержит в себе три гидроксильные группы. Поэтому для него будут характерны и химические реакции одноатомных спиртов. Причем кислотные свойства глицерина выражены гораздо сильнее, чем у любого другого одноатомного спирта. Так, он может взаимодействовать с металлами, их оксидами или щелочами. Уравнения химических реакций глицерина представлены ниже.
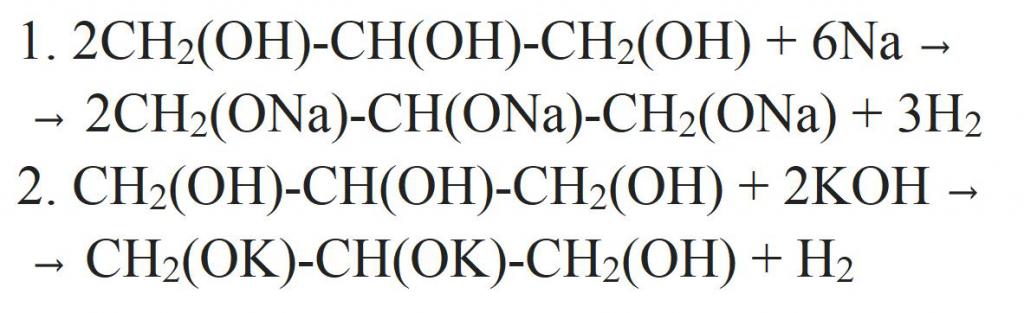
Также он может вступать в реакции дегидратации, образуя множество разных продуктов. Таким образом получают акролеин.
Отдельно стоит сказать про замещение гидроксильной группы на галоген. Это может происходить при взаимодействии глицерина с галогеноводородами. Как видно из структурной формулы глицерина, в результате реакции могут образовываться моно-, ди- и трипроизводные. Более полного замещения можно добиться, если взаимодействие проводить с галогенидами фосфора.
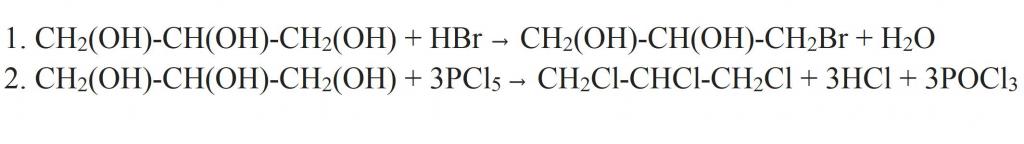
Но глицерин имеет и специфичные свойства, присущие только многоатомным спиртам. Например, он взаимодействует с гидроксидом меди (II), образуя комплексное соединение синего цвета — глицерат меди. Это реакция является качественной для всех многоатомных спиртов.
Характеры для него и реакции этерификации. Это реакция взаимодействия с кислотами, в результате которой получается сложный эфир. Причем этерифицируется глицерин как органическими кислотами, так и минеральными. Например, азотной. Данную реакцию также называют нитрование. В результате нее получается очень полезный, но крайне взрывоопасный продукт — нитроглицерин. Опять же из структурной формулы глицерина видно, что этирифицироваться могут не все гидроксильные группы. Здесь все зависит от условий проведения реакции.

При взаимодействии с водородом при высоком давлении и в присутствии катализторов одна из гидроксильных групп восстанавливается. В результате реакции получается двухатомный спирт — пропиленгликоль.
Глицерин может вступать и в реакции поликонденсации, образуя смесь полиглицеринов. Для этого его очень долго нагревают почти до 300 °C в слабощелочной среде. Химическую формулу глицерина рассмотрели.
Окисление
Очень много у глицерина вариантов окисления. Конечный продукт зависит от природы окислителя, катализаторов и других условий реакции. Так, глицерин можно окислить сильными окислителями, например, дихроматом калия в кислой среде. В результате этой реакции весь глицерин разложится на углекислый газ и воду.
Окисление может происходить и более мягко. Например, при взаимодействии с перекисью водорода получается альдегид или кетон. В качестве катализатора используются соли железа (II).
Окисление можно вести и до получения глицериновой кислоты. В этом случае взаимодействие проводят с концентрированной азотной кислотой. Одна из гидроксильных групп просто окисляется до карбоксильной группы. Из глицерина получают и более экзотические кислоты. При взаимодействии с раствором перманганата калия образуются тартроновая и мезоксалевая кислоты. А при окислении кислородом воздуха с нагреванием в присутствии гидроксида бария получается смесь щавелевой и муравьиной кислоты. Йодной кислотой глицерин можно окислить до муравьиной и формальдегида.
Применение в промышленности
Благодаря своему составу и свойствам, находит глицерин применение в промышленности.
- В текстильной промышленности его используют для придания тканям мягкости и эластичности, а также для синтеза красителей и синтетических волокон.
- Используют его и в производстве некоторых видов бумаги.
- В кожевенной промышленности его растворы применяются для дубления и жировки кожи.
- В сельском хозяйстве с помощью глицерина обрабатывают семена для того, чтобы обеспечить им более стабильное прорастание.
- В лакокрасочной промышленности глицерин применяется для синтеза полировочных составов и лаков.
- При производстве упаковочных материалов, например, целлофана, он используется как пластификатор.
- Полимеры на основе глицерина применяются для производства упаковки. Бумага, пропитанная глицерином, приобретает огнестойкие качества.
Применение в пищевой отрасли
Глицерин — это пищевая добавка Е422. Он используется в качестве стабилизатора для сохранения и увеличения вязкости продуктов. Его применяют в производстве хлебобулочных и кондитерских изделий (особенно шоколада) как загуститель и влагоудерживающий агент. Он помогает придавать объем готовым продуктам. Благодаря этой добавке хлеб может дольше оставаться свежим.
Экстракты на основе глицерина зачастую добавляют в напитки. Они позволяют сделать их вкус менее резким. Также его применяют в производстве алкоголя. Добавляют и в табак, чтобы регулировать влажность, устранять раздражающий привкус.
Применение в медицине
Глицерин входит в состав некоторых препаратов, которые используют при лечении кожных болезней. Он имеет антисептические свойства, препятствует заражению ран. Он также способствует понижению внутричерепного и внутриглазного давления, поэтому его применяют при лечении отека мозга.
Из-за того, что глицерин — хороший растворитель, его активно используют в фармакологической промышленности. С помощью этого вещества можно достигнуть очень высокой концентрации действующего компонента. Также он может придавать нужную консистенцию лекарствам. Его часто добавляют в мази и кремы, ведь тот препятствует выпариванию влаги и высыханию.
Применение в косметологии
Глицерин входит в состав многих косметических средств: мыл, шампуней, кремов, увлажняющих масок. При попадании на кожу в небольших количествах он удерживает влагу в верхних слоях кожи. Однако некоторые утверждают, что частое применение средств с глицериновой основой лишает кожу естественной влаги и лишь усугубляет сухость. Также глицерин часто используют как добавку в мыло. Так увеличивается его моющая способность.
Влияние на организм человека
Глицерин хорошо усваивается организмом, так как легко преобразуется в жиры пищеварительной системой. По этой причине он не считается токсичным. Суточное потребление этого вещества никак не ограничено. Но не стоит забывать, что глицерин гигроскопичен, поэтому в организме он приводит к большому выделению волы, то есть имеется риск наступления обезвоживания. По этой причине применение его в пищевых продуктах строго регламентируется. При попадании на кожу он также оказывает осушающий эффект. До сих пор ведутся споры о необходимости применении вещества в косметических средствах.
Итак, в статье рассмотрели состав и свойства глицерина, его применение.
Глицерин: свойства и все характеристики
Характеристики и физические свойства глицерина
Его температуры плавления и кипения равны 18oС и 290oС соответственно. Глицерин гигроскопичен, хорошо смешивается с водой и этанолом. Абсолютно чистый безводный глицерин затвердевает при +18oС, но получить его в твердом виде чрезвычайно сложно. Строение молекулы глицерина представлено на рис. 1.
Рис. 1. Строение молекулы глицерина.
Глицерин широко распространен в живой природе. Он играет важную роль в процессах обмена в организмах животных, входит в состав большинства липидов – жиров и других веществ, содержащихся в животных и растительных тканях и выполняющих в живых организмах важнейшие функции.
Получение глицерина
Старейший способ производства глицерина – гидролиз жиров и масел:
В настоящее время глицерин получают синтетическим путем из пропилена, образующегося при крекинге нефти. При этом используют разные пути превращения пропилена в глицерин. Наиболее перспективный способ – окисление пропилена кислородом воздуха в присутствии катализатора и при высокой температуре (kat = Cu, t0 = 370). Процесс идет в несколько стадий.
Химические свойства глицерина
Глицерин является представителем трехатомных спиртов, для которых, как для гидроксилсодержащих соединений характерны те же реакции, что и для одноатомных спиртов.
Глицерин реагирует с активными металлами (калием, натрием и др.), замещающими водород во всех гидроксильных группах, вступают в реакции с галогеноводородами (HCl, HBr и др.), в реакции дегидратации, образуя различные эфиры.
Глицерин имеет и специфические свойства, отличающие его от одноатомных спиртов: он вступает в реакцию, не только со щелочными металлами, но и с некоторыми основаниями, в том числе нерастворимыми, например с гидроксидом меди (II):
Результатом реакции глицерина с гидроксидом меди (II) является глицерат меди (сложное комплексное соединение ярко-синего цвета). Эта реакция – качественная реакция на многоатомные спирты.
Важнейшей в практическом отношении является реакция нитрования глицерина, в результате которой образуется тринитроглицерин C3H5(ONO2)3:
Применение глицерина
Глицерин является компонентом многих пищевых продуктов, кремов и косметических средств.
Примеры решения задач
Глицерин ℹ️ физические свойства, плотность, температура замерзания и кипения, вред для организма, для чего используют, получение, чем можно заменить, качественная реакция, структурная химическая формула
Свойства вещества
Глицерин представлен органическим соединением, которое получают из растительных и животных масел. В нем хорошо растворяются различные вещества. Средство не относится к токсичным и ядовитым соединениям. На марки дистиллированного вещества распространяются действия государственного стандарта ГОСТ 6824–96 .
Химическая формула глицерина — C3H8O3. В структурной формуле вещество состоит из цепочки трех атомов углерода, каждый из которых связан с атомом водорода и гидроксильной группы. Сложные эфиры глицерина с длинноцепочными карбоновыми кислотами называются триглицеридами. Они выступают важными производными в метаболизме живых организмов.
Основные физические свойства глицерина:

- плотность — 1,261 г/см3;
- молярная масса — 92,1 г/моль;
- температура кипения (испарения) — 290 °C.
В чистом виде вещество не замерзает, поэтому температура замерзания глицерина определяется в зависимости от его концентрации в растворах. Простейший представитель трехатомных спиртов выглядит как вязкая прозрачная жидкость. Его можно смешивать с водой в разных пропорциях. Глицерин характеризуется сладким вкусом. В сочетании с пропиленгликолем жидкое вещество становится более текучим. Сильно нагретое и зажженное соединение горит синим пламенем.
Химические свойства вещества характерны для многоатомных спиртов. При его взаимодействии с галогеноводородами или галогенидами фосфора образуются моно- и дигалогенгидрины. С азотной кислотой формируется нитроглицерин, который используется в изготовлении бездымных порохов.
При дегидратации образуется токсичный акролеин, после чего окисляется до глицеринового альдегида, дигидроксиацетона или глицериновой кислоты.
Получение глицерина
Впервые вещество было получено в 1779 году путем нагревания масла оливы с оксидом свинца. Этот метод разработал шведский исследователь Карл Шееле. Химик смог доказать, что во все жиры и масла включена сладкая основа.

До начала XIX века технический трехатомный спирт делали именно по способу Шееле. Вскоре его стали широко использовать в промышленной сфере, что заставило увеличить его производство. Француз Мишель Шеврель изучил органическое соединение, выведенное шведским ученым, и дал ему название в 1811 году. Химик открыл первый промышленный метод получения вещества, на который получил патент. При использовании его способа жировые вещества обрабатываются известью или щелочью, чтобы при разложении получились жирные кислоты. Сегодня к этой схеме все еще прибегают во многих странах.

В середине XIX века А. Тилгман открыл еще один промышленный метод создания трехатомного спирта в биохимии. Вещество начали получать путем перемешивания и давления жиров и воды. В течение 12 часов жиры расщепляются на жирные кислоты и глицерин при температуре 180−200 °С. Когда глицериновую воду охлаждают, жирные кислоты всплывают на поверхность. Этот способ часто используют в современной промышленности.
Сделать глицерин можно и мыловарам. Вещество выступает побочным продуктом при изготовлении продукта для ухода за кожей. Он образуется при реакции омыления тристеарата глицерина гидроксидом натрия.
Сферы использования
Не все люди знают, зачем и для чего нужен глицерин. Он используется в различных областях и быту, благодаря своим химическим и физическим свойствам. Глицерин придает мягкость разным видам текстиля, а также регулирует влажность табака. Его часто включают в состав моющих средств и препаратов для обработки сельскохозяйственных культур.
Сферы применения вещества:


- Пищевая промышленность. Глицерин используется в качестве подсластителя для создания различных пищевых продуктов и напитков, а также как загуститель в ликерах. А также он прекрасный увлажнитель и растворитель. Органическое соединение входит в состав низкокалорийных продуктов вместо жира. В пищевой промышленности компонент обозначают как Е422. Он может заменить сахар и препятствовать размножению бактерий.
- Косметика. Девушки часто интересуются, где взять глицерин растительного и животного происхождения. Компонент включают в качественные средства личной гигиены. Он используется в увлажняющей косметике по уходу за лицом и телом, кремах для бритья и других продуктах. Вещество считается одним из главных составляющих глицеринового мыла, которое предназначено для сухой и чувствительной кожи. Его применяют при раздражениях, зуде кожного покрова и шелушениях.
Поскольку вещество не реагирует с маслами и имеет высокую устойчивость к окислению, оно может применяться в качестве смазочного материала для механических деталей, подвергающихся воздействию бензина. Органическое соединение используют в технической промышленности при обработке алюминия и при изготовлении смол и пластмассы.
Оно применяется в типографии при нанесении красок, для создания кальки, салфеток и пергаментной бумаги.
Область медицины
Глицерин считается безопасным средством для взрослых, не вызывает брожение в организме или размножение болезнетворных бактерий. Вещество хорошо всасывается в тонком кишечнике и не попадает в толстую кишку. Еще оно не обладает канцерогенными свойствами, повреждающими ДНК и вызывающими врожденные эффекты.

Компонент добавляют в аптечные сиропы от кашля и отхаркивающие средства. Он может присутствовать в зубных пастах и жидкостях для полоскания полости рта. В таблетках вещество используется как влагоудерживающий агент. Оно входит в состав слабительных средств. Глицерин принимают в качестве первой помощи при экстренном лечении глазного давления, он быстро его понижает.
Глицерин безопасен для здоровья человека. Иногда его используют для приема внутрь при лечении различных заболеваний.
Полезные действия лекарственного средства:

- снижает вес;
- улучшает выносливость при физических нагрузках и помогает организму удерживать влагу;
- избавляет от диареи и поноса;
- снижает отек мозга при нейрохирургических операциях;
- предотвращает обмороки при нарушении кровотока к мозгу.
Глицерин может использоваться и внутривенно в неврологии. Он применяется для понижения внутричерепного давления при инсульте, менингите, синдроме Рейна, энцефалите, менингите, травмах ЦНС. Спортсмены принимают средство, чтобы предотвратить обезвоживание.
Вред для организма и меры безопасности
Если человек использует препараты или косметику, в которых содержится глицерин, ему необходимо предварительно узнать о вреде этого вещества, а также в каких случаях его не следует использовать.
Когда средство применяется в домашних условиях без контроля или назначения специалиста, у человека могут проявляться побочные последствия или обезвоживание организма:



- При приеме препаратов внутрь у больных иногда возникают головокружения, тошнота, рвота, вздутие живота, мигрень, жажда или диарея.
- Нередко людей мучает сухость во рту, частое мочеиспускание или понос после внутривенного применения средства. Такие симптомы могут привести к обезвоживанию организма, поэтому лечение назначают с большой осторожностью.
- Данных о влиянии глицерин на беременных и кормящих женщин при приеме перорально или внутривенно, не имеется. В этом случае стоит отказаться от лечения, чтобы избежать негативных последствий.
- Поскольку вещество растительного происхождения обычно получают из кокосового или пальмового масла, в индивидуальных случаях оно вызывает аллергическую реакцию.
- Гигроскопичная жидкость в чистом виде оказывает вредное действие и вызывает ожог, если капнуть ее на язык.
- Курящие электронные сигареты часто испытывают сухость во рту и першение в горле. В этих устройствах содержится глицерин, который при вдыхании «забирает» влагу, что негативно влияет на состояние легких человека. Не рекомендуется парить аптечный глицерин. Специалисты советуют использовать только пищевой вариант.
Препараты с органическим соединением необходимо применять согласно инструкции на упаковке. Некоторые лекарства с этим веществом следует предварительно встряхивать перед употреблением. Если глицерин применяется для увлажнения и смягчения кожи или при лечении опрелостей, тогда его придется наносить после каждого мытья рук.
Необходимо следить, чтобы средство не попало в глаза, рот и нос. После лучевой терапии для лечения ожогов кожи рекомендуется проконсультироваться с врачом о приеме вещества.
Глицерин незаменим в пищевой и промышленной сфере. Он обладает множеством полезных свойств, которые особенно ценятся в медицине. При правильном применении средств с таким подсластителем получится улучшить здоровье без вреда организму.
XuMuK.ru — Глицерин
Глицерин (пропантриол-1,2,3). Наиболее важным из трехатомных спиртов является простейший, называемый просто глицерином; он имеет строение СН2ОН—СНОН—СН2ОН. Глицерин был открыт в 1779 г. Шееле; его состав был установлен Пелузом в 1836 г., а для уяснения его строения богатые данные дали работы Бертело (1854) и Вюрца (1855—1857). В свободном состоянии глицерин в небольших количествах содержится в крови животных.
Как уже было указано, природные жиры и масла состоят из сложных эфиров глицерина и высших жирных предельных и непредельных кислот, из которых главнейшими являются пальмитиновая C15H31COOH, стеариновая C17H35COOH и олеиновая C17H33COOH. Омыление жиров производится обычно под действием различных катализаторов (кислот, щелочей, энзимов), причем жиры расщепляются на глицерин и жирные кислоты, например:
Полный синтез глицерина был произведен Фриделем (1873) следующим путем. Восстановлением ацетона был получен изопропиловый спирт СН3—СНОН—СН3, при отнятии воды дающий пропилен СН3—СН=СН2, который, присоединяя хлор, превращается в хлористый пропилен СН3—СНСl—СН2Сl; при действии на него хлора получается трихлорпропан (трихлоргидрин глицерина) СН2Сl—СНСl—СН2Сl, при нагревании с водой дающий глицерин:
Глицерин может быть получен также осторожным окислением аллилового спирта перманганатом в щелочной среде (Е. Е. Вагнер):
Глицерин образуется в небольшом количестве при спиртовом брожении; в особых условиях он может быть получен путем брожения и в промышленном масштабе.
В настоящее время осуществлено промышленное производство синтетического глицерина из непищевого сырья (на основе пропилена, выделяемого из газов нефтепереработки).
Синтез глицерина из пропилена включает следующие стадии:
1. Хлорирование пропилена при 500° С:
2. Омыление хлористого аллила в аллиловый спирт:
3. Присоединение элементов хлорноватистой кислоты:
4. Омыление монохлоргидринов глицерина:
Возможен и другой, более короткий путь — присоединение элементов хлорноватистой кислоты к хлористому аллилу
и последующее омыление дихлоргидринов глицерина:
Третий способ, основанный на окислении пропилена, состоит из следующих стадий:
1. Окисление пропилена в акролеин:
2. Присоединение перекиси водорода к акролеину в присутствии четырехокиси осмия:
3. Гидрирование глицеринового альдегида в глицерин:
Глицерин — сиропообразная бесцветная жидкость сладкого вкуса; смешивается с водой и спиртом, нерастворим в эфире и хлороформе; способен растворять многие органические, а также и неорганические соединения (многие соли, например гипс). Он может быть получен в виде кристаллов, плавящихся при 17° С. Получение глицерина в кристаллическом виде представляет, однако, значительную трудность вследствие его большой склонности к переохлаждению и медленной кристаллизации. Глицерин кипит со слабым разложением при 290° С; относительная плотность d420=1,260.
Химические свойства глицерина определяются наличием в его молекуле трех гидроксильных групп, благодаря чему он может давать три ряда производных, причем моно- и дипроизводные могут существовать в двух структурно-изомерных формах. Монопроизводные глицерина типа СН2Х—СНОН—СН2ОН и дипроизводные СН2Х—СНХ—СН2ОН содержат асимметрический атом углерода, и потому для них возможна оптическая изомерия.
Глицерин дает три ряда металлических производных — глицератов, которые могут получаться даже при действии на глицерин окислов тяжелых металлов, например окиси меди. Это свидетельствует о том, что кислотные свойства у глицерина выражены значительно сильнее, чем у одноатомных спиртов.
Действием галоидоводородных кислот или галоидных соединений фосфора можно получить ряд галоидгидринов глицерина, например монохлоргидрины
дихлоргидрины
и, наконец, трихлорпропан:
При действии иода и фосфора на безводный глицерин получается иодистый аллил, который, вероятно, образуется в результате отщепления иода от непрочного трииодпропана:
Действием иода и фосфора на водный глицерин получается иодистый изопропил. Возможно, что он образуется при неполном восстановлении трииодпропана иодистым водородом:
При недостаточном содержании иодистого водорода в реакционной смеси в качестве побочного продукта получается пропилен СН3—СН=СН2.
Окислением глицерина были получены следующие вещества:
Можно предполагать образование также следующих продуктов:
При действии кислот, хлорангидридов или ангидридов на глицерин могут получиться три ряда сложных эфиров.
Сложные эфиры глицерина с органическими одноосновными кислотами получают названия по входящим в их состав кислотам: эфиры пальмитиновой кислоты называются пальмитинами, стеариновой — стеаринами, олеиновой — олеинами и т. д. Три ряда сложных эфиров обозначают, пользуясь приставками моно-, ди- и три-, например:
При действии на глицерин безводной щавелевой кислоты НООС—СООН можно получить аллиловый спирт. Если безводную щавелевую кислоту нагревать с избытком глицерина до 150° С, то сначала образуется двузамещенный щавелевоглицериновый эфир, который при дальнейшем нагревании распадается на углекислоту и аллиловый спирт:
С водной щавелевой кислотой (Н2С2О4∙2Н2О) образуется однозамещенный кислый эфир щавелевой кислоты, который при нагревании теряет СО2 и переходит в сложный эфир муравьиной кислоты (моноформин глицерина):
Под действием новой порции щавелевой кислоты в результате омыления получается муравьиная кислота, которая при нагревании отгоняется, а глицерин и щавелевая кислота снова вступают в реакцию и т. д. Таким образом с помощью небольшого количества глицерина можно превратить в муравьиную кислоту неограниченное количество щавелевой кислоты.
При действии водоотнимающих средств (KHSO4, H3BO3, безводный MgSO4) из глицерина получается акролеин.
При действии более слабых водоотнимающих средств могут образоваться полиглицериновые алкоголи, например
Из производных глицерина, содержащих окисное кольцо, наибольший интерес представляют соединения типа
Глицидный спирт (глицидол) — бесцветная, слабо пахнущая жидкость, смешивающаяся с водой, спиртом и эфиром; т. кип. 180° С. Подобно окиси этилена, он может быть получен действием едкого кали на монохлоргидрин глицерина. Аналогичное ему хлорпроизводное — эпихлоргидрин может быть получено действием едкого кали на дихлоргидрины, например:
Эпихлоргидрин — нерастворимая в воде жидкость с т. кип. 118° С. В настоящее время он приобрел важное значение как исходный полупродукт для получения эпоксидных смол. Эти полимеры получаются поликонденсацией эпихлоргидрина с ароматическими диоксисоединениями, чаще всего с бис-фенолами.
Глицерин находит значительное практическое применение. В больших количествах он расходуется для изготовления полиэфирных, так называемых алкидных смол, в частности глифталевых, широко применяемых в лакокрасочной промышленности. Он употребляется также для подслащивания ликеров и других напитков, для предохранения материалов от высыхания (на этом основано применение его в текстильной промышленности для аппретуры и шлихтования), как средство смягчения кожи и составная часть различных косметических препаратов. Значительные количества глицерина идут на приготовление нитроглицерина.
Нитроглицерином неправильно называют полный сложный эфир глицерина и азотной кислоты (глицеринтринитрат)
получающийся при осторожном смешении глицерина с охлажденной смесью концентрированных серной и азотной кислот. Нитроглицерин — маслообразная, тяжелая (относительная плотность 1,601 при 15° С) жидкость, нерастворимая в воде, легкорастворимая в спирте, смешивающаяся с эфиром, хлороформом и бензолом. При охлаждении он кристаллизуется (две полиморфные модификации: неустойчивая с т. пл. 2,2° С и устойчивая с т. пл. 12,2°С). Пары нитроглицерина довольно ядовиты.
Нитроглицерин — чрезвычайно взрывчатое вещество. Он взрывает, особенно в твердом состоянии, с исключительной силой, иногда от простого прикосновения. Растворы его не взрывают. Жидкий нитроглицерин вследствие слишком легкой взрываемости не применяется для подрывных работ. Сравнительно безопасна в обращении смесь 75% нитроглицерина с 25% инфузорной земли (трепела), называемая динамитом. Динамит «бризантен», т. е. разложение его носит характер мгновенного взрыва; поэтому динамит не может быть использован для стрельбы из огнестрельного оружия, а применяется лишь для подрывных работ. Так как в твердом состоянии тринитрат глицерина весьма чувствителен к механическим воздействиям, температуру замерзания динамитов понижают, применяя различные добавки, например добавляют к нитроглицерину динитрат гликоля.
Нитроглицерин в смеси с нитратом целлюлозы образует желатинообразную массу («взрывчатый желатин», или «гремучий студень»), которая горит сравнительно медленно и применяется для изготовления бездымных порохов.
Конспект урока по теме «Глицерин». 10-й класс
Класс: 10 класс
Тип урока: урок изучения нового материала
Цель урока: дать понятие о многоатомных спиртах
Задачи урока:
- Образовательные: раскрыть зависимость: состав —> строение —> свойства —> применение глицерина
- Развивающие: продолжить формирование умений: наблюдать за физическими и химическими явлениями, объяснять наблюдаемые явления.
- Воспитательные: формирование интереса к предмету
Использованная литература: Рудзитис Г.Е., Фельдман Ф.Г. Органическая химия, 10 класс
Используемое оборудование:
- Реактивы: растворы сульфата меди (II), натрий кристаллический, глицерин, вода, хлорид натрия, снег
- Оборудование: медиапроектор, презентация, пробирки, фильтровальная бумага, спиртовка, спички, лучинка
Ход урока
I. Организационный момент: приветствие
II. Актуализация опорных ЗУН
Устная фронтальная беседа
— Что такое спирты? (Спирты – производные углеводородов, в молекулах которых один или несколько атомов водорода замещены гидроксильными группами)
— Какова общая формула одноатомных спиртов? (Cnh3n+1OH)
— Какие виды изомерии характерны для спиртов? (Изомерия углеродного скелета, изомерия положения гидроксильной группы)
— Как даются названия спиртам? (Названия производятся от названий соответствующих углеводородов с добавлением суффикса –ол)
III. Логический переход к новому материалу. Определение темы и цели урока.
Классификация спиртов
Одноатомные Многоатомные
Многоатомные спирты – органические соединения, в молекулах которых содержится несколько гидроксильных групп, соединенных с углеводородными радикалами.
СН2ОН-СН2ОН — этандиол-1,2, этиленгликоль
СН2ОН-СНОН-СН2ОН — пропантриол – 1,2,3 , глицерин
Цель урока: рассмотреть глицерин, его физические и химические свойства, способы его получения и применение
Определение темы урока (Глицерин)
IV. Формирование новых ЗУН
1. Получение глицерина
Впервые глицерин получил К. В. Шееле (1779 г) и повторно М.Э. Шеврель (1813г).
В лаборатории глицерин получают из галогенопроизводых соответствующих углеводородов.
СН2Сl – СНCl-СН2Cl +3h3O —> 2СН2ОН – СНОН-СН2ОН +3HCl
Чтобы сдвинуть равновесие реакции вправо. Выделяющуюся соляную кислоту нейтрализуют щелочью.
Глицерин на производстве получают из пропилена, который образуется при крекинге и пиролизе нефти, а также из жиров.
С3Н5(ОС17Н35)3 + 3Н2О —> СН2ОН — СНОН — СН2ОН + 3С17Н35СООН
2. Физические свойства
Глицерин – бесцветная сиропообразная жидкость сладковатого вкуса, хорошо растворяется в воде и в этаноле, кипит при температуре 2900С, гигроскопичен.
Опыт №1. Понижение точки замерзания водных растворов глицерина.
В пробирку налить 5 мл глицерина и сверху постепенно наслаивается такой же объем подкрашенной фуксином воды, встряхнуть. Пробирку поместить в охладительную смесь (смесь снега и твердого хлорида натрия), в смесь одновременно поместить пробирку с водой.
Вопросы во время демонстрации:
— Что наблюдаете? (жидкость становится однородной и окрашивается)
— Какой вывод можно сделать в результате опыта? (Глицерин – незамерзающая жидкость и может быть использована в качестве незамерзающих жидкостей для охлаждения моторов)
Опыт №2. Гигроскопиность глицерина
На лист фильтровальной бумаги нанести несколько капель воды, на второй лист – несколько капель глицерина. Оставить на время.
3. Химические свойства.
Химические свойства глицерина схожи с химическими свойствами одноатомных спиртов.
1. Взаимодействие с кристаллическим натрием
Опыт 3. Реакция с натрием
В пробирку налить 2-3 мл глицерина, опустить в раствор металлический натрий величиной с горошину. Пробирку слегка подогреть, поджечь выделяющийся газ.
Вопросы во время демонстрации
— Что наблюдаете? (выделяется газ, обугливание)
— Какой газ выделяется? (водород, т.к. лучинка горит синим пламенем)
2СН2ОН – СНОН-СН2ОН + 6Nа —> 2СН2ОNа –СНОNa- СН2ОNа +3Н2
глицерат натрия
Взаимодействие с гидроксидом меди (II), в присутствии щелочи. Осадок растворяется и образуется раствор ярко-синего цвета – глицерат меди.
Опыт 4. В пробирку налить гидроксид натрия и по каплям до образования осадка приливаем сульфат меди, к полученному осадку приливаем глицерин.
Уравнение реакции дано в упрощенном виде, ибо одновременно образуются и соединения более сложного состава. Данная реакция доказывает, что многоатомные спирты обладают слабыми кислотными свойствами. Эта реакция является качественной на многоатомные спирты.
Увеличение числа гидроксильных групп в молекулах многоатомных спиртов придает большую подвижность атомам водорода по сравнению с одноатомными спиртами. Это результат взаимного влияния гидроксильных групп друг на друга.
4. Взаимодействие с азотной кислотой.
В результате образуется нитроглицерин – сложный эфир азотной кислоты и глицерина.
Для практического применения нитроглицерина его переводят в динамит, пропитывая нитроглицерином инфузорную землю или древесную муку. Автором динамита является А. Нобель
СН2ОН – СНОН – СН2ОН + 3НNO3 —> СН2ОNO2 – СНОNO2 – СН2ОNO2 + 3Н2О
1,2,3 – тринитроглицерин
Взаимодействие с галогеноводородами
СН2ОН – СНОН – СН2ОН + 3HCl —> СН2Сl – СНСl – СН2Сl + 3Н2О
1,2,3 — трихлорпропан
5. Применение
Глицерин применяют для получения нитроглицерина и динамита. Глицерин используется в парфюмерии и медицине (для изготовления мазей, смягчающих кожу), в кожевенном производстве (для предохранения кож от высыхания), в текстильной промышленности (для придания тканям мягкости и эластичности). В медицине 1%-й раствор нитроглицерина в спирте служит в качестве одного из средств, расширяющих кровеносные сосуды.
6. Генетическая связь многоатомных спиртов с другими классами органических соединений
Вернемся к опыту с фильтровальной бумагой
— Что наблюдаете? (бумага с водой высохла, а с глицерином стала еще важнее)
— Что можно сказать о глицерине? (глицерин может поглощать влагу, тем самым увлажнять предметы).
V. Закрепление.
Раскрыть генетическую схему
VI. Сообщение д/з: параграф 24
Итак, сегодня на уроке мы познакомились с многоатомными спиртами на примере глицерина, рассмотрели его физические и химические свойства, способы получения и применение. На этом урок окончен.