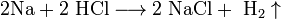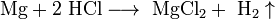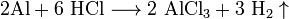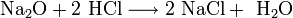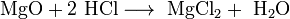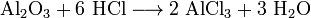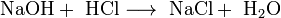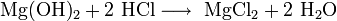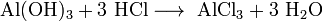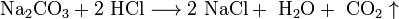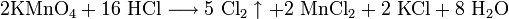Соляная кислота — Википедия
Материал из Википедии — свободной энциклопедии
Соля́ная кислота́ (также хлороводоро́дная, хлористоводоро́дная кислота, хлористый водород[1]) — раствор хлороводорода (HCl) в воде, сильная одноосновная кислота. Бесцветная, прозрачная, едкая жидкость, «дымящаяся» на воздухе (техническая соляная кислота — желтоватого цвета из-за примесей железа, хлора и пр.). В концентрации около ω=0,5%{\displaystyle \omega =0,5\%} присутствует в желудке человека, что соответствует pH=pω−lg(ρh3O/μHCl)≅0,86{\displaystyle pH=p\omega -lg(\rho _{H_{2}O}/\mu _{HCl})\cong 0,86}. Максимальная концентрация при 20 °C равна 38 % по массе, плотность такого раствора 1,19 г/см³. Соли соляной кислоты называются хлоридами.
Физические свойства
Физические свойства соляной кислоты сильно зависят от концентрации растворённого хлороводорода:
| Конц. (вес), кг HCl/кг | кг HCl/м³ | Плотность, кг/л | Молярность M | Водородный показатель (pH) | Вязкость, мПа·с | Удельная теплоемкость, кДж/(кг·К) | Давление пара, Па | Температура кипения, °C | Температура плавления, °C |
| 10 % | 104,80 | 1,048 | 2,87 | −0,4578 | 1,16 | 3,47 | 0,527 | 103 | −18 |
| 20 % | 219,60 | 1,098 | 6,02 | −0,7796 | 1,37 | 2,99 | 27,3 | 108 | −59 |
| 30 % | 344,70 | 1,149 | 9,45 | −0,9754 | 1,70 | 2,60 | 1,410 | 90 | −52 |
| 32 % | 370,88 | 1,159 | 10,17 | −1,0073 | 1,80 | 2,55 | 3,130 | 84 | −43 |
| 34 % | 397,46 | 1,169 | 10,90 | −1,0374 | 1,90 | 2,50 | 6,733 | 71 | −36 |
| 36 % | 424,44 | 1,179 | 11,64 | −1,06595 | 1,99 | 2,46 | 14,100 | 61 | −30 |
| 38 % | 451,82 | 1,189 | 12,39 | −1,0931 | 2,10 | 2,43 | 28,000 | 48 | −26 |
При 20 °C, 1 атм (101 кПа)При затвердевании даёт кристаллогидраты составов HCl·H2O, HCl·2H2O, HCl·3H2O, HCl·6H2O.
Видео по теме
Химические свойства
- 2Na+2 HCl⟶2 NaCl+ h3↑{\displaystyle {\mathsf {2Na+2\ HCl\longrightarrow 2\ NaCl+\ H_{2}\uparrow }}}
- Mg+2 HCl⟶ MgCl2+ h3↑{\displaystyle {\mathsf {Mg+2\ HCl\longrightarrow \ MgCl_{2}+\ H_{2}\uparrow }}}
- 2Al+6 HCl⟶2 AlCl3+3 h3↑{\displaystyle {\mathsf {2Al+6\ HCl\longrightarrow 2\ AlCl_{3}+3\ H_{2}\uparrow }}}
- Na2O+2 HCl⟶2 NaCl+ h3O{\displaystyle {\mathsf {Na_{2}O+2\ HCl\longrightarrow 2\ NaCl+\ H_{2}O}}}
- MgO+2 HCl⟶ MgCl2+ h3O{\displaystyle {\mathsf {MgO+2\ HCl\longrightarrow \ MgCl_{2}+\ H_{2}O}}}
- Al2O3+6 HCl⟶2 AlCl3+3 h3O{\displaystyle {\mathsf {Al_{2}O_{3}+6\ HCl\longrightarrow 2\ AlCl_{3}+3\ H_{2}O}}}
- NaOH+ HCl⟶ NaCl+ h3O{\displaystyle {\mathsf {NaOH+\ HCl\longrightarrow \ NaCl+\ H_{2}O}}}
- Ba(OH)2+2 HCl⟶ BaCl2+2 h3O{\displaystyle {\mathsf {Ba(OH)_{2}+2\ HCl\longrightarrow \ BaCl_{2}+2\ H_{2}O}}}
- Al(OH)3+3 HCl⟶ AlCl3+3 h3O{\displaystyle {\mathsf {Al(OH)_{3}+3\ HCl\longrightarrow \ AlCl_{3}+3\ H_{2}O}}}
- Na2CO3+2 HCl⟶2 NaCl+ h3O+ CO2↑{\displaystyle {\mathsf {Na_{2}CO_{3}+2\ HCl\longrightarrow 2\ NaCl+\ H_{2}O+\ CO_{2}\uparrow }}}
- 2KMnO4+16 HCl⟶5 Cl2↑+2 MnCl2+2 KCl+8 h3O{\displaystyle {\mathsf {2KMnO_{4}+16\ HCl\longrightarrow 5\ Cl_{2}\uparrow +2\ MnCl_{2}+2\ KCl+8\ H_{2}O}}}
 Соляная кислота (в стакане) взаимодействует с аммиаком
Соляная кислота (в стакане) взаимодействует с аммиаком- Nh4+HCl⟶Nh5Cl{\displaystyle {\mathsf {NH_{3}+HCl\longrightarrow NH_{4}Cl}}}
- HCl+AgNO3→AgCl↓+HNO3{\displaystyle {\mathsf {HCl+AgNO_{3}\rightarrow AgCl{\downarrow }+HNO_{3}}}}
Получение
Соляную кислоту получают растворением газообразного хлороводорода в воде. Хлороводород получают сжиганием водорода в хлоре, полученная таким способом кислота называется синтетической. Также соляную кислоту получают из абгазов — побочных газов, образующихся при различных процессах, например, при хлорировании углеводородов. Хлороводород, содержащийся в этих газах, называется абгазным, а полученная таким образом кислота — абгазной. В последние десятилетия доля абгазной соляной кислоты в объёме производства постепенно увеличивается, вытесняя кислоту, полученную сжиганием водорода в хлоре. Но полученная методом сжигания водорода в хлоре соляная кислота содержит меньше примесей и применяется при необходимости высокой чистоты.
В лабораторных условиях используется разработанный ещё алхимиками способ, заключающийся в действии концентрированной серной кислоты на поваренную соль:
- NaCl+h3SO4→150oCNaHSO4+HCl{\displaystyle {\mathsf {NaCl+H_{2}SO_{4}{\xrightarrow[{}]{150^{o}C}}NaHSO_{4}+HCl}}}
При температуре выше 550 °C и избытке поваренной соли возможно взаимодействие:
- 2NaCl+h3SO4→550oCNa2SO4+2HCl{\displaystyle {\mathsf {2NaCl+H_{2}SO_{4}{\xrightarrow[{}]{550^{o}C}}Na_{2}SO_{4}+2HCl}}}
Возможно получение путём гидролиза хлоридов магния, алюминия (нагревается гидратированная соль):
- MgCl2⋅6h3O→t,oCMgO+2HCl+5h3O{\displaystyle {\mathsf {MgCl_{2}\cdot 6H_{2}O{\xrightarrow[{}]{t,^{o}C}}MgO+2HCl+5H_{2}O}}}
- AlCl3⋅6h3O→t,oCAl(OH)3+3HCl+3h3O{\displaystyle {\mathsf {AlCl_{3}\cdot 6H_{2}O{\xrightarrow[{}]{t,^{o}C}}Al(OH)_{3}+3HCl+3H_{2}O}}}
Эти реакции могут идти не до конца с образованием основных хлоридов (оксихлоридов) переменного состава, например:
- MgCl2+h3O→Mg2OCl2+HCl{\displaystyle {\mathsf {MgCl_{2}+H_{2}O{\xrightarrow[{}]{}}Mg_{2}OCl_{2}+HCl}}}[4]
Хлороводород хорошо растворим в воде. Так, при 0 °C 1 объём воды может поглотить 507 объёмов HCl, что соответствует концентрации кислоты 45 %. Однако при комнатной температуре растворимость HCl ниже, поэтому на практике обычно используют 36-процентную соляную кислоту.
Применение
Промышленность
Медицина
- Естественная составная часть желудочного сока человека. В концентрации 0,3—0,5 %, обычно в смеси с ферментом пепсином, назначается внутрь при недостаточной кислотности.
Особенности обращения

Высококонцентрированная соляная кислота — едкое вещество, при попадании на кожу вызывает сильные химические ожоги. Особенно опасно попадание в глаза. Для нейтрализации ожогов применяют раствор слабого основания, или соли слабой кислоты, обычно питьевой соды.
При открывании сосудов с концентрированной соляной кислотой пары хлороводорода, притягивая влагу воздуха, образуют туман, раздражающий глаза и дыхательные пути человека.
Реагируя с сильными окислителями (хлорной известью, диоксидом марганца, перманганатом калия) образует токсичный газообразный хлор.
В РФ оборот соляной кислоты концентрации 15 % и более — ограничен[5].
Примечания
Ссылки
wiki2.red
Соляная кислота | Info-Farm.RU
Соляная кислота, также: соляная кислота, хлороводородная кислота — раствор хлористого водорода (HCl) в воде. Соляная кислота является типичной кислотой. По своей химической активностью она относится к числу наиболее сильных кислот. Подобно другим сильных кислот она активно растворяет большинство металлов с выделением водорода, взаимодействует с оксидами металлов и т.
Концентрированная соляная кислота содержит 37% HCl и имеет плотность 1,19 г / см 3. Она имеет резкий запах и «дымит» на воздухе вследствие выделения газообразного хлороводорода. Техническая кислота имеет желтый цвет, который обуславливается примесями главным образом солей железа.
Соляная кислота широко используется в народном хозяйстве. Больше всего применяется она в химической промышленности для получения различных солей: хлорида цинка, хлорида бария и др., А также для производства красителей, лечебных веществ. Многие соляной кислоты потребляет также металлургическая промышленность для выделения цветных и редких металлов из их природных смесей. В химических лабораториях соляная кислота относится к наиболее употребляемых реактивов. В небольших количествах из нее также получают водород и хлор.
История открытия
Трудно сказать, кто и когда впервые получил соляную кислоту. Известно, что уже в конце XV в. алхимик Василий Валентин и в XVI в. Андреас Либаве в исполнительных поисках чудодейственного жизненного эликсира прокаливали в своих алхимических приборах поваренную соль с квасцами и купороса и получили продукт, который описали под названием «кислого спирта». Это и была знакома теперь нам соляная кислота, очень нечисто.
Для первых исследователей это была совершенно новая вещество, обладавшей свойствами, которые сильно поражали их воображение. Нюхая ее, они задыхались и кашляли, «кислый спирт» дымов в воздухе. При пробе на вкус, она обжигала язык и небо, металлы она разъедала, ткани разрушала.
В 1658 г.. Немецкий химик И. Глаубер (1604-1670) нашел новый способ получения соляной кислоты, которую он назвал «соляным спиртом». Способ этот широко применяется до сих пор в лабораториях. Он нагревал поваренную соль с концентрированной серной кислотой и «дым», который выделялся, поглощал водой.
В 1772 г.. Английский химик Джозеф Пристли (1733-1804) установил, что при действии серной кислоты на поваренную соль выделяется бесцветный газ, который может быть собран над ртутью, и этот газ имеет очень большую способность растворяться в воде. Водный раствор этого газа получил название «соляной кислоты» (acidum muriaticum), а сам газ Пристли назвал «чистой газообразной соляной кислотой».
В 1774 шведский химик К.В. Шееле (1742-1786), исследуя действие соляной кислоты (которую он называл еще «соляным спиртом») на оксид марганца (IV), нашел, что он растворяется в соляной кислоте на холоде, образуя темно-коричневый раствор, из которого при нагревании выделяется газ желто-зеленого цвета, обладающий очень резким запахом, способностью разрушать растительные краски и действует на все металлы, не исключая золота. Шееле, как последователь флогистонной теории, господствовавшей в то время, считал, что смысл этой реакции заключается в том, что под действием оксида марганца (IV) с соляной кислотой уходит из нее флогистон, благодаря чему соляная кислота превращается в желто-зеленый газ. Поэтому сам газ он назвал «дефлогистированный соляной кислотой».
Химические свойства
- Взаимодействие с металлами, стоящими в ряду напряжений левее водорода с образованием соли и выделением газообразного водорода:
- Взаимодействие с оксидами металлов с образованием растворимой соли и воды:
- Взаимодействие с гидроксидами металлов с образованием растворимой соли и воды (реакция нейтрализации):
- Взаимодействие с солями металлов, образованных более слабыми кислотами, например угольной:
- Взаимодействие с сильными окислителями (перманганат калия, диоксид марганца) с выделением газообразного хлора
Изображения по теме
info-farm.ru
Разница между Технической Соляной кислотой и Серной кислотой
Ключевое различие между Технической Соляной кислотой и Серной кислотой заключается в том, что Техническая Соляная кислота представляет собой хлорсодержащее соединение, тогда как Серная кислота представляет собой серосодержащее соединение.
Техническая Соляная кислота имеет ту же химическую формулу, что и Соляная кислота — HCl. Но она отличается от Соляной кислоты своим желтым цветом. Этот желтый цвет возникает из-за присутствия примесей железа и хлора. С другой стороны, Серная кислота является одной из наиболее важных кислот, производимых в химической промышленности, так как она применяется при производстве многих других химических соединений.
Содержание
- Обзор и основные отличия
- Что такое Техническая Соляная кислота
- Что такое Серная кислота
- В чем разница между Технической Соляной и Серной кислотой
- Заключение
Что такое Техническая Соляная кислота?
Техническая Соляная кислота — это соляная кислота с примесями. Она имеет ту же химическую формулу, что и соляная кислота, то есть HCl. Из-за присутствия примесей это соединение имеет желтый цвет. Этот желтый цвет возникает из-за примесей железа и хлора.

Производство Технической соляной кислоты осуществляется с помощью дистилляции соляной кислоты и соли (содержащей хлорид-ионы). Примеси в этой кислоте проявляются в процессе дистилляции. Однако эти примеси не влияют на свойства этой кислоты. По шкале «Baume» — эта кислота имеет более низкое значение по сравнению с соляной кислотой. Шкала оценки «Baume» — это шкала, используемая для измерения плотности жидкости.
Техническая Соляная кислота применяется в различных областях. Например, она применяется в качестве средства для регулирования рН воды в бассейне и для очищения его стенок от налёта, для очистки металлических поверхностей, для травления металлов.
Что такое Серная кислота?
Серная кислота является минеральной кислотой состоящую из элементов серы, кислорода и водорода. Химическая формула этого соединения H2SO4. При комнатной температуре это жидкость без цвета и запаха, которая является сиропообразной. Растворяется в воде, выделяя тепловую энергию (экзотермическая реакция). Молярная масса этого соединения составляет 98,07 г/моль.
 Серная кислота
Серная кислотаТемпература плавления этой кислоты составляет 10°С, а температура кипения составляет 337°С. Однако при температуре выше 300°С серная кислота медленно разлагается. Эта кислота является сильной кислотой. Следовательно, она очень агрессивна по отношению к металлам и тканям. Даже в малых концентрациях серная кислота может повредить кожу человека. Кроме того, это соединение гигроскопично. Следовательно, серная кислота легко поглощает водяной пар из атмосферы.
Некоторые применения серной кислоты:
- Для производства удобрений
- В переработке нефти
- Переработка сточных вод
- Синтез различных химических соединений
В чем разница между Технической Соляной кислотой и Серной кислотой?

Заключение — Техническая Соляная кислота против Серной кислоты
Кислоты — это соединения, способные высвобождать протоны. Некоторые кислоты являются сильными, а другие являются слабыми кислотами. Однако большинство кислотных соединений в их концентрированном состоянии являются разъедающими. Техническая Соляная кислота и Серная кислота являются такими двумя кислотными соединениями. Различие между Технической Соляной кислотой и Серной кислотой заключается в том, что Техническая Соляная кислота представляет собой хлорсодержащее соединение, тогда как Серная кислота представляет собой серосодержащее соединение.
raznisa.ru
Соляная кислота — Знаешь как
В лаборатории хлороводород получают действием серной кислоты на хлорид натрия:
NaCl + h3SO4 = HCI + NaHSO4
При 700—800° С гидросульфат натрия взаимодействует со вторым молем хлорида натрия:
NaCl + NaHSO4 = HCI + Na2SO4
Поэтому при высокой температуре (в технике) реакция протекает с образованием двух молей хлороводорода и сульфата натрия:
2NaCl + h3SO4 = 2HCl + Na2SO4
Хлороводород— бесцветный газ с резким запахом, раздражает слизистые оболочки, немного тяжелее воздуха, не горит и горения не поддерживает. Во влажном воздухе он дымит, образуя с водяными парами мельчайшие капли соляной кислоты, имеющие вид тумана (в сухом воздухе этого не происходит). Растворимость хлороводорода в воде очень велика; в 1 объеме воды при 0° С растворяется 507 объемов хлороводорода. Получающийся при этом раствор называют хлороводородной или соляной кислотой.
Соляная кислота что такое
В технике соляную кислоту получают синтетическим и сульфатным методами.
Синтетический метод состоит из двух процессов: синтеза хлороводорода и поглощения его водой. Синтез ведут в контактной печи — вертикальной стальной трубе (высота 7 м, диаметр 0,0 м) с горелкой, состоящей из двух трубок ; по внутренней трубке подается хлор, а по внешней водород. Подожженная смесь горите образованием хлороводорода, направляемого в поглотительную колонну с кислотоупорными кольцами, обеспечивающими большую поверхность контакта газа с водой (вода и хлороводород, движутся навстречу друг другу по принципу противотока).
Концентрированная соляная кислота получается в первой колонне (во второй колонне улавливаются остатки хлороводорода). Синтетический метод удобен, не требует расхода кислот и дешев, необходимые хлор и водород получают электролизом раствора хлорида натрия.
Химически чистая соляная кислота — бесцветная жидкость с резким запахом, содержит 42% НСl (при 18° С). Концентрированную соляную кислоту, получаемую сульфатным способом, содержащую 37% НСl (пл. 1,19 г/см³ ) и выделяющую на воздухе хлороводород, называют дымящей. Синтетическая соляная кислота содержит около 31% HCI. Желтый цвет технической соляной кислоты вызывается примесями хлорида железа (III).
Известно, что соляная кислота входит в состав желудочного сока, имеет большое значение для пищеварения человека и животных.
Соляную кислоту используют в производстве красителей, лекарств, хлорида аммония, угольной кислоты , хлора и водорода. Применяется она в пищевой промышленности и в медицине. Но больше всего расходуется ее на производство хлоридов.
Хлорид калия КСl — пенное калийное удобрение. Кроме того, хлорид калия используют в стекольной и химической промышленности.
Хлорид бария ВаO2-2Н2O применяется как инсектицид кишечного действия.
Хлорид ртути (II), или сулема, HgCl2 — сильнейший яд. Сулему используют для дезинфекции в медицине и как протравитель семян в сельском хозяйстве.
Хлорид ртути (I), или каломель, Hg2CI2 не ядовит, применяется в медицине как слабительное.
Хлорид натрия, или поваренная соль, NaCl — природное сырьё химической промышленности. Используется в производстве едкого натра, соляной кислоты, хлора, хлорной извести, соды, применяется также в металлургической, кожевенной и мыловаренной промышленности. Хлорид натрия — приправа к пище и средство консервирования (квашения, соления) продукции растениеводства.
Хлорид цинка ZnCl2 служит главным образом для пропитывании древесины (шпал-и телеграфных столбов) против гниения, применяется в медицине, а также при паянии.
Хлорид серебра AgCl — один из немногих малорастворнимых хлоридов . Он находит применение в фотопромышленности, так как oбладает светочувствительностью, т. е. свойством разлагаться под действием света с выделением свободного серебра.
Вы читаете, статья на тему соляная кислота
znaesh-kak.com
Соляная кислота. Кислородсодержащие кислоты
Соляная кислота HCl
 Цистерна с соляной кислотой
Цистерна с соляной кислотойСоляная кислота — одна из сильных одноосновных кислот и образуется при растворении газа хлороводорода (HCl) в воде, — прозрачная бесцветная жидкость с характерным запахом хлора. Разбавленная соляная кислота (также как и фосфорная) часто применяется для снятия оксидов при пайке металлов.
Иногда газообразное соединение HCl ошибочно называют соляной кислотой. HCl — это газ, который при растворении в воде образует соляную кислоту.
Хлороводород — бесцветный газ с резким удушливым запахом хлора. Он переходит в жидкое состояние при -840C, а при -1120C — переходит в твёрдое состояние.
Хлороводород очень хорошо растворяется в воде. Так при 00C в 1л воды растворяется 500л хлороводорода.
В сухом состоянии газ хлороводород достаточно инертный, но уже может взаимодействовать с некоторыми органическими веществами, например с ацетиленом (газ, который выделяется при опускании карбида в воду).
Химические свойства соляной кислоты
— химическая реакция с металлами:2HCl + Zn =ZnCl2 + H2 — образуется соль (в данном случае прозрачный раствор хлорид цинка) и водород
— химическая реакция с оксидами металлов:
2HCl + CuO = CuCl2 + H2O — образуется соль (в данном случае раствор соли зёленого хлорида меди) и вода
— химическая реакция с основаниями и щелочами (или реакция нейтрализации)
HCl + NaOH = NaCl + H2O — реакция нейтрализации, -образуется соль (в данном случае прозрачный раствор хлорид натрия) и вода.
— химическая реакция с солями (например, c мелом СaCO3):
HCl + СaCO3 = CaCl2 + CO2 + H2O — образуется углекислый газ, вода и прозрачный раствор хлорида кальция CaCl2.
Получение соляной кислоты
Соляную кислоту получают с помощью химической реакции соединения:
H2 + Cl2 = HCl — реакция происходит при повышенной температуре
А также при взаимодействии поваренной соли и концентрированной серной кислотой:
H2SO4 (конц.) + NaCl = NaHSO4 + HCl
В этой реакции, если вещество NaCl — в твёрдом виде, то HCl — это газ хлороводород, который при растворении в воде образует соляную кислоту
Кислородсодержащие кислоты
 Соляная кислота
Соляная кислотаСуществуют сложные химические вещества, по химическому строению сходные с соляной кислотой, но при этом содержащие в молекуле от одного до четырёх атомов кислорода. Эти вещества можно назвать кислородсодержащими кислотами. С повышением числа атомов кислорода увеличивается стойкость кислоты и её окислительная способность.
К кислородсодержащим кислотам слудующие:
- хлорноватистая (HClO),
- хлористая (HClO2),
- хлорноватая (HClO3),
- хлорная (HClO4).
Каждое из этих химических сложных веществ обладает всеми свойствами кислот и способна образовывать соли. Хлорноватистая кислота (HClO) образует гипохлориты, например, соединение NaClO — гипохлорит натрия. Сама хлорноватистая кислота образуется при растворении хлора в холодной воде по химической реакции:
H2O + Cl2 = HCl + HClO,
Как видите, в этой реакции образуется сразу две кислоты — соляная HCl и хлорноватистая HClO. Но последняя — нестойкое химическое соединение и постепенно переходит в соляную кислоту;
Хлористая HClO2 образует хлориты, соль NaClO2 — хлорит натрия;
хлорноватая (HClO3) — хлораты, соединение KClO3, — хлорат калия (или бертолетова соль)- кстати, это вещество широко применяется при изготовления спичек.
И наконец самая сильная из известных одноосновных кислот — хлорная (HClO4) — бесцветная, дымящаяся на воздухе, сильно гигроскопичная жидкость, — образует перхлораты, например, KClO4 — перхлорат калия.
Соли, образованные хлорноватистой HClO и хлористой HClO2 кислотами, в свободном состоянии не устойчивы и являются сильными окислителями в водных растворах. А вот соли, образованные хлорноватой HClO3 и хлорной HClO4 кислотами на основании щелочных металлов (например, таrже бертолетова соль KClO3), — достаточно устойчивы и не проявляют окислительных свойств.
www.kristallikov.net