Классификация неорганических веществВо-первых, все неорганические вещества делятся на простые и сложные. Простые вещества — это вещества, состоящие из атомов одного химического элемента. Иными словами, это форма существования элементов в свободном виде. Все остальные вещества являются сложными. Простые:1) Неметаллы: H2, O2, O3, N2, F2, He и др. Всего в периодической таблице химических элементов присутствуют 22 неметалла. В обычных условиях они могут быть в твердом состоянии (I2), жидком (Br2) или газообразном (H2, O2, F2, Cl2 и другие). Сложные:1) Оксиды — соединения, состоящие из двух элементов, один из которых кислород в степени окисления -2.
2) Пероксиды — сложные вещества, в которых атомы кислорода соединены друг с другом и находятся в степени окисления -1.
3) Гидроксиды
4) Соли — сложные вещества, состоящие из катиона(ов) металла (или катиона аммония NH4+) и аниона(нов) кислотного остатка.
5) Бинарные неорганические соединения
6) Водородные соединения (также являются бинарными соединениями)
|
Классификация неорганических веществ основана на их способности к разложению. Простые вещества, состоящие из атомов только одного химического элемента (O2, h3, Mg), не распадаются. Легко разлагаются сложные вещества, состоящие из атомов двух и более элементов (CO2, h3SO4, NaOH, KCl).


Простые
Классификация классов неорганических веществ включает:
- металлы – элементы, обладающие тепло- и электропроводностью, высокой пластичностью, ковкостью, металлическим блеском;
- неметаллы – более хрупкие, чем металлы, элементы, не обладающие электропроводностью и проявляющие окислительные свойства.


Рис. 1. Схема классификации неорганических веществ.
Металлы расположены в нижнем левом углу периодической таблицы, неметаллы – в правом верхнем углу и включают благородные газы.


Рис. 2. Расположение металлов и неметаллов в таблице Менделеева.
Многие простые химические элементы обладают аллотропией – свойством образовывать несколько простых веществ. Например, при присоединении ещё одного атома к кислороду образуется простое вещество озон (О3), углерод в зависимости от количества атомов образует графит, уголь или алмаз.
Сложные
Сложные вещества классифицируют на следующие классы:
- оксиды – состоят из двух элементов, один из которых является кислородом;
- кислоты – состоят из атомов водорода и кислотного остатка;
- основания – состоят из металла и одной или нескольких гидроксильных групп;
- соли – состоят из металла и кислотного остатка.
Отдельно выделяют амфотерные гидроксиды, которые проявляют свойства кислот и оснований. Это твёрдые вещества, являющиеся слабыми электролитами. К ним относятся гидроксиды металлов со степенью окисления +3 и +4. Исключениями являются Be(OH)2, Zn(OH)2, Sn(OH)2, Pb(OH)2.
Более подробная классификация сложных веществ представлена в таблице с примерами.
Вид | Номенклатура | Химические свойства | Пример |
Оксиды – ЕхОу | Оксид элемента (степень окисления) | Выделяют основные оксиды, которые при взаимодействии с кислотами образуют соли, и кислотные оксиды, образующие при взаимодействии с основаниями кислоты. Отдельно выделяют амфотерные оксиды, взаимодействующие с кислотами и основаниями (образуется соль) | Na2O – оксид натрия, Fe2O3 – оксид железа (III), N2O5 – оксид азота (V) |
Основания – Ме(ОН)х | Гидроксид металла (степень окисления) | В соответствии с растворимостью выделяют щёлочи и нерастворимые в воде основания. Щёлочи взаимодействуют с неметаллами и кислотными оксидами. Нерастворимые основания взаимодействуют с кислотами и способны разлагаться при высоких температурах | Fe(OH)2 – гидроксид железа (II), Cu(OH)2 – гидроксид меди (II), NaOH – гидроксид натрия |
Кислоты – HnAc | Читается в зависимости от кислотного остатка | Взаимодействуют с металлами, стоящими левее водорода в ряде активности, с оксидами, солями. Способны разлагаться при высоких температурах | h3SO4 – серная кислота, HCl – соляная кислота, HNO3 – азотная кислота |
Соли – Мех(Ас)у | Кислотный остаток металла (степень окисления) | Реагируют с кислотами, щелочами, металлами и солями | Na2SO4 – сульфат натрия, CaCO3 – карбонат кальция, KCl – хлорид калия |


Рис. 3. Список названий кислот.
Генетические связи между классами основаны на взаимном превращении веществ. При химических реакциях атомы переходят от одного вещества к другому, образуя генетические ряды (ряды превращений). Металл при присоединении кислорода образует оксид, который при взаимодействии с водой превращается в основание. Из неметалла образуется кислотный оксид, который, взаимодействуя с водой, образует кислоту. Любой генетический ряд заканчивается солью.
Что мы узнали?
Неорганические вещества включают простые и сложные соединения. Простые вещества состоят из атомов одного и того же элемента. К ним относятся металлы и неметаллы. Сложные соединения включают вещества, состоящие из нескольких элементов. К ним относятся оксиды, кислоты, основания, соли и амфотерные гидроксиды. Все вещества генетически связаны между собой. Из простого вещества можно получить более сложное вещество. Наиболее сложными веществами считаются соли.
ПредыдущаяХимияКислотные оксиды – список с примерами и формулами
СледующаяХимияХимические свойства солей – общие для нерастворимых и кислых (8 класс, химия)
Оксиды.
Оксиды – это сложные химические вещества, состоящие из двух элементов, один из которых – кислород (на втором месте) со степенью окисления -2.
Оксиды имеют большинство элементов (за исключением фтора, самого кислорода и некоторых благородных газов).
Большинство оксидов получают прямым взаимодействием простых веществ с кислородом (чаще при нагревании) – это так называемые реакции горения.
В зависимости от того, атомами какого элемента образованы оксиды, они будут проявлять различные свойства. В зависимости от этих свойств оксиды делятся на 4 группы:
- Основные оксиды.
Как видно из названия проявляют основные свойства. Основным оксидам соответствуют основные гидроксиды (ВСТАВИТЬ).
Основные оксиды образуют ТОЛЬКО металлы со степенями окисления +1,+2. Примеры: Li2O, Na2O, Ag2O, CaO, BaO, MgO, CuO.
Но есть четыре исключения: ZnO, BeO, SnO, PbO – в этих соединениях металлы проявляют степень окисления +2, однако основными оксидами они не являются. Если не основными тогда какими они будут? Об этом позже.
- Кислотные оксиды.
В противоположность основным оксидам, кислотные оксиды проявляют кислотные свойства. И этим оксидам соответствуют кислоты.
Кислотные оксиды образуют:
- Большинство неметаллов (SO2, N2O5, Cl2O7, CO2)
- Металлы со степенями окисления +5, +6, +7 (CrO3, Mn2O3)
- Амфотерные оксиды.
Амфотерность – это явление, при котором соединение проявляет как кислотные, так и основные свойства. (от др. греч. ἀμφότεροι — «двойственный», «обоюдный»).
Амфотерные оксиды образуют:
- ТОЛЬКО металлы со степенями окисления +3,+4 (Al2O3, Fe2O3, Cr2O3, MnO2)
- Четыре исключения о которых мы упомянули в пункте про основные оксиды: Zn, Be, Pb, Sn. Их оксиды будут амфотерными не смотря на то, что степень окисления металла = +2: ZnO, BeO, PbO, SnO.
- Несолеобразующие оксиды.
Эти оксиды не проявляют кислотно-основных свойств вообще. Им не соответствуют ни кислоты, ни основания. Они стоят особняком от остальных оксидов. Их не так много поэтому нужно выучить все, которые встречаются в ЕГЭ: CO, N2O, NO, SiO.
Гидроксиды.
Гидроксидами называют неорганические вещества, содержащие одну или несколько групп OH.
ВАЖНО: каждому гидроксиду соответствуют свой оксид. В оксиде и соответствующем ему гидроксиде степень окисления элемента (который образует оксид и гидроксид) одинакова.
То есть оксид K2O – степень окисления +1, ему соответствует гидроксид KOH (степень окисления калия +1).
Особенно это актуально для элементов с переменной степенью окисления.
Оксиду FeO соответствует гидроксид Fe(OH)2, степень окисления +2.
Оксиду Fe2O3 соответствует гидроксид Fe(OH)3, степень окисления +3.
Соответственно гидроксиды, как и оксиды мы будем делить на три группы: основные, амфотерные, кислотные.
Несолеобразующие оксиды – это отдельная история у них нет соответствующих им гидроксидом, они стоят стороной.
Принцип классификации тот же самый.
- Основные гидроксиды.
Как и соответствующие им оксиды, основные гидроксиды – это гидроксиды ТОЛЬКО металлов со степенями окисления +1,+2 (KOH, NaOH, Ca(OH)2, Cu(OH)2, Fe(OH)2, Mg(OH)2).
Кроме четырех уже известных нам исключений: цинк, бериллий, свинец и олово: их гидроксиды будут амфотерными.
Основные гидроксиды часто называют основаниями. Пусть пока для вас эти понятия будут синонимами.
Основный гидроксид = основание.
По своим свойствам основные гидроксиды (основания) делятся на сильные и слабые. Сила основания зависит от его растворимости в воде. Сильные – растворимы, слабые – нет.
Сильные основания называются щелочами. Их отличительный признак – растворимость в воде. Не нужно смотреть в таблице растворимости является ли данный гидроксид щелочью. Во-первых, не все они там есть. Во-вторых, понятие растворимости условное. В таблице растворимости указано: «М» – малорастворим. Для нас такое не годится – в ЕГЭ между растворимыми и нерастворимыми основаниями есть резкая граница.
Поэтому нужно запомнить восьмерку активных металлов, которые образуют щелочи (то есть растворимые в воде основания): это IA группа и AII, начиная с кальция. То есть: литий, натрий, калий, рубидий, цезий, кальций, стронций, барий.
Их гидроксиды – щелочи (растворимые в воде основания): LiOH, NaOH, KOH, RbOH, CsOH, Ca(OH)2, Sr(OH)2, Ba(OH)2.
Слабые основания гораздо хуже растворимы в воде. Поскольку щелочи мы выучили – это восьмерка, все остальные основные гидроксиды являются слабыми (то есть нерастворимыми).
- Амфотерные гидроксиды.
Это гидроксиды металлов со степенью окисления +3,+4 (Al(OH)3, Cr(OH)3, Fe(OH)3, Sn(OH)4).
А также четыре гидроксида-исключения: Zn(OH)2, Be(OH)2, Sn(OH)2, Pb(OH)2. В которых металлы проявляют степень окисления +2, но тем не менее их гидроксиды проявляют амфотерные свойства. То есть сочетают в себе свойства как кислот, так и оснований.
- Кислотные гидроксиды.
С этими веществами, как правило бывает очень много путаницы и непонимания.
Объясню на примере. Возьмем оксид серы VI SO3 он кислотный. Степень окисления +6. Какой кислотный гидроксид ему соответствует?
Никому в голову не придет сказать, что это S(OH)6. Такого вещества нет.
Запомните и осмыслите, кислотные гидроксиды – это кислородсодержащие кислоты. В частности, для оксида серы (VI), это будет кислородсодержащая кислота, образованная серой в степени окисления +6. Это серная кислота: H2SO4.
Посмотрим на ее структурную формулу:
И видим в структуре ОН группы. Поэтому кислородсодержащие кислоты являются гидроксидами, про это часто забывают.
Кислоты.
Кислоты – это сборная группа веществ, обладающие общими свойствами. Существует много концепций кислот и оснований, в которых понятие кислоты различное.
Мы будем рассматривать классическое представление.
Кислоты – это сложные химические вещества, состоящие из кислотного остатка и атомов водорода.
Кислоты имеют свойства диссоциировать (обратимо распадаться): кислотный остаток, как бы отделяется от водорода. При этом образуются положительно заряженные ионы водорода: H+, и кислотный остаток. Соответственно кислотный остаток будет являться отрицательно заряженным ионом (анионом).
Вот именно по этому признаку: способность образовывать положительно заряженные ионы водорода (H+), мы будет относить то или иное вещество к кислотам.
Кислотный остаток – это отрицательно заряженный ион (анион), образующийся при отнятии от кислоты ионов водорода H+.
По-своему, если можно сказать происхождению, неорганические кислоты делятся на две группы: бескислородные и кислородосодержащие.
Кислородосодержащие кислоты.
Кислородосодержащие кислоты, так или иначе, содержат в строении группу ОН, как мы убедились на примере серной кислоты. Соответственно, кислородосодержащие кислоты – это кислотные гидроксиды. И им будут соответствовать кислотные оксиды.
Не путайте кислотный остаток и кислотный оксид!
Кислотный оксид – это оксид элемента, который образует данную кислородосодержащую кислоту. Степень окисления элемента в кислоте и кислотном оксиде, который ей соответствует, одинаковая.
Кислотный остаток – это НЕ ВЕЩЕСТВО, это группа атомов (ион, имеющий отрицательный заряд).
| Название кислородсодержащей кислоты (кислотного гидроксиды) | Формула | Кислотный остаток | Кислотный оксид, соответствующий кислотному гидроксиду. | Степень окисления элемента, образующего кислоту |
| Серная | H2SO4 | SO42- | SO3 | +6 |
| Cернистая | H2SO3 | SO32- | SO2 | +4 |
| Азотная | HNO3 | NO3– | N2O5 | +5 |
| Азотистая | HNO2 | NO2– | N2O3 | +3 |
| Угольная | H2CO3 | CO32- | CO2 | +4 |
| Ортофосфорная (фосфорная) | H3PO4 | PO43- | P2O5 | +5 |
| Борная | H3BO3 | BO33- | B2O3 | +3 |
| Хлорноватистая | HClO | ClO– | Cl2O | +1 |
| Хлористая | HClO2 | ClO2– | Cl2O3 | +3 |
| Хлорноватая | HClO3 | ClO3– | Cl2O5 | +5 |
| Хлорная | HClO4 | ClO4– | Cl2O7 | +7 |
| Марганцовая | HMnO4 | MnO4– | Mn2O7 | +7 |
| Хромовая | H2CrO4 | CrO42- | CrO3 | +6 |
| Кремниевая | H2SiO3 | SiO32- | SiO2 | +4 |
Бескислородные кислоты.
Бескислородные кислоты – это неорганические вещества, которые не относятся к классу кислотных гидроксидов, но тем не менее, вследствие своих индивидуальных особенностей способны образовывать ионы водорода (H+) с отщеплением кислотного остатка.
Есть вещества: HF (фтороводород), HCl (хлороводород), HBr (бромоводород), HI (иодоводород), H2S (сероводород), которые при нормальных условиях находятся в газообразном состоянии. Эти вещества растворяясь в воде, образуют соответствующие кислоты.
| Название бескислородной кислоты | Формула | Кислотный остаток | Степень окисления элемента, образующего кислоту |
| Фтороводородная (плавиковая) | HF | F– | -1 |
| Хлороводородная (соляная) | HCl | Cl– | -1 |
| Бромоводородная | HBr | Br– | -1 |
| Иодоводородная | HI | I– | -1 |
| Сероводородная | H2S | S2- | -2 |
Возьмем, к примеру, хлороводород – это газ. Растворим его в воде – получим хлороводородную кислоту. Никаких химических преобразований не происходит, простое растворение.
Как вы можете убедиться на этом примере, то в каком состоянии находится вещество (например, в растворе или в чистом виде) значительно влияет на свойства, которые будет проявлять данное вещество.
Кислоты, как и основания делятся на слабые и сильные. Принадлежность кислоты к категории сильных или слабых нужно запомнить. Это важный момент.
| Сильные кислоты | Слабые кислоты |
| 1. Серная 2. Азотная 3. Хлорноватая 4. Хлорная 5. Марганцовая 6. Хромовая 7. Хлороводородная 8. Бромоводородная 9. Иодоводородная | 1. Сернистая 2. Азотистая 3. Угольная 4. Сероводородная 5. Фтороводородная 6. Фосфорная 7. Кремниевая 8. Хлорноватистая 9. Хлористая 10. Борная |
Соли.
Соли – это производные кислот, в которых атомы водорода замещаются на металлы. То есть соль состоит из двух частей: металл и кислотный остаток.
Название соли складывается из названия кислотного остатка (аниона) и металла.
| Кислотный остаток (анион) | Называние аниона | Пример соли | Название соли |
| SO42- | Сульфат-ион | K2SO4 | Сульфат калия |
| SO32- | Сульфит-ион | K2SO3 | Сульфит калия |
| NO3– | Нитрат-ион | KNO3 | Нитрат калия |
| NO2– | Нитрит-ион | KNO2 | Нитрит калия |
| CO32- | Карбонат-ион | K2CO3 | Карбонат калия |
| PO43- | Ортофосфат-ион (Фосфат-ион) | K3PO4 | Ортофосфат (Фосфат) калия |
| BO33- | Борат-ион | K3BO3 | Борат калия |
| ClO– | Гипохлорит-ион | KClO | Гипохлорит калия |
| ClO2– | Хлорит-ион | KClO2 | Хлорит калия |
| ClO3– | Хлорат-ион | KClO3 | Хлорат калия |
| ClO4– | Перхлорат-ион | KClO4 | Перхлорат калия |
| MnO4– | Перманганат-ион | KMnO4 | Перманганат калия |
| CrO42- | Хромат-ион | K2CrO4 | Хромат калия |
| SiO32- | Силикат-ион | K2SiO3 | Силикат калия |
| F– | Фторид-ион | KF | Фторид калия |
| Cl– | Хлорид-ион | KCl | Хлорид калия |
| Br– | Бромид-ион | KBr | Бромид калия |
| I– | Иодид-ион | KI | Иодид калия |
| S2- | Сульфид-ион | K2S | Сульфид калия |
Сводная таблица кислот и их солей:
| Название кислоты | Формула | Формула кислотного остатка | Название кислотного остатка (и соли) | Формула кислотного оксида, который соответствует кислоте | Название кислотного оксида | Слабая? | Степень окисления элемента, образующего кислоту |
| Борная | H3BO3 | BO33- | борат | B2O3 | Оксид бора | Да | +3 |
| Азотная | HNO3 | NO3– | нитрат | N2O5 | Оксид азота (V) | +5 | |
| Азотистая | HNO2 | NO2– | нитрит | N2O3 | Оксид азота (III) | Да | +3 |
| Серная | H2SO4 | SO42- | сульфат | SO3 | Оксид серы (VI) – серный ангидрид | +6 | |
| Сернистая | H2SO3 | SO32- | сульфит | SO2 | Оксид серы (IV) – сернистый ангидрид, сернистый газ | Да | +4 |
| Фосфорная (ортофосфорная) | H3PO4 | PO43- | Фосфат (ортофосфат) | P2O5 | Оксид фосфора (V) | Да | +5 |
| Угольная | H2CO3 | CO32- | Карбонат | CO2 | Оксид углерода (IV), углекислый газ | Да | +4 |
| Хромовая | H2CrO4 | CrO42- | Хромат | CrO3 | Оксид хрома (Vl) | +6 | |
| Марганцевая | HMnO4 | MnO4– | Перманганат | Mn2O7 | Оксид марганца (VII) | +7 | |
| Хлорноватистая | HClO | ClO– | гипохлорит | Cl2O | Оксид хлора (I) | Да | +1 |
| Хлористая | HClO2 | HClO2– | хлорит | Cl2O3 | Оксид хлора (III) | Да | +3 |
| Хлорноватая | HClO3 | ClO3– | хлорат | Cl2O5 | Оксид хлора (V) | +5 | |
| Хлорная | HClO4 | ClO4– | перхлорат | Cl2O7 | Оксид хлора (Оксид хлора (VII) | +6 | |
| Кремниевая | H2SiO3 | SiO32- | Силикат | SiO2 | Оксид кремния (IV) | Да | +4 |
| Соляная (хлороводородная) | HCl | Cl– | хлорид | – | – | -1 | |
| Фтороводородная (плавиковая) | HF | F– | фторид | – | – | Да | -1 |
| Иодоводородная | HI | I– | Иодид | – | – | -1 | |
| Бромоводородная | HBr | Br– | бромид | – | – | -1 | |
| Сероводородная | H2S | S2- | сульфид | – | – | Да | -2 |
Проверь себя – пройди тестирование!
Тренажер по классификации неорганических веществ
Ограничение продолжительности: 0
Информация
You have already completed the quiz before. Hence you can not start it again.
Тест загружается…
Вам необходимо авторизоваться или подписаться на курс, чтобы пройти тест.
Чтобы пройти данный тест, Вы сначала должны закончить этот:
Quiz complete. Results are being recorded.
- Отмечено
- Просмотр
Видеоурок: Классы неорганических соединений
Лекция: Классификация неорганических веществ. Номенклатура неорганических веществ (тривиальная и международная)
Начнем с простого деления неорганических веществ на простые и сложные. Молекулы простых состоят из атомов одного элемента, а сложных из атомов нескольких элементов. Простые делятся на металлы и неметаллы. Сложные в свою очередь подразделены на оксиды, гидроксиды, соли.
 Оксиды
Оксиды
Оксиды — это сложные вещества, состоящие из двух элементов, один из которых кислород со степенью окисления -2.
Оксиды подразделяются на солеобразующие (основные, кислотные, амфотерные), несолеобразующие и солеобразные (двойные).
Основные оксиды обладают основными свойствами и способны образовать типичные металлы, имеющие степень окисления +1, +2, (Li2O, MgO, CaO, CuO).
Кислотные оксиды обладают кислотными свойствами и способны образовать неметаллы со степенью окисления более +2. Так же образуют металлы со степенью от +5 до +7 (SO 2, SeO2, P2O5, As2O3, CO2, SiO2, CrO3, и Mn2O7). Исключение: у оксидов NO2 и ClO2 нет соответствующих кислотных гидроксидов. Несмотря на это, их считают кислотными.
Амфортерные оксиды обладают и основными, и кислотными свойствами. Они образованы амфотерными металлами, имеющими степень окисления +2, +3, +4 (Cr2O3, Al2O3, GeO2, SnO2. В данной группе оксидов со степенью окисления +2 всего 4: ZnO, PbO, SnO, BeO.
Несолеобразующие оксиды не обладают ни основными, ни кислотными свойствами. К ним относятся оксиды неметаллов со степенью окисления +1, +2. Их всего 4: CO, NO, N2O, SiO.
Солеобразные оксиды образованы двумя элементами с разными степенями окисления. К примеру, магнитный железняк FeO·Fe2O3, который при взаимодействии с кислотами образует две соли: FeO·Fe2O3 + 4H2SO4 → FeSO4 + Fe2(SO4)3+ 4H2O
 Гидроксиды
Гидроксиды
Гидроксиды — это сложные вещества, состоящие из оксидов и воды, имеющие гидроксогруппу (OH—).
Они подразделяются на основания, кислородсодержащие кислоты и амфотерные гидроксиды.
- Основания – гидроксиды металлов со степенью окисления +1, +2, проявляющие основные свойства и состоящие из ионов металлов и гидроксид – ионов OH—.
К примеру:
- гидроксид натрия — Na+OH,
- гидроксид кальция — Ca +2(OH)2,
- гидроксид железа — Fe+3(OH)3.
Все основания – твердые вещества. Они делятся на растворимые (щелочи) и нерастворимые. О том, растворимо основание в воде или нет можно узнать из таблицы.
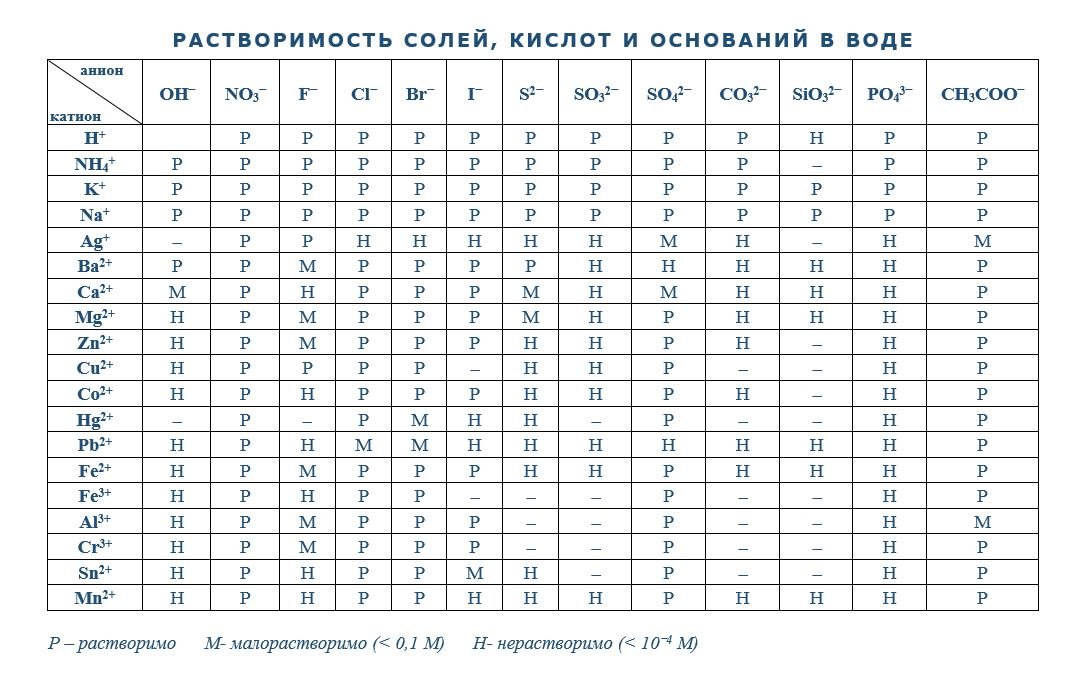
- Кислотные гидроксиды (кислородсодержащие кислоты) – гидроксиды неметаллов и металлов со степенью окисления +5, +6, проявляющие кислотные свойства, состоящие из гидроксоний – катионов Н3О+ и кислотного остатка.
К примеру:
- Азотная кислота — HNO3,
- Серная кислота — H2SO4.
- Амфотерные гидроксиды – гидроксиды металлов со степенью окисления +2, +3, +4, проявляющие и кислотные, и основные свойства. В данной группе гидроксидов со степенью окисления +2 всего 4: Zn(OН)2, Pb(OН)
 Соли
Соли
Соли — сложные химические вещества, образованные атомами металлов, связанных с кислотными остатками.
К примеру:
- Хлорид натрия — NaCl,
- Сульфат натрия — Na2SO4,
- Хлорид кальция — СаCl2,
- Сульфат кальция — СаSO4.
Существуют следующие виды солей:
Средние соли – соли, содержащие атомы металлов и кислотного остатка. К примеру: нитрат кальция Ca(NO3)2, сульфат свинца PbSO4, карбонат натрия Na2CO3 и др.
Кислые соли – соли, содержащие атомы металлов, кислотного остатка и водорода. Атомы металла образуются при нейтрализации основания избытком кислоты. Чтобы образовать название какой — либо кислой соли, необходимо к названию соли добавить приставку гидро — или дигидро -. Приставка зависит от числа атомов водорода, входящих в состав кислой соли. Пример: KHCO3 – гидрокарбонат калия, КH2PO4 – дигидроортофосфат калия. Так же необходимо помнить, что кислые соли способны образовывать две и более основные кислоты. Ими могут быть как кислородсодержащие, так и бескислородные кислоты.
Основные соли – соли, содержащие атомы металлов, кислотного остатка и гидроксогруппы (OH−). Чтобы определить название основной соли, необходимо к названию обычной соли добавить приставку гидроксо- или дигидроксо. Приставка будет зависеть от количества ОН — групп, входящих в состав соли. К примеру, (CuOH)2CO3 — гидроксокарбонат меди (II). Так же следует знать, что основные соли образуют основания, содержащие в составе две и более гидроксогрупп.
Двойные соли – соли, содержащие катионы двух металлов и кислотный остаток. К примеру, сульфат алюминия — калия KAl(SO
Смешанные соли – соли, содержащие анионы двух металлов и кислотный остаток. К примеру, дигидроксокарбонат меди (II) Cu2(OH)2CO3.
Гидратные соли – соли, содержащие молекулы кристаллизационной воды. К примеру, декагидрат сульфата натрия Na2SO4 •10H2O
 Номенклатура неорганических веществ
Номенклатура неорганических веществ Построение формул и названий определяются химической тривиальной и международной номенклатурой. Тривиальные названия – это исторически сложившиеся традиционные названия.
Формула | Тривиальные названия | Международные названия |
NaCl | Поваренная соль | Хлорид натрия |
NaOH | Едкий натр | Гидроксид натрия |
Na2CO3 | Сода, кальцинированная сода | Карбонат натрия |
NaHCO3 | Питьевая сода | Гидрокарбонат натрия |
Na2SiO3 | Жидкое стекло | Силикат натрия |
CaO | Негашеная известь | Оксид кальция |
Ca(OH)2 | Гашеная известь | Гидроксид кальция |
CaCO3 | Известняк, мел, мрамор | Карбонат кальция |
CaF2 | Флюорит | Фторид кальция |
С | Графит, алмаз | Углерод |
CO | Угарный газ | Монооксид углерода |
CO2 | Углекислый газ | Диоксид углерода |
KOH | Едкое кали | Гидроксид калия |
K2CO3 | Поташ | Карбонат калия |
KNO3 | Калийная селитра | Нитрат калия |
KClO3 | Бертолетова соль | Хлорат калия |
K4[Fe(CN)6] | Желтая кровяная соль | Гексацианоферрат (II) калия |
K3[Fe(CN)6] | Красная кровяная соль | Гексацианоферрат (III) калия |
MgO | Жженая магнезия Оксид магния | Оксид магния |
MgСO3 | Магнезит Карбонат магния | Карбонат магния |
Fe2O3 | Гематит | Оксид железа (III) |
FeS2 | Железный колчедан, пирит | Дисульфид железа |
Fe4[Fe(CN)6]3 | Берлинская лазурь | Гексацианоферрат (II) железа (III) |
FeSO4 • 7H2O | Железный купорос | Гептагидрат сульфата железа (II) |
Cu2S | Медный блеск | Сульфид меди (I) |
Cu2(OH)2CO3 | Малахит | Карбонат гидроксомеди (II) |
CuSO4 • 5H2O | Медный купорос | Пентагидрат сульфата меди (II) |
Возник вопрос по теме? Задавайте его репетитору по химии 👉 Джапарову Тамерлану
В неорганической химии вещества традиционно делят на простые и сложные.
Простые вещества — это вещества, молекулы которых состоят из атомов одного элемента (О2, P4).
Сложные вещества — это вещества, молекулы которых состоят из атомов двух и более элементов (CaO, H3PO4).
Сложные вещества делят на оксиды, гидроксиды, соли, прочие бинарные соединения.
Простые вещества делят на металлы и неметаллы.
Металлы — это элементы, которые в виде простых веществ обладают характерными металлическими свойствами (металлический блеск, высокая электро- и теплопроводность, пластичность и др.).
Неметаллы — это элементы, которые в виде простых веществ проявляют характерные неметаллические свойства.
Неметаллы занимают правый верхний угол таблицы химических элементов (главные подгруппы). К металлам относятся все остальные элементы (включая элементы побочных подгрупп). Разделяют металлы и неметаллы обычно, проводя условную линию от бериллия до астата. На рисунке показано точное разделение на металлы и неметаллы. Зеленым цветом отмечены металлы, желтым цветом — неметаллы, розовым цветом отмечены амфотерные металлы, и фиолетовым — благородные (инертные) газы, которые химически мало или неактивны, и в школьном курсе химии практически не рассматриваются.
Оксиды — это сложные вещества, состоящие из атомов двух элементов, один из которых — кислород со степенью окисления -2. При этом кислород связан только с менее электроотрицательным элементом.
В зависимости от второго элемента оксиды проявляют разные химические свойства. В школьном курсе оксиды традиционно делят на солеобразующие и несолеобразующие. Некоторые оксиды относят к солеобразным (двойным).
Двойные оксиды — это некоторые оксиды , образованные элементом с разными степенями окисления. Например, магнетит (магнитный железняк) FeO·Fe2O3.
Солеобразующие оксиды делят на основные, амфотерные и кислотные.
Основные оксиды — это оксиды, обладающие характерными основными свойствами. К ним относят оксиды, образованные атомами металлов со степенью окисления +1 и +2. Например, оксид лития Li2O, оксид железа (II) FeO.
Кислотные оксиды — это оксиды, характеризующиеся кислотными свойствами. К ним относят оксиды, образованные атомами металлов со степенью окисления +5, +6 и +7, а также атомами неметаллов с любой степенью окисления. Например, оксид хлора (I) Cl2O, оксид хрома (VI) CrO3.
Амфотерные оксиды — это оксиды, характеризующиеся и основными, и кислотными свойствами. Это оксиды металлов со степенью окисления +3 и +4, а также четыре оксида со степенью окисления +2: ZnO, PbO, SnO и BeO.
Несолеобразующие оксиды не проявляют характерных основных или кислотных свойств, им не соответствуют гидроксиды. К несолеобразующим относят четыре оксида: CO, NO, N2O и SiO.
Классификация оксидов
Алгоритм определения типа оксида: сначала определяем, какой элемент образует оксид — металл или неметалл. Если это металл, то определяем степень окисления, затем определяем тип оксида. Если это неметалл, то оксид кислотный (если это не исключение).
Каждому солеобразующему оксиду соответствует гидроксид:
основному оксиду соответствует гидроксид основание,
кислотному оксиду соответствует гидроксид кислота,
амфотерному оксиду соответствует амфотерный гидроксид.
Например, оксид хрома (II) CrO- основный, ему соответствует гидроксид основание. Формулу гидроксида легко получить, просто добавив к металлу гидроксидную группу OH. Получаем: Cr(OH)2. Оксид хрома (III) -Cr2O3 — амфотерный, ему соответствует амфотерный гидроксид, который, в зависимости от реакции, может выступать и как основание, и как кислота: Cr(OH)3 = HCrO2. Формулу кислоты выводим, просто добавляя к формуле оксида воду: Cr2O3+H2O = H2Cr2O4, и делим все индексы в формуле на 2, если он не равен 1: HCrO2. Данной кислоте соответствует кислотный остаток хромит-ион CrO2—. Оксид хрома (VI) — кислотный, ему соответствует гидроксид кислота H2CrO4, и кислотный остаток хромат-ион CrO42-.
Гидроксиды — это сложные вещества, в составе которых есть группа Э-O-H. К гидроксидам относятся основания, амфотерные гидроксиды, и кислородсодержащие кислоты.
Взаимосвязь оксидов и гидроксидов:
Основания (основные гидроксиды) — это сложные вещества, которые при диссоциации в водных растворах в качестве анионов (отрицательных ионов) образуют только гидроксид-ионы OH—.
Основания делят на растворимые в воде (щелочи), нерастворимые основания и разлагающиеся в воде.
* к щелочам также относится гидроксид таллия (I). Водный раствор этого соединения имеет явно выраженный щелочной характер.
К разлагающимся в воде (неустойчивым) основаниям относят гидроксид аммония, гидроксид серебра (I), гидроксид меди (I). В водном растворе такие соединения практически необратимо распадаются:
NH4OH = NH3 + H2O
2AgOH = Ag2O + H2O
2CuOH = Cu2O + H2O
Также основания делят по числу гидроксидных групп на однокислотные (например NaOH), двухкислотные (например Ca(OH)2) и трехкислотные, (например Fe(OH)3).
Кислоты — сложные вещества, которые при диссоциации в водных растворах образуют в качестве катионов только ионы гидроксония H3O+(H+).
По числу кислых атомов водорода кислоты разделяют на одноосновные (HNO3), двухосновные (H2SO4), трехосновные (H3PO4) и т.д.
По содержанию атомов кислорода кислоты делят на бескислородные (например, соляная кислота HCl) и кислородсодержащие (например, серная кислота H2SO4).
Наибоее полезна в школьном курсе классификация кислот по силе и устойчивости. По силе и устойчивости кислоты делят на:
Сильные кислоты. К ним относятся:
- бескислородные кислоты: HCl, HBr, HI. Остальные бескислородные кислоты, которые встречаются в школьном курсе, как правило, слабые.
- некоторые высшие кислородсодержащие кислоты: H2SO4, HNO3, HClO4 и др.
Слабые кислоты. К ним относятся:
- Слабые и растворимые кислоты: это H3PO4, CH3COOH, HF и др.
- Летучие или неустойчивые кислоты: H2S — считаем в реакциях, что это газ; H2CO3 — распадается в реакциях на воду и оксид: H2CO3=Н2О + СО2↑; H2SO3 — распадается на воду и оксид: H2SO3=H2O+ SО2↑.
- Нерастворимые в воде кислоты: H2SiO3, H3BO3 и некоторые другие.
Интересный метод для быстрого определения силы кислоты по числу атомов водорода и кислорода в молекуле кислоты. Вычитаем из числа атомов O в молекуле число атомов H. Если получаем число 2 или 3, то кислота сильная. Если 1 или 0 — то кислота слабая.
Соли – сложные вещества, состоящие из катиона металла (или иона аммония NH4+) и аниона кислотного остатка. Также солями называют вещества, которые могут быть получены при взаимодействии кислот и оснований с выделением воды.
Если рассматривать соли, как продукты взаимодействия кислоты и основания, то соли делят на средние, кислые и основные.
Средние соли – продукты полного замещения катионов водорода в кислоте на катионы металла (например, Na2CO3, K3PO4).
Кислые соли – продукты неполного замещения катионов водорода в кислоте на катионы металлов (например, NaHCO3, K2HPO4).
Основные соли – продукты неполного замещения гидроксогрупп основания на анионы кислотных остатков кислоты (например, малахит (CuOH)2CO3).
По числу катионов и анионов соли разделяют на:
Простые соли – состоящие из катиона одного типа и аниона одного типа (например, хлорид кальция CaCl2).
Двойные соли – это соли, состоящие из двух или более разных катионов и аниона одного типа (например, алюмокалиевые квасцы – KAl(SO4)2).
Смешанные соли – это соли, состоящие из катиона одного типа и двух или более анионов разного типа (например, хлорид-гипохлорит кальция Ca(OCl)Cl).
По структурным особенностям выделяют также гидратные соли и комплексные соли.
Гидратные соли (кристаллогидраты) – это такие соли, в состав которых входят молекулы кристаллизационной воды (например, декагидрат сульфата натрия Na2SO4·10 H2O).
Комплексные соли – это соли, содержащие комплексный катион или комплексный анион (K3[Fe(CN)6], [Cu(NH3)4](OH)2).
Водородные соединения – это сложные вещества, состоящие из двух элементов, один из которых водород. Водородные соединения разделяют на солеобразные гидриды и летучие водородные соединения.
Солеобразные гидриды ЭНх – это соединения металлов IA, IIA групп и алюминия с водородом. Степень окисления водорода равна -1. Например, гидрид натрия NaH.
Летучие водородные соединения НхЭ – это соединения неметаллов с водородом. Степень окисления водорода равна +1. Например, аммиак NH3, фосфин PH3.
ВЕщЕСТВА
ПРОСТЫЕ
Металлы
Неметаллы
СЛОЖНЫЕ
Оксиды ЭхОу
Основный МехОу (В (Ме) = I,II)
Амфотерный МехОу (В (Ме) = III, IV)
КислотныеНемхОу, МехОу (В (Ме) > IV)
ОснованияМе(ОН)n
Щелочи
Нерастворимые
Кислоты HnR
Соли
Бескислородные
Кислородсодержащие
Средние
Кислые
Основные
МехRу
солями.
1
— сложные вещества, состоящие из двух химических элементов,
один из которых кислород со степенью окисления -2.
Оксиды
2 Сложные вещества,
состоящие из катионов водорода и аниона
кислотами.
3
Кислоты
Оксиды
Соли
…………
……….
Кислоты
Соли
Основания
Оксиды
Основания
кислотного остатка называются
Сложные вещества,
состоящие из катионов металла и анионов
кислотного остатка называются
……….
Соли
Кислоты
Оксиды
Основания
Неорганические вещества
Простые
Сложные
Простые вещества
Металлы
Неметаллы
Металлы
Au
Cu
Pt
Hg
Mg
Pb
Неметаллы
Графит
Кремний алмазоподобный
Мышьяк
Селен
Сера
Азот
Сложные вещества
Оксиды
Кислоты
Соли
Основания
Оксиды ЭхОу
Выпишите формулы оксидов
Оксиды ЭхОу
Основный МехОу (В (Ме) = I,II)
Амфотерный МехОу (В (Ме) = III, IV)
КислотныеНемхОу, МехОу (В (Ме) > IV)
несолеобразующие
кислотные
амфотерные
основные
CO2
FeO
Al2O3
N2O
BeO
CaO
SO2
NO
P2O5
Na2O
ZnO
CO
Назовите оксиды, определите их ХИМИЧЕСКИЙ характер И ОПИШИТЕ ФИЗИЧЕСКИЕ СВОЙСТВА
CаO
CuO
HgO
PbO
PbO2
Al2O3
Fe2O3
Cr2O3
SiO2
P2O5
Формула оксида
Название оксида
Химический характер
СаО
Оксид кальция
Основный
Fe2O3
Оксид железа (III)
Амфотерный
P2O5
Оксид фосфора(V)
Кислотный
HgO
Оксид ртути (II)
Основный
SiO2
Оксид кремния(IV)
Кислотный
Cr2O3
Оксид хрома (III)
Амфотерный
СuО
Оксид меди (II)
Основный
Аl2O3
Оксид алюминия
Амфотерный
Заполни таблицу: «Номенклатура и характер оксидов»
Составьте формулы оксидов, образующих следующие минералы. Определите их химический характер.
Изумруд –оксиды бериллия, алюминия, кремния
Разновидности оксида алюминия
Рубин
Корунд
Пиролюзит –оксид марганца(IV)
Горный хрусталь – оксид кремния
Оксид → Гидроксид
Основный оксид ↓основание
Амфотерный оксид ↓Амфотерный гидроксид
CаO
Са(ОН)2
Кислотный оксид ↓Кислота
+Н2О
+Н2О
SO3
Формула оксида
Название оксида
Формула соответствующего гидроксида
Название соответствующего гидроксида
Основные оксиды
Щелочи
Na2OК2О
Оксид натрияОксид калия
NaOНКОН
Гидроксид натрия Гидроксид калия
Нерастворимые основания
CrO
FeO
Оксид хрома(II) Оксид железа(II)
Cr(OН)2Fe(OН)2
Гидроксид хрома(II) Гидроксид железа(II)
Амфотерные оксиды
Амфотерные оксиды
ZnO
Al2O3
Оксид цинка Оксид алюминия
Zn(OН)2Al(OH)3
Гидроксид цинка Гидроксид алюминия
Кислотные оксиды
Кислородсодержащие кислоты
СrO3SO3N2O5
Оксид хрома(VI) Оксид серы (VI) Оксид азота(V)
Н2СrO4 Н2SO4 НNO3
Хромовая килотаСерная кислотаАзотная кислота
ОснованияМе(ОН)n
Растворимые –ЩЕЛОЧИ
Нерастворимые
Верно!
Ошибка!
Ошибка!
Верно!
Ошибка!
Верно!
Верно!
Ошибка!
Верно!
Ошибка!
Верно!
Верно!
Ошибка
Верно!
Ошибка!
Верно!
N O
КОН
Ca (OH)2
Cr2 O 3
Вa(OН)2
h3 SO4
Fe(OH) 3
NaOH
h4 PO4
h3Si O3
Al(OН)3
Mg SO4
С u(OH)2
Cr(OH) 2
h3 СrO4
LiOH
НАЙДИТЕ ФОРМУЛЫ ОСНОВАНИЙ
Щелочи
Гидроксид калия –едкий кали
Гидроксид кальция –гашеная известь
Индикатор
Окраска
Лакмус
Метилоранж
Фенолфталеин
Гидроксид натрия –едкий натр — каустик
Кислоты
Индикатор
Окраска
Лакмус
Метилоранж
Фенолфталеин
Фосфорная кислота
Кислотные оксиды, соответствующие им кислоты и кислотные остатки
Кислотный оксид
Кислота
Кислотный остаток
CO2
N2O3
N2O5
SiO2
P2O5
SO2
SO3
CrO3
Cl2O7
Mn2O7
h3CO3 — угольнаяHNO2 – азотистаяHNO3 — азотнаяh3SiO3 — кремниваяHPO3 — метафосфорнаяh4PO4 — ортофосфорнаяh3SO3 — сернистаяh3SO4 — сернаяh3CrO4 — хромоваяHClO4 — хлорнаяHMnO4 — марганцовая
=CO3 — карбонат — NO2 — нитрит — NO3 — нитрат = SiO3 — силикат — PO3 — метафосфат Ξ PO4 — ортофосфат = SO3 — сульфит = SO4 — сульфат = CrO4 — хромат — ClO4 — хлорат — MnO4 — перманганат
Верно!
Ошибка!
Ошибка!
Верно!
Ошибка!
Верно!
Верно!
Ошибка!
Верно!
Ошибка!
Верно!
Верно!
Ошибка
Ошибка
Ошибка!
Верно!
N O
HCl
Ca (OH)2
Cr2 O 3
ВaSO4
h3 SO4
Н2СО3
NaСl
Na3 PO4
h3Si O3
Al(OН)3
Mg SO4
HNO3
Н3РО4
h3 СrO4
HBr
НАЙДИТЕ ФОРМУЛЫ КИСЛОТ И НАЗОВИТЕ ИХ
Соли
Средние
Кислые
Основные
Двойные
Na3PO4Фосфат натрияK2SO4Сульфат калия
Nah3PO4 Дигидрофосфат натрияKHSO4Гидросульфат калия
Mg(OH)ClГидроксохлорид магния(CuOH)2CO3Гидроксокарбонат меди (II)
K2NaPO4Калий-натрий фосфотKAl(SO4)2Калий-алюминий сульфат
Доломит –магний-кальций карбонат
Магнезит-карбонат магния
Малахит –гидроксокарбонат меди
Сульфат калия
Пирит – дисульфид железа(II)
Нитрат серебра
Киноварь –сульфид ртути
Составить формулы следующих солей
Оксиды
Основания
Кислоты
Соли
сложные вещества, состоящие из двух элементов, один из которых кислород
сложные вещества, состоящие из ионов металлов связанных с одним или несколькими гидроксид-ионами
сложные вещества, молекулы которых состоят из атомов водорода и кислотных остатков
сложные вещества, состоящие из ионов металлов и кислотных остатков
назад
Оксиды
Основания
Кислоты
Соли
Слово «оксид»
Элемент(род. падеж)
Центральный элемент + окончание поколичеству кислорода
Кислотный остаток
Элемент(род. падеж)
Слово «гидроксид»
Кислота
Металл(род. падеж)
=
=
=
=
+
+
+
+
Установите соответствие между классом веществ и формулой.
1) Основания
2) Кислоты
3) Оксиды
4) Соли
Класс
Вещества
А) HCL
Б) NaCl
В) Н2O2
1
2
3
4
Б
В
Б
А
Ошибка
А) NaOH
А) KNO3
А) SO3
Б) KOH
Б) OF2
Б) NaOH
В) Na2O
В) НNO3
В) CaO
Ошибка
Ошибка
Ошибка
5
4
3
1
2
8
10
6
7
9
Na+ и I-
Ca2+ и Cl-
Al3+ и Br —
Na+ и S2-
Ca2+ и P3-
K+ и NO3-
Ca2+ и OH-
K+ и OH-
Ba2+ и NO3-
Al3+ и OH-
Na2O
оксиды
кислоты
основания
соли
CaO
Fe2O3
Al(OH)3
KOH
Al2(SO4)3
Fe(OH)2
KF
Cu(NO3)2
ZnO
h3SO4
N2O5
FeSO3
Na2CO3
NaOH
Cu(OH)2
h3SO3
HNO3
HF
проверка
проверка
проверка
проверка
?
h3CO3
Дать названия веществам
назад
Химические свойства оксидов
Основный оксид+Н2О → щелочь+ кислотный оксид → соль+ кислота → соль + Н2О + Н2 → Ме + Н2О
Кислотный оксид+Н2О → кислота+ основный оксид → соль+ щелочь → соль + Н2О
Химические свойства оснований
Щелочи
Нерастворимые основания
1. Окраска индикаторов:
Изменяют окраску
Не изменяют окраску
2. Отношение к нагреванию:
Устойчивы
РазлагаютсяМе(ОН)n → МехОу +Н2О
3. Отношение к кислотам: взаимодействуют – реакция нейтрализации Ме(ОН)n + НnR → МехRу + Н2О
4. Отношение к кислотным оксидам: взаимодействуют → соль + Н2О
быстро
медленно
5. Отношение к растворам солей:
Если один из продуктов — осадок
Реакция не идет
Химические свойства кислот
1. Окраска индикаторов:
Изменяют окраску
2. Взаимодействие с металлами,стоящим в ряду напряжения до водорода:
4. Взаимодействие с основаниями – реакция нейтрализации Ме(ОН)n + НnR → МехRу + Н2О
3. Взаимодействие с основными оксидами:Кислота + основный оксид → соль + Н2О
5. Взаимодействие с растворами солей: Соль1 + кислота1 → соль2 + кислота2 (↑↓)
Ме + НnR → МехRу + Н2↑
Закончите уравнения реакций:
а) Na2O + СО2 →…; б) MgO + HCl → … ; в) K2O + h4PO4 → … ;г) NaOH + CO2 → … ;д) КOH + SO3 → … .
Ушакова Наталья Валерьевна
Формула основного оксида
Вопрос 1
Вопрос 2
Вопрос 3
Вопрос 4
Вопрос 5
Вопрос 6
Вопрос 7
Вопрос 8
Вопрос 9
Вопрос 10
CaO
А
SO3
В
h3O
Г
NO
Б
Ушакова Наталья Валерьевна
Формула кислоты
Mg(OH)2
А
h4PO4
В
CaO
Б
NaNO3
Г
Ушакова Наталья Валерьевна
Формула соли
Na2SO4
А
NaOH
В
HCl
Б
Na2O
Г
Ушакова Наталья Валерьевна
Какое из перечисленных утверждений не характерно для щелочей
основания, растворимые в воде
А
взаимодействуют с основными оксидами
Б
изменяют окраску фенолфталеина
В
взаимодействуют с кислотными оксидами
Г
Ушакова Наталья Валерьевна
Формула основания
Na2SO4
А
Li2O
В
h3SO4
Б
NaOH
Г
Ушакова Наталья Валерьевна
Формула кислотного оксида
K2O
А
P2O5
В
HCl
Б
BaO
Г
Ушакова Наталья Валерьевна
Оксиды, взаимодействующие между собой
SiO2 и h3O
А
CaO и MgO
В
Li2O и h3O
Б
ZnO и h3O
Г
Ушакова Наталья Валерьевна
В 200 г раствора с массовой долей соли – 0,1 содержится …грамм соли
100 г
А
20 г
Б
0,05 г
В
10 г
Г
Ушакова Наталья Валерьевна
Среди уравнений реакции получения солей, реакция замещения
2Na +Cl2=2NaCl
А
KOH +HCl=KCl+h3O
В
CaO+2HCl=CaCl2+h3O
Б
Zn +2HCl=ZnCl2+h3O
Г
Ушакова Наталья Валерьевна
С оксидом углерода (IV) взаимодействует
SO3
А
NaOH
В
P2O5
Б
HCl
Г
Ушакова Наталья Валерьевна
+
—
+
+
+
+
+
+
+
+
+
—
—
—
—
—
—
—
—
—
Впишите формулы оксидов указанных элементов в соответствующие клетки (по стрелкам).
Впишите формулы оснований и кислот указанных оксидов в соответствующие клетки (по стрелкам).
Тема урока №7.: «Классификация неорганических соединений и их свойства».
Цель урока: знать классификацию неорганических веществ, определение оксидов, оснований, кислот, солей; состав и химические свойства данных классов неорганических соединений; уметь по составу и свойствам классифицировать неорганические вещества; составлять генетические ряды металлов и неметаллов, иллюстрировать уравнениями химических реакций генетическую связь между их членами;
Задачи урока: углубление, систематизация и обобщение знаний студентов об основных классах неорганических соединений как о самостоятельном классе неорганических соединений и их химических свойствах в свете теории электролитической диссоциации.
Обучающие: дать понятие о кислотах, основаниях, солях как классе электролитов, изучить классификацию кислот, оснований, солей, их номенклатуру, научить записывать уравнения диссоциации кислот, оснований, солей, изучить общие химические свойства кислот, оснований, солей в свете ионных представлений;
Развивающие: продолжить развивать умения и навыки в решении проблемных ситуаций, строить гипотезы, находить пути их решения; участвовать в дискуссии и высказывать свое мнение;
Воспитывающие: формировать умение выслушать своего собеседника.
Оборудование: компьютер, мультимедиа проектор, экран, презентация.
Метод обучения: информационно-развивающий (работа с электронной версией учебного материала, работа с тетрадями и таблицей, самостоятельная работа.
Наглядные пособия: таблица растворимости.
Ход урока:
Организационный момент.
Повторение пройденного материала.
Отдельные студенты получают карточки с заданиями (или тест).
Проверка тетрадей с д/з – сдать после урока выборочно.
Фронтальный опрос:
1. Почему в горячем чае кусочек сахара растворяется быстрее, чем в холодном?
2. Приведите примеры хорошо растворимых, малорастворимых и практически нерастворимых в воде веществ различных классов, пользуясь таблицей растворимости.
3. Почему аквариумы нельзя заполнять быстро охлажденной прокипяченной водой (они должна постоять несколько дней)?
4. Почему ранки, промытые водой, в которую были помещены серебряные изделия, заживают быстрее?
5. Какие вещества относят к электролитам, а какие — к неэлектролитам?
6. Какие из следующих жидкостей проводит электрический ток: этиловый спирт, водный раствор глюкозы, водный раствор натрия, раствор кислорода в воде, водный раствор карбоната натрия, расплав гидроксида калия? Ответ объясните.
Изучение нового материала.
Самая простая классификация заключается в том. что все известные вещества делят на неорганические и органические.
К органическим веществам относят углеводороды и их производные. Все остальные вещества — неорганические.
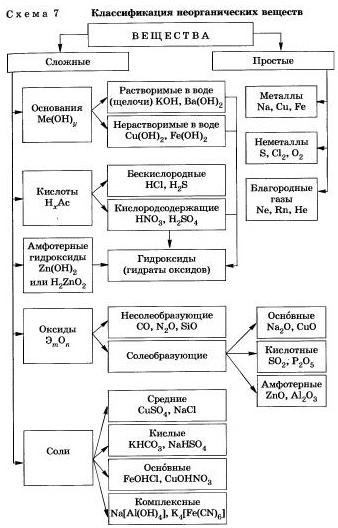
Классификация неорганических веществ
Неорганические вещества по составу делят на простые и сложные.
Простые вещества состоят из атомов одного химического элемента и подразделяются на металлы, неметаллы, благородные газы. Сложные вещества состоят из атомов разных элементов, химически связанных друг с другом.
Сложные неорганические вещества по составу и свойствам распределяют по следующим важнейшим классам: оксиды, основания, кислоты, амфотерные гндроксиды, соли.
Оксиды — это сложные вещества, состоящие из двух химических элементов, один из которых — кислород со степенью окисления (—2),
Общая формула оксидов: ЭmОn, где m — число атомов элемента Э, а n — число атомов кислорода. Оксиды, в свою очередь, классифицируют на солеобразующие и несолеобрадующие. Солеобразующие делятся на основные, амфотерные, кислотные, которым соответствуют основания, амфотерные гидроксиды, кислоты соответственно.
Основания — это сложные вещества, состоящие из атомов металла и одной или нескольких гидроксогрупп (-ОН).
Общая формула оснований: М(ОНу, где у — число гидроксогрупп, равное степени окислении металла М (как правило, +1 и +2).
Основания делятся на растворимые (щелочи) и нерастворимые (подробнее в § 21).
Кислоты — это сложные вещества, состоящие из атомов водорода, способных замещаться на атомы металла, и кислотных остатков.
Общая формула кислот: НхАс, где Ас — кислотный остаток (от английского «acid» — кислота), х — число атомов водорода, равное заряду иона кислотного остатка (подробнее см. § 20).
Амфотерные гидроксиды — это сложные вещества, которые проявляют и свойства кислот, и свойства оснований. Поэтому формулы амфотерных гидроксидов можно записывать и в форме кислот, и в форме оснований (см. также § 22).
Соли — это сложные вещества, состоящие из катионов металла и анионов кислотных остатков.
Такое определение относится к средним солям.
Средние соли — это продукты полного замещения ато мое водорода в молекуле кислоты атомами металла или полного замещения гидроксогрупп в молекуле основания кислотными остатками.
Кислые соли — это продукты неполного замещения атомов водорода в молекулах мноеоосновных кислот атомами металла.
Основные соли — это продукты неполно/о замещения гидрокеогрупп в многокислотных основаниях кислотны ми остатками.
Классификация неорганических соединений и их свойства.
ТЕМА урока №7.
ЦЕЛЬ
Актуализировать знания о важнейших классах неорганических соединений и их свойствах. Провести вводный инструктаж о правилах поведения в кабинете химии.
СОДЕРЖАНИЕ
Вводный инструктаж по ТБ. Свойства важнейших классов неорганических соединений в свете теории электролитической диссоциации.
ОБОРУДОВАНИЕ
Правила ТБ. ПСХЭ. Таблица растворимости. Таблица «Основные химические свойства неорганических соединений».
ДОМ. ЗАДАНИЕ
Классификация неорганических соединений. Химические свойства основных классов неорганических соединений в свете ТЭД.
ПЛАН УРОКА.
I. Вводная беседа.
· Правила поведения в кабинете химии. Поведение при возникновении возгорания. Инструктаж по ТБ.
· Учебник, его структура и правила пользования.
· Необходимое обеспечение учебного процесса: рабочая тетрадь, тетради для практических и контрольных работ; правила оформления записей в тетрадях.
II. Актуализация знаний.
1. Классификация неорганических соединений.
Формы существования ХЭ:
свободные атомы, простые вещества (металлы, неметаллы), сложные вещества (оксиды – основные, кислотные, амфотерные, гидроксиды – основания, кислородсодержащие кислоты, амфотерные гидроксиды, бескислородные кислоты, соли).
2. Номенклатура основных классов неорганических соединений.
Номенклатура оксидов, оснований, кислот, солей.
3. Составление формул оксидов, солей, оснований по названию.
Молекула в целом электронейтральна. Суммарный заряд «+» и «-« ионов, входящих в состав молекулы = «0». Индекс.
4. Химические свойства основных классов неорганических соединений.
И неэлектролиты. Условия протекания реакций между электролитами. Беседа по таблице «Основные химические свойства неорганических соединений».
III. Совершенствование умений и навыков.
Осуществить превращения:
Ca → CaO → Ca(OH)2 → CaCl2
P → P2O5 → H3PO4 → K3PO4
Zn → ZnO → ZnSO4 → Zn(OH)2 → ZnCl2→ Na2ZnO2
IY. Домашнее задание (инструктаж).
Классификация неорганических соединений. Химические свойства основных классов неорганических соединений в свете ТЭД.
Химическое соединение , любое вещество, состоящее из идентичных молекул, состоящих из атомов двух или более химических элементов.
молекула метана Метан, в котором четыре атома водорода связаны с одним атомом углерода, является примером основного химического соединения. На структуру химических соединений влияют сложные факторы, такие как углы связи и длина связи. Encyclopædia Britannica, Inc.Британика Викторина
входов и выходов из химии
Что из этого не является редкоземельным элементом?
Вся материя во вселенной состоит из атомов более 100 различных химических элементов, которые содержатся как в чистом виде, так и в химических соединениях.Образец любого данного чистого элемента состоит только из атомов, характерных для этого элемента, и атомы каждого элемента являются уникальными. Например, атомы, составляющие углерод, отличаются от атомов, составляющих железо, которые, в свою очередь, отличаются от атомов золота. Каждый элемент обозначается уникальным символом, состоящим из одной, двух или трех букв, возникающих из имени текущего элемента или его оригинального (часто латинского) имени. Например, символы для углерода, водорода и кислорода — это просто C, H и O соответственно.Символом железа является Fe, от его первоначального латинского названия Ferrum . Фундаментальный принцип науки о химии состоит в том, что атомы различных элементов могут соединяться друг с другом, образуя химические соединения. Например, известно, что метан, который образуется из элементов углерода и водорода в соотношении четыре атома водорода для каждого атома углерода, содержит различные молекулы CH 4 . Формула соединения, такая как CH 4 , указывает на типы присутствующих атомов с индексами, представляющими относительные числа атомов (хотя цифра 1 никогда не пишется).
молекула воды Молекула воды состоит из двух атомов водорода и одного атома кислорода. Один атом кислорода содержит шесть электронов в своей внешней оболочке, которая может содержать в общей сложности восемь электронов. Когда два атома водорода связаны с атомом кислорода, внешняя электронная оболочка кислорода заполняется. Encyclopædia Britannica, Inc.- Исследовать магнитоподобную ионную связь, образующуюся при переносе электронов от одного атома к другому Ионы — атомы с положительным или отрицательным суммарным зарядом — связываются вместе, образуя ионные соединения. Encyclopædia Britannica, Inc. Просмотреть все видео на эту статью
- См. Молекулярные связи в работе, когда два атома водорода соединяются с атомом серы, образуя сероводород Молекулярные соединения образуются, когда молекулы, такие как метан или вода, присоединяются вместе, делясь электронами. Encyclopædia Britannica, Inc. Просмотреть все видео этой статьи
Вода, которая представляет собой химическое соединение водорода и кислорода в соотношении два атома водорода на каждый атом кислорода, содержит молекулы H 2 О.Хлорид натрия представляет собой химическое соединение, образованное из натрия (Na) и хлора (Cl) в соотношении 1: 1. Хотя формула для хлорида натрия — NaCl, соединение не содержит фактических молекул NaCl. Скорее, он содержит одинаковое количество ионов натрия с зарядом положительного (Na + ) и хлорид-ионов с зарядом отрицательного (Cl — ). ( См. Ниже Тенденции в химических свойствах элементов для обсуждения процесса превращения незаряженных атомов в ионы [i.виды с положительным или отрицательным суммарным зарядом].) Упомянутые выше вещества служат примером двух основных типов химических соединений: молекулярного (ковалентного) и ионного. Метан и вода состоят из молекул; то есть они являются молекулярными соединениями. Хлорид натрия, с другой стороны, содержит ионы; это ионное соединение.
Атомы различных химических элементов можно сравнить с буквами алфавита: точно так же, как буквы алфавита объединяются в тысячи слов, атомы элементов могут объединяться различными способами, образуя множество соединений. ,На самом деле известны миллионы химических соединений, и возможно еще много миллионов, но они еще не были открыты или синтезированы. Большинство веществ, встречающихся в природе, таких как дерево, почва и камни, представляют собой смеси химических соединений. Эти вещества могут быть разделены на составляющие их соединения физическими методами, которые не изменяют способ агрегации атомов в соединениях. В результате химических изменений соединения могут быть разбиты на составляющие их элементы.Химическое изменение (то есть химическая реакция) — это то, в котором изменяется организация атомов. Примером химической реакции является сжигание метана в присутствии молекулярного кислорода (O 2 ) с образованием диоксида углерода (CO 2 ) и воды. CH 4 + 2O 2 → CO 2 + 2H 2 O В этой реакции, которая является примером реакции горения, происходят изменения в способе, которым атомы углерода, водорода и кислорода связаны друг с другом в соединениях.
Получите эксклюзивный доступ к контенту из нашего первого издания 1768 года с вашей подпиской. Подпишитесь сегодняХимические соединения показывают удивительный набор характеристик. При обычных температурах и давлениях некоторые являются твердыми веществами, некоторые являются жидкостями, а некоторые являются газами. Цвета различных соединений охватывают цвета радуги. Некоторые соединения очень токсичны для человека, тогда как другие необходимы для жизни. Замена только одного атома в соединении может быть причиной изменения цвета, запаха или токсичности вещества.Для того, чтобы из этого большого разнообразия можно было разобраться, были разработаны системы классификации. Приведенный выше пример классифицирует соединения как молекулярные или ионные. Соединения также классифицируются как органические или неорганические. Органические соединения ( см. Ниже Органические соединения), так называемые, потому что многие из них были первоначально выделены из живых организмов, обычно содержат цепочки или кольца из атомов углерода. Из-за большого разнообразия способов, которыми углерод может связываться с собой и другими элементами, существует более девяти миллионов органических соединений.Соединения, которые не считаются органическими, называют неорганическими соединениями ( см. Ниже Неорганические соединения).
ртути (Hg) ртути (химический символ: Hg) является единственным металлическим элементом, который является жидким при комнатной температуре. © marcel / FotoliaВ рамках широкой классификации органических и неорганических веществ существует множество подклассов, главным образом основанных на конкретных элементах или группах элементов, которые присутствуют. Например, среди неорганических соединений оксиды содержат ионы или атомы кислорода O 2 , гидриды содержат ионы или атомы водорода H — , сульфиды содержат ионы S 2 и так далее.Подклассы органических соединений включают спирты (которые содержат группу -OH), карбоновые кислоты (характеризуемые группой -COOH), амины (которые имеют группу -NH 2 ) и так далее.
Различные способности различных атомов объединяться в соединения могут лучше всего быть поняты с точки зрения периодической таблицы. Периодическая таблица была первоначально построена для представления закономерностей, наблюдаемых в химических свойствах элементов ( см. химическая связь).То есть, по мере развития науки о химии было замечено, что элементы могут быть сгруппированы в соответствии с их химической реактивностью. Элементы с похожими свойствами перечислены в вертикальных столбцах периодической таблицы и называются группами. Когда были раскрыты детали строения атома, стало ясно, что положение элемента в периодической таблице коррелирует с расположением электронов, которыми обладают атомы этого элемента ( см. атомов). В частности, было замечено, что электроны, которые определяют химическое поведение атома, являются электронами в его внешней оболочке.Такие электроны называются валентными электронами.
периодическая таблица Периодическая таблица элементов. Encyclopædia Britannica, Inc.Например, все атомы элементов в группе 1 периодической таблицы имеют один валентный электрон, атомы элементов в группе 2 имеют два валентных электрона и так далее, пока группа 18, чьи элементы содержат восемь валентных электронов, достигается. Самое простое и наиболее важное правило для предсказания того, как атомы образуют соединения, состоит в том, что атомы имеют тенденцию объединяться таким образом, чтобы они могли либо опустошить свою валентную оболочку, либо завершить ее (т.е.заполнить его), в большинстве случаев всего восемь электронов. Элементы в левой части периодической таблицы имеют тенденцию терять свои валентные электроны в химических реакциях. Например, натрий (в группе 1) имеет тенденцию терять свой одиночный валентный электрон, образуя ион с зарядом +1. Каждый атом натрия имеет 11 электронов ( e — ), каждый с зарядом -1, чтобы просто уравновесить заряд +11 на его ядре. Потеря одного электрона оставляет 10 отрицательных зарядов и 11 положительных зарядов, чтобы получить чистый заряд +1: Na → Na + + e — .Калий, расположенный непосредственно под натрием в группе 1, также образует +1 ионов (K + ) в своих реакциях, как и остальные члены группы 1: рубидий (Rb), цезий (Cs) и франций (Fr). Атомы элементов к правому концу периодической таблицы имеют тенденцию подвергаться таким реакциям, что они получают (или делят) достаточно электронов, чтобы завершить свою валентную оболочку. Например, кислород в группе 16 имеет шесть валентных электронов и, следовательно, нуждается в еще двух электронах для завершения своей внешней оболочки. Кислород достигает этой договоренности, реагируя с элементами, которые могут потерять или разделить электроны.Например, атом кислорода может реагировать с атомом магния (Mg) (в группе 2), принимая два валентных электрона магния, производя ионы Mg 2+ и O 2-. (Когда нейтральный атом магния теряет два электрона, он образует ион Mg 2+ , а когда нейтральный атом кислорода приобретает два электрона, он образует ион O 2-.) Получающийся Mg 2+ и Затем O 2- объединяют в соотношении 1: 1, получая ионное соединение MgO (оксид магния). (Хотя сложный оксид магния содержит заряженные частицы, он не имеет чистого заряда, потому что он содержит равные количества ионов Mg 2+ и O 2-.) Аналогично, кислород реагирует с кальцием (чуть ниже магния в группе 2) с образованием CaO (оксида кальция). Кислород реагирует аналогичным образом с бериллием (Be), стронцием (Sr), барием (Ba) и радием (Ra), остальными элементами в группе 2. Ключевым моментом является то, что, поскольку все элементы в данной группе имеют одинаковое количество валентных электронов, они образуют аналогичные соединения.
Химические элементы могут быть классифицированы по-разному. Наиболее фундаментальное разделение элементов на металлы, которые составляют большинство элементов, и неметаллы.Типичными физическими свойствами металлов являются блестящий внешний вид, податливость (способность быть изогнутым в тонкий лист), пластичность (способность быть втянутым в проволоку) и эффективная термическая и электрическая проводимость. Наиболее важным химическим свойством металлов является тенденция отдавать электроны с образованием положительных ионов. Медь (Cu), например, является типичным металлом. Это блестящий, но легко тускнеет; это отличный проводник электричества и обычно используется для электрических проводов; и он легко превращается в изделия различной формы, такие как трубы для систем водоснабжения.Медь содержится во многих ионных соединениях в форме ионов Cu + или Cu 2+ .
Металлические элементы находятся с левой стороны и в центре таблицы Менделеева. Металлы групп 1 и 2 называются типичными металлами; те, что находятся в центре периодической таблицы, называются переходными металлами. Лантаноиды и актиноиды, показанные под периодической таблицей, представляют собой особые классы переходных металлов.
металлических элементов в периодической таблице Металлы, неметаллы и металлоиды представлены в разных областях периодической таблицы. Encyclopædia Britannica, Inc.Неметаллы, которых относительно немного, находятся в верхнем правом углу периодической таблицы — за исключением водорода, единственного неметаллического члена группы 1. Физические свойства металлов отсутствуют в неметаллах. В химических реакциях с металлами неметаллы приобретают электроны с образованием отрицательных ионов. Неметаллические элементы также реагируют с другими неметаллами, в этом случае образуя молекулярные соединения. Хлор является типичным неметаллом.При обычных температурах элементарный хлор содержит молекулы Cl 2 и реагирует с другими неметаллами с образованием молекул, таких как HCl, CCl 4 и PCl 3 . Хлор реагирует с металлами с образованием ионных соединений, содержащих ионы Cl — .
Разделение элементов на металлы и неметаллы только приблизительное. Несколько элементов вдоль разделительной линии проявляют как металлические, так и неметаллические свойства и называются металлоидами или полуметаллами.
3,6: названия и формулы неорганических соединений
Эмпирические и молекулярные формулы, рассмотренные в предыдущем разделе, являются точными и информативными, но имеют некоторые недостатки. Во-первых, они неудобны для рутинного устного общения. Например, сказать «C-A-три-P-O-четыре-два» для Ca 3 (PO 4 ) 2 гораздо сложнее, чем сказать «фосфат кальция». Кроме того, многие соединения имеют одинаковые эмпирические и молекулярные формулы, но разное расположение атомов, что приводит к очень разным химическим и физическим свойствам.В таких случаях необходимо, чтобы соединения имели разные названия, которые различают возможные варианты.
Многие соединения, особенно те, которые были известны в течение относительно длительного времени, имеют более одного имени: общее имя (иногда несколько) и систематическое имя, то есть имя, назначаемое в соответствии с конкретными правилами. Как и названия большинства элементов, общие названия химических соединений обычно имеют историческое происхождение, хотя зачастую они не связаны с интересующими соединениями.Например, систематическое название для KNO 3 — нитрат калия, но его общее название — селитра .
В этом тексте систематическая номенклатура используется для присвоения значимых имен миллионам известных веществ. К сожалению, некоторые химические вещества, которые широко используются в торговле и промышленности, до сих пор известны почти исключительно под их общими названиями; в таких случаях требуется знакомство как с общим, так и с систематическим названием. Цель этого и следующих двух разделов — научить, как написать формулу для простого неорганического соединения из его названия — и наоборот — и ввести некоторые часто встречающиеся общие имена.
Бинарные ионные соединения содержат только два элемента. Процедура присвоения названий таким соединениям описана на рисунке 3.5.1 и использует следующие шаги:
Рисунок 3.5.1: Наименование ионного соединения
1. Расположите ионы в правильном порядке: катион, а затем анион.
2. Назовите катион.
а. Металлы, которые образуют только один катион . Как отмечалось ранее, эти металлы обычно находятся в группах 1, 3, 12 и 13. Название катиона металла, который образует только один катион, совпадает с названием металла (с добавлением слова ион, если катион это само по себе).Например, Na + представляет собой ион натрия, Ca 2 + представляет собой ион кальция, а Al 3 + представляет собой ион алюминия.
б. Металлы, которые образуют более одного катиона . Как показано на рисунке 3.5.2, многие металлы могут образовывать более одного катиона. Такое поведение наблюдается для большинства переходных металлов, многих актинидов и самых тяжелых элементов групп 13–15. В таких случаях положительный заряд на металле обозначается римской цифрой в скобках сразу после названия металла.Таким образом, Cu + представляет собой медь (I) (читается как «медная»), Fe 2 + представляет собой железо (II), Fe 3 + представляет собой железо (III), Sn 2 + — олово (II), а Sn 4 + — олово (IV).
Однако более старая система номенклатуры для таких катионов все еще широко используется. Название катиона с более высоким зарядом образовано из корня латинского имени элемента с присоединенным суффиксом -ic, а имя катиона с более низким зарядом имеет тот же корень с суффиксом -ous.Поэтому названия Fe 3 + , Fe 2 + , Sn 4 + и Sn 2 + , соответственно, являются трехвалентным, двухвалентным, оловянным и оловянным. Несмотря на то, что в этом тексте используются систематические имена с римскими цифрами, важно распознать эти распространенные имена, потому что они все еще часто используются. Например, на этикетке для полоскания зубов фторидами химики-составители называют фторид олова (II), который обычно указан как фторид олова.
Некоторые примеры металлов, которые образуют более одного катиона, перечислены в таблице 3.5.1 вместе с названиями ионов. Обратите внимание, что простой катион Hg + не встречается в химических соединениях. Вместо этого все соединения ртути (I) содержат димерный катион Hg 2 2 + , в котором два атома Hg связаны друг с другом.
| Катион | Системное имя | Общее имя | Катион | Системное имя | Общее имя | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| * Не широко используемый. | |||||||||||
| † Изолированный ион ртути (I) существует только как газообразный ион. | |||||||||||
| Co 2 + | кобальт (II) | кобальт * | Pb 4 + | свинец (IV) | 93101 931 331 931 3 301 + | кобальт (III) | кобальт * | Pb 2 + | свинец (II) | свинцовый * | |
| Cr 2 + | хром | хром | Cu 2 + | медь (II) | медь | ||||||
| Cr 3 + | хром (III) | хром | Cu + + + I) | медь | |||||||
| Fe 2 + | железо (II) | железо | Sn 4 + | олово (I V) | станник | ||||||
| Fe 3 + | железо (III) | железо | Sn 2 + | олово (II) | олово | 2 901 099 996 + | марганца (II) | марганца * | рт.ст. 2 + | ртути (II) | ртути |
| Mn 3 + | 93128 93128 93128 3 3 +Марганец (II) | ртуть | марганец * | Hg 2 2 + | ртуть (I) | ртуть † | |||||
c. катионов многоатомных . Названия общих многоатомных катионов, которые относительно важны в ионных соединениях (таких как ион аммония), приведены в таблице 2.4 «Общие многоатомные ионы и их названия».
3. Назовите анион.
а. одноатомные анионы . Имена одноатомных анионов добавляются путем добавления суффикса -ide к корню имени родительского элемента; таким образом, Cl — представляет собой хлорид, O 2- представляет собой оксид, P 3- представляет собой фосфид, N 3-93232 представляет собой нитрид (также называемый азидом) и C 4- представляет собой карбид.Поскольку заряды на этих ионах можно предсказать по их положению в периодической таблице, указывать заряд в названии не обязательно. Примеры одноатомных анионов приведены в таблице 2.2 «Некоторые общие одноатомные ионы и их названия».
б. Полиатомные анионы . Многоатомные анионы обычно имеют общие имена, которые необходимо запомнить; некоторые примеры приведены в таблице 2.4. Многоатомные анионы, которые содержат один атом металла или неметалла плюс один или несколько атомов кислорода, называются оксоанионами (или оксианионами).В тех случаях, когда для элемента известно только два оксоаниона, название оксоаниона с большим количеством атомов кислорода заканчивается на -ate, а название оксоаниона с меньшим числом атомов кислорода заканчивается на -ite. Например, NO 3 — является нитратом, а NO 2 — является нитритом.
Галогены и некоторые переходные металлы образуют более обширную серию оксоанионов с четырьмя членами. В названиях этих оксоанионов префикс используется для идентификации оксоаниона с наибольшим количеством кислорода (так что ClO 4 — является перхлоратом, а ClO 3 — — хлоратом), а префикс гипо- используется для идентификации аниона с наименьшим количеством кислорода (ClO 2 — — хлорит и ClO — — гипохлорит).Взаимосвязь между названиями оксоанионов и количеством присутствующих атомов кислорода показана на рисунке 3.5.3. «Взаимосвязь между названиями оксоанионов и количеством присутствующих атомов кислорода». Дифференцирование оксоанионов в такой серии не является тривиальным вопросом; например, гипохлорит-ион является активным ингредиентом в отбеливателе для стирки и в дезинфицирующем средстве для бассейна, но соединения, которые содержат перхлорат-ион, могут взорваться, если они вступят в контакт с органическими веществами.
4.Напишите название соединения в качестве названия катиона, за которым следует название аниона.
Рисунок 3.5.2: Металлы, которые образуют более одного катиона, и их местоположения в периодической таблице информация подразумевается зарядами на ионах. Однако при написании формулы для ионного соединения из его названия необходимо учитывать заряд ионов.Поскольку заряд иона хлорида равен -1, а заряд иона кальция равен +2, например, в соответствии с их позициями в периодической таблице, арифметика показывает, что хлорид кальция должен содержать вдвое больше хлорид-ионов, чем ионов кальция, чтобы сохранить электрическая нейтральность. Таким образом, формула CaCl 2 . Точно так же фосфат кальция должен быть Ca 3 (PO 4 ) 2 , потому что катион и анион имеют заряды +2 и −3 соответственно. Лучший способ узнать, как назвать ионные соединения, — это проработать несколько примеров, ссылаясь на рисунок 3.5.1, Таблица 2.2, Таблица 2.4 и Таблица 3.5.1 по мере необходимости.
За некоторыми исключениями, эти металлы обычно являются переходными металлами или актинидами.
Рисунок 3.5.3: Связь между названиями оксоанионов и числом присутствующих атомов кислорода
Катионы всегда называются перед анионами.
Большинство переходных металлов, много актинидов и самые тяжелые элементы групп 13–15 могут образовывать более одного катиона.
Напишите систематическое имя (и общее название, если применимо) для каждого ионного соединения.
90 382Учитывая : Эмпирическая формула
В ответ на просьбу : Название
Стратегия :
A Если для катиона возможен только один заряд, дайте его название, обращаясь к таблице 2.2 или таблице 2.4, если это необходимо. Если катион может иметь более одного заряда (Таблица 3.5.1), указать плату, используя римские цифры.
B Если анион не содержит кислорода, назовите его в соответствии с шагом 3а, используя Таблицу 2.2 и Таблицу 2.4, если необходимо. Для многоатомных анионов, которые содержат кислород, используйте Таблицу 2.4 и соответствующий префикс и суффикс, перечисленные в шаге 3b.
C Начиная с катиона, напишите название соединения.
Решение :
a. A B Литий входит в группу 1, поэтому мы знаем, что он образует только катион Li + , который является ионом лития.Точно так же хлор находится в группе 7, поэтому он образует анион Cl — , который является хлорид-ионом. C Поскольку мы начинаем с названия катиона, название этого соединения — хлорид лития, который используется в медицине в качестве антидепрессанта.
б. A B Катион — это ион магния, а анион, который содержит кислород, — это сульфат. C Поскольку мы сначала перечислим катион, название этого соединения — сульфат магния. Гидратированная форма сульфата магния (MgSO 4 · 7H 2 O) продается в аптеках в виде солей Эпсома, резкого, но эффективного слабительного.
в. A B Катионом является ион аммония (из таблицы 2.4), а анионом — фосфат. C Таким образом, соединение представляет собой фосфат аммония, который широко используется в качестве удобрения. Нет необходимости указывать, что формульная единица содержит три иона аммония, потому что три необходимы для уравновешивания отрицательного заряда на фосфате.
d. A B Катион — это переходный металл, который часто образует более одного катиона (таблица 3.5.1). Поэтому мы должны указать положительный заряд катиона в названии: медь (I) или, согласно более старой системе, медь.Анион оксидный. C Название этого соединения — оксид меди (I) или, в более старой системе, оксид меди. Оксид меди (I) используется в качестве красной глазури на керамике и в красках против обрастания для предотвращения роста организмов на днище лодок.
Cu 2 O . Дно лодки защищено красной краской против обрастания, содержащей оксид меди (I), Cu 2 O.
Упражнение
Напишите систематическое имя (и общее название, если применимо) для каждого иона соединение.
- CuCl 2
- MgCO 3
- FePO 4
Ответ :
- хлорид меди (II) (или хлорид меди)
- карбонат магния
- карбонат магния (или фосфат железа)
Напишите формулу для каждого соединения.
- дигидрофосфат кальция
- сульфат алюминия
- оксид хрома (III)
Дано : систематическое имя
Запрошено : формула
Стратегия :
A A его заряд с использованием местоположения элемента в периодической таблице и таблице 2.2 и образуйте катионы с разными зарядами, используйте соответствующую римскую цифру или суффикс, чтобы указать его заряд.
B Определите анион, используя таблицу 2.2 «Некоторые общие одноатомные ионы и их названия» и таблицу 2.4. Начиная с катиона, напишите формулу соединения и затем определите количество катионов и анионов, необходимое для достижения электрической нейтральности.
Решение :
a. A Кальций находится в группе 2, поэтому он образует только ион Ca 2 + . B Дигидрофосфат — это ион H 2 PO 4 — (Таблица 2.4). Два иона H 2 PO 4 — необходимы для уравновешивания положительного заряда на Ca 2 + , чтобы получить Ca (H 2 PO 4 ) 2 . Гидрат дигидрофосфата кальция, Ca (H 2 PO 4 ) 2 · H 2 O, является активным ингредиентом в разрыхлителе.
б. A Алюминий, расположенный ближе к вершине группы 13 в периодической таблице, образует только один катион, Al 3, , + (рис. 3.5.2 «Металлы, которые образуют более одного катиона и их расположение в периодической таблице»). B Сульфат SO 4 2 (Таблица 2.4). Для уравновешивания электрических зарядов нам понадобятся два катиона Al 3 + и три аниона SO 4 2-93232, что дает Al 2 (SO 4 ) 3 . Сульфат алюминия используется для дубления кожи и очистки питьевой воды.
в. A Поскольку хром является переходным металлом, он может образовывать катионы с различными зарядами.Римская цифра говорит нам, что положительный заряд в этом случае +3, поэтому катион Cr 3 + . Оксид B является O 2 . Таким образом, два катиона (Cr 3 + ) и три аниона (O 2-) необходимы для получения электрически нейтрального соединения, Cr 2 O 3 . Это соединение представляет собой обычный зеленый пигмент, который имеет множество применений, в том числе камуфляжных покрытий.
Cr 2 O 3 .Оксид хрома (III) (Cr 2 O 3 ) является обычным пигментом в темно-зеленых красках, таких как камуфляжная краска.
Напишите формулу для каждого соединения.
- хлорид бария
- карбонат натрия
- гидроксид железа (III)
Ответ :
- BaCl 2
- Na 2 CO 3 3 3 9038 9383 3 9383 9383 3 3 038 93838
Резюме
- Существует систематический метод, используемый для названия ионных соединений.
Ионные соединения названы в соответствии с систематическими процедурами, хотя распространенные названия широко используются. Систематическая номенклатура позволяет химикам писать структуру любого соединения от его имени и наоборот. Ионные соединения называются сначала записью катиона, а затем аниона. Если металл может образовывать катионы с более чем одним зарядом, заряд указывается римскими цифрами в скобках после названия металла. Оксоанионы представляют собой многоатомные анионы, которые содержат один атом металла или неметалла и один или несколько атомов кислорода.
- Описать состав химического соединения.
- Назвать ковалентные соединения, содержащие до трех элементов.
Как и в случае ионных соединений, система именования ковалентных соединений позволяет химикам написать молекулярную формулу из названия и наоборот. В этом и следующем разделе описываются правила именования простых ковалентных соединений, начиная с неорганических соединений, а затем переходя к простым органическим соединениям, которые содержат только углерод и водород.
Когда химики синтезируют новое соединение, они могут еще не знать его молекулярную или структурную формулу. В таких случаях они обычно начинают с определения своей эмпирической формулы относительного числа атомов элементов в соединении, приведенного к наименьшему целому числу. Поскольку эмпирическая формула основана на экспериментальных измерениях количества атомов в образце соединения, она показывает только отношения числа присутствующих элементов. Различие между эмпирическими и молекулярными формулами можно проиллюстрировать с помощью бутана, ковалентного соединения, используемого в качестве топлива в одноразовых зажигалках.Молекулярная формула для бутана является C 4 H 10 . Соотношение атомов углерода и атомов водорода в бутане составляет 4:10, что может быть уменьшено до 2: 5. Таким образом, эмпирическая формула для бутана C 2 H 5 . Единица формулы — это абсолютная группировка атомов или ионов, представленная эмпирической формулой соединения, ионного или ковалентного. Бутан имеет эмпирическую формулу C 2 H 5 , но содержит две формульные единицы C 2 H 5 , что дает молекулярную формулу C 4 H 10 .
Поскольку ионные соединения не содержат дискретных молекул, для указания их составов используются эмпирические формулы. Все соединения, будь то ионные или ковалентные, должны быть электрически нейтральными. Следовательно, положительные и отрицательные заряды в формульной единице должны точно взаимно отменять друг друга. Если катион и анион имеют заряды одинаковой величины, такие как Na + и Cl — , то соединение должно иметь соотношение катионов к анионам 1: 1, и эмпирическая формула должна быть NaCl.Если заряды не имеют одинаковую величину, тогда для получения нейтрального соединения требуется соотношение катион: анион, отличное от 1: 1. Например, в случае Mg 2 + и Cl — два иона Cl — необходимы для уравновешивания двух положительных зарядов на каждом ионе Mg 2 + , что дает эмпирическую формулу MgCl 2 . Точно так же формула для ионного соединения, которое содержит Na + и O 2-, представляет собой Na 2 O.
Ионные соединения не содержат дискретных молекул, поэтому для указания их составов используются эмпирические формулы.
бинарных ионных соединений
Ионное соединение, которое содержит только два элемента, один из которых представлен в виде катиона, а другое в качестве аниона, называется бинарным ионным соединением. Одним из примеров является MgCl 2, коагулянт, используемый при приготовлении тофу из соевых бобов. Для бинарных ионных соединений индексы в эмпирической формуле также могут быть получены путем скрещивания зарядов: используйте абсолютное значение заряда для одного иона в качестве индекса для другого иона.Этот метод схематически показан следующим образом:
Пересечение сборов . Один из способов получения подписок в эмпирической формуле заключается в пересечении сборов .
При пересечении сборов иногда необходимо уменьшить число подписчиков до их простейшего соотношения, чтобы написать эмпирическую формулу. Рассмотрим, например, соединение, образованное Mg 2 + и O 2 . Использование абсолютных значений зарядов на ионах в качестве индексов дает формулу Mg 2 O 2 :
Это упрощает до правильной эмпирической формулы MgO.Эмпирическая формула содержит один ион Mg 2 + и один ион O 2 .
Напишите эмпирическую формулу для простейшего бинарного ионного соединения, образованного из каждой пары ионов или элементов.
- Ga 3 + и As 3−
- Eu 3 + и O 2−
- кальций и хлор
Данные : ионы или элементы
Запрашивается : эмпирическая формула для бинарного ионного соединения.
, чтобы написать эмпирическую формулу. Убедитесь, что эмпирическая формула электрически нейтральна.
Решение
a. B Использование абсолютных значений зарядов на ионах в качестве индексов дает Ga3As3:
Сокращение индексов до наименьших целых чисел дает эмпирическую формулу GaAs, которая электрически нейтральна [+3 + (−3) = 0] ,В качестве альтернативы, мы могли бы признать, что Ga 3 + и As 3- имеют заряды одинаковой величины, но противоположных знаков. Один ион Ga 3 + уравновешивает заряд на одном ионе As 3-, и соединение 1: 1 не будет иметь полного заряда. Поскольку мы пишем индексы только в том случае, если число больше 1, эмпирическая формула GaAs. GaAs представляет собой арсенид галлия, который широко используется в электронной промышленности в транзисторах и других устройствах.
б. B Поскольку Eu 3 + имеет заряд +3, а O 2- имеет заряд -2, чистый состав 1: 1 будет иметь чистый заряд +1. Поэтому мы должны найти кратные сборы, которые отменяют. Мы пересекаем заряды, используя абсолютное значение заряда одного иона в качестве индекса для другого иона:
Индекс для Eu 3 + равен 2 (из O 2– ), а индекс для O 2 — — 3 (из Eu 3 + ), что дает Eu 2 O 3 ; подписки не могут быть сокращены в дальнейшем.Эмпирическая формула содержит положительный заряд 2 (+3) = +6 и отрицательный заряд 3 (-2) = −6 для чистого заряда 0. Соединение Eu 2 O 3 является нейтральным. Оксид европия отвечает за красный цвет на экранах телевизоров и компьютеров.
в. A Поскольку заряды на ионах не приведены, мы должны сначала определить ожидаемые заряды для наиболее распространенных ионов, полученных из кальция и хлора. Кальций находится в группе 2, поэтому он должен потерять два электрона, чтобы образовать Ca 2 + .Хлор находится в группе 17, поэтому он должен получить один электрон, чтобы образовать Cl — .
B Два иона Cl — необходимы для уравновешивания заряда на одном ионе Ca 2 + , что приводит к эмпирической формуле CaCl 2 . Мы также могли бы пересекать заряды, используя абсолютное значение заряда на Ca 2 + в качестве индекса для Cl и абсолютное значение заряда на Cl — в качестве индекса для Ca:
Индексы в CaCl 2 не может быть уменьшена в дальнейшем.Эмпирическая формула электрически нейтральна [+2 + 2 (−1) = 0]. Это соединение — хлорид кальция, одно из веществ, используемых в качестве «соли» для таяния льда на дорогах и тротуарах зимой.
Напишите эмпирическую формулу для простейшего бинарного ионного соединения, образованного из каждой пары ионов или элементов.
- Li + и N 3-
- Al 3 + и O 2-
- лития и кислорода
Ответ :
примеров неорганических соединений
Неорганические соединенияНеорганическое соединение — это любое соединение, в котором отсутствует атом углерода, из-за отсутствия более глубокого определения. Эти соединения с атомом углерода называются органическими соединениями из-за их корневого основания в атоме, которое жизненно важно для жизни. Существует небольшое количество неорганических соединений, которые на самом деле содержат углерод, учитывая его склонность к образованию молекулярных связей; К ним относятся угарный газ и углекислый газ, чтобы назвать несколько.
Неорганические соединения часто довольно просты, так как они не образуют сложных молекулярных связей, которые делает возможным углерод.Типичным примером простого неорганического соединения может быть хлорид натрия, более известный как домашняя соль. Это соединение содержит только два атома, натрия (Na) и хлора (Cl).
Примеры неорганических соединений:
1. H 2 O — Вода является простым неорганическим соединением, даже если оно содержит водород, ключевой атом (наряду с углеродом) во многих органических соединениях. Атомы в молекуле воды образовали очень простые связи из-за этого недостатка углерода.
2.HCl — гидрохлорид, также известный как соляная кислота при растворении в воде, представляет собой бесцветную едкую кислоту с довольно сильным pH. Это найдено в желудочных соках многих животных, помогая в вываривании, расщепляя пищу.
3. CO 2 — Двуокись углерода, несмотря на присутствие в формуле атома углерода, классифицируется как неорганическое соединение. Это вызвало спор в научном сообществе, когда возникли вопросы относительно обоснованности наших нынешних методов классификации соединений.В настоящее время органические соединения содержат углерод или углеводород, который образует более прочную связь. Связь, образованная углеродом в CO 2 , не является прочной связью.
4. NO 2 — Газообразный диоксид азота имеет различные цвета при разных температурах. Он часто производится при атмосферных ядерных испытаниях и отвечает за красноречивый цвет, отображаемый в грибных облаках. Он высокотоксичен и образует довольно слабые связи между атомами азота и кислорода.
5.Fe 2 O 3 — Оксид железа (III) является одним из трех основных оксидов железа и является неорганическим соединением из-за отсутствия атома углерода или углеводорода. Оксид железа (III) встречается в природе в виде гематита и является источником большинства железа для сталелитейной промышленности. Это обычно известно как ржавчина, и имеет много особенностей со своим естественным аналогом.
Примеры неорганических соединений
Цели обучения
- Описать состав химического соединения.
- Назвать ковалентные соединения, содержащие до трех элементов.
Как и в случае ионных соединений, система именования ковалентных соединений позволяет химикам писать молекулярные формулы из названия и наоборот. В этом и следующем разделе описываются правила именования простых ковалентных соединений, начиная с неорганических соединений, а затем переходя к простым органическим соединениям, которые содержат только углерод и водород.
Когда химики синтезируют новое соединение, они могут еще не знать его молекулярную или структурную формулу. В таких случаях они обычно начинают с определения своей эмпирической формулы относительного числа атомов элементов в соединении, приведенного к наименьшему целому числу. Поскольку эмпирическая формула основана на экспериментальных измерениях количества атомов в образце соединения, она показывает только отношения числа присутствующих элементов. Различие между эмпирическими и молекулярными формулами можно проиллюстрировать с помощью бутана, ковалентного соединения, используемого в качестве топлива в одноразовых зажигалках.Молекулярная формула для бутана \ (\ ce {C4h20} \). Соотношение атомов углерода и атомов водорода в бутане составляет 4:10, что может быть уменьшено до 2: 5. Таким образом, эмпирическая формула для бутана \ (\ ce {C2H5} \). Единица формулы — это абсолютная группировка атомов или ионов, представленная эмпирической формулой соединения, ионного или ковалентного. Бутан имеет эмпирическую формулу \ (\ ce {C2H5} \), но он содержит две \ (\ ce {C2H5} \) формульные единицы, что дает молекулярную формулу \ (\ ce {C4h20} \).
Поскольку ионные соединения не содержат , содержат дискретные молекулы, эмпирические формулы используются для указания их составов.{-}} \), например, два иона Cl — необходимы для уравновешивания двух положительных зарядов на каждом ионе Mg 2 + , давая эмпирическую формулу \ (\ ce {MgCl2} \). Аналогично, формула для ионного соединения, которое содержит ионы Na + и O 2-, представляет собой Na 2 O.
Ионные соединения не содержат дискретных молекул, поэтому для указания их составов используются эмпирические формулы.
бинарных ионных соединений
Ионное соединение, которое содержит только два элемента, один из которых представлен в виде катиона, а другой в качестве аниона, называется бинарным ионным соединением.Одним из примеров является \ (\ ce {MgCl_2} \), коагулянт, используемый при приготовлении тофу из соевых бобов. Для бинарных ионных соединений индексы в эмпирической формуле также могут быть получены путем скрещивания зарядов: используйте абсолютное значение заряда для одного иона в качестве индекса для другого иона. Этот метод схематически показан следующим образом:
Пересечение обвинений. Один из методов получения подписок в эмпирической формуле — это пересечение сборов.При пересечении сборов иногда необходимо уменьшить число подписчиков до их простейшего соотношения, чтобы написать эмпирическую формулу.Рассмотрим, например, соединение, образованное Mg 2 + и O 2 . Использование абсолютных значений зарядов на ионах в качестве индексов дает формулу \ (\ ce {Mg2O2} \):
Это упрощает до правильной эмпирической формулы MgO. Эмпирическая формула имеет один ион Mg 2 + и один ион O 2 .
Пример \ (\ PageIndex {1} \): бинарные ионные соединения
Напишите эмпирическую формулу для простейшего бинарного ионного соединения, образованного из каждой пары ионов или элементов.
- Ga 3 + и As 3
- Eu 3 + и O 2–
- кальций и хлор
Дано : ионы или элементы
Запрошено : эмпирическая формула для бинарного ионного соединения
Стратегия :
- Если не указано, определить ионные заряды на основе расположения элементов в периодической таблице.
- Используйте абсолютное значение заряда для каждого иона в качестве индекса для другого иона. Уменьшите количество подписчиков до самых низких цифр
, чтобы написать эмпирическую формулу. Убедитесь, что эмпирическая формула электрически нейтральна.
Решение
а. B Использование абсолютных значений зарядов на ионах в качестве индексов дает \ (\ ce {Ga3As3} \):
Сокращение индексов до наименьших целых чисел дает эмпирическую формулу GaAs, которая является электрически нейтральной [+3 + (−3) = 0].В качестве альтернативы, мы могли бы признать, что Ga 3 + и As 3- имеют заряды одинаковой величины, но противоположных знаков. Один ион Ga 3 + уравновешивает заряд на одном ионе As 3-, и соединение 1: 1 не будет иметь полного заряда. Поскольку мы пишем индексы только в том случае, если число больше 1, эмпирическая формула GaAs. GaAs представляет собой арсенид галлия, который широко используется в электронной промышленности в транзисторах и других устройствах.
б. B Так как Eu 3 + имеет заряд +3, а O 2- имеет заряд -2, чистый состав 1: 1 будет иметь чистый заряд +1. Поэтому мы должны найти кратные сборы, которые отменяют. Мы пересекаем заряды, используя абсолютное значение заряда для одного иона в качестве индекса для другого иона:
Индекс для Eu 3 + равен 2 (из O 2– ), а индекс для O 2– равен 3 (из Eu 3 + ), что дает 2 O 3 ; подписки не могут быть сокращены в дальнейшем.Эмпирическая формула содержит положительный заряд 2 (+3) = +6 и отрицательный заряд 3 (-2) = −6, для чистого заряда 0. Соединение Eu 2 O 3 является нейтральным. Оксид европия отвечает за красный цвет на экранах телевизоров и компьютеров.
в. A Поскольку заряды на ионах не приведены, мы должны сначала определить ожидаемые заряды для наиболее распространенных ионов, полученных из кальция и хлора. Кальций находится в группе 2, поэтому он должен потерять два электрона, чтобы образовать Ca 2 + .Хлор находится в группе 17, поэтому он должен получить один электрон, чтобы образовать Cl — .
B Два иона Cl — необходимы для уравновешивания заряда на одном ионе Ca 2 + , что приводит к эмпирической формуле CaCl 2 . Мы также могли бы пересекать заряды, используя абсолютное значение заряда для Ca 2 + в качестве индекса для Cl и абсолютное значение заряда для Cl — в качестве индекса для Ca:
Подписки в CaCl 2 не могут быть уменьшены в дальнейшем.Эмпирическая формула электрически нейтральна [+2 + 2 (−1) = 0]. Это соединение — хлорид кальция, одно из веществ, используемых в качестве «соли» для таяния льда на дорогах и тротуарах зимой.
Упражнение \ (\ PageIndex {1} \)
Напишите эмпирическую формулу для простейшего бинарного ионного соединения, образованного из каждой пары ионов или элементов.
- Li + и N 3−
- А1 3 + и О 2
- литий и кислород
- Ответ
Li 3 N
- Ответ б
Al 2 O 3
- Ответ c
Li 2 O
многоатомных ионов
Многоатомные ионы — это группы атомов, которые несут электрические заряды, хотя атомы в многоатомном ионе удерживаются вместе одними и теми же ковалентными связями, которые удерживают атомы вместе в молекулах.Подобно тому, как молекул гораздо больше, чем простых элементов, много многоатомных ионов больше, чем одноатомных. Двумя примерами многоатомных катионов являются ионы аммония (NH 4 + ) и метиламмония (CH 3 NH 3 + ). Многоатомные анионы гораздо более многочисленны, чем многоатомные катионы; некоторые общие примеры находятся в Таблице \ (\ PageIndex {1} \).
| Формула | Имя Ион | Формула | Имя Ион |
|---|---|---|---|
| NH 4 + | аммоний | HPO 4 2− | гидрофосфат |
| CH 3 NH 3 + | метиламмоний | H 2 PO 4 — | дигидрофосфат |
| OH — | гидроксид | ClO — | гипохлорит |
| O 2 2− | пероксид | ClO 2 — | хлорит |
| CN — | цианид | ClO 3 — | хлорат |
| SCN — | тиоцианат | ClO 4 — | перхлорат |
| NO 2 — | нитрит | MnO 4 — |