Двойная связь — Википедия
Материал из Википедии — свободной энциклопедии


Двойная связь — ковалентная связь двух атомов в молекуле посредством двух общих электронных пар. Строение двойной связи отражено в теории валентных связей. В этой теории считалось, что двойная связь образуется комбинацией сигма- и пи-связей.
На симпозиуме по теоретической органической химии (Лондон, сентябрь 1958 г.) был представлен доклад Л. Полинга, дважды лауреата Нобелевских премий. Доклад Полинга был посвящён природе двойной связи. Был предложен новый путь описания двойной связи как комбинации двух одинаковых изогнутых связей.[1]
Описание двойной и тройной связи с помощью представления об изогнутых связях поразительным образом объясняет некоторые из их свойств. Так, если кратные связи имеют вид дуг длиной 1,54 Å (длина простой связи углерод—углерод) и начальное направление их совпадает с тетраэдрическим, то их вычисленная длина оказывается равной 1,32 Å для двойной связи и 1,18 Å для тройной, что хорошо соответствует экспериментальным значениям 1,33 и 1,20 Å.
Дальнейшее развитие представлений об электростатическом отталкивании электронов предпринято в теории отталкивания электронных пар Р. Гиллеспи.[2]
- ↑ Полинг Л. Кекуле и химическая связь (книга «Теоретическая органическая химия») / под. ред. Р. Х. Фрейдлиной. — М.: Издательство иностранной литературы, 1963. — С. 7—16. — 366 с.
- ↑ Гиллеспи Р. Геометрия молекул. — М.: Мир, 1975. — 280 с.
Строение и химическая связь веществ
20-Янв-2015 | Нет комментариев | Лолита Окольнова
Задание А3 ГИА (ОГЭ) по химии —

ковалентная полярная и ковалентная неполярная, ионная, металлическая
1. Одинарная, двойная и тройная
Как известно, химическая связь это образование общей электронной пары между атомами (один от одного атома, другой от другого).
Если электронов несколько, то и связей больше, чем одна.
Валентность элементов главных подгрупп Периодической системы зависит от числа электронов, находящихся на внешнем электронном слое. Поэтому эти внешние электроны принято называть валентными. Для элементов побочных подгрупп в качестве валентных электронов могут выступать как электроны внешнего слоя, так и электроны внутренних подуровней.
- атомы одновалентных элементов образуют одинарную связь:
h3, Cl2
H-H, Cl-Cl
- двухвалентные — двойную: O2: O=O
- если валентность = 3, то тройную: N2: N≡N
И это применимо не только к простым веществам.
- если у атома валентность = 1, то он будет проявлять ее и в сложных веществах — образовывать три связи:
HCl h3S
H-Cl H-S-H;
- у S, как и у О валентность равна двум: h3O: это могут быть две одинарнеы связи: H-O-H или двойные: CO: C=O
- N, P, B и т.д. — 3: Nh4 — три одинарные связи, HCN: H-C≡N — тройная связь

Ответ: 3) Nh4 — три одинарные свзи

Ответ: 3) O2 — двойная связь
2. Ковалентная, ионная и т.д. …

1) PCl5 — два разных неметалла, значит, связь полярная ковалентная
2) CaCl2 — металл и неметалл, следовательно, ионная
3) Cl2 — два одинаковых неметалла — неполярная ковалентная
4) KCl — металл и неметалл, следовательно, ионная
Ответ: 1) PCl5

1) оксид серы — два неметалла, значит, будет ковалентная связь;
2) оксид бария — металл и неметалл — ионная
3) сероводород — неметалл и водород — ковалентная
4) аммиак — аналогично
Ответ: 2) BaO

1) все вещества образованы разными неметаллами и водородом — ковалентная поярная;
2) все вещества простые — значит, связь неполярная ковалентная
3) все вещества ионные
4) хлороводород и фосфин — ковалентная связь, соль — ионная
Ответ: 1)

Здесь важна последовательность — чтобы первое вещество было с ковалентной. а второй — с ионной, не наоборот. Такие каверзы редко, но встречаются в заданиях ГИА (ОГЭ).
1) Оксид фосфора — полярная ковалентная, оксид натрия — ионная;
2) хлорид натрия — ионная, хлор — ковалентная;
3) азот — ковалентная, неполярная, сульфид натрия — ионная;
4) хлорид кальция — ионная, хлороводород — ковалентная полярная
Ответ: 3)
Еще на эту тему:
Обсуждение: «Строение и химическая связь веществ»
(Правила комментирования)Типы ковалентной связи
☰
Ковалентная химическая связь возникает в молекулах между атомами за счет образования общих электронных пар. Под типом ковалентной связи может пониматься как механизм ее образования, так и полярность связи. Вообще ковалентные связи можно классифицировать так:
- По механизму образования ковалентная связь может образовываться по обменному или донорно-акцепторному механизму.
- По полярности ковалентная связь может быть неполярной или полярной.
- По кратности ковалентная связь может быть одинарной, двойной или тройной.
Это значит, что ковалентная связь в молекуле обладает тремя характеристиками. Например, в молекуле хлороводорода (HCl) ковалентная связь образуется по обменному механизму, она полярная и одинарная. В катионе аммония (NH4+) ковалентная связь между аммиаком (NH3) и катионом водорода (H+) образуется по донорно-акцепторному механизму, кроме того эта связь полярна, является одинарной. В молекуле азота (N2) ковалентная связь образована по обменному механизму, она неполярна, является тройной.
При обменном механизме образования ковалентной связи у каждого атома есть свободный электрон (или несколько электронов). Свободные электроны разных атомов образуют пары в виде общего электронного облака.
При донорно-акцепторном механизме образования ковалентной связи у одного атома есть свободная электронная пара, а у другого есть пустая орбиталь. Первый (донор) отдает пару в общее пользование со вторым (акцептор). Так в катионе аммония у азота есть неподеленная пара, а у иона водорода есть свободная орбиталь.
Неполярная ковалентная связь образуется между атомами одного химического элемента. Так в молекулах водорода (H2), кислорода (O2) и др. связь неполярна. Это значит, что общая электронная пара в равной степени принадлежит обоим атомам, т. к. у них одинаковая электроотрицательность.
Полярная ковалентная связь образуется между атомами разных химических элементов. Более электроотрицательный атом смещает к себе электронную пару. Чем больше различие электроотрицательностей атомов, тем сильнее будут смещены электроны, и связь будет более полярной. Так в CH4 смещение общих электронных пар от атомов водорода к атому углерода не столь велико, т. к. углерод не намного электроотрицательней водорода. Однако во фтороводороде HF связь сильно полярная, т. к. разница в электроотрицательности между водородом и фтором значительна.
Одинарная ковалентная связь образуется, если атомы делят одну электронную пару, двойная — если две, тройная — если три. Примером одинарной ковалентной связи могут быть молекулы водорода (H2), хлороводорода (HCl). Пример двойной ковалентной связи — молекула кислорода (O2), где каждый атом кислорода имеет два неспаренных электрона. Пример тройной ковалентной связи — молекула азота (N2).
Двойная связь (химия) — это… Что такое Двойная связь (химия)?
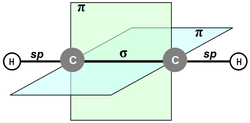
Рис.1.Сигма-связь Рис.2.Пи-связьДвойная связь — ковалентная связь двух атомов в молекуле посредством двух общих электронных пар. Строение двойной связи отражено в теории валентных связей. В этой теории считалось, что двойная связь образуется комбинацией сигма- (рис.1) и пи- (рис.2) связей.
На симпозиуме по теоретической органической химии (Лондон, сентябрь 1958 г.) был представлен докла Л.Полинга, дважды лауреата Нобелевских премий. Доклад Полинга был посвящён природе двойной связи. Был предложен новый путь описания двойной связи как комбинации двух одинаковых изогнутых связей. [1]
Полинг особое внимание уделил на кулоновскую электронную корреляцию: «Взаимодействие электронов (отталкивание) может играть весьма сущестенную роль в повышении устойчивости изогнутых связей…»
Описание двойной и тройной связи с помощью представления об изогнутых связях поразительным образом объясняет некоторые из их свойств. Так, если кратные связи имеют вид дуг длиной 1,54 Å (длина простой связи углерод-углерод) и начальное направление их совпадает с тетраэдрическим, то их вычисленная длина оказывается равной 1,32 Å для двойной связи и 1,18 Å для тройной, что хорошо соответствует экспериментальным значениям 1,33 и 1,20 Å.»
Дальнейшее развитие представлений об электростатическом отталкивании электронов предпринято в теории отталкивания электронных пар Р.Гиллеспи.
Примечания
- ↑ Полинг Л. Кекуле и химическая связь (книга «Теоретическая органическая химия») / под. ред. Р.Х.Фрейдлиной. — М.: Издательство иностранной литературы, 1963. — С. 7-16. — 366 с.
- ↑ Гиллеспи Р. Геометрия молекул. — М.: Мир, 1975. — 280 с.
См. также
|
|
Двойная связь, ковалентная четырёхэлектронная связь между двумя соседними атомами в молекуле. Двойная связь обычно обозначается двумя валентными штрихами: >С=С<, >C=N —, >С=О, >C=S, — N=N —, — Н=О и др. При этом подразумевается, что одна пара электронов с sp2 или sp — гибридизованными орбиталями образует s-связь (см. рис. 1), электронная плотность которой сосредоточена вдоль межатомной оси; s-связь подобна простой связи. Другая пара электронов с р-орбиталями образует p-связь, электронная плотность которой сосредоточена вне межатомной оси. Если в образовании двойной связи принимают участие атомы IV или V группы периодической системы, то эти атомы и атомы, связанные с ними непосредственно, расположены в одной плоскости; валентные углы равны 120°. В случае несимметричных систем возможны искажения молекулярной структуры. Двойная связь короче простой связи и характеризуется высоким энергетическим барьером внутреннего вращения; поэтому положения заместителей при атомах, связанных двойной связью, неэквивалентны, и это обусловливает явление геометрической изомерии. Соединения, содержащие двойную связь, способны к реакциям присоединения. Если двойная связь электронно-симметрична, то реакции осуществляются как по радикальному (путем гомолиза p-связи), так и по ионному механизмам (вследствие поляризующего действия среды). Если электроотрицательности атомов, связанных двойной связью, различны или если с ними связаны различные заместители, то p-связь сильно поляризована. Соединения, содержащие полярную двойную связь, склонны к присоединению по ионному механизму: к электроноакцепторной двойной связи легко присоединяются нуклеофильные реагенты, а к электронодонорной двойной связи — электрофильные. Направление смещения электронов при поляризации двойной связи принято указывать стрелками в формулах, а образующиеся избыточные заряды — символами d— и d+. Это облегчает понимание радикального и ионного механизмов реакций присоединения: В соединениях с двумя двойными связями, разделёнными одной простой связью, имеет место сопряжение p-связей и образование единого p-электронного облака, лабильность которого проявляется вдоль всей цепи (рис. 2, слева). Следствием такого сопряжения является способность к реакциям 1,4-присоединения: Если три двойных связи сопряжены в шестичленном цикле, то секстет p-электронов становится общим для всего цикла и образуется относительно стабильная ароматическая система (см. рис. 2, справа). Присоединение к подобным соединениям как электрофильных, так и нуклеофильных реагентов энергетически затруднено. (См. также Химическая связь.) Г. А. Сокольский. Рис. 1. Схема двойной связи >С = С< Рис. 2. Системы сопряжённых связей (вид сверху). |
Двойная связь — это… Что такое Двойная связь?
ковалентная четырёхэлектронная связь между двумя соседними атомами в молекуле. Д. с. обычно обозначается двумя валентными штрихами: >С=СC=N —, >С=О, >C=S, — N=N —, — Н=О и др. При этом подразумевается, что одна пара электронов с sp2 или sp — гибридизованными орбиталями образует σ-связь (см. рис. 1), электронная плотность которой сосредоточена вдоль межатомной оси; σ-связь подобна простой связи. Другая пара электронов с р-орбиталями образует π-связь, электронная плотность которой сосредоточена вне межатомной оси. Если в образовании Д. с. принимают участие атомы IV или V группы периодической системы, то эти атомы и атомы, связанные с ними непосредственно, расположены в одной плоскости; валентные углы равны 120°. В случае несимметричных систем возможны искажения молекулярной структуры. Д. с. короче простой связи и характеризуется высоким энергетическим барьером внутреннего вращения; поэтому положения заместителей при атомах, связанных Д. с., неэквивалентны, и это обусловливает явление геометрической изомерии (См. Изомерия). Соединения, содержащие Д. с., способны к реакциям присоединения. Если Д. с. электронно-симметрична, то реакции осуществляются как по радикальному (путем гомолиза π-связи), так и по ионному механизмам (вследствие поляризующего действия среды). Если электроотрицательности атомов, связанных Д. с., различны или если с ними связаны различные заместители, то π-связь сильно поляризована. Соединения, содержащие полярную Д. с., склонны к присоединению по ионному механизму: к электроноакцепторной Д. с. легко присоединяются нуклеофильные реагенты, а к электронодонорной Д. с. — электрофильные. Направление смещения электронов при поляризации Д. с. принято указывать стрелками в формулах, а образующиеся избыточные заряды — символами δ— и δ+. Это облегчает понимание радикального и ионного механизмов реакций присоединения:В соединениях с двумя Д. с., разделёнными одной простой связью, имеет место сопряжение π-связей и образование единого π-электронного облака, лабильность которого проявляется вдоль всей цепи (рис. 2, слева). Следствием такого сопряжения является способность к реакциям 1,4-присоединения:
Если три Д. с. сопряжены в шестичленном цикле, то секстет π-электронов становится общим для всего цикла и образуется относительно стабильная ароматическая система (см. рис. 2, справа). Присоединение к подобным соединениям как электрофильных, так и нуклеофильных реагентов энергетически затруднено. (См. также Химическая связь.)Г. А. Сокольский.
Рис. 1. Схема двойной связи >С = С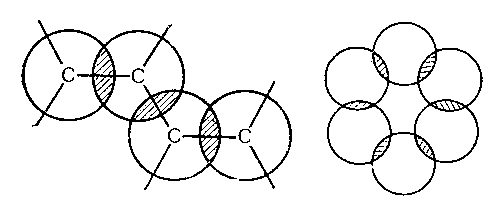
Рис. 2. Системы сопряжённых связей (вид сверху).
Большая советская энциклопедия. — М.: Советская энциклопедия. 1969—1978.
Тройная связь — Википедия
Материал из Википедии — свободной энциклопедии
 Тройная связь в рамках теории валентных связей
Тройная связь в рамках теории валентных связейТройная связь — ковалентная связь двух атомов в молекуле посредством трёх общих связывающих электронных пар.
Первая картина наглядного строения тройной связи была дана в теории валентных связей. Тройная связь в рамках теории валентных связей образуется путём перекрытия двух p-орбиталей атомов в двух перпендикулярных плоскостях и одной s-орбитали атома в состоянии sp-гибридизации по оси, соединяющей атомы.
Позднее (1958 г.) Л. Полинг предложил другой путь описания тройной связи, включающей комбинацию трёх равноценных изогнутых простых ковалентных связей[1]. Изгиб ковалентной связи имеет место за счёт электростатического отталкивания электронных пар.
Дальнейшее развитие этих представлений нашло отражение в работах Гиллеспи — Найхолма. Идея учёта отталкивания электронных пар получила заслуженное признание и распространение под названием теории отталкивания электронных пар.
В основу теории положена модель жёстких сфер. Согласно этой модели, длина простой ковалентной связи d равна сумме радиусов двух атомных остовов и диаметра совместно используемой электронной пары (2re):
- d = rAостов + rBостов + 2re.
Для гомоядерной двухатомной молекулы ковалентный радиус атома rков = 1/2 d, поэтому справедливо следующее соотношение:
- rков = rостов + re,
или
- re = rков − rостов.
Из этого соотношения можно рассчитать радиусы электронных пар для большинства элементов, используя значения ковалентных радиусов и ионных радиусов по Полингу, которые соответствуют размерам атомных остовов.[2]
Для атома углерода ковалентный радиус равен 0,77 Å, радиус атомного остова — 0,15 Å, радиус связывающей электронной пары — 0,62 Å, длина химической связи углерод-углерод — 1,54 Å.[2]
| Кратность связи | Число связывающих электронных пар | Длина химической связи, Å | Энергия разрыва химической связи, кДж/моль |
|---|---|---|---|
| Одинарная (C−C) | одна | 1,54 | 348 |
| двойная (C=C) | две | 1,34 | 614 |
| тройная (C≡C) | три | 1,20 | 839 |
Соединения с кратными химическими связями легко вступают в реакции присоединения и получили название непредельных соединений.
- ↑ Полинг Л. Кекуле и химическая связь (книга «Теоретическая органическая химия») / под. ред. Р. Х. Фрейдлиной. — М.: Издательство иностранной литературы, 1963. — С. 7—16. — 366 с.
- ↑ 1 2 Гиллеспи Р. Геометрия молекул. — М.: Мир, 1975. — С. 47—48. — 280 с.