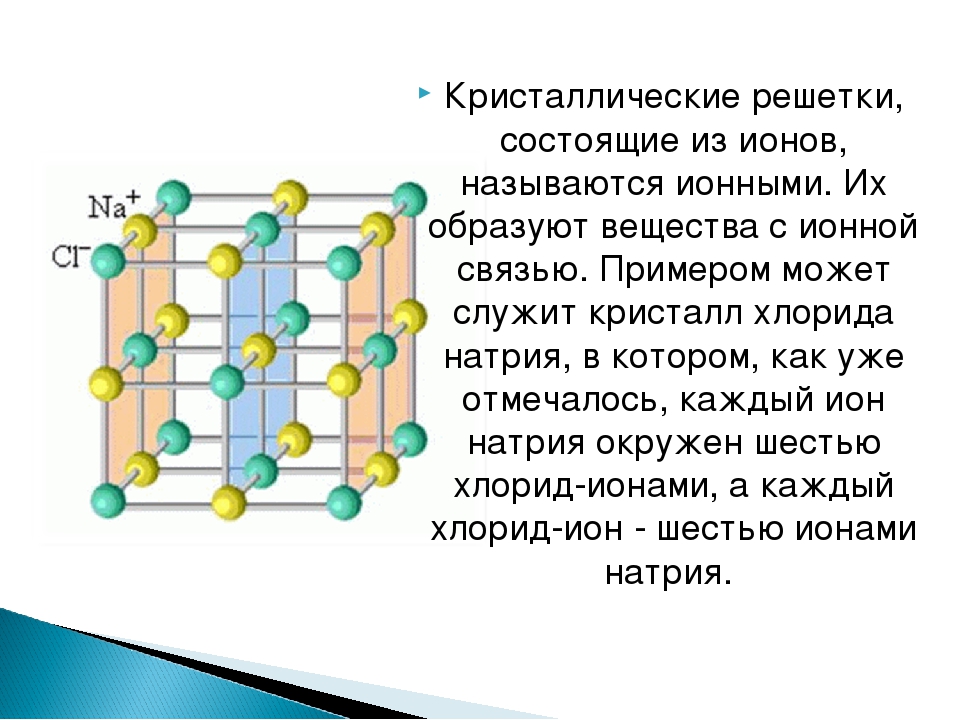
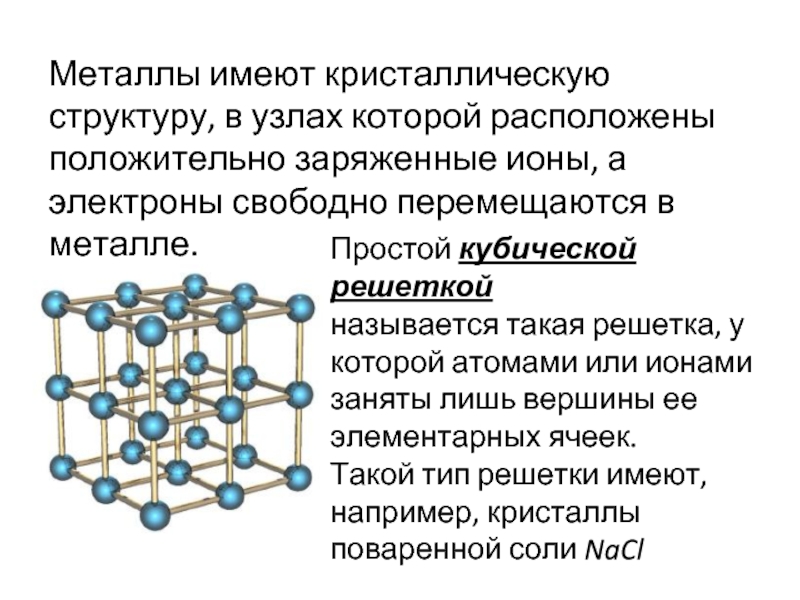
«Кристаллическая решетка» — Химия, 8 класс
#1. Наиболее высокую температуру плавления имеет вещество
#2. Выберите тип кристаллической решётки веществ, для которых характерны следующие свойстванизкие температуры плавления, летучесть, малая твёрдость
#3. Выберите вещество с ионным типом кристаллической решётки
#4. Правильны ли следующие суждения1. аморфные вещества не имеют определённой температуры плавления
#5. Молекулярное строение имеет
#6. Не имеет (ют) атомную кристаллическую решетку
#7. Частицы в узлах кристаллической решетке связаны друг с другом ковалентной связью, такая решётка называется
#8. Выберите кристаллическое вещество
#9. Ионную кристаллическую решётку имеет
#10. Молекулярное строение имеет каждое из двух веществ
#11. Выберите аморфное вещество
#12. Вещества с атомной кристаллическои решёткой
#13. Выберите тип кристаллической решётки веществ, для которых характерны следующие свойстваковкость, пластичность, электропроводность
#14.
 Выберите вещество с металлическим типом кристаллической решётки
Выберите вещество с металлическим типом кристаллической решётки#15. Атомную кристаллическую решетку имеет
#16. Ионную кристаллическую решетку имеет вещество
#17. Оксид серы (IV) в кристаллическом состоянии имеет кристаллическую решётку
#18. Бром в твердом состоянии имеет кристаллическую решётку
#19. Выберите вещество с атомным типом кристаллической решётки
#20. Частицы в узлах кристаллической решетке связаны друг с другом металлической связью, тип решётки
Показать результаты
Ваши результаты
Тест на тему: «Кристаллическая решетка» обновлено: 1 декабря, 2021 автором: Научные Статьи.Ру
Тест на тему: «Кристаллическая решетка» обновлено: 1 декабря, 2021 автором: Научные Статьи.Ру
Спасибо, что прошли тест, оцените его:Тест на тему: «Кристаллическая решетка» обновлено: 1 декабря, 2021 автором: Научные Статьи.Ру
Задания а 6 (егэ 2012) вещества молекулярного и немолекулярного строения тип кристаллической решетки зависимость свойств веществ от их состава и строения
Вещества молекулярного и немолекулярного
строения. Тип кристаллической решетки.
Зависимость свойств веществ от их
состава и строения.
Тип кристаллической решетки.
Зависимость свойств веществ от их
состава и строения.
Немолекулярное строение имеет: 1) фуллерен, 2) алмаз, 3) вода, 4) углекислый газ.
Немолекулярное строение имеет: 1) железо, 2) водород, 3) кислород, 4) угарный газ.
Ионную кристаллическую решетку имеет: 1) бромид калия, 2) бром, 3) калий, 4) бромоводород.
Молекулярную кристаллическую решетку имеет: 1) литий, 2) оксид натрия, 3) красный фосфор, 4) белый фосфор.
Молекулярную
кристаллическую решетку имеет:
1) фторид серы (VI),
2) сульфид натрия, 3) графит, 4)
натрий.
Молекулярное строение имеет: 1) йод, 2) йодид калия, 3) гидроксид калия, 4) гидроксид алюминия.
Немолекулярное строение имеет: 1) йод, 2) хлорид йода, 3) гидроксид калия, 4) уксусная кислота.
Немолекулярное строение имеет: 1) цинк, 2) муравьиная кислота, 3) фтороводород, 4) кислород.
Молекулярную
кристаллическую решетку в твердом
состоянии имеет:
1) иодид бария, 2) гидроксид
бария, 3) барий, 4) йод.
Ионную кристаллическую решетку имеет: 1) фтор, 2) фтороводород, 3) гидрид натрия, 4) хлорид титана(IV).
Молекулярное строение имеет: 1) оксид кремния(IV), 2) нитрат бария, 3) хлорид натрия, 4) оксид углерода(II).
Молекулярную кристаллическую решетку имеют: 1) H2O, CuO, 2) CuO, K2S, 3) K2S, H2SO4, 4) H2SO4, O2.
Атомную
кристаллическую решетку имеет:
1) графит, 2) железо,
3) карбонат кальция, 4)
азотная кислота.
Ионную кристаллическую решетку имеет: 1) фторид кальция, 2) оксид кремния, 3) алмаз, 4) медь.
Вещество, имеющее низкую температуру плавления, возгоняющееся при нагревании, неэлектропроводное – имеет кристаллическую решетку: 1) ионную, 2) металлическую, 3) молекулярную, 4) атомную.
Твердое, хрупкое вещество, расплав которого проводит электрический ток – имеет кристаллическую решетку: 1) ионную, 2) металлическую, 3) молекулярную, 4) атомную
Вещество, имеющее высокую электропроводность, ковкое, пластичное, имеет кристаллическую решетку: 1) ионную, 2) металлическую, 3) молекулярную, 4) атомную.
Тугоплавкое хрупкое вещество, нерастворимое в воде, имеет кристаллическую решетку: 1) ионную, 2) металлическую, 3) молекулярную, 4) атомную
Атом
является структурной единицей в
кристаллической решетке:
1) фосфорной кислоты,
2) белого фосфора, 3) кремнезема,
4) хлорида аммония.
В кристалле вольфрама частицы связаны металлической связью, поэтому вольфрам: 1) тугоплавок, 2) химически стоек, 3) электропроводен, 4) имеет высокую плотность.
Ионный тип кристаллической решетки характерен для: 1) кислот, 2) металлов, 3) неметаллов, 4) солей.
Из молекул состоит каждое из веществ: 1) поваренная соль и кислород, 2) оксид магния и хлороводород, 3) вода и хлор, 4) алмаз и сода.
Атомную кристаллическую решетку имеет каждое из веществ: 1) алмаз и графит, 2) аммиак и йод, 3) озон и кислород, 4) вода и мел.
Ионную
кристаллическую решетку имеет каждое
из веществ:
1) серная кислота и оксид
углерода(IV),
2) гидроксид натрия и хлорид калия,
3) карбонат кальция и
хлороводород, 4) оксид
кремния и гидроксид меди(II).
Верны ли следующие суждения о типах кристаллических решеток веществ в твердом состоянии? А) этанол имеет ионную кристаллическую решетку. Б) йод имеет молекулярную кристаллическую решетку. 1) верно только А, 2) верно только Б, 3) верны оба суждения, 4) оба суждения неверны.
Какие свойства характерны для вещества с атомной кристаллической решеткой? 1) нерастворимость в воде и тугоплавкость, 2) хрупкость и легкоплавкость, 3) растворимость в воде и летучесть, 4) хорошая тепло- и электропроводность.
В твердых веществах молекулярного строения химическая связь: 1) ковалентная, 2) металлическая, 3) ионная, 4) водородная
В твердых веществах атомного строения химическая связь между атомами: 1) ковалентная, 2) металлическая, 3) ионная, 4) водородная
Некоторое
вещество тугоплавко и не проводит
электрический ток ни в твердом виде,
ни в расплаве. Какую кристаллическую
решетку оно имеет?
1) атомную,
2) молекулярную, 3) ионную,
4) металлическую.
Какую кристаллическую
решетку оно имеет?
1) атомную,
2) молекулярную, 3) ионную,
4) металлическую.
Некоторое вещество тугоплавко и не проводит электрический ток в твердом виде, но его водный раствор обладает электрической проводимостью. Какую кристаллическую решетку имеет это вещество? 1) атомную, 2) молекулярную, 3) ионную, 4) металлическую.
Выберите вещество, которое в твердом состоянии имеет молекулярную кристаллическую решетку: 1) С (графит), 2) SiO2, 3) SiC,4) CO2
Выберите вещество, которое в твердом состоянии имеет атомную кристаллическую решетку: 1) SiO2, 2) SiH4, 3) O2, 4) Na.
Выберите
вещество, которое в твердом состоянии
имеет ионную кристаллическую решетку:
1) N2O5,
2) HNO3, 3)
NH4NO3,
4) NH3.
Какое свойство характерно для веществ с атомной кристаллической решеткой? 1) высокая плотность, 2) тугоплавкость, 3) хорошая растворимость в воде, 4) электропроводность.
Один и тот же тип решетки в кристаллическом состоянии имеют: 1) хлор и водород, 2) вода и алюминий, 3) поваренная соль и серная кислота, 4) кремнезем и гидроксид натрия.
Запахом обладают вещества, имеющие кристаллическую решетку: 1) атомную, 2) молекулярную, 3) ионную, 4) металлическую.
Молекулярную решетку в кристаллическом состоянии имеет: 1) хлорид натрия, 2) хлор, 3) натрий, 4) гидроксид натрия.
Хлорид-ионы
отсутствую в кристаллах:
1) хлорида натрия, 2) хлорида
кальция, 3) хлорида фосфора(V), 4)
хлорида цезия.
Ионную кристаллическую решетку в кристаллическом состоянии имеет: 1) бром, 2) вода, 3) серная кислота, 4) карбонат натрия.
Металлическую кристаллическую решетку имеет: 1) NH3, 2) AlCl3, 3) Cu3Al, 4) CuO.
Один и тот же тип решетки в кристаллическом состоянии имеют вода и: 1) железо, 2) углекислый газ, 3) поваренная соль, 4) алмаз.
Легкоплавкое кристаллическое вещество хорошо растворимо в этаноле и не проводит электрический ток ни в расплаве, ни в растворе. Какую кристаллическую решетку оно имеет? 1) атомную, 2) молекулярную, 3) ионную, 4) металлическую.
Тугоплавкое
кристаллическое вещество нерастворимо
в воде и хорошо проводит теплоту и
электрический ток. Какую кристаллическую
решетку оно имеет?
1) атомную, 2)
молекулярную, 3) ионную, 4)
металлическую.
Какую кристаллическую
решетку оно имеет?
1) атомную, 2)
молекулярную, 3) ионную, 4)
металлическую.
Тот же тип кристаллической решетки, что и у сульфата натрия, имеет: 1) красный фосфор, 2) хлороводород, 3) серная кислота, 4) сульфид бария.
Тот же тип кристаллической решетки, что и у натрия, имеет: 1) хлорид цинка, 2) сульфат натрия, 3) карбонат натрия, 4) золото.
Тот же тип кристаллической решетки, что и у кислорода, имеет: 1) бром, 2) оксид натрия, 3) поваренная соль, 4) калий.
Один
и тот же тип решетки в кристаллическом
состоянии имеют:
1) фтор и фторид натрия,
2) хлор и хлорид калия,
3)
хлорид натрия и гидроксид калия, 4)
оксид хлора(VII) и гидроксид
калия.
Оксид алюминия в кристаллическом состоянии имеет тот же тип кристаллической решетки, что и: 1) алюминий, 2) кислород, 3) фтор, 4) фторид алюминия.
Ванилин представляет собой легкоплавкое кристаллическое вещество с характерным запахом. Какой тип кристаллической решетки он имеет? 1) атомный, 2) молекулярный, 3) ионный, 4) металлический.
Атомную решетку в кристаллическом состоянии имеет: 1) азот, 2) аммиак, 3) карбид кремния, 4) платина.
Один
и тот же тип решетки в кристаллическом
состоянии имеют:
1) натрий и хлорид натрия,
2) сульфат бария и барий,
3)
сульфат бария и серная кислота, 4)
серная кислота и оксид серы(VI).
Для твердых веществ с молекулярной кристаллической решеткой характерна высокая: 1) плотность, 2) температура плавления, 3) летучесть, 4) энергия связи между молекулами.
Для твердых веществ с металлической кристаллической решеткой характерна низкая: 1) теплопроводность, 2) плотность, 3) летучесть при комнатной температуре, 4) электропроводность.
Для твердых веществ с ионной кристаллической решеткой характерна низкая: 1) температура плавления, 2) энергия связи между ионами, 3) растворимость в воде, 4) летучесть.
Твердое
вещество с ионной кристаллической
решеткой расплавили. Полученная
жидкость: 1) имеет высокую
плотность, 2) быстро испаряется,
3) неприятно пахнет,
4) проводит электрический ток.
Полученная
жидкость: 1) имеет высокую
плотность, 2) быстро испаряется,
3) неприятно пахнет,
4) проводит электрический ток.
Атомную кристаллическую решетку не образует: 1) кремний, 2) германий, 3) алюминий, 4) углерод.
Если вещество хорошо растворимо в воде, имеет высокую температуру плавления, не электропроводно, то его кристаллическая решетка: 1) молекулярная, 2) атомная, 3) ионная, 4) металлическая.
Понятие
«молекула» не применимо по отношению
к структурной единице вещества:
1) хлороформа, 2) кислорода,
3) алмаза, 4) озона.
Атомная кристаллическая решетка характерна для: 1) алюминия и карбида алюминия, 2) серы и йода, 3) оксида кремния и хлорида натрия, 4) алмаза и бора.
Вещества, имеющие молекулярную кристаллическую решетку, как правило: 1) тугоплавкие и хорошо растворимые в воде, 2) легкоплавкие и летучие, 3) твердые и электропроводные, 4) теплопроводные и пластичные.
Кристаллические решетки ионные — Справочник химика 21
Чем отличаются вещества с кристаллической решеткой ионного типа от веществ с кристаллической решеткой молекулярного типа (примеры) [c. 50]
50]Энергия кристаллической решетки ионного кристалла может быть вычислена независимым путем, если известны радиусы ионов. Для бинарного кристалла АВ эта величина рассчитывается по формуле [c.213]
Напомним, что, согласно изложенному в разд. 7.3, ч. 1, анионы, как правило, имеют большие радиусы, чем катионы. Поэтому можно представить себе кристаллическую решетку ионного вещества в виде плотноупакованной анионной структуры, в которой тот или иной тип дырок занят катионами. Относительные размеры катионов и анионов определяют тип дырок, занимаемых катионами. Наиболее устойчивая структура достигается при максимальном числе контактов между катионами и анионами, что соответствует наибольшей суммарной величине сил электростатического притяжения между противоположно заряженными ионами в кристаллической решетке ионного вешества. Однако устойчивая структура не может существовать при наличии прямых контактов между анионами, которые привели бы к появлению слишком больших электростатических сил отталкивания. Рассмотрим подробнее различные возможности на примере ситуации, когда небольшие катионы в точности заполняют тетраэдрические дырки, образованные плотноупакованным расположением анионов. Как было указано, такая ситуация возникает при условии, что отношение радиусов катиона и аниона rJr равно 0,225. При таком условии катион касается четырех окружающих его анионов. Теперь посмотрим, что произойдет, если размер катиона начнет увеличиваться, так что станет выполняться условие rJr > 0,225. В таком случае анионы раздвигаются, что уменьшает дестабилизующие контакты между ними, тогда как стабилизующие структуру катионно-анионные контакты сохраняются. Однако, когда отношение радиусов достигает значения 0,414, положение катиона в тетраэдрической дырке перестает быть устойчивым. Более устойчивым положением для катиона становится октаэдрическая дырка, находясь в которой он обеспечивает большее число [c.352]
Рассмотрим подробнее различные возможности на примере ситуации, когда небольшие катионы в точности заполняют тетраэдрические дырки, образованные плотноупакованным расположением анионов. Как было указано, такая ситуация возникает при условии, что отношение радиусов катиона и аниона rJr равно 0,225. При таком условии катион касается четырех окружающих его анионов. Теперь посмотрим, что произойдет, если размер катиона начнет увеличиваться, так что станет выполняться условие rJr > 0,225. В таком случае анионы раздвигаются, что уменьшает дестабилизующие контакты между ними, тогда как стабилизующие структуру катионно-анионные контакты сохраняются. Однако, когда отношение радиусов достигает значения 0,414, положение катиона в тетраэдрической дырке перестает быть устойчивым. Более устойчивым положением для катиона становится октаэдрическая дырка, находясь в которой он обеспечивает большее число [c.352]
Экспериментально определить энергию кристаллической решетки ионного соединения очень сложно.
 Ее можно вычислить посредством термодинамического цикла (цикл Борна — Габера), воспользовавшись другими известными энтальпиями превращений, которым может подвергаться исследуемое ионное соединение. [c.214]
Ее можно вычислить посредством термодинамического цикла (цикл Борна — Габера), воспользовавшись другими известными энтальпиями превращений, которым может подвергаться исследуемое ионное соединение. [c.214]Объяснение. Как известно, кристаллы сильно полярных солей состоят из ионов, которые образуют так называемую кристаллическую решетку. Ионы в такой решетке связаны между собой электростатическими силами притяжения. Силы взаимодействия в ионных кристаллах весьма значительны. В твердом виде ионные кристаллы не проводят электрический ток, так как в них электроны прочно удерживаются в атомных орбитах отдельных ионов. В расплавленном состоянии кристаллические вешества проводят электрический ток, причем электропроводность осуществляется за счет переноса ионов. [c.68]
Возможность образования ионной атмосферы вытекает из статистической теории электролитов. Распределение ионов в растворе следует рассматривать как промежуточное между беспорядочным распределением молекул в жидкости и упорядоченным распределением частиц в кристаллической решетке. Ионы в растворе в каждый данный момент времени распределены не хаотически, а в некоторой степени упорядоченно благодаря кулоновскому притяжению зарядов противоположного знака. В каждый момент времени вокруг любого из ионов формируется оболочка из ионов противоположного заряда — ионная атмосфера (рис. 6.1,а). [c.286]
Ионы в растворе в каждый данный момент времени распределены не хаотически, а в некоторой степени упорядоченно благодаря кулоновскому притяжению зарядов противоположного знака. В каждый момент времени вокруг любого из ионов формируется оболочка из ионов противоположного заряда — ионная атмосфера (рис. 6.1,а). [c.286]
Расчет энергии кристаллической решетки ионного кристалла. [c.14]
Твердые растворы металлов также обладают свойствами, качественно напоминающими свойства индивидуальных металлов, но количественно отличающимися от них и зависящими от состава растворов, который может изменяться в довольно широких пределах. Среди компонентов твердого раствора различают металл—растворитель и растворенный металл. Растворителем считается металл, который сохраняет свою кристаллическую решетку при образовании раствора и содержание которого в растворе должно быть не менее определенного значения. Ионы растворяемого металла постепенно замещают в кристаллической решетке ионы металла—растворителя (растворы замещения) или же располагаются между ионами металла—растворителя (растворы внедрения). Содержание растворенного металла в твердом растворе может быть не больше определенной величины. В случае, когда различные металлы с близкими кристаллическими решетками способны образовать твердые растворы в любых количественных соотношениях, уже нет возможности отличать растворенный металл от металла—растворителя, а приходится считать, что металлы взаимно растворяют друг друга. [c.32]
Содержание растворенного металла в твердом растворе может быть не больше определенной величины. В случае, когда различные металлы с близкими кристаллическими решетками способны образовать твердые растворы в любых количественных соотношениях, уже нет возможности отличать растворенный металл от металла—растворителя, а приходится считать, что металлы взаимно растворяют друг друга. [c.32]
Если бы поляризационные взаимодействия между ионами отсутствовали, тип кристаллической решетки ионного соединения определялся бы только числом структурных единиц и их размерами (XII 2). Однако поляризационные явления играют важную роль при образовании кристаллов и иногда сильно влияют на тип образуемой кристаллизующимся веществом решетки. [c.425]
Есть ли различие в протекании процесса растворения веществ с кристаллическими решетками ионного и молекулярного типа [c.51]
Во-вторых, большинство химических сложных веществ состоит не из молекул, а из ионов. Ионными соединениями являются все соли, а также солеобразные соединения (см. 6.10). Составными частями таких соединений являются одноэлементные или многоэлементные ионы, соединенные между собой (в кристаллической решетке) ионной связью. [c.25]
Ионными соединениями являются все соли, а также солеобразные соединения (см. 6.10). Составными частями таких соединений являются одноэлементные или многоэлементные ионы, соединенные между собой (в кристаллической решетке) ионной связью. [c.25]
Гетерогенные высокодисперсные коллоидные системы в большинстве случаев существуют в виде дисперсий трехмерных и двухмерных структур как аморфных (включая жидкости), так и относящихся к различным кристаллическим решеткам — ионной, атомной, молекулярной или металлической. Дисперсионной средой обычно является нерастворяющая жидкость, реже газы. Наличие высокоразвитой поверхности раздела — наиболее характерная черта, общая для всех коллоидных систем этого рода. [c.23]
Гидроксиды Э(0Н)2 — белые порошкообразные вещества (кристаллическая решетка ионная) Они могут быть получены в безводном состоянии и в виде кристаллогидратов с 1, 2, 3, 8 молекулами воды Растворимость в воде относительно невелика и увеличивается при переходе от Ве(ОН)г к Ва(ОН)г Некоторые свойства гидроксидов элементов группы ПА приведены ниже [c. 198]
198]
К сильным электролитам относят вещества, которые полностью диссоциированы и не образуют ионных пар, т. е. агрегатов из противоположно заряженных ионов, которые в целом не несут электрического заряда. В твердом состоянии сильные электролиты образуют кристаллическую решетку ионного типа. Подобных веществ сравнительно немного. К ним относятся минеральные соли щелочных и щелочно-земельных металлов, галогениды, перхлораты и нитраты некоторых переходных металлов. Минеральные кислоты и щелочи являются сильными электролитами только в достаточно разбавленных водных растворах. В концентрированных же растворах они диссоциированы не полностью. [c.43]
Общее название веществ, обладающих способностью люминесцировать — люминофоры. Так же называются неорганические люминофоры. Сложные неорганические кристаллические люминофоры с дефектной структурой, вызванной внедрением в их кристаллическую решетку ионов тяжелых металлов (активаторов), называют кристаллофосфорами. Органические люминофоры принято называть органолюминофорами. [c.498]
Органические люминофоры принято называть органолюминофорами. [c.498]
Заряд ионов. Электрический заряд ионов (обозначаемый в формулах арабской цифрой с последующим знаком + или — ) определяет, в каком соотношении эти ионы находятся в кристаллической решетке ионного соеди-нения. [c.157]
Для энергии кристаллической решетки ионного кристалла Л. Полинг [ ] дает следующую формулу [c.99]
Можно, до известной степени, провести параллели между силами сцепления и силами, которые удерживают в кристаллической решетке ионы гетерополярных и молекулы гомеополярных веществ. Эти силы находятся в тесной связи со строением решетки. От них зависит величина теплоты плавления и температуры плавления. Эти величины [c.202]
Кристаллическую решетку ионного соединения можно рассматривать как бесконечное повторение минимального трехмерного участка (параллелепипеда), называемого элементарной ячейкой. В соответствии с симметрией элементарной ячейки кристаллическую решетку относят к одной из кристаллических систем (сингоний) кубической, тетрагональной, гексагональной, тригональной, орторомбической, моноклинной и триклинной (в порядке убывания симметрии). Нена-сыщаемость и ненаправленность ионной связи приводят в большинстве ионных кристаллов к образованию структур так называемых плотнейших упаковок. Это кубические решетки типов Na I и s l (рис. 60), сфалерита (ZnS) и флюорита (СаРг), гексагональные типа ZnO и др. [c.129]
Нена-сыщаемость и ненаправленность ионной связи приводят в большинстве ионных кристаллов к образованию структур так называемых плотнейших упаковок. Это кубические решетки типов Na I и s l (рис. 60), сфалерита (ZnS) и флюорита (СаРг), гексагональные типа ZnO и др. [c.129]
Энергией кристаллической решетки ионного соединения, ЛЯкр, называют то количество энергии, которое требуется для удаления 1 моль ионов из решетки на расстояние, при котором силы взаимодействия между ионами бесконечно малы. Например, для кристалла Na l стандартная энергия кристаллической решетки равна [c.213]
Простые соли — соединения типичных металлических элементов с окислительными элементами (оксоидами). Связь между атомами в молекулах простых солей, находящихся в газовом состоянии, преимущественно ионная, по крайней мере для типичных случаев (т. е. для соединений наиболее активных, например щелочных, металлов с активными оксоидами, например галогенами). Простые соли характеризуются кристаллическими решетками ионного типа, а в жидком состоянии — ионной электропроводностью. Несомненно, что к классу простых солей должны быть отнесены оксиды и нитриды активных металлов, поскольку они характеризуются теми же типичными для солей признаками гидриды наиболее активных (например, щелочных) металлов также являются простыми солями, обладая всеми их признаками. Характерной химической функцией простых солей является их способность бьта донорами положительно и отрицательно заряженных элементарных ионов, сочетаниями которых они являются. [c.51]
Несомненно, что к классу простых солей должны быть отнесены оксиды и нитриды активных металлов, поскольку они характеризуются теми же типичными для солей признаками гидриды наиболее активных (например, щелочных) металлов также являются простыми солями, обладая всеми их признаками. Характерной химической функцией простых солей является их способность бьта донорами положительно и отрицательно заряженных элементарных ионов, сочетаниями которых они являются. [c.51]
Кристаллические решетки ионных соединений. Решетку можно рассматривать как бесконечное новторение минимального трехмерного участка (пареллелепипеда), называемого элементарной ячейкой. В соответствии с симметрией элементарной ячейки кристаллическую решетку относят к одной из семи кристаллических систем (сингоний) кубической, тетрагональной, гексагональной, тригональной, орторомбической, моноклинной и триклинной (в порядке убывания симметрии).
 [c.167]
[c.167]Ионы [РЮ1б]2″ занимают углы кубической, центрированной в гранях, кристаллической решетки. Ионы К составляют куб. [c.135]
Упругость кристаллических твердых тел обусловлена тем, что небольшое увеличение (при приложении виешних сил) нормальных для данного вещества расстояний между молекулами (или ионами, если кристаллическая решетка ионная) сопровождается работой против сил кристаллической реиштки (и вообще межмолекулярных сил). Именно эти силы и стремятся после снятия нагрузки вернуть молекулы (ионы) в их нормальное положение. [c.321]
Оксид титана(1У) TIO2 может существовать в виде бесцветных кристаллов трех модификаций — рутил, анатаз и брукит. Все его модификации образуют очень прочные кристаллические решетки ионного типа. Он медленно растворяется только в концентрированной серной кислоте, образуя оксосульфат (сульфат титанила) [c.345]
При соприкосновении СдЗ с водой происходит удаление из его кристаллической решетки ионов кальция и образование пористого модифицированного слоя на поверхности минерала за счет стягивания — возникновение промежуточного продукта гидратации. Судя по кривой pH, насыщение дисперсионной среды щелочными ионами достигается к 3 ч от начала гидратации, после чего остается практически постоянным [341. По ИК-спектрам идентифицирован СдЗ и доказано наличие конденсации тетраэдров и образование слоистых гидросиликатов. При гидратации наблюдается увеличение активности и величин поверхности трехкальциевого силиката и его новообразований, доказываемое ростом теплового эффекта при смачивании образцов водой. Аномально высокое значение теплоты смачивания исходного СдЗ водой обусловлено частичным растворением вяжущего, поверхностными ионообменными реакциями и другими факторами. Об этом свидетельствует малый тепловой эффект при смачивании бензолом, в то время как для гидрати- [c.236]
Судя по кривой pH, насыщение дисперсионной среды щелочными ионами достигается к 3 ч от начала гидратации, после чего остается практически постоянным [341. По ИК-спектрам идентифицирован СдЗ и доказано наличие конденсации тетраэдров и образование слоистых гидросиликатов. При гидратации наблюдается увеличение активности и величин поверхности трехкальциевого силиката и его новообразований, доказываемое ростом теплового эффекта при смачивании образцов водой. Аномально высокое значение теплоты смачивания исходного СдЗ водой обусловлено частичным растворением вяжущего, поверхностными ионообменными реакциями и другими факторами. Об этом свидетельствует малый тепловой эффект при смачивании бензолом, в то время как для гидрати- [c.236]
Наиболее простыми кристаллическими решетками ионного типа являются решетки ЫаС1 и СзС1, рассмотренные нами ранее (см. рис. 6-2). Однако в кристаллах веществ, содержащих комплексные ионы, структура элементарных ячеек может быть очень сложной. [c.107]
[c.107]
На рис. 5 схематически изображен кусок меди. Здесь атомы не имеют одного электрона. Объединяясь в кристаллическую решетку, атомы теряют свой самый удагген-ный электрон (слабее всех связанный). Этот электрон становится свободным. Таким образом, создается кристаллическая решетка ионов и электронный газ. При отсутствии электрического поля имеется только тепловое поле. [c.17]
Учащимся предлагают выполнить задания после краткого напоминания учителем, какие существуют виды химической связи (ионная, ковалентная полярная, ковалентная неполярная, металлическая), какого типа кристаллические решетки (ионная, атомная, молекулярная, металлическая) образуют вещества при затвердевании. Чтобы возбудить интерес учащихся к выполнению работы, учитель предлагает учащимся попытаться самостоятельно определить, какие виды связи имеются между химическими элементами в тех или ииых указанных веществах, какого типа кристаллические решетки имеют указ. . н-иые твердые вещества. [c.121]
н-иые твердые вещества. [c.121]
В кристаллах ионного типа, например, галите Na l, флюорите СаРг, кварце ЗЮг, положительно заряженные атомы (катионы) отдают электроны из наружной электронной оболочки, а отрицательно заряженные (анионы) принимают их. Вследствие этого число положительных зарядов соответствует числу отрицательных. Длина связи между катионом и анионом приблизительно равна сумме их радиуса действия. Энергия кристалла (так часто называют энергию кристаллической решетки) ионного типа пропорциональна числу структурных единиц 2/п, слагающих кристалл (на это число ионов распадается молекула), валентности ионов Zi и Z2 и обратно пропорциональна радиусам действия атомов гк — катиона и га — аниона. [c.16]
В(. граиваюгииеся из газовой фазы в кристаллическую решетку ионы кислорода коицентри[)уются вблизи поверхности кристалла N 0, а затем часть пикеля диффундирует к повер, ности, чтобы сбалансировать избыточный. электрический заряд. При эго.м в объеме кристалла возникают вакансии. Черный оксид нтн сля проводит электрический тoк 1ак как электроны. могут легко переходить от к N1 + [c.82]
При эго.м в объеме кристалла возникают вакансии. Черный оксид нтн сля проводит электрический тoк 1ак как электроны. могут легко переходить от к N1 + [c.82]
Из фторобериллатов наиболее важны соединения состава М2 Вер4(1М11Вер4) и М ВеРз. Фторобериллаты — комплексы, содержащие в кристаллической решетке ион Вер42 с тетраэдрической конфигурацией ионов фтора. [c.26]
Жан Дюран, пропустив сухой ацетилен над нагретым до 450 °С порошком бериллия, получил черные кристаллы карбида бериллия другого состава — ВеСд. Впрочем, черный цвет скорее всего был вызван примесью углерода, который одновременно выделялся при термическом разложении ацетилена. Позже установили, что карбид Лебо содержит в кристаллической решетке ионы Ве и С , а карбид Дюрана — ионы Ве и С . Как эти карбиды будут реагировать с водой [c.158]
В табл. 6.1 с)пммированы результаты современных исследований природы окраски кристаллов кварца. Коричневые синтетические камни, напоминающие природный цитрин, были получены добавлением в гидротермальный раствор соединений железа, причем затравочные пластины вырезались в специально выбранных направлениях. Предполагают, что коричневая окраска обусловлена или вхождением в кристаллическую решетку ионов трехвалентного железа, или тонко-дисперсньоми силикатами железа, присутствующими в виде очень мелких частичек внутри кристалла кварца. Зеленые камни получают нагреванием коричневых разновидностей для восстановления трехвалентного железа до двухвалентного опять же или в кристаллической решетке, нлн в тонкоднсперсных частичках. Прн радиоактивном облучении (например, когда в качестве источника излучения используют кобальт-60) кварц приобретает фиолетовую окраску, характерную [c.111]
Предполагают, что коричневая окраска обусловлена или вхождением в кристаллическую решетку ионов трехвалентного железа, или тонко-дисперсньоми силикатами железа, присутствующими в виде очень мелких частичек внутри кристалла кварца. Зеленые камни получают нагреванием коричневых разновидностей для восстановления трехвалентного железа до двухвалентного опять же или в кристаллической решетке, нлн в тонкоднсперсных частичках. Прн радиоактивном облучении (например, когда в качестве источника излучения используют кобальт-60) кварц приобретает фиолетовую окраску, характерную [c.111]
Французский химик Поль Лебо в 1895 г впервые получил карбид бериллия при взаимодействии оксида бериллия с углем Лебо спрессо вал из смеси ВеО и С таблетки и нагрел их в атмосфере водорода при 1900 °С По окончании реакции образовались красивые кирпично-крас ные кристаллы B g Позднее, в 1924 г, другой французский химик — Жан Дюран, пропустив сухой ацетилен над нагретым до 450 °С порош ком бериллия, получил черные кристаллы карбида бериллия другого состава — Be g Впрочем, черный цвет скорее всего был вызван при месью углерода, который одновременно выделялся при термическом разложении ацетилена Позже установили, что карбид Лебо содержит в кристаллической решетке ионы Ве и а карбид Дюрана — ионы Ве и С Как эти карбиды будут реагировать с водой [c. 158]
158]
Ионные реакции (см. 7.6), как следует из их названия, протекают при участии ионов, причем такие ионы должны быть более или менее подвижными. Ионные реакции ие могут протекать между связанными ионами, которые на ходятся в узлах кристаллической решетки ионных соединений. Свободные, т. е. достаточно подвижные ионы, необходимые для проведения ионных реакций, появляются только в расплавах или в растворах вследствие электролиТи ческой диссоциации расплавленных или растворенных вешеств. [c.166]
Механизм процесса появления свободных ионов в растворе несколько иной, что обусловлено другой причиной разрыва связей в кристаллической решетке ионных соединений. Разрушение ионной решетки происходит под воздействием растворителя, например воды. Полярныг молекулы воды (см. 6.7) настолько понижают силы электростатического притяжения между ионами в решетке, что ионы становятся свободными и переходят в раствор. Таким образом, процесс растворения в воде ионных веществ обязательно сопровождается распадом иа составляющие их ионы. Получающиеся растворы также обладают электропроводимостью. [c.166]
Получающиеся растворы также обладают электропроводимостью. [c.166]
Органические производные природных глин-бентонитов обладают высокой селективностью при отделении ароматических УВ от алифатических. Бентонитовая глина относится к группе монтморил-лонитовых, содержит в кристаллической решетке ионы, способные замещаться. Эти глины с успехом могут применяться для разделения м- и -ксилолов (отношение удерживаемых объемов разделяемых компонентов в этом случае составляет 1,26—1,40). [c.233]
Тест,тест,тест,тест,тест — Docsity
1. Немолекулярное строение имеет: 1) фуллерен, 2) алмаз, 3) вода, 4) углекислый газ. 2. Немолекулярное строение имеет: 1) железо, 2) водород, 3) кислород, 4) угарный газ. 3. Ионную кристаллическую решетку имеет: 1) бромид калия, 2) бром, 3) калий, 4) бромоводород. 4. Молекулярную кристаллическую решетку имеет: 1) литий, 2) оксид натрия, 3) красный фосфор, 4) белый фосфор. 5. Молекулярную кристаллическую решетку имеет: 1) фторид серы (VI),VI),), 2) сульфид натрия, 3) графит, 4) натрий. 6. Молекулярное строение имеет: 1) йод, 2) йодид калия, 3) гидроксид калия, 4) гидроксид алюминия. 7. Немолекулярное строение имеет: 1) йод, 2) хлорид йода, 3) гидроксид калия, 4) уксусная кислота. 8. Немолекулярное строение имеет: 1) цинк, 2) муравьиная кислота, 3) фтороводород, 4) кислород. 9. Молекулярную кристаллическую решетку в твердом состоянии имеет: 1) иодид бария, 2) гидроксид бария, 3) барий, 4) йод. 10. Ионную кристаллическую решетку имеет: 1) фтор, 2) фтороводород, 3) гидрид натрия, 4) хлорид титана(VI),I),V). 11. Молекулярное строение имеет: 1) оксид кремния(VI),I),V), 2) нитрат бария, 3) хлорид натрия, 4) оксид углерода(VI),I),I),). 12. Молекулярную кристаллическую решетку имеют: 1) h3O, CuO, 2) CuO, K2S, 3) K2S, h3SO4, 4) h3SO4, O2. 13. Атомную кристаллическую решетку имеет: 1) графит, 2) железо, 3) карбонат кальция, 4) азотная кислота. 14. Ионную кристаллическую решетку имеет: 1) фторид кальция, 2) оксид кремния, 3) алмаз, 4) медь. 15. Вещество, имеющее низкую температуру плавления, возгоняющееся при нагревании, неэлектропроводное – имеет кристаллическую решетку: 1) ионную, 2) металлическую, 3) молекулярную, 4) атомную.
6. Молекулярное строение имеет: 1) йод, 2) йодид калия, 3) гидроксид калия, 4) гидроксид алюминия. 7. Немолекулярное строение имеет: 1) йод, 2) хлорид йода, 3) гидроксид калия, 4) уксусная кислота. 8. Немолекулярное строение имеет: 1) цинк, 2) муравьиная кислота, 3) фтороводород, 4) кислород. 9. Молекулярную кристаллическую решетку в твердом состоянии имеет: 1) иодид бария, 2) гидроксид бария, 3) барий, 4) йод. 10. Ионную кристаллическую решетку имеет: 1) фтор, 2) фтороводород, 3) гидрид натрия, 4) хлорид титана(VI),I),V). 11. Молекулярное строение имеет: 1) оксид кремния(VI),I),V), 2) нитрат бария, 3) хлорид натрия, 4) оксид углерода(VI),I),I),). 12. Молекулярную кристаллическую решетку имеют: 1) h3O, CuO, 2) CuO, K2S, 3) K2S, h3SO4, 4) h3SO4, O2. 13. Атомную кристаллическую решетку имеет: 1) графит, 2) железо, 3) карбонат кальция, 4) азотная кислота. 14. Ионную кристаллическую решетку имеет: 1) фторид кальция, 2) оксид кремния, 3) алмаз, 4) медь. 15. Вещество, имеющее низкую температуру плавления, возгоняющееся при нагревании, неэлектропроводное – имеет кристаллическую решетку: 1) ионную, 2) металлическую, 3) молекулярную, 4) атомную. 16. Твердое, хрупкое вещество, расплав которого проводит электрический ток – имеет кристаллическую решетку: 1) ионную, 2) металлическую, 3) молекулярную, 4) атомную 17. Вещество, имеющее высокую электропроводность, ковкое, пластичное, имеет кристаллическую решетку: 1) ионную, 2) металлическую, 3) молекулярную, 4) атомную. 18. Тугоплавкое хрупкое вещество, нерастворимое в воде, имеет кристаллическую решетку: 1) ионную, 2) металлическую, 3) молекулярную, 4) атомную 19. Атом является структурной единицей в кристаллической решетке: 1) фосфорной кислоты, 2) белого фосфора, 3) кремнезема, 4) хлорида аммония. 20. В кристалле вольфрама частицы связаны металлической связью, поэтому вольфрам: 1) тугоплавок, 2) химически стоек, 3) электропроводен, 4) имеет высокую плотность. 21. Ионный тип кристаллической решетки характерен для: 1) кислот, 2) металлов, 3) неметаллов, 4) солей. 22. Из молекул состоит каждое из веществ: 1) поваренная соль и кислород, 2) оксид магния и хлороводород, 3) вода и хлор, 4) алмаз и сода.
16. Твердое, хрупкое вещество, расплав которого проводит электрический ток – имеет кристаллическую решетку: 1) ионную, 2) металлическую, 3) молекулярную, 4) атомную 17. Вещество, имеющее высокую электропроводность, ковкое, пластичное, имеет кристаллическую решетку: 1) ионную, 2) металлическую, 3) молекулярную, 4) атомную. 18. Тугоплавкое хрупкое вещество, нерастворимое в воде, имеет кристаллическую решетку: 1) ионную, 2) металлическую, 3) молекулярную, 4) атомную 19. Атом является структурной единицей в кристаллической решетке: 1) фосфорной кислоты, 2) белого фосфора, 3) кремнезема, 4) хлорида аммония. 20. В кристалле вольфрама частицы связаны металлической связью, поэтому вольфрам: 1) тугоплавок, 2) химически стоек, 3) электропроводен, 4) имеет высокую плотность. 21. Ионный тип кристаллической решетки характерен для: 1) кислот, 2) металлов, 3) неметаллов, 4) солей. 22. Из молекул состоит каждое из веществ: 1) поваренная соль и кислород, 2) оксид магния и хлороводород, 3) вода и хлор, 4) алмаз и сода. 23. Атомную кристаллическую решетку имеет каждое из веществ: 1) алмаз и графит, 2) аммиак и йод, 3) озон и кислород, 4) вода и мел. 24. Ионную кристаллическую решетку имеет каждое из веществ: 1) серная кислота и оксид углерода(VI),I),V), 2) гидроксид натрия и хлорид калия, 3) карбонат кальция и хлороводород, 4) оксид кремния и гидроксид меди(VI),I),I),). 25. Верны ли следующие суждения о типах кристаллических решеток веществ в твердом состоянии? А) этанол имеет ионную кристаллическую решетку. Б) йод имеет молекулярную кристаллическую решетку. 1) верно только А, 2) верно только Б, 3) верны оба суждения, 4) оба суждения неверны. 26. Какие свойства характерны для вещества с атомной кристаллической решеткой? 1) нерастворимость в воде и тугоплавкость, 2) хрупкость и легкоплавкость, 3) растворимость в воде и летучесть, 4) хорошая тепло- и электропроводность. 27. В твердых веществах молекулярного строения химическая связь: 1) ковалентная, 2) металлическая, 3) ионная, 4) водородная 28. В твердых веществах атомного строения химическая связь между атомами: 1) ковалентная, 2) металлическая, 3) ионная, 4) водородная 29.
23. Атомную кристаллическую решетку имеет каждое из веществ: 1) алмаз и графит, 2) аммиак и йод, 3) озон и кислород, 4) вода и мел. 24. Ионную кристаллическую решетку имеет каждое из веществ: 1) серная кислота и оксид углерода(VI),I),V), 2) гидроксид натрия и хлорид калия, 3) карбонат кальция и хлороводород, 4) оксид кремния и гидроксид меди(VI),I),I),). 25. Верны ли следующие суждения о типах кристаллических решеток веществ в твердом состоянии? А) этанол имеет ионную кристаллическую решетку. Б) йод имеет молекулярную кристаллическую решетку. 1) верно только А, 2) верно только Б, 3) верны оба суждения, 4) оба суждения неверны. 26. Какие свойства характерны для вещества с атомной кристаллической решеткой? 1) нерастворимость в воде и тугоплавкость, 2) хрупкость и легкоплавкость, 3) растворимость в воде и летучесть, 4) хорошая тепло- и электропроводность. 27. В твердых веществах молекулярного строения химическая связь: 1) ковалентная, 2) металлическая, 3) ионная, 4) водородная 28. В твердых веществах атомного строения химическая связь между атомами: 1) ковалентная, 2) металлическая, 3) ионная, 4) водородная 29. Некоторое вещество тугоплавко и не проводит электрический ток ни в твердом виде, ни в расплаве. Какую кристаллическую решетку оно имеет? 1) атомную, 2) молекулярную, 3) ионную, 4) металлическую. 30. Некоторое вещество тугоплавко и не проводит электрический ток в твердом виде, но его водный раствор обладает электрической проводимостью. Какую кристаллическую решетку имеет это вещество? 1) атомную, 2) молекулярную, 3) ионную, 4) металлическую. 31. Выберите вещество, которое в твердом состоянии имеет молекулярную кристаллическую решетку: 1) С (VI),графит), 2) SiO2, 3) SiC, 4) CO2 32. Выберите вещество, которое в твердом состоянии имеет атомную кристаллическую решетку: 1) SiO2, 2) Sih5, 3) O2, 4) Na. 33. Выберите вещество, которое в твердом состоянии имеет ионную кристаллическую решетку: 1) N2O5, 2) HNO3, 3) Nh5NO3, 4) Nh4. 34. Какое свойство характерно для веществ с атомной кристаллической решеткой? 1) высокая плотность, 2) тугоплавкость, 3) хорошая растворимость в воде, 4) электропроводность.
Некоторое вещество тугоплавко и не проводит электрический ток ни в твердом виде, ни в расплаве. Какую кристаллическую решетку оно имеет? 1) атомную, 2) молекулярную, 3) ионную, 4) металлическую. 30. Некоторое вещество тугоплавко и не проводит электрический ток в твердом виде, но его водный раствор обладает электрической проводимостью. Какую кристаллическую решетку имеет это вещество? 1) атомную, 2) молекулярную, 3) ионную, 4) металлическую. 31. Выберите вещество, которое в твердом состоянии имеет молекулярную кристаллическую решетку: 1) С (VI),графит), 2) SiO2, 3) SiC, 4) CO2 32. Выберите вещество, которое в твердом состоянии имеет атомную кристаллическую решетку: 1) SiO2, 2) Sih5, 3) O2, 4) Na. 33. Выберите вещество, которое в твердом состоянии имеет ионную кристаллическую решетку: 1) N2O5, 2) HNO3, 3) Nh5NO3, 4) Nh4. 34. Какое свойство характерно для веществ с атомной кристаллической решеткой? 1) высокая плотность, 2) тугоплавкость, 3) хорошая растворимость в воде, 4) электропроводность. 35. Один и тот же тип решетки в кристаллическом состоянии имеют: 1) хлор и водород, 2) вода и алюминий, 3) поваренная соль и серная кислота, 4) кремнезем и гидроксид натрия. 36. Запахом обладают вещества, имеющие кристаллическую решетку: 1) атомную, 2) молекулярную, 3) ионную, 4) металлическую. 37. Молекулярную решетку в кристаллическом состоянии имеет: 1) хлорид натрия, 2) хлор, 3) натрий, 4) гидроксид натрия. 38. Хлорид-ионы отсутствую в кристаллах: 1) хлорида натрия, 2) хлорида кальция, 3) хлорида фосфора(VI),V), 4) хлорида цезия. 39. Ионную кристаллическую решетку в кристаллическом состоянии имеет: 1) бром, 2) вода, 3) серная кислота, 4) карбонат натрия. 40. Металлическую кристаллическую решетку имеет: 1) Nh4, 2) AlCl3, 3) Cu3Al, 4) CuO.
35. Один и тот же тип решетки в кристаллическом состоянии имеют: 1) хлор и водород, 2) вода и алюминий, 3) поваренная соль и серная кислота, 4) кремнезем и гидроксид натрия. 36. Запахом обладают вещества, имеющие кристаллическую решетку: 1) атомную, 2) молекулярную, 3) ионную, 4) металлическую. 37. Молекулярную решетку в кристаллическом состоянии имеет: 1) хлорид натрия, 2) хлор, 3) натрий, 4) гидроксид натрия. 38. Хлорид-ионы отсутствую в кристаллах: 1) хлорида натрия, 2) хлорида кальция, 3) хлорида фосфора(VI),V), 4) хлорида цезия. 39. Ионную кристаллическую решетку в кристаллическом состоянии имеет: 1) бром, 2) вода, 3) серная кислота, 4) карбонат натрия. 40. Металлическую кристаллическую решетку имеет: 1) Nh4, 2) AlCl3, 3) Cu3Al, 4) CuO.
Кристаллические решетки. Гексагональная тирания Тип кристаллической решетки сухого льда
Как мы знаем, все материальные вещества могут пребывать в трех базовых состояниях: жидком, твердом, и газообразном. Правда есть еще состояние плазмы, которое ученые считают ни много ни мало четвертым состоянием вещества, но наша статья не о плазме. Твердое состояние вещества потому твердое, так как имеет особую кристаллическую структуру, частицы которой находятся в определенном и четко заданном порядке, создавая, таким образом, кристаллическую решетку. Строение кристаллической решетки состоит из повторяющихся одинаковых элементарных ячеек: атомов, молекул, ионов, других элементарных частиц, связанных между собой различными узлами.
Твердое состояние вещества потому твердое, так как имеет особую кристаллическую структуру, частицы которой находятся в определенном и четко заданном порядке, создавая, таким образом, кристаллическую решетку. Строение кристаллической решетки состоит из повторяющихся одинаковых элементарных ячеек: атомов, молекул, ионов, других элементарных частиц, связанных между собой различными узлами.
Виды кристаллических решеток
В зависимости от частиц кристаллической решетки существует четырнадцать типов оной, приведем наиболее популярные из них:
- Ионная кристаллическая решетка.
- Атомная кристаллическая решетка.
- Молекулярная кристаллическая решетка.
- кристаллическая решетка.
Ионная кристаллическая решетка
Главной особенностью строения кристаллической решетки ионов являются противоположные электрические заряды, собственно, ионов, вследствие чего образуется электромагнитное поле, определяющее свойства веществ, имеющих ионную кристаллическую решетку. А это тугоплавкость, твердость, плотность и возможность проводить электрический ток. Характерным примером ионной кристаллической решетки может быть поваренная соль.
А это тугоплавкость, твердость, плотность и возможность проводить электрический ток. Характерным примером ионной кристаллической решетки может быть поваренная соль.
Атомная кристаллическая решетка
Вещества с атомной кристаллической решеткой, как правило, имеют в своих узлах, состоящих собственно из атомов сильные . Ковалентная связь происходит, когда два одинаковых атома делятся друг с другом по-братски электронами, образуя, таким образом, общую пару электронов для соседних атомов. Из-за этого ковалентные связи сильно и равномерно связывают атомы в строгом порядке – пожалуй, это самая характерная черта строения атомной кристаллической решетки. Химические элементы с подобными связями могут похвастаться своей твердостью, высокой температурой . Атомную кристаллическую решетку имеют такие химические элементы как алмаз, кремний, германий, бор.
Молекулярная кристаллическая решетка
Молекулярный тип кристаллической решетки характеризуется наличием устойчивых и плотноупакованных молекул. Они располагаются в узлах кристаллической решетки. В этих узлах они удерживаются такими себе вандервальсовыми силами, которые в десять раз слабее сил ионного взаимодействия. Ярким примером молекулярной кристаллической решетки является лед – твердое вещество, имеющее однако свойство переходить в жидкое – связи между молекулами кристаллической решетки совсем слабенькие.
Они располагаются в узлах кристаллической решетки. В этих узлах они удерживаются такими себе вандервальсовыми силами, которые в десять раз слабее сил ионного взаимодействия. Ярким примером молекулярной кристаллической решетки является лед – твердое вещество, имеющее однако свойство переходить в жидкое – связи между молекулами кристаллической решетки совсем слабенькие.
Металлическая кристаллическая решетка
Тип связи металлической кристаллической решетки гибче и пластичнее ионной, хотя внешне они весьма похожи. Отличительной особенностью ее является наличие положительно заряженных катионов (ионов метала) в узлах решетки. Между узлами живут электроны, участвующие в создании электрического поля, эти электроны еще называются электрическим газом. Наличие такой структуры металлической кристаллической решетки объясняет ее свойства: механическую прочность, тепло и электропроводность, плавкость.
Кристаллические решетки, видео
И в завершение подробное видео пояснения о свойствах кристаллических решеток.
Вещество, как вам известно, может существовать в трёх агрегатных состояниях: газообразном, жидком и твёрдом (рис. 70). Например, кислород, который при обычных условиях представляет собой газ, при температуре -194 °С превращается в жидкость голубого цвета, а при температуре -218,8 °С затвердевает в снегообразную массу, состоящую из кристаллов синего цвета.
Рис. 70.
Агрегатные состояния воды
Твёрдые вещества делят на кристаллические и аморфные.
Аморфные вещества не имеют чёткой температуры плавления — при нагревании они постепенно размягчаются и переходят в текучее состояние. К аморфным веществам относится большинство пластмасс (например, полиэтилен), воск, шоколад, пластилин, различные смолы и жевательные резинки (рис. 71).
Рис. 71.
Аморфные вещества и материалы
Кристаллические вещества характеризуются правильным расположением составляющих их частиц в строго определённых точках пространства. При соединении этих точек прямыми линиями образуется пространственный каркас, называемый кристаллической решёткой. Точки, в которых размещены частицы кристалла, называют узлами решётки.
Точки, в которых размещены частицы кристалла, называют узлами решётки.
В узлах воображаемой кристаллической решётки могут находиться одноатомные ионы, атомы, молекулы. Эти частицы совершают колебательные движения. С повышением температуры размах этих колебаний возрастает, что приводит, как правило, к тепловому расширению тел.
В зависимости от типа частиц, расположенных в узлах кристаллической решётки, и характера связи между ними различают четыре типа кристаллических решёток: ионные, атомные, молекулярные и металлические (табл. 6).
Таблица 6
Положение элементов в Периодической системе Д. И. Менделеева и типы кристаллических решёток их простых веществ
Простые вещества, образованные элементами, не представленными в таблице, имеют металлическую решётку.
Ионными называют кристаллические решётки, в узлах которых находятся ионы. Их образуют вещества с ионной связью, которой могут быть связаны как простые ионы Na + , Cl — , так и сложные , ОН — . Следовательно, ионные кристаллические решётки имеют соли, основания (щёлочи), некоторые оксиды. Например, кристалл хлорида натрия построен из чередующихся положительных ионов Na + и отрицательных Сl — , образующих решётку в форме куба (рис. 72). Связи между ионами в таком кристалле очень прочны. Поэтому вещества с ионной решёткой обладают сравнительно высокой твёрдостью и прочностью, они тугоплавки и нелетучи.
Следовательно, ионные кристаллические решётки имеют соли, основания (щёлочи), некоторые оксиды. Например, кристалл хлорида натрия построен из чередующихся положительных ионов Na + и отрицательных Сl — , образующих решётку в форме куба (рис. 72). Связи между ионами в таком кристалле очень прочны. Поэтому вещества с ионной решёткой обладают сравнительно высокой твёрдостью и прочностью, они тугоплавки и нелетучи.
Рис. 72.
Ионная кристаллическая решётка (хлорид натрия)
Атомными называют кристаллические решётки, в узлах которых находятся отдельные атомы. В таких решётках атомы соединены между собой очень прочными ковалентными связями.
Рис. 73.
Атомная кристаллическая решётка (алмаз)
Такой тип кристаллической решётки имеет алмаз (рис. 73) — одно из аллотропных видоизменений углерода. Огранённые и отшлифованные алмазы называют бриллиантами. Их широко применяют в ювелирном деле (рис. 74).
Рис. 74.
Две императорские короны с алмазами:
а — корона Британской империи; б — Большая императорская корона Российской империи
К веществам с атомной кристаллической решёткой относятся кристаллические бор, кремний и германий, а также сложные вещества, например такие, как кремнезем, кварц, песок, горный хрусталь, в состав которых входит оксид кремния (IV) SiO 2 (рис. 75).
75).
Рис. 75.
Атомная кристаллическая решётка (оксид кремния (IV))
Большинство веществ с атомной кристаллической решёткой имеют очень высокие температуры плавления (например, у алмаза она свыше 3500 °С, у кремния — 1415 °С, у кремнезёма — 1728 °С), они прочны и тверды, практически нерастворимы.
Молекулярными называют кристаллические решётки, в узлах которых располагаются молекулы. Химические связи в этих молекулах могут быть и ковалентными полярными (хлороводород НСl, вода Н 2 0), и ковалентными неполярными (азот N 2 , озон 0 3). Несмотря на то что атомы внутри молекул связаны очень прочными ковалентными связями, между самими молекулами действуют слабые силы межмолекулярного притяжения. Поэтому вещества с молекулярными кристаллическими решётками имеют малую твёрдость, низкие температуры плавления, летучи.
Примерами веществ с молекулярными кристаллическими решётками являются твёрдая вода — лёд, твёрдый оксид углерода (IV) С) 2 — «сухой лёд» (рис. 76), твёрдые хлороводород НСl и сероводород H 2 S, твёрдые простые вещества, образованные одно- (благородные газы: гелий, неон, аргон, криптон), двух- (водород Н 2 , кислород O 2 , хлор Сl 2 , азот N 2 , иод 1 2), трёх- (озон O 3), четырёх- (белый фосфор Р 4), восьмиатомными (сера S 7) молекулами. Большинство твёрдых органических соединений имеют молекулярные кристаллические решётки (нафталин, глюкоза, сахар).
76), твёрдые хлороводород НСl и сероводород H 2 S, твёрдые простые вещества, образованные одно- (благородные газы: гелий, неон, аргон, криптон), двух- (водород Н 2 , кислород O 2 , хлор Сl 2 , азот N 2 , иод 1 2), трёх- (озон O 3), четырёх- (белый фосфор Р 4), восьмиатомными (сера S 7) молекулами. Большинство твёрдых органических соединений имеют молекулярные кристаллические решётки (нафталин, глюкоза, сахар).
Рис. 76.
Молекулярная кристаллическая решётка (углекислый газ)
Вещества с металлической связью имеют металлические кристаллические решётки (рис. 77). В узлах таких решёток находятся атомы и ионы (то атомы, то ионы, в которые легко превращаются атомы металла, отдавая свои внешние электроны в общее пользование). Такое внутреннее строение металлов определяет их характерные физические свойства: ковкость, пластичность, электро- и теплопроводность, металлический блеск.
Рис. 77.
Металлическая кристаллическая решётка (железо)
Лабораторный опыт № 13
Ознакомление с коллекцией веществ с разным типом кристаллической решётки.
 Изготовление моделей кристаллических решёток
Изготовление моделей кристаллических решётокДля веществ, имеющих молекулярное строение, справедлив открытый французским химиком Ж. Л. Прустом (1799-1803) закон постоянства состава. В настоящее время этот закон формулируют так:
Закон Пруста — один из основных законов химии. Однако для веществ немолекулярного строения, например ионного, этот закон не всегда справедлив.
Ключевые слова и словосочетания
- Твёрдое, жидкое и газообразное состояния вещества.
- Твёрдые вещества: аморфные и кристаллические.
- Кристаллические решётки: ионные, атомные, молекулярные и металлические.
- Физические свойства веществ с различными типами кристаллических решёток.
- Закон постоянства состава.
Работа с компьютером
- Обратитесь к электронному приложению. Изучите материал урока и выполните предложенные задания.
- Найдите в Интернете электронные адреса, которые могут служить дополнительными источниками, раскрывающими содержание ключевых слов и словосочетаний параграфа.
 Предложите учителю свою помощь в подготовке нового урока — сделайте сообщение по ключевым словам и словосочетаниям следующего параграфа.
Предложите учителю свою помощь в подготовке нового урока — сделайте сообщение по ключевым словам и словосочетаниям следующего параграфа.
Вопросы и задания
- В каком агрегатном состоянии будет находиться кислород при -205 °С?
- Вспомните произведение А. Беляева «Продавец воздуха» и охарактеризуйте свойства твёрдого кислорода, используя его описание, приведённое в книге.
- К какому типу веществ (кристаллические или аморфные) относятся пластмассы? Какие свойства пластмасс лежат в основе их промышленного применения?
- К какому типу относится кристаллическая решетка алмаза? Перечислите характерные для алмаза физические свойства.
- К какому типу относится кристаллическая решетка иода? Перечислите характерные для иода физические свойства.
- Почему температура плавления металлов изменяется в очень широких пределах? Для подготовки ответа на этот вопрос используйте дополнительную литературу.
- Почему изделие из кремния при ударе раскалывается на кусочки, а изделие из свинца только расплющивается? В каком из указанных случаев происходит разрушение химической связи, а в каком — нет? Почему?
Вода — вещество привычное и необычное.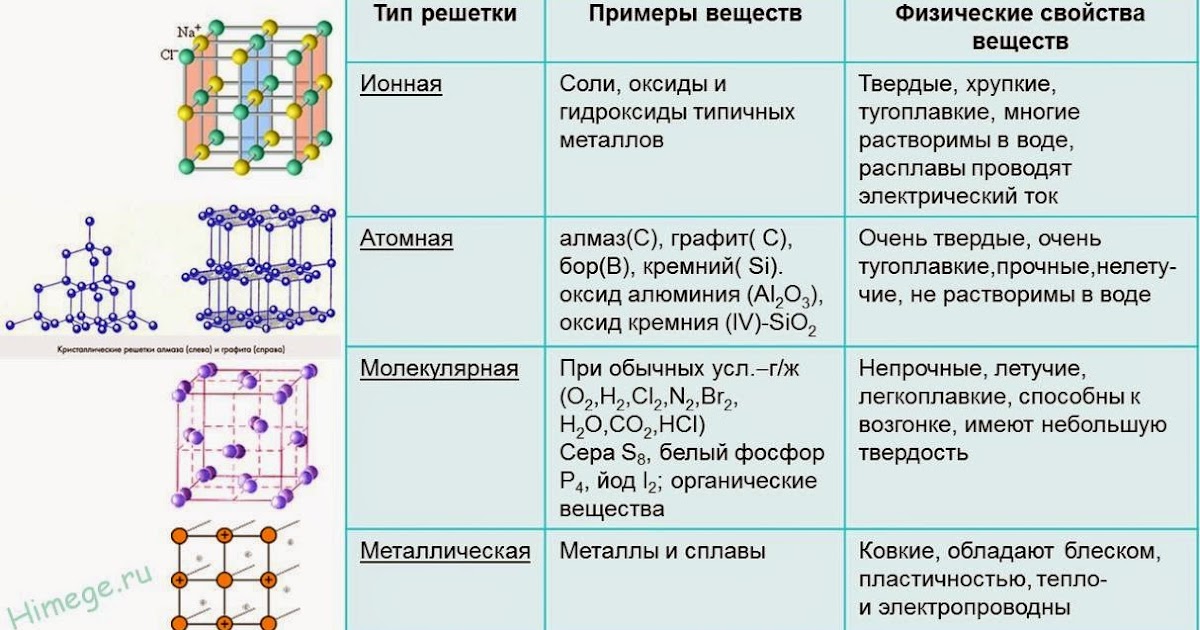 Почти 3/4 поверхности нашей
планеты занято океанами и морями. Твёрдой водой — снегом и льдом —
покрыто 20% суши. От воды зависит климат планеты. Геофизики утверждают,
что Земля давно бы остыла и превратилась в безжизненный кусок камня, если бы не вода. У неё очень большая теплоёмкость. Нагреваясь, она поглощает тепло;
остывая, отдаёт его. Земная вода и поглощает, и возвращает очень много
тепла и тем самым «выравнивает» климат. А от космического холода
предохраняет Землю те молекулы воды, которые рассеяны в атмосфере — в
облаках и в виде паров.
Почти 3/4 поверхности нашей
планеты занято океанами и морями. Твёрдой водой — снегом и льдом —
покрыто 20% суши. От воды зависит климат планеты. Геофизики утверждают,
что Земля давно бы остыла и превратилась в безжизненный кусок камня, если бы не вода. У неё очень большая теплоёмкость. Нагреваясь, она поглощает тепло;
остывая, отдаёт его. Земная вода и поглощает, и возвращает очень много
тепла и тем самым «выравнивает» климат. А от космического холода
предохраняет Землю те молекулы воды, которые рассеяны в атмосфере — в
облаках и в виде паров.
Вода – самое загадочное вещество в природе после ДНК, обладающее уникальными свойствами, которые не только ещё полностью не
объяснены, но далеко не все известны. Чем дольше ее изучают, тем больше
находят новых аномалий и загадок в ней. Большинство из этих аномалий,
обеспечивающих возможность жизни на Земле, объясняются наличием между
молекулами воды водородных связей, которые много сильнее
вандерваальсовских сил притяжения между молекулами других веществ, но на
порядок величины слабее ионных и ковалентных связей между атомами в
молекулах. Такие же водородные связи также присутствуют и в молекуле
ДНК.
Такие же водородные связи также присутствуют и в молекуле
ДНК.
Молекула воды (H 2 16 O) состоит из двух атомов водорода (H) и одного атома кислорода (16 O). Оказывается, что едва ли не все многообразие свойств воды и необычность их проявления определяется, в конечном счете, физической природой этих атомов, способом их объединения в молекулу и группировкой образовавшихся молекул.
Рис. Строение молекулы воды . Геометрическая схема (а), плоская модель (б) и пространственная электронная структура (в) мономера h3O. Два из четырех электронов внешней оболочки атома кислорода участвуют в создании ковалентных связей с атомами водорода, а два других образуют сильно вытянутые электронные орбиты, плоскость которых перпендикулярна плоскости Н-О-Н.
Молекула воды H 2 O
построена в виде треугольника: угол между двумя связками кислород —
водород 104 градуса. Но поскольку оба водородных атома расположены по
одну сторону от кислорода, электрические заряды в ней
рассредоточиваются. Молекула воды полярная, что является причиной
особого взаимодействия между разными её молекулами. Атомы водорода в
молекуле H 2 O, имея частичный положительный заряд,
взаимодействуют с электронами атомов кислорода соседних молекул. Такая
химическая связь называется водородной. Она объединяет молекулы H 2 O
в своеобразные ассоциаты пространственного строения; плоскость, в
которой расположены водородные связи, перпендикулярны плоскости атомов
той же молекулы H 2 O. Взаимодействием между молекулами воды и
объясняются в первую очередь незакономерно высокие температуры её
плавления и кипения. Нужно подвести дополнительную энергию, чтобы
расшатать, а затем разрушить водородные связи. И энергия эта очень
значительна. Вот почему так велика теплоёмкость воды.
Молекула воды полярная, что является причиной
особого взаимодействия между разными её молекулами. Атомы водорода в
молекуле H 2 O, имея частичный положительный заряд,
взаимодействуют с электронами атомов кислорода соседних молекул. Такая
химическая связь называется водородной. Она объединяет молекулы H 2 O
в своеобразные ассоциаты пространственного строения; плоскость, в
которой расположены водородные связи, перпендикулярны плоскости атомов
той же молекулы H 2 O. Взаимодействием между молекулами воды и
объясняются в первую очередь незакономерно высокие температуры её
плавления и кипения. Нужно подвести дополнительную энергию, чтобы
расшатать, а затем разрушить водородные связи. И энергия эта очень
значительна. Вот почему так велика теплоёмкость воды.
В молекуле воды имеются две полярные ковалентные связи Н–О. Они образованы за счёт перекрывания двух одноэлектронных р — облаков атома кислорода и одноэлектронных S — облаков двух атомов водорода.
В
соответствии с электронным строением атомов водорода и кислорода
молекула воды располагает четырьмя электронными парами. Две из них
участвуют в образовании ковалентных связей с двумя атомами водорода,
т.е. являются связывающими. Две другие электронные пары являются
свободными — не связывающими. Они образуют электронное облако. Облако
неоднородно – в нем можно различить отдельные сгущения и разрежения.
Две из них
участвуют в образовании ковалентных связей с двумя атомами водорода,
т.е. являются связывающими. Две другие электронные пары являются
свободными — не связывающими. Они образуют электронное облако. Облако
неоднородно – в нем можно различить отдельные сгущения и разрежения.
В молекуле воды имеются четыре полюс зарядов: два — положительные и два — отрицательные. Положительные заряды сосредоточены у атомов водорода, так как кислород электроотрицательнее водорода. Два отрицательных полюса приходятся на две не связывающие электронные пары кислорода.
У
кислородного ядра создается избыток электронной плотности. Внутренняя
электронная пара кислорода равномерно обрамляет ядро: схематически она
представлена окружностью с центром -ядром O 2- . Четыре внешних
электрона группируются в две электронные пары, тяготеющие к ядру, но
частично не скомпенсированные. Схематически суммарные электронные
орбитали этих пар показаны в виде эллипсов, вытянутых от общего центра –
ядра O 2- .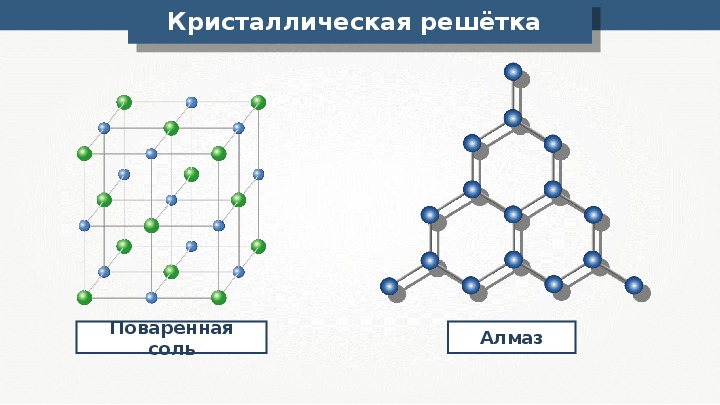 Каждый из оставшихся двух электронов кислорода
образует пару с одним электроном водорода. Эти пары также тяготеют к
кислородному ядру. Поэтому водородные ядра – протоны – оказываются
несколько оголенными, и здесь наблюдается недостаток электронной
плотности.
Каждый из оставшихся двух электронов кислорода
образует пару с одним электроном водорода. Эти пары также тяготеют к
кислородному ядру. Поэтому водородные ядра – протоны – оказываются
несколько оголенными, и здесь наблюдается недостаток электронной
плотности.
Таким образом, в молекуле воды различают четыре полюса зарядов: два отрицательных (избыток электронной плотности в области кислородного ядра) и два положительных (недостаток электронной плотности у двух водородных ядер). Для большей наглядности можно представить, что полюса занимают вершины деформированного тетраэдра, в центре которого находится ядро кислорода.
Рис. Строение молекулы воды: а – угол между связями O-H; б – расположение полюсов заряда; в – внешний вид электронного облака молекулы воды.
Почти
шарообразная молекула воды имеет заметно выраженную полярность, так как
электрические заряды в ней расположены асимметрично. Каждая молекула
воды является миниатюрным диполем с высоким дипольным моментом – 1,87
дебая. Дебай – внесистемная единица электрического дипольного 3,33564·10 30
Кл·м. Под воздействием диполей воды в 80 раз ослабевают межатомные или
межмолекулярные силы на поверхности погруженного в нее вещества. Иначе
говоря, вода имеет высокую диэлектрическую проницаемость, самую высокую
из всех известных нам соединений.
Дебай – внесистемная единица электрического дипольного 3,33564·10 30
Кл·м. Под воздействием диполей воды в 80 раз ослабевают межатомные или
межмолекулярные силы на поверхности погруженного в нее вещества. Иначе
говоря, вода имеет высокую диэлектрическую проницаемость, самую высокую
из всех известных нам соединений.
Во многом благодаря этому, вода проявляет себя как универсальный растворитель. Ее растворяющему действию в той или иной мере подвластны и твердые тела, и жидкости, и газы.
Удельная теплоемкость воды наибольшая среди всех веществ. Кроме того, она в 2 раза выше, чем у льда, в то время как у большинства простых веществ (например, металлов) в процессе плавления теплоемкость практически не изменяется, а у веществ из многоатомных молекул она, как правило, уменьшается при плавлении.
Подобное представление о
строении молекулы позволяет объяснить многие свойства воды, в частности
структуру льда. В кристаллической решётке льда каждая из молекул
окружена четырьмя другими. В плоскостном изображении это можно
представить так:
В плоскостном изображении это можно
представить так:
Связь между молекулами осуществляется посредством атома водорода. Положительно заряженный атом водорода одной молекулы воды притягивается к отрицательно заряженному атому кислорода другой молекулы воды. Такая связь получила название водородной (её обозначают точками). По прочности водородная связь примерно в 15 — 20 раз слабее ковалентной связи. Поэтому водородная связь легко разрывается, что наблюдается, например, при испарении воды.
Рис. слева — Водородные связи между молекулами воды
Структура жидкой воды напоминает структуру льда. В жидкой воде молекулы также связаны друг с другом посредством водородных связей, однако структура воды менее «жёсткая», чем у льда. Вследствие теплового движения молекул в воде одни водородные связи разрываются, другие образуются.
Рис. Кристаллическая решётка льда. Молекулы воды H 2 O (чёрные шарики) в её узлах расположены так, что каждая имеет четырёх „соседок».
Полярность молекул воды, наличие в них частично нескомпенсированных электрических зарядов порождает склонность к группировке молекул в укрупненные «сообщества» – ассоциаты. Оказывается, полностью соответствует формуле Н2O лишь вода, находящаяся в парообразном состоянии. Это показали результаты определения молекулярной массы водяного пара. В температурном интервале от 0 до 100°С концентрация отдельных (мономерных молекул) жидкой воды не превышает 1%. Все остальные молекулы воды объединены в ассоциаты различной степени сложности, и их состав описывается общей формулой (H 2 O)x.
Непосредственной причиной образования
ассоциатов являются водородные связи между молекулами воды. Они
возникают между ядрами водорода одних молекул и электронными
«сгущениями» у ядер кислорода других молекул воды. Правда, эти связи в
десятки раз слабее, чем «стандартные» внутримолекулярные химические
связи, и достаточно обычных движений молекул, чтобы разрушить их. Но под
влиянием тепловых колебаний так же легко возникают и новые связи этого
типа. Возникновение и распад ассоциатов можно выразить схемой:
Возникновение и распад ассоциатов можно выразить схемой:
x·H 2 O↔ (H 2 O) x
Поскольку электронные орбитали в каждой молекуле воды образуют тетраэдрическую структуру, водородные связи могут упорядочить расположение молекул воды в виде тетраэдрических координированных ассоциатов.
Большинство
исследователей объясняют аномально высокую теплоемкость жидкой воды тем,
что при плавлении льда его кристаллическая структура разрушается не
сразу. В жидкой воде сохраняются водородные связи между молекулами. В
ней остаются как бы обломки льда — ассоциаты из большого или меньшего
числа молекул воды. Однако в отличие от льда каждый ассоциат существует
недолго. Постоянно происходит разрушение одних и образование других
ассоциатов. При каждом значении температуры в воде устанавливается свое
динамическое равновесие в этом процессе. А при нагревании воды часть
теплоты затрачивается на разрыв водородных связей в ассоциатах. При этом
на разрыв каждой связи расходуется 0,26-0,5 эВ. Этим и объясняется
аномально высокая теплоемкость воды по сравнению с расплавами других
веществ, не образующих водородных связей. При нагревании таких расплавов
энергия расходуется только на сообщение тепловых движений их атомам или
молекулам. Водородные связи между молекулами воды полностью разрываются
только при переходе воды в пар. На правильность такой точки зрения
указывает и то обстоятельство, что удельная теплоемкость водяного пара
при 100°С практически совпадает с удельной теплоемкостью льда при 0°С.
При нагревании таких расплавов
энергия расходуется только на сообщение тепловых движений их атомам или
молекулам. Водородные связи между молекулами воды полностью разрываются
только при переходе воды в пар. На правильность такой точки зрения
указывает и то обстоятельство, что удельная теплоемкость водяного пара
при 100°С практически совпадает с удельной теплоемкостью льда при 0°С.
Рисунок ниже:
Элементарным структурным элементом ассоциата является кластер: Рис. Отдельный гипотетический кластер воды. Отдельные кластеры образуют ассоциаты молекул воды (H 2 O) x: Рис. Кластеры из молекул воды образуют ассоциаты.
Существует
и другая точка зрения на природу аномально высокой теплоемкости воды.
Профессор Г. Н. Зацепина заметила, что молярная теплоемкость воды,
составляющая 18 кал/(мольград), точно равна теоретической молярной
теплоемкости твердого тела с трехатомными кристаллами. А в соответствии с
законом Дюлонга и Пти атомные теплоемкости всех химически простых
(одноатомных) кристаллических тел при достаточно высокой температуре
одинаковы и равны 6 калДмоль o град).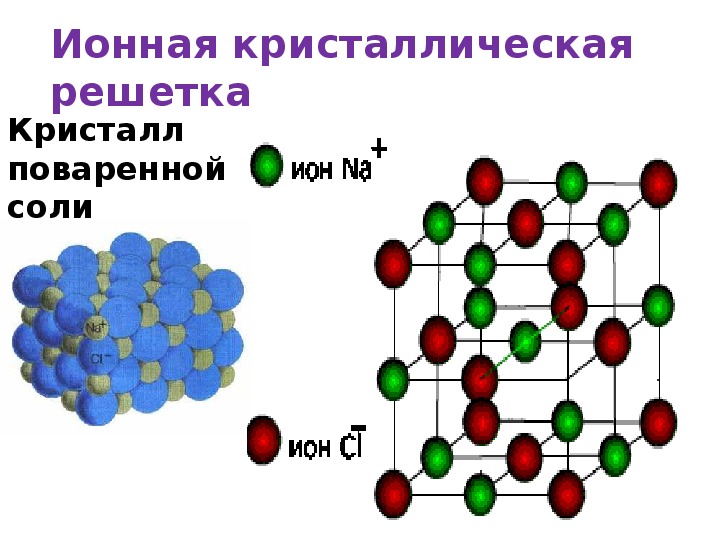 А для трехатомных, в граммоле
которых содержится 3 N а узлов кристаллической решетки, — в 3 раза больше. (Здесь N а — число Авогадро).
А для трехатомных, в граммоле
которых содержится 3 N а узлов кристаллической решетки, — в 3 раза больше. (Здесь N а — число Авогадро).
Отсюда следует, что вода является как бы кристаллическим телом, состоящим из трехатомных молекул Н 2 0. Это соответствует распространенному представлению о воде как смеси кристаллоподобных ассоциатов с небольшой примесью свободных молекул H 2 O воды между ними, число которых растет с повышением температуры. С этой точки зрения вызывает удивление не высокая теплоемкость жидкой воды, а низкая твердого льда. Уменьшение удельной теплоемкости воды при замерзании объясняется отсутствием поперечных тепловых колебаний атомов в жесткой кристаллической решетке льда, где у каждого протона, обуславливающего водородную связь, остается только одна степень свободы для тепловых колебаний вместо трех.
Но за счет чего и как могут
происходить столь большие изменения теплоемкости воды без
соответствующих изменений давления? Чтобы ответить на этот вопрос,
познакомимся с гипотезой кандидата геолого-минералогических наук Ю.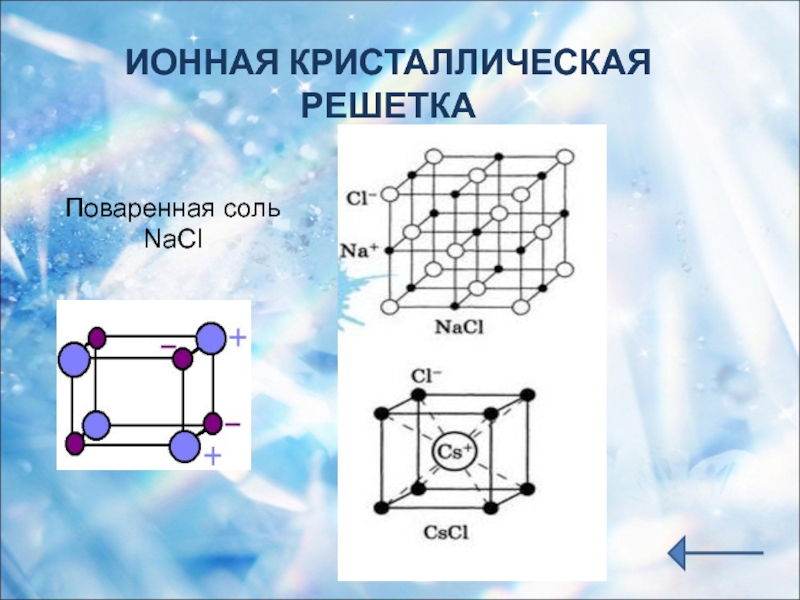 А. Колясникова о структуре воды.
А. Колясникова о структуре воды.
Он указывает, что еще первооткрыватели водородных связей Дж. Бернал и Р. Фаулер в 1932 г. сравнивали структуру жидкой воды с кристаллической структурой кварца, а те ассоциаты, о которых говорилось выше, — это в основном тетрамеры 4Н 2 0, в которых четыре молекулы воды соединены в компактный тетраэдр с двенадцатью внутренними водородными связями. В результате образуется четырёхгранная пирамида — тетраэдр.
При
этом, водородные связи в этих тетрамерах могут образовывать как право-
так и левовинтовую последовательности, подобно тому, как кристаллы
широко распространённого кварца (Si0 2), тоже имеющие
тетраэдрическую структуру, бывают право- и лево-вращательной
кристаллической форм. Поскольку каждый такой тетрамер воды имеет еще и
четыре незадействованные внешние водородные связи (как у одной молекулы
воды), то тетрамеры могут соединяться этими внешними связями в своего
рода полимерные цепочки, наподобие молекулы ДНК. А поскольку внешних
связей всего четыре, а внутренних — в 3 раза больше, то это позволяет
тяжелым и прочным тетрамерам в жидкой воде изгибать, поворачивать и даже
надламывать эти ослабленные тепловыми колебаниями внешние водородные
связи. Это и обуславливает текучесть воды.
Это и обуславливает текучесть воды.
Такую структуру вода, по мнению Колясникова, имеет только в жидком состоянии и, возможно, частично в парообразном. А вот во льду, кристаллическая структура, которого хорошо изучена, тетрагидроли соединены между собой негибкими равнопрочными прямыми водородными связями в ажурный каркас с большими пустотами в нем, что делает плотность льда меньше плотности воды.
Рис. Кристаллическая структура льда: молекулы воды соединены в правильные шестиугольники
Когда же лед тает, часть водородных связей в нем ослабевает и изгибается, что ведет к перестройке структуры в вышеописанные тетрамеры и делает жидкую воду более плотной, чем лед. При 4°С наступает состояние, когда все водородные связи между тетрамерами максимально изогнуты, чем и обуславливается максимум плотности воды при этой температуре. Дальше связям гнуться некуда.
При температуре выше 4°С начинается
разрывание отдельных связей между тетрамерами, и при 36-37°С оказывается
разорвана половина внешних водородных связей. Это и определяет минимум
на кривой зависимости удельной теплоемкости воды от температуры. При
температуре же 70°С разорваны уже почти все межтетрамерные связи, и
наряду со свободными тетрамерами в воде остаются только короткие обрывки
«полимерных» цепочек из них. Наконец при кипении воды происходит
окончательный разрыв теперь уже одиночных тетрамеров на отдельные
молекулы Н 2 0. И то обстоятельство, что удельная теплота
испарения воды ровно в 3 раза больше суммы удельных теплот плавления
льда и последующего нагрева воды до 100°С, является подтверждением
предположения Колясникова о том. что число внутренних связей в тетрамере
в 3 раза больше числа внешних.
Это и определяет минимум
на кривой зависимости удельной теплоемкости воды от температуры. При
температуре же 70°С разорваны уже почти все межтетрамерные связи, и
наряду со свободными тетрамерами в воде остаются только короткие обрывки
«полимерных» цепочек из них. Наконец при кипении воды происходит
окончательный разрыв теперь уже одиночных тетрамеров на отдельные
молекулы Н 2 0. И то обстоятельство, что удельная теплота
испарения воды ровно в 3 раза больше суммы удельных теплот плавления
льда и последующего нагрева воды до 100°С, является подтверждением
предположения Колясникова о том. что число внутренних связей в тетрамере
в 3 раза больше числа внешних.
Такая тетраэдрально-винтовая
структура воды может быть обусловлена ее древней реологической связью с
кварцем и другими кремнекислородными минералами, преобладающими в земной
коре, из недр которой когда-то появилась вода на Земле. Как маленький
кристаллик соли заставляет окружающий его раствор кристаллизоваться в
подобные ему кристаллы, а не в другие, так кварц заставил молекулы воды
выстраиваться в тетраэдрические структуры, которые, энергетически
наиболее выгодны. А в нашу эпоху в земной атмосфере водяные пары,
конденсируясь в капли, образуют такую структуру потому, что в атмосфере
всегда присутствуют мельчайшие капельки аэрозольной воды, уже имеющей
эту структуру. Они и являются центрами конденсации водяных паров в
атмосфере. Ниже приведены возможные цепочечные силикатные структуры на
основе тетраэдра, которые могут быть составлены и из тетраэдров воды.
А в нашу эпоху в земной атмосфере водяные пары,
конденсируясь в капли, образуют такую структуру потому, что в атмосфере
всегда присутствуют мельчайшие капельки аэрозольной воды, уже имеющей
эту структуру. Они и являются центрами конденсации водяных паров в
атмосфере. Ниже приведены возможные цепочечные силикатные структуры на
основе тетраэдра, которые могут быть составлены и из тетраэдров воды.
Рис. Элементарный правильный кремне-кислородный тетраэдр SiO 4 4- .
Рис. Элементарные кремнекислородные единицы-ортогруппы SiO 4 4- в структуре Mg-пироксена энстатите (а) и диортогруппы Si 2 O 7 6- в Са-пироксеноиде волластоните (б).
Рис. Простейшие типы островных кремнекислородных анионных группировок: а-SiO 4 , б-Si 2 O 7 , в-Si 3 O 9 , г-Si 4 О 12 , д-Si 6 O 18 .
Рис.
ниже — Важнейшие типы кремнекислородных цепочечных анионных группировок
(по Белову): а-метагерманатная, б — пироксеновая, в — батиситовая,
г-волластонитовая, д-власовитовая, е-мелилитовая, ж-родонитовая,
з-пироксмангитовая, и-метафосфатная, к-фторобериллатная, л —
барилитовая.
Рис. ниже — Конденсация пироксеновых кремнекислородных анионов в сотовые двухрядные амфиболовые (а), трехрядные амфиболоподобные (б), слоистые тальковые и близкие им анионы (в).
Рис. ниже — Важнейшие типы ленточных кремнекислородных группировок (по Белову): а — силлиманитовая, амфиболовая, ксонотлитовая; б-эпидидимитовая; в-ортоклазовая; г-нарсарсукитовая; д-фенакитовая призматическая; е-эвклазовая инкрустированная.
Рис. справа — Фрагмент (элементарный пакет) слоистой кристаллической структуры мусковита KAl 2 (AlSi 3 O 10 XOH) 2 , иллюстрирующий переслаивание алюмокремне-кислородных сеток с полиэдрическими слоями крупных катионов алюминия и калия, напоминает цепочку ДНК.
Возможны и другие модели водной структуры.
Тетраэдрически связанные молекулы воды образуют своеобразные цепочки
довольно стабильного состава. Исследователи раскрывают все более тонкие
и сложные механизмы «внутренней организации» водной массы. Кроме
льдоподобной структуры, жидкой воды и мономерных молекул, описан и
третий элемент структуры – нететраэдрической.
Кроме
льдоподобной структуры, жидкой воды и мономерных молекул, описан и
третий элемент структуры – нететраэдрической.
Определенная часть молекул воды ассоциирована не в трехмерные каркасы, а в линейные кольцевые объединения. Кольца, группируясь, образуют еще более сложные комплексы ассоциатов.
Таким образом, вода теоретически может
образовывать цепочки, наподобие молекулы ДНК, о чём будет сказано ниже. В
этой гипотезе интересно еще и то, что из нее следует равновероятность
существования право — и левовинтовой воды. Но биологами давно подмечено,
что в биологических тканях и структурах наблюдаются только либо лево -,
либо правовинтовые образования. Пример тому — белковые молекулы,
построенные только из лево-винтовых аминокислот и закрученные только по
левовинтовой спирали. А вот сахара в живой природе — все только
правовинтовые. Никто пока не смог объяснить, почему в живой природе
обнаруживается такое предпочтение к левому в одних случаях и к правому —
в других. Ведь в неживой природе с равной вероятностью встречаются как
право-, так и левовинтовые молекулы.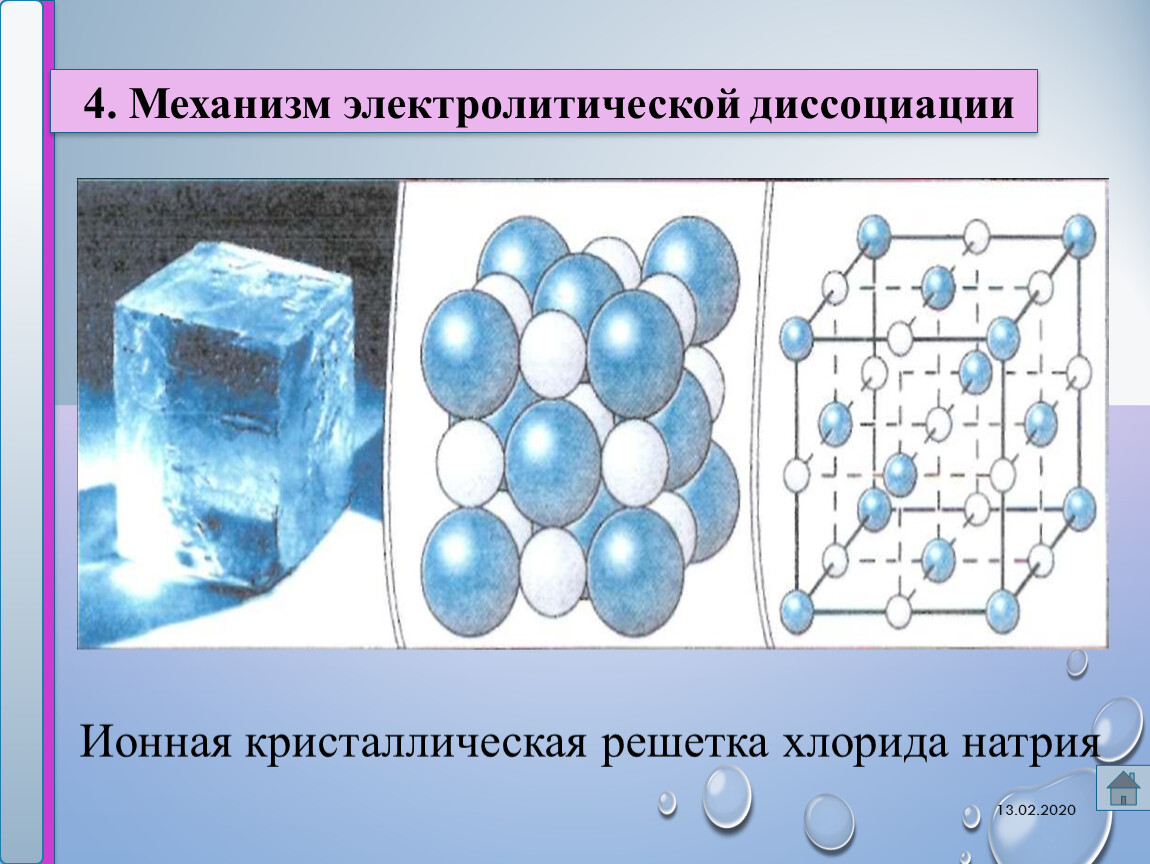
Более ста лет назад знаменитый французский естествоиспытатель Луи Пастер обнаружил, что органические соединения в составе растений и животных оптически асимметричны — они вращают плоскость поляризации падающего на них света. Все аминокислоты, входящие в состав животных и растений, вращают плоскость поляризации влево, а все сахара — вправо. Если мы синтезируем такие же по химическому составу соединения, то в каждом из них будет равное количество лево- и правовращающих молекул.
Как известно,
все живые организмы состоят из белков, а они, в свою очередь, — из
аминокислот. Соединяясь друг с другом в разнообразной
последовательности, аминокислоты образуют длинные пептидные цепи,
которые самопроизвольно «закручиваются» в сложные белковые молекулы.
Подобно многим другим органическим соединениям, аминокислоты обладают
хиральной симметрией (от греч. хирос — рука), то есть могут существовать
в двух зеркально симметричных формах, называемых «энантиомеры». Такие
молекулы похожи одна на другую, как левая и правая рука, поэтому их
называют D- и L-молекулами (от лат. dexter, laevus — правый и левый).
dexter, laevus — правый и левый).
Теперь представим себе, что среда с левыми и правыми молекулами перешла в состояние только с левыми или только с правыми молекулами. Такую среду специалисты называют хирально (от греческого слова «хейра» — рука) упорядоченной. Самовоспроизведение живого (биопоэз — по определению Д. Бернала) могло возникнуть и поддерживаться только в такой среде.
Рис. Зеркальная симметрия в природе
Другое
название молекул-энантиомеров — «правовращающие» и «левовращающие» —
происходит от их способности вращать плоскость поляризации света в
различных направлениях. Если линейно поляризованный свет пропустить
через раствор таких молекул, происходит поворот плоскости его
поляризации: по часовой стрелке, если молекулы в растворе правые, и
против — если левые. А в смеси одинаковых количеств D-и L-форм (она
называется «рацемат») свет сохранит первоначальную линейную поляризацию.
Это оптическое свойство хиральных молекул впервые было обнаружено Луи
Пастером в 1848 году.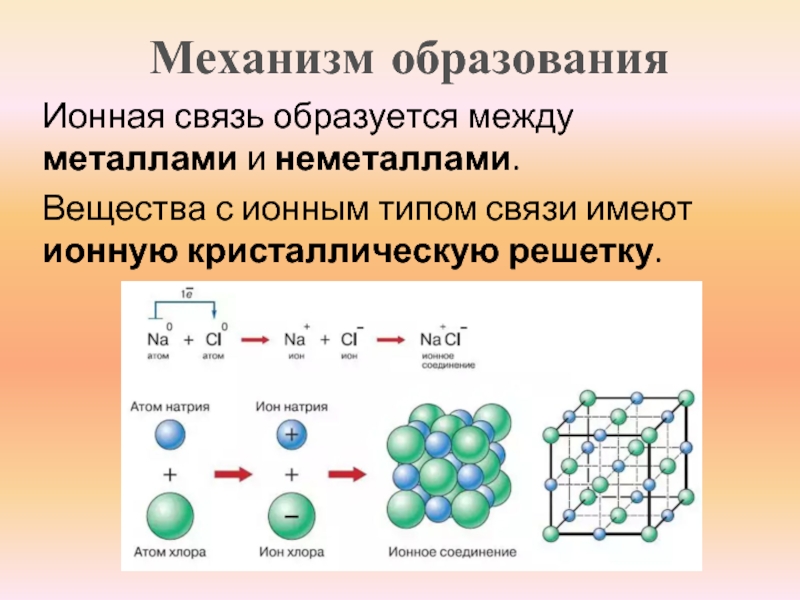
Любопытно, что почти все природные белки состоят только из левых аминокислот. Этот факт тем более удивляет, что при синтезе аминокислот в лабораторных условиях образуется примерно одинаковое число правых и левых молекул. Оказывается, этой особенностью обладают не только аминокислоты, но и многие другие важные для живых систем вещества, причем каждое имеет строго определенный знак зеркальной симметрии во всей биосфере. Например, сахара, входящие в состав многих нуклеотидов, а также нуклеиновых кислот ДНК и РНК, представлены в организме исключительно правыми D-молекулами. Хотя физические и химические свойства «зеркальных антиподов» совпадают, их физиологическая активность в организмах различна: L-caxaра не усваиваются, L-фенилаланин в отличие от безвредных его D-молекул вызывает психические заболевания и т. д.
Согласно современным представлениям о
происхождении жизни на Земле, выбор органическими молекулами
определенного типа зеркальной симметрии послужил главной предпосылкой их
выживания и последующего самовоспроизводства. Однако вопрос, как и
почему произошел эволюционный отбор того или иного зеркального антипода,
— до сих пор остается одной из самых больших загадок науки.
Однако вопрос, как и
почему произошел эволюционный отбор того или иного зеркального антипода,
— до сих пор остается одной из самых больших загадок науки.
Советский ученый Л. Л. Морозов доказал, что переход к хиральной упорядоченности мог произойти не эволюционно, а только при каком-то определённом резком фазовом изменении. Академик В. И. Гольданский назвал этот переход, благодаря которому зародилась жизнь на Земле хиральной катастрофой.
Как же возникли условия для фазовой катастрофы, вызвавшей хиральный переход?
Наиболее
важным было то, что органические соединения плавились при 800-1000 0С в
земной коре, а верхние остывали до температуры космоса, то есть
абсолютного нуля. Перепад температуры достигал 1000 °С. В таких условиях
органические молекулы плавились под действием высокой температуры и
даже полностью разрушались, а верх оставался холодным, так как
органические молекулы замораживались. Газы и пары воды, которые
просачивались из земной коры, меняли химический состав органических
соединений. Газы несли с собой тепло, из-за чего граница плавления
органического слоя смещалась вверх и вниз, создавая градиент.
Газы несли с собой тепло, из-за чего граница плавления
органического слоя смещалась вверх и вниз, создавая градиент.
При очень низких давлениях атмосферы вода была на земной поверхности лишь в виде пара и льда. Когда же давление достигало так называемой тройной точки воды (0,006 атмосферы), вода впервые смогла находиться в виде жидкости.
Конечно, лишь экспериментально можно доказать, что именно вызвало хиральный переход: земные или космические причины. Но так или иначе в какой-то момент хирально упорядоченные молекулы (а именно — левовращающие аминокислоты и правовращающие сахара) оказались более устойчивыми и начался неостановимый рост их количества — хиральный переход.
Летопись планеты повествует и о том, что тогда на Земле
не было ни гор, ни впадин. Полурасплавленная гранитная кора представляла
собой поверхность столь же ровную, как уровень современного океана.
Однако в пределах этой равнины все же были понижения из-за
неравномерного распределения масс внутри Земли. Эти понижения сыграли
чрезвычайно важную роль.
Эти понижения сыграли
чрезвычайно важную роль.
Дело в том, что плоскодонные впадины поперечником в сотни и даже тысячи километров и глубиной не более ста метров, вероятно, и стали колыбелью жизни. Ведь в них стекала вода, собиравшаяся на поверхности планеты. Вода разбавляла хиральные органические соединения в пепловом слое. Постепенно менялся химический состав соединения, стабилизировалась температура. Переход от неживого к живому, начавшийся в безводных условиях, продолжался уже в водной среде.
Таков ли сюжет зарождения жизни? Вероятнее всего, что да. В геологическом разрезе Исуа (Западная Гренландия), возраст которого 3,8 миллиарда лет, найдены бензино- и нефтеподобные соединения с изотопным соотношением С12/С13, свойственным углероду фотосинтетического происхождения.
Если
биологическая природа углеродистых соединений из разреза Исуа
подтвердится, то получится, что весь период зарождения жизни на Земле —
от возникновения хиральной органики до появления клетки, способной к
фотосинтезу и размножению,- был пройден лишь за сто миллионов лет. И в
этом процессе огромную роль сыграли молекулы воды и ДНК.
И в
этом процессе огромную роль сыграли молекулы воды и ДНК.
Самое удивительное в структуре воды заключается в том, что молекулы воды при низких отрицательных температурах и высоких давлениях внутри нанотрубок могут кристаллизоваться в форме двойной спирали, напоминающую ДНК. Это было доказано компьютерными экспериментами американских учёных под руководством Сяо Чэн Цзэна в Университете штата Небраска (США).
ДНК представляет собой двойную цепочку, скрученную в спираль. Каждая
нить состоит из «кирпичиков» — из последовательно соединенных
нуклеотидов. Каждый нуклеотид ДНК содержит одно из четырёх азотистых
оснований — гуанин (G), аденин (A) (пурины), тимин (T) и цитозин (C)
(пиримидины), связанное с дезоксирибозой, к последней, в свою очередь,
присоединена фосфатная группа. Между собой соседние нуклеотиды соединены
в цепи фосфодиэфирной связью, образованной 3″-гидроксильной (3″-ОН) и
5″-фосфатной группами (5″-РО3). Это свойство обуславливает наличие
полярности в ДНК, т. е. противоположной направленности, а именно 5″- и
3″-концов: 5″-концу одной нити соответствует 3″-конец второй нити.
Последовательность нуклеотидов позволяет «кодировать» информацию о
различных типах РНК, наиболее важными из которых являются
информационные, или матричные (мРНК), рибосомальные (рРНК) и
транспортные (тРНК). Все эти типы РНК синтезируются на матрице ДНК за
счёт копирования последовательности ДНК в последовательность РНК,
синтезируемой в процессе транскрипции и принимают участие в важнейшем
процессе жизни – передачи и копирования информации (трансляции).
е. противоположной направленности, а именно 5″- и
3″-концов: 5″-концу одной нити соответствует 3″-конец второй нити.
Последовательность нуклеотидов позволяет «кодировать» информацию о
различных типах РНК, наиболее важными из которых являются
информационные, или матричные (мРНК), рибосомальные (рРНК) и
транспортные (тРНК). Все эти типы РНК синтезируются на матрице ДНК за
счёт копирования последовательности ДНК в последовательность РНК,
синтезируемой в процессе транскрипции и принимают участие в важнейшем
процессе жизни – передачи и копирования информации (трансляции).
Первичная структура ДНК — это линейная последовательность нуклеотидов ДНК в цепи. Последовательность нуклеотидов в цепи ДНК записывают в виде буквенной формулы ДНК: например — AGTCATGCCAG, запись ведется с 5″- на 3″-конец цепи ДНК.
Вторичная структура ДНК образуется за счет
взаимодействий нуклеотидов (в большей степени азотистых оснований) между
собой, водородных связей. Классический пример вторичной структуры ДНК —
двойная спираль ДНК. Двойная спираль ДНК — самая распространенная в
природе форма ДНК, состоящая из двух полинуклеотидных цепей ДНК.
Построение каждой новой цепи ДНК осуществляется по принципу
комплементарности, т.е. каждому азотистому основанию одной цепи ДНК
соответствует строго определенное основание другой цепи: в
комплемнтарной паре напротив A стоит T, а напротив G располагается C и
т.д.
Двойная спираль ДНК — самая распространенная в
природе форма ДНК, состоящая из двух полинуклеотидных цепей ДНК.
Построение каждой новой цепи ДНК осуществляется по принципу
комплементарности, т.е. каждому азотистому основанию одной цепи ДНК
соответствует строго определенное основание другой цепи: в
комплемнтарной паре напротив A стоит T, а напротив G располагается C и
т.д.
Чтобы вода сформировала спираль, наподобие, в моделируемом эксперименте она «помещалась» в нанотрубки под высоким давлением, варьирующимися в разных опытах от 10 до 40000 атмосфер. После этого задавали температуру, которая имела значение -23°C. Запас по сравнению с температурой замерзания воды делался в связи с тем, что с повышением давления температура плавления водяного льда понижается. Диаметр нанотрубок составлял от 1,35 до 1,90 нм.
Рис. Общий вид структуры воды (изображение New Scientist)
Молекулы
воды связываются между собой посредством водородных связей, расстояние
между атомами кислорода и водорода равно 96 пм, а между двумя водородами
— 150 пм. В твёрдом состоянии атом кислорода участвует в образовании
двух водородных связей с соседними молекулами воды. При этом отдельные
молекулы H 2 O соприкасаются друг с другом разноимёнными
полюсами. Таким образом, образуются слои, в которых каждая молекула
связана с тремя молекулами своего слоя и одной из соседнего. В
результате, кристаллическая структура льда состоит из шестигранных
«трубок» соединенных между собой, как пчелиные соты.
В твёрдом состоянии атом кислорода участвует в образовании
двух водородных связей с соседними молекулами воды. При этом отдельные
молекулы H 2 O соприкасаются друг с другом разноимёнными
полюсами. Таким образом, образуются слои, в которых каждая молекула
связана с тремя молекулами своего слоя и одной из соседнего. В
результате, кристаллическая структура льда состоит из шестигранных
«трубок» соединенных между собой, как пчелиные соты.
Рис. Внутренняя стенка структуры воды (изображение New Scientist)
Учёные ожидали увидеть, что вода во всех случаях образует тонкую трубчатую структуру. Однако, модель показала, что при диаметре трубки в 1,35 нм и давлении в 40000 атмосфер водородные связи искривились, приведя к образованию спирали с двойной стенкой. Внутренняя стенка этой структуры является скрученной в четверо спиралью, а внешняя состоит из четырёх двойных спиралей, похожих на структуру молекулы ДНК.
Последний
факт накладывает отпечаток не только на эволюцию наших представлений о
воде, но и эволюцию ранней жизни и самой молекулы ДНК. Если
предположить, что в эпоху зарождения жизни криолитные глинистые породы
имели форму нанотрубок, возникает вопрос — не могла ли вода,
сорбированная в них служить структурной основой (матрицей) для синтеза
ДНК и считывания информации? Возможно, поэтому спиральная структура ДНК
повторяет спиральную структуру воды в нанотрубках.
Как сообщает
журнал New Scientist, теперь нашим зарубежным коллегам предстоит
подтвердить существование таких макромолекул воды в реальных
экспериментальных условиях с использованием инфракрасной спектроскопии и
спектроскопии нейтронного рассеяния.
Если
предположить, что в эпоху зарождения жизни криолитные глинистые породы
имели форму нанотрубок, возникает вопрос — не могла ли вода,
сорбированная в них служить структурной основой (матрицей) для синтеза
ДНК и считывания информации? Возможно, поэтому спиральная структура ДНК
повторяет спиральную структуру воды в нанотрубках.
Как сообщает
журнал New Scientist, теперь нашим зарубежным коллегам предстоит
подтвердить существование таких макромолекул воды в реальных
экспериментальных условиях с использованием инфракрасной спектроскопии и
спектроскопии нейтронного рассеяния.
К.х.н. О.В. Мосин
Из 14 известных на сегодняшний день форм твердой воды в природе мы встречаем только одну лед. Остальные образуются в экстремальных условиях и для наблюдений вне специальных лабораторий недоступны. Самое интригующее свойство льда это удивительное многообразие внешних проявлений. При одной и той же кристаллической структуре он может выглядеть совершенно по-разному, принимая форму прозрачных градин и сосулек, хлопьев пушистого снега, плотной блестящей корки фирна на снежном поле или же гигантских ледниковых масс.
В небольшом японском городе Кага, расположенном на западном берегу острова Хонсю, есть необычный музей. Снега и льда. Основал его Укихиро Накайя первый человек, который научился выращивать в лаборатории искусственные снежинки, такие же красивые, как и те, что падают с неба. В этом музее посетителей со всех сторон окружают правильные шестиугольники, потому что именно такая гексагональная симметрия свойственна кристаллам обычного льда (кстати, греческое слово kristallos, собственно, и означает «лед»). Она определяет многие уникальные его свойства и заставляет снежинки, при всем бесконечном их разнообразии, расти в форме звездочек с шестью, реже тремя или двенадцатью лучами, но никогда с четырьмя или пятью.
Молекулы в ажуре
Разгадка структуры твердой воды кроется в строении ее молекулы. Н2О можно упрощенно представить себе в виде тетраэдра (пирамиды с треугольным основанием). В центре находится кислород, в двух вершинах по водороду, точнее протону, электроны которых задействованы в образовании ковалентной связи с кислородом. Две оставшиеся вершины занимают пары валентных электронов кислорода, которые не участвуют в образовании внутримолекулярных связей, отчего их называют неподеленными.
Две оставшиеся вершины занимают пары валентных электронов кислорода, которые не участвуют в образовании внутримолекулярных связей, отчего их называют неподеленными.
Лед, который образуется при атмосферном давлении и плавится при 0°С, самое привычное, но все еще не до конца понятное вещество.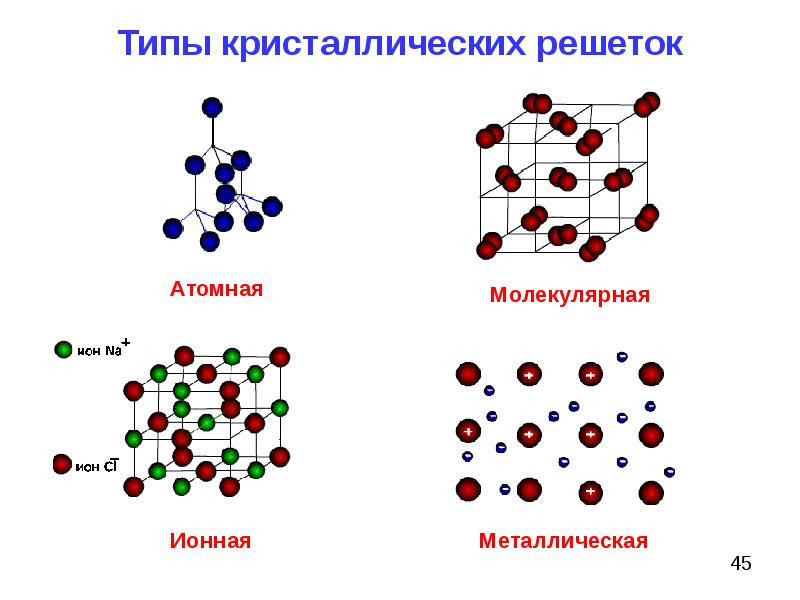 Многое в его структуре и свойствах выглядит необычно. В узлах кристаллической решетки льда атомы кислорода выстроены упорядоченно, образуя правильные шестиугольники, а вот атомы водорода занимают самые разные положения вдоль связей. Такое поведение атомов вообще-то нетипично как правило, в твердом веществе все подчиняются одному закону: либо все атомы расположены упорядоченно, и тогда это кристалл, либо случайно, и тогда это аморфное вещество.
Многое в его структуре и свойствах выглядит необычно. В узлах кристаллической решетки льда атомы кислорода выстроены упорядоченно, образуя правильные шестиугольники, а вот атомы водорода занимают самые разные положения вдоль связей. Такое поведение атомов вообще-то нетипично как правило, в твердом веществе все подчиняются одному закону: либо все атомы расположены упорядоченно, и тогда это кристалл, либо случайно, и тогда это аморфное вещество.
К «странностям» льда относят и генерацию электромагнитного излучения его растущими кристаллами. Давно известно, что большинство растворенных в воде примесей не передается льду, когда он начинает расти, проще говоря, вымораживается. Поэтому даже на самой грязной луже пленка льда чистая и прозрачная. Примеси скапливаются на границе твердой и жидкой сред, в виде двух слоев электрических зарядов разного знака, которые вызывают значительную разность потенциалов. Заряженный слой примесей перемещается вместе с нижней границей молодого льда и излучает электромагнитные волны. Благодаря этому процесс кристаллизации можно наблюдать в деталях. Так, кристалл, растущий в длину в виде иголки, излучает иначе, чем покрывающийся боковыми отростками, а излучение растущих зерен отличается от того, что возникает, когда кристаллы трескаются. По форме, последовательности, частоте и амплитуде импульсов излучения можно определить, с какой скоростью замерзает лед и какая при этом получается ледовая структура.
Примеси скапливаются на границе твердой и жидкой сред, в виде двух слоев электрических зарядов разного знака, которые вызывают значительную разность потенциалов. Заряженный слой примесей перемещается вместе с нижней границей молодого льда и излучает электромагнитные волны. Благодаря этому процесс кристаллизации можно наблюдать в деталях. Так, кристалл, растущий в длину в виде иголки, излучает иначе, чем покрывающийся боковыми отростками, а излучение растущих зерен отличается от того, что возникает, когда кристаллы трескаются. По форме, последовательности, частоте и амплитуде импульсов излучения можно определить, с какой скоростью замерзает лед и какая при этом получается ледовая структура.
Неправильный лед
В твердом состоянии вода насчитывает, по последним данным, 14 структурных модификаций. Есть среди них кристаллические (их большинство), есть аморфные, но все они отличаются друг от друга взаимным расположением молекул воды и свойствами. Правда, все, кроме привычного нам льда, образуются в условиях экзотических при очень низких температурах и высоких давлениях, когда углы водородных связей в молекуле воды изменяются и образуются системы, отличные от гексагональной. Например, при температуре ниже 110°С водяные пары выпадают на металлической пластине в виде октаэдров и кубиков размером в несколько нанометров это так называемый кубический лед. Если температура чуть выше 110°, а концентрация пара очень мала, на пластине формируется слой исключительно плотного аморфного льда.
Например, при температуре ниже 110°С водяные пары выпадают на металлической пластине в виде октаэдров и кубиков размером в несколько нанометров это так называемый кубический лед. Если температура чуть выше 110°, а концентрация пара очень мала, на пластине формируется слой исключительно плотного аморфного льда.
Две последние модификации льда XIII и XIV открыли ученые из Оксфорда совсем недавно, в 2006 году. Предсказание 40-летней давности о том, что должны существовать кристаллы льда с моноклинной и ромбической решетками, было трудно подтвердить: вязкость воды при температуре 160°С очень велика, и собраться вместе молекулам сверхчистой переохлажденной воды в таком количестве, чтобы образовался зародыш кристалла, трудно. Помог катализатор соляная кислота, которая повысила подвижность молекул воды при низких температурах. В земной природе подобные модификации льда образовываться не могут, но их можно поискать на замерзших спутниках других планет.
Комиссия решила такСнежинка это монокристалл льда, вариация на тему гексагонального кристалла, но выросшего быстро, в неравновесных условиях. Над тайной их красоты и бесконечного разнообразия не одно столетие бьются самые пытливые умы. Астроном Иоганн Кеплер в 1611 году написал целый трактат «О шестиугольных снежинках». В 1665 году Роберт Гук в огромном томе зарисовок всего, что он увидел с помощью микроскопа, опубликовал множество рисунков снежинок самой разной формы. Первую удачную фотографию снежинки под микроскопом сделал в 1885 году американский фермер Уилсон Бентли. С тех пор он уже не мог остановиться. До конца жизни, сорок с лишним лет, Бентли фотографировал их. Более пяти тысяч кристаллов, и ни одного одинакового.
Над тайной их красоты и бесконечного разнообразия не одно столетие бьются самые пытливые умы. Астроном Иоганн Кеплер в 1611 году написал целый трактат «О шестиугольных снежинках». В 1665 году Роберт Гук в огромном томе зарисовок всего, что он увидел с помощью микроскопа, опубликовал множество рисунков снежинок самой разной формы. Первую удачную фотографию снежинки под микроскопом сделал в 1885 году американский фермер Уилсон Бентли. С тех пор он уже не мог остановиться. До конца жизни, сорок с лишним лет, Бентли фотографировал их. Более пяти тысяч кристаллов, и ни одного одинакового.
Самые знаменитые последователи дела Бентли это уже упомянутый Укихиро Накайя и американский физик Кеннет Либбрехт . Накайя впервые предположил, что величина и форма снежинок зависят от температуры воздуха и содержания в нем влаги, и блистательно подтвердил эту гипотезу экспериментально, выращивая в лаборатории кристаллы льда разной формы. А Либбрехт у себя в и вовсе стал выращивать снежинки на заказ заранее заданной формы.
Жизнь снежинки начинается с того, что в облаке водяного пара при понижении температуры образуются кристаллические зародыши льда. Центром кристаллизации могут быть пылинки, любые твердые частицы или даже ионы, но в любом случае эти льдинки размером меньше десятой доли миллиметра уже имеют гексагональную кристаллическую решетку.
Водяной пар, конденсируясь на поверхности этих зародышей, образует сначала крошечную гексагональную призму, из шести углов которой начинают расти совершенно одинаковые ледяные иголочки боковые отростки. Одинаковые просто потому, что температура и влажность вокруг зародыша тоже одинаковые. На них в свою очередь вырастают, как на дереве, боковые отростки веточки. Подобные кристаллы так и называют дендритами, то есть похожими на дерево.
Передвигаясь вверх и вниз в облаке, снежинка попадает в условия с разной температурой и концентрацией водяного пара. Ее форма меняется, до последнего подчиняясь законам гексагональной симметрии. Так снежинки становятся разными. Хотя теоретически в одном облаке на одной высоте они могут «зародиться» одинаковыми. Но путь до земли у каждой свой, довольно долгий в среднем снежинка падает со скоростью 0,9 км в час. А значит, у каждой своя история и своя окончательная форма. Образующий снежинку лед прозрачен, но когда их много, солнечный свет, отражаясь и рассеиваясь на многочисленных гранях, создает у нас впечатление белой непрозрачной массы мы называем ее снегом.
Хотя теоретически в одном облаке на одной высоте они могут «зародиться» одинаковыми. Но путь до земли у каждой свой, довольно долгий в среднем снежинка падает со скоростью 0,9 км в час. А значит, у каждой своя история и своя окончательная форма. Образующий снежинку лед прозрачен, но когда их много, солнечный свет, отражаясь и рассеиваясь на многочисленных гранях, создает у нас впечатление белой непрозрачной массы мы называем ее снегом.
Тем же законам подчиняется и рост инея, изморози и узоров на стеклах. Эти явления, как и снежинки, образуются при конденсации, молекула за молекулой на земле, траве, деревьях. Узоры на окне появляются в мороз, когда на поверхности стекла конденсируется влага теплого комнатного воздуха.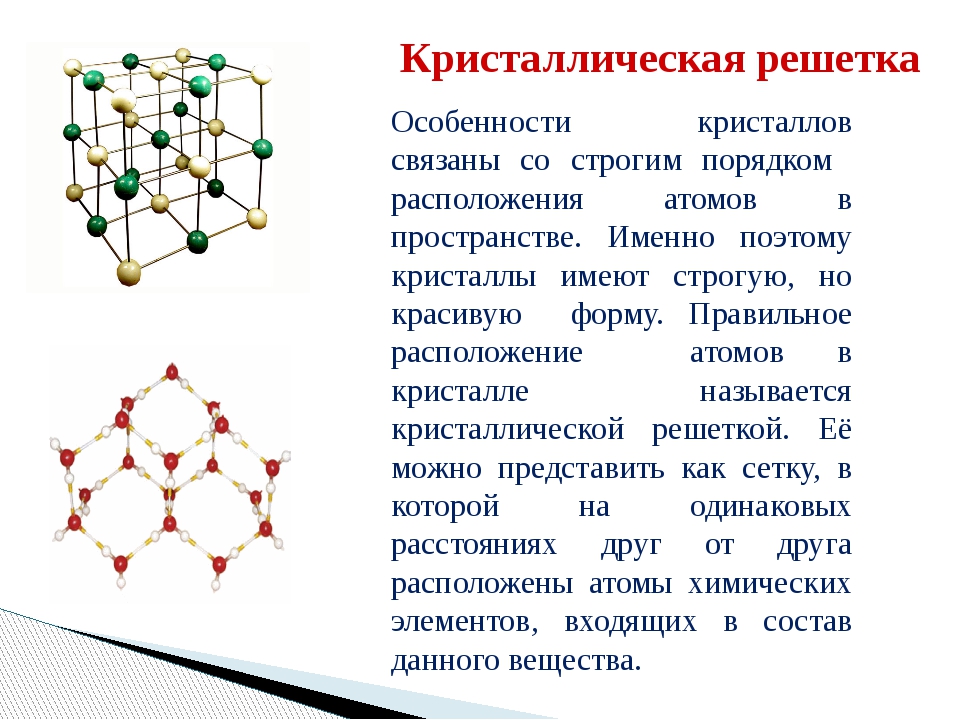 А вот градины получаются при застывании капель воды или когда в насыщенных водяным паром облаках лед плотными слоями намерзает на зародыши снежинок. На градины могут намерзать другие, уже сформировавшиеся снежинки, сплавляясь с ними, благодаря чему градины принимают самые причудливые формы.
А вот градины получаются при застывании капель воды или когда в насыщенных водяным паром облаках лед плотными слоями намерзает на зародыши снежинок. На градины могут намерзать другие, уже сформировавшиеся снежинки, сплавляясь с ними, благодаря чему градины принимают самые причудливые формы.
Нам на Земле довольно и одной твердой модификации воды обычного льда. Он буквально пронизывает все области обитания или пребывания человека. Собираясь в огромных количествах, снег и лед образуют особые структуры с принципиально иными, нежели у отдельных кристаллов или снежинок, свойствами. Горные ледники , ледяные покровы акваторий, вечная мерзлота, да и просто сезонный снежный покров существенно влияют на климат больших регионов и планеты в целом: даже те, кто никогда не видел снега, чувствуют на себе дыхание его масс, скопившихся на полюсах Земли, например, в виде многолетних колебаний уровня Мирового океана. А лед имеет столь большое значение для облика нашей планеты и комфортного обитания на ней живых существ, что ученые отвели для него особую среду криосферу, которая простирает свои владения высоко в атмосферу и глубоко в земную кору.
Ольга Максименко, кандидат химических наук
Как мы уже знаем, вещество может существовать в трех агрегатных состояниях: газообразном , твердом и жидком . Кислород, который при обычных условиях находится в газообразном состоянии, при температуре -194° С преобразуется в жидкость голубоватого цвета, а при температуре -218,8° С превращается в снегообразную массу с кристаллами синего цвета.
Температурный интервал существования вещества в твердом состоянии определяется температурами кипения и плавления. Твердые вещества бывают кристаллическими и аморфными .
У аморфных веществ нет фиксированной температуры плавления – при нагревании они постепенно размягчаются и переходят в текучее состояние. В таком состоянии, например, находятся различные смолы, пластилин.
Кристаллические вещества отличаются закономерным расположением частиц, из которых они состоят: атомов, молекул и ионов, – в строго определенных точках пространства. Когда эти точки соединяются прямыми линиями, создается пространственный каркас, его называют кристаллической решеткой. Точки, в которых находятся частицы кристалла, называют узлами решетки.
Когда эти точки соединяются прямыми линиями, создается пространственный каркас, его называют кристаллической решеткой. Точки, в которых находятся частицы кристалла, называют узлами решетки.
В узлах воображаемой нами решетки могут находиться ионы, атомы и молекулы. Эти частицы совершают колебательные движения. Когда температура увеличивается, размах этих колебаний тоже возрастает, что приводит к тепловому расширению тел.
В зависимости от разновидности частиц, находящихся в узлах кристаллической решетки, и характера связи между ними различают четыре типа кристаллических решеток: ионные , атомные , молекулярные и металлические .
Ионными называют такие кристаллические решетки, в узлах которых расположены ионы. Их образуют вещества с ионной связью, которой могут быть связаны как простые ионы Na+, Cl- , так и сложные SO24-, OH-. Таким образом, ионные кристаллические решетки имеют соли, некоторые оксиды и гидроксилы металлов, т. е. те вещества, в которых существует ионная химическая связь. Рассмотрим кристалл хлорида натрия, он состоит из положительно чередующихся ионов Na+ и отрицательных CL-, вместе они образуют решетку в виде куба. Связи между ионами в таком кристалле чрезвычайно устойчивы. Из-за этого вещества с ионной решеткой обладают сравнительно высокой прочностью и твердостью, они тугоплавки и нелетучи.
е. те вещества, в которых существует ионная химическая связь. Рассмотрим кристалл хлорида натрия, он состоит из положительно чередующихся ионов Na+ и отрицательных CL-, вместе они образуют решетку в виде куба. Связи между ионами в таком кристалле чрезвычайно устойчивы. Из-за этого вещества с ионной решеткой обладают сравнительно высокой прочностью и твердостью, они тугоплавки и нелетучи.
Атомными кристаллическими решетками называют такие кристаллические решетки, в узлах которых находятся отдельные атомы. В подобных решетках атомы соединяются между собой очень крепкими ковалентными связями. К примеру, алмаз – одно из аллотропных видоизменений углерода.
Вещества с атомной кристаллической решеткой не сильно распространены в природе. К ним относятся кристаллический бор, кремний и германий, а также сложные вещества, например такие, в составе которых есть оксид кремния (IV) – SiO 2: кремнезем, кварц, песок, горный хрусталь.
Подавляющее большинство веществ с атомной кристаллической решеткой имеют очень высокие температуры плавления (у алмаза она превышает 3500° С), такие вещества прочны и тверды, практически не растворимы.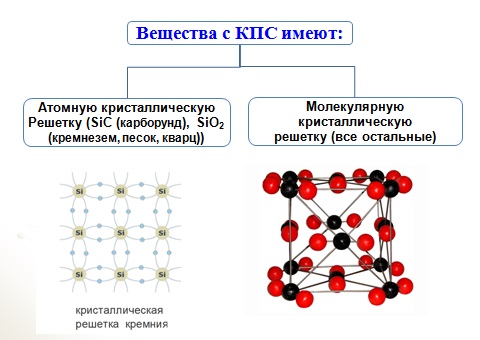
Молекулярными называют такие кристаллические решетки, в узлах которых расположены молекулы. Химические связи в этих молекулах могут быть также, как полярными (HCl, H 2 0), так и неполярными (N 2 , O 3). И хотя атомы внутри молекукл связаны очень крепкими ковалентными связями, между самими молекулами действует слабые силы межмолекулярного притяжения. Именно поэтому вещества с молекулярными кристаллическими решетками характеризуются малой твердостью, низкой температурой плавления, летучестью.
Примерами таких веществ могут послужить твердая вода – лед, твердый оксид углерода (IV) – «сухой лед», твердые хлороводород и сероводород, твердые простые вещества, образованные одно – (благородные газы), двух – (H 2 , O 2 , CL 2 , N 2 , I 2), трех – (O 3), четырех – (P 4), восьмиатомными (S 8) молекулами. Подавляющее большинство твердых органических соединений обладают молекулярными кристаллическими решетками (нафталин, глюкоза, сахар).
blog.сайт,
при полном или частичном копировании материала ссылка на первоисточник обязательна.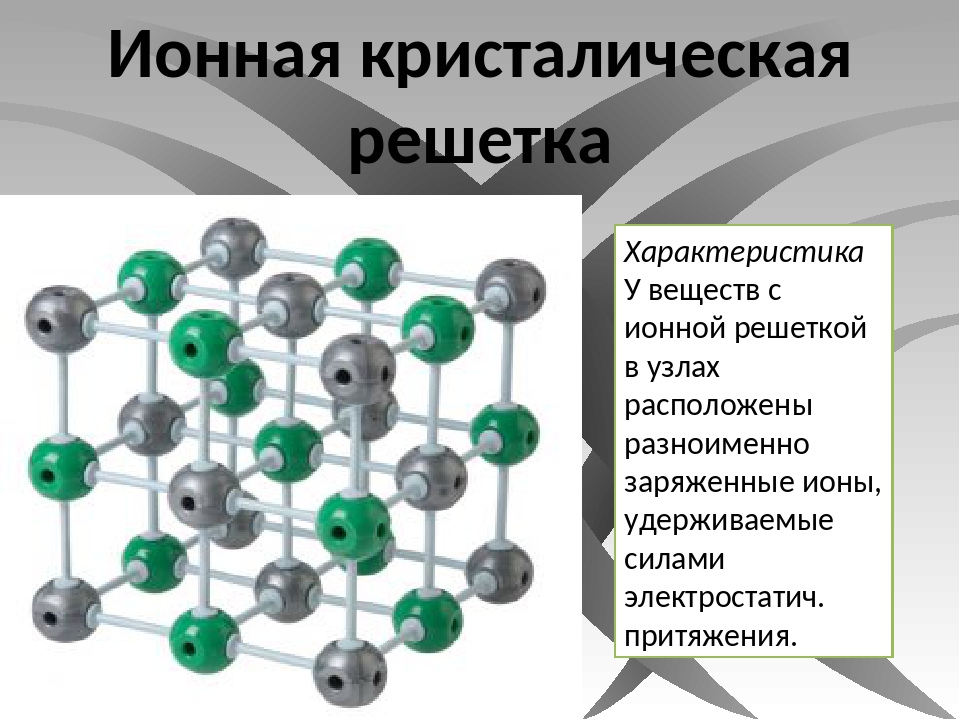
Кристаллические решетки
Цели.
- Дать понятие о кристаллическом и аморфном состоянии твердых веществ; познакомиться с типами кристаллических решеток, их взаимосвязью с видами химической связи и влиянием на физические свойства веществ; дать представление о законе постоянства состава веществ.
- Развивать логическое мышление, умения наблюдать и делать выводы.
- Формировать эстетический вкус и коллективизм, расширять кругозор.
Оборудование и реактивы. Модели кристаллических решеток; пластилин, жевательная резинка, смолы, воск, поваренная соль NaCl, графит, сахар, вода; раздаточный материал, компьютер, презентация (приложение).
Тип урока: усвоение нового материала.
Форма организации работы. фронтальная, групповая.
Методы и приемы. объяснительно-иллюстративный, проблемный, демонстрационный опыт, лабораторная работа, самостоятельная работа.
объяснительно-иллюстративный, проблемный, демонстрационный опыт, лабораторная работа, самостоятельная работа.
Презентация к уроку
Ход урока
Сегодня я хочу начать урок со слов поэта Леонида Мартынова:
(Cлайд 1)
«В мире этом – я знаю –
нет счета сокровищам,
Но весьма поучительно
для очей заглянуть
повнимательнее в нутро вещам,
прямо в нутро вещей».
(Слайд 2) Тема урока: Кристаллические решетки
Цель урока– понять, что такое кристаллическое и аморфное состояние твердых веществ, познакомиться с типами кристаллических решеток, получить представление о законе постоянства состава веществ.
Посмотрите на слайд (3). На нем представлены вещества: алмаз, медный купорос, аметист, графит, алюминий, оксид углерода (IV), ртуть, каменная соль.
В конце урока вы должны ответить на вопрос:
(Слайд 3) Что общего у этих веществ?
Вспомните: Какие агрегатные состояния веществ известны?
(Ответ): Твердое, жидкое и газообразное.
(Слайд 4) Следовательно: вещества по агрегатному состоянию делят на газы, жидкости и твердые тела.
Приведите примеры веществ. (Слайд 4, продолжение)
Для нас важны все три агрегатных состояния, так как любое вещество может быть газом, жидкостью или твердым веществом.
Приведите примеры таких переходов:
Например: лед ↔ вода ↔ пар; твердый натрий легко плавится и может испарятся, т.е. быть газообразным. Газ кислород при низких температурах сначала превращается в жидкость, а при еще более низких – затвердевает в синие кристаллы.
Сегодня мы рассмотрим твердое состояние вещества.
(Лабораторная работа) Посмотрите на вещества на ваших столах и распределите их на две группы (по своему усмотрению). (на столе: пластилин, жевательная резинка, смола, воск, поваренная соль NaCl, графит, сахар)
(на столе: пластилин, жевательная резинка, смола, воск, поваренная соль NaCl, графит, сахар)
(Ответ учащихся) Пластилин, жевательная резинка, смола, воск – это аморфные вещества. У них часто нет постоянной температуры плавления, наблюдается текучесть, нет упорядоченного строения. Напротив, соль NaCl, графит и сахар – кристаллические вещества. Для них характерны четкие температуры плавления, правильные геометрические формы, симметрия, упорядоченное строение.
(Слайд 5) Исходя из вашего ответа следует вывод, что все твердые вещества делятся на аморфные и кристаллические (их характеристика).
Что бы выяснить отличие аморфных и кристаллических веществ мы заглянем внутрь этих веществ.
Кристаллические вещества характеризуются правильным расположением частиц, из которых они построены: атомов, молекул или ионов. Эти частицы расположены в строго (Слайд 6) определенных точках пространства – называемыхузлами. Если соединить узлы прямыми линиями, то образуется пространственный каркас – кристаллическая решетка.
Если соединить узлы прямыми линиями, то образуется пространственный каркас – кристаллическая решетка.
В соответствии с видом частиц можно выделить четыре типа кристаллических решеток.
Установим взаимосвязь между типом решетки, видом химической связи и свойствами веществ одновременно заполняя таблицу (приложение 1).
(слайды 7-10)
1 кристаллическая решетка – ИОННАЯ.
Виды частиц в узлах решетки? – ионы.
Вид связи между частицами – ионная, прочная.
Какие вещества могут иметь ионную кристаллическую решетку? – соли, оксиды и гидроксиды типичных металлов (I– III групп)
Какими физ. свойствами будут обладать такие вещества? – твердые, прочные, нелетучие, тугоплавкие.
Следующий тип кристаллической решетки – АТОМНАЯ.
Виды частиц в узлах решетки – атомы.
Вид связи между частицами? – (атомная или) ковалентная.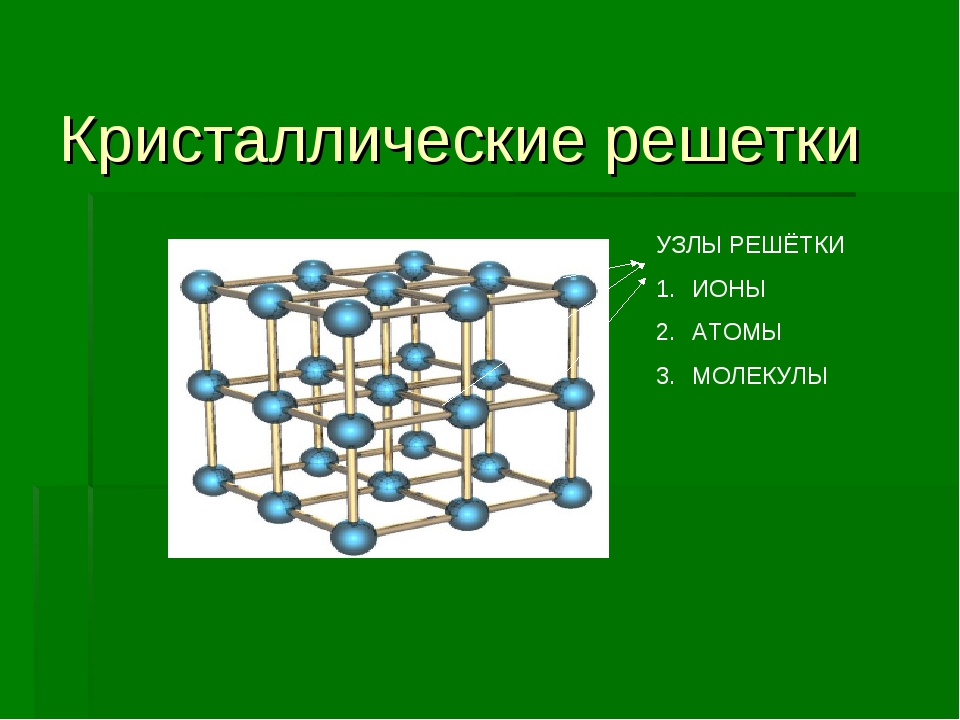
Примеры – графит (его кристаллическая. решетка показана на слайде), кварц, алмаз.
Физические свойства веществ – такие же что и у веществ с ионной кристаллической решеткой – твердые, прочные, нелетучие, тугоплавкие, не растворимы в воде.
У алмаза кристаллическая решетка по структуре отличается от решетки графита. (демонстрация кристаллических решеток графита и алмаза) Она имеет тетраэдрическое строение. Из за такого своего строения алмаз – твердое, очень прочное вещество.
3 тип кристаллической решетки – МОЛЕКУЛЯРНАЯ.
В узлах такой решетки находятся – молекулы.
Между молекулами – слабые силы межмолекулярного притяжения, а внутри молекул – прочная ковалентная связь.
Примеры веществ –твердые при особых условиях вещества, которые при обычных условиях газы, жидкости; сера, иод, уксусная кислота.
Характерные физические свойства таких веществ – непрочные, летучие, легкоплавкие, имеющие малую твердость.
На слайде приведена кристаллическая решетка углекислого газа – оксида углерода (IV). В узлах находится молекула состоящая из атома углерода и двух атомов кислород.
В кристаллических решетках простых веществ, например иода – в узлах находятся двухатомные молекулы иода. (Приложение 2)
И последняя кристаллическая решетка – МЕТАЛЛИЧЕСКАЯ.
В узлах находятся – атом – ионы (металлов).
Связь – металлическая, осуществляемая свободными обобществленными электронами (которые двигаются между атом – ионами).
(Демонстрация кристаллической решетки металлов, раздаточный материал) (приложение 3).
Примеры – металлы и сплавы.
Какими физ. свойствами будут обладать такие вещества? – ковкие, пластичные, электро – и теплопроводны, имеют мет. блеск ( все свойства металлов).
(слайды 11-12) Рассмотрев типы кристаллических решеток мы с вами установили взаимосвязь между строением атома, химическими связями, кристаллическими решетками и свойствами веществ.
Строение атома химическая связь кристаллическая решетка свойства вещества. |
Откройте учебник на стр. 80, табл. 6 и обратите внимание на типы кристаллических решеток простых веществ в зависимости от их положения в периодической системе.
Какой тип решетки не встречается в простых веществах?
Ответ учеников. У простых веществ не бывает ионных решеток.
Для веществ с молекулярной решеткой характерно явление возгонки (сублимации).
Демонстрационный опыт. Возгонка иода. (Возгонка – это превращение (при нагревании) твердого вещества в газ, минуя жидкую фазу, а затем снова кристаллизация в виде инея.)
(слайд13) Остался еще один момент урока – закон постоянства состава вещества, которому подчиняются вещества с молекулярным строением.
Этот закон открыт французским химиком Ж. Л.Прустом.
Л.Прустом.
Его формулировка такова: вещества молекулярного строения имеют постоянный состав независимо от способа их получения.
Н-р: вода – не зависимо от того как ее получают, в каком агрегатном состоянии она находится, состав ее не меняется – Н2О.
Для веществ с ионным строением закон Пруста не всегда выполняется.
ИТОГ: Мы заглянули в нутро вещей. Рассмотрели кристаллические решетки
А теперь отвечаем на вопрос, который был задан в начале урока.
(слайды 14-16) Что общего у этих веществ? (типы кристаллических решеток)
Закрепление материала
(слайд 17)
Какие кристаллические решетки у О2, Н2О, NaCl, С?
Ответ учеников. О2 и Н2О – молекулярные кристаллические решетки, NaCl – ионная решетка, С – атомная решетка.
Кремний имеет атомную кристаллическую решетку. Каковы его физические свойства?
Оксид СО2 имеет низкую tпл, а кварц SiO2 – очень высокую (кварц плавится при 1725°С).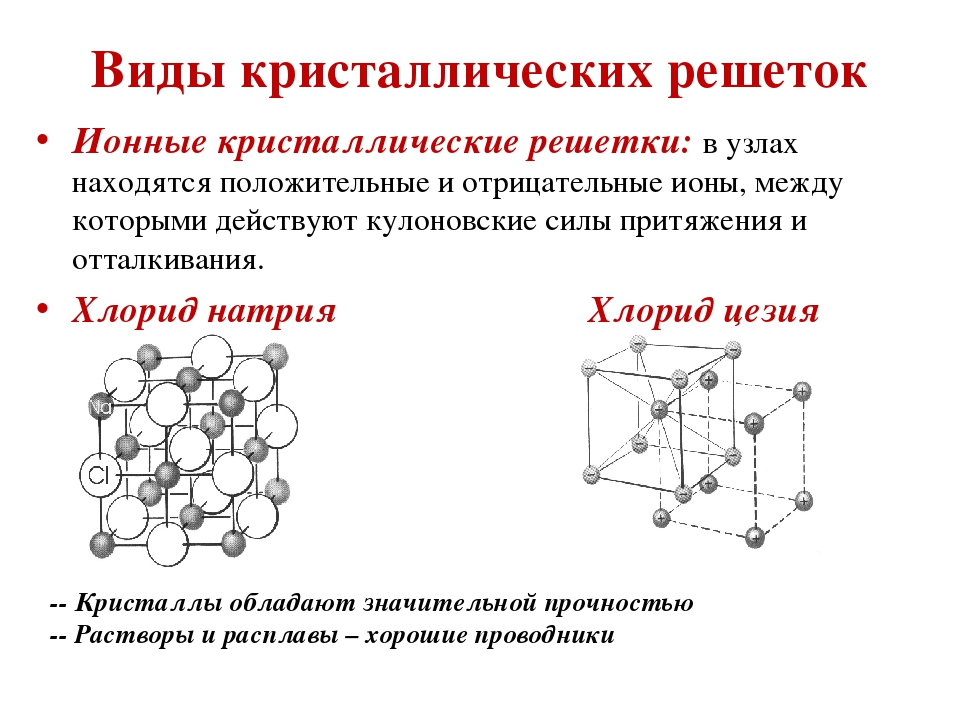 Какие кристаллические решетки они должны иметь?
Какие кристаллические решетки они должны иметь?
Я на бумаге оставляю (слайд 18)
Конечно, очень жирный след.
И рисовать вам помогаю
Уже я много – много лет!
Не прочен я, не как гранит!
А называюсь я … (графит)
Какое строение (кристаллическую решетку) имеет это вещество? Какими свойствами он обладает?
Горжусь своим я блеском (слайд 19)
И тем, что очень твёрд.
Разрежу я железку
На тысячи кусков.
Я – камень драгоценный,
Чужих боюсь я глаз!
Надеюсь, догадались:
Меня зовут… (алмаз)
Какое строение (кристаллическую решетку) имеет это вещество? Какими свойствами он обладает?
(слайд 20) Самостоятельная работа
Определить тип кристаллической решетки для веществ:
- 1 вариант: Н2, Са, КСl, Si, Н2S
- 2 вариант: Сl2, NaNO3, Mg, Н2SO4, С
(слайд 21) Домашнее задание § 22, упр.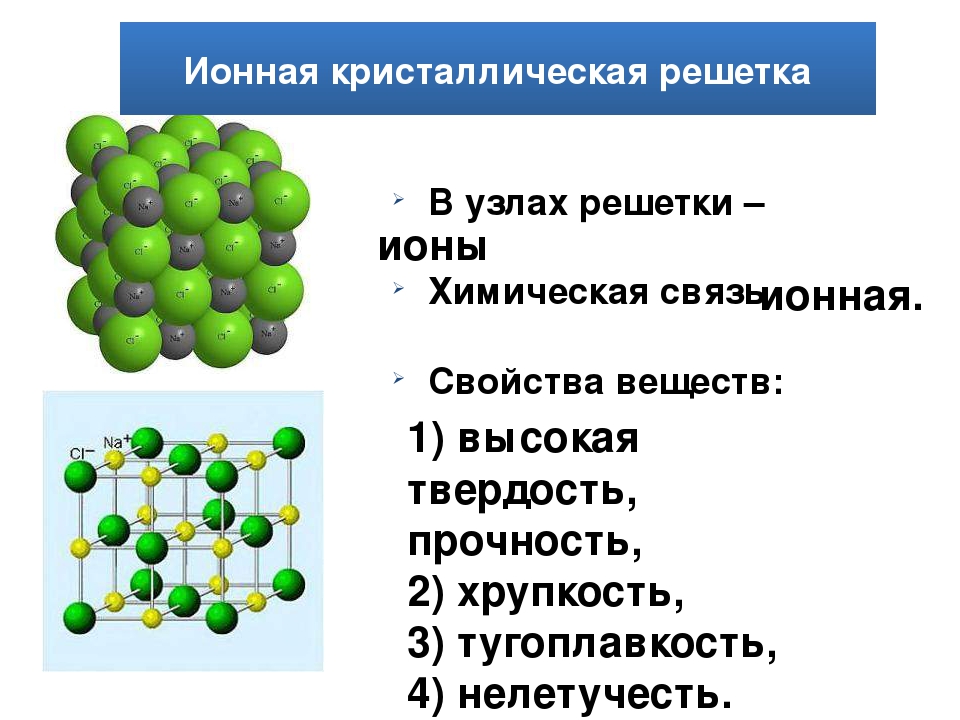 6
6
Используемая литература
- О.С.Габриелян и др. — Химия. 8 класс — М.: Дрофа, 2005.
- О.С.Габриелян и др.– Настольная книга учителя химии 8 класс – М.: Дрофа, 2005.
Помощь студентам в учёбе от Людмилы Фирмаль
Здравствуйте!
Я, Людмила Анатольевна Фирмаль, бывший преподаватель математического факультета Дальневосточного государственного физико-технического института со стажем работы более 17 лет. На данный момент занимаюсь онлайн обучением и помощью по любыми предметам. У меня своя команда грамотных, сильных бывших преподавателей ВУЗов. Мы справимся с любой поставленной перед нами работой технического и гуманитарного плана. И не важно: она по объёму на две формулы или огромная сложно структурированная на 125 страниц! Нам по силам всё, поэтому не стесняйтесь, присылайте.
Срок выполнения разный: возможно онлайн (сразу пишите и сразу помогаю), а если у Вас что-то сложное – то от двух до пяти дней.
Для качественного оформления работы обязательно нужны методические указания и, желательно, лекции. Также я провожу онлайн-занятия и занятия в аудитории для студентов, чтобы дать им более качественные знания.
Моё видео:
Как вы работаете?
Вам нужно написать сообщение в WhatsApp . После этого я оценю Ваш заказ и укажу срок выполнения. Если условия Вас устроят, Вы оплатите, и преподаватель, который ответственен за заказ, начнёт выполнение и в согласованный срок или, возможно, раньше срока Вы получите файл заказа в личные сообщения.
Сколько может стоить заказ?Стоимость заказа зависит от задания и требований Вашего учебного заведения. На цену влияют: сложность, количество заданий и срок выполнения.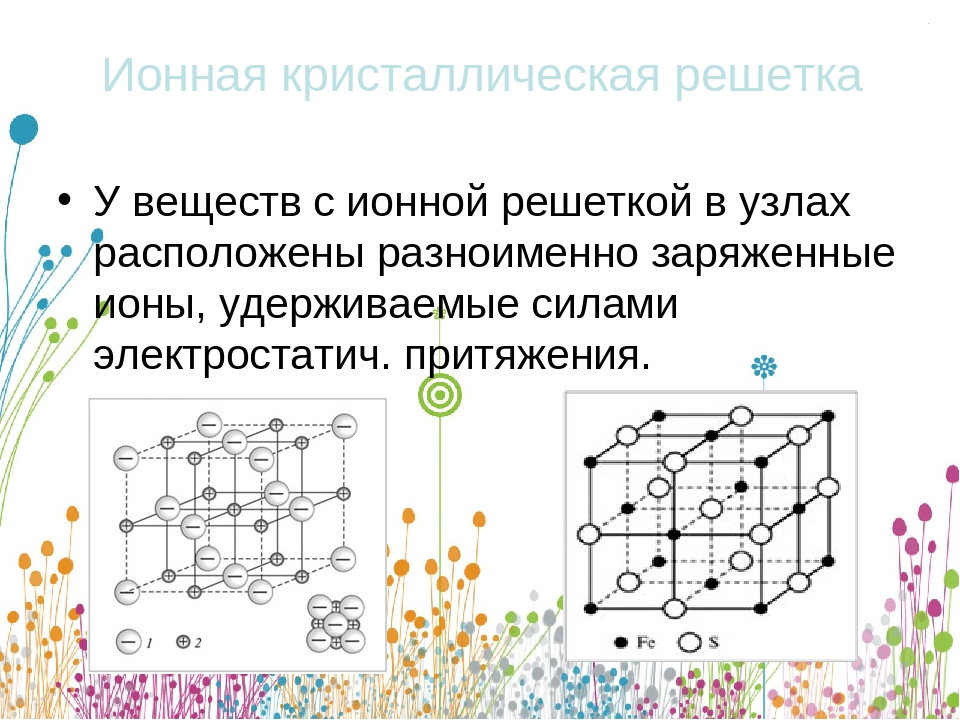 Поэтому для оценки стоимости заказа максимально качественно сфотографируйте или пришлите файл задания, при необходимости загружайте поясняющие фотографии лекций, файлы методичек, указывайте свой вариант.
Поэтому для оценки стоимости заказа максимально качественно сфотографируйте или пришлите файл задания, при необходимости загружайте поясняющие фотографии лекций, файлы методичек, указывайте свой вариант.
Минимальный срок выполнения заказа составляет 2-4 дня, но помните, срочные задания оцениваются дороже.
Как оплатить заказ?Сначала пришлите задание, я оценю, после вышлю Вам форму оплаты, в которой можно оплатить с баланса мобильного телефона, картой Visa и MasterCard, apple pay, google pay.
Какие гарантии и вы исправляете ошибки?В течение 1 года с момента получения Вами заказа действует гарантия. В течении 1 года я и моя команда исправим любые ошибки в заказе.
Качественно сфотографируйте задание, или если у вас файлы, то прикрепите методички, лекции, примеры решения, и в сообщении напишите дополнительные пояснения, для того, чтобы я сразу поняла, что требуется и не уточняла у вас. Присланное качественное задание моментально изучается и оценивается.
Присланное качественное задание моментально изучается и оценивается.
Теперь напишите мне в Whatsapp или почту и прикрепите задания, методички и лекции с примерами решения, и укажите сроки выполнения. Я и моя команда изучим внимательно задание и сообщим цену.
Если цена Вас устроит, то я вышлю Вам форму оплаты, в которой можно оплатить с баланса мобильного телефона, картой Visa и MasterCard, apple pay, google pay.
Мы приступим к выполнению, соблюдая указанные сроки и требования. 80% заказов сдаются раньше срока.
После выполнения отправлю Вам заказ в чат, если у Вас будут вопросы по заказу – подробно объясню. Гарантия 1 год. В течении 1 года я и моя команда исправим любые ошибки в заказе.
youtube.com/embed/Clc1txB_PxE» frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>
youtube.com/embed/7Oesl-SOw2I» frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>
youtube.com/embed/TDbubCz4IMs» frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>
Можете смело обращаться к нам, мы вас не подведем. Ошибки бывают у всех, мы готовы дорабатывать бесплатно и в сжатые сроки, а если у вас появятся вопросы, готовы на них ответить.
В заключение хочу сказать: если Вы выберете меня для помощи на учебно-образовательном пути, у вас останутся только приятные впечатления от работы и от полученного результата!
Жду ваших заказов!
С уважением
Пользовательское соглашение
Политика конфиденциальности
8.
 7: Ионная кристаллическая структура — Химия LibreTexts
7: Ионная кристаллическая структура — Химия LibreTexts- Последнее обновление
- Сохранить как PDF
- Ионная кристаллическая структура
- Резюме
- Участники и авторство
Кристаллы можно найти везде, где расположены химические месторождения.Кристаллы рубина чрезвычайно ценны как из-за красоты рубина, так и из-за его полезности в таком оборудовании, как лазеры. Некоторые утверждают, что кристаллы обладают магическими свойствами. Для других «волшебство» заключается в регулярной структуре кристалла, поскольку катионы и анионы выстраиваются в правильном порядке.
Ионная кристаллическая структура
Электронно-точечные диаграммы показывают характер переноса электрона, который происходит между атомами металла и неметалла.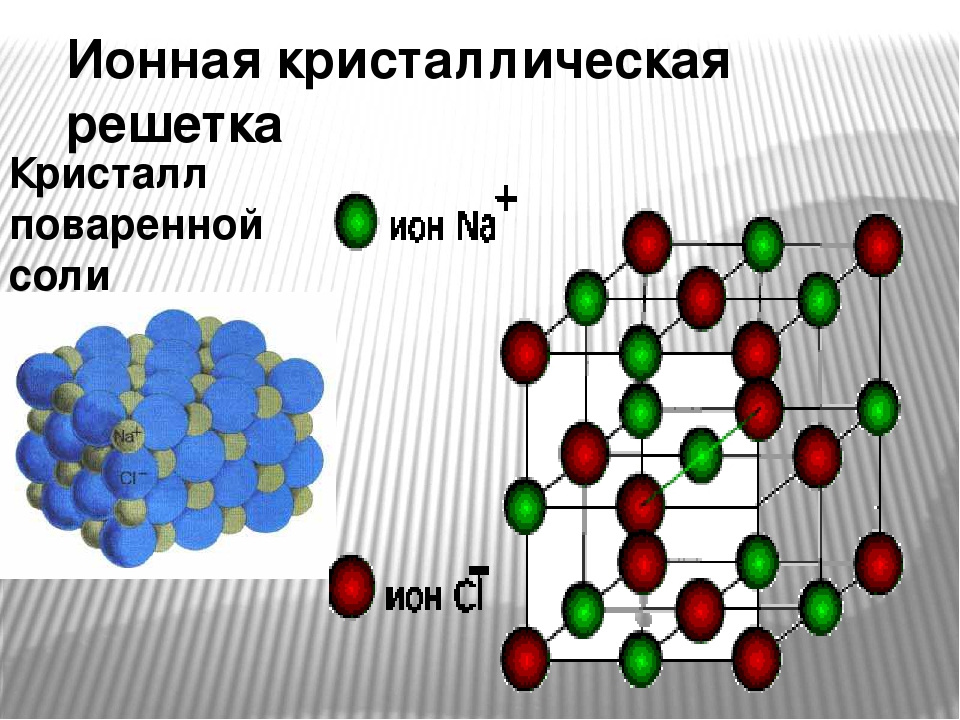 Однако ионные соединения не существуют в виде дискретных молекул, как можно предположить из точечных диаграмм.Чтобы минимизировать потенциальную энергию системы, ионные соединения принимают форму расширенного трехмерного массива чередующихся катионов и анионов. Это максимизирует силы притяжения между противоположно заряженными ионами. На рисунке ниже показаны два разных способа представления ионной кристаллической решетки. Модель шара и стержня позволяет легче увидеть, как отдельные ионы ориентированы друг относительно друга. Диаграмма заполнения пространства является более точным представлением того, как ионы упаковываются вместе в кристалле .-}\) ионов. (A) В расширенном виде расстояния между ионами преувеличены, что упрощает отображение координационных чисел каждого иона. (B) В модели заполнения пространства электронные облака ионов контактируют друг с другом.
Однако ионные соединения не существуют в виде дискретных молекул, как можно предположить из точечных диаграмм.Чтобы минимизировать потенциальную энергию системы, ионные соединения принимают форму расширенного трехмерного массива чередующихся катионов и анионов. Это максимизирует силы притяжения между противоположно заряженными ионами. На рисунке ниже показаны два разных способа представления ионной кристаллической решетки. Модель шара и стержня позволяет легче увидеть, как отдельные ионы ориентированы друг относительно друга. Диаграмма заполнения пространства является более точным представлением того, как ионы упаковываются вместе в кристалле .-}\) ионов. (A) В расширенном виде расстояния между ионами преувеличены, что упрощает отображение координационных чисел каждого иона. (B) В модели заполнения пространства электронные облака ионов контактируют друг с другом.
Встречающийся в природе хлорид натрия (галит) на первый взгляд не похож на аккуратные диаграммы, показанные выше. Только когда мы используем современные методы анализа кристаллической структуры на атомном уровне, мы можем увидеть истинную регулярность организованных ионов.
Только когда мы используем современные методы анализа кристаллической структуры на атомном уровне, мы можем увидеть истинную регулярность организованных ионов.
Резюме
- Ионные соединения принимают форму расширенных трехмерных массивов катионов и анионов.
- Расположение максимально увеличивает силу притяжения между противоположно заряженными ионами.
Авторы и авторство
Фонд CK-12, созданный Шэрон Бьюик, Ричардом Парсонсом, Терезой Форсайт, Шонной Робинсон и Джин Дюпон.
6.4: Ионная кристаллическая решетка
- Последнее обновление
- Сохранить как PDF
- Авторы
До сих пор мы рассматривали, что произойдет, если объединить один атом Li и один атом H. Когда объединяется большое количество атомов каждого вида, результат несколько отличается.Электроны снова переносятся, и образуются ионы, но ионы уже не образуют пары попарно. Вместо этого под влиянием их взаимного притяжения и отталкивания они собираются вместе в гораздо более крупные агрегаты, в конечном итоге образуя трехмерный массив, подобный показанному на рисунке \(\PageIndex{1}\). На макроскопическом уровне образуется кристалл твердого гидрида лития.
Когда объединяется большое количество атомов каждого вида, результат несколько отличается.Электроны снова переносятся, и образуются ионы, но ионы уже не образуют пары попарно. Вместо этого под влиянием их взаимного притяжения и отталкивания они собираются вместе в гораздо более крупные агрегаты, в конечном итоге образуя трехмерный массив, подобный показанному на рисунке \(\PageIndex{1}\). На макроскопическом уровне образуется кристалл твердого гидрида лития.
Формирование такой ионной кристаллической решетки приводит к более низкой потенциальной энергии, чем это возможно, если ионы группируются только в пары.Из рисунка кристаллической решетки легко понять, почему это должно быть так. В ионной паре каждый ион Li + близок только к одному иону H – , тогда как в кристаллической решетке он близок не менее чем к шести ионам противоположного заряда. И наоборот, каждый ион H – окружен шестью ионами Li + . Поэтому в кристаллической решетке сближается больше противоположных зарядов, чем это возможно для отдельных пар ионов, и потенциальная энергия ниже на дополнительные 227 кДж моль –1 .Расположение ионов в кристалле LiH соответствует минимально возможной энергии. Если бы существовало альтернативное геометрическое расположение, сближающее еще больше ионов с противоположным зарядом, чем показано на рисунке, то ионы Li + и ионы H – , безусловно, приняли бы его.
Поэтому в кристаллической решетке сближается больше противоположных зарядов, чем это возможно для отдельных пар ионов, и потенциальная энергия ниже на дополнительные 227 кДж моль –1 .Расположение ионов в кристалле LiH соответствует минимально возможной энергии. Если бы существовало альтернативное геометрическое расположение, сближающее еще больше ионов с противоположным зарядом, чем показано на рисунке, то ионы Li + и ионы H – , безусловно, приняли бы его.
 Дэвис и Дж. В. Мур.)
Дэвис и Дж. В. Мур.)Ионная решеткаХрустальная упаковкаВ ионном твердом теле ионы упакованы вместе в повторяющийся массив, называемый кристаллической решеткой.Концепция кристаллической упаковки предполагает, что ионы представляют собой твердые сферы. Самый простой способ изобразить такой массив — расположить один слой сфер, а затем разместить последовательные слои над ним. Простейшая конструкция — это когда сферы в основании расположены рядом друг с другом. Последовательный
Затем слои сфер добавляются непосредственно поверх сфер нижнего слоя. Этот
тип массива известен как простая кубическая упаковка . Альтернативный вариант упаковки можно получить, поместив второй слой
сферы над отверстиями (или междоузлиями) базового слоя. Другой набор имеет базовый слой сфер, организованных в виде шестиугольника в
в котором каждая сфера окружена шестью соседями в плоскости. Каждая сфера имеет координационное число двенадцать.  Если третий слой сфер вместо размещения над отверстием второго
слой, размещается поверх отверстий, не закрытых от первого слоя, расположение называется куб.плотно упакованный . Каждая сфера имеет координационное число двенадцать. Элементарные ячейкиПростейшее расположение сфер, которое позволит воспроизвести весь кристалл повторяющаяся структура называется элементарной ячейкой . Элементарные ячейки для порядок упаковки показан ниже.Ионная решеткаВ большинстве ионных соединений анионы намного крупнее катионов, и это анионы, образующие кристаллический массив. Меньшие катионы находятся в отверстиях между анионы. Основные понятия:
Если размер катиона слишком велик, чтобы обеспечить оптимальное соотношение 0,414, анионы будут разделены.
Можно предсказать координационное число для солей, не соответствующих ни одному из перечисленных типов. в таблице выше.
Устойчивость решеток и правила разрешимостиСравним энергии решетки трех солей одной и той же стехиометрии 1:1. (А + Х — , Б + У — , С + З — ).Предположим следующее: (А + Х — , Б + У — , С + З — ).Предположим следующее:
Если сравнить общую энергию гидратации катионов и анионов в каждой из этих солей,
можно ожидать, что сумма этих энергий будет пропорциональна Z 2 /r для катионов плюс
Z 2 /r для аниона (уравнение соли Латимете). Таким образом, конечная причина того, что некислотные катионы и неосновные анионы образуют нерастворимые соли, заключается в том, что оба иона большие (одинаковые по размеру), образуя особенно стабильную кристаллическую решетку, но не давая особенно хороших энергий гидратации по сравнению с к энергии решетки. Причина того, что кислые катионы и неосновные анионы образуют растворимые соли, заключается в том, что ионы сильно различаются по размеру, что дает более низкую энергию решетки
чем энергия гидратации. Трудность предсказания растворимости солей слабоосновных анионов, таких как сульфат возникает из-за того, что эти анионы являются достаточно основными, чтобы иметь термин -TDS умеренно благоприятствует осаждению кислыми катионами, в то время как термин DH неблагоприятен из-за того, что анион значительно больше, чем у большинства кислых катионов.Поэтому обобщенное правило растворимости следует изменить следующим образом: большие -2-зарядные (слабоосновные) анионы, такие как сульфат, лучше всего осаждаются большими +2-зарядными (слабокислотными) катионами (такими как барий). Меньшие, слабоосновные анионы, такие как NO 2 — и ClO 2 — , не имеют терминов -TDS и DH, которые указывают на нерастворимость. Соли этих анионов обычно растворимы. |
Энергия решетки
Энергия решетки
Энергии решетки и сила ионной Бонд
Сила притяжения между противоположно заряженными частицами прямо пропорциональна
произведению начислений на два объекта ( q 1 и q 2 )
и обратно пропорциональна квадрату расстояния между объектами ( r 2 ).
Прочность связи между ионами противоположного заряда в ионном соединении поэтому зависит от зарядов ионов и расстояния между центрами ионы, когда они упаковываются, образуя кристалл.
Оценку прочности связей в ионном соединении можно получить с помощью измерение энергии решетки соединения, которая представляет собой энергию, выделяемую при противоположно заряженные ионы в газовой фазе объединяются, образуя твердое тело.
Пример: Энергия решетки NaCl представляет собой энергию, выделяемую при взаимодействии Na + и Cl — . ионы в газовой фазе объединяются, образуя решетку чередующихся Na + и Ионы Cl — в кристалле NaCl показаны на рисунке ниже.
| Na + ( г ) + Cl — ( г ) NaCl( с ) | H или = -787.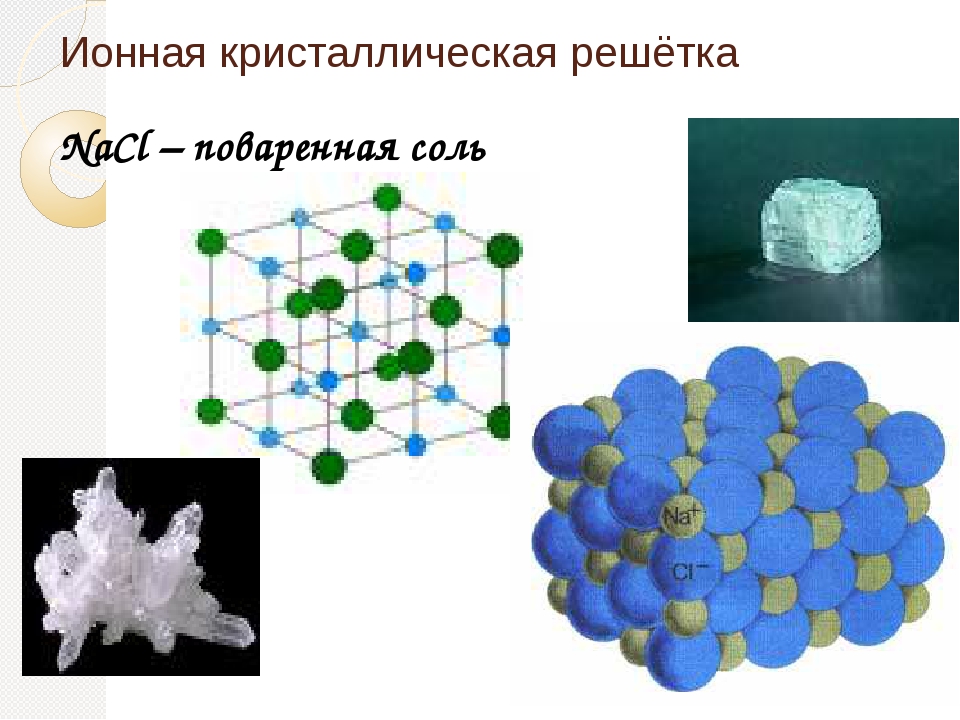 3 кДж/моль 3 кДж/моль |
Энергии решетки ионных соединений относительно велики. Энергия решетки NaCl, например, составляет 787,3 кДж/моль, что лишь немного меньше выделяемой энергии когда горит природный газ.
Связь между ионами противоположного заряда наиболее прочна, когда ионы маленькие.
Энергии решетки для галогенидов щелочных металлов, таким образом, самые большие для LiF и наименьший для CsI, как показано в таблице ниже.
Энергия решетки галогенидов щелочных металлов (кДж/моль)
| Ф — | Класс — | Бр — | I — | |||||
| Ли + | 1036 | 853 | 807 | 757 | ||||
| Нет данных + | 923 | 787 | 747 | 704 | ||||
| К + | 821 | 715 | 682 | 649 | ||||
руб.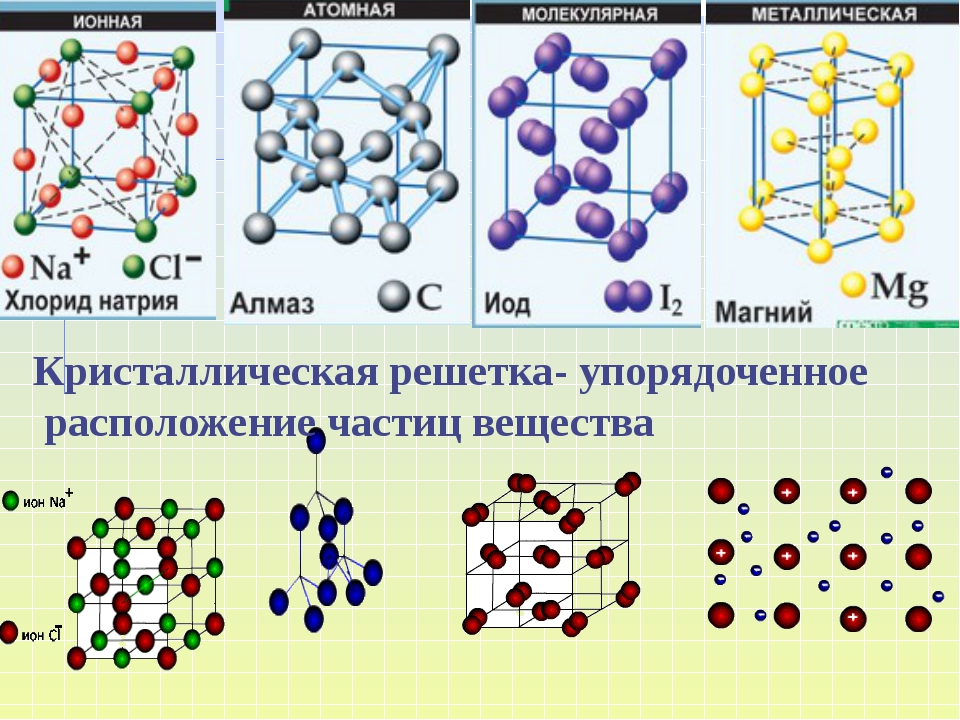 + + | 785 | 689 | 660 | 630 | ||||
| Cs + | 740 | 659 | 631 | 604 |
Ионная связь также должна становиться прочнее по мере увеличения заряда ионов.Данные в таблице ниже показывают, что энергии решетки для солей ОН — и O 2- быстро увеличиваются по мере увеличения заряда иона.
Энергии решетки солей ОН — и О 2- Ионы (кДж/моль)
| ОХ — | О 2- | |||
| Нет данных + | 900 | 2481 | ||
| Мг 2+ | 3006 | 3791 | ||
| Ал 3+ | 5627 | 15 916 |
Энергия решетки и растворимость
Когда соль, такая как NaCl, растворяется в воде, кристаллы исчезают на макроскопическом
масштаб. В атомном масштабе ионы Na + и Cl — в кристалле равны
выпущен в раствор.
В атомном масштабе ионы Na + и Cl — в кристалле равны
выпущен в раствор.
| NaCl( s ) | Н 2 О | Na + ( водный раствор ) + Cl — ( водный раствор ) |
Таким образом, энергия решетки соли дает приблизительное представление о растворимости соль в воде, потому что она отражает энергию, необходимую для разделения положительного и отрицательные ионы в соли.
Соли натрия и калия растворимы в воде, потому что они имеют относительно небольшую
энергии решетки. Соли магния и алюминия часто гораздо менее растворимы, потому что они
требуется больше энергии, чтобы разделить положительные и отрицательные ионы в этих солях. NaOH, для
Например, хорошо растворяется в воде (420 г/л), но Mg(OH) 2 растворяется в воде
только до 0,009 г/л, а Al(OH) 3 практически нерастворим в воде.
ионные структуры
Как расположены ионы в хлориде натрия
Хлорид натрия считается типичным ионным соединением.Подобные соединения состоят из гигантской (бесконечно повторяющейся) решетки ионов. Таким образом, хлорид натрия (и любое другое ионное соединение) описывается как имеющий гигантскую ионную структуру.
Вам должно быть ясно, что гигант в данном контексте не означает просто очень большой. Это означает, что вы не можете точно сказать, сколько существует ионов.
Могут быть миллиарды ионов натрия и ионов хлора, упакованных вместе, или триллионы, или что-то еще — это просто зависит от размера кристалла.Это отличается, скажем, от молекулы воды, которая всегда содержит ровно 2 атома водорода и один атом кислорода — никогда больше и никогда меньше.
Небольшой образец решетки хлорида натрия выглядит следующим образом:
Если вы внимательно посмотрите на схему, то увидите, что ионы натрия и ионы хлора чередуются друг с другом в каждом из трех измерений.
Эту диаграмму достаточно легко нарисовать на компьютере, но чрезвычайно сложно убедительно нарисовать вручную.Обычно мы рисуем «взорванную» версию, которая выглядит так:
.На самом деле соприкасаются друг с другом только те ионы, которые соединены линиями. Ион натрия в центре соприкасается с 6 ионами хлора. Случайно мы могли бы с тем же успехом расположить диаграмму вокруг иона хлорида, который, конечно же, был бы затронут 6 ионами натрия. Хлорид натрия описывается как 6:6-координированный.
Вы должны помнить, что эта диаграмма представляет собой лишь крошечную часть всего кристалла хлорида натрия.Картина повторяется таким образом для бесчисленных ионов.
Как нарисовать эту структуру
Нарисовать идеальный квадрат:
Теперь нарисуйте такой же квадрат позади этого и немного сместите его. Возможно, вам придется немного потренироваться, чтобы правильно расположить два квадрата. Если вы ошибетесь, все ионы перепутаются друг с другом на вашей окончательной диаграмме.
Если вы ошибетесь, все ионы перепутаются друг с другом на вашей окончательной диаграмме.
Превратите это в идеальный куб, соединив квадраты вместе:
Теперь самое сложное! Разделите этот большой куб на 8 маленьких кубов, соединив среднюю точку каждого ребра с средней точкой ребра напротив него.Чтобы завершить процесс, вам также нужно будет соединить среднюю точку каждой грани (легко найти, когда вы соедините края) с средней точкой противоположной грани.
Теперь все, что вам нужно сделать, это вставить ионы. Используйте разные цвета или разные размеры для двух разных ионов и не забудьте ключ. Неважно, окажетесь ли вы в центре куба ионом натрия или ионом хлорида — важно лишь то, что они чередуются во всех трех измерениях.
Вы должны быть в состоянии нарисовать совершенно адекватный набросок этого от руки менее чем за две минуты — менее одной минуты, если вы не слишком привередливы!
Почему хлорид натрия имеет соотношение 6:6?
Чем сильнее притяжение между положительными и отрицательными ионами, тем больше энергии высвобождается. Чем больше энергии высвобождается, тем более энергетически стабильной становится структура.
Чем больше энергии высвобождается, тем более энергетически стабильной становится структура.
Это означает, что для достижения максимальной стабильности необходимо максимальное количество аттракционов. Так почему же каждый ион окружает себя 6 ионами противоположного заряда?
Это максимальное количество ионов хлора, которое вы можете уместить вокруг центрального иона натрия до того, как ионы хлора начнут касаться друг друга. Если они начнут соприкасаться, вы создадите отталкивание в кристалле, что сделает его менее устойчивым.
Энергия решетки ионных кристаллов
Энергия решетки является мерой энергии, содержащейся в кристаллической решетке. Это количество энергии, необходимое для разделения моля ионного твердого вещества на газообразные ионы. Энергию решетки нельзя измерить эмпирически, но ее можно рассчитать с помощью электростатики или оценить.
Энергия решетки ионного кристалла — ионный кристалл представляет собой твердое тело, состоящее из положительных и отрицательных ионов, организованных в кристаллы, которые состоят из регулярно повторяющихся единиц и удерживаются вместе за счет ионной связи и электростатического притяжения.
ионных кристаллов:
- Точки решетки заняты положительными и отрицательными ионами.
- Твердые и хрупкие твердые вещества.
- Высокая температура плавления из-за очень сильных электростатических сил притяжения.
- Плохие проводники электричества в твердом состоянии, но хорошие в подвижном состоянии.
- Упаковка сфер зависит от присутствия заряженных частиц и разницы в размерах анионов и катионов.
В ионных кристаллах действуют как минимум две силы.Есть,
- Электростатическая сила притяжения (Потенциальная энергия притяжения)
- Межатомная сила отталкивания (Потенциальная энергия отталкивания)
Изменение потенциальной энергии противоположно заряженных ионов при их межъядерном разделении (r) в ионном кристалле показано ниже:
Изменение потенциальной энергии (ПЭ) противоположно заряженных ионов при их межъядерном разделении (r) в ионном кристалле . На этом же рисунке показана и полная (результирующая) потенциальная энергия, r ° — равновесное расстояние, при котором потенциальная энергия минимальна. Таким образом, если принять, что потенциальная энергия ионов, разделенных бесконечным расстоянием, равна нулю, то минимальная потенциальная энергия при r ° становится численно равной энергии решетки U кристалла. (при r ° , dU/dr=0)
Таким образом, если принять, что потенциальная энергия ионов, разделенных бесконечным расстоянием, равна нулю, то минимальная потенциальная энергия при r ° становится численно равной энергии решетки U кристалла. (при r ° , dU/dr=0)
Энергия решетки:
Энергия решетки определяется как количество энергии, высвобождаемой, когда составные ионы сближаются из бесконечности на расстояния связи, образуя один моль твердой решетки.
M + (ж) + X – (ж) → MX (с) (U= -ve)
Когда любая система становится стабильной, она высвобождает энергию.Минимальная энергия, максимальная стабильность системы. Следовательно, энергия решетки такая же по величине, но противоположна по знаку энергии диссоциации кристалла. Следовательно, чем больше значение энергии решетки, тем больше энергии требуется для распада ионного кристалла на его ионы М + и Х – . Энергия решетки также может быть определена как количество энергии, высвобождаемой при объединении газообразных катиона и аниона и образовании одного моля ионного соединения.
Na + (г) + Cl – (г) → NaCl (т)
При образовании NaCl и катион, и анион находятся в газообразном состоянии. Когда оба иона объединяются, они образуют один моль NaCl, и количество энергии, высвобождаемой при этом, называется энергией решетки.
Теоретический расчет энергии решетки:
1. Уравнение Борна-Ланде:
Уравнение Борна-Ланде является средством расчета энергии решетки кристаллического ионного соединения.В 1918 году Макс Борн и Альфред Ланде предложили, чтобы энергия решетки могла быть получена из электростатического потенциала ионной решетки и члена потенциальной энергии отталкивания.
Предположения этой модели следующие:
- Ионные кристаллы состоят из правильной ориентации противоположно заряженных ионов, которые рассматриваются как твердые сферы.
- Ионы удерживаются вместе сильными электростатическими силами.
- Внутри кристалла помимо кулоновских сил существует короткодействующая сила отталкивания, возникающая из-за взаимопроникновения электронных облаков.

- В равновесии силы притяжения и отталкивания взаимно уравновешиваются.
Вывод выражения энергии решетки:
. Рассмотрим ионную пару, разделенную расстоянием r и предполагая, что ионы являются точечными зарядами. Теперь, если эти два иона приблизить друг к другу, то энергия системы будет уменьшаться до тех пор, пока не будет достигнут минимум, а при еще большем сближении ионов происходит резкое увеличение энергии (как показано на графике выше).Когда ионы приближаются друг к другу, единственная сила, действующая между ними первой, — это сила притяжения, которая прямо пропорциональна произведению зарядов и обратно пропорциональна расстоянию между ними. Таким образом, (PE) притяжение определяется как:
(PE) притяжение = − 1/4πε ° ( Z + Z – e 2 /r)
Поскольку ионы подходят очень близко друг к другу, они отталкиваются друг от друга из-за взаимопроникновения их электронных облаков. (PE) отталкивание определяется как:
(PE) отталкивание определяется как:
(PE) отталкивание = B/r n
Где,
- B = константа отталкивания (постоянная)
- n = показатель Борна
В кристаллической решетке каждый катион/анион подвергается притягивающему взаимодействию с непохожими ионами и отталкивающему взаимодействию с близко расположенными подобными ионами. Сумма всех их геометрических взаимодействий называется константой Маделунга, представленной символом А.
(PE) аттракцион = — A / 4πε ° (Z + Z — E 2 / R) или (PE)
- 3 Attraction = — AKZ + Z — е 2 /r
- N A = постоянная Авогадро
- A = постоянная Маделунга, связанная с геометрией кристалла заряд электрона 1.

- r = расстояние до ближайшего иона A AKZ + Z – e 2 / р [ 1 − 1 / п ]
- N A = 6.023 × 10 23
- E = 1,6 × 10 -19 C
- ε ° = 8,85 × 10 -12 CJ -1 M -2
Подставив все эти значения, мы получим
У = – 1.39×10 5 (Z + Z – e 2 ) / r [ 1 − 1 / n ] кДж / моль
Постоянная Маделунга:
Постоянная Маделунга используется для определения электростатического потенциала отдельного (каждого) иона в кристалле путем аппроксимации ионов точечным зарядом.
- Значение этой константы зависит от геометрии кристалла и не зависит от величины Z + , Z – и, r.
- Безразмерная константа.
1-D кристалл NaCl:
Электростатический потенциал ближайших ионов:
U = − 2e 2 / 4πε ° (r e )
Электростатический потенциал следующих ближайших ионов:
U = + 2e 2 / 4πε ° (2r e )
Электростатический потенциал всего кристалла:
U = — 2e 2 / 4πε ° (R E ) + 2e 2 / 4πε ° (2R E ) — 2E 2 / 4πε ° (3R E ) + ….

U = − 2e 2 / 4πε ° r e (1 − 1/2 + 1/3 − 1/4 ….)
U = − 2e 2 / 4πε ° r e ln2
U = − e 2 / 4πε ° r e 2ln2
U = − e 2 / 4πε ° r e A
А – постоянная Маделунга = 2 ln2
2-D кристалл NaCl:
Электростатический потенциал ближайших ионов:
U = − 4e 2 / 4πε ° (r e )
Электростатический потенциал следующих ближайших ионов:
U = + 4e 2 / 4πε ° (√2r e )
Электростатический потенциал всего кристалла:
u = — 4e 2 / 4πε ° (R E ) + 4E 2 / 4πε ° (√2R E ) — 4E 2 / 4πε ° (2R E ) + 8e 2 / 4πε ° (2√2 r e ) ….
U = − e 2 / 4πε ° r e (4 − 4/√2 + 4/2 − 8/2√2 ….
 )
)U = − e 2 / 4πε ° r e A
A — постоянная Маделунга = (4 − 4/√2 + 4/2 − 8/2√2 …. )
Трехмерный кристалл NaCl:
Электростатический потенциал ближайших ионов:
U = − 6e 2 / 4πε ° (r e )
Электростатический потенциал следующих ближайших ионов:
U = + 12e 2 / 4πε ° (√2r e )
Электростатический потенциал всего кристалла:
U = — 6E 2 / 4πε ° (R E ) + 12E 2 / 4πε ° 9 /4 √2R E ) — 8E 2 / 4πε ° (√3 r e ) + 6e 2 / 4πε ° (√4 r e ) ….
U = − e 2 / 4πε ° r e (6/2 − 12/√2 + 8/√3 − 6/√4 ….)
U = − e 2 / 4πε ° r e A
A – постоянная Маделунга = (6/2 − 12/√2 + 8/√3 − 6/√4 ….
 ) = 1,74756 ·
) = 1,74756 ·9012
Структура Madelung Constance «A» 1.74756 1.76267 Zink Blende (ZNS) 1 .63806 Wurtzite (ZNS) 1.64132 RUTILE (TiO 2 ) 2 ) 2 Anatase (TiO 2 ) 2.400 Флюорит (CAF 2 ) 2.51939 Корунд (Al 2 O 3 ) 4.17186 0 1:10108
6
Показатель Борна — это мера сопротивления, которое проявляют ионы, когда они вынуждены приближаться друг к другу на близкое расстояние.
- Атомы не имеют твердой оболочки и обладают слабой сжимаемостью.

- Этот коэффициент основан на принципиальном квантовом числе самого внешнего электрона.
Принцип квантового номера внешнего электрона рожденных показателей «N» 5 9 2 7 3 9 4 10 5 12 Что такое показатель Борна «n» для перечисленных ниже ионов:
- LI +
- BR —
- ZN 2+
- O 2-
- 2-
- 2 для LI + :
Нам нужно определить главное квантовое число самых удаленных электронов.Электронная конфигурация лития Li: 1s 2 , 2s 1 . Когда литий теряет свой валентный электрон и становится ионом Li + 1s 2 . Таким образом, это означает, что главное квантовое число этих самых удаленных электронов равно 1, что означает, что Li + будет иметь прирожденный показатель степени 5.

Для Br
– :Электронная конфигурация BROMINE BR 1S 2 , 2S 2 , 2P 2 , 3S 2 , 3P 6 , 4S 2 , 3D 10 , 4P 5 .Когда бромин получает электрон и становится ION BR — 1S 2 , 2S 2 , 2S 6 , 3S 2 , 3P 6 , 4S 2 , 3D 10 , 4P 6 . Таким образом, это означает, что главное квантовое число этих самых удаленных электронов равно 4, что означает, что Br – будет иметь прирожденный показатель степени 10.
Для Zn
2+ :Электронная конфигурация цинка Zn 1S 2 , 2S 2 , 2P 6 , 3S 2 , 3P 6 , 4S 2 , 3D 10 .Когда цинк теряет свои 4S 2 электрона и становится ионом Zn 2+ 1S 2 , 2S 2 , 2P 6 , 3S 2 , 3P 6 , 3D 10 .
 Таким образом, это означает, что главное квантовое число этих самых удаленных электронов равно 3, что означает, что Zn 2+ будет иметь рожденный показатель степени 9.
Таким образом, это означает, что главное квантовое число этих самых удаленных электронов равно 3, что означает, что Zn 2+ будет иметь рожденный показатель степени 9.Для О
2- :Электронная конфигурация Oxygen O 2 : 1s 2 , 2s 2 , 2p 4 .Когда кислород получает два электрона и становится ионом O 2- 1s 2 , 2s 2 , 2p 6 . Таким образом, это означает, что главное квантовое число этих самых удаленных электронов равно 2, что означает, что O 2- будет иметь прирожденный показатель степени 7.
Каков средний показатель Борна для солей, перечисленных ниже:
- LiBr
- ZnO
Для LiBr:
Для литий-ионных аккумуляторов показатель Борна равен 5.
Для иона брома значение показателя Борна равно 10.
Для LiBr принятие среднего значения 5+10/2 означает, что LiBr будет иметь показатель Борна, равный 7,5.

Для ZnO:
Для иона цинка значение показателя Борна равно 9.
Для оксид-иона значение показателя Борна равно 7.
Для ZnO среднее значение 9+7/2 означает, что ZnO будет иметь показатель Борна, равный 8.
2. Уравнение Капустинского:
Уравнение Капустинского вычисляет энергию решетки U для ионного кристалла, которую трудно определить экспериментально.Он назван в честь Анатолия Федоровича Капустинского , опубликовавшего формулу в 1956 году.
U = – N A A K Z + Z – e 2 / r [ 1 − 1 / n ] J —— Уравнение Борна-Ланде
Более строгое рассмотрение выражения энергии решетки было проведено Мейяром при расчете потенциала отталкивания и, наконец, пришло к уравнению:
U = – N A A K Z + Z – e 2 / r ° [ 1 − ρ / r ° ] J
Для случаев, когда тип решетки неизвестен, константа Маделунга недоступна, мы не можем использовать уравнение Борна-Ланде для определения энергии решетки таких соединений, и для таких решеток используется уравнение Капустинского .

U = – 1,2×10 5 x Z + Z – / r ° [ 1 − 34,5 / r ° ] КДж/моль
Где
- X= Общее число ионов в формуле ионных соединений (2 для NaCl, 3 для MgF 2 и т.д.)
- Увеличивается с увеличением заряда ионов
- Больше для меньших ионов
Закон Гесса постоянного теплового суммирования:
Процесс Борна-Габера основан на законе Гесса.Этот закон был открыт экспериментально в 1840 году немцем Генрихом Гессом , профессором из Санкт-Петербурга, Россия.
Заявление:
«Количество тепла, выделяющегося или поглощаемого при изменении (физическом или химическом), остается неизменным независимо от того, происходит ли изменение в одну или несколько стадий»
Предположим, что A можно превратить в D непосредственно в одну стадию с изменением энтальпии ∆H, если реакция может идти по пути от ABC с изменением энтальпии ∆H 1 , ∆H 2 , ∆H 3 соответственно.
 Согласно закону Гесса,
Согласно закону Гесса,∆H = ∆H 1 + ∆H 2 + ∆H 3
Проверка закона Гесса:
Образование карбоната натрия можно изучать как одностадийный или двухстадийный процесс.
Одноэтапный процесс:
2NaOH + CO 2 → Na 2 CO 3 + H 2 O ∆H = −89,08 кДж/моль
Двухэтапный процесс:
NaOH + CO 2 → NaHCO 3 ∆H = −48.06 кДж/моль
NaHCO 3 + NaOH → Na 2 CO 3 + H 2 O ∆H = −41,02 кДж/моль
Согласно закону Гесса,
∆H = ∆H 1 + ∆H 2
-89,08 = -48,06 — 41,02
-89,08 = -89,08
Следовательно, закон Гесса подтверждается
Применение закона Гесса:
Существует много соединений, для которых ∆H нельзя измерить непосредственно калориметрическим методом.

- Теплота образования CCl 4 , поскольку его нельзя получить прямой реакцией углерода и хлора. Точно так же теплоты образования оксида бора (B 2 O 3 ) и оксида алюминия (Al 2 O 3 ) создают проблемы для измерения стандартных энтальпий их образования.
- Теплота образования монооксида углерода за счет образования диоксида углерода. Следовательно, энтальпия таких соединений может быть измерена косвенно по закону Гесса.
C (графит) + O 2 → CO 2 ∆H (графит) = −393 кДж/моль
CO + 1/2 O 2 → CO 2 ∆H 2 = −283 кДж/моль
C (графит) + 1/2 O 2 → CO ∆H 1 = ? кДж/моль
Согласно закону Гесса,
∆H = ∆H 1 + ∆H 2
∆H 1 = ∆H − ∆H 2
∆H 1 = −393 − (−283)
∆H 1 = −110 кДж/моль
-110 кДж/моль — изменение энтальпии образования COЦикл Борна-Габера — поиск энергии решетки:
Цикл Борна-Габера — это особое применение закона Гесса, которое используется для определения энергии решетки бинарных ионных соединений.
 В цикле Борна-Габера в процессе задействовано много терминов энергии.
В цикле Борна-Габера в процессе задействовано много терминов энергии.Теплота образования:
«Количество теплоты, выделяющееся при образовании 1 моля соединения из его элементов в чистом и стабильном состоянии»
Na (т) + 1/2 Cl 2(г) → NaCl (т) ∆H f =?
Разница в энергии решетки и теплоте образования заключается в том, что при энергии решетки газообразные катион и анион объединяются и образуют 1 моль ионного соединения, а при теплоте образования чистое и стабильное состояние атома объединяется и образует ионное соединение.
Связь между ∆H
f и энергией решетки:- При получении NaCl используются два метода. Один из них — прямой метод (одноэтапный), а другой — непрямой метод (несколько этапов).
- Косвенный метод используется для определения энергии решетки NaCl (ионная связь) в цикле Борна-Габера.
- Энергия, высвобождаемая за один шаг, называется ∆H f
- Энергия, высвобождаемая за несколько шагов, называется энергией решетки.

- Принципом цикла Борна-Габера является закон Гесса (энергия, задействованная в одном шаге = энергия, задействованная в разных шагах)
∆H f = ∆H sub + I.E + ∆H diss + E.A + U
Теперь рассчитаем энергию решетки хлорида натрия,
В одном шаге:
Na (т) + 1/2 Cl 2(г) → NaCl (т) ∆H f = -411 кДж/моль
В несколько шагов»
Na (т) → Na (г) ∆H sub = +108 кДж/моль
Na (г) → Na + (г) I.E = +496 кДж/моль
1/2 Cl 2(г) → Cl (г) ∆H дисс = +122 кДж/моль
Cl (г) → Cl – (г) E.А = -349 кДж/моль
Na + (г) + Cl – (г) → NaCl (тв) L.
 E = ?
E = ? ∆H f = ∆H sub + I.E + ∆H diss + E.A + U
-411 = +108 + 496 + 122 – 349 + U
У = = -411 -108 -496 -122 +349
U = – 788 кДж/моль
Энергия решетки U составляет -788 кДж/моль
В случае MgO
Первое сродство к электрону при образовании O – отрицательно, потому что оно экзотермическое и выделяется тепло.Но сродство ко второму электрону положительно, потому что второй электрон отталкивается от уже присутствующего электрона, поэтому энергия передается присоединяющимся электроном. Итак, сродство ко второму электрону эндотермическое и положительное.
ΔH F = ΔH SUB + I.E 1 + I.E 2 + ΔH DISP + E.A 1 + E.A 2 + U
Энергия решетки для некоторых ионных соединений:
9012
Соединения Rattiction Energy (KJ / MOL) 9151 9158 NAF 910 NaCl 788 NaBr 732 NaI 682 KF 808 KCl 701 KBr 671 CSCL 657 657 CSI 600 2 2127 MgO 3795 CAO 3414 ООО 3217 СН 7547 Фактор, от которого зависит энергия решетки:
Na + (г) + Cl – (г) → NaCl (к) (л.
 Е)
Е)- Энергия высвобождается из-за притяжения между Na + и Cl –
- Больше притяжения = больше прочность связи
- Больше энергии высвобождается = больше стабильности
F ∝ q 3 q /р 2
F = K q 1 q 2 / r 2
- q 1 и q 2 – заряды на ионах.
- r — расстояние между ними.
F ∝ Энергия решетки
Фактор 1:
Энергия решетки ∝ Z + Z –
Энергия решетки прямо пропорциональна заряду катиона и аниона.
Фактор 2:
Энергия решетки ∝ 1/размер
Энергия решетки обратно пропорциональна размеру катиона и аниона.
Какой из них имеет самую высокую энергию решетки?
а) NaF
б) МгФ 2
в) AlF 3
- Анион один и тот же в данных соединениях.
- Катион отличается, поэтому мы видим только фактор заряда, а не фактор размера, потому что размер слева направо немного увеличивается.
 Заряд Na, Mg, Al равен +1, +2, +3 соответственно.Так как чем больше заряд, тем больше энергия решетки.
Заряд Na, Mg, Al равен +1, +2, +3 соответственно.Так как чем больше заряд, тем больше энергия решетки.
Заказ:
NaF < MgF 2 < AlF 3
Какой из них имеет самую высокую энергию решетки?
а) Na 2 O
б) MgO
в) Ал 2 О 3
- Анион один и тот же в данных соединениях.
- Катион отличается, поэтому мы видим только заряд, а не фактор размера. Заряд Na, Mg, Al равен +1, +2, +3 соответственно.
Заказ:
Na 2 O < MgO < Al 2 O 3
Какой из них имеет самую высокую энергию решетки?
а) Ли 2 О
б) Ли 3 Н
- Катион одинаковый в данных соединениях.
- Анион отличается, поэтому мы видим только фактор заряда, а не размер, потому что N и O очень близки друг к другу. Заряд O и N равен -2 и -3 соответственно.
Заказ:
Li 2 O < Li 3 N
Какой из них имеет самую высокую энергию решетки?
а) NaCl
б) KCl
- Анион один и тот же в данных соединениях.

- Катион отличается, поэтому мы видим только фактор размера заряда, а не заряд, потому что и Na, и K имеют +1 заряд. Размер K больше, чем Na. (больше размер, меньше энергия решетки)
Заказ:
NaCl > KCl
Какой из них имеет самую высокую энергию решетки?
а) NaF
б) NaCl
в) NaBr
- Катион одинаковый в данных соединениях.
- Анион отличается, поэтому мы видим только фактор размера, а не фактор заряда, потому что F, Cl, Br имеют заряд -1.По мере того, как мы движемся вниз, размер группы в перуидической таблице увеличивается.
Заказ:
NaF > NaCl > NaBr
Какой из них имеет самую высокую энергию решетки?
а) NaF
б) MgCl 2
- И катион, и анион разные.
- Сравните катион Na + < Mg 2+ (фактор заряда)
- Сравните анион F – < Cl – (фактор размера)
если и размер, и коэффициент заряда несовместимы с каждым в противном случае коэффициент заряда будет преобладать над размером.

Заказ:
NaF < MgCl 2
Ионная связь | Группа Грандинетти
Когда катионы и анионы выпадают в осадок из насыщенного раствора, они кристаллизуются в такую решетку, которая максимизирует силы притяжения между катионами и анионами и минимизирует силы отталкивания между ионами с одинаковым зарядом. Например, ниже показано расположение ионов в кристаллическом хлориде натрия.
Демо:- Модель заполнения пространства кристаллической структурой NaCl.
На этом рисунке ионы хлорида обозначены зеленым цветом, а ионы натрия — желтым. Чтобы лучше понять энергетику этого устройства, давайте рассмотрим закон Кулона для потенциальной энергии взаимодействия между двумя зарядами:
В NaCl мы имеем три типа кулоновских взаимодействий: взаимодействие притяжения между катионами натрия и анионами хлорида и взаимодействие отталкивания между катионами натрия и между анионами хлорида.
Для моля твердого NaCl сумма всех этих кулоновских энергий для всех катионов и анионов в кристалле составляет -861 кДж/моль.

Na + (г) + Cl — (г) →NaCl (т) ΔU = -861 кДж/моль Энергия решетки — изменение энергии при сближении полностью газообразных атомов в 1 моль твердого ионного вещества.
Как видно из закона Кулона, энергия решетки связана с зарядом и расстоянием между ионами в твердом теле. Ионы меньшего размера будут иметь меньшие расстояния между собой в твердом теле и, следовательно, иметь более высокие энергии решетки.
Цикл Борна-Габера
Энергия решеткитакже может быть измерена экспериментально с использованием закона Гесса в так называемом цикле Борна-Габера . Напомним, что закон Гесса говорит нам, что изменение энергии при переходе от реагента к продуктам одинаково, независимо от того, протекает ли реакция в одну стадию или в несколько стадий. Например, зная изменение энтальпии следующих реакций, мы можем получить изменение энтальпии образования кристаллической решетки NaCl.

CL — (G) (G) → CL (G) + E — ΔH = -E.A. (CL) = 349 KJ / MoleNa + (г) + e — → Na (г) ΔH = -E.A. Na (г) → Na (т) ΔH = -104,8 кДж/моль Cl (г) → 1/2 Cl 2(г) ΔH = -120.5 кДж/моль Na (г) + 1/2 Cl 2(г) → NaCl (т) ΔH = -411,2 /моль ————————————————————- ————————————————— ——— Na + (г) + Cl — (г) → NaCl (т) ΔH = -783,5 кДж/моль Это довольно близко к нашему расчетному значению -861 кДж/моль (ошибка < 10%).

Полная потенциальная энергия дана:
(PE) всего = (PE) притяжение + (PE) отталкивание
(PE) всего = U = − A K Z + Z – e 2 /r + B/r n
Взятие производной с обеих сторон
dU/dr = d ( − A K Z + Z – e 2 /r ) /dr + d ( B/r n ) /dr
В равновесии dU/dr=0
d ( – A K Z + Z – e 2 /r ) /dr + d ( B/r n ) /dr = 0
− A K Z + Z – e 2 d (1/r) /dr + B d (1/r n ) /dr = 0
− A K Z + Z – e 2 d (r -1 ) /dr + B d (r -n ) /dr = 0
− A K Z + Z – e 2 (-1) r -2 + B (-n) r -n-1 = 0
A K Z + Z – e 2 / r 2 − Bn r -(n+1) = 0
A K Z + Z – e 2 / r 2 − Bn / r (n+1) = 0
A K Z + Z – e 2 / r 2 = Bn / r (n+1)
B = A K Z + Z – e 2 r (n+1) / r 2 n
B = A K Z + Z – e 2 r (n+1) r -2 / n
B = A K Z + Z – e 2 r (n+1-2) / n
B = A K Z + Z – e 2 r (n-1) / n
Формула полной энергии на 1 моль,
(PE) всего = U = N A [− A K Z + Z – e 2 /r + B/r n ]
Поместите значение B в приведенное выше уравнение,
U = N A [- AKZ + Z — E 2 / R + AKZ + Z — E 2 R (N-1) / R N N ]
U = N A A K Z + Z – e 2 [−1/r + r (n-1) /r n n ]
U = N A A K Z + Z – e 2 [−1/r + r (n-1) r -n / n ]
U = N A A K Z + Z – e 2 [−1/r + 1 / r n ]
U = −N A A K Z + Z – e 2 / r [ 1 − 1 / n ]
Где,
 Предложите учителю свою помощь в подготовке нового урока — сделайте сообщение по ключевым словам и словосочетаниям следующего параграфа.
Предложите учителю свою помощь в подготовке нового урока — сделайте сообщение по ключевым словам и словосочетаниям следующего параграфа. Третий слой сфер размещается над
отверстия второго слоя. Таким же образом добавляются последующие слои. Этот тип
массив известен как объемно-центрированная кубическая .
Третий слой сфер размещается над
отверстия второго слоя. Таким же образом добавляются последующие слои. Этот тип
массив известен как объемно-центрированная кубическая . 
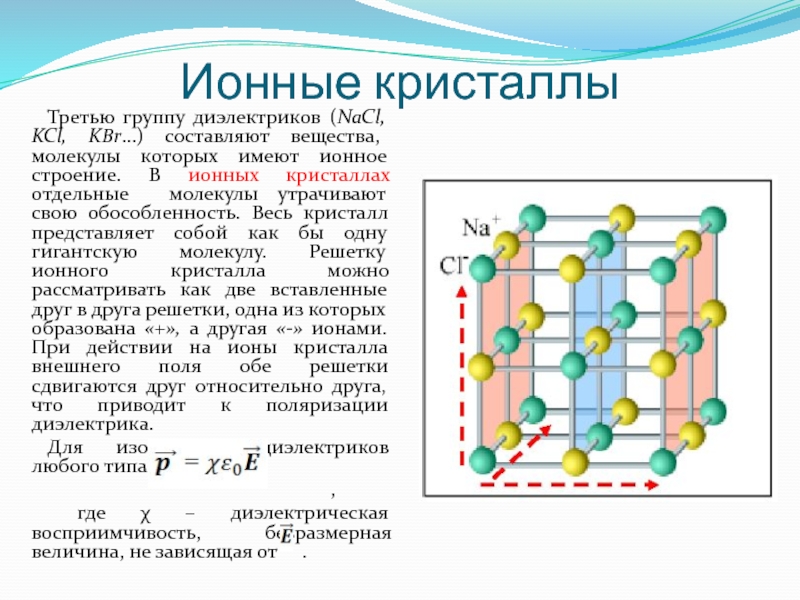 Когда отношение радиусов превышает 0,732, становится возможным разместить вокруг катиона восемь анионов.
Когда отношение меньше 0,414, анионы будут располагаться слишком близко друг к другу, и анионы будут
принять расположение, которое имеет меньшие полости, окруженные только четырьмя анионами.
Когда отношение радиусов превышает 0,732, становится возможным разместить вокруг катиона восемь анионов.
Когда отношение меньше 0,414, анионы будут располагаться слишком близко друг к другу, и анионы будут
принять расположение, которое имеет меньшие полости, окруженные только четырьмя анионами. CsCl имеет отношение радиусов 0,934, что указывает на то, что катионы
достаточно велики, чтобы предотвратить контакт анионов друг с другом. Каждая элементарная ячейка содержит
один катион цезия и 8(1/8) ионов хлора. Таким образом, каждая элементарная ячейка содержит одну формульную единицу.
CsCl имеет отношение радиусов 0,934, что указывает на то, что катионы
достаточно велики, чтобы предотвратить контакт анионов друг с другом. Каждая элементарная ячейка содержит
один катион цезия и 8(1/8) ионов хлора. Таким образом, каждая элементарная ячейка содержит одну формульную единицу.
 Соль обычно принимает
один из известных типов решеток, в структуре которого катион и анион меняются ролями. В этих случаях,
вычислить обратное отношение и добавить префикс против — к названию типа решетки.
Соль обычно принимает
один из известных типов решеток, в структуре которого катион и анион меняются ролями. В этих случаях,
вычислить обратное отношение и добавить префикс против — к названию типа решетки.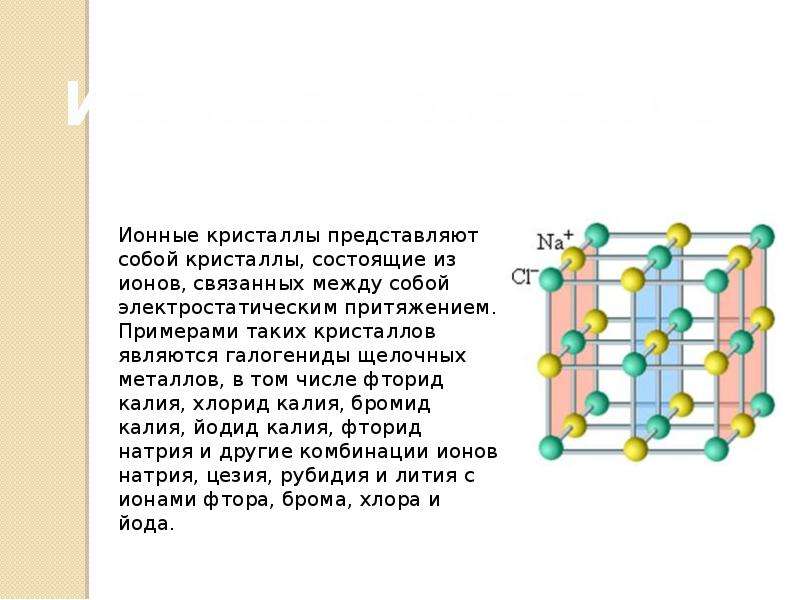 Сумма энергий гидратации
должно быть самым отрицательным для A + X — , потому что у него самые разные радиусы. Применение
термодинамический цикл для растворимости, энтальпия осаждения должна быть наибольшей
положительный для A + X — и самый отрицательный для C + Z — . Наиболее нерастворимыми солями являются
обычно те, в которых энергии гидратации катионов и анионов наиболее близки. Это катионы и
анионы, наиболее близкие по силе кислотности и основности соответственно.
Сумма энергий гидратации
должно быть самым отрицательным для A + X — , потому что у него самые разные радиусы. Применение
термодинамический цикл для растворимости, энтальпия осаждения должна быть наибольшей
положительный для A + X — и самый отрицательный для C + Z — . Наиболее нерастворимыми солями являются
обычно те, в которых энергии гидратации катионов и анионов наиболее близки. Это катионы и
анионы, наиболее близкие по силе кислотности и основности соответственно.
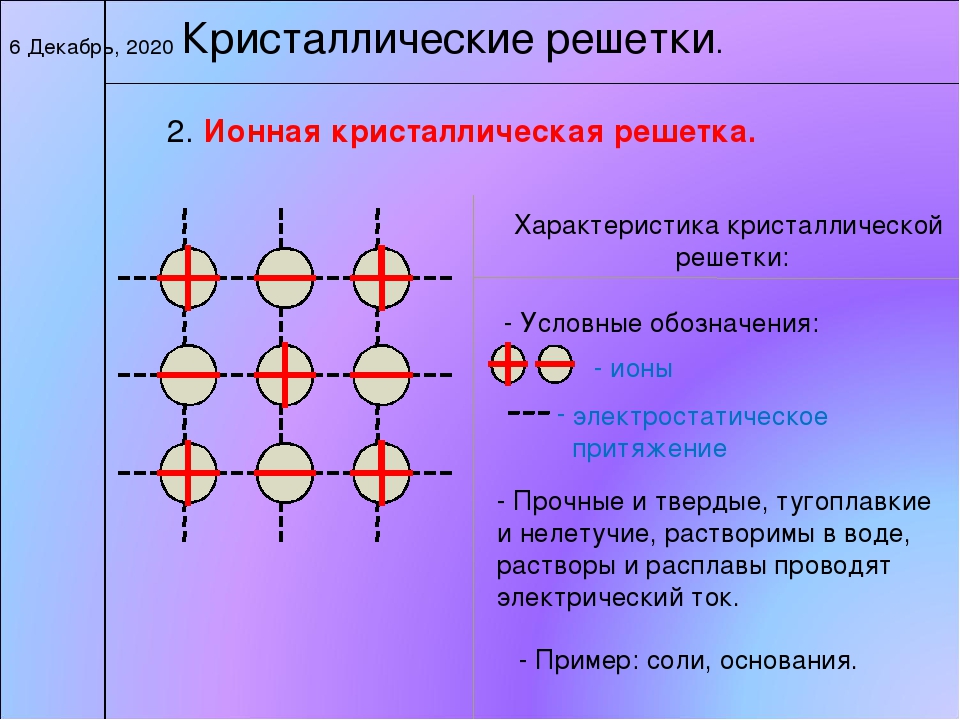


 )
) ) = 1,74756 ·
) = 1,74756 ·

 Таким образом, это означает, что главное квантовое число этих самых удаленных электронов равно 3, что означает, что Zn 2+ будет иметь рожденный показатель степени 9.
Таким образом, это означает, что главное квантовое число этих самых удаленных электронов равно 3, что означает, что Zn 2+ будет иметь рожденный показатель степени 9.

 Согласно закону Гесса,
Согласно закону Гесса,
 В цикле Борна-Габера в процессе задействовано много терминов энергии.
В цикле Борна-Габера в процессе задействовано много терминов энергии.
 E = ?
E = ?  Е)
Е) Заряд Na, Mg, Al равен +1, +2, +3 соответственно.Так как чем больше заряд, тем больше энергия решетки.
Заряд Na, Mg, Al равен +1, +2, +3 соответственно.Так как чем больше заряд, тем больше энергия решетки.