Составьте электронные формулы мышьяка и представьте графически размещение электронов по квантовым…
Составьте электронные формулы мышьяка и представьте графически размещение электронов по квантовым ячейкам. Проанализируйте возможности разъединения спаренных электронов при возбуждении атомов с образованием валентных электронов в соответствии с теорией спин-валентности.
Решение.
| | | | | | | | |||||||||||||||||||||||||||||
| ?? | ?? | ?? | ?? | ?? | ? | ? | ? | ||||||||||||||||||||||
| ?? | ?? | ?? | ?? | ?? | ?? | 3d10 | ?? | 4p3 | |||||||||||||||||||||
| As | 33 | ?? | ?? | 2p6 | ?? | 3p6 | 4s2 | ||||||||||||||||||||||
| 1s2 | 2s2 | 3s2 | |||||||||||||||||||||||||||
| ? | | | | | | | | | | | | | |||||||||||||||||||||||||
| ? | ? | ? | 4d1 | ||||||||||||||||||||||||||
| As* | 33 | ? | 4p3 | ||||||||||||||||||||||||||
| 4s1 | |||||||||||||||||||||||||||||
Мышьяк, имеет 3 валентных, неспаренных электрона на 4p-подуровне, поэтому проявляет валентность 3 (например мышьяковистая кислота — h4AsO3). В возбужденном состоянии, электроны находящиеся на 4s-подуровне разъединяются, и один электрон с 4s-подуровня перескакивает на 4d-подуровень, таким образом атом мышьяка имеет уже 5 неспаренных электронов и способен проявлять валентность 5 (например мышьяковая кислота — h4AsO4).
В возбужденном состоянии, электроны находящиеся на 4s-подуровне разъединяются, и один электрон с 4s-подуровня перескакивает на 4d-подуровень, таким образом атом мышьяка имеет уже 5 неспаренных электронов и способен проявлять валентность 5 (например мышьяковая кислота — h4AsO4).
Мышьяк в ногтях
Мышьяк оказывает влияние на окислительные процессы в клетке. Основное значение данный микроэлемент имеет в качестве яда. Интоксикация мышьяком сопровождается желудочно-кишечными расстройствами, нарушениями в работе сердца. Основные проявления отравления отмечаются со стороны нервной системы в виде параличей, нарушений чувствительности, судорог.
Синонимы английские
Arsenic (As), nails.
Метод исследования
Масс-спектрометрия с индуктивно-связанной плазмой.
Единицы измерения
Мкг/г (микрограмм на грамм).
Какой биоматериал можно использовать для исследования?
Ногти.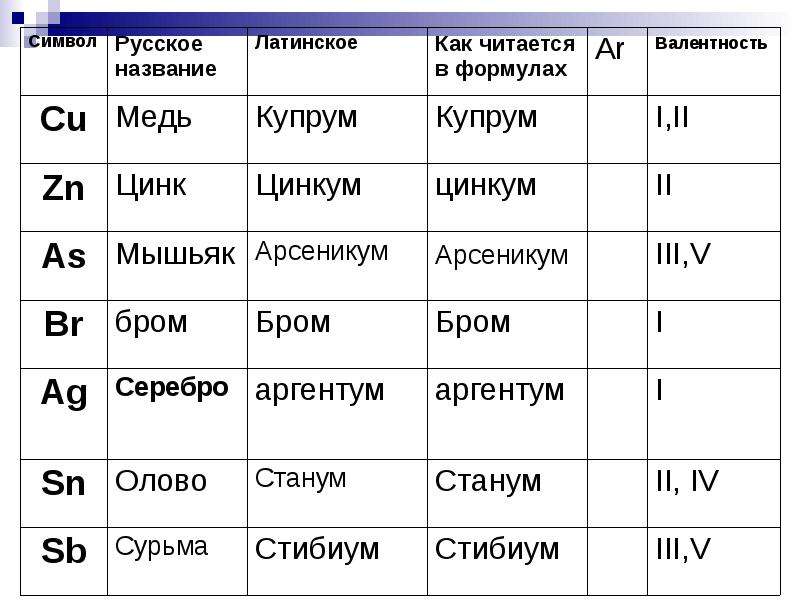
Общая информация об исследовании
Мышьяк является достаточно распространенным в природе элементом, широко используется в коммерческих продуктах (в производстве стекла и полупроводников, литейных производствах), имеет медицинское применение (в стоматологии и онкологии). Чаще всего ассоциируется с ядом вследствие частых преднамеренных и непреднамеренных отравлений. Большинство экологических воздействий мышьяка не представляет опасности, однако выявлены природные и антропогенные очаги с повышенным содержанием данного элемента, представляющие опасность. В окружающей среде мышьяк встречается в неорганических и органических формах, в соединениях с разным уровнем валентности (на человека большей частью влияют трех- и пятивалентные соединения). Наиболее токсичными являются трехвалентные соединения, которые обладают реакционной способностью с серосодержащими соединениями с образованием активных форм кислорода.
В нормальной концентрации в организме человека мышьяк может участвовать в процессах кроветворения, в ферментативных реакциях. Недостаток данного микроэлемента встречается редко и не имеет специфических симптомов. Отравление мышьяком может быть острым и хроническим. Острое отравление характеризуется выраженной диареей, гиповолемией и шоком, поражением нервной системы (эпилептические припадки, кома), острой почечной недостаточностью, дыхательной недостаточностью, а также поражением других органов и систем. Хроническое отравление может проявляться поражением кожи, желудочно-кишечного тракта (понос, тошнота выражены слабее), артериальной гипертензией, сахарным диабетом и злокачественными новообразованиями.
Недостаток данного микроэлемента встречается редко и не имеет специфических симптомов. Отравление мышьяком может быть острым и хроническим. Острое отравление характеризуется выраженной диареей, гиповолемией и шоком, поражением нервной системы (эпилептические припадки, кома), острой почечной недостаточностью, дыхательной недостаточностью, а также поражением других органов и систем. Хроническое отравление может проявляться поражением кожи, желудочно-кишечного тракта (понос, тошнота выражены слабее), артериальной гипертензией, сахарным диабетом и злокачественными новообразованиями.
Определить уровень мышьяка возможно в нескольких биологических средах: в крови, моче, в волосах и ногтях. Концентрация в волосах и ногтях обычно выше, чем в крови и моче, из-за высокого содержания кератина (SH-группы которого могут связывать трехвалентный неорганический мышьяк).
Для чего используется исследование?
- Для диагностики хронического отравления мышьяком.
Когда назначается исследование?
- При симптомах хронического отравления мышьяком: периферической невропатии (боль, слабость, парестезия), характерных изменениях пигментации кожи, гиперкератозе, линиях Ми, ломкости ногтей, алопеции, нарушении перистальтики кишечника.

Что означают результаты?
Референсные значения: 0 — 0,5 мкг/г.
Повышенные показатели означают, что организм подвергается воздействию мышьяка в больших дозах, то есть отравление организма.
Понижение уровня мышьяка не имеет диагностического значения.
Мышьяк электронное строение — Справочник химика 21
Фосфор, мышьяк или сурьма (имеющие электронное строение внешнего энергетического уровня s pЗ и проявляющие валентность 5), будучи введенными в кристаллические решетки германия или олова (электронное строение внешнего уровня 5 р валентность 4) ведут себя как донорные примеси, т. е. отдают электроны и создают проводимость п-типа. Если же в германий или кремний ввести бор, алюминий, галлий или индий (электронное строение внешнего уровня 5 р, валентность 3), то атомы примеси захватывают четвертый электрон и полупроводник обнаруживает проводимость р-типа. [c.186]Научные работы посвящены физикохимии флотационных процессов и исследованию комплексооб-)азования парамагнитных ионов.
 Исследовал продукты взаимодействия реагентов с минералами с применением методов радиоспектроскопии. Установил влияние электронно-дырочных центров минералов на изменение их флотационных свойств. Разработал синтез спин-меченых флотореагентов и нашел пути их широкого использования для изучения механизма взаимодействия реагентов с поверхностью минералов. Разработал технологию комплексной переработки руд ряда месторождений. Изучал комнлексообразование парамагнитных ионов с лигандами, содержащими атомы серы, кислорода, азота, селена, фосфора и мышьяка. Установил строение и параметры химической связи ряда комплексов. Разработал способ [c.472]
Исследовал продукты взаимодействия реагентов с минералами с применением методов радиоспектроскопии. Установил влияние электронно-дырочных центров минералов на изменение их флотационных свойств. Разработал синтез спин-меченых флотореагентов и нашел пути их широкого использования для изучения механизма взаимодействия реагентов с поверхностью минералов. Разработал технологию комплексной переработки руд ряда месторождений. Изучал комнлексообразование парамагнитных ионов с лигандами, содержащими атомы серы, кислорода, азота, селена, фосфора и мышьяка. Установил строение и параметры химической связи ряда комплексов. Разработал способ [c.472]Электронное строение атомов фосфора, мышьяка, сурьмы и висмута [c.275]
На основании электронного строения атомов р-элементов IV и V групп, изменения их атомных радиусов, их металлических и неметаллических свойств решите вопрос об изменении наиболее устойчивой степени окисления этих элементов по группам. Ответ мотивируйте составлением уравнений реакций растворения в азотной кислоте а) углерода, кремния, олова, свинца б) мышьяка, сурьмы, висмута. [c.67]
[c.67]
Строение внешней электронной оболочки атома Азот Фосфор Мышьяк Сурьма Висмут [c.427]
Рассмотренное строение двойного слоя характерно для собственных полупроводников, в которых нет ни объемных примесей (добавок), ни так называемых поверхностных состояний, обусловленных чаще всего адсорбцией чужеродных атомов. Часто полупроводник в качестве примеси содержит атомы такого вещества, благодаря которому резко увеличивается число свободных электронов п. Такие добавки называются донорами электронов. Для германия такой добавкой служит мышьяк. Поскольку произведение пр в присутствии доноров электронов остается постоянным [уравнение (28.3)1, то увеличение п приводит к соответствующему уменьшению числа дырок р—=К 1п. Поэтому проводимость таких примесных полупроводников п-типа осуществляется в основном за счет свободных электронов в зоне проводимости. Если же атомы примеси резко увеличивают число дырок в валентной зоне, то растет дырочная проводимость и соответственно уменьшается число свободных электронов п = Кз/р- Такого рода примеси называются акцепторами электронов, а полупроводники с дырочной проводимостью — полупроводниками /7-типа. Акцепторами электрона для германия служат атомы галлия. В присутствии примесей соотношение (28.2) в объеме полупроводника уже не остается справедливым. Вместо него следует записать [c.141]
Акцепторами электрона для германия служат атомы галлия. В присутствии примесей соотношение (28.2) в объеме полупроводника уже не остается справедливым. Вместо него следует записать [c.141]
Рассмотренное строение двойного слоя характерно для собственных полупроводников, в которых нет ни объемных примесей (добавок), ни так называемых поверхностных состояний, обусловленных чаще всего адсорбцией чужеродных атомов. Часто полупроводник в качестве примеси содержит атомы такого вещества, благодаря которому резко увеличивается число свободных электронов п. Такие добавки называются донорами электронов. Для германия такой добавкой служит мышьяк. Поскольку произведение пр в присутствии доноров электронов остается постоянным [уравнение (28.3)1, то увеличение п приводит к соответствующему уменьшению числа дырок р = Поэтому [c.150]
Больщинство известных химических элементов, находясь в виде простых веществ, представляют собой металлы. Некоторые элементы (германий, мышьяк, сурьма, алюминий) в одних условиях ведут себя как металлы, в других условиях — как неметаллы. Все металлы имеют на внешнем энергетическом уровне небольшое число валентных электронов — электронные конфигурации металлов представлены в табл. I. Повторение химических свойств металлов обусловлено периодическим повторением строения электронных конфигураций внешних электронных уровней. [c.317]
Все металлы имеют на внешнем энергетическом уровне небольшое число валентных электронов — электронные конфигурации металлов представлены в табл. I. Повторение химических свойств металлов обусловлено периодическим повторением строения электронных конфигураций внешних электронных уровней. [c.317]
Сурьма принадлежит к пятой группе периодической системы химических элементов Д. И. Менделеева и входит в подгруппу мышьяка. Атомная масса сурьмы равна 121,75 [213, 992], атомный номер 51. Строение электронной оболочки 1 , 2 , 2/) , З , Зр 45 , 4р , 4 1 , 5s 5р [c.7]
Процессы старения и связанные с ними изменения формы и строения коллоидных частиц в золях сернистого мышьяка протекают очень медленно. Так, золи полуторагодичной давности дают такую же электронографическую картину, как и свежеприготовленные золи. Электронно-микроско-пическая картина отличается лишь тем, что в старых золях можно наблюдать большее количество агрегатов. [c.171]
[c.171]
Внутреннее строение атома В1 роднит его не только с мышьяком и сурьмой, что естественно, но и со многими другими металлами. В атоме висмута есть предпоследний 18-электронный слой (слой типа купро ), который характерен для свинца, а также меди и ее аналогов (Ап, Ag). Интересно, что с этими же элементами висмут нередко бывает связан в рудных месторождениях. [c.240]
Мышьяк Аз (5-10 %), сурьма 8Ь (110″ %) и висмут В1 (2-10″ %). Строение электронных оболочек атомов этих элементов отличается от такового для азота и фосфора. Второй снаружи энергетический уровень в атомах мышьяка, сурьмы и висмута содержит 18 электронов (п—1)5 (тг—1)р (/г—1) 1 . В связи со значительным ростом радиусов атомов и уменьшением энергии ионизации атомы этих элементов могут превращаться в положительно заряженные ионы Однако восстановительные свойства их [c.364]
Соединения бора с другими элементами. Существует много других типов соединений, в которых атом бора связан с азотом, фосфором, мышьяком, серой и углеродом.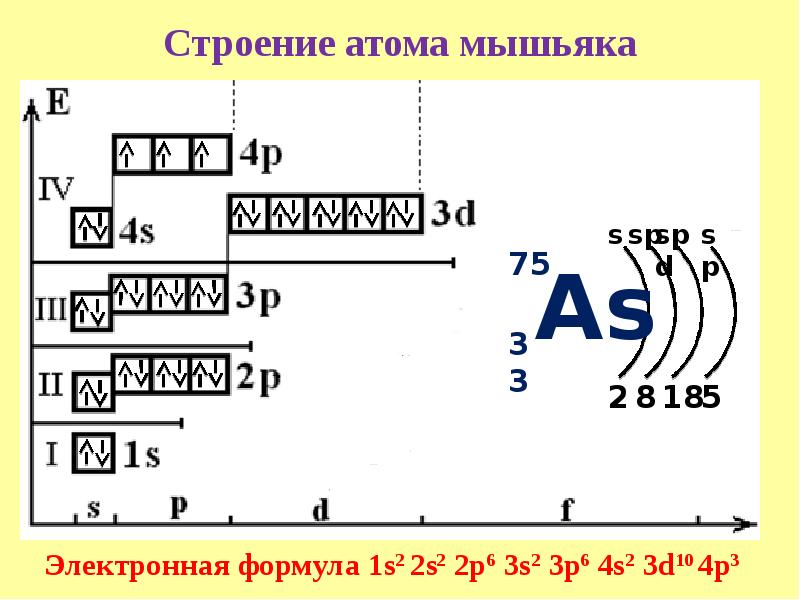 Борорганические соединения уже упоминались в разд. 12.5. Здесь мы отметим лишь некоторые соединения бора с азотом. Фрагмент —ЫН — ВК — идентичен структурному элементу—СН = СН—и может замещать его во многих соединениях. Мы уже отмечали графитоподобное строение нитрида бора ВЫ (разд, 12.2). Эту аналогию можно сделать более понятной, если принять, что истинное электронное распределение в связи В — N может быть описано резонансным гибридом, [c.291]
Борорганические соединения уже упоминались в разд. 12.5. Здесь мы отметим лишь некоторые соединения бора с азотом. Фрагмент —ЫН — ВК — идентичен структурному элементу—СН = СН—и может замещать его во многих соединениях. Мы уже отмечали графитоподобное строение нитрида бора ВЫ (разд, 12.2). Эту аналогию можно сделать более понятной, если принять, что истинное электронное распределение в связи В — N может быть описано резонансным гибридом, [c.291]
Таким образом, теория Льюиса объясняет кислотно- и основные свойства веществ с позиции их строения. Это является одним из существенных недостатков рассматриваемой теории. Не только строение, но и состав и многие другие, неучитываемые Льюисом факторы, определяют проявление веществом кислотно-основного характера. Теория Льюиса не объясняет кислотные свойства многих кислот (в том числе как содержащих, таки не содержащих в своем составе водород), ограничиваясь узкими рамками кислотноосновных реакций, которые протекают по донорно-акцепторному механизму. Например, сопоставляя электронные формулы молекул аммиака и хлорида мышьяка(П1) [c.136]
Например, сопоставляя электронные формулы молекул аммиака и хлорида мышьяка(П1) [c.136]
Строение внешних электронных слоев ионов подгруппы мышьяка такое же, как и катионов подгруппы меди. К подгруппе мышьяка относятся ионы, имеющие а) внешний 18- или (18 + 2)-электронный слой б) незаконченный, т. е. переходный, от 8-к 18-электронному внешнему слою, при условии, если имеются 18- или 32-электронные глубинные слои, наличие которых усиливает и поляризующее действие и собственную поляризуемость ионов. [c.397]
Подгруппа мышьяка. Мышьяк. Элементы подгруппы мышьяка — мышьяк, сурьма и висмут — имеют во внешнем квантовом слое атомов такое же число электронов, как азот и фосфор. Однако они отличаются строением предпоследнего квантового слоя, который содержит 18 электронов . Этим объясняется зна- [c.274]
Свойства атомов. Сопоставление внутренних электронных остовов, валентных и вакантных подуровней показывает, что различия в физических и химических свойствах элементов обусловлены в основном особенностями строения электронных оболочек атомов (табл. 19.2). Атомы элементов этой подгруппы имеют совпадающие по строению валентные подуровни (пз пр ), различные электронные остовы и вакантные подуровни. Два электрона валентных з-подуровней спарены, три электрона р-подуровней заселяют орбитали этих подуровней по одному. Электронная структура азота выделяется отсутствием вакантных подуровней, энергетически близких к наполовину заполненному 2р-подуровню. У фосфора есть один вакантный с -подуровень, а мышьяк, сурьма и висмут имеют несколько вакантных подуровней, близко расположенных к валентным подуровням. [c.383]
19.2). Атомы элементов этой подгруппы имеют совпадающие по строению валентные подуровни (пз пр ), различные электронные остовы и вакантные подуровни. Два электрона валентных з-подуровней спарены, три электрона р-подуровней заселяют орбитали этих подуровней по одному. Электронная структура азота выделяется отсутствием вакантных подуровней, энергетически близких к наполовину заполненному 2р-подуровню. У фосфора есть один вакантный с -подуровень, а мышьяк, сурьма и висмут имеют несколько вакантных подуровней, близко расположенных к валентным подуровням. [c.383]
Используя представления о кайносимметрии, можно выделить более тонкий вид электронной аналогии, так называемую слоевую аналогию (в дополнение к групповой и типовой аналогии). Слоевыми аналогами называют элементы, которые являются типовыми аналогами, но не имеют внешних или предвнешних кайносимметричных электронов. К таким аналогам относятся, например, в IA-группе К, Rb, s и Fr, а Li и Na не являются слоевыми аналогами с остальными щелочными металлами, поскольку у Li присутствует внешняя кайносимметричная 2р-оболочка (вакантная), а у Na кайносимметрнчная заполненная 2р-оболочка является предвнеш-ней. В ПА-группе слоевыми аналогами являются щелочно-земельные металлы (подгруппа кальция), а в П1А-группе — элементы подгруппы галлия и т. д. С точки зрения электронного строения слоевые аналоги являются между собой полными электронными аналогами. Поэтому рассматривать химические свойства элементов группы мы будет в такой последовательности первый типический элемент, второй типический элемент, остальные элементы главной подгруппы, элементы побочной подгруппы. Например, в И1 группе отдельно рассматриваются бор, алюминий, подгруппа галлия, подгруппа скандия в V группе — азот, фосфор, подгруппа мышьяка, подгруппа ванадия п т. п. [c.15]
В ПА-группе слоевыми аналогами являются щелочно-земельные металлы (подгруппа кальция), а в П1А-группе — элементы подгруппы галлия и т. д. С точки зрения электронного строения слоевые аналоги являются между собой полными электронными аналогами. Поэтому рассматривать химические свойства элементов группы мы будет в такой последовательности первый типический элемент, второй типический элемент, остальные элементы главной подгруппы, элементы побочной подгруппы. Например, в И1 группе отдельно рассматриваются бор, алюминий, подгруппа галлия, подгруппа скандия в V группе — азот, фосфор, подгруппа мышьяка, подгруппа ванадия п т. п. [c.15]
Валентная электронная конфигурация всех элементов VA-группы— ns np , т. е. на внешнем энергетическом (валентном) уровне они содержат 2 спаренных s-электрона и 3 неспаренных (в соответствии с правилом Гунда) электрона на трехкратно вырожденном р-уровне. Однако между элементами этой группы существуют и различия в электронном строении. Так, у фосфора в отличие от азота впервые появляется вакантный внешний М-уровепь, что обусловливает возможность промотирования одного 35-электрона с образованием пятиковалентного состояния, которое, как известно, отсутствует у азота. У мышьяка, сурьмы и висмута к вакантному -уровню добавляется еще в отличие от фосфора полностью завершенный внутренний (п—1) -уровень, а у висмута, следующего за лентаноидами, кроме того, и 4/ -уровень. [c.282]
У мышьяка, сурьмы и висмута к вакантному -уровню добавляется еще в отличие от фосфора полностью завершенный внутренний (п—1) -уровень, а у висмута, следующего за лентаноидами, кроме того, и 4/ -уровень. [c.282]
Наличие заполненных предвнешних (п—l)d- и (п—2)/-уровней сверх оболочки предыдущего благородного газа накладывает отпечаток на свойства элементов подгруппы мышьяка. Отметим, что между собой мышьяк, сурьма и висмут являются полными электронными аналогами и отличаются с точки зрения электронного строения от типических элементов VA-группы — азота и фосфора, т. е. по отношению к ним являются неполными электронными аналогами. [c.282]
Подгруппа иьппьяка. Характеристика элементов УА-группы. Валентная электронная конфигурация всех элементов УА-Г1зуппы — пз пр , т.е. на внешнем энергетическом (валентном) уровне они содержат два спаренных -электрона и три неспаренных электрона на трехкратно вырожденном пр-уровне. Однако между элементами этой группы существуют и р личия в электронном строении. У мышьяка, сурьмы и висмута к вакантному пс(-уровню добавляется еще в отличие от фосфора полностью завершенный внутренний (п — 1) -уровень, а у висмута, следующего за лантаноидами, кроме того, и 4/ -уровень. В силу наличия внутренних и /оболочек, экранирующих внешние электроны, в ряду Аз — 8Ь — В1 проявляется вторичная периодичность. В результате этого для среднего элемента ряда — сурьмы — степень окисления +5 оказывается более стабильной, чем для мышьяка и висмута. [c.417]
У мышьяка, сурьмы и висмута к вакантному пс(-уровню добавляется еще в отличие от фосфора полностью завершенный внутренний (п — 1) -уровень, а у висмута, следующего за лантаноидами, кроме того, и 4/ -уровень. В силу наличия внутренних и /оболочек, экранирующих внешние электроны, в ряду Аз — 8Ь — В1 проявляется вторичная периодичность. В результате этого для среднего элемента ряда — сурьмы — степень окисления +5 оказывается более стабильной, чем для мышьяка и висмута. [c.417]
В результате оба атома образуют ковалентные а-связи с тремя заместителями, например КзАз или Кз5Ь, причем орбитали центрального атома оказываются средними между Зр-орби-талями, требующими угла 90° между связями, и хр -гибридизо-ванными орбиталями, требующими углов около 109,5° [1]. Как и следовало ожидать из электронного строения и по аналогии с такими же соединениями фосфора, соединения трехвалентного мышьяка и сурьмы являются основаниями Льюиса и образуют четвертичные соли.
 [c.302]
[c.302]Хотя химия органических соединений фосфора и мышьяка широко изучается многими авторами с использованием разнообразных физических и химических методов /1-15/,проблема механизма электронных взаимодействий в них еще далека от своего решения.С целью получения дополнительной информации по этому вопросу в настоящей работе исследовано влияние факторов электронного строения на скорость основного дейтерообмена метильной группы и некоторые спектроскопические характеристики третичных метил-фенилфосфинов и арсинов,соответствующих им окисей,сульфидов и «ониевых» соединений. [c.443]
Свойства элементов и простых веществ закономерно изменяются в подгруппе с ростом радиуса атомов и уменьшением энергии ионизации, как это можно видеть из табл. 27. Азот и фосфор — типичные неметаллы, т. е. кислотообразователи. Различия в строении предвнеш-него электронного уровня у атомов фосфора и мышьяка меньше сказываются на изменении свойств элементов, чем при переходе от кремния к германию в IVA-подгруппе. У мышьяка сильнее выражены неметаллические свойства. У сурьмы неметаллические и металлические свойства проявляются приблизительно в одинаковой степени. Для висмута характерно преобладание металлических (основных) свойств. [c.339]
У мышьяка сильнее выражены неметаллические свойства. У сурьмы неметаллические и металлические свойства проявляются приблизительно в одинаковой степени. Для висмута характерно преобладание металлических (основных) свойств. [c.339]
Бинарные соединения, оба компонента которых расположены справа от границы Цинтля, как отмечено выше, характеризуются преимущественно ковалентным типом взаимодействия в силу незначительной разности ОЭО. Правило октета здесь соблюдается, поскольку число валентных электронов у обоих компонентов достаточно для реализации ковалентного взаимодействия. Для соединений, подчиняющихся правилу формальной валентности, у катионообразователя необходимо учитывать лишь число электронов, участвующих в образовании связи. Так, в оксидах мышьяка АзгОз и АззОз у кислорода в обоих случаях учитывается шесть электронов, а у мышьяка в первом случае три, а втором — пять электронов. Тогда для АзгОз получим (3-2 + 6-3)/3 = 8, а для АзгОб — (5-2 + 6-5)/5 = 8. Если соединения не подчиняются правилу формальной валентности, то применимо правило Музера — Пирсона. Особенности кристаллохимического строения бинарных соединений с компонентами, расположенными справа от границы Цинтля, состоят в том, что в их структуре присутствуют группировки атомов в виде цепочек, сеток и молекул. Следовательно, кроме ковалентной связи здесь реализуется и межмолекулярное взаимодействие. [c.261]
Особенности кристаллохимического строения бинарных соединений с компонентами, расположенными справа от границы Цинтля, состоят в том, что в их структуре присутствуют группировки атомов в виде цепочек, сеток и молекул. Следовательно, кроме ковалентной связи здесь реализуется и межмолекулярное взаимодействие. [c.261]
В настоящей работе было предпринято электронно-микроскопическое исследование структуры некоторых аморфных полимеров, обладающих различным строением молекулярных цепей. В качестве объектов были изучены полимеры мышьяка (сальварсан), полиакриламид и сополимер па основе метилметакрилата и метакриловой кислоты. Таким образом, были исследованы полимеры, содержащие различные полярные группы в цепи и, следовательно, обладающие различными внутри- и межмолекулярными силами взаимодействия. [c.121]
Проведены некоторые определения сравнительной легкости, с которой фосфины, арсины и стибины аналогичного строения способны расширять свою валентную оболочку. Обширная информация получена при использовании этих соединений в качестве лигандов в комплексах с металлами. Чатт и Харт [11] исследовали монозамещенные карбонилы никеля Ы1(С0)зЦ где Ь=(СбН5)зР или (СбН5)зАз. Эти соединения были приготовлены вытеснением окиси углерода из тетракарбонила никеля, причем эта реакция шла много быстрее в случае фосфина. Однако частота колебаний карбонильной группы фосфина составляла 2063 см тогда как для арсина 2072 см К На основании этих данных было принято, что обратная подача электронов с заполненных -орбиталей никеля в направлении СО-групп больше в случае фосфинового комплекса по сравнению с тем же эффектом в арсиновом комплексе. Другими словами, арсин (фактически в виде арсониевой группы, поскольку мышьяк поделил электроны с никелем) вновь принимает электроны на свои вакантные -орбитали в большей мере, чем фосфор в фосфине (т. е. вклад структуры Па больше, чем вклад 1а в истинное р ас-пределение электронной плотности в соответствующем комплексе). [c.
Обширная информация получена при использовании этих соединений в качестве лигандов в комплексах с металлами. Чатт и Харт [11] исследовали монозамещенные карбонилы никеля Ы1(С0)зЦ где Ь=(СбН5)зР или (СбН5)зАз. Эти соединения были приготовлены вытеснением окиси углерода из тетракарбонила никеля, причем эта реакция шла много быстрее в случае фосфина. Однако частота колебаний карбонильной группы фосфина составляла 2063 см тогда как для арсина 2072 см К На основании этих данных было принято, что обратная подача электронов с заполненных -орбиталей никеля в направлении СО-групп больше в случае фосфинового комплекса по сравнению с тем же эффектом в арсиновом комплексе. Другими словами, арсин (фактически в виде арсониевой группы, поскольку мышьяк поделил электроны с никелем) вновь принимает электроны на свои вакантные -орбитали в большей мере, чем фосфор в фосфине (т. е. вклад структуры Па больше, чем вклад 1а в истинное р ас-пределение электронной плотности в соответствующем комплексе). [c. 304]
304]
Как видно из приведенных в табл. III. 4 данных, по химическому строению диазиды делятся на четыре группы к первой группе (соединения 1—6) относятся вещества, в которых азидсодержащие арильные ядра не сопряжены, ко второй (7—20)—соединения, в которых электронное взаимодействие между такими ядрами осуществляется через карбонил, к третьей (21—27)—диазиды, в молекулах которых имеется единая сопряженная система, к четвертой (28—31)—формально сопряженные и несопряженные диазиды, содержащие гетероатом фосфора, мышьяка и другие в цепи, связывающей два ароматических ядра. [c.122]
С)т формы частиц дисперсной фазы зависят некоторые свойства коллоидных растворов. Так, коллоидные системы асимметрического строения способны образовать внутреннюю сетчатую структуру. На рис. 174 и 175 приведены полученные на электронном микроскопе снимки коллоидных частиц свежеприготовленного золя сульфида мышьяка и пятнокиси ванадия. Как видно из этих рисунков, частицы пятиолиси [c. 407]
407]
На основании приведенных данных можно считать твердо установленным экстремум значений проводимости, магнитной восприимчивости, плотности и микротвердости у стекол системы мышьяк—селен, содержащих 9 ат. % мышьяка. Наличие экстремальных значений характеристических величин свидетельствует о существенном изменении структуры стеклообразных сплавов в этой области составов. Л инимальное значение магнитной восприимчивости у стекол, содержащих -9ат. % мышьяка, связано с изменением степени деформации валентных электронных облаков в химических связях As—Se и Se—Se. Это изменение обусловлено статистическим распределением трехмерных пространственных структурных единиц образующегося AsaSes в структуре стеклообразного селена. В таких стеклообразных сплавах с максимально неупорядоченным строением затрудняется сквозной перенос носителей заряда, для них получены заниженные значения плотности и микро-твердости. Перенос носителей заряда с конца оборванной цепи на соседнюю цепь в таких стеклообразных сплавах требует преодоления значительного активационного барьера. Такой перенос может осуществляться в результате перекрытия электронных орбит в процессе низкочастотных термических колеба- [c.44]
Такой перенос может осуществляться в результате перекрытия электронных орбит в процессе низкочастотных термических колеба- [c.44]
Общим для трех исследованных систем является наличие области максимальных значений парамагнетизма Ван-Флека. Для составов с максимальными значениями парамагнитной составляющей получены также экстремальные значения парамет-)0Б электропроводности и других физико-химических величин. 4з анализа полученных экстремальных значений следует, что стекла указанных составов характеризуются статистическим распределением структурных единиц АзЗез/г, АзЗз/г и ОеЗе4/г в полимерных цепях и циклах стеклообразных селена и серы. Такое распределение приводит к нарушению правильности чередования структурных единиц, нарушению исходного ближнего порядка и вносит тем самым дополнительную асимметрию в строение электронных оболочек атомов. Стекла в системе Аз—Зе с содержанием 9 ат. % мышьяка, в системе Аз—3 с содержанием мышьяка 12 ат. % и в системе Се—Зе с содержанием 6—7 ат, % германия имеют наименьшую степень [c. 73]
73]
Одним из последних экспериментальных подтверждений уменьшения тенденции к образованию я-связей у тяжелых элементов V группы является работа Бигли и др. [23], изучавших молекулу А5(5 Нз)з. Эта молекула имеет пирамидальное строение, все углы SiAsS равны 93°. Очевидно, для образования связей АзЗ мышьяк использует только р-орбитали неподеленная пара электронов располагается в основном на х-орбитали. Электроны неподеленной пары не могут переходить на вакантные З -орбитали кремния и вносить вклад в образование двойных связей. [c.175]
Помощь студентам в учёбе от Людмилы Фирмаль
Здравствуйте!
Я, Людмила Анатольевна Фирмаль, бывший преподаватель математического факультета Дальневосточного государственного физико-технического института со стажем работы более 17 лет. На данный момент занимаюсь онлайн обучением и помощью по любыми предметам. У меня своя команда грамотных, сильных бывших преподавателей ВУЗов.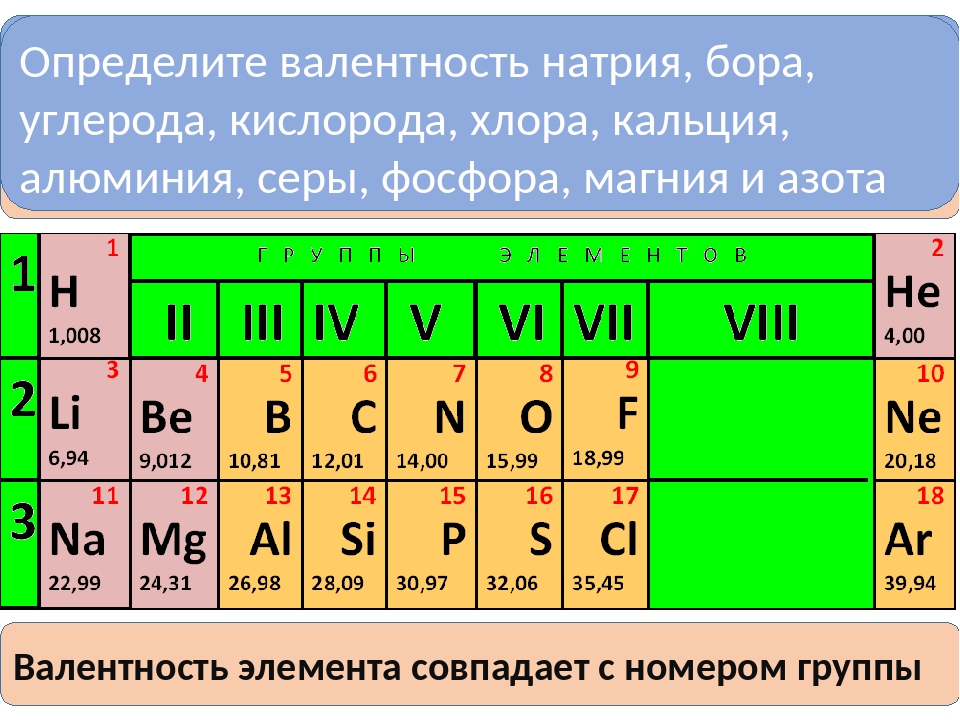 Мы справимся с любой поставленной перед нами работой технического и гуманитарного плана. И не важно: она по объёму на две формулы или огромная сложно структурированная на 125 страниц! Нам по силам всё, поэтому не стесняйтесь, присылайте.
Мы справимся с любой поставленной перед нами работой технического и гуманитарного плана. И не важно: она по объёму на две формулы или огромная сложно структурированная на 125 страниц! Нам по силам всё, поэтому не стесняйтесь, присылайте.
Срок выполнения разный: возможно онлайн (сразу пишите и сразу помогаю), а если у Вас что-то сложное – то от двух до пяти дней.
Для качественного оформления работы обязательно нужны методические указания и, желательно, лекции. Также я провожу онлайн-занятия и занятия в аудитории для студентов, чтобы дать им более качественные знания.
Моё видео:
Как вы работаете?
Вам нужно написать сообщение в WhatsApp . После этого я оценю Ваш заказ и укажу срок выполнения. Если условия Вас устроят, Вы оплатите, и преподаватель, который ответственен за заказ, начнёт выполнение и в согласованный срок или, возможно, раньше срока Вы получите файл заказа в личные сообщения.
Если условия Вас устроят, Вы оплатите, и преподаватель, который ответственен за заказ, начнёт выполнение и в согласованный срок или, возможно, раньше срока Вы получите файл заказа в личные сообщения.
Стоимость заказа зависит от задания и требований Вашего учебного заведения. На цену влияют: сложность, количество заданий и срок выполнения. Поэтому для оценки стоимости заказа максимально качественно сфотографируйте или пришлите файл задания, при необходимости загружайте поясняющие фотографии лекций, файлы методичек, указывайте свой вариант.
Какой срок выполнения заказа?Минимальный срок выполнения заказа составляет 2-4 дня, но помните, срочные задания оцениваются дороже.
Как оплатить заказ?Сначала пришлите задание, я оценю, после вышлю Вам форму оплаты, в которой можно оплатить с баланса мобильного телефона, картой Visa и MasterCard, apple pay, google pay.
В течение 1 года с момента получения Вами заказа действует гарантия. В течении 1 года я и моя команда исправим любые ошибки в заказе.
Качественно сфотографируйте задание, или если у вас файлы, то прикрепите методички, лекции, примеры решения, и в сообщении напишите дополнительные пояснения, для того, чтобы я сразу поняла, что требуется и не уточняла у вас. Присланное качественное задание моментально изучается и оценивается.
Теперь напишите мне в Whatsapp или почту и прикрепите задания, методички и лекции с примерами решения, и укажите сроки выполнения. Я и моя команда изучим внимательно задание и сообщим цену.
Если цена Вас устроит, то я вышлю Вам форму оплаты, в которой можно оплатить с баланса мобильного телефона, картой Visa и MasterCard, apple pay, google pay.
Мы приступим к выполнению, соблюдая указанные сроки и требования. 80% заказов сдаются раньше срока.
80% заказов сдаются раньше срока.
После выполнения отправлю Вам заказ в чат, если у Вас будут вопросы по заказу – подробно объясню. Гарантия 1 год. В течении 1 года я и моя команда исправим любые ошибки в заказе.
youtube.com/embed/g4ioDc7sLwU» frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>
youtube.com/embed/zW5JhiZ4140″ frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>
Можете смело обращаться к нам, мы вас не подведем. Ошибки бывают у всех, мы готовы дорабатывать бесплатно и в сжатые сроки, а если у вас появятся вопросы, готовы на них ответить.
Ошибки бывают у всех, мы готовы дорабатывать бесплатно и в сжатые сроки, а если у вас появятся вопросы, готовы на них ответить.
В заключение хочу сказать: если Вы выберете меня для помощи на учебно-образовательном пути, у вас останутся только приятные впечатления от работы и от полученного результата!
Жду ваших заказов!
С уважением
Пользовательское соглашение
Политика конфиденциальности
| |||||
| ✎ New thread | Private message | Name | Date | |||
| 2022 23:23:19″>6 | 89 | сделана отдельная подписка | VictorMashkovtsev | 4.02.2022 | 9:56 |
| 8 | 115 | mow down откосить от — уже внесён в МТ? | mahavishnu | 5.02.2022 | 10:47 |
| 97 | 1181 | OFF: Поздравляю всех ИП на патенте | 1 2 3 all | Svetozar | 3.02.2022 | 8:21 |
| 4 | 31 | crash-lock bottom box | bnv | 5. 02.2022 02.2022 |
18:31 |
| 2 | 20 | straight-line box | bnv | 5.02.2022 | 19:10 |
| 872 | 15598 | Ошибки в словаре | 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 all | 4uzhoj | 23.02.2021 | 13:36 |
| 2 | 57 | Indemnity clause — MAA Cyprus | Julia_KP | 4.02.2022 | 12:56 |
| 2 | 42 | Prejudice to any claim — MAA Cyprus | Julia_KP | 4. 02.2022 02.2022 |
12:29 |
| 14 | 735 | ОФФ — Ральф Эмерсон | tigeorvip6 | 14.12.2011 | 15:52 |
| 4 | 80 | станковая/прикладная композиция как дисциплины в художественной школе | Eugene Eryomin | 4.02.2022 | 13:03 |
| 50 | 887 | Предлагаю поучаствовать в интересном проекте | 1 2 all | maricom | 2.02.2022 | 11:57 |
| 327 | 11088 | Предложения и вопросы по работе нового сайта | 1 2 3 4 5 6 7 8 all | 4uzhoj | 15. 05.2019 05.2019 |
11:02 |
| 3 | 142 | OFF: нужна ли заглавная буква. | adelaida | 4.02.2022 | 13:06 |
| 23 | 141 | контекстное значение слова miasma? | Perujina | 4.02.2022 | 12:48 |
| 6 | 98 | supply provision | Анастасия Сергиенко | 4.02.2022 | 1:03 |
| 2 | 73 | Doghouse latch placard | Arima | 4. 02.2022 02.2022 |
4:46 |
| 2 | 75 | SCR | Baturin | 3.02.2022 | 14:58 |
| 5 | 83 | must be rocking клапаны двигателя | Mueller | 3.02.2022 | 15:59 |
| 3 | 78 | Outcome and Output | Anastasia_BN | 3.02.2022 | 23:18 |
| 2 | 122 | горная промышленность | Nataliei | 2.02.2022 | 21:40 |
| 02.2022 18:02:29″>3 | 85 | товарный знак | m3m3 | 3.02.2022 | 16:37 |
| 2 | 110 | Ворота, калитка, окно..а может все-таки точка принятия решений? | Shiper | 3.02.2022 | 14:56 |
| 2 | 52 | на систему | Baturin | 3.02.2022 | 15:07 |
| 4 | 98 | натянуть концы труб | Lonely Knight | 3.02.2022 | 11:44 |
| 02.2022 22:40:40″>624 | 20629 | Проблемы в работе нового сайта | 1 2 3 4 5 6 7 8 9 10 11 12 13 14 all | 4uzhoj | 15.05.2019 | 11:05 |
| 7 | 208 | Voidic | DrHesperus | 1.02.2022 | 0:52 |
| 20 | 501 | OFF: Вопрос, конечно, интересный | Amor 71 | 1.02.2022 | 20:45 |
| 11 | 217 | Постановка очистительной клизмы | _abc_ | 2. 02.2022 02.2022 |
7:14 |
электронов валентности мышьяка | Валентность мышьяка (As) с точечной диаграммой
Изучайте здесь валентных электрона мышьяка , чтобы стать лучше в химии. Мы раскроем всю возможную информацию об этом элементе ниже. Мышьяк является одним из наиболее часто используемых химических элементов в области химии. Он имеет представительный символ As и атомный номер 33.
.Сколько валентных электронов имеет мышьяк?
Мышьяк не имеет ядерной естественной формы в природе.Это происходит с количеством минералов, таких как сера или кристаллический элемент. Мышьяк относится к группе металлоидов. Он имеет типичный внешний вид, как твердое сероватое металлическое вещество.
Кроме того, мышьяк является одним из тех химических элементов, которые имеют множество применений. Следовательно, мышьяк имеет важное значение в промышленной сфере. Типичное и общее использование мышьяка включает свинец в производстве сплавов. Он широко используется в качестве ключевого компонента в производстве батарей или боеприпасов.
Он широко используется в качестве ключевого компонента в производстве батарей или боеприпасов.
Мышьяк также работает как полупроводник, а также в электронных устройствах. Таким образом, вы также можете увидеть форму мышьяка в нескольких видах пестицидов.
Точечная диаграмма электронов валентности мышьякаДиаграмма или графическая форма — лучший способ изучения валентных электронов. Он разрушает полноценную электронную конфигурацию химического элемента. Для той же цели у нас есть точечная диаграмма мышьяка Льюиса. Эта точечная диаграмма позволит вам изучить количество валентных электронов атома.
Диаграмма в основном показывает точки вокруг символа мышьяка (As). Эти точки на самом деле являются точным числом валентных электронов мышьяка.
Валентность мышьяка – As Валентность мышьяка может варьироваться от 3 до 5. Мышьяк имеет две формы: формы арсенита и формы арсената. Арсенит здесь является доминирующей формой, следовательно, он имеет валентность 3. Итак, арсенатная форма мышьяка имеет валентность 5.
Итак, арсенатная форма мышьяка имеет валентность 5.
Мышьяк — обзор | ScienceDirect Topics
Лечение интоксикации мышьяком и ртутью
Принципы лечения интоксикации мышьяком и ртутью включают быстрое удаление от источника отравления, активную стабилизацию и поддерживающую терапию, обеззараживание и хелатирующую терапию, когда это необходимо. При подозрении на диагноз следует связаться с местным токсикологическим центром и согласовать лечение с врачами, знакомыми с лечением отравлений тяжелыми металлами.
Поддерживающая терапия пациентов, подвергшихся воздействию газообразного мышьяка, требует тщательного наблюдения за признаками гемолиза, включая оценку мазка периферической крови и анализа мочи. Может потребоваться переливание эритроцитарной массы, а также введение внутривенных жидкостей, бикарбоната натрия и маннитола для предотвращения почечной недостаточности, вторичной по отношению к отложению гемоглобина в почках.После вдыхания паров элементарной ртути пациентам требуется тщательный мониторинг состояния дыхания, который может включать пульсоксиметрию, анализ газов артериальной крови и рентгенографию органов грудной клетки. Поддерживающая терапия включает введение дополнительного кислорода и, в тяжелых случаях, интубацию и искусственную вентиляцию легких.
Поддерживающая терапия включает введение дополнительного кислорода и, в тяжелых случаях, интубацию и искусственную вентиляцию легких.
Острый прием внутрь неорганических солей мышьяка и ртути приводит к геморрагическому гастроэнтериту, сердечно-сосудистому коллапсу и полиорганной дисфункции. Для лечения нестабильности сердечно-сосудистой системы могут потребоваться инфузионная терапия, вазопрессоры и переливание продуктов крови.Тяжелая дыхательная недостаточность, кома с потерей рефлексов дыхательных путей, некупируемые судороги и паралич дыхания являются показаниями для интубации и искусственной вентиляции легких. Необходимо тщательно контролировать функцию почек для выявления признаков почечной недостаточности и необходимости проведения гемодиализа.
Обеззараживание желудочно-кишечного тракта после приема внутрь неорганических солей мышьяка и ртути недостаточно изучено. Из-за разъедающего действия этих соединений не рекомендуется вызывать рвоту, и перед промыванием желудка можно рассмотреть возможность проведения эндоскопии. Мышьяк и ртуть плохо абсорбируются активированным углем, но его использование может быть полезным, если есть подозрения на наличие сопутствующего пищеварения. Промывание всего кишечника используется для удаления любого рентгеноконтрастного материала, оставшегося в желудочно-кишечном тракте.
Мышьяк и ртуть плохо абсорбируются активированным углем, но его использование может быть полезным, если есть подозрения на наличие сопутствующего пищеварения. Промывание всего кишечника используется для удаления любого рентгеноконтрастного материала, оставшегося в желудочно-кишечном тракте.
Chelation при остром отравлении мышьяком и ртутью наиболее эффективен при введении как можно скорее после воздействия. Хелатирование следует продолжать до тех пор, пока суточные уровни мышьяка или ртути в моче не вернутся к норме (<50 мкг/л для мышьяка и <20 мкг/л для ртути), пока у пациента не исчезнут симптомы, или оставшиеся токсические эффекты считаются необратимыми. .Эффективность хелатообразования при длительном воздействии снижается, поскольку тяжелые металлы в тканевом компартменте практически не заменяются, а некоторая степень необратимой токсичности уже имеет место.
Димеркапрол , также известный как 2,3-димеркаптопропанол или Британский антилевизит (БАЛ) , является энтеросорбентом выбора для пациентов, которые не переносят пероральную терапию, что часто верно для пациентов в критическом состоянии и после приема внутрь агрессивных неорганических солей мышьяка и ртути. БАЛ выпускается в виде суспензии в арахисовом масле и бензилбензоате в ампулах по 3 мл в концентрации 100 мг/мл для глубокой внутримышечной (в/м) инъекции. При отравлении мышьяком рекомендуемая схема БАЛ составляет 2,5 мг/кг в/м каждые 6 ч в течение первых 2 дней, 2,5 мг/кг в/м каждые 12 ч в 3-й день, а затем 2,5 мг/кг/сут в/м в течение 10 дней. При тяжелом отравлении мышьяком доза БАЛ увеличивается до 3 мг/кг в/м каждые 4 ч в течение 2 дней, 3 мг/кг в/м каждые 6 ч в 3-й день, а затем 3 мг/кг в/м каждые 12 ч в течение 10 дней. Доза БАЛ при отравлении неорганической ртутью составляет 5 мг/кг в/м в 1-й день, затем 2.5 мг/кг в/м каждые 12–24 ч в течение 10 дней. Комплекс БАЛ-тяжелые металлы выводится с мочой и желчью. Рекомендуется период 5 дней между курсами хелатирования. Побочные эффекты БАЛ включают боль в месте инъекции, артериальную гипертензию, тахикардию, потливость, тошноту, рвоту, боль в животе, ощущение жжения в ротоглотке и чувство сдавления в груди.
БАЛ выпускается в виде суспензии в арахисовом масле и бензилбензоате в ампулах по 3 мл в концентрации 100 мг/мл для глубокой внутримышечной (в/м) инъекции. При отравлении мышьяком рекомендуемая схема БАЛ составляет 2,5 мг/кг в/м каждые 6 ч в течение первых 2 дней, 2,5 мг/кг в/м каждые 12 ч в 3-й день, а затем 2,5 мг/кг/сут в/м в течение 10 дней. При тяжелом отравлении мышьяком доза БАЛ увеличивается до 3 мг/кг в/м каждые 4 ч в течение 2 дней, 3 мг/кг в/м каждые 6 ч в 3-й день, а затем 3 мг/кг в/м каждые 12 ч в течение 10 дней. Доза БАЛ при отравлении неорганической ртутью составляет 5 мг/кг в/м в 1-й день, затем 2.5 мг/кг в/м каждые 12–24 ч в течение 10 дней. Комплекс БАЛ-тяжелые металлы выводится с мочой и желчью. Рекомендуется период 5 дней между курсами хелатирования. Побочные эффекты БАЛ включают боль в месте инъекции, артериальную гипертензию, тахикардию, потливость, тошноту, рвоту, боль в животе, ощущение жжения в ротоглотке и чувство сдавления в груди. БАЛ может вызывать гемолиз у лиц с дефицитом глюкозо-6-фосфатдегидрогеназы. Важно отметить, что БАЛ противопоказан для хелатирования метилртути, потому что БАЛ перераспределяет метилртуть в мозг из других тканей, что приводит к повышению нейротоксичности.
БАЛ может вызывать гемолиз у лиц с дефицитом глюкозо-6-фосфатдегидрогеназы. Важно отметить, что БАЛ противопоказан для хелатирования метилртути, потому что БАЛ перераспределяет метилртуть в мозг из других тканей, что приводит к повышению нейротоксичности.
Общая информация о мышьяке
Мышьяк в больших количествах встречается в земной коре. Он присутствует в ряде минералов и встречается в следовых количествах в горных породах, почве, воде и воздухе.
Около трети атмосферного мышьяка является производным из природных источников, т.е. вулканы и оставшиеся две трети происходит за счет техногенных источников.
Высокий
уровни или мышьяк могут быть обнаружены в питьевой воде, которая была
собранные из глубоко пробуренных скважин или даже как
природное явление, при котором грунтовые воды были загрязнены
минералы, растворяющиеся в горных породах и почвах. Эта проблема
более распространены в Южной Азии.
Эта проблема
более распространены в Южной Азии.
Основные промышленные процессы, вызывающие антропогенные мышьяковое загрязнение воздуха, почвы и воды в окружающей среде являются:
Применение
пестицидов, содержащих мышьяк, также загрязнили большие территории.
сельскохозяйственных угодий.
То
использование мышьяка в качестве консерванта для древесины также привело к экологическим
загрязнение.12 февраля 2002 года Агентство по охране окружающей среды США объявило
добровольное решение деревообрабатывающей промышленности, обработанной под давлением
поэтапный отказ от использования известного консерванта древесины на основе мышьяка
в виде хромированного арсената меди (CCA) во всех продуктах, предназначенных для
потребительский рынок. CCA, который был наиболее распространенным консервантом для древесины. в США содержит 22% чистого мышьяка.
в США содержит 22% чистого мышьяка.
В США от 31 декабря 2003 г. запрещается использование деревообработчиков или производителей. для сохранения древесины для жилых помещений с CCA.Нажмите здесь для получения дополнительной информации о CCA.
Мышьяк и его соединения также используются в инсектицидах, гербицидах, твердотельных легирующие агенты и различные сплавы.
Как влияет ли мышьяк на здоровье человека?
Воздействие высоких концентраций мышьяка может вызвать рак кожи, мочевого пузыря, почек и легких, болезни крови сосуды голеней и стоп.Сахарный диабет, высокое кровяное давление и нарушения репродуктивной функции также были связаны с воздействием мышьяка.
Информация об элементе мышьяка: факты, свойства, тенденции, использование и сравнение — Периодическая таблица элементов
История мышьяка
Элемент мышьяк был открыт в бронзовом веке в год
1250 в неизвестном месте
. мышьяк
производное от английского слова (лат. arsenicum)
мышьяк
производное от английского слова (лат. arsenicum)
Присутствие мышьяка: изобилие в природе и вокруг нас
В таблице ниже показано содержание мышьяка во Вселенной, на Солнце, в метеоритах, Земная кора, океаны и тело человека.
Кристаллическая структура мышьяка
Твердотельная структура мышьяка представляет собой простой тригонал .
Кристаллическую структуру можно описать с точки зрения ее элементарной ячейки. Единичные клетки повторяются в три объемное пространство для формирования конструкции.
Параметры ячейки
Элементарная ячейка представлена в терминах ее параметров решетки, которые являются длинами ячейки края Константы решетки ( a , b и c )
| и | б | в |
|---|---|---|
375. 98 98 | 375,98 | 1054,75 вечера |
и углы между ними Углы решетки (альфа, бета и гамма).
| альфа | бета | гамма |
|---|---|---|
| π/2 | №/2 | 2 π/3 |
Положения атомов внутри элементарной ячейки описываются набором положений атомов ( x i , y i , z i ), измеренные от опорной точки решетки.
Свойства симметрии кристалла описываются понятием пространственных групп. Все возможное
симметричное расположение частиц в трехмерном пространстве описывается 230 пространственными группами
(219 различных типов или 230, если хиральные копии считаются различными.
Атомные и орбитальные свойства мышьяка
Атомы мышьяка имеют 33 электрона и структура электронной оболочки [2, 8, 18, 5] с атомарным символом (квантовыми числами) 4 S 3/2 .
Оболочечная структура мышьяка – количество электронов на единицу энергии уровень
| п | с | р | д | ф | |
|---|---|---|---|---|---|
| 1 | К | 2 | |||
| 2 | л | 2 | 6 | ||
| 3 | М | 2 | 6 | 10 | |
| 4 | Н | 2 | 3 |
Электронная конфигурация мышьяка в основном состоянии — нейтральная Атом мышьяка
Электронная конфигурация нейтрального атома мышьяка в основном состоянии
[Ар] 3d10 4s2 4p3. Часть конфигурации мышьяка, эквивалентная благородному газу
предшествующий период обозначается аббревиатурой [Ar]. Для атомов с большим количеством электронов это
нотация может стать длинной, поэтому используется сокращенная нотация. Это важно, поскольку это
валентные электроны 3d10 4s2 4p3, электроны в
внешняя оболочка, определяющая химические свойства элемента.
Часть конфигурации мышьяка, эквивалентная благородному газу
предшествующий период обозначается аббревиатурой [Ar]. Для атомов с большим количеством электронов это
нотация может стать длинной, поэтому используется сокращенная нотация. Это важно, поскольку это
валентные электроны 3d10 4s2 4p3, электроны в
внешняя оболочка, определяющая химические свойства элемента.
Расшифрованная электронная конфигурация нейтрального мышьяка
Полная электронная конфигурация в основном состоянии атома мышьяка, Полная электронная конфигурация
1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p3
Атомная структура мышьяка
Атомный радиус мышьяка составляет 114 пм, а его ковалентный радиус — 119 пм.
Атомный спектр мышьяка
Химические свойства мышьяка: Энергии ионизации мышьяка и сродство к электрону
Электронное сродство мышьяка составляет 78 кДж/моль.
Энергия ионизации мышьяка
Энергии ионизации мышьяка
см. в таблице ниже.| Номер энергии ионизации | Энтальпия — кДж/моль |
|---|---|
| 1 | 947 |
| 2 | 1798 |
| 3 | 2735 |
| 4 | 4837 |
| 5 | 6043 |
| 6 | 12310 |
Физические свойства мышьяка
См. таблицу ниже для физических свойств мышьяка
| Плотность | 5. 727 г/см3 727 г/см3 |
| Молярный объем | 13.0821721669 см3 |
Упругие свойства
Твердость мышьяка — испытания для измерения твердости элемента
Электрические свойства мышьяка
Мышьяк является проводником электричества. Ссылаться на Таблица ниже для электрических свойств мышьяка
Свойства тепла и проводимости мышьяка
Магнитные свойства мышьяка
Оптические свойства мышьяка
Акустические свойства мышьяка
Термические свойства мышьяка – энтальпии и термодинамика
См. таблицу ниже для термических свойств мышьяка
.Энтальпии мышьяка
Изотопы мышьяка — ядерные свойства мышьяка
Изотопы родия. Встречающийся в природе мышьяк
1 стабильный изотоп —
75Ас.
Встречающийся в природе мышьяк
1 стабильный изотоп —
75Ас.
| Изотоп | Масса изотопов | % Изобилие | Т половина | Режим затухания |
|---|---|---|---|---|
| 60Ас | ||||
| 61Ас | ||||
| 62Ас | ||||
| 63А | ||||
| 64А | ||||
| 65Ас | ||||
| 66Ас | ||||
| 67А | ||||
| 68Ас | ||||
| 69Ас | ||||
| 70Ас | ||||
| 71Ас | ||||
| 72Ас | ||||
| 73А | ||||
| 74А | ||||
| 75Ас | 100% | Стабильный | Н/Д | |
| 76Ас | ||||
| 77Ас | ||||
| 78Ас | ||||
| 79Ас | ||||
| 80Ас | ||||
| 81А | ||||
| 82Ас | ||||
| 83А | ||||
| 84А | ||||
| 85Ас | ||||
| 86Ас | ||||
| 87Ас | ||||
| 88Ас | ||||
| 89Ас | ||||
| 90Ас | ||||
| 91Ас | ||||
| 92Ас |
Нормативно-правовое регулирование и здоровье – Параметры и рекомендации по охране здоровья и безопасности
| Количество CAS | КАС7440-38-2 |
| Номер РТЕКС | {Н/Д, RTECSCG0525000, Н/Д} |
| Класс опасности DOT | {Н/Д, 6. 1, н/д} 1, н/д} |
| Номера точек | «Н/Д», {1558}, «Н/Д» |
| Номер ЕС | {Н/Д, Н/Д, Н/Д} |
| Рейтинг огнестойкости NFPA | {Н/Д, 2, Н/Д} |
| Опасности NFPA | Н/Д, Н/Д, Н/Д |
| Рейтинг здоровья NFPA | {Н/Д, 3, Н/Д} |
| Рейтинг реактивности NFPA | {Н/Д, Н/Д, Н/Д} |
Поиск по базе данных
Список уникальных идентификаторов для поиска элемента в различных базах данных химических реестров
Изучите нашу интерактивную периодическую таблицу
Сравнение элементов периодической таблицы
Какова конфигурация валентных электронов для атома мышьяка
Какие валентные электроны у мышьяка?, Мышьяк находится в группе 15, поэтому его атомы имеют 5 валентных электронов .
Кроме того, какова валентность мышьяка?, Мышьяк имеет 5 валентных электронов.
Наконец, какова конфигурация валентных электронов в нейтральном атоме мышьяка? Электронная конфигурация для основного состояния, нейтральный атом мышьяка : 1s22s22p63s23p63d104s24p3 или [Ar]3d104s24p3.
Часто задаваемый вопрос:
Сколько валентных электронов в нейтральном атоме мышьяка?
Мышьяк находится в группе 15, поэтому его атомы имеют 5 валентных электронов .
Под каким номером Оболочка является валентной оболочкой нейтрального атома мышьяка?
Мышьяк , As , расположен в периоде 4, группе 15 периодической таблицы и имеет атомный номер равный 33. Как видите, самая внешняя оболочка является четвертой оболочкой , n=4 .
Как определить валентность мышьяка?
Мышьяк имеет 5 валентных электронов.
Его электронная конфигурация 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p3. Его внешняя оболочка (4s и 4p) имеет 5 электронов, это валентных электронов.
Его внешняя оболочка (4s и 4p) имеет 5 электронов, это валентных электронов.
Как определить валентность мышьяка?
Мышьяк имеет 5 валентных электронов.
Его электронная конфигурация 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p3.Его внешняя оболочка (4s и 4p) имеет 5 электронов, это валентных электронов.
Почему у мышьяка 5 валентных электронов?
Конфигурация самой внешней оболочки Мышьяк имеет вид 4s24p3, поэтому его самая внешняя оболочка имеет 5 электронов , что дает 5 валентных электронов .
Сколько валентных электронов может удерживать мышьяк?
Природный химикат
В периодической таблице элементов мышьяк занимает №.33. Атом мышьяка имеет 33 электронов и 33 протона с пятью валентными электронами (те, что могут участвовать в образовании химических связей с другими электронами ) во внешней оболочке.
Какова валентная оболочка мышьяка?
Мышьяк имеет 5 валентных электронов .
Самая внешняя оболочка (4s и 4p) имеет 5 электронов , это валентных электронов .
Почему у мышьяка 5 валентных электронов?
Конфигурация самой внешней оболочки Мышьяк имеет вид 4s24p3, поэтому его самая внешняя оболочка имеет 5 электронов , что дает 5 валентных электронов .
Сколько валентных и остовных электронов имеет мышьяк?
Мышьяк находится в группе 15, поэтому его атомы имеют 5 валентных электронов .
Сколько остовных электронов в мышьяке как )?
Мышьяк имеет атомный номер 33.Это означает, что у него 33 протона в ядре и 33 электронов, жужжащих вокруг ядра, когда оно не заряжено.
Сколько валентных электронов у мышьяка?
Мышьяк находится в группе 15, поэтому его атомы имеют 5 валентных электронов .
Как найти валентные электроны и остовные электроны?
Вы также можете найти ядро и валентные электроны с помощью определения или поиска электронных конфигураций основных элементов группы.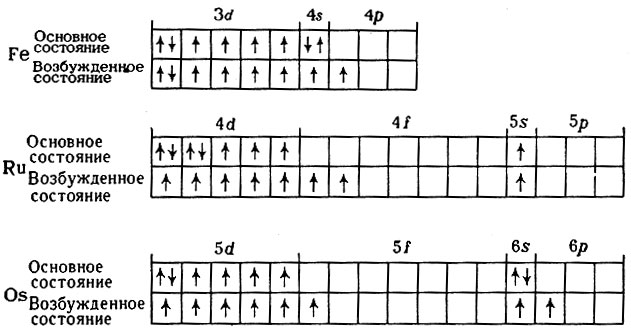 Атомный номер – это количество протонов в ядрах атомов элемента. Нейтральный атом имеет такое же количество электронов, что и протонов. Мы можем посмотреть в периоде 2 в качестве примера.
Атомный номер – это количество протонов в ядрах атомов элемента. Нейтральный атом имеет такое же количество электронов, что и протонов. Мы можем посмотреть в периоде 2 в качестве примера.
Сколько остовных электронов в Be?
Следовательно, Mg имеет 10 основных электронов и 2 валентных электрона . Количество основных электронов зависит от периода (ряда), в котором находится элемент.
…
Валентность и остовных электронов .
| 1 | 19К |
| 2 | 20Ca |
| 26Fe | |
| 31Ga | |
| 36Кр |
Сколько валентных электронов у мышьяка?
Мышьяк находится в группе 15, поэтому его атомы имеют 5 валентных электронов .
Какой единственный металл имеет 5 валентных электронов?
Атомы в семействе азота имеют 5 валентных электронов . Они имеют тенденцию делиться 90 175 электронами на 90 176, когда они связываются. Другими элементами этого семейства являются фосфор, мышьяк, сурьма и висмут.
Они имеют тенденцию делиться 90 175 электронами на 90 176, когда они связываются. Другими элементами этого семейства являются фосфор, мышьяк, сурьма и висмут.
Имеет ли мышьяк 3 валентных электрона?
Мышьяк находится в группе 15, поэтому его атомы имеют 5 валентных электронов . Мы можем также определить количество валентных электронов репрезентативных элементов, определив их основные состояния электронных конфигураций. Самые высокие энергетические (самые внешние) s- и p-подуровни, также называемые валентной оболочкой, содержат валентных электронов .
Какова валентность мышьяка?
Мышьяк находится в группе 15, поэтому его атомы имеют 5 валентных электронов.
(Посетили 5 раз, сегодня посетили 1 раз)
РодственныеПриродный мышьяк с уникальной структурой порядка: потенциал для новых квантовых материалов
Кристаллический полиморф мышьяка
Третий кристаллический полиморф природного мышьяка был обнаружен в Японии и назван парарсенолампритом 1 . Параарсеноламприт более устойчив к изменениям в результате выветривания или окисления, чем серый мышьяк (\(R\bar{{3}}m\)-As). На возможность двух пространственных групп (одной из предложенных является Pnm2 1 ) была указана 1 и кристаллическая структура не определена. Определение неизвестной структуры требует измерения широкого диапазона интенсивностей дифракционных пиков. Здесь мы выясняем уникальную структуру этой третьей кристаллической минеральной фазы мышьяка (параарсеноламприта) с помощью превосходного экспериментального оборудования и ее электронной структуры с помощью моделирования и обсуждаем ее возможности в создании новых функциональных материалов.Параарсеноламприт имеет именно промежуточную структуру, в которой регулярно расположены структурные \(R\bar{{3}}m\)-As и Bmab -As.
Параарсеноламприт более устойчив к изменениям в результате выветривания или окисления, чем серый мышьяк (\(R\bar{{3}}m\)-As). На возможность двух пространственных групп (одной из предложенных является Pnm2 1 ) была указана 1 и кристаллическая структура не определена. Определение неизвестной структуры требует измерения широкого диапазона интенсивностей дифракционных пиков. Здесь мы выясняем уникальную структуру этой третьей кристаллической минеральной фазы мышьяка (параарсеноламприта) с помощью превосходного экспериментального оборудования и ее электронной структуры с помощью моделирования и обсуждаем ее возможности в создании новых функциональных материалов.Параарсеноламприт имеет именно промежуточную структуру, в которой регулярно расположены структурные \(R\bar{{3}}m\)-As и Bmab -As.
Электрические свойства соединения полупроводника с металлом в элементах группы V широко изучались в областях физики, химии и материаловедения 1,2,3,4,5,6 . Ряд P, As и Sb в элементах V группы показывает градацию свойств от неметалла к металлу. Несколько фаз в P, As и Sb обладают сверхпроводящими свойствами 90–169 7,8,9 90–170 .Физические свойства элементов группы V сильно анизотропны из-за асимметричного характера химической связи. Непростые структуры описываются следующим образом: ковалентно связанные атомные слои слабо удерживаются вместе силой Ван-дер-Ваальса, легко расщепляются в соответствующей плоскости и образуют двумерную структуру. Двумерные полупроводники были предложены из-за их многообещающих характеристик устройств, таких как черный фосфор, состоящий из слоя фосфорена 10 .Изучение одноэлементных материалов, таких как P и As, даст рекомендации для разработки материалов следующего поколения.
Ряд P, As и Sb в элементах V группы показывает градацию свойств от неметалла к металлу. Несколько фаз в P, As и Sb обладают сверхпроводящими свойствами 90–169 7,8,9 90–170 .Физические свойства элементов группы V сильно анизотропны из-за асимметричного характера химической связи. Непростые структуры описываются следующим образом: ковалентно связанные атомные слои слабо удерживаются вместе силой Ван-дер-Ваальса, легко расщепляются в соответствующей плоскости и образуют двумерную структуру. Двумерные полупроводники были предложены из-за их многообещающих характеристик устройств, таких как черный фосфор, состоящий из слоя фосфорена 10 .Изучение одноэлементных материалов, таких как P и As, даст рекомендации для разработки материалов следующего поколения.
Одноэлементные минералы мышьяка хорошо известны благодаря двум полиморфам кристаллических фаз, названным мышьяком (пространственная группа \(R\bar{{3}}m\)) и арсенолампритом (пространственная группа Bmab ). Полуметаллический серый мышьяк (\(R\bar{{3}}m\)-As) является наиболее распространенным и считается стабильной формой мышьяка в условиях окружающей среды. Он кристаллизуется в ромбоэдрической структуре с пространственной группой \(R\bar{{3}}m\) (структура типа A7).Черный мышьяк (от черного до темно-серого, Bmab -As) представляет собой стекловидный кристалл и изоструктурирован черным фосфором 11,12,13 . Его можно получить охлаждением паров мышьяка при 100–220 °С или нагреванием аморфного мышьяка при 100–175 °С в присутствии Hg 14 . Черный мышьяк превращается в полуметаллический серый мышьяк при температуре около 520 К. Из теоретических расчетов следует, что чистый черный мышьяк является метастабильным и стабилизируется примесями 15 . Метастабильный желтый диэлектрик мышьяк состоит из молекул As 4 и имеет ту же конфигурацию, что и молекула P 4 .Этот аллотроп получают путем конденсации пара на стеклянных подложках при очень низкой температуре. Эта форма разрушается рентгеновским излучением и превращается в полуметаллический мышьяк серого цвета при температуре выше 30 К.
Он кристаллизуется в ромбоэдрической структуре с пространственной группой \(R\bar{{3}}m\) (структура типа A7).Черный мышьяк (от черного до темно-серого, Bmab -As) представляет собой стекловидный кристалл и изоструктурирован черным фосфором 11,12,13 . Его можно получить охлаждением паров мышьяка при 100–220 °С или нагреванием аморфного мышьяка при 100–175 °С в присутствии Hg 14 . Черный мышьяк превращается в полуметаллический серый мышьяк при температуре около 520 К. Из теоретических расчетов следует, что чистый черный мышьяк является метастабильным и стабилизируется примесями 15 . Метастабильный желтый диэлектрик мышьяк состоит из молекул As 4 и имеет ту же конфигурацию, что и молекула P 4 .Этот аллотроп получают путем конденсации пара на стеклянных подложках при очень низкой температуре. Эта форма разрушается рентгеновским излучением и превращается в полуметаллический мышьяк серого цвета при температуре выше 30 К. В системе мышьяка 16 не предложено фазовой диаграммы P-T с кристаллическими формами.
В системе мышьяка 16 не предложено фазовой диаграммы P-T с кристаллическими формами.
Мышьяк имеет пять валентных электронов. В основном число связей для ковалентных веществ равно 8- N , где N — порядковый номер периодической группы, т.е.г. 8-5 = 3 для As. Каждый атом в полиморфах мышьяка имеет тройную координацию, как и ожидалось для ковалентной связи с электронной конфигурацией s 2 p 3 . s -орбиталь полностью занята двумя электронами и не способствует когезии. В сцеплении преобладают наполовину заполненные p орбитали. Элемент As группы V по своей кристаллической структуре можно просто объяснить как результат пайерлсовского искажения p -связанных атомов.Шесть лепестков орбиталей p образуют простую кубическую структуру. Простое кубическое искажение в A7 устраняет орбитальное вырождение p и приводит к образованию трех насыщенных связей ближайшего соседа. Удвоение периодичности в трех основных направлениях простой кубической структуры может быть достигнуто за счет чередования коротких ковалентных связей и длинных ван-дер-ваальсовых связей. Это приводит к слоистой структуре трехкоординированных ковалентных атомов. Причина, по которой элементы группы V являются полупроводниками или полуметаллами, связана с щелью на уровне Ферми, открывающейся за счет удвоения периодичности.Электронная конфигурация AS 4 S 2 3D 10 4P 4P 9119 3 , в котором есть D Orbitals в дополнение к S и P Orbitals. Выяснение вклада орбиталей d важно для понимания физических свойств и последующего проектирования материалов.
Это приводит к слоистой структуре трехкоординированных ковалентных атомов. Причина, по которой элементы группы V являются полупроводниками или полуметаллами, связана с щелью на уровне Ферми, открывающейся за счет удвоения периодичности.Электронная конфигурация AS 4 S 2 3D 10 4P 4P 9119 3 , в котором есть D Orbitals в дополнение к S и P Orbitals. Выяснение вклада орбиталей d важно для понимания физических свойств и последующего проектирования материалов.
Кристаллическая структура, морфология, двойникование и сравнение с другими фазами As
Кристаллическая структура As типа Pnm2 1 была определена методом рентгеновской дифракции монокристаллов с использованием превосходного экспериментального оборудования.Так как удалось обнаружить хорошие монокристаллы и получить хороший набор дифракционных данных, структуру можно было определить прямым методом (подробности в файле CIF). Кристаллы представляют собой встречающийся в природе мышьяк, содержащий три процента элемента сурьмы из гомологичных элементов. На рисунках 1a,b показана кристаллическая структура в проекциях на (010) и (001) соответственно. Существует восемь типов кристаллографически неэквивалентных узлов As (расширенная таблица данных 1). Все атомы находятся в плоскости зеркала, параллельной (010).Сайты As повторяются как -As1-As2-As2′-As1′-As3′-As4′-As4-As3-As1- вдоль оси или в противоположном направлении. Трехсвязный (выпученный) шестиугольный слой изгибается в положениях As4′-As4 или As4-As4′. Структурно восемь видов кристаллографически эквивалентных узлов As делятся на четыре пары: As1-As1′, As2-As2′, As3-As3′ и As4-As4′. Эту структуру также можно разделить на две части, такие как As1-As2-As2′-As1′ (желтовато-зеленая сфера на рис. 1a) и As3′-As4′-As4-As3 (зеленая сфера).
Кристаллы представляют собой встречающийся в природе мышьяк, содержащий три процента элемента сурьмы из гомологичных элементов. На рисунках 1a,b показана кристаллическая структура в проекциях на (010) и (001) соответственно. Существует восемь типов кристаллографически неэквивалентных узлов As (расширенная таблица данных 1). Все атомы находятся в плоскости зеркала, параллельной (010).Сайты As повторяются как -As1-As2-As2′-As1′-As3′-As4′-As4-As3-As1- вдоль оси или в противоположном направлении. Трехсвязный (выпученный) шестиугольный слой изгибается в положениях As4′-As4 или As4-As4′. Структурно восемь видов кристаллографически эквивалентных узлов As делятся на четыре пары: As1-As1′, As2-As2′, As3-As3′ и As4-As4′. Эту структуру также можно разделить на две части, такие как As1-As2-As2′-As1′ (желтовато-зеленая сфера на рис. 1a) и As3′-As4′-As4-As3 (зеленая сфера).
( a ) Кристаллическая структура мышьяка типа Pnm2 1 (параарсеноламприта) в проекции на (001) и (010). Каждый прямоугольник обозначает элементарную ячейку. ( b ) Сравнение кристаллических структур кристаллических фаз мышьяка. Конструкция Pnm2 1 -As состоит из стержневой набивки 1:1 из серо- и черно-мышьяковистых частей. Массив представляет собой узор «елочка» из двух частей. Серый мышьяк (\(R\bar{{3}}m\)-As) имеет слоистую структуру и может быть получен искажением типа Пайерса вдоль направления [111] простой кубической структуры 32,33 . В структуре шесть ближайших соседей в исходной простой кубической структуре разбиваются на трех равноудаленных ближайших соседей и трех следующих ближайших соседей.Слоистые атомы образуют шестичленные кольца в конформации кресла с внутрислойными и межслоевыми связями. Расположение атомов в черном мышьяке ( Bmab -As) состоит из гофрированных слоев, уложенных друг на друга в направлении c 13 .
Каждый прямоугольник обозначает элементарную ячейку. ( b ) Сравнение кристаллических структур кристаллических фаз мышьяка. Конструкция Pnm2 1 -As состоит из стержневой набивки 1:1 из серо- и черно-мышьяковистых частей. Массив представляет собой узор «елочка» из двух частей. Серый мышьяк (\(R\bar{{3}}m\)-As) имеет слоистую структуру и может быть получен искажением типа Пайерса вдоль направления [111] простой кубической структуры 32,33 . В структуре шесть ближайших соседей в исходной простой кубической структуре разбиваются на трех равноудаленных ближайших соседей и трех следующих ближайших соседей.Слоистые атомы образуют шестичленные кольца в конформации кресла с внутрислойными и межслоевыми связями. Расположение атомов в черном мышьяке ( Bmab -As) состоит из гофрированных слоев, уложенных друг на друга в направлении c 13 .
На рис. 1b показано сравнение кристаллических структур кристаллических фаз мышьяка ( Pnm2 1 -As (параарсеноламприт), \(R\bar{{3}}m\)-As (полуметаллический серый самородный мышьяк ) и Bmab -As (черный мышьяк, арсеналампит)). Выявлено, что структура Pnm2 1 -As, параарсеноламприта, представляет собой смешанную структуру, в которой регулярно расположены структурные единицы серого и черного As. Структура Pnm2 1 -As состоит из упаковки 1:1 \(R\bar{{3}}m\)-As и Bmab -As основных единиц. Массив представляет собой узор «елочка», состоящий из двух блоков.
Выявлено, что структура Pnm2 1 -As, параарсеноламприта, представляет собой смешанную структуру, в которой регулярно расположены структурные единицы серого и черного As. Структура Pnm2 1 -As состоит из упаковки 1:1 \(R\bar{{3}}m\)-As и Bmab -As основных единиц. Массив представляет собой узор «елочка», состоящий из двух блоков.
Расстояния и углы коротких ковалентных связей в Pnm2 1 -As представлены в расширенной таблице данных 2.Расстояния и углы связи являются полезными индикаторами свойств химической связи и орбиталей связывающих электронов и позволяют сравнивать кристаллические полиморфы. Так как четыре парных положения можно разделить на две группы со средними валентными углами большими (As3 (98,2°) и As4 (96,3°)) или меньшими (As1′ (89,4°) и As2 (94,0°)) среднего значения 94,45°. Внутрислоевые и межслоевые расстояния As-As в As типа Pnm2 1 являются промежуточными между As типа \(R\bar{{3}}m\) и Bmab типа и имеют разброс значений.
Установленная взаимосвязь между морфологией кристалла и осью элементарной ячейки для Pnm2 1 -As показана на рис. 2. Двойниковая граница и бороздки на поверхности кристалла наблюдаются параллельно оси b. Структура Pnm2 1 -As состоит из упаковки частей \(R\bar{{3}}m\) — и Bmab -As (рис. 1б). Оба участка параллельны оси b, а двойникование и исчерченность возникают из-за изменения периодичности участков.Определенный двойник изменит соотношение каждой части \(R\bar{{3}}m\) — и Bmab -As.
Рисунок 2 СЭМ-изображение кристаллического агрегата Pnm2 1 -арсенина и взаимосвязь между морфологией кристалла и осью решетки. Сравнение морфологии кристаллов с единичной решеткой и расположением атомов. Pnm2 1 -кристаллы мышьяка формируются в виде пластинчатых кристаллов, которые демонстрируют параллельный рост вдоль оси b. Плохой рост в направлении, перпендикулярном оси с, приводит к форме тонкой пластины. Поскольку периодичность в направлении оси b короткая, кристаллы мышьяка имеют тенденцию к удлинению в этом направлении и приобретают лопастную форму.
Поскольку периодичность в направлении оси b короткая, кристаллы мышьяка имеют тенденцию к удлинению в этом направлении и приобретают лопастную форму.
Структурная оптимизация путем моделирования и электронной структуры в
Pnm2 1 -As Экспериментально определенные константы элементарной ячейки, объем ячейки и координаты атомов для Pnm2 1 -As были хорошо оптимизированы путем моделирования.Различия между оптимизацией до и после для каждого параметра составляли один процент или меньше. Ковалентная связь (сильная связь), ван-дер-ваальсова связь (слабая связь) и разрыхление в Pnm2 1 -мышьяке показаны на рис. 3. Трехмерное представление связей и антисвязей вокруг атома As1 в Pnm2 1 — Как указано на рис. 1 с расширенными данными. Разрыхление наблюдается только между атомами в каждом слое. Ван-дер-ваальсовы связи наблюдаются внутрислоевые (As1…As4′ и As4…As1′), а остальные – межслоевые (т. г. As1…As3, As2…As4′ и As2…As3′).
г. As1…As3, As2…As4′ и As2…As3′).
Ковалентная связь (сильная связь), ван-дер-ваальсова связь (слабая связь) и разрыхление связи в Pnm2 1 -мышьяк.
Частичные орбитально-орбитальные корреляции популяций перекрывающихся связей в кристалле мышьяка типа Pnm2 1 приведены в расширенной таблице данных 2. Для ковалентной связи (сильной связи) вклад гибридизации pp является самым большим, и pd и sd имеют последующие вклады.Связывающие орбитали сохраняют большую часть р -подобного характера. Вклада гибридизации sp не наблюдалось. Для ван-дер-ваальсовой связи (слабой связи) важны вклады гибридизации sd и pd , а pp имеет последующие вклады. Показано, что d -орбитали вносят большой вклад в ковалентные связи и особенно в связи Ван-дер-Ваальса. Электроны d также ответственны за сцепление. Абсолютные значения парциальных орбитально-орбитальных корреляций для антисвязывания обычно больше, чем для ван-дер-ваальсовой связи. Перекрывание связей особенно мало в ван-дер-ваальсовых связях As1-As3 и As2-As4.
Перекрывание связей особенно мало в ван-дер-ваальсовых связях As1-As3 и As2-As4.
Электронная конфигурация As: 4 s 2 3d 10 4p 3 . Атомный суммарный заряд и вклад каждой орбитали в атомный заряд в кристаллах Pnm2 1 -As приведены в таблице 1. Наиболее важным результатом является то, что общие заряды четко разделены на положительные и отрицательные в As1, As1′, As2 , As2′ и As3, As3′, As4, As4′, соответственно.Отклонение от 5.000 среднего заряда всех атомов указывает на перенос электрона. Суммарные заряды 4,97 для As2 и 5,02 для As3 соответствуют положительным и отрицательным зарядам +0,03 и -0,02 соответственно. Четкое разделение этих суммарных зарядов вызвано разницей вклада d орбиталей. Вклад d в общий заряд явно меньше в части As1, As1′, As2, As2′, соответствующей части структуры \(R\bar{{3}}m\) — As.Вклад s + p в части As1, As1′, As2, As2′ увеличивается, чтобы компенсировать уменьшение вклада d . Вклад орбитали s наибольший в As1As1′, а вклад орбитали p наибольший в As2As2′. Результаты моделирования показывают уникальные электронные состояния в Pnm2 1 -As.
Вклад орбитали s наибольший в As1As1′, а вклад орбитали p наибольший в As2As2′. Результаты моделирования показывают уникальные электронные состояния в Pnm2 1 -As.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка браузера на прием файлов cookie
Существует множество причин, по которым файл cookie не может быть установлен правильно. Ниже приведены наиболее распространенные причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки браузера, чтобы принять файлы cookie, или спросить вас, хотите ли вы принимать файлы cookie.

- Ваш браузер спрашивает, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файл cookie.
- Ваш браузер не поддерживает файлы cookie. Попробуйте другой браузер, если вы подозреваете это.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы это исправить, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Предоставить доступ без файлов cookie
потребует от сайта создания нового сеанса для каждой посещаемой вами страницы, что замедляет работу системы до неприемлемого уровня.
Предоставить доступ без файлов cookie
потребует от сайта создания нового сеанса для каждой посещаемой вами страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в файле cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только та информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, если вы не решите ввести его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступ к остальной части вашего компьютера, и только сайт, создавший файл cookie, может его прочитать.
.

