Вычисление массовой доли химического элемента в веществе – HIMI4KA

Одним из основных законов химии является закон постоянства состава вещества (рассмотрен ранее в уроке 5).
На основании данного закона проводятся различные практически значимые вычисления, в том числе вычисления массовой доли химического элемента в веществе.
Массовой долей вещества ω(X) называют отношение массы данного вещества в системе к массе всей системы. Для некоего вещества X:


где ω(Х) — массовая доля вещества Х, m(X) — его масса; M — масса всей системы.
Массовая доля является величиной безразмерной. Ее выражают в долях от единицы или в процентах, если долю от единицы умножить на 100:


В качестве системы может выступать как молекула химического соединения, так и смесь, раствор и т. д. Рассмотрим несколько типовых заданий.
Пример 1. Рассчитайте массовую долю серы в оксиде серы (VI).
Решение: Молярная масса оксида серы (VI) M(SO3) = 80 г/моль, атомная масса серы в этом соединении 32 г/ моль. Для расчётов выбираем образец оксида серы количеством вещества 1 моль. Масса этого вещества составит:
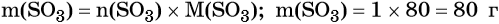
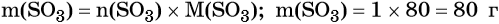
Исходя из формулы SO3 можно заключить, что в 1 моль SO3 будет содержаться 1 моль серы, масса которой составит:


Тогда массовая доля серы в оксиде серы (VI) будет равна:


Ответ: 0,4, или 40%.
Пример 2. Рассчитайте массовые доли элементов в фосфате калия K3PO4.
Решение: Молярная масса M(K3PO4) = 212 г/моль. Для расчётов выбираем образец фосфата калия количеством вещества 1 моль. Масса этого вещества составит:


Исходя из формулы K3PO4 можно заключить, что в 1 моль этого соединения будет содержаться 3 моль калия, 1 моль фосфора и 4 моль кислорода, масса которых составит:


Определим массовые доли элементов:


Тренировочные задания
1. Количественное содержание элементов калия, серы и кислорода в сульфите калия равно
1) 20,2; 30,4; 49,4
2) 49,4; 20,2; 30,4
3) 30,4; 49,4; 20,2
4) 49,4; 30,4; 20,2
2. Количественное содержание элементов бария, серы и кислорода в сульфите бария равно
1) 63,1; 22,1; 14,8
2) 63,1; 14,8; 22,1
3) 14,8; 22,1; 63,1
4) 22,1; 63,1; 14,8
3. Количественное содержание элементов кальция, фосфора и кислорода в фосфате кальция равно
1) 20,0; 41,3; 38,7
2) 38,7; 20,0; 41,3
3) 38,7; 41,3; 20,0
4) 41,3; 38,7; 20,0
4. Количественное содержание элементов натрия, фосфора и кислорода в фосфате натрия равно
1) 42,1; 18,9; 39,0
2) 18,9; 39,0; 42,1
3) 39,0; 42,1; 18,9
4) 18,9; 42,1; 39,0
5. Количественное содержание элементов калия, фосфора и кислорода в фосфате калия равно
1) 14,6; 30,2; 55,2
2) 30,2; 55,2; 14,6
3) 55,2; 14,6; 30,2
4) 55,2; 30,2; 14,6
6. Количественное содержание элементов алюминия, серы и кислорода в сульфате алюминия равно
1) 15,8; 56,1; 28,1
2) 28,1; 56,1; 15,8
3) 56,1; 15,8; 28,1
4) 15,8; 28,1; 56,1
7. Количественное содержание элементов кальция, углерода и кислорода в карбонате кальция равно
1) 18,0; 48,0; 40,0
2) 48,0; 40,0 18,0
3) 40,0; 48,0; 12,0
4) 40,0 12,0; 48,0
8. Количественное содержание элементов алюминия, фосфора и кислорода в фосфате алюминия равно
1) 22,1; 25,4; 52,5
2) 22,1; 52,5; 25,4
3) 52,5; 25,4; 22,1
4) 25,4; 52,5; 22,1
9. Количественное содержание элементов кальция, азота и кислорода в нитрате кальция равно
1) 24,4; 17,1; 58,5
2) 17,1; 58,5; 24,4
3) 58,5; 24,4; 17,1
4) 24,4; 58,5; 24,4
10. Количественное содержание элементов магния, азота и кислорода в нитрате магния равно
1) 16,2; 64,9; 18,9
2) 16,2; 18,9; 64,9
3) 18,9; 64,9; 16,2
4) 64,9; 16,2; 18,9
Ответы


Массовая доля химического элемента в соединении.
Урок № 14. Дата_____________ |
ТЕМА УРОКА: Массовая доля химического элемента в соединении.
ЦЕЛЬ УРОКА: Научить вычислять массовую долю элементов в соединении по формуле соединения и устанавливать химическую формулу сложного вещества по известным массовым долям химических элементов.
Основные понятия. Массовая доля химического элемента.
Планируемые результаты обучения
Предметные. Уметь рассчитывать массовую долю элемента в соединении по его формуле и устанавливать химическую формулу сложного вещества по известным массовым долям химических элементов.
Метапредметные. Формировать умения устанавливать аналогии, использовать алгоритмы для решения учебных и познавательных задач.
Структура урока
I. Организационный этап
II. Актуализация опорных знаний
III. Изучение нового материала
IV. Закрепление. Подведение итогов урока
V. Домашнее задание
Ход урока
Организационный момент.
Проверка домашнего задания.

Актуализация опорных знаний.
Дайте определения: относительной атомной массе, относительной молекулярной массе.В каких единицах можно измерить относительную атомную массу.
В каких единицах можно измерить относительную молекулярную массу.
Изучение нового материала.
Работа с учебником. Рабочая тетрадь.
Ребята, допустим у нас есть вещество — серная кислота H2SO4,
можем мы ли узнать какие атомы входят в состав соединения.
А их количество?
А в каком массовом соотношении они соединяются?
Вычисление массовых отношений химических
элементов в сложном веществе. (стр. 51)
А как можно узнать в каких массовых отношениях соединены элементы в соединении формула которого H2SO4?
m(H):m(S):m(O)= 2*2 + 32 + 16*4= 2:32:64 = 1:16:32.
1+16+32 = 49, то есть 49 массовых частей серной кислоты, содержаться 1 массовая часть водорода, 16 массовых частей серы, 32 массовых частей кислорода.
Ребята, а как вы думаете, можем ли мы рассчитать долю каждого элемента в соединении?
Сегодня мы с вами познакомимся с новым понятием массовая доля элемента в соединении.
W — массовая доля элемента в соединении.
n — число атомов элемента.
Mr — относительная молекулярная масса.
Вычисление массовых долей химических элементов 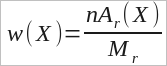
в сложном веществе. (РТ)
1. Изучите алгоритм вычисления массовой доли элемента в соединении.
Задача №1 (РТ)
Вывод химических формул, если известны массовые доли химических элементов,
входящих в состав данного вещества. (РТ)
2. Изучите алгоритм вычисления массовой доли элемента в соединении.
Задача №5 (РТ)
Закрепление изученного материала.
РТ стр. 25 №2.
РТ стр. 27 №6.
Подведение итогов урока.
Какие новые понятия вы узнали сегодня на уроке?
Самостоятельная работа.
Домашнее задание:
изучить §15 стр. 51 — 53;
ответить на вопросы №3,4,7 стр. 53-54 (письменно).
Перечень использованной литературы.
Учебник. Химия 8 класс. авт. Г.Е. Рудзитис, Ф.Г. Фельдман. Издательство «Просвещение», 2014.
Рабочая тетрадь по химии. авт. Боровских Т.А.



Массовая доля химического вещества онлайн
| Формула химического вещества |
| Молярная масса вещества (Грамм/Моль) |
| Процентное содержание элементов в заданном веществе |
| Массовое содержание элементов в веществе |
Массовая доля элемента
Что же такое массовая доля? Например, массовая доля химического элемента — это отношении массы элемента к массе всего вещества. Массовая доля может выражаться как в процентах, так и долях.
Где же может применятся массовая доля?
Вот одни из направлений:
— определение элементарного состава сложного химического вещества
— содержание массовых долей элементов
— нахождение массы элемента по массе сложного вещества
Для расчетов используется калькулятор Молярная масса вещества онлайн с расширенными данными которые можно увидеть если пользоватся XMPP запросом.
Расчет подобных задач, что указаны выше, при примении этой страницы становятся еще проще, удобнее и точнее. Кстати про точность. В школьных учебниках почему то молярные массы элементов округлены до целых значений, что для решения школьных задач это вполне пригодится, хотя на самом деле молярные массы каждого химического элемента периодически предаются корректировке.
Наш калькулятор не стремится показать высокую точность (выше 5-ти знаков после запятой), хотя в этом нет ничего сложного. В большинстве своем, те атомные массы элементов, которые используют калькулятор, достаточны для решения поставленных задач на определение массовых долей элементов
Но для тех педантов 🙂 , которым важна точность, хотелось бы порекомендовать ссылку Atomic Weights and Isotopic Compositions for All Elements в которой отображены все химические элементы, их относительные атомные массы, а также массы всех изотопов каждого из элемента.
Вот и все, что хотелось бы сказать. Теперь будем рассматривать конкретные задачи и как их решать. Заметьте что несмотря на то, что они все разнородны, они в своей сути опираются на молярную массу вещества и массовые доли элементов в этом веществе
На начало осени 2017 года, я добавил еще один калькульятор Мольные доли вещества и количество атомов, который поможет решать задачи на массу чистого вещества в сложном веществе, количество моль в веществе и в каждом элементе, а также количество атомов/молекул в веществе.
Примеры
Вычислит массовую долю элементов в меди сульфате CuSO4
Запрос очень простой, просто пишем формулу и получаем результат который и будет нашим ответом
| Формула химического вещества |
| Молярная масса вещества (Грамм/Моль) |
|
159.6036 |
| Процентное содержание элементов в заданном веществе |
|
|
| Массовое содержание элементов в веществе |
|
|
Как уже сказано в школьных учебниках идет достаточно угрубленные значения, поэтому не удивляйтесь если в ответах бумажных книг Вы увидите Cu = 40% ,O = 40%, S = 20%. Это скажем так «побочные эффекты» упрощения школьного материала, для учеников. Для реальных задач наш ответ (ответ бота) естественно более точен.
Если речь шла о том , что бы выразить в долях а не процентах, то делим проценты каждого из элементов на 100 и получаем ответ в долях.
Сколько натрия содержится в 10 тоннах криолина Na3[AlF6]?
Введем формулу криолина и получим следующие данные
| Формула химического вещества |
| Молярная масса вещества (Грамм/Моль) |
|
209.94125 |
| Процентное содержание элементов в заданном веществе |
|
|
| Массовое содержание элементов в веществе |
|
|
Из полученных данных мы видим, что в 209,9412 количестве вещества содержится 68,96931 количества натрия.
В граммах ли мы будем это измерять, в килограммах или тоннах для соотношения это ничего не меняется.
Теперь осталось построить другое соответствие где у нас есть 10 тон исходного вещества и неизвестное количество натрия
Это получилась типичная пропорция. Можно конечно воспользоваться ботом Расчет пропорций и соотношений но данная пропорция настолько проста, что сделаем это ручками.
209,9412 относится к 10(тоннам) как 68,96391 к неизвестному числу.
Таким образом количество натрия (в тоннах) в криолине составит 68.96391*10/209.9412=3.2849154906231 тонны натрия.
Опять же для школы иногда придется округлять до целого числа массовое содержание элементов в веществе, но ответ фактически не сильно отличается от предыдущего
69*10/210=3.285714
Точность до сотых долей совпадает.
Вычислить сколько кислорода содержится в 50 тоннах фосфата кальция Ca3(PO4)2 ?
Массовые доли заданного вещества следующие
| Формула химического вещества |
| Молярная масса вещества (Грамм/Моль) |
|
310.18272 |
| Процентное содержание элементов в заданном веществе |
|
|
| Массовое содержание элементов в веществе |
|
|
Та же самая пропорция что и в предыдущей задаче 310.18272 относится к 50 (тоннам) так же как и 127.9952 к неизвестной величине
ответ 20,63 тонны кислорода находится в заданной массе вещества.
Если же мы добавим к формуле служебный символ восклицательный знак, говорящий нам о том что задача школьная(используются грубые округления атомных масс до целых чисел), то ответ получим следующий:
| Формула химического вещества |
| Молярная масса вещества (Грамм/Моль) |
|
310 |
| Процентное содержание элементов в заданном веществе |
|
|
| Массовое содержание элементов в веществе |
|
|
Пропорция будет уже вот такой
310 относится к 50 (тоннам) так же как и 128 к неизвестной величине. И ответ
20,64 тонны
Как то так 🙂
Удачи в расчетах!!
Массовая доля элемента в сложном веществе
⇐ ПредыдущаяСтр 9 из 11Следующая ⇒С XVII в. химия перестала быть описательной наукой. Ученые-химики стали широко использовать измерение вещества. Все более совершенствовалась конструкция весов, позволяющих определять массы образцов. Для газообразных веществ помимо массы измеряли также объем и давление. Применение количественных измерений дало возможность понять сущность химических превращений, определять состав сложных веществ.
Как вы уже знаете, в состав сложного вещества входят два или более химических элементов. Очевидно, что масса всего вещества слагается из масс составляющих его элементов. Значит, на долю каждого элемента приходится определенная часть массы вещества.
Массовой долей элемента называется отношение массы этого элемента в сложном веществе к массе всего вещества, выраженное в долях единицы (или в процентах):

Массовая доля элемента в соединении обозначается латинской строчной буквой w («дубль-вэ») и показывает долю (часть массы), приходящуюся на данный элемент в общей массе вещества. Эта величина может выражаться в долях единицы или в процентах. Конечно, массовая доля элемента в сложном веществе всегда меньше единицы (или меньше 100%). Ведь часть от целого всегда меньше целого, как долька апельсина меньше всего апельсина.
Например, в состав оксида ртути входят два элемента – ртуть и кислород. При нагревании 50 г этого вещества получается 46,3 г ртути и 3,7 г кислорода (рис. 57). Рассчитаем массовую долю ртути в сложном веществе:
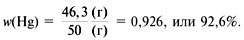
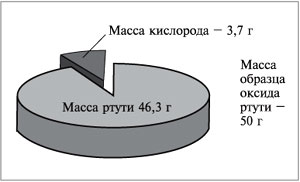 |
| Рис. 57. В состав оксида ртути входят два элемента – ртуть и кислород |
Массовую долю кислорода в этом веществе можно рассчитать двумя способами. По определению массовая доля кислорода в оксиде ртути равна отношению массы кислорода к массе оксида:

Зная, что сумма массовых долей элементов в веществе равна единице (100%), массовую долю кислорода можно вычислить по разности:
w(O) = 1 – 0,926 = 0,074,
или
w(О) = 100% – 92,6% = 7,4%.
Для того чтобы найти массовые доли элементов предложенным способом, необходимо провести сложный и трудоемкий химический эксперимент по определению массы каждого элемента. Если же формула сложного вещества известна, та же задача решается значительно проще.
Для расчета массовой доли элемента нужно его относительную атомную массу умножить на число атомов (n) данного элемента в формуле и разделить на относительную молекулярную массу вещества:
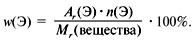
Например, для воды (рис. 58):
Mr(H2O) = 1•2 + 16 = 18,
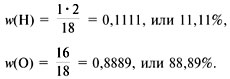
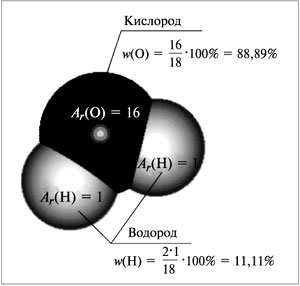 |
| Рис. 58. Схема вычисления массовых долей элементов в воде |
Далее рассмотрим решение задач на вычисление массовых долей элементов в сложных веществах.
Задача 1.Рассчитайте массовые доли элементов в аммиаке, формула которого NH3.
Дано:
вещество аммиак NH3.
Найти:
w(N), w(H).
Решение
1) Рассчитаем относительную молекулярную массу аммиака:
Mr(NH3) = Ar(N) + 3Ar(H) = 14 + 3•1 = 17.
2) Найдем массовую долю азота в веществе:

3) Вычислим массовую долю водорода в аммиаке:
w(H) = 1 – w(N) = 1 – 0,8235 = 0,1765, или 17,65%.
Ответ. w(N) = 82,35%, w(H) = 17,65%.
Задача 2.Рассчитайте массовые доли элементов в серной кислоте, имеющей формулу H2SO4.
Дано:
серная кислота H2SO4.
Найти:
w(H), w(S), w(O).
Решение
1) Рассчитаем относительную молекулярную массу серной кислоты:
Mr(H2SO4) = 2Ar(H) + Ar(S) + 4Ar(O) = 2•1 + 32 + 4•16 = 98.
2) Найдем массовую долю водорода в веществе:
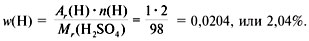
3) Вычислим массовую долю серы в серной кислоте:
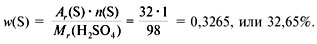
4. Рассчитаем массовую долю кислорода в веществе:
w(O) = 1 – (w(H) + w(S)) = 1 – (0,0204 + 0,3265) = 0,6531, или 65,31%.
Ответ. w(H) = 2,04%, w(S) = 32,65%, w(O) = 65,31%.
Чаще химикам приходится решать обратную задачу: по массовым долям элементов определять формулу сложного вещества. То, как решаются подобные задачи, проиллюстрируем одним историческим примером.
Из природных минералов – тенорита и куприта – были выделены два соединения меди с кислородом (оксиды). Они отличались друг от друга по цвету и массовым долям элементов. В черном оксиде массовая доля меди составляла 80%, а массовая доля кислорода – 20%. В оксиде меди красного цвета массовые доли элементов составляли соответственно 88,9% и 11,1%. Каковы же формулы этих сложных веществ? Проведем несложные математические расчеты.
Пример 1. Расчет химической формулы черного оксида меди (w(Cu) = 0,8 и w(О) = 0,2).
1) Обозначим формулу вещества с помощью индексов х, у – по числу атомов химических элементов в его составе: СuxOy.
2) Отношение индексов равно отношению частных от деления массовой доли элемента в соединении на относительную атомную массу элемента:

3) Полученное соотношение нужно привести к соотношению целых чисел: индексы в формуле, показывающие число атомов, не могут быть дробными. Для этого полученные числа разделим на меньшее (т.е. любое) из них:
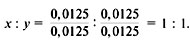
Получилась формула – СuO.
Пример 2. Расчет формулы красного оксида меди по известным массовым долям w(Cu) = 88,9% и w(O) = 11,1%.
Дано:
w(Cu) = 88,9%, или 0,889,
w(O) = 11,1%, или 0,111.
Найти:
формулу.
Решение
1) Обозначим формулу оксида СuxOy.
2) Найдем соотношение индексов x и y:
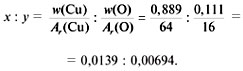
3) Приведем соотношение индексов к отношению целых чисел:
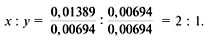
Ответ. Формула соединения – Cu2O.
А теперь немного усложним задачу.
Задача 3.По данным элементного анализа состав прокаленной горькой соли, использовавшейся еще алхимиками в качестве слабительного средства, следующий: массовая доля магния – 20,0%, массовая доля серы – 26,7%, массовая доля кислорода – 53,3%.
Дано:
w(Mg) = 20,0%, или 0,2,
w(S) = 26,7%, или 0,267,
w(O) = 53,3%, или 0,533.
Найти:
формулу.
Решение
1) Обозначим формулу вещества с помощью индексов x, y, z: MgxSyOz.
2) Найдем соотношение индексов:

3) Определим значение индексов x, y, z:

Ответ. Формула вещества – MgSO4.
 1. Что называется массовой долей элемента в сложном веществе? Как рассчитывается эта величина?
1. Что называется массовой долей элемента в сложном веществе? Как рассчитывается эта величина?
2. Рассчитайте массовые доли элементов в веществах: а) углекислом газе CO2;
б) сульфиде кальция СаS; в) натриевой селитре NaNO3; г) оксиде алюминия Al2O3.
3. В каком из азотных удобрений массовая доля питательного элемента азота наибольшая: а) хлориде аммония NH4Cl; б) сульфате аммония (NH4)2SO4; в) мочевине (NH2)2CO?
 4. В минерале пирите на 7 г железа приходится 8 г серы. Вычислите массовые доли каждого элемента в этом веществе и определите его формулу.
4. В минерале пирите на 7 г железа приходится 8 г серы. Вычислите массовые доли каждого элемента в этом веществе и определите его формулу.
5. Массовая доля азота в одном из его оксидов равна 30,43%, а массовая доля кислорода – 69,57%. Определите формулу оксида.
6. В средние века из золы костра выделяли вещество, которое называли поташ и использовали для варки мыла. Массовые доли элементов в этом веществе: калий – 56,6%, углерод – 8,7%, кислород – 34,7%. Определите формулу поташа.
Массовая доля химического элемента в сложном веществе —
1. Заполните пропуски в предложениях.а) В математике «доля» — это отношенеи части к целому. Для расчета массовой доли элемента нужно его относительную атомную массу умножить на число атомов данного элемента в формуле и разделить на относительную молекулярную массу вещества.
б) Сумма массовых долей всех элементов, входящих в состав вещества, равна 1 или 100%.
2. Запишите математические формулы для нахождения массовых долей элементов, если:
а) формула вещества — P2O5, Mr = 2*31+5*16=142
w(P) = 2*31/132 *100% = 44%
w(O) = 5*16/142*100% = 56% или w(O) = 100-44=56.
б) формула вещства — AxBy
w(A) = Ar(A)*x/Mr(AxBy) * 100%
w(B) = Ar(B)*y / Mr(AxBy) *100%
3. Рассчитывайте массовые доли элементов:
а) в метане (СН4)


б) в карбонате натрия (Na2CO3)

4. Сравните массовые доли указанных элементов в веществах и поставьте знак <, > или = :

5. В соединении кремния с водородом массовая доля кремния равна 87,5%, водорода 12,5%. Относительная молекулярная масса вещества равна 32. Определите формулу этого соединения.

6. Массовые доли элементов в соединении отражены в диаграмме:

Определите формулу этого вещества, если известно, что его относительная молекулярная масса равна 100.

7. Этилен является природным стимулятором созревания плодов: его накопление в плодах ускоряет их созревание. Чем раньше начинается накопление этилена, тем раньше созревают плоды. Поэтому этилен используют для искусственного ускорения созревания плодов. Выведите формулу этилена, если известно, что массовая доля углерода составляет 85,7%, массовая доля водорода -14,3%. Относительная молекулярная масса этого вещства равна 28.

8. Выведите химическую формулу вещества, если известно, что
а) w(Ca) = 36%, w(Cl) = 64%

б) w(Na) 29,1%, w(S) = 40,5%, w(O) = 30,4%.

9. Ляпис обладает противомикробными свойствами. Раньшего его применяли для прижигания бородавок. В небльших концентрациях он действует как противовоспалительное и вяжущее вредство, но может вызвать ожоги. Выведите формулу ляписа, если известно, что в его состав входит 63,53% серебра, 8,24% азота, 28,23% кислорода.

Массовая доля элемента — параграф 11 ГДЗ химия 7 (Габриелян)
1. Что называется массовой долей элемента в сложном веществе? Как рассчитывается эта величина?
Массовой долей элемента называется отношение массы этого элемента в сложном веществе к массе всего вещества, выраженное в долях единицы или процентах.
w (Э) = Ar (Э) * n (Э) (* 100%) / Mr (вещества)
где w (Э) — массовая доля элемента;
Ar (Э)- относительная атомная масса элемента;
n (Э) — число атомов данного элемента в составе вещества;
Mr (вещества) — относительная молекулярная масса вещества.
2. Рассчитайте массовые доли элементов в веществах: а) углекислом газе CO2; б) сульфиде кальция СаS; в) натриевой селитре NaNO3; г) оксиде алюминия Al2O3.
w (Э) = Ar (Э) * n (Э) / Mr (вещества) (* 100%)
Mr = ∑Ar (см. параграф относительные атомная и молекулярная массы)
а) Mr (CO2) = Ar (C) + Ar(O) * 2 = 12 + 16*2 = 44
w (C) = Ar (C) (100%) / Mr (CO2) = 12 *100% / 44 = 27,3%
w (O) = Ar (O) * 2 (количество атомов ) (100%) / Mr (CO2) = 16 * 2 * 100% / 44 = 72,7%
Хотя массовую долю кислорода можно было найти иным способом. Так как в оксиде углерода всего химических элемента — углерод и кислород, то сумма массовых долей этих элементов равна 100%. Поэтому w (O) = 100% — w (C) = 100% — 27,3% = 72,7%
Аналогично решаются и другие примеры:
б) w (Ca) = Ar (Ca) (100%) / Mr (CaS) = 40 * 100% / 72 = 55,6%
w (S) = 100% — w (Ca) = 100% — 55,6% = 44,4%
в) В этом примере в составе вещества уже 3 различных химических элемента.
w (Na) = Ar (Na) (100%) / Mr (NaNO3) = 23 * 100% / (23 + 14 + 16*3) = 27,06%
w (N) = Ar (N) (100%) / Mr (NaNO3) = 14 * 100% / (23 + 14 + 16*3) = 16,47%
w (O) = Ar (O) * 3 (100%) / Mr (NaNO3) = 14 * 100% / (23 + 14 + 16*3) = 56,47%
Либо:
w (O) = 100% — w (Na) — w (N) = 100% — 27,06% — 16,47% = 56,47%
г) w (Al) = Ar (Al) * 2 (100%) / Mr (Al2O3) = 27 * 2 * 100% / (27 * 2 + 16*3) = 52,94%
w (O) = 100% — w (Al) = 100% — 52,94% = 47,06%
3. В каком из азотных удобрений массовая доля питательного элемента азота наибольшая: а) хлориде аммония NH4Cl; б) сульфате аммония (NH4)2SO4; в) мочевине (NH2)2CO?
Для ответа на вопрос нужно определить массовую долю азота в каждом соединении.
а) w (N) = Ar (N) * 100% / Mr (NH4Cl) = 14 * 100% / 14 + 1*4 + 35,5 = 26,17%
б) w (N) = Ar (N) * 2 * 100% / Mr ((NH4)2SO4) = 14 * 2 * 100% / (14 + 1*4) * 2 + 32 + 16 *4 = 21,21%
в) w (N) = Ar (N) * 2 * 100% / Mr ((NH2)2CO) = 14 * 2 * 100% / (14 + 1*2) * 2 + 12 + 16 = 46,67%
Ответ: наибольшая массовая доля азота в мочевине.
4. В минерале пирите на 7 г железа приходится 8 г серы. Вычислите массовые доли каждого элемента в этом веществе и определите его формулу.
Вот тут важно понять, что соотношение относительных атомных масс элементов в составе сложного вещества приравнивается к отношению масс простых веществ, полученных из этого сложного вещества, т. е. w (Fe) : w (S) = m (Fe) : m (S)
Таким образом, w (Fe) : w (S) = 7 : 8
Остается найти массовую долю железа и серы.
w (Fe) = m (Fe) / m (пирит)
m (пирит) = m (Fe) + m (S) = 7 + 8 = 15
Тогда,
w (Fe) = m (Fe) / 15 = 7 / 15 = 0,4667
Массовую долю серы можно рассчитать таким же способом:
w (S) = m (S) / 15 = 8 / 15 = 0,5333
Либо, можно поступить проще:
w (S) = 1 — w (Fe) = 1 — 0,47 = 0,53
Другой вариант решения, более математический:
Мы знаем, что w (Fe) + w (S) = 1
Обозначим w (Fe) как «x», а w (S) как «y», тогда получим систему уравнений:
x + y = 1
x / y = 7 / 8
Решение не сложное:
x = 1 — y
8x = 7y
Объединяем наши два уравнения:
8(1 — y) = 7y
переносим «y» вправо:
1 — y = 7y / 8
1 = (7y / 8) + y
умножаем все на 8
8 = 7y + 8y
8 = 15y
y = 0,5333
Значит, x = 1 — y = 1 — 0,53 = 0,4667
А теперь найдем соотношение индексов. Обозначим формулу вещества как FenSm, тогда:
n : m = w (Fe) / Ar (Fe) : w (S) / Ar (S) = 0,4667 / 56 : 0,5333 / 32 = 0,00833 : 0,01667 = 1 : 2
Ответ: формула пирита FeS2
5. Массовая доля азота в одном из его оксидов равна 30,43%, а массовая доля кислорода – 69,57%. Определите формулу оксида.
Обозначим формулу вещества как NxOy, тогда:
x : y = w (N) / Ar (N) : w (O) / Ar (O) = 30,43 / 14 : 69,57 / 16 = 2,17 : 4,35 = 1 : 2
Ответ: формула оксида NO2
6. В средние века из золы костра выделяли вещество, которое называли поташ и использовали для варки мыла. Массовые доли элементов в этом веществе: калий – 56,6%, углерод – 8,7%, кислород – 34,7%. Определите формулу поташа.
Обозначим формулу вещества как KxCyOz, тогда:
x : y : z = w (K) / Ar (K) : w (C) / Ar (C): w (O) / Ar (O) = 56,6 / 39 : 8,7 / 12 : 34,7 / 16 = 1,45 : 0,725 : 2,17 = 2 : 1 : 3
Ответ: формула поташа K2CO3