Простые вещества Википедия

Просты́е вещества́ — химические вещества, состоящие исключительно из атомов одного химического элемента (из гомоядерных молекул)[1][2], в отличие от сложных веществ. Являются формой существования химических элементов в свободном виде[1][3]; или, иначе говоря, химические элементы, не связанные химически ни с каким другим элементом, образуют простые вещества[3]. Известно свыше 400 разновидностей простых веществ[2].
В зависимости от типа химической связи между атомами простые вещества могут быть металлами (Na, Mg, Al, Bi и др.) и неметаллами (H2, N2, Br2, Si и др.)[2].
Примеры простых веществ: молекулярные (O2, O3, H2, Cl2) и атомарные (He, Ar) газы; различные формы углерода, иод (I
Аллотропные модификации[ | ]

Один и тот же химический элемент зачастую может образовывать несколько типов простых веществ (аллотропия), называемых аллотропными модификациями. Явление аллотропии может быть обусловлено либо различным составом молекул данного элемента (аллотропия состава), либо различным строением молекул и способом размещения молекул (атомов) в кристаллах (аллотропия формы). Способность элемента к образованию соответствующих аллотропных модификаций обусловлена строением атома, которое определяет тип химической связи, строение молекул и кристаллов[2].
Различные аллотропные модификации могут переходить друг в друга. Для данного химического элемента его аллотропные модификации всегда различаются по физическим свойствам и химической активности (например, озон активнее кислорода, температура плавления алмаза больше, чем фуллерена) [4].
ru-wiki.ru
Простое вещество Википедия

Просты́е вещества́ — химические вещества, состоящие исключительно из атомов одного химического элемента (из гомоядерных молекул)[1][2], в отличие от сложных веществ. Являются формой существования химических элементов в свободном виде[1][3]; или, иначе говоря, химические элементы, не связанные химически ни с каким другим элементом, образуют простые вещества[3]. Известно свыше 400 разновидностей простых веществ[2].
В зависимости от типа химической связи между атомами простые вещества могут быть металлами
Примеры простых веществ: молекулярные (O2, O3, H2, Cl2) и атомарные (He, Ar) газы; различные формы углерода, иод (I2), металлы (не в виде сплавов).
Аллотропные модификации[ | ]

Один и тот же химический элемент зачастую может образовывать несколько типов простых веществ (аллотропия), называемых аллотропными модификациями. Явление аллотропии может быть обусловлено либо различным составом молекул данного элемента (аллотропия состава), либо различным строением молекул и способом размещения молекул (атомов) в кристаллах (аллотропия формы). Способность элемента к образованию соответствующих аллотропных модификаций обусловлена строением атома, которое определяет тип химической связи, строение молекул и кристаллов [2].
Различные аллотропные модификации могут переходить друг в друга. Для данного химического элемента его аллотропные модификации всегда различаются по физическим свойствам и химической активности (например, озон активнее кислорода, температура плавления алмаза больше, чем фуллерена)[4].
ru-wiki.ru
Простые вещества — Википедия
Материал из Википедии — свободной энциклопедии
Просты́е вещества́ — химические вещества, состоящие исключительно из атомов одного химического элемента (из гомоядерных молекул)[1][2], в отличие от сложных веществ. Являются формой существования химических элементов в свободном виде[1][3]; или, иначе говоря, химические элементы, не связанные химически ни с каким другим элементом, образуют простые вещества
В зависимости от типа химической связи между атомами простые вещества могут быть металлами (Na, Mg, Al, Bi и др.) и неметаллами (H2, N2, Br2, Si и др.)[2].
Примеры простых веществ: молекулярные (O2, O3, H2, Cl2) и атомарные (He, Ar) газы; различные формы углерода, иод (I2), металлы (не в виде сплавов).
Аллотропные модификации
Один и тот же химический элемент зачастую может образовывать несколько типов простых веществ (аллотропия), называемых аллотропными модификациями. Явление аллотропии может быть обусловлено либо различным составом молекул данного элемента (аллотропия состава), либо различным строением молекул и способом размещения молекул (атомов) в кристаллах (аллотропия формы). Способность элемента к образованию соответствующих аллотропных модификаций обусловлена строением атома, которое определяет тип химической связи, строение молекул и кристаллов [2].
Различные аллотропные модификации могут переходить друг в друга. Для данного химического элемента его аллотропные модификации всегда различаются по физическим свойствам и химической активности (например, озон активнее кислорода, температура плавления алмаза больше, чем фуллерена)[4].
При нормальных условиях соответствующие простые вещества для 11 элементов являются газами (H, He, N, O, F, Ne, Cl, Ar, Kr, Xe, Rn), для 2 — жидкостями (Br, Hg), для остальных элементов — твёрдыми телами.
При комнатной температуре (либо близкой к ней) 5 металлов находятся в жидком либо полужидком состоянии, так как их температура плавления близка к комнатной:
Отношение понятий
Понятия «атом», «химический элемент» и «простое вещество» имеют каждый своё индивидуальное смысловое значение. Применение этих понятий возможно только в учебных целях. В научной и практической работе эта информация крайне недостаточна.
В таблице приведена классификация материальных объектов, в части масса-габаритных размеров и их вероятные соответствующие характеристики, см. таблицу ниже[4]:
Широта и правильность применения этих понятий базируется на знании русского языка и предмета Вашего изучения.
См. также
Примечания
- ↑ 1 2 Редкол.:Кнунянц И. Л. (гл. ред.). Химическая энциклопедия: в 5 т. — М.: Советская энциклопедия, 1987. — Т. 1. — С. 361. — 623 с. — 100 000 экз.
- ↑ 1 2 3 4 Ахметов Н. С. Общая и неорганическая химия. — 4 изд., испр. — М.: Высшая школа, Издательский центр «Академия», 2001. — С. 253-269. — 743 с. — 15 000 экз. — ISBN 5-06-003363-5, ISBN 5-7695-0704-7.
- ↑ 1 2 Глинка Н. Л. Общая химия. — 24 изд., испр. — Л.: Химия, 1985. — С. 18-19. — 702 с.
- ↑ 1 2 Врублевский А. И. Химия: базовый школьный курс. — Мн.: Юнипресс, 2009. — С. 11-12. — 576 с. — 3100 экз. — ISBN 978-985-507-813-6.
Литература
- Ахметов Н. С. Общая и неорганическая химия. — 4 изд., испр. — М.: Высшая школа, Издательский центр «Академия», 2001. — 743 с. — 15 000 экз. — ISBN 5-06-003363-5, ISBN 5-7695-0704-7.
- Врублевский А. И. Химия: базовый школьный курс. — Мн.: Юнипресс, 2009. — 576 с. — 3 100 экз. — ISBN 978-985-507-813-6.
Ссылки
Что такое простое вещество? Свойства простых веществ :: SYL.ru
Все вокруг нас состоит из каких-либо веществ. В зависимости от своего состава, они могут быть простыми и сложными. Но что это означает? Что такое простые вещества? Какими свойствами они обладают? Давайте это выясним.
Что такое простое вещество?
Разъяснения о веществах лучше всего начинать с понятия «атом». Это микроскопическая частица, обладающая конкретным размером, массой и другими свойствами. Каждый вид атома представляет определенный химический элемент. Но сами по себе они не могут существовать в природе и обязательно объединяются с другими атомами, формируя вещества.
Что такое простые вещества? Это структуры, образованные атомами одного вида элемента. При нормальных условиях они чаще всего являются твердыми, однако 11 из них пребывают в газообразном состоянии, а два — в жидком. В зависимости от того, какой тип связи образовался между атомами, их разделяют на две большие группы: металлы и неметаллы.
Понять, что такое простые вещества, иногда бывает затруднительно, ведь их названия могут совпадать с названиями химических элементов. Одинаково именуются: кислород, железо, медь, сера, фосфор и другие.

Свойства простых веществ
Основные качества, по которым характеризуют вещества:
- цвет;
- запах;
- твердость/мягкость;
- вязкость;
- растворимость;
- тепло- и электропроводность;
- магнитные свойства;
- температуры плавления и кипения и т. д.
Многие свойства веществ зависят от того, как и в каком количестве соединены их атомы. При этом может возникать аллотропия. Это явление, при котором одно простое химическое вещество существует в нескольких формах или модификациях. Так, атомы кислорода (О), объединяясь в пару, образуют О2 или вещество кислород – прозрачного цвета, без запаха и вкуса. Если же объединятся три атома, то получится озон или О3 – голубой газ с резким специфическим запахом.
Аллотропные модификации есть у селена, фосфора, водорода, кремния, сурьмы, олова, железа и других веществ. Формы могут переходить друг в друга при изменении температуры или давления. При этом существуют переходы обратимые, в которых вещество может вернуться к прежнему состоянию, и необратимые, в которых возврат уже невозможен.
Металлы
Простые вещества металлы характеризуются целым рядом общих свойств. Они в той или иной степени пластичны, а значит, поддаются ковке, растягиванию и сгибанию, не разрываясь и ломаясь. Самыми пластичными считаются золото, медь, серебро. А вот марганец, цинк или висмут сразу же ломаются при механическом воздействии.
Металлы хорошо проводят тепло и электричество. Наилучшим в этой области является серебро, хуже всего себя проявляет ртуть и висмут. Кстати, ртуть — единственный металл, который при нормальных условиях не твердый. Застывает она только при температуре -39 °C.

Другие представители этой группы простых веществ изначально твердые. Они переходят в жидкое состояние (плавятся) при определенных температурах, как правило, высоких. Так, франций плавится при 27 °C, свинец – при 1170 °C, алюминий — при 1554 °C, индий – при 156,6 °C , а вольфраму нужно целых 3410 °C.
Практически все металлы обладают блеском и серой окраской. Отличаются лишь их оттенки: у одних он темный и практически матовый, у других серебристо-белый и очень блестящий. Есть, конечно, и исключения. Например, золото и цезий окрашены в желтый, медь — в красноватый.
Неметаллы
Простых веществ неметаллов гораздо меньше. Их 118 известных элементов их образует только 22. Сходных черт между этими веществами тоже немного. Объединяет их в основном то, что они не принадлежат к металлам и не обладают характерным для них блеском (кроме йода и графита).
Все они имеют либо молекулярное, либо атомное строение. В первом случае неметаллы могут быть газами (хлор, азот, водород, кислород), твердыми телами (сера, фосфор, йод) или жидкостями (бром). Их атомы связаны тесно, а вот молекулы – нет. Поэтому такие вещества летучи, в твердом состоянии легко плавятся и крошатся.
Во втором случае они образованы длинными цепочками атомов. Их частицы связаны между собой очень тесно, поэтому вещества обладает твердостью, слабой пластичностью и летучестью, высокими температурами плавления и кипения. Графит, например, плавится только при 3800 °C, что выше, чем у самого тугоплавкого металла.

Фтор
Фтор – химический элемент под номером 9. В качестве простого вещества он является двухатомным газом (F2) желтоватого оттенка. Он имеет ярко выраженный запах, который немного напоминает хлор.
Фтор является самым активным неметаллом. Он вступает в реакцию со всеми элементами, кроме неона и гелия. Он также реагирует с большинством существующих веществ, которые при этом загораются или взрываются. Даже вода в атмосфере наполненной фтором начинает гореть. Водород, соединяясь с фтором, взрывается и при минусовых температурах.

Элемент фтор содержится в зубной эмали и костях нашего организма. Он необходим нам ежедневно в количестве 2,5—3,5 мг. Вместе с тем газ фтор очень токсичен и агрессивен. Он способен вызывать раздражение слизистых и ожоги II степени.
Сера
Химический элемент сера как простое вещество тоже проявляет неметаллические свойства. Он образует огромное количество аллотропных модификаций, основные из которых это: моноклинная, ромбическая, пластическая.
В природе встречается в свободном виде, поэтому человек знаком с ней давно. В таком состоянии она часто образуется в местах вулканических извержений и геотермальных источников. Кроме того, входит в состав многих минералов, например, пиритов.
Многим сера известна как вещество светло-желтого цвета с жирным блеском и высокой хрупкостью. Это моноклинная сера, которую часто производят в виде порошка. При нагревании такого порошка до 160 °C он расплавляется и приобретает темно-коричневый цвет. Остывая, он вновь становится желтого цвета.

Если расплавленную коричневую массу опустить в воду, то образуется пластическая сера. Она похожа на резину или пластилин. В таком виде она отлично растягивается и формируется. Однако через несколько дней опять превращается в моноклинную серу, обладающую хрупкостью.
При высоких вулканических температурах вещество образует красивые полупрозрачные кристаллы. На их образования уходят несколько тысяч лет, поэтому в природе они встречаются нечасто.
При сильной влажности измельченная сера может самовозгораться. С хлоратами, нитратами, маслами и жирами она реагирует очень бурно, возгораясь или взрываясь. Сера хорошо горит на воздухе, образуя бесцветный сернистый газ, обладающий резким запахом.
www.syl.ru
Конспект «Простые и сложные вещества»
«Простые и сложные вещества»
Ключевые слова конспекта: агрегатные состояния веществ, кристаллическая решетка, вещества молекулярного и немолекулярного строения, простые и сложные вещества.
Вещества могут существовать только в трёх агрегатных состояниях: газообразном, жидком и твёрдом.

В газообразном состоянии вещество существует в виде отдельных частиц (молекул, атомов или ионов). Расстояние между частицами в газах намного превышает размеры этих частиц. В жидкостях расстояние между отдельными частицами намного меньше, поэтому силы взаимного притяжения между ними существенно больше, чем в газах. В то время как частицы, составляющие твёрдое тело (атомы, молекулы или ионы), плотно упакованы и совершают колебательные движения. Различают кристаллические и аморфные
твёрдые тела.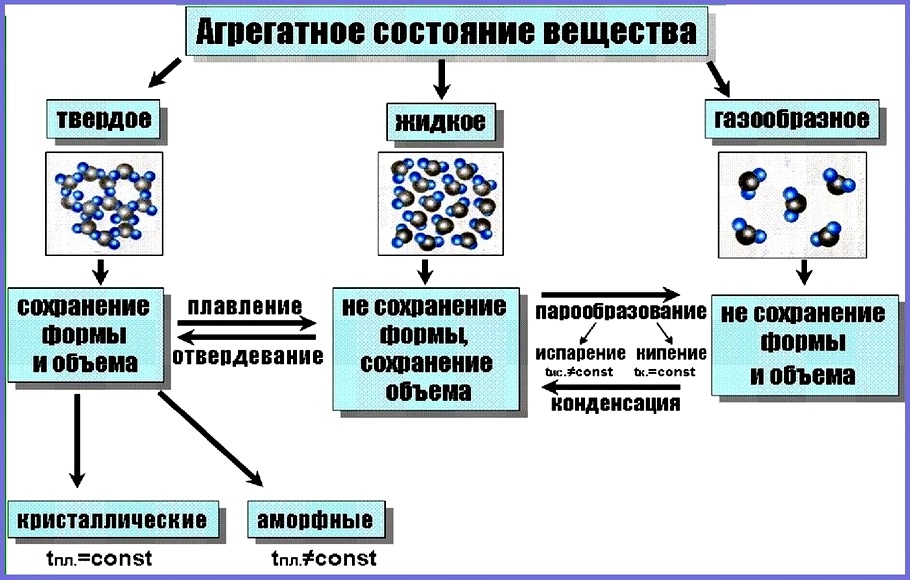
Для кристаллических веществ характерно упорядоченное расположение частиц, из которых они состоят. Например, снежинка имеет совершенную форму благодаря тому, что молекулы воды, из которых она состоит, располагаются упорядоченно по отношению друг к другу. Правильная форма кристаллов обусловлена особенностями их внутреннего строения. В кристаллах ионы, атомы или молекулы расположены в определённом порядке, на определённых расстояниях друг от друга.
Совокупность точек пространства, в которых располагаются частицы, образующие кристалл, называют КРИСТАЛЛИЧЕСКОЙ РЕШЁТКОЙ.
Вещества, которые состоят из молекул, — это вещества молекулярного строения. А вещества, которые состоят из атомов или ионов, — это вещества немолекулярного строения.

Вещества с молекулярным и немолекулярным строением существенно различаются по своим свойствам. Чтобы расплавить вещество, необходимо разрушить его кристаллическую решётку. Оказывается, что в кристаллической решётке связи между молекулами гораздо слабее, чем связи между атомами или ионами. Поэтому, как правило, вещества с молекулярным строением имеют низкие температуры плавления и кипения. Такие вещества часто летучи и имеют запах.
Вещества с немолекулярным строением имеют высокие температуры плавления и кипения. Эти вещества твёрдые, нелетучие и не имеют запаха.
Простые и сложные вещества
Сложные вещества — это вещества, которые образованы атомами разного вида. Например, такое сложное вещество, как вода, состоит из атомов кислорода и водорода, углекислый газ — из атомов углерода и кислорода.
Такие вещества, как, например, сера, железо, кислород и водород, нельзя ни получить из более простых веществ, ни разложить. Эти вещества относят только к простым веществам.
Простые вещества — это вещества, которые образованы атомами одного вида. Например, простое вещество кислород состоит только из атомов кислорода, простое вещество графит — только из атомов углерода.

Сложные вещества и простые вещества молекулярного строения часто называют химическими соединениями.
Аллотропия — это явление образования химическим элементом нескольких простых веществ, различных по строению и свойствам. Образующиеся вещества называются аллотропными видоизменениями.
С — алмаз, графит, карбин;
О — кислород, озон;
Р — белый, красный, черный;
S — ромбическая, моноклинная, пластическая
Конспект урока «Простые и сложные вещества».
Следующая тема: «Химические элементы и их знаки».
uchitel.pro
Сложные вещества — урок. Химия, 8–9 класс.
Химические элементы входят в состав сложных веществ (химических соединений).
Сложными называют вещества, состоящие из атомов разных химических элементов.
Большинство химических веществ являются сложными.
Многие сложные вещества имеют молекулярное строение. К молекулярным относятся метан Ch5, вода h3O, углекислый газ CO2, серная кислота h3SO4, глюкоза C6h22O6. Пластмассы, белки, жиры, крахмал тоже представляют собой сложные вещества, состоящие из молекул.
Модель молекулы воды

Модель молекулы глюкозы
Немолекулярное строение имеет песок SiO2, а также все сложные вещества, в состав которых входят металлы: поваренная соль NaCl, мел CaCO3, питьевая сода NaHCO3 и многие другие. Из сложных веществ немолекулярного строения состоят минералы и горные породы.

Модель кристалла поваренной соли
При определённых условиях сложные вещества можно разложить на несколько новых веществ. Так под действием электрического тока вода разлагается на водород и кислород, а сахар при нагревании превращается в уголь и воду.
Водород и кислород совсем не похожи на воду. При обычных условиях водород и кислород представляют собой газы, а вода — жидкость. Уголь и вода ничем не напоминают сахар.
Обрати внимание!
Свойства сложного вещества не являются суммой свойств веществ, образующихся при его разложении.
www.yaklass.ru
Простые вещества — WiKi
Просты́е вещества́ — химические вещества, состоящие исключительно из атомов одного химического элемента (из гомоядерных молекул)[1][2], в отличие от сложных веществ. Являются формой существования химических элементов в свободном виде[1][3]; или, иначе говоря, химические элементы, не связанные химически ни с каким другим элементом, образуют простые вещества[3]. Известно свыше 400 разновидностей простых веществ[2].
В зависимости от типа химической связи между атомами простые вещества могут быть металлами (Na, Mg, Al, Bi и др.) и неметаллами (H2, N2, Br2, Si и др.)[2].
Примеры простых веществ: молекулярные (O2, O3, H2, Cl2) и атомарные (He, Ar) газы; различные формы углерода, иод (I2), металлы (не в виде сплавов).
Аллотропные модификации
Один и тот же химический элемент зачастую может образовывать несколько типов простых веществ (аллотропия), называемых аллотропными модификациями. Явление аллотропии может быть обусловлено либо различным составом молекул данного элемента (аллотропия состава), либо различным строением молекул и способом размещения молекул (атомов) в кристаллах (аллотропия формы). Способность элемента к образованию соответствующих аллотропных модификаций обусловлена строением атома, которое определяет тип химической связи, строение молекул и кристаллов[2].
Различные аллотропные модификации могут переходить друг в друга. Для данного химического элемента его аллотропные модификации всегда различаются по физическим свойствам и химической активности (например, озон активнее кислорода, температура плавления алмаза больше, чем фуллерена)[4].
При нормальных условиях соответствующие простые вещества для 11 элементов являются газами (H, He, N, O, F, Ne, Cl, Ar, Kr, Xe, Rn), для 2 — жидкостями (Br, Hg), для остальных элементов — твёрдыми телами.
При комнатной температуре (либо близкой к ней) 5 металлов находятся в жидком либо полужидком состоянии, так как их температура плавления близка к комнатной:
Отношение понятий
Понятия «атом», «химический элемент» и «простое вещество» имеют каждый своё индивидуальное смысловое значение. Применение этих понятий возможно только в учебных целях. В научной и практической работе эта информация крайне недостаточна.
В таблице приведена классификация материальных объектов, в части масса-габаритных размеров и их вероятные соответствующие характеристики, см. таблицу ниже[4]:
Широта и правильность применения этих понятий базируется на знании русского языка и предмета Вашего изучения.
См. также
Примечания
- ↑ 1 2 Редкол.:Кнунянц И. Л. (гл. ред.). Химическая энциклопедия: в 5 т. — М.: Советская энциклопедия, 1987. — Т. 1. — С. 361. — 623 с. — 100 000 экз.
- ↑ 1 2 3 4 Ахметов Н. С. Общая и неорганическая химия. — 4 изд., испр. — М.: Высшая школа, Издательский центр «Академия», 2001. — С. 253-269. — 743 с. — 15 000 экз. — ISBN 5-06-003363-5, ISBN 5-7695-0704-7.
- ↑ 1 2 Глинка Н. Л. Общая химия. — 24 изд., испр. — Л.: Химия, 1985. — С. 18-19. — 702 с.
- ↑ 1 2 Врублевский А. И. Химия: базовый школьный курс. — Мн.: Юнипресс, 2009. — С. 11-12. — 576 с. — 3100 экз. — ISBN 978-985-507-813-6.
Литература
- Ахметов Н. С. Общая и неорганическая химия. — 4 изд., испр. — М.: Высшая школа, Издательский центр «Академия», 2001. — 743 с. — 15 000 экз. — ISBN 5-06-003363-5, ISBN 5-7695-0704-7.
- Врублевский А. И. Химия: базовый школьный курс. — Мн.: Юнипресс, 2009. — 576 с. — 3 100 экз. — ISBN 978-985-507-813-6.
Ссылки
ru-wiki.org