Массовая доля химического элемента в веществе. Видеоурок. Химия 8 Класс
Тема: Первоначальные химические представления
Урок: Массовая доля химического элемента в веществе
Представьте, что вам предстоит поровну разделить еще с четырьмя друзьями яблочный пирог. Вес пирога — 500г. Кусок какой массы достанется каждому? Масса каждого куска будет равна 100 г. Долю одного куска от всего пирога можно вычислить, разделив массу куска на массу всего пирога, т.е. 100/500 = 1/5 или 20% (Рис. 1).

Рис. 1. Массовая доля куска от всего пирога
Массовая доля части от целого – отношение массы части к массе целого. Массовая доля обозначается буквой греческого алфавита («омега») – ω. Измеряется массовая доля в долях или %. Она принимает значения от 0 до 1 или 0 до 100%.
Понятие «массовая доля» применимо и в химии. Используя знание о законе сохранения массы веществ, участвующих в реакции, можно вычислять массовую долю химического элемента в веществе.
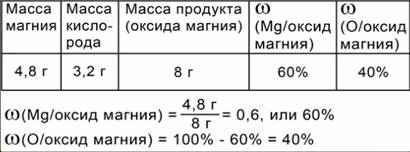
ПРИМЕР 1. Магний массой 4,8 г вступает в реакцию соединения с кислородом. При этом образуется 8 г оксида магния (Таблица 1). Чему равна масса вступившего в реакцию кислорода?
Таблица 1.

Воспользуемся законом сохранения массы веществ. Масса вступившего в реакцию кислорода равна разности масс оксида магния и магния, т.е. равна 3,2 г. Впишем это значение в таблицу 2.
Таблица 2.

Вычислим массовые доли магния и кислорода в продукте реакции – оксиде магния. В соответствии с АМТ, атомы в ходе химической реакции не делятся и не изменяются. Значит, все атомы магния, которые вступили в реакцию, вошли в состав оксида магния. То же произошло и с атомами кислорода.
Чтобы найти массовую долю магния (части) в оксиде магния (целом), надо массу магния (части) разделить на массу оксида магния (целого). Итак:
ω(Mg/оксид магния) = 4,8 г/8 г = 0,6 или 60%
Массовую долю кислорода можно найти аналогично, или вычесть из 100% массовую долю магния (Таблица 3).
ω(О/оксид магния) = 100% — 60% = 40%
Таблица 3.
Проверим, изменятся ли массовые доли элементов в оксиде магния, если в реакцию вступит 24 г магния, а получится 40 г оксида мания. По закону сохранения массы веществ масса кислорода, вступившего в реакцию будет равна16 г. Массовая доля магния – 24г/40г=0,6 или 60%, а массовая доля кислорода тогда равна 40% (Таблица 4).
Таблица 4.

Таким образом, массовая доля химического элемента в веществе – это отношение массы атомов данного элемента, входящих в состав вещества, к массе всего вещества. Массовая доля не зависит от массы вещества!
Список рекомендованной литературы
1. Сборник задач и упражнений по химии: 8-й класс: к учебнику П.А. Оржековского и др. «Химия, 8 класс» / П.А. Оржековский, Н.А. Титов, Ф.Ф. Гегеле. – М.: АСТ: Астрель, 2006. (с. 25-28)
2. Ушакова О.В. Рабочая тетрадь по химии: 8-й кл.: к учебнику П.А. Оржековского и др. «Химия. 8 класс» / О.В. Ушакова, П.И. Беспалов, П.А. Оржековский; под. ред. проф. П.А. Оржековского — М.: АСТ: Астрель: Профиздат, 2006. (с.21-23)
3. Химия: 8-й класс: учеб. для общеобр. учреждений / П.А. Оржековский, Л.М. Мещерякова, Л.С. Понтак. М.: АСТ: Астрель, 2005.(§9)
4. Химия: неорг. химия: учеб. для 8 кл. общеобр. учреждений / Г.Е. Рудзитис, ФюГю Фельдман. – М.: Просвещение, ОАО «Московские учебники», 2009. (§§10,14)
5. Энциклопедия для детей. Том 17. Химия / Глав. ред.В.А. Володин, вед. науч. ред. И. Леенсон. – М.: Аванта+, 2003.
Дополнительные веб-ресурсы
1. Единая коллекция цифровых образовательных ресурсов (Источник).
2. Электронная версия журнала «Химия и жизнь» (Источник).
3. Тесты по химии (онлайн) (Источник).
Домашнее задание
1. с. 26 №№ 54, 55 из Сборника задач и упражнений по химии: 8-й класс: к учебнику П.А. Оржековского и др. «Химия, 8 класс» / П.А. Оржековский, Н.А. Титов, Ф.Ф. Гегеле. – М.: АСТ: Астрель, 2006.
2. с. 22 №№ 4-6 из Рабочей тетради по химии: 8-й кл.: к учебнику П.А. Оржековского и др. «Химия. 8 класс» / О.В. Ушакова, П.И. Беспалов, П.А. Оржековский; под. ред. проф. П.А. Оржековского — М.: АСТ: Астрель: Профиздат, 2006.
interneturok.ru
Расчёт массовой доли химических элементов по формуле вещества
Урок посвящен изучению формулы для расчета массовой доли химического элемента в веществе и применению данной формулы для решения расчетных задач. Такой вид расчетов пригодится при решении более сложных химических задач.
Зная химическую формулу, можно вычислить массовую долю химических элементов в веществе. Массовая доля элемента в вещества обозначается греч. буквой «омега» — ωЭ/В и рассчитывается по формуле:
где k – число атомов этого элемента в молекуле.
Какова массовая доля водорода и кислорода в воде (Н2О)?
Решение:
1) Вычисляем относительную молекулярную массу воды:
Mr(Н2О) = 2*Аr(Н) + 1*Аr(О) = 2*1 + 1* 16 = 18
2) Вычисляем массовую долю водорода в воде:
3) Вычисляем массовую долю кислорода в воде. Так как в состав воды входят атомы только двух химических элементов, массовая доля кислорода будет равна:

Рис. 1. Оформление решения задачи 1
Рассчитайте массовую долю элементов в веществе H3PO4.
Решение:
1) Вычисляем относительную молекулярную массу вещества:
Mr(Н3РО4) = 3*Аr(Н) + 1*Аr(Р) + 4*Аr(О)= 3*1 + 1* 31 +4*16 = 98
2) Вычисляем массовую долю водорода в веществе:
3) Вычисляем массовую долю фосфора в веществе:
4) Вычисляем массовую долю кислорода в веществе:
Список рекомендованной литературы
1. Сборник задач и упражнений по химии: 8-й класс: к учебнику П.А. Оржековского и др. «Химия, 8 класс» / П.А. Оржековский, Н.А. Титов, Ф.Ф. Гегеле. – М.: АСТ: Астрель, 2006.
2. Ушакова О.В. Рабочая тетрадь по химии: 8-й кл.: к учебнику П.А. Оржековского и др. «Химия. 8 класс» / О.В. Ушакова, П.И. Беспалов, П.А. Оржековский; под. ред. проф. П.А. Оржековского — М.: АСТ: Астрель: Профиздат, 2006. (с.34-36)
3. Химия: 8-й класс: учеб. для общеобр. учреждений / П.А. Оржековский, Л.М. Мещерякова, Л.С. Понтак. М.: АСТ: Астрель, 2005.(§15)
4. Энциклопедия для детей. Том 17. Химия / Глав. ред.В.А. Володин, вед. науч. ред. И. Леенсон. – М.: Аванта+, 2003.
Дополнительные рекомендованные ссылки на ресурсы Интернет
1. Единая коллекция цифровых образовательных ресурсов (Источник).
2. Электронная версия журнала «Химия и жизнь» (Источник).
3. Тесты по химии (онлайн) (Источник).
4. Видеоурок по теме «Массовая доля химического элемента в веществе» (Источник).
Домашнее задание
1. с.78 № 2 из учебника «Химия: 8-й класс» (П.А. Оржековский, Л.М. Мещерякова, Л.С. Понтак. М.: АСТ: Астрель, 2005).
2. с. 34-36 №№ 3,5 из Рабочей тетради по химии: 8-й кл.: к учебнику П.А. Оржековского и др. «Химия. 8 класс» / О.В. Ушакова, П.И. Беспалов, П.А. Оржековский; под. ред. проф. П.А. Оржековского — М.: АСТ: Астрель: Профиздат, 2006.
interneturok.ru
Массовая доля вещества – статья – Корпорация Российский учебник (издательство Дрофа – Вентана)
Статьи
Линия УМК О. С. Габриеляна. Химия (8-9)
Химия
Ребятам, впервые пришедшим на урок химии, кажется: «Ух, какой отличный предмет. Столько разноцветных баночек и скляночек в лабораторном ящике. Вот сейчас я как нахимичу, друзья ахнут и выпадут в осадок». Однако, при виде ровных рядков непонятных формул на доске энтузиазм у ребят испаряется быстрее, чем происходит взгонка кристаллов йода. Если подходить к химии, как к науке, которой нет места в реальной жизни, и просто заучивать ряды формул, то интерес может умереть очень быстро.Но все становится намного веселее, если поискать примеры химических реакций вокруг нас.
Костер в летнем походе, сквашивание овощей, изменение вкуса любимых блюд с помощью соли или сахара — это все химия.
Сегодня мы разберем одну из базовых тем «Массовая доля вещества в растворе».
Если хорошо изучить тему и научиться быстро решать задачи, можно не только определить, сколько ложек сахара бабушка добавила в свой чай, но и находить ответы на сложные криминалистические задачи.
Но перед тем, как приступить к практической части, стоит разобраться с теорией.
ОСНОВНЫЕ ТЕРМИНЫ
Основными терминами в этой теме будут:
-
Раствор — однородная смесь различных веществ в жидком виде.
-
Компоненты — вещества, которые подлежат смешиванию для получения раствора.
-
Растворитель — жидкий компонент, к которому добавляют субстанции для получения раствора.
-
Растворенное вещество — твердые или жидкие вещества, которые добавляют к растворителю для получения раствора.
-
Массовая доля — отношение массы вещества к массе раствора, в котором оно содержится.
-
Концентрация — отношение количества растворенного вещества к растворителю, выраженное в процентах.
Когда мы смешиваем между собой жидкости, которые идеально растворяются друг в друге, например воду и спирт, то можем любой из этих компонентов считать растворителем. Однако традиционно в водных растворах вода является растворителем, а второй ингредиент — растворенным веществом.
НЕОБХОДИМЫЕ ФОРМУЛЫ
Массовая доля вещества обозначается буквой греческого алфавита ω — омега. Чтобы ее определить, используется формула для вычисления массовой доли вещества.
ω (в-ва)= m (в-ва)/ m (р-ра) (1)
В этом равенстве массовая доля принимает значение от 0 до 1.
Однако в задачах чаще используется процентное соотношение, которое получается по следующей формуле:
ω (в-ва)= m (в-ва)/ m (р-ра)*100% (2)
Масса раствора равна сумме его компонентов.
m (р-ра)=m (в-ва)+m (р-ля) (3)
В случае двухкомпонентного раствора массовая доля растворенного вещества и массовая доля растворителя в сумме дают 100%
ω (в-ва)+ω (р-ля)=100% (4)
Масса раствора находится сложением масс компонентов, входящих в раствор
m (р-ра)=m (в-ва)+m (р-ля)(5)
Для успешного решения задачи на определение массовой доли вещества в растворе следует вспомнить еще одну формулу, которая связывает массу вещества, его объем и плотность.
m (в-ва)=p(в-ва)*V(в-ва) (6)
Напомним, что плотность воды составляет 1 г/мл. Это значит, что 100 мл воды весит ровно 100 гр.
Если возникает недопонимание теоретической части, более подробно теория изложена в учебнике «Химия. 8 класс» под редакцией О. С. Габриеляна, который можно найти на портале электронных учебников LECTA
#ADVERTISING_INSERT#
rosuchebnik.ru
Формула массовой доли
Определение и формула массовой доли
Массовая доля – отношение массы растворённого вещества к общей массе раствора. Массовая доля обычно обозначается буквой или W и измеряется в долях единицы или в процентах:
Массовая доля элемента в соединении показывает вклад массы данного элемента в общую массу соединения:
Массовая доля определенного компонента в смеси:
Массовая доля примеси или основного соединения характеризует чистоту вещества.
Связь с другими способами выражения концентрации
Формула перехода от массовой доли к молярности:
где СМ – молярная концентрация раствора моль/л; ρ – плотность раствора, г/л; — массовая доля растворенного вещества в процентах ; M – молярная масса растворенного вещества, г/моль.
Формула перехода от массовой доли к титру:
где Т – титр раствора г/мл; ρ – плотность раствора, г/мл; — массовая доля растворенного вещества в процентах.
Примеры решения задач по теме «формула массовой доли»
| Понравился сайт? Расскажи друзьям! | |||
ru.solverbook.com
Массовая доля Википедия
Концентра́ция или до́ля компонента смеси — величина, количественно характеризующая содержание компонента относительно всей смеси. Терминология ИЮПАК под концентрацией компонента понимает четыре величины: соотношение молярного, или численного количества компонента, его массы, или объёма исключительно к объёму раствора[1] (типичные единицы измерения — соответственно моль/л, л−1, г/л, и безразмерная величина). Долей компонента ИЮПАК называет безразмерное соотношение одной из трёх однотипных величин — массы, объёма или количества вещества.[2] Однако в обиходе термин «концентрация» могут применять и для долей, не являющихся объёмными долями, а также к соотношениям, не описанным ИЮПАК. Оба термина могут применяться к любым смесям, включая механические смеси, но наиболее часто применяются к растворам.
Можно выделить несколько типов математического описания: массовая концентрация, молярная концентрация, концентрация частиц и объемная концентрация[3].

Эти стаканы, содержащие красный краситель, демонстрируют качественные изменения концентрации. Растворы слева более разбавлены, по сравнению с более концентрированными растворами справа.
Массовая доля[ | ]
Массовая доля компонента — отношение массы данного компонента к сумме масс всех компонентов. По рекомендациям ИЮПАК,[4] обозначается символом w{\displaystyle w}, в русскоязычной литературе чаще встречается обозначение ω{\displaystyle \omega }. Массовая доля — безразмерная величина, как правило выражается в долях единицы или в процентах (для выражения массовой доли в процентах следует умножить указанное выражение на 100 %):
- ωB=mBm{\displaystyle \omega _{\mathrm {B} }={\frac {m_{\mathrm {B} }}{m}}}
где:
- ωB — массовая доля компонента B
- mB — масса компонента B;
- m{\displaystyle m} — общая масса всех компонентов смеси.
В бинарных растворах часто существует однозначная (функциональная) зависимость между плотностью раствора и его концентрацией (при данной температуре). Это даёт возможность определять на практике кон
ru-wiki.ru
| | Адрес этой страницы (вложенность) в справочнике dpva.ru: главная страница / / Техническая информация / / Химический справочник / / Концентрация. Доля. / / Концентрации растворов. Массовая и молярная концентрация, Титр, Моляльность, Мольная, массовая, объемная доли. Нормальная (эквивалентная) концентрация, Фактор эквивалентности, Молярная масса эквивалента вещества Поделиться:
|
dpva.ru
Масса, относительные массы, молярная масса, массовые доли — урок. Химия, 8–9 класс.
Особенности применения физической величины «масса»
Масса обозначается буквой m и измеряется в граммах, килограммах или миллиграммах.
Пример:
m(h3SO4)= \(98\) г — масса серной кислоты равна \(98\) г.
Обрати внимание!
Связь между единицами измерения массы:
\(1\) кг \(=\) \(1000\) г, \(1\) г \(= 1000\) мг, \(1\) г \(= 0,001\) кг, \(1\) мг \(= 0,001\) г.
Массу атомов и молекул тоже можно выражать в граммах, килограммах или миллиграммах.
Пример:
масса одного атома серы:
ma(S)= 5,312⋅10−23 г.
Масса одной молекулы серной кислоты:
mm(h3SO4)= 1,627⋅10−22 г.
Это очень маленькие числа, которыми пользоваться неудобно. Поэтому для характеристики масс атомов и молекул введена атомная единица массы.
Атомная единица массы (а. е. м.) — 112 часть массы атома углерода. Её международное обозначение — u («unit»).
\(1\) u \(= 1\) а. е. м. \(=\) 1,66⋅10−24 г \(=\) 1,66⋅10−27 кг.
В атомных единицах массы атомов и молекул равны небольшим целым числам.
Пример:
ma(S)= \(32\) а. е. м. \(= 32\) u,
mm(h3SO4)= \(98\) а. е. м. \(= 98\) u.
Относительные массы
Применяются также относительные массы. Эти величины показывают, во сколько раз масса атома или молекулы больше одной атомной единицы массы.
Относительная атомная масса Ar — это отношение массы атома к \(1\) атомной единице массы. Величина безразмерная.
Пример:
Ar(S)= \(32\).
Относительная молекулярная масса Mr — это отношение массы молекулы к \(1\) атомной единице массы. Величина безразмерная.
Пример:
Mr(h3SO4)= \(98\).
Молярная масса
В расчётах используется также понятие «молярная масса».
Молярная масса численно равна массе \(1\) моль вещества. Она обозначается буквой M и измеряется в г/моль.
Пример:
M(h3SO4)= \(98\) г/моль.
Массовые доли
Массовая доля — это отношение массы компонента к массе образца вещества, в котором он содержится. Вычисляют массовую долю химического элемента в веществе, вещества в смеси, растворённого вещества в растворе, примесей и т. д.
Массовая доля обозначается буквой w. Это безразмерная величина. Может вычисляться также в %.
www.yaklass.ru