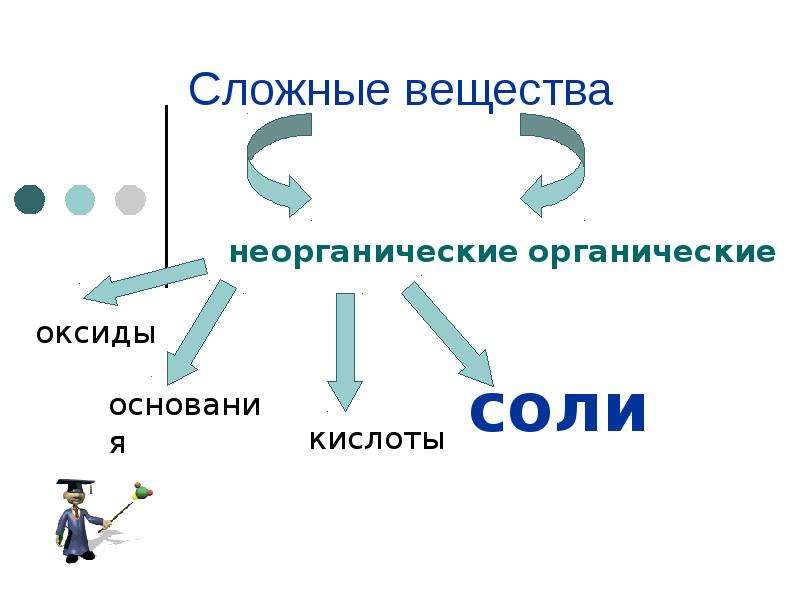
Погода в Ногинске Живой календарь Праздники | Философская истина: все в нашем мире относительно, – справедлива и для классификации веществ и их свойств. Великое многообразие веществ во Вселеннойи на нашей планете состоит всего лишь из 90 химических элементов. В природе встречаются вещества, построенные элементами с порядковыми номерами с 1 по 91 включительно. Элемент 43 – технеций, в настоящее время на Земле в природе не обнаружен, т.к. этот элемент не имеет стабильных изотопов. Он был получен искусственно в результате ядерной реакции. Отсюда и название элемента – от греч. téhnos – искусственный. Органических веществ насчитывается более 27 млн – гораздо больше, чем неорганических, число которых по самым оптимистическим подсчетам не превышает 400 тыс. О причинах многообразия органических соединений мы поговорим чуть позже, а пока отметим, что резкой границы между двумя этими группами веществ не существует. Например, соль изоцианат аммония Nh5NCO считается неорганическим соединением, а мочевина (Nh3)2CO, имеющая точно такой же элементный состав N2h5CO, – вещество органическое. Вещества, имеющие одинаковую молекулярную формулу, но разное химическое строение, называются изомерами. Неорганические вещества принято делить на два подтипа – простые и сложные (схема 1). Как вы уже знаете, простыми называют вещества, состоящие из атомов одного химического элемента, а сложные – из двух и более химических элементов. Схема 1 Классификация неорганических веществ Казалось бы, число простых веществ должно совпадать с числом химических элементов. Самая общая классификация сложных неорганических веществ хорошо вам знакома из курса химии основной школы. Здесь выделяют четыре класса соединений: оксиды, основания, кислоты и соли. Деление неорганических веществ на классы проводят на основании их состава, который, в свою очередь, отражается на свойствах соединений. Напомним определения представителей каждого класса. Оксиды – сложные вещества, состоящие из двух элементов, один из которых – кислород в степени окисления –2 (например, Н2О, СО2, CuO). Основания – это сложные вещества, состоящие из атома металла и одной или нескольких гидроксигрупп (например, NaOH, Ca(OH)2). 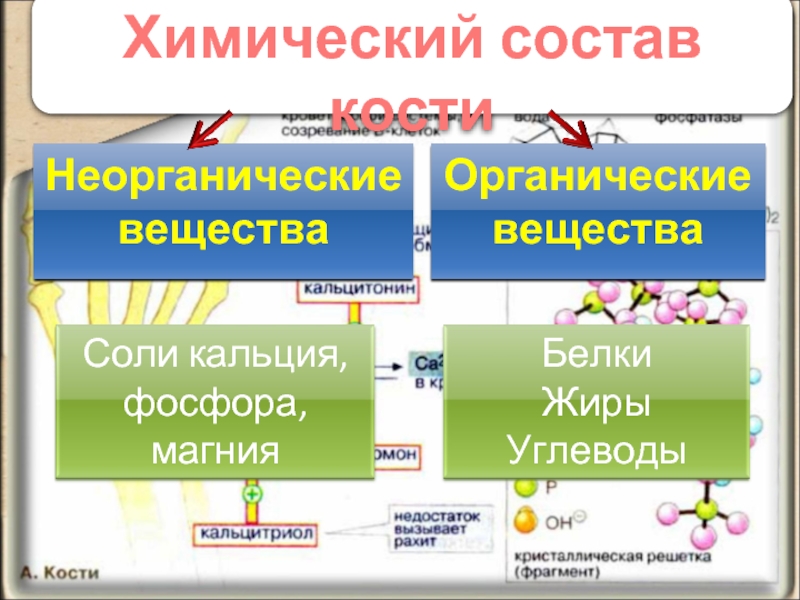 Кислоты – это сложные вещества, состоящие из атомов водорода и кислотного остатка (например, HCl, HNO3, h3SO4, h4PO4). Соли – это сложные вещества, состоящие из атомов металла и кислотных остатков (например, NaNO3, K2SO4, AlCl3). Подобная классификация и определения также весьма относительны. Во-первых, роль металла в основаниях и солях могут выполнять сложные частицы наподобие знакомоговам катиона аммония Nh5+, состоящего только из элементов неметаллов. Во-вторых, существует достаточно многочисленная группа веществ, которые пформальным признакам (по составу) являются основаниями, а по свойствам относятся к амфотерным гидроксидам, т.е. сочетают свойства оснований и кислот. Например, гидроксид алюминия Al(OH)3 при взаимодействии с кислотой ведет себя как основание: а при сплавлении со щелочами проявляет свойства кислоты: h4AlO3 + NaOH = NaAlO2 + h3O. В-третьих, в приведенную выше классификацию сложных неорганических веществ не попадает большое число соединений, которые нельзя отнести ни к одному из перечисленных классов.  Это, например, соединения, образованные двумя или более элементами-неметаллами (хлорид фосфора(V) PCl5, сульфид углерода CS2, фосген COCl2). Это, например, соединения, образованные двумя или более элементами-неметаллами (хлорид фосфора(V) PCl5, сульфид углерода CS2, фосген COCl2).? 1. Какие вещества называются неорганическими, а какие – органическими? Приведите примеры. Докажите относительность такой классификации веществ. 2. Какие вещества называются простыми, а какие – сложными? Почему число простых веществ превышает число химических элементов? 3. Какова классификация простых веществ? Приведите примеры веществ каждого типа. Благородные газы являются веществами атомного или молекулярного строения? Приведите аргументы в пользу той и другой точек зрения. 4. Какие неорганические вещества называются оксидами, основаниями, кислотами, солями? Приведите примеры веществ каждого класса, проиллюстрируйте их свойства двумя-тремя уравнениями химических реакций. 5. С помощью уравнений химических реакций докажите, что амфотерные гидроксиды проявляют свойства как кислот, так и оснований. 6. Карбонат кальция (мел, мрамор, известняк) вдохновлял скульпторов, художников, поэтов. 
| Новости сайта Поздравляем победителей и лауреатов Всероссийских дистанционных олимпиад по химии и биологии Полезные ссылки Архив записей |
Калий органические — Справочник химика 21
Высокочувствительные методы определения ультрамикроколичеств серебра основаны на каталитическом действии ионов серебра в реакциях разложения некоторых веществ, а также в реакциях окисления раствором персульфата калия органических и неорга- [c.117] Метод был проверен на образцах (фторидов ам.мония, бария, свинца, кислого фторида калия, органических соединений и, в особенности, тефлона.
Метод определения основан на осаждении хлора азотнокислым серебром в присутствии азотной кислоты. Избыток азотнокислого серебра оттитровывают роданистым аммонием в присутствии железоаммиачных квасцов, являющихся индикатором. Помимо солей, в крови содержится много органических веществ (белки, углеводы, жиры и др.), которые могут осаждаться, образуя соединения с серебром, а в некоторых случаях восстанавливать его до металла. Поэтому определение хлора в присутствии органических веществ крови вести нельзя и их удаляют окислением (путем нагревания с марганцовокислым калием). Органические вещества при этом окисляются до углекислоты и воды, а марганцовокислый калий восстанавливается частью до двухвалентного марганца, частью— до темнобурой перекиси марганца. Избыток перекиси марганца восстанавливают до солей двухвалентного марганца при помощи глюкозы, которая не мешает определению.
Орган растения Источник калия Органические кислоты к Са Mg Gl РО4 [c.73]
Неорганические окисляющиеся вещества, как, например, аммонийные соли, сульфиты, арсениты щелочных металлов и др., так же как и значительные количества цианидов щелочных металлов, должны отсутствовать. Аммонийные соли и цианиды могут быть удалены до нагревания с иодатом калия путем выпаривания исследуемого вещества с разбавленной едкой щелочью или соляной кислотой. Влияние других окисляющихся неорганических соединений, как-то сульфидов, сульфитов, арсенитов и др. —можно обезвредить многократным выпариванием тонко растертой пробы с подкисленным соляной кислотой или подщелоченным раствором перекиси водорода. Присутствие едкой щелочи или карбонатов не мешает восстановлению иодата калия органическими веществами.
Фторид натрия, парафин (или воск), концентрированная серная кислота, бромид натрия (или бромид калия), органические растворители (бензин, бензол и др.), алюминий, магний, раствор нитрата серебра, гипосульфит, иод, крахмальный клейстер, древесный уголь. [c.138]
При действии водных растворов щелочей, иногда просто воды на хлорпроизводные метана получаются спирты, при действии аммиака — амины, при действии цианистого калия — органические цианистые соединения (нитрилы). [c.97]
В помещении для упаковки одновременно может находиться не более 30 т аммиачной селитры, причем не допускаются упаковка и хранение в одном здании аммиачной селитры и нитрита натрия, нитрита калия, органических горючих веществ.
Катализаторы реакции ацетилирования. В литературе описано большое количество катализаторов реакции ацетилирования, относящихся к различным классам (минеральные и органические кислоты, основания, соли и др. ), однако основное практическое применение находят минеральные кислоты (серная и хлорная), являющиеся, по существу, единственным типом катализаторов, используемым в промышленности- Наряду с кислотами в качестве катализаторов ацетилирования применяются соединения типа кислот Льюиса (например, хлористый цинк), соли щелочных металлов (ацетаты натрия и калия), органические основания (пиридин). [c.316]
), однако основное практическое применение находят минеральные кислоты (серная и хлорная), являющиеся, по существу, единственным типом катализаторов, используемым в промышленности- Наряду с кислотами в качестве катализаторов ацетилирования применяются соединения типа кислот Льюиса (например, хлористый цинк), соли щелочных металлов (ацетаты натрия и калия), органические основания (пиридин). [c.316]
Описан быстрый метод с применением цинкуранилацетата полуколичественного определения растворимого и обмениваемого натрия в почвах. Метод основан на измерении скорости развития интенсивности флуоресценции, наблюдаемой при добавлении раствора цинкуранилацетата к анализируемой почве или ее водному экстракту. Продолжительность определения не больше 15 мин. Колебания в содержании фосфора, калия, органических веществ, солей, а также структура почвы не влияют на результаты определений. [c.238]
Содержится в выбросах производств неорганических соединений калия, органического синтеза, фотоэлектрических элементов, титана, катализаторов. [c.56]
[c.56]
Совместное хранение веществ, при соединении которых может произойти самовоспламенение (азотная кислота и скипидар или другие органические вещества серная кислота, марганцовокислый калий, органические вещества и др.), а также сливание остатков этих веществ в одну посуду категорически запрещается. [c.32]
В качестве абразивов для чистки меди, латуни и бронзы рекомендуют использовать порошкообразные трепел, или диатомит (по химическому составу это диоксид кремния), зеленый оксид хрома, красно-бурый оксид железа (старинное название крокус ), мел, а для составления удобных в использовании паст (вроде пасты ГОИ ) в роли связующих выступают вода, скипидар, олеиновая кислота. Иногда добавляют и химические компоненты — щавелевую кислоту или винный камень (гидротартрат калия). Органические кислоты, в том числе винная, образуют с катионом меди прочные комплексы. [c.108]
Ацетат калия (органическая соль) [c.
 236]
236]Если в смесь, состоящую из двух несмешивающихся жидкостей, внести некоторое количество какого-либо вещества, растворимого в обеих жидкостях, то равновесные концентрации этого вещества (в данном случае йода) будут неравны. При этом оказывается, что вещество распределяется между двумя растворителями в строго определенном соотношении, называемом коэффициентом распределения. Таким образом, система, состоящая из воды или водного раствора йодида калия, органического растворителя и йода, при данной температуре будет характеризоваться строго постоянным отношением концентраций йода в органическом растворителе и в воде (водном растворе). [c.188]
Палит с сотр. [17] сообщили, что для инициирования полимеризации ненасыщенных мономеров в водной среде и введения в образующиеся полимерные цепи концевых карбоксильных групп можно использовать реакции окисления перманганатом калия органических кислот, таких, как щавелевая или винная, проводимые в атмосфере азота. Как предполагают, в этом случае образуются радикалы СОО или «СООН, которые и инициируют полимеризацию. Имеется сообщение [18] о том, что концевые карбоксильные группы в полиметилметакрилат были введены по этой схеме. Следовало ожидать, однако, что в образующемся полиметилметакрилате будет содержаться в цепи только одна концевая карбоксильная группа, в то время как в цепях полистирола, полученного в присутствии этого инициатора,— две. Это обусловлено тем фактом, что при полимеризации метилметакрилата обрыв цепи происходит преимущественно в результате диспропорционирования, а при полимеризации стирола — в результате рекомбинации. [c.268]
Как предполагают, в этом случае образуются радикалы СОО или «СООН, которые и инициируют полимеризацию. Имеется сообщение [18] о том, что концевые карбоксильные группы в полиметилметакрилат были введены по этой схеме. Следовало ожидать, однако, что в образующемся полиметилметакрилате будет содержаться в цепи только одна концевая карбоксильная группа, в то время как в цепях полистирола, полученного в присутствии этого инициатора,— две. Это обусловлено тем фактом, что при полимеризации метилметакрилата обрыв цепи происходит преимущественно в результате диспропорционирования, а при полимеризации стирола — в результате рекомбинации. [c.268]
Образовавшиеся кислоты реагируют со щелочью калия и образуют соли. После окончания реакции окисления непрореа-гнронавшнй перманганат калия обесцвечивался древесным спиртом. Образовавшиеся в результате реакции соли калия органических кислот фильтрацией отделяли от двуокиси марганца, который несколько раз промывался горячей водой. Фильтрат, с целью увеличения концентрации выпаривался на водяной бане. Из солей калия органических кислот, действием на них минеральной кислоты, были получены соответствующие органические кислоты. Так как во фракции, взятой для окисления, ожидалось присутствие этилбензола и трех изомеров ксилола, в результате окисления которых должны были получать 4 кислоты разного строения, поэтому мы долж- [c.68]
Фильтрат, с целью увеличения концентрации выпаривался на водяной бане. Из солей калия органических кислот, действием на них минеральной кислоты, были получены соответствующие органические кислоты. Так как во фракции, взятой для окисления, ожидалось присутствие этилбензола и трех изомеров ксилола, в результате окисления которых должны были получать 4 кислоты разного строения, поэтому мы долж- [c.68]
Изучались реакции сочетания алкилгалогенидов с другими металлоорганическими соединениями [1031]. Натрий- и калий-органические соединения более реакционноспособны, чем реактивы Гриньяра, и поэтому вступают в реакции даже с менее активными галогенидами. Сложность заключается в их приготовлении и достаточно долгом сохранении, чтобы успеть прибавить алкилгалогенид. Алкены можно синтезировать сочетанием виниллитиевых соединений с первичными галогенидами [1032] или винилгалогеиидов с алкиллитиевыми соединениями в присутствии палладия или рутения в качестве катализатора [1033]. При обработке медьорганическими соединениями п кислотами Льюиса (например, н-ВиСи-ВРз) аллилгалогениды вступают в реакцию замещения с практически полной аллильной перегруппировкой независимо от степени разветвления обоих концов аллильной системы [1034]. [c.191]
При обработке медьорганическими соединениями п кислотами Льюиса (например, н-ВиСи-ВРз) аллилгалогениды вступают в реакцию замещения с практически полной аллильной перегруппировкой независимо от степени разветвления обоих концов аллильной системы [1034]. [c.191]
Разрушение ассоциатов — не единственный путь увеличения реакционной способности литийорганических соединений. Альтернативный путь заключается в использовании смешанных литийорганических иатрий(или калий)органических соединений [c.224]
По реакционной способности органические соединения натрия и более тяжелых щелочных металлов весьма близки к литийорга-ническим соединениям. Однако из-за трудностей получения этих соединений и обращения с ними они относительно мало применяются в органическом синтезе. В то же время все более широкое применение в качестве промежуточных продуктов находят калий-органические соединения, получаемые in sita (см. выше). Наиболее важными в настоящее время областями применения этих соединений является карбанионный синтез с использованием, иапример, карбонильных соединений, и реакции полимеризации. [c.33]
[c.33]
Употребляя для растворения безводного фторида калия органические растворители, можно осуществить обмен галоида в СНХ и СНдХ, (Х=С1, Вг, J)-rpynnax в одну стадию, причем реакция протекает при атмосферном давлении. При этом работают, пользуясь обычной стеклянной аппаратурой. Для ускорения процесса реакцию ведут при температуре не ниже 140 . Подходящими растворителями служат алифатические ди- и полиоксисоединения этиленгликоль, глицерин, диэтиленгликоль, полиэтиленгликоль и т. д., или их смеси. [c.186]
М. получают в иромышлепности гидратацией виннлацетилеиа. Продажный продукт представляет собой азеотропную смесь 85% метилвинилкетона и 15% воды. Этот продукт сушат избытком безводного карбоната калия, органический слой отделяют, охлаждают [c.266]
Молекулярный бром и бромистый водород, обогащенные радиобромом, получались из меченого бромистого калия. Органические производные, меченные радиобромом, получались синтезом. Измерения радиоактивности производились счетчиком Гейгера-Мюллера в свинцовой защите. Обозначения в таблицах — исходная радиоактивность препарата [c.202]
Измерения радиоактивности производились счетчиком Гейгера-Мюллера в свинцовой защите. Обозначения в таблицах — исходная радиоактивность препарата [c.202]
Тетраметилпиперидин. В круглодонную колбу емко-стью 1000 мл, снабженную обратным холодильником, загружают 300 мл диэтиленгликоля, 77 г триацетонимина, 75 мл 85″о-ного гидразингидрата и 100 г едкого кали. Смесь нагревают на масляной бане при 135 X до прекраш,ения выделения азота, а затем обратный холодильник заменяют на нисходящий и температуру бани постепенно повышают до 195 X. Дистиллят насыщают карбонатом калия, органический слой отделяют и фракционируют при обычном давлении, собирая фракцию 148—155 С. Повторная ректификация над натрием дает чистый препарат. Выход 50 г [c.191]
В качестве добавок, улучшающих сгорание, предложено много самых различных соединений, в том числе перекись натрия или нитрат, перхлорат калия, органические материалы и даже вода [179, 181, 197—199]. Лайт и Маннион [191] выбрали додеканол, так как в нем содержится достаточно водорода для связывания фтора, он хорошо сгорает и удобен для добавления к небольшим количествам анализируемого вещества. [c.68]
[c.68]
Химические свойства. Довольно реактивные соединения. Большая часть реакций обусловливается обменом атомов галоида на всевозможные радикалы. Восстановлением X. У. образуются парафиновые углеводороды. При действии воды получаются спирты, при действии аммиака — амины, при действии цианистого калия — органические цианистые соединения или нитрилы.. При действии едких щелочей от молекулы X. У. отщепляется соляная кислота, с образованием этиленовых углеводородов. Двугалоидопроизводные углеводороды реагируют сходно, лишь с той разницей, что в реакции могут вступать либо один, либо сразу оба галоида. При действии воды обмениваются оба атома галоида с образованием альдегидов и кетонов. [c.129]
Методика выделения С(1 и Си при активационно.м анализе иттрия следующая. Облученную пробу переводят в раствор в присутствии носителей Сё и Си. Причем количество Сс1 должно быть достаточным для полного вытеснения 2п из его дитиокар-баминатного комплекса.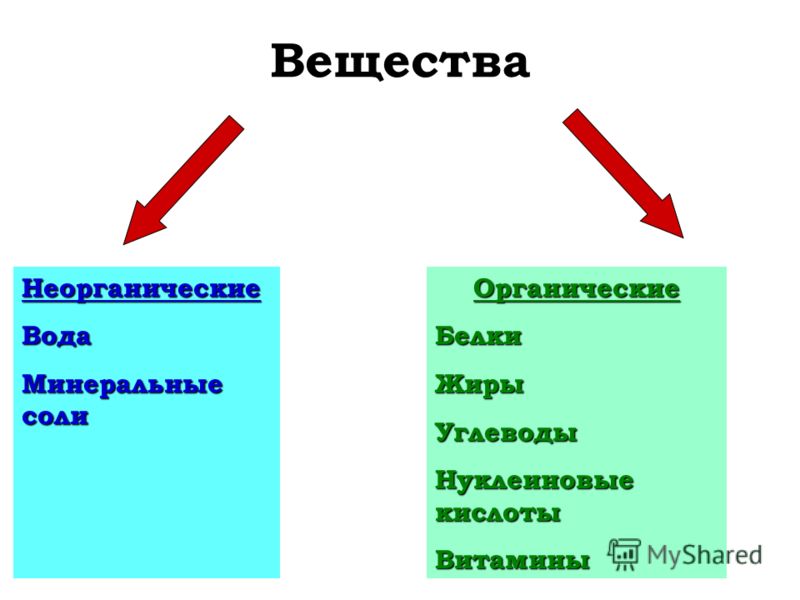 Предварительно определяемые элеме -ты отделяют от макрокомпонента обычной экстракцией их дитиокарбаминатных комплексов хлороформом при рН = 5-ь6 в присутствии цитрата калия. Органическую фазу упаривают, комплексы разрушают при обработке смесью НоЗО -Ь НКОз-Остаток в водном растворе пропускают через колонку. При этом Си образует узкую зону в верхней части колонки, а остальную часть занимает Сс1. Колонку про.чывают водой для удаления избытка Сб. Затем 50% Сс1 из колонки вытесняется соответствующим количеством меди при пропускании раствора Си (N03)2. Элюат собирают для измерения. [c.264]
Предварительно определяемые элеме -ты отделяют от макрокомпонента обычной экстракцией их дитиокарбаминатных комплексов хлороформом при рН = 5-ь6 в присутствии цитрата калия. Органическую фазу упаривают, комплексы разрушают при обработке смесью НоЗО -Ь НКОз-Остаток в водном растворе пропускают через колонку. При этом Си образует узкую зону в верхней части колонки, а остальную часть занимает Сс1. Колонку про.чывают водой для удаления избытка Сб. Затем 50% Сс1 из колонки вытесняется соответствующим количеством меди при пропускании раствора Си (N03)2. Элюат собирают для измерения. [c.264]
Среди промстоков предприятий часто встречаются такие, которые нельзя сбрасывать в реку, но с большим эффектом можно использовать для полива огородных и технических культур. В первую очередь к этой категории относятся промстоки, содержащие удобрительные вещества азот, фосфор, калий, органические вещества. Для этой цели пригодны все слабоминерализованные промстоки с щелочной реакцией, не содержащие высокотоксичных примесей, например промстоки Горловского азотно-тукового завода, сточные воды Донецкого завода хим-реактивов.
 В условиях засушливого климата Донбасса целесообразно использовать непротивопоказанные для орошения в сельском хозяйстве промстоки. [c.10]
В условиях засушливого климата Донбасса целесообразно использовать непротивопоказанные для орошения в сельском хозяйстве промстоки. [c.10]Схн(Срн, Скп)—коэффициент выноса урожаем азота (фосфора, калия) органических удобрений (Скн==507о, Срн=30%, Скн= = 67%) [c.169]
Андерсон и сотр. [12] действовали на раствор хлористого винила в тетрагидрофуране при 0° С 90 %-ным сплавом калий—натрий. Авторы на основании косвенных данных предполагают образование винилкалия (выход 32%), Последний взаимодействует с тетрагидрофураном. Следовательно, калий-органическое соединение нужно сразу вводить в те или иные реакции. [c.546]
Прежде чем устанавливать титр, необходимо приготовить посуду, Приготовление заключается в окислении марганцовокислым калием органических веществ, попавших в посуду с пылью из воздуха, и производится следующим образом в коническую колбу на 200 мл наливают 100 мл дестиллированной воды, 5 мл серной кислоты (разведенной по объему 1 3) и 4—5 мл раствора марганцовокислого калия. Кроме того, бросают в колбу неоколь-ко тонких стеклянных капилляров, запаянных с одного конца. Присутствие капилляров необходимо, чтобы поддерживать равномерность кипения жидкости и чтобы 01на не разбрызгивалась при [c.98]
Кроме того, бросают в колбу неоколь-ко тонких стеклянных капилляров, запаянных с одного конца. Присутствие капилляров необходимо, чтобы поддерживать равномерность кипения жидкости и чтобы 01на не разбрызгивалась при [c.98]
В соответствии с этим координационный характер процесса в таких системах в наибольшей степени был представлен для калий-органических инициаторов. Так, введение в углеводородную среду 10% амина при 25° С довольно резко меняет структуру литийно-либутадиена, меньше меняется структура в случае натрийполибутадиена, а структура калийполибутадиена почти не меняется [51]. [c.187]
Такой механизм предложен для реакции совместного окисления о-дианизидина и ферроцианида калия. Органический субстрат, связавшийся на поверхности белковой глобулы окисляется, и в результате образуется фермент-субстратный комплекс с полуокисленным субстратом, эффективно окисляющий ферроцианид или любой другой медленно окисляемый субстрат [Лебедева и др. , 1981]. [c.43]
, 1981]. [c.43]
Входная работа по химии
Проверочная работа по теме «Введение. Предмет органической химии. Алканы»
Вариант 1 ФИ_____________________________________класс_______
1 Элемент, который обязательно входит в состав органических соединений:
А) кислород Б) азот В) углерод Г) фосфор
2 Число известных органических соединений равно:
А) 1 тыс. Б) 100 тыс. В) 1 млн. Г) 20 млн.
3 Ученый, который ввел понятие «органическая химия»:
А) А.Бутлеров Б) М.Бертло В) Ф.Веллер Г) Й.Берцелиус
4 Валентность углерода в органических соединениях равна:
А) I Б) II В) III Г) IV
5 Формулу С2Н8 называют:
А) молекулярной Б) сокращенной структурной В) полной структурной Г) все ответы верны
6 Вещества, формулы которых СН3-СН2-СН2-СН3 и СН3-СН(СН2)-СН3 являются:
А) изомерами Б) гомологами В) веществами разных классов Г) верного ответа нет
7 Число всех химических связей в молекуле пропана:
А) 4 Б) 6 В) 8 Г) 10
8 Первое органическое вещество, полученное человеком:
А) белок Б) мочевина В) жир Г) сахаристое вещество
9 Пропан и пентан являются:
А) изомерами Б) гомологами В) веществами разных классов Г) одним и тем же веществом
10 Гомологом этана является:
А) пропан Б) пропен В) пропин Г) этен
11 Установите соответствие:
Природа вещества: 1. неорганическое вещество 2. Органическое вещество
неорганическое вещество 2. Органическое вещество
Вещество:
А) сахар Б) мел В) воск Г) поваренная соль Д) уксусная кислота
12 Электронная конфигурация наружного электронного слоя атома углерода в возбуждённом состоянии: А) 3s23p2 Б) 2s22p2 В) 3s13p3 Г) 2s12p3
13 Атомы углерода в алканах находятся в состоянии:
а) sр-гибридизации;
б) pр-гибридизации;
в) sр3-гибридизации;
г) в негибридном состоянии.
14 Молекула метана имеет строение:
а) октаэдрическое; б) плоскостное; в) тетраэдрическое; г) гексагональное
15 Радикал – это:
а). группа атомов с неспаренными электронами;
б). группа атомов, отличающихся от метана на – CH2 ;
в). группа атомов, имеющих положительный заряд;
г). группа атомов, которая называется функциональной
16 Девятый представитель ряда алканов называется:
а) октан; б) нонан; в) декан; г) гептан.
17 Дайте определение понятия «гомологи»
18 Дайте определение понятия «изомерия»
19 Рассчитайте массовые доли элементов в веществе С2Н4О2
20 Запишите структурные формулы изомерных веществ состава С5Н12. Дайте названия веществам по систематической номенклатуре.
Проверочная работа по теме «Введение. Предмет органической химии. Алканы»
Вариант 2 ФИ_____________________________________класс_______
1 Принадлежность к органическим веществам можно установить:
А) по окраске Б) по продуктам сгорания В) по растворимости в воде Г) по агрегатному состоянию
2 Автор теории строения органических веществ:
А) Д.Менделеев Б) Ф.Кекуле В) А.Бутлеров Г) Й.Берцелиус
3 Ученый, первым осуществивший синтез щавелевой кислоты из неорганических веществ:
А) Ф.Веллер Б) М.Бертло В) А. Кольбе Г) А.Бутлеров
Кольбе Г) А.Бутлеров
4 Численные значения степени окисления и валентности углерода совпадают в веществах:
А) СС14 и СО Б) СН4 и СО2 В) СН3С1 и СН4 Г) С3Н8 и С4Н10
5 Формулу СН3-СН3 называют:
А) молекулярной Б) сокращенной структурной В) полной структурной Г) все ответы верны
6 Гомологом бутана является:
А) пропанол Б) пентан В) бутен Г) сахароза
7 Относительная молекулярная масса пропана равна:
А) 30 Б) 42 В) 44 Г) 58
8 Общая формула предельных УВ:
А) СnH2n Б) СnH2n-2 В) СnH2n+2 Г) СnH2n-6
9 2-метилбутан и пентан являются:
А) изомерами Б) гомологами В) веществами разных классов Г) одним и тем же веществом
10 Элемент, атомы которого способны соединятся друг с другом с образованием цепей:
А) водород Б) азот В) кислород Г) углерод
11 Установите соответствие:
Природа вещества: 1. неорганическое вещество 2. Органическое вещество
неорганическое вещество 2. Органическое вещество
Вещество:
А) пищевая сода Б) мочевина В) молоко Г) полипропилен Д) соляная кислота
12 Электронная конфигурация наружного электронного слоя атома углерода в стационарном состоянии: А) 2s22p2 Б) 2s12p3 В) 2s22p3 Г) 2s22p4
13 Атомы углерода в алканах находятся в состоянии:
а) sр-гибридизации;
б) pр-гибридизации;
в) sр3-гибридизации;
г) в негибридном состоянии.
14 Валентный угол в алканах равен:
а) 109°28′; б) 180°; в) 90°; г) 270°.
15 Чтобы дать название радикалу, необходимо заменить -ан в названии алкана на:
а) -ин; б) -ил; в) -ен; г) -диен.
16 Седьмой представитель ряда алканов называется:
а) октан; б) нонан; в) декан; г) гептан.
17 Дополните фразу: «Изомеры – это вещества…»
18 Дайте определение понятия «гомологический ряд»
19 Рассчитайте массовые доли элементов в веществе СН2О
20 Запишите две структурные формулы изомеров состава С6Н14. Дайте названия веществам по систематической номенклатуре.
Дайте названия веществам по систематической номенклатуре.
Вариант 1 ФИ_____________________________________класс_______
Проверочная работа по теме «Введение. Предмет органической химии. Алканы»
Вариант2 ФИ_____________________________________класс_______
1 Элемент, который обязательно входит в состав органических соединений:
А) кислород Б) азот В) углерод Г) фосфор
2 Число известных органических соединений равно:
А) 1 тыс. Б) 100 тыс. В) 1 млн. Г) 20 млн.
3 Ученый, который ввел понятие «органическая химия»:
А) А.Бутлеров Б) М.Бертло В) Ф.Веллер Г) Й.Берцелиус
4 Валентность углерода в органических соединениях равна:
А) I Б) II В) III Г) IV
5 Формулу С2Н8 называют:
А) молекулярной Б) сокращенной структурной В) полной структурной Г) все ответы верны
6 Вещества, формулы которых СН3-СН2-СН2-СН3 и СН3-СН(СН2)-СН3 являются:
А) изомерами Б) гомологами В) веществами разных классов
Г) верного ответа нет
7 Число всех химических связей в молекуле пропана:
А) 4 Б) 6 В) 8 Г) 10
8 Первое органическое вещество, полученное человеком:
А) белок Б) мочевина В) жир Г) сахаристое вещество
9 Пропан и пентан являются:
А) изомерами Б) гомологами В) веществами разных классов Г) одним и тем же веществом
10 Гомологом этана является:
А) пропан Б) пропен В) пропин Г) этен
11 Установите соответствие:
Природа вещества: 1. неорганическое вещество 2. Органическое вещество
неорганическое вещество 2. Органическое вещество
Вещество:
А) сахар Б) мел В) воск Г) поваренная соль Д) уксусная кислота
12 Электронная конфигурация наружного электронного слоя атома углерода в возбуждённом состоянии: А) 3s23p2 Б) 2s22p2 В) 3s13p3 Г) 2s12p3
1 Принадлежность к органическим веществам можно установить:
А) по окраске Б) по продуктам сгорания В) по растворимости в воде Г) по агрегатному состоянию
2 Автор теории строения органических веществ:
А) Д.Менделеев Б) Ф.Кекуле В) А.Бутлеров Г) Й.Берцелиус
3 Ученый, первым осуществивший синтез щавелевой кислоты из неорганических веществ:
А) Ф.Веллер Б) М.Бертло В) А.Кольбе Г) А.Бутлеров
4 Численные значения степени окисления и валентности углерода совпадают в веществах:
А) СС14 и СО Б) СН4 и СО2 В) СН3С1 и СН4 Г) С3Н8 и С4Н10
5 Формулу СН3-СН3 называют:
А) молекулярной Б) сокращенной структурной В) полной структурной Г) все ответы верны
6 Гомологом бутана является:
А) пропанол Б) пентан В) бутен Г) сахароза
7 Относительная молекулярная масса пропана равна:
А) 30 Б) 42 В) 44 Г) 58
8 Общая формула предельных УВ:
А) СnH2n Б) СnH2n-2 В) СnH2n+2 Г) СnH2n-6
9 2-метилбутан и пентан являются:
А) изомерами Б) гомологами В) веществами разных классов Г) одним и тем же веществом
10 Элемент, атомы которого способны соединятся друг с другом с образованием цепей:
А) водород Б) азот В) кислород Г) углерод
11 Установите соответствие:
Природа вещества: 1. неорганическое вещество 2. Органическое вещество
неорганическое вещество 2. Органическое вещество
Вещество:
А) пищевая сода Б) мочевина В) молоко Г) полипропилен Д) соляная кислота
12 Электронная конфигурация наружного электронного слоя атома углерода в стационарном состоянии: А) 2s22p2 Б) 2s12p3 В) 2s22p3 Г) 2s22p4
13 Атомы углерода в алканах находятся в состоянии:
а) sр-гибридизации;
б) pр-гибридизации;
в) sр3-гибридизации;
г) в негибридном состоянии.
14 Молекула метана имеет строение:
а) октаэдрическое; б) плоскостное; в) тетраэдрическое; г) гексагональное
15 Радикал – это:
а). группа атомов с неспаренными электронами;
б). группа атомов, отличающихся от метана на – CH2 ;
в). группа атомов, имеющих положительный заряд;
г). группа атомов, которая называется функциональной
16 Девятый представитель ряда алканов называется:
а) октан; б) нонан; в) декан; г) гептан.
17 Дайте определение понятия «гомологи»
18 Дайте определение понятия «изомерия»
19 Рассчитайте массовые доли элементов в веществе С2Н4О2
20 Запишите структурные формулы изомерных веществ состава С5Н12. Дайте названия веществам по систематической номенклатуре.
13 Атомы углерода в алканах находятся в состоянии:
а) sр-гибридизации;
б) pр-гибридизации;
в) sр3-гибридизации;
г) в негибридном состоянии.
14 Валентный угол в алканах равен:
а) 109°28′; б) 180°; в) 90°; г) 270°.
15 Чтобы дать название радикалу, необходимо заменить -ан в названии алкана на:
а) -ин; б) -ил; в) -ен; г) -диен.
16 Седьмой представитель ряда алканов называется:
а) октан; б) нонан; в) декан; г) гептан.
17 Дополните фразу: «Изомеры – это вещества…»
18 Дайте определение понятия «гомологический ряд»
19 Рассчитайте массовые доли элементов в веществе СН2О
20 Запишите две структурные формулы изомеров состава С6Н14. Дайте названия веществам по систематической номенклатуре.
Дайте названия веществам по систематической номенклатуре.
Химические элементы названные по свойствам простых веществ. Простые и сложные вещества. Химический элемент
Билет 1:
Химия — это наука о веществах,их строении и свойствах, а также превращении одних веществ в другие. Химический элемент -это определенный вид атомов с одинаковым положительным зарядом ядра. Химический элемент существует в виде трех форм: 1) одиночный атом; 2) простые вещества;3) сложные вещества или химические соединения. Вещества,образованные одним химическим элементом,называются простыми. Вещества,образованные несколькими химическими элементами,называются сложными
Билет 2:
Жизнь человека зависит от химии — процессы расщепления еды в организме — это сплошная химическая реакция. Ну и всё, что мы носим, в чем ездим, на что смотрим так или иначе проходит через определенные этапы химической обработки — будь то покраска, изготовление сплавов разных и прочего. Химия играет большую роль промышленности. Как тяжелой, так и легкой. Например: без химии человек бы не смог получить лекарства и некоторые пищевые продукты неприродного происхождения (уксус). По большому счету — химия внутри и вокруг нас. Химическая промышленность — одна из наиболее бурно развивающихся отраслей. Она относится к отраслям, составляющим базу современного научно-технического прогресса (пластмасс, химические волокна, красители, фармацевтические препараты, моющие и косметические средства). В результате хозяйственной деятельности человека изменяется газовый состав и запыленность нижних слоев атмосферы. В результате это может вызвать эффект отдаленного влияния на человека: хронические воспалительные заболевания различных органов, изменения нервной системы, действие на внутриутробное развитие плода, приводящее к различным отклонениям у новорожденных. Экологические проблемы возможно решить лишь при стабилизации экономического положения и создании такого экономического механизма природопользования, когда плата за загрязнение окружающей среды будет соответствовать затратам на ее полную очистку.
Химия играет большую роль промышленности. Как тяжелой, так и легкой. Например: без химии человек бы не смог получить лекарства и некоторые пищевые продукты неприродного происхождения (уксус). По большому счету — химия внутри и вокруг нас. Химическая промышленность — одна из наиболее бурно развивающихся отраслей. Она относится к отраслям, составляющим базу современного научно-технического прогресса (пластмасс, химические волокна, красители, фармацевтические препараты, моющие и косметические средства). В результате хозяйственной деятельности человека изменяется газовый состав и запыленность нижних слоев атмосферы. В результате это может вызвать эффект отдаленного влияния на человека: хронические воспалительные заболевания различных органов, изменения нервной системы, действие на внутриутробное развитие плода, приводящее к различным отклонениям у новорожденных. Экологические проблемы возможно решить лишь при стабилизации экономического положения и создании такого экономического механизма природопользования, когда плата за загрязнение окружающей среды будет соответствовать затратам на ее полную очистку.
Билет 3:
Наиболее известные:
Дмитрий Иванович Менделеев конечно же, со своей известной переодической системой химических элементов.
КУЧЕРОВ МИХАИЛ ГРИГОРЬЕВИЧ — русский химик-органик, открыл реакцию каталитической гидратации ацетиленовых УВ с образованием карбонилсодержащих соединений, в частности, превращение ацетилена в уксусный альдегид в присутствии солей ртути.
КОНОВАЛОВ МИХАИЛ ИВАНОВИЧ — русский химик-органик, открыл нитрующее действие слабого раствора азотной кислоты на предельные УВ, разработал методы выделения и очистки нафтенов.
ЛЕБЕДЕВ СЕРГЕЙ ВАСИЛЬЕВИЧ — русский химик, впервые получил образец синтетичесого бутадиенового каучука, получил синтетический каучук полимеризацией бутадиена под действием металлического натрия. Благодаря Лебедеву с 1932 г в нашей стране начала создаваться отечественная промышленность синтетического каучука.
Билет 4: Тип элемента, какой элемент, информация о нем (кол-во электроных слоёв, кол-во электронов на внешнем уровне, степень оисления, кол-во протонов/нейтронов/электронов, относительная масса, группа элемента, конфигурация внешнего слоя) , реакция — взаимодействие элементов, веществ, формулы — вещества и классы веществ.
Билет 5: Атом состоит из атомного ядра и частиц (электронов, протонов, нейтронов) находящихся на периферии. Протоны и нейтроны составляют ядро атома, которое несёт почти всю массу атома. Электроны составляют электронную оболочку атома, которая делится на энергитические уровни (1,2,3 и тд), уровни делятся на подуровни (обозначаются буквами s, p, d, f).Подуровни состоят из атомных орбиталей, т.е. областей пространства, где вероятно пребывание электронов. Орбитали обозначаются как 1s(орбиталь первого уровня, s-подуровня)Заполнение атомных орбиталей происходит в соответсвии с тремя условиями: 1) Принцип минимума энергии
2)Правило запрета, ну или принцип Паули
3)Принцип максимальной мультиплетности, правило Хунда.
Изотопы — это атомы одного элемента, различающиеся числом нейтронов в ядре.
Так например наиболее ярким примером могут быть изотопы водорода:
1H — протий с одним протоном в ядре и 1 электроном в оболочке
2H — дейтерий с одним протоном и одним нейтроном в ядре и одним электроном в оболочке
3H — тритий с одним протоном и двумя нейтронов в ядре и одним электроном в оболочке
Билет 6:
1. H)1
H)1
2. He)2
3. Li)2)1
4. Be)2)2
5. B)2)3
6. C)2)2
7. N)2)5
8. O)2)6
9. F)2)7
10. Ne)2)8
11. Na)2)8)1
12. Mg)2)8)2
13. Al)2)8)3
14. Si)2)8)4
15. P)2)8)5
16. S)2)8)6
17. Cl)2)8)7
18. Ar)2)8)8
19. K)2)8)8)1
20. Ca)2)8)8)8
На внешнем уровне если 2 или 8 электронов — завершенный, а если другое количество — не завершенный.
Билет 8:
Ионная связь это: типичный металл + типичный неметалл. Пример: NaCl, AlBr3. Ковалентная полярная это: неметалл + неметалл (разные). Пример: h3O, HCl.Ковалентная неполярная это: неметалл + неметалл (одинаковые). Пример: h3, Cl2, O2, O3.А металлическая когда металл + металл Li, Na, K
Билет 11:
Сложные вещества состоят из органических и неорганических веществ.
Неорганические вещества: Оксиды, гидроксиды, соли
Органические вещества: кислоты, основания.
Ну, дружище, с чем смог — помог.)
Все вещества, о которых мы говорим в
школьном курсе химии, принято делить
на простые и сложные. Простые
вещества — это такие вещества, в
состав молекул которых входят атомы
одного и того же элемента. Атомарный
кислород (O), молекулярный кислород
(O2) или просто кислород, озон (O3),
графит, алмаз — это примеры простых
веществ, которые образуют
химические элементы кислород и
углерод. Сложные вещества делятся на
органические и неорганические. Среди
неорганических веществ, прежде всего
выделяют следующие четыре класса:
окислы (или оксиды), кислоты
(кислродные и безкислородные),
основания (растворимые в воде
основания называются щелочами) и
соли. Соединения неметаллов
(исключая кислород и водород) не
входят в эти четыре класса, мы будем
их называть условно «и другие сложные
вещества».
Простые
вещества — это такие вещества, в
состав молекул которых входят атомы
одного и того же элемента. Атомарный
кислород (O), молекулярный кислород
(O2) или просто кислород, озон (O3),
графит, алмаз — это примеры простых
веществ, которые образуют
химические элементы кислород и
углерод. Сложные вещества делятся на
органические и неорганические. Среди
неорганических веществ, прежде всего
выделяют следующие четыре класса:
окислы (или оксиды), кислоты
(кислродные и безкислородные),
основания (растворимые в воде
основания называются щелочами) и
соли. Соединения неметаллов
(исключая кислород и водород) не
входят в эти четыре класса, мы будем
их называть условно «и другие сложные
вещества».
Простые вещества принято делить на
металлы, неметаллы и инертные газы. К
металлам относятся все химические
элементы, у которых идет заполнение
d- и f-подуровней, это в 4-ом периоде
элементы: Sc — Zn, в 5-ом периоде: Y —
Cd, в 6-ом периоде: La — Hg, Ce — Lu, в 7
периоде Ac — Th — Lr. Если теперь среди
оставшихся элементов провести линию
от Be к At, то слева и внизу от нее
будут расположены металлы, а справа
и вверху — неметаллы. В 8 группе
Периодической системы расположены
инертные газы. Элементы,
расположенные на диагонали: Al, Ge,
Sb, Po (и некоторые другие. Например,
Zn) в свободном состоянии обладают
свойствами металлов, а гидроксиды
обладают свойствами и оснований, и
кислот, т.е. являются амфотерными
гидроксидами. Поэтому эти элементы
можно считать металло-неметаллами,
занимающими промежуточное
положение между металлами и
неметаллами. Таким образом,
классификация химических элементов
зависит от того, какими свойствами
будут обладать их гидроксиды:
основными — значит это металл,
кислотными — неметалл, и теми и
другими (в зависимости от условий) —
металло-неметалл. Один и тот же
химический элемент в соединениях с
низшей положительной степенью
окисления (Mn+2, Cr+2) проявляет ярко
выраженные «металлические» свойства,
а в соединениях с максимальной
положительной степенью окисления
(Mn+7, Cr+6) проявляет свойства
типичного неметалла.
Если теперь среди
оставшихся элементов провести линию
от Be к At, то слева и внизу от нее
будут расположены металлы, а справа
и вверху — неметаллы. В 8 группе
Периодической системы расположены
инертные газы. Элементы,
расположенные на диагонали: Al, Ge,
Sb, Po (и некоторые другие. Например,
Zn) в свободном состоянии обладают
свойствами металлов, а гидроксиды
обладают свойствами и оснований, и
кислот, т.е. являются амфотерными
гидроксидами. Поэтому эти элементы
можно считать металло-неметаллами,
занимающими промежуточное
положение между металлами и
неметаллами. Таким образом,
классификация химических элементов
зависит от того, какими свойствами
будут обладать их гидроксиды:
основными — значит это металл,
кислотными — неметалл, и теми и
другими (в зависимости от условий) —
металло-неметалл. Один и тот же
химический элемент в соединениях с
низшей положительной степенью
окисления (Mn+2, Cr+2) проявляет ярко
выраженные «металлические» свойства,
а в соединениях с максимальной
положительной степенью окисления
(Mn+7, Cr+6) проявляет свойства
типичного неметалла. Чтобы увидеть
взаимосвязь простых веществ, оксидов,
гидроксидов и солей приведем сводную
таблицу.
Чтобы увидеть
взаимосвязь простых веществ, оксидов,
гидроксидов и солей приведем сводную
таблицу.
При изучении материала предыдущих параграфов, вы уже познакомились с некоторыми веществами. Так, например, молекула газа водорода, состоит из двух атомов химического элемента водорода – Н + Н = Н2.
Простые вещества – вещества, в состав которых входят атомы одного вида
К простым веществам, из числа известных вам веществ, относят: кислород, графит, серу, азот, все металлы: железо, медь, алюминий, золото и т.д. Сера состоит только из атомов химического элемента серы, а графит состоит из атомов химического элемента углерода.
Нужно четко различать понятия «химический элемент» и «простое вещество» . Например, алмаз и углерод – не одно и тоже. Углерод – химический элемент, а алмаз – простое вещество, образованное химическим элементов углеродом. В данном случае химический элемент (углерод) и простое вещество (алмаз) называются по-разному. Часто химический элемент и отвечающее ему простое вещество называются одинаково. Например, элементу кислороду, соответствует простое вещество – кислород.
Часто химический элемент и отвечающее ему простое вещество называются одинаково. Например, элементу кислороду, соответствует простое вещество – кислород.
Различать, где идет речь об элементе, а где о веществе, необходимо научиться! Например, когда говорят, что кислород входит в состав воды – речь идет об элементе кислороде. Когда говорят, что кислород – это газ, необходимый для дыхания – здесь идет речь о простом веществе кислороде.
Простые вещества химических элементов подразделяют на две группы – металлы и неметаллы.
Металлы и неметаллы кардинально отличаются по своим физическим свойствам. Все металлы при нормальных условиях твердые вещества, исключение составляет ртуть – единственный жидкий металл . Металлы непрозрачны, обладают характерным металлическим блеском. Металлы пластичны, хорошо проводят тепло и электрический ток.
Неметаллы не похожи друг на друга по физическим свойствам. Так, водород, кислород, азот – газы, кремний, сера, фосфор – твердые вещества. Единственный жидкий неметалл – бром – жидкость коричнево-красного цвета.
Единственный жидкий неметалл – бром – жидкость коричнево-красного цвета.
Если провести условную линию от химического элемента бора к химическому элементу астату, то в длинном варианте Периодической Системы над линией расположены неметаллические элементы, а под ней – металлические . В коротком варианте Периодической Системы под этой линией расположены неметаллические элементы, а над ней – как металлические, так и неметаллические элементы. Значит, определять, является элемент металлическим или неметаллическим, удобнее по длинному варианту Периодической Системы. Это деление условное, поскольку все элементы так или иначе проявляют как металлические, так и неметаллические свойства, но в большинстве случаев такое распределение соответствует действительности.
Сложные вещества и их классификация
Если в состав простых веществ входят атомы только одного вида, несложно догадаться, что в состав сложных веществ будут входить несколько видов различных атомов, как минимум двух. Примером сложного вещества является вода, ее химическая формула вам известна – Н2О . Молекулы воды состоят из двух видов атомов: водорода и кислорода.
Примером сложного вещества является вода, ее химическая формула вам известна – Н2О . Молекулы воды состоят из двух видов атомов: водорода и кислорода.
Сложные вещества – вещества, в состав которых входят атомы различных видов
Проведем следующий эксперимент. Смешаем порошки серы и цинка. Поместим смесь на металлический лист и подожжем при помощи деревянной лучины. Смесь загорается и быстро сгорает ярким пламенем. После завершения химической реакции образовалось новое вещество, в состав которого входят атомы серы и цинка. Свойства этого вещества совершенно другие, нежели свойства исходных веществ – серы и цинка.
Сложные вещества принято делить на две группы: неорганические вещества и их производные и органические вещества и их производные. Например, каменная соль – это неорганическое вещество, а крахмал, содержащийся в картофеле – органическое вещество.
Типы строения веществ
По типу частиц, входящих в состав веществ, вещества делят на вещества молекулярного и немолекулярного строения.
В состав вещества могут входить различные структурные частицы, такие как атомы, молекулы, ионы. Следовательно, существует три типа веществ: вещества атомного, ионного и молекулярного строения. Вещества различного типа строения будут иметь различные свойства.
Вещества атомного строения
Примером веществ атомного строения могут быть вещества, образованные элементом углеродом: графит и алмаз . В состав этих веществ входят только атомы углерода, но свойства этих веществ очень сильно отличаются. Графит – хрупкое, легко расслаивающееся вещество серо-черного цвета. Алмаз – прозрачный, один из самых твердых на планете, минерал. Почему вещества, состоящие из одного типа атомов, имеют различные свойства? Все дело в строении этих веществ. Атомы углерода в графите и алмазе соединяются различным способом. Вещества атомного строения имеют высокие температуры кипения и плавления, как правило, нерастворимы в воде, нелетучи.
Кристаллическая решетка – вспомогательный геометрический образ, вводимый для анализа строения кристалла
Вещества молекулярного строения
Вещества молекулярного строения – это практически все жидкости и большинство газообразных веществ. Существуют и кристаллические вещества, в состав кристаллической решетки которых входят молекулы. Вода – вещество молекулярного строения. Лед также имеет молекулярное строение, но в отличие от жидкой воды, имеет кристаллическую решетку, где все молекулы строго упорядочены. Вещества молекулярного строения имеют невысокие температуры кипения и плавления, как правило хрупкие, не проводят электрический ток.
Существуют и кристаллические вещества, в состав кристаллической решетки которых входят молекулы. Вода – вещество молекулярного строения. Лед также имеет молекулярное строение, но в отличие от жидкой воды, имеет кристаллическую решетку, где все молекулы строго упорядочены. Вещества молекулярного строения имеют невысокие температуры кипения и плавления, как правило хрупкие, не проводят электрический ток.
Вещества ионного строения
Вещества ионного строения – это твердые кристаллические вещества. Примером вещества ионного соединения может быть поваренная соль. Ее химическая формула NaCl. Как видим, NaCl состоит из ионов Na+ и Cl⎺, чередующихся в определенных местах (узлах) кристаллической решетки. Вещества ионного строения имеют высокие температуры плавления и кипения, хрупкие, как правило, хорошо растворимы в воде, не проводят электрический ток.
Понятия «атом», «химический элемент» и «простое вещество» не следует смешивать.
- «Атом» – конкретное понятие, так как атомы существуют реально.

- «Химический элемент» – это собирательное, абстрактное понятие; в природе химический элемент существует в виде свободных или химически связанных атомов, то есть простых и сложных веществ.
Названия химических элементов и соответствующих простых веществ совпадают в большинстве случаев.
Когда мы говорим о материале или компоненте смеси – например, колба наполнена газообразным хлором, водный раствор брома, возьмём кусочек фосфора, – мы говорим о простом веществе. Если же мы говорим, что в атоме хлора содержится 17 электронов, вещество содержит фосфор, молекула состоит из двух атомов брома, то имеем в виду химический элемент.
Нужно различать свойства (характеристики) простого вещества (совокупности частиц) и свойства (характеристики) химического элемента (изолированного атома определенного вида), см. таблицу ниже:
Сложные вещества необходимо отличать от смесей , которые тоже состоят из разных элементов.
Количественное соотношение компонентов смеси может быть переменным, а химические соединения имеют постоянный состав.
Например, в стакан чая вы можете внести одну ложку сахара, или несколько, а молекулы сахарозы С12Н22О11 содержит точно 12 атомов углерода, 22 атома водорода и 11 атомов кислорода.
Таким образом, состав соединений можно описать одной химической формулой, а состав смеси – нет.
Компоненты смеси сохраняют свои физические и химические свойства. Например, если смешать железный порошок с серой, то образуется смесь двух веществ. И сера, и железо в этой смеси сохраняют свои свойства: железо притягивается магнитом, а сера не смачивается водой и плавает по ее поверхности.
Если же сера и железо прореагируют друг с другом, образуется новое соединение с формулой FeS , не имеющее свойств ни железа, ни серы, но обладающее набором собственных свойств. В соединении FeS железо и сера связаны друг с другом, и разделить их методами, которыми разделяют смеси, нельзя.
Таким образом, вещества можно классифицировать по нескольким параметрам:
Выводы из статьи по теме Простые и сложные вещества
- Простые вещества – вещества, в состав которых входят атомы одного вида
- Простые вещества делят на металлы и неметаллы
- Сложные вещества – вещества, в состав которых входят атомы различных видов
- Сложные вещества делят на органические и неорганические
- Существуют вещества атомного, молекулярного и ионного строения, их свойства различны
- Кристаллическая решетка – вспомогательный геометрический образ, вводимый для анализа строения кристалла
Химия относится к естественным наукам. Она
изучает состав, строение, свойства и
превращения веществ, а также явления,
сопровождающие эти превращения.
Она
изучает состав, строение, свойства и
превращения веществ, а также явления,
сопровождающие эти превращения.
Вещество является одной из основных форм существования материи. Вещество как форма материи состоит из отдельных частиц различной степени сложности и обладает собственной массой, так н а з ы в а е м о й
массой покоя.
Простые и сложные вещества. Аллотропия.
Все вещества можно разделить на простые и сложные .
Простые вещества состоят из атомов одного химического элемента, сложные — из атомов нескольких химических элементов.
Химический элемент — это определенный вид атомов с одинаковым зарядом ядра. Следовательно, атом — это мельчайшая частица химического элемента.
Понятие простое вещество нельзя отождествлять с понятием
химический
элемент . Химический элемент характеризуется
определенным положительным зарядом
ядра атома, изотопным составом, химическими
свойствами. Свойства элементов относятся
к его отдельным атомам. Простое вещество
характеризуется определенной плотностью,
растворимостью, температурами плавления
и кипения и т.п. Эти свойства относятся
к совокупности атомов и для разных
простых веществ они различны.
Химический элемент характеризуется
определенным положительным зарядом
ядра атома, изотопным составом, химическими
свойствами. Свойства элементов относятся
к его отдельным атомам. Простое вещество
характеризуется определенной плотностью,
растворимостью, температурами плавления
и кипения и т.п. Эти свойства относятся
к совокупности атомов и для разных
простых веществ они различны.
Простое вещество — это форма существования химического элемента в свободном состоянии. Многие химические элементы образуют несколько простых веществ, различных по строению и свойствам. Это явление называется аллотропией , а образующие вещества — аллотропными видоизменениями . Так, элемент кислород образует две аллотропные модификации — кислород и озон, элемент углерод — алмаз, графит, карбин, фуллерен.
Явление аллотропии
вызывается двумя причинами: различным
числом атомов в молекуле (например,
кислород О 2 и азон О 3 )
либо образованием различных кристаллических
форм (например, углерод образует следующие
аллотропные модификации: алмаз, графит,
карбин, фуллерен), карбин был открыт в
1968г (А. Сладков, Россия), а фуллерен в 1973
г теоретически (Д.Бочвар, Россия), а в
1985г — экспериментально (Г.Крото и Р.Смолли,
США).
Сладков, Россия), а фуллерен в 1973
г теоретически (Д.Бочвар, Россия), а в
1985г — экспериментально (Г.Крото и Р.Смолли,
США).
Сложные вещества состоят не из простых веществ, а из химических элементов. Так водород и кислород, входящие в состав воды, содержатся в воде не в виде газообразных водорода и кислорода с их характерными свойствами, а в виде элементов — водорода и кислорода.
Мельчайшей частицей веществ, имеющих молекулярную структуру, является молекула, которая сохраняет химические свойства данного вещества. Согласно современным представлениям из молекул состоят в основном вещества, находящиеся в жидком и газообразном состоянии. Большинство же твердых веществ (в основном неорганических) состоит не из молекул, а из других частиц (ионов, атомов). Не имеют молекулярной структуры соли, оксиды металлов, алмаз, металлы и пр.
Относительная атомная масса
Современные методы
исследования позволяют определить
чрезвычайно малые массы атомов с большей
точностью.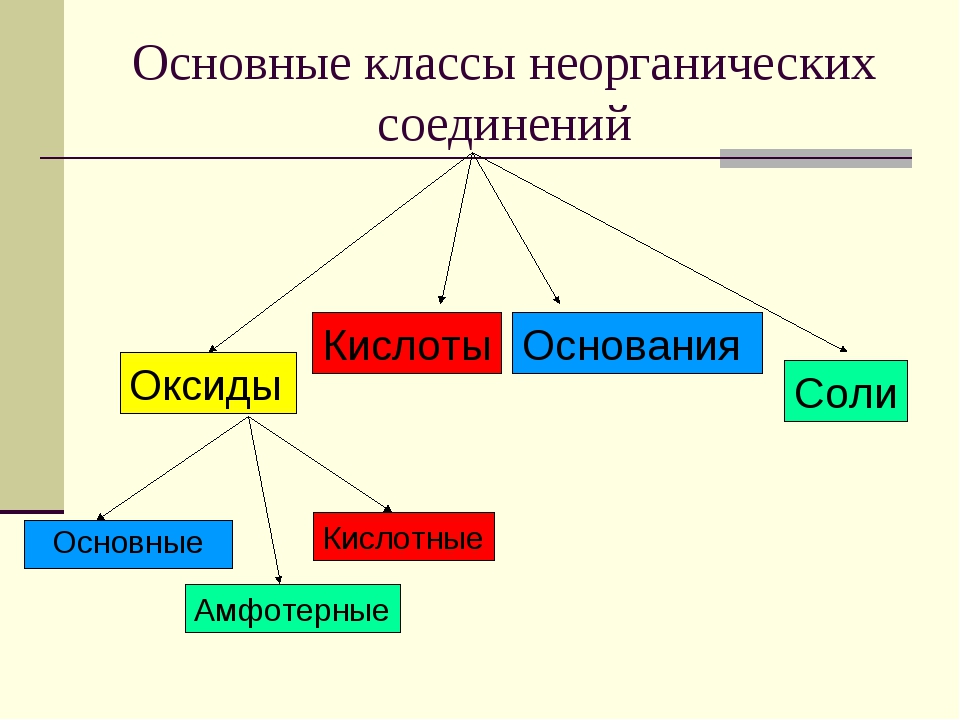 Так, например, масса атома
водорода составляет 1,674 10 -27 кг, углерода – 1,993 10 -26 кг.
Так, например, масса атома
водорода составляет 1,674 10 -27 кг, углерода – 1,993 10 -26 кг.
В химии традиционно используются не абсолютные значения атомных масс, а относительные. В 1961г за единицу атомной массы принята атомная единица массы (сокращенно а.е.м.), которая представляет собой 1/12 часть массы атома изотопа углерода 12 С .
Большинство химических элементов имеют атомы с различной массой (изотопы). Поэтому относительной атомной массой (или просто атомной массой) А r химического элемента называется величина, равная отношению средней массы атома элемента к 1/12 массы атома углерода 12 С.
Атомные массы
элементов обозначают А r ,
где индекс r – начальная
буква английского слова relative – относительный. Записи A r (H),
A r (O), A r (C) означают:
относительная атомная масса водорода,
относительная атомная масса кислорода,
относительная атомная масса углерода.
Относительная атомная масса – одна из основных характеристик химического элемента.
Органические и неорганические вещества;
> распознавать металлы и неметаллы;
> определять металлические и неметаллические элементы по их расположению в периодической системе Д. И. Менделеева; понять, почему все металлы похожи по свойствам.
Атомы в обычных условиях не могут долго существовать поодиночке. Они способны соединяться с такими же или другими атомами, что обуславливает большое разнообразие в мире веществ.
Вещество, образованное одним химическим элементом, называется простым, а вещество, образованное несколькими элементами, — сложным, или химическим соединением.
Простые вещества
Простые вещества делят на металлы и неметаллы. Такую классификацию простых веществ предложил выдающийся французский ученый A.Л. Лавуазье в конце XVIII в. Химические элементы, от которых происходят металлы, называют металлическими, а те, которые образуют неметаллы, —
неметаллическими. В длинном варианте системы Д. И. Менделеева (форзац II) они разграничены ломаной линией. Металлические элементы находятся слева от нее; их значительно больше, чем неметаллических.
В длинном варианте системы Д. И. Менделеева (форзац II) они разграничены ломаной линией. Металлические элементы находятся слева от нее; их значительно больше, чем неметаллических.
Это интересно
Простые вещества 13 элементов — Au, Ag, Cu, Hg, Pb, Fe, Sn, Pt, S, С, Zn, Sb и As были известны еще в древности.
Каждый из вас может, не задумываясь, назвать несколько металлов (рис. 36). Они отличаются от остальных веществ особым «металлическим» блеском. Эти вещества имеют много общих свойств.
Рис. 36. Металлы
Металлы в обычных условиях являются твердыми веществами (только ртуть — жидкость), хорошо проводят электрическии ток и теплоту, имеют в основном высокие температуры плавления (свыше 500 °С).
Рис. 37. Упрощенная модель внутреннего строения металла
Они пластичны; их можно ковать, вытягивать из них проволоку.
Благодаря своим свойствам металлы уверенно вошли в жизнь людей. Об их огромном значении свидетельствуют названия исторических эпох: медный век, бронзовый1 век, железный век.
Сходство металлов обусловлено их внутренним строением.
Строение металлов. Металлы — кристаллические вещества. Кристаллы в металлах намного мельче, чем кристаллы сахара или поваренной соли, и увидеть их невооруженным глазом невозможно.
Молекула — электронейтральная частица, состоящая из двух или большего числа соединенных атомов.
В каждой молекуле атомы соединены между собой достаточно прочно, а молекулы друг с другом в веществе — очень слабо. Поэтому вещества молекулярного строения имеют невысокие температуры плавления и кипения.
Кислород и озон являются молекулярными веществами. Это простые вещества Оксигена. Молекула кислорода содержит два атома Оксигена, а молекула озона — три (рис. 39).
Рис. 39. Модели молекул
He только Оксиген, но и многие другие элементы образуют по два и более простых веществ. Поэтому простых веществ в несколько раз больше, чем химических элементов .
Названия простых веществ.
Большинство простых веществ называют так, как и соответствующие элементы. Если названия разные, то они приведены в периодической системе, причем название простого вещества расположено ниже названия
Если названия разные, то они приведены в периодической системе, причем название простого вещества расположено ниже названия
элемента (рис. 40).
Назовите простые вещества элементов Гидргена, Лития, Магния, Нитрогена.
1 Термин «молекула» происходит от латинского слова moles (масса), уменьшительного суффикса cula и в переводе означает «маленькая масса».
Названия простых веществ записывают внутри предложения с маленькой буквы.
Рис. 40. Клетка периодической системы
Сложные вещества (химические соединения)
Соединение атомов разных химических элементов порождает множество сложных веществ (их в десятки тысяч раз больше, чем простых).
Существуют сложные вещества с молекулярным, атомным и ионным строением. Поэтому их свойства очень разные.
Молекулярные соединения в основном летучи, нередко имеют запах. Температуры их плавления и кипения значительно ниже, чем соединений с атомным или ионным строением.
Молекулярным веществом является вода. Молекула воды состоит из двух атомов Гидрогена и одного атома Оксигена (рис. 41).
Рис. 41. Модель молекулы воды
Молекулярное строение имеют угарный и углекислый газы , сахар, крахмал, спирт, уксусная кислота и др. Количество атомов в молекулах сложных веществ может быть разным — от двух атомов до сотен и даже тысяч.
Некоторые соединения имеют атомное строение.
Одним из них является минерал кварц, главная составляющая песка. В нем содержатся атомы Силиция и Оксигена (рис. 42).
Рис. 42. Модель соединения атомного строения (кварца)
Существуют также ионные соединения. Это — поваренная соль, мел, сода, известь, гипс и многие другие. Кристаллы поваренной соли состоят из положительно заряженных ионов Натрия и отрицательно заряженных ионов Хлора (рис. 43). Каждый такой ион образуется из соответствующего атома (§ 6).
Рис. 43. Модель ионного соединения (поваренной соли)
Это интересно
В молекулах органических соединений, кроме атомов Карбона, содержатся, как правило, атомы Гидрогена, нередко — атомы Оксигена, иногда — некоторых других элементов.
Взаимное притяжение многих противоположно заряженных ионов обуславливает существование ионных соединений.
Ион, образовавшийся из одного атома, называют простым, а ион, который образовался из нескольких атомов, — сложным.
Положительно заряженные простые ионы существуют для металлических элементов, а отрицательно заряженные — для неметаллических элементов.
Названия сложных веществ.
В учебнике до сих пор приводились технические или бытовые названия сложных веществ. Кроме того, вещества имеют и химические названия. Например, химическое название поваренной соли — натрий хлорид, а мела — кальций карбонат. Каждое такое название состоит из двух слов. Первым словом является название одного из элементов, которыми образовано вещество (оно пишется с маленькой буквы), а второе происходит от названия другого элемента.
Органические и неорганические вещества.
Раньше органическими веществами называли те вещества, которые содержатся в живых организмах.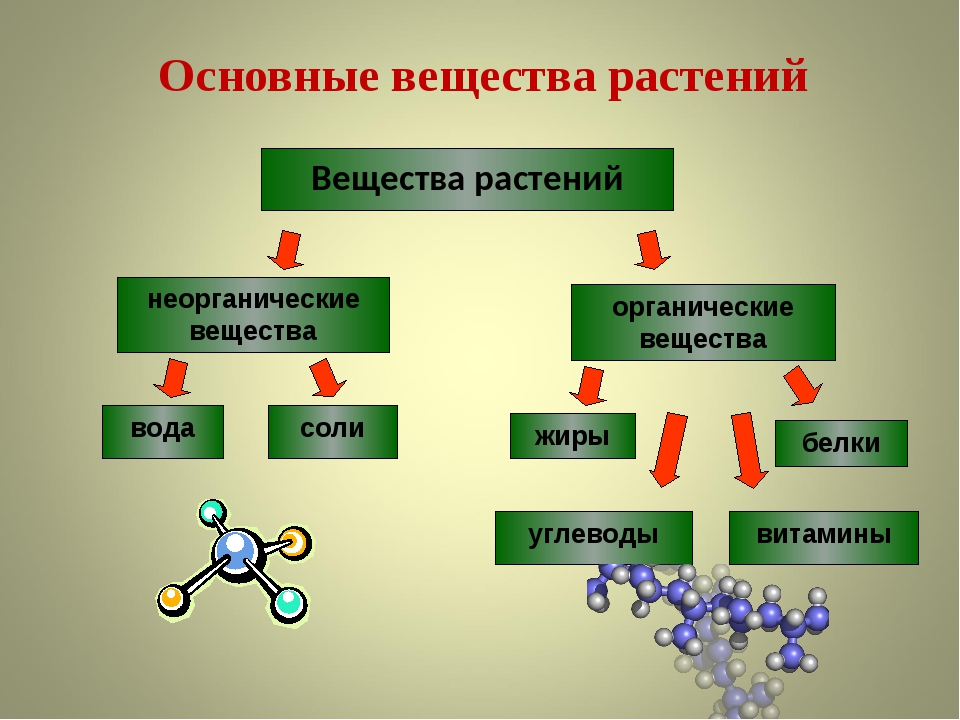 Это белки, жиры, сахар, крахмал, витамины , соединения, придающие цвет, запах, вкус овощам и фруктам, и др. Co временем ученые начали получать в лабораториях подобные по составу и свойствам вещества, которых нет в природе. Сейчас органическими веществами называют соединения Карбона (за исключением угарного и углекислого газов, мела, соды, некоторых других).
Это белки, жиры, сахар, крахмал, витамины , соединения, придающие цвет, запах, вкус овощам и фруктам, и др. Co временем ученые начали получать в лабораториях подобные по составу и свойствам вещества, которых нет в природе. Сейчас органическими веществами называют соединения Карбона (за исключением угарного и углекислого газов, мела, соды, некоторых других).
Большинство органических соединений способны гореть, а при нагревании в отсутствие воздуха обугливаются (уголь почти полностью состоит из атомов Карбона).
К неорганическим веществам принадлежат остальные сложные вещества, а также все простые. Они составляют основу минерального мира, т. е. содержатся в почве, минералах, горных породах, воздухе, природной воде. Кроме того, неорганические вещества есть и в живых организмах.
Материал параграфа обобщен в схеме 6.
Лабораторный опыт № 2
Ознакомление с веществами различных типов
Вам выданы такие вещества (вариант укажет учитель):
вариант I — сахар, кальций карбонат (мел), графит, медь;
вариант II — парафин, алюминий, сера, натрий хлорид (поваренная соль).
Вещества находятся в банках с этикетками.
Внимательно рассмотрите вещества, обратите внимание на их названия. Определите среди них простые (металлы, неметаллы) и сложные вещества, а также органические и неорганические.
Внесите в таблицу название каждого вещества и укажите его тип, записав в соответствующих столбцах знак «+».
Выводы
Вещества бывают простыми и сложными, органическими и неорганическими.
Простые вещества делят на металлы и неметаллы, а химические элементы — на металлические и неметаллические.
Металлы имеют немало общих свойств благодаря сходству их внутреннего строения.
Неметаллы состоят из атомов или молекул и по своим свойствам отличаются от металлов.
Сложные вещества (химические соединения) имеют атомное, молекулярное или ионное строение.
Почти все соединения Карбона принадлежат к органическим веществам, а остальные соединения и простые вещества — к неорганическим веществам.
?
56. Какое вещество называют простым, а какое — сложным? Какие типы простых веществ существуют и как называют соответствующие элементы?
Какое вещество называют простым, а какое — сложным? Какие типы простых веществ существуют и как называют соответствующие элементы?
57. По каким физическим свойствам металл можно отличить от неметалла?
58. Дайте определение молекулы. Чем отличается молекула простого вещества от молекулы сложного вещества?
59. Заполните пропуски, вставив в соответствующих падежах слова «Нитроген» или «азот», и объясните свой выбор:
а) … — газ, которого в воздухе содержится наибольшее количество;
б) молекула… состоит из двух атомов…;
в) соединения… попадают в растения из почвы;
г)… плохо растворяется в воде.
60. Заполните пропуски, вставив слова «элемент», «атом» или «молекула» в соответствующем падеже и числе:
а)… белого фосфора содержит четыре… Фосфора;
б) в воздухе есть… углекислого газа;
в) золото — простое вещество… Аурума.
Наполнители органические — Энциклопедия по машиностроению XXL
Связующее — мочевино- и меламиноформальдегидные смолы наполнитель — органический, минеральный, их смесь [c. 550]
550]Прессующиеся составы (пластмассы). Изготовляются на основе различных связующих (преимущественно синтетических полимеров) с всевозможными наполнителями (органическими и минеральными) и без наполнителей. [c.106]
При введении наполнителя затрудняется перемещение молекул полимера, поэтому, как правило, уменьшается тепловое расширение. Пластмассы с минеральным наполнителем имеют обычно меньший коэффициент теплового расширения, чем пластмассы, содержащие наполнитель органического происхождения. Температурный коэффициент линейного расширения асбофрикционных материалов (15—40)-10″ (°С)» . [c.163]
Введение наполнителя, затрудняя перемещение молекул полимера, как правило, уменьшает тепловое расширение. Пластмассы с минеральным наполнителем имеют обычно меньший температурный коэффициент линейного расширения, чем пластмассы, содержащие наполнитель органического происхождения.
 Температурный коэффициент линейного расширения фрикционных полимерных материалов составляет (15 Ч-40)-10- » -i.
[c.255]
Температурный коэффициент линейного расширения фрикционных полимерных материалов составляет (15 Ч-40)-10- » -i.
[c.255]Свойства пластмасс, а следовательно, и область их применения зависят от природы связующих и наполнителей. В качестве связующих применяют синтетические смолы (полимеры), а в качестве наполнителей — органические и минеральные вещества. Наполнители оказывают существенное влияние на механическую прочность, электроизоляционные свойства, теплостойкость и другие свойства, а также снижают стоимость пластмасс. [c.258]
В качестве наполнителей органического происхождения применяются преимущественно хлопковые очесы, обрезки ткани или бумаги, древесный шпон. [c.140]
Пластмассы представляют собой композицию из искусственной смолы и наполнителя органического или минерального происхождения (за исключением целлулоида). Они имеют слоистую или однородную (гомогенную) структуру. К листовым пластмассам, имеющим слоистую структуру, относятся гетинакс, текстолит и стеклотекстолит к пластмассам гомогенной структуры — органическое стекло, винипласт, целлулоид. [c.295]
[c.295]
Пластики, которые содержат волокнистый наполнитель (органические, стеклянные, борные, углеродные волокна), названы волокнитами. [c.5]
Композиционные пластмассы представляют собой композицию, в которых химически инертные наполнители органического или неорганического происхождения (в виде крошки, муки, волокон, обрезков) смешаны со связующими веществами — естественными или искусственными смолами. [c.46]
Наполнителями органического происхождения в этих пластмассах являются древесина, бумага, хлопчатобумажные ткани, растительные волокна и др. наполнителями неорганического происхождения — асбест, графит, стекловолокно и др. [c.46]
Пластические массы — пластмассы представляют композицию из искусственной смолы и наполнителя органического или минерального происхождения (за исключением целлулоида). [c.108]
Наполнители по их природе разделяют на две группы наполнители органического и неорганического (минерального) происхождения.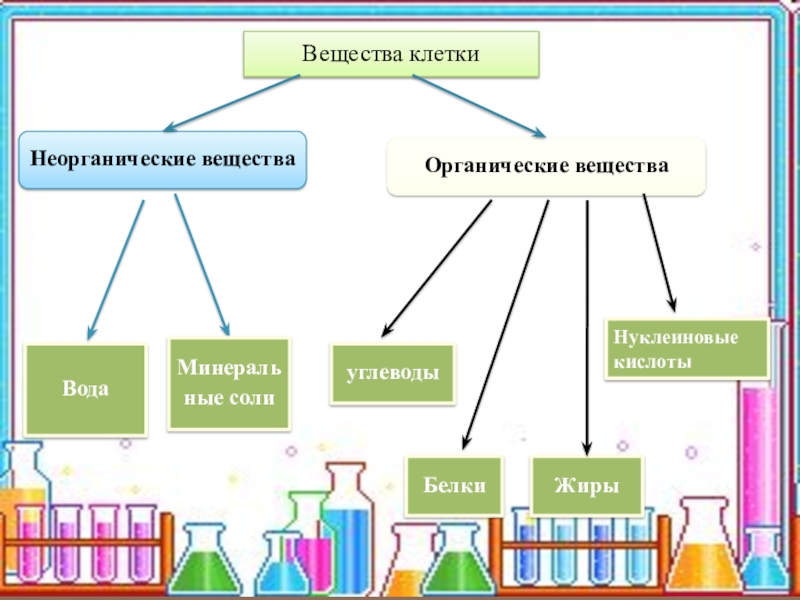 К первой группе относят вещества, содержащие в своем составе целлюлозу. Эти наполнители снижают хрупкость смолы, позволяют сохранить низкий удельный вес, но придают пластической массе большую гигроскопичность и меньшую термостойкость.
[c.47]
К первой группе относят вещества, содержащие в своем составе целлюлозу. Эти наполнители снижают хрупкость смолы, позволяют сохранить низкий удельный вес, но придают пластической массе большую гигроскопичность и меньшую термостойкость.
[c.47]
Порошкообразный Фенольно-формальдегидные смолы (в том числе модифицированные) Без наполнителя Органический (древесная мука) Минеральный (кварц, слюда) 140—250 150-350 250-450 130—160 150—190 160—180 [c.143]
Красные и оранжевые пигменты. Киноварь искусственная представляет собой краску красного цвета различных оттенков получается осаждением или смешением с наполнителями органических пигментов пара-красного НК, пигмента красного С, пигмента алого. В качестве наполнителей служат шпат, известняк, мрамор или отмученный мел. [c.117]
Исходными материалами для получения пластмассовых изделий являются прессовочные порошки (пресспорошки) и прессовочные материалы (прессматериалы). Последние представляют собой связующие и другие компоненты с волокнистыми наполнителями органического (кусочки бумаги, волокна и др.) и неорганического (асбест и др.) происхождения.
[c.75]
Последние представляют собой связующие и другие компоненты с волокнистыми наполнителями органического (кусочки бумаги, волокна и др.) и неорганического (асбест и др.) происхождения.
[c.75]
Одним из способов транспортирования ТСМ в зону контакта является введение в формовочную массу для изготовления абразивного инструмента наполнителей (органических и неорганических соединений) [7, 9, 13]. При температуре шлифования эти соединения разлагаются с выделением реакционно-способных продуктов или вступают во взаимодействие с обрабатываемым материалом, снижая реакционную способность вновь образующихся ювенильных поверхностей [7, 13]. [c.437]
Наиболее механически прочными являются слоистые пластики с листовыми волокнистыми наполнителями органического и минерального происхождения (древесный шпон, стеклянные, хлопчатобумажные и асбестовые ткани, бумага и т. п.). [c.509]
Материалы первой группы слоистой и волокнистой структуры представляют собой композицию из искусственных смол и наполнителей органического или минерального происхождения. Слоистые и волокнистые пластмассы изготовляют прессованием волокнистых материалов, пропитанных связующими веществами — смолами.
[c.17]
Слоистые и волокнистые пластмассы изготовляют прессованием волокнистых материалов, пропитанных связующими веществами — смолами.
[c.17]
Наполнители вводят для улучшения физико-механических свойств пластмасс и повышения их экономичности. Наполнители делятся на органические и неорганические. [c.342]
Органические наполнители — это материалы на основе целлюлозы. Они снижают хрупкость смол и сохраняют малый удельный вес, однако увеличивают гигроскопичность и уменьшают термостойкость пластмасс. [c.342]
Неорганические наполнители увеличивают хрупкость пластмасс, но повышают теплостойкость и улучшают электроизоляционные свойства. При формовании у пластмасс с неорганическими (минеральными) наполнителями усадка значительно меньше, чем у пластмасс о органическими наполнителями. [c.342]
В некоторых случаях изготовляют пластмассы без наполнителей это или прозрачные (типа органического стекла) или отдельные непрозрачные композиции. [c.343]
[c.343]
Пластические массы представляют собой материалы на основе высокомолекулярных органических соединений, обладающие в определенной фазе своего производства пластичностью, позволяющей формовать изделия. Кроме основы, служащей связующим, многие пластмассы имеют так называемый наполнитель для повышения механических свойств, обычно 40…70 %, и небольшие добавки — пластификаторы, смазочные материал >1, красители. Наполнители позволяют сильно изменять свойства пластмасс, например стеклопластики и углепластики имеют даже прочность стали, а газонаполненные (азотом, воздухом) пластики обладают малой плотностью, низкой теплопровод- [c.37]
Органическими наполнителями являются древесная мука, целлюлоза, бумага, хлопчатобумажная ткань. В качестве неорганических наполнителей используют асбест, графит, стеклоткань, слюду, кварц и другие материалы. [c.43]
Изготовление и переработка прессматерналов с волокнистыми наполнителями (органическими и неорганическими) подобны производству и переработке прессматериалов с порошкообразными наполнителями. В качестве связующего вещества для пластмасс с волокнистыми наполнителями применяют термореактивные смолы феноло-формальдегидные (и их производные), амино-формальдегидные, полиэфирные, полисилоксановые и др.
[c.356]
В качестве связующего вещества для пластмасс с волокнистыми наполнителями применяют термореактивные смолы феноло-формальдегидные (и их производные), амино-формальдегидные, полиэфирные, полисилоксановые и др.
[c.356]
Связующее — новолачная и резольные фенолформаль-дегидные смолы (или их модификации) наполнитель— органический, минеральный, их смесь [c.550]
Битумно-каучуковый оберточный материал бикарул представляет собо смесь, состоящую из нефтяного битума, синтетических каучуков и наполнителей органических или минеральных. В рулоне внутренняя поверхность бикарула припудривается тонкоизмельченным мелом или асбестом. Бикарул наносят на трубопровод поверх изоляционной мастики с натяжением без резкого растягивания обеспечивая удлинение не более 5 %. [c.66]
Водопоглош,аемость зависит, очевидно, от вида полимера и типа наполнителя. Органические наполнители в основном увеличивают водопоглощение, минеральные — наоборот.
 Пленки, чаще всего пористые, поглощают воду быстрее, чем блоки.
[c.35]
Пленки, чаще всего пористые, поглощают воду быстрее, чем блоки.
[c.35]Для изделий бытового назначения (посуда, тара) и отдельных деталей общего приборостроения (рукоятки, ручки, кнопки, клавиши, крышки) применяют пресспорошки на основе мочевино-формаль-дегидной смолы, сочетая ее с целлюлозой, выполняющей функцию наполнителя. Такие композиции, называемые аминопластами, выгодно отличаются от фенопластов бесцветностью, способностью окрашиваться в любые цвета и безвредностью. Однако смола начинает разрушаться уже при температуре выше 145° С, поэтому ее обычно сочетают с наполнителями органического происхождения. К тому же смола обладает повышенной влагоемкостью (до 0,7% при 20° С), быстро нарастающей с повышением температуры. Эти дефекты аминопластов сужают возможности их применения. [c.65]
В органопластиках матрицей обычно служит эпоксидная смола, а наполнителем — органическое или синтетическое волокно (полиамидные или полиэтилентерефталатные волокна). Органопластики -это полимеры, наполненные полимерами. Они имеют плотность 1,4 г/см область рабочих температур до 300 °С. При получении органопластиков происходит диффузия компонентов связующего в волокно и их химическое взаимодействие. В результате получается бездефектная структура, пористость которой не превышает 1+3 % (в других материалах 10+20 %). Отсюда стабильность механических свойств органопластиков при резком перепаде температур, при действии ударных и циклических нагрузок. Недостатки этих материалов — сравнительно низкая прочность на сжатие и высокая ползучесть (особенно для эластичных волокон). Поэтому в комбинированных материалах наряду с синтетическими волокнами применяют минеральные (стеклянные, карбоволокна и бороволокна), повышая прочность и жесткость. Органопластики применяют в авиационной и космической технике, авто- и судостроении, электро-и радиотехнической промышленности из них изготавливают трубы, емкости для реактивов и др.
[c.420]
Органопластики -это полимеры, наполненные полимерами. Они имеют плотность 1,4 г/см область рабочих температур до 300 °С. При получении органопластиков происходит диффузия компонентов связующего в волокно и их химическое взаимодействие. В результате получается бездефектная структура, пористость которой не превышает 1+3 % (в других материалах 10+20 %). Отсюда стабильность механических свойств органопластиков при резком перепаде температур, при действии ударных и циклических нагрузок. Недостатки этих материалов — сравнительно низкая прочность на сжатие и высокая ползучесть (особенно для эластичных волокон). Поэтому в комбинированных материалах наряду с синтетическими волокнами применяют минеральные (стеклянные, карбоволокна и бороволокна), повышая прочность и жесткость. Органопластики применяют в авиационной и космической технике, авто- и судостроении, электро-и радиотехнической промышленности из них изготавливают трубы, емкости для реактивов и др.
[c.420]
Все огромное разнообразие современных пластмасс по обрабатьшаемости резанием обьединяют в пять групп (табл. 2.1.14). Обрабатываемость пластмассы, режим обработки резанием которой не известен, устанавливают в последовательности 1) по стандарту на рассматриваемую пластмассу устанавливают термопластичное (ТП) или термореактивное (РП) полимерное связующее пластмассы 2) по стандарту определяют природу наполнителя — органическая (ОРГ) или неорганическая (НОР) 3) по стандарту устанавливают структуру наполнителя — порошок, волокно, ткань и др. 4) сопоставляя установленные по стандарту данные о пластмассе, определяют группу обрабатываемости.
[c.138]
2.1.14). Обрабатываемость пластмассы, режим обработки резанием которой не известен, устанавливают в последовательности 1) по стандарту на рассматриваемую пластмассу устанавливают термопластичное (ТП) или термореактивное (РП) полимерное связующее пластмассы 2) по стандарту определяют природу наполнителя — органическая (ОРГ) или неорганическая (НОР) 3) по стандарту устанавливают структуру наполнителя — порошок, волокно, ткань и др. 4) сопоставляя установленные по стандарту данные о пластмассе, определяют группу обрабатываемости.
[c.138]
Состав резин и эластотермопластов. Роль порошковых наполнителей (саж, окиси кремния ) и волокнистых наполнителей ( органические, стеклянные, металлические волокна и корды ). Свойства и области применения резин и эластотермопластов. [c.11]
Помимо связующего в состав композ1щионных пластмасс входят следующие составляющие 1) наполнители различного происхождения для повышения механической прочности, теплостойкости, уменьшения усадки и снижения стоимости композиции органические наполнители — древесная мука, хлопковые очесы, целлюлоза, хлопчатобумажная ткань, бумага, древесный шпон и др. неорганические — графит, асбест, кварц, стекловолокно, стеклоткань и др. 2) пластификаторы (дибутилфталат, кастровое масло и др.), увели-чнийю цие эластичность, текучесть, гибкость и уменьшающие хрупкость п. тастмасс 3) смазочные вещества (стеарин, олеиновая кислота и др.), увеличивающие текучесть, уменьшающие трение между частицами композиций, устраняющие прилипание к формообразующим поверхностям пресс-форм, 4) катализаторы (известь, магнезия и др.), ускоряющие процесс отверждения материала 5) красители (сурик, нигрозин и др.), придающие нужный цвет изготовляемым деталям,
[c.428]
неорганические — графит, асбест, кварц, стекловолокно, стеклоткань и др. 2) пластификаторы (дибутилфталат, кастровое масло и др.), увели-чнийю цие эластичность, текучесть, гибкость и уменьшающие хрупкость п. тастмасс 3) смазочные вещества (стеарин, олеиновая кислота и др.), увеличивающие текучесть, уменьшающие трение между частицами композиций, устраняющие прилипание к формообразующим поверхностям пресс-форм, 4) катализаторы (известь, магнезия и др.), ускоряющие процесс отверждения материала 5) красители (сурик, нигрозин и др.), придающие нужный цвет изготовляемым деталям,
[c.428]
Стойкость режущего инструмента различная в зависимости от типа обрабатываемого материала и материала инструмента. Незначительный износ наблюдается при обработке термопластов без на-нолпителя. При обработке реактопластов особенно со стеклянными и другим[1 подобными наполнителями, стойкость режущего инструмента значительно снижается. Заготовки из термопластов (органического стекла, полистирола, фторопласта и т. д.) можно обрабатывать режущими инструментами из углеродистых и быстрорежущих сталс . Материалы, оказывающие абразивное действие, обрабатывают инструментами, оснащенными твердым сплавом, алмазом, эльбором.
[c.442]
д.) можно обрабатывать режущими инструментами из углеродистых и быстрорежущих сталс . Материалы, оказывающие абразивное действие, обрабатывают инструментами, оснащенными твердым сплавом, алмазом, эльбором.
[c.442]
Химическая стойкость резин в первуо очередь определяется видом каучука, его строением, наполнителем, вулканизующими агентами и другими факторами. Подавляющее большинство резин стойки в растворах щелочей и кислот, главным образом,разбавленных, в растворах солеи, а некоторые из них и в отдельных органических растворителях аслах, бензинах, алифатических углеводородах, спиртах. Химически стойкие резины на основе бутилкаучука, наирита, фторкаучуков, этилен-пропи-леновых и других каучуков обладает повышенной по сравнению с остальными резинами химической стойкостью. [c.69]
Пленкообразующее вещество — это основной компонент, обладающий хорошей адгезией (сцеплением) с окрашйва,емой поверхностью и являющийся связующим для порошкообразных компонентов (пигментов и наполнителей). Пленкообразующие вещества должны быть стойкими и прочными в условиях эксплуатации, химически нейтральными по своей природе они относятся к веществам органического происхождения. Пленкообразующие в нормальных условиях являются твердыми веществами или вязкими жидкостями, которые необходимо предварительно растворить до определенной вязкости. В машиностроении применяют лакокрасочные материалы на основе водонерастворимых пленкообразующих они не вызывают коррозии металлов и дают более качественные покрытия. К их числу относятся растительные масла, смолы, эфиры целлюлозы, жидкое стекло и др.
[c.397]
Пленкообразующие вещества должны быть стойкими и прочными в условиях эксплуатации, химически нейтральными по своей природе они относятся к веществам органического происхождения. Пленкообразующие в нормальных условиях являются твердыми веществами или вязкими жидкостями, которые необходимо предварительно растворить до определенной вязкости. В машиностроении применяют лакокрасочные материалы на основе водонерастворимых пленкообразующих они не вызывают коррозии металлов и дают более качественные покрытия. К их числу относятся растительные масла, смолы, эфиры целлюлозы, жидкое стекло и др.
[c.397]
Наполнители применяют органические и неорганические они служат для модификации свойств материала, улучшения физи-ко-ме.чанических, фрикционных и других свойств материала, а также для снижения его стоимости. [c.43]
Мел является органическим или неорганическим соединением? – Nosubjectlosangeles.
 com
comЯвляется ли мел органическим или неорганическим соединением?
Мел имеет органическое происхождение. Он формировался в течение миллионов лет из защитных покровов мелких организмов, обитавших в морях и океанах.
Является ли мел неорганическим соединением?
Соединения углерода, такие как карбиды (например, карбид кремния [SiC2]), некоторые карбонаты (например, карбонат кальция [CaCO3]), некоторые цианиды (например, цианид натрия [NaCN]), графит, двуокись углерода и окись углерода классифицируются как неорганический.…
Почему мел неорганическое вещество?
Карбонат кальция CaCO3 считается неорганическим соединением, поскольку он не является углеродно-водородной основой. Органическое соединение – содержит только углерод и водород.
Является ли серебро органическим или неорганическим?
Цианат серебра фактически классифицируется как ионное соединение, поскольку он содержит как металлические, так и неметаллические элементы. Очевидно, что нашим металлом является серебро, а углерод, кислород и азот считаются неметаллами.
Очевидно, что нашим металлом является серебро, а углерод, кислород и азот считаются неметаллами.
Какие 4 неорганических соединения?
В целом существует четыре группы типов неорганических соединений.Они делятся на основания, кислоты, соли и воду. Обратите внимание, что это самые широкие категории неорганических соединений.
В чем разница между органическими соединениями и неорганическими?
Основное различие между этими органическими соединениями и неорганическими соединениями заключается в том, что органические соединения всегда имеют атом углерода, в то время как большинство неорганических соединений не содержат в себе атома углерода. Почти все органические соединения содержат в себе углерод-водородную или простую связь С-Н.
Можно ли есть мел?
Хотя мел минимально токсичен, не ядовит в небольших количествах и может не причинить вам вреда, есть мел не рекомендуется. Однако модель поедания мела — это совсем другая история. Употребление мела часто может нарушить работу пищеварительной системы и повредить внутренние органы.
Является ли витамин С органическим или неорганическим?
Аскорбиновая кислота, также известная как витамин С или L-аскорбиновая кислота, представляет собой встречающееся в природе органическое соединение с антиоксидантными свойствами.Аскорбиновая кислота содержится в растениях и продуктах питания, в том числе в цитрусовых, томатах и зеленых овощах.
Какие 5 органических соединений?
В физиологии человека важны пять функциональных групп; это гидроксильная, карбоксильная, амино, метильная и фосфатная группы (табл. 2.1). Гидроксильные группы полярны. Они являются компонентами всех четырех типов органических соединений, обсуждаемых в этой главе.
Какие существуют типы неорганических?
Типы неорганических соединений.В целом существует четыре группы типов неорганических соединений. Они делятся на основания, кислоты, соли и воду. Обратите внимание, что это самые широкие категории неорганических соединений.
Каковы четыре основные категории неорганических соединений?
Встречается ли мел в природе?
Мел, как в природном, так и в искусственном виде, имеет белый цвет и считается довольно мягким твердым веществом. Естественно, он происходит из-под земли, где он находится в виде пористой (может удерживать воду) осадочной породы.Это форма известняка, состоящая из минерального кальцита.
Естественно, он происходит из-под земли, где он находится в виде пористой (может удерживать воду) осадочной породы.Это форма известняка, состоящая из минерального кальцита.
Какой мел лучше есть?
Лучший мел для еды — это натуральный мел без добавления химикатов. Мел, продаваемый в розничных магазинах, содержит вредные добавки и химикаты. Наша самая продаваемая глина — белый горный мел, который имеет самый простой вкус мела.
Является ли витамин С органическим соединением?
Является ли мел неорганическим соединением? — Ответы на все
Является ли мел неорганическим соединением?
Мел представляет собой форму известняка, осадочной породы, точнее органической осадочной породы.Он мягкий, белый и пористый. Известняк – самая распространенная из химических осадочных пород; образуются либо в результате неорганических осадков, либо в результате биохимических процессов.
Это органическое или неорганическое соединение?
Органические и неорганические соединения
| Органические соединения | |
|---|---|
| Химическое соединение | Ковалентная связь; в основном с углерод-водородными (C-H) связями |
| Происхождение | По существу биологические (в результате биологической активности) |
| Соляные образования | Не может образовывать соль |
| Атомы металлов | Не содержат атомов металлов |
Является ли кристалл органическим или неорганическим?
Минералы — это неорганические кристаллы, которые не являются производными каких-либо живых организмов. Кристаллы могут образовываться и из органических соединений. Например, сахар (получаемый из растений) может образовывать кристаллы, но, поскольку сахар состоит из органического материала, эти кристаллы не являются минералами.
Кристаллы могут образовываться и из органических соединений. Например, сахар (получаемый из растений) может образовывать кристаллы, но, поскольку сахар состоит из органического материала, эти кристаллы не являются минералами.
Почему мел неорганическое вещество?
Мел имеет органическое происхождение. Он формировался в течение миллионов лет из защитных покровов мелких организмов, обитавших в морях и океанах. В некоторых случаях движения земли поднимали из воды меловые отложения, как в случае с Белыми скалами Дувра.Мел до сих пор образуется живыми существами.
Какое свойство мела?
Мел представляет собой необломочную карбонатную осадочную породу, представляющую собой форму известняка, состоящего из минерального кальцита. Он мягкий, мелкозернистый и легко измельчается. Поскольку мел хорошо трещиноватый, он может удерживать большой объем грунтовых вод, создавая естественный резервуар, который медленно высвобождает воду в засушливые сезоны.
Является ли соль органической или неорганической?
Однако такие соли, как поваренная соль (хлорид натрия), пищевая сода (хлорид натрия), карбонат кальция и соляная кислота (соляная кислота промышленного класса), являются одними из широко известных неорганических соединений. Итак, чтобы подчеркнуть это, поваренная соль или пищевая соль, которую потребляют люди, являются неорганическими соединениями.
Итак, чтобы подчеркнуть это, поваренная соль или пищевая соль, которую потребляют люди, являются неорганическими соединениями.
Откуда берется кальций в меле?
Мел представляет собой разновидность известняка, состоящего в основном из карбоната кальция, полученного из раковин крошечных морских животных, известных как фораминиферы, и из известковых остатков морских водорослей, известных как кокколиты.
Какого цвета мел?
Мел обычно белого или светло-серого цвета. Он чрезвычайно пористый, проницаемый, мягкий и рыхлый.Бентические фораминиферы: изображения шести различных бентических фораминифер, полученные с помощью сканирующего электронного микроскопа.
Какие окаменелости находятся в меловом известняке?
Морской известняк, состоящий в основном из остатков фораминифер и водорослей. Известняковый мел: Мелкозернистый светлый известняковый мел, образованный из карбоната кальция скелетных останков крошечных морских организмов. Что такое мел?
Где в мире добывают крупный мел?
Грубый мел: Образец крупнозернистого мела из бассейна Кристианстад мелового периода, собранный в гравийном карьере недалеко от общины Люнебург, северная Германия. Этот образец из геологической коллекции Городского музея Берлина, и изображение используется в соответствии с лицензией Creative Commons.
Этот образец из геологической коллекции Городского музея Берлина, и изображение используется в соответствии с лицензией Creative Commons.
Неорганическое вещество – обзор
12.5 Люминесценция кристаллического фосфора
Люминесценция неорганических кристаллов является неотъемлемым свойством кристаллической основы, поэтому ее необходимо анализировать на основе ленточной схемы. Многие неорганические вещества люминесцируют при облучении, и такие вещества называются кристаллолюминофорами.Если длительность свечения при мгновенном возбуждении меньше ~1 мкс, то такой кристаллический фосфор считается сцинтиллятором, а если больше — люминофором.
Зонная схема кристалла представлена на рис. 12.8. Заряженная частица переносит электрон из валентной зоны в зону проводимости, создавая электронно-дырочную пару.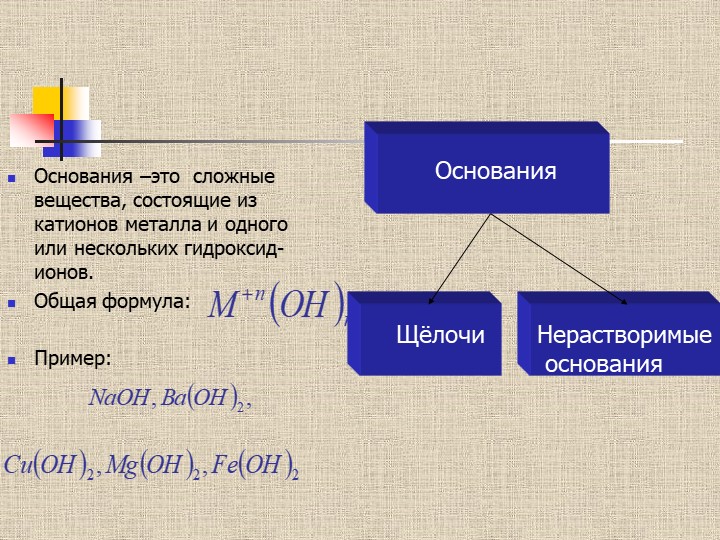 Часть энергии частица тратит на создание экситонов. Образовавшиеся электроны и дырки рекомбинируют, как правило, через какой-либо локальный центр, расположенный в запрещенной зоне и называемый центром люминесценции или центром рекомбинации.Такими центрами обычно являются специально введенные в вещество атомы примеси, называемой активатором.
Часть энергии частица тратит на создание экситонов. Образовавшиеся электроны и дырки рекомбинируют, как правило, через какой-либо локальный центр, расположенный в запрещенной зоне и называемый центром люминесценции или центром рекомбинации.Такими центрами обычно являются специально введенные в вещество атомы примеси, называемой активатором.
Рисунок 12.8. Зонная схема кристаллолюминофора. На этой схеме показана рекомбинация электрона с центром Tl ++ .
Одним из самых известных и широко изученных типов кристаллолюминофоров являются щелочно-галоидные кристаллы. Практически все галогениды щелочных металлов люминесцируют при определенной активации, но лучшими сцинтилляционными свойствами обладают иодиды щелочных металлов, такие как NaI, CsI и LiI.
Первый универсальный неорганический сцинтиллятор представляет собой кристалл йодида натрия, активированный таллием, NaI(Tl). Около 0,1% соли TlI смешивают с солью NaI, смесь расплавляют и из расплава выращивают крупные, совершенные и прозрачные монокристаллы. Кристалл NaI представляет собой типичный ионный кристалл, построенный из ионов Na + и I – . Ионы Tl + замещают ионы Na + в узлах кристаллической решетки.
Кристалл NaI представляет собой типичный ионный кристалл, построенный из ионов Na + и I – . Ионы Tl + замещают ионы Na + в узлах кристаллической решетки.
Зона проводимости кристалла образована незаполненными уровнями 3s Na (один 3s электрон от атома натрия переходит к атому йода).Валентная зона кристалла полностью образована 5р-уровнями йода.
Под ионизацией решетки понимается отрыв электрона от I – с образованием нейтрального атома йода и переход электрона на ион натрия с образованием нейтрального атома натрия. Дырка в щелочно-галоидных кристаллах быстро самолокализуется в течение нескольких периодов колебаний решетки, и электрон оказывается принадлежащим двум соседним атомам йода, т.е.т. е. молекулярная конфигурация I2– соответствует автолокализованной дырке. Это самозапирающееся отверстие называется центром V K .
При низких температурах центр V K неподвижен, а при комнатных температурах может перемещаться прыжковым механизмом.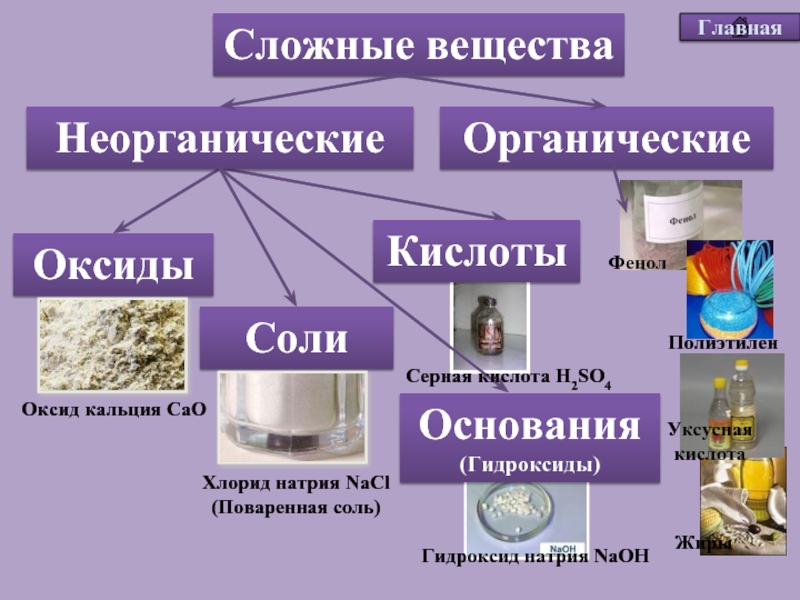
Рекомбинация электрона с центром V K соответствует реакции
(12.23)I2−+e→I22−∗→2I–+hν
Возбужденный ион молекулярного йода переходит в основное состояние с испусканием кванта света.Энергия этих квантов лежит в ультрафиолетовой области спектра.
Излучательная рекомбинация электронов с центром V K очень эффективна, но только при низкой (азотной) температуре. При комнатной температуре это излучение почти полностью гасится. Для получения эффективной люминесценции при комнатной температуре в кристалл вводят активатор. В случае NaI это таллий. Таллий — элемент третьего столбца таблицы Менделеева, а электронная конфигурация внешней оболочки — 6s 2 6p 1 .Ионы таллия создают центры рекомбинации. Из элементарных энергетических соображений можно определить, что первыми захватываются электроны. Это соответствует реакции
(12,24)Tl++e→Tl0.
Затем происходит рекомбинация дырки с центром Tl 0 , в возбужденном состоянии возникает ион Tl + , после чего с системой уровней этого центра люминесценции связаны достаточно сложные процессы излучения.
Кристалл NaI(Tl) имеет существенный недостаток — он очень гигроскопичен.В нераспакованном виде хрусталь поглощает влагу из воздуха и растворяется в нем, а йод окрашивает все в желтый цвет. Поэтому сразу после выращивания кристаллы помещают в герметичные сухие ящики, и в этих ящиках проводят их обработку — резку, полировку и помещение в герметичную упаковку. В тех случаях, когда желательно иметь на пути излучения как можно меньше балластного материала, мешающим фактором является упаковка сцинтиллятора.
Другие щелочно-галоидные кристаллы, например CsI(Tl), CsI(Na) и LiI(Eu), обладают хорошими сцинтилляционными свойствами.
Экран, с помощью которого В. Рентген обнаружил излучение, был покрыт слоем люминесцентного платиноцианида бария BaPt (CN 6 ). В первом приборе, позволявшем наблюдать отдельные альфа-частицы, использовался спинтарископ Крукса — экран, покрытый слоем сульфида цинка (ZnS). Это вещество используется до настоящего времени; однако вырастить большие прозрачные монокристаллы ZnS очень сложно, и это вещество можно было использовать только в тонких слоях порошка. Вещества типа ZnS, напр.например, ZnS(Ag) или ZnCdS(Ag), обычно активируются серебром. Эти вещества обладают максимальной эффективностью преобразования альфа-частиц, отношение альфа-бета которых составляет около 2, и желто-зеленого света, к которому глаз наиболее чувствителен.
Вещества типа ZnS, напр.например, ZnS(Ag) или ZnCdS(Ag), обычно активируются серебром. Эти вещества обладают максимальной эффективностью преобразования альфа-частиц, отношение альфа-бета которых составляет около 2, и желто-зеленого света, к которому глаз наиболее чувствителен.
В экранах для рентгенографии также используются неорганические люминофоры. Например, вольфрамат кальция (CaWO 4 ) сильно поглощает рентгеновское излучение, так как содержит элемент с большим Z и имеет сине-фиолетовый свет, к которому чувствительна рентгеновская пленка.Такие экраны называются усиливающими экранами.
В шестидесятых годах германат висмута Bi 4 Ge 3 O 12 , BGO использовался в калориметрах. Плотность этого сцинтиллятора составляет 7,12 г/см 3 ; его характеристики приведены в таблице 12.2. Кристаллы германата висмута негигроскопичны, поэтому их можно использовать без специальной упаковки, что значительно снижает количество балластного материала в калориметрах. Меньшая эффективность преобразования по сравнению с NaI(Tl) могла бы стать препятствием при работе с нуклидами естественной активности (∼МэВ), но в физике высоких энергий это не играет существенной роли.Частица с минимальной ионизирующей способностью теряет в кристалле ∼14 МэВ/см.
Меньшая эффективность преобразования по сравнению с NaI(Tl) могла бы стать препятствием при работе с нуклидами естественной активности (∼МэВ), но в физике высоких энергий это не играет существенной роли.Частица с минимальной ионизирующей способностью теряет в кристалле ∼14 МэВ/см.
Большинство неорганических сцинтилляторов имеют время свечения порядка долей или единиц микросекунд. Однако даже среди неорганических кристаллов оказался сцинтиллятор с крайне малой постоянной времени, которым является кристалл BaF 2 . Основные характеристики сцинтиллятора BaF 2 приведены в таблице 12.2. Если для данной экспериментальной задачи важными параметрами являются хорошее время разрешения и высокая точность синхронизации, то кристалл BaF 2 подходит для этого как нельзя лучше.
Ассортимент неорганических сцинтилляторов постоянно расширяется. год за годом появляются сообщения о все новых кристаллах с замечательными свойствами. Например, YAlO 3 (Ce), т. е. перовскит иттрия, также называемый ортоалюминат иттрия (YAP), представляет собой кристалл, нерастворимый в неорганических кислотах, устойчивый к щелочам и негигроскопичный. Кристалл активирован примесью Се с оптимальной массовой концентрацией около 0,2%. Характеристики сцинтиллятора YAP приведены в таблице 12.2. Ожидается, что
е. перовскит иттрия, также называемый ортоалюминат иттрия (YAP), представляет собой кристалл, нерастворимый в неорганических кислотах, устойчивый к щелочам и негигроскопичный. Кристалл активирован примесью Се с оптимальной массовой концентрацией около 0,2%. Характеристики сцинтиллятора YAP приведены в таблице 12.2. Ожидается, что
Кристаллы вольфрамата кадмия, CdWO 4 , (CWO), будут внедрены в радиометрию по ряду характеристик, превосходящих BGO. Также, обладая высокой эффективностью регистрации, сцинтилляторы CWO имеют лучшее разрешение, большую светоотдачу и меньшую зависимость от температуры окружающей среды.
Сцинтилляционные кристаллы бромида лантана, легированного церием LaBr 3 (Ce), имеют более высокое энергетическое разрешение и меньшее время затухания, чем традиционные кристаллы NaI(Tl).Энергетическое разрешение для гамма-излучения 662 кэВ составляет 2,9 % (19 кэВ), а для кристалла NaI(Tl) того же размера в тех же условиях разрешение составляет 6 %, включая более высокую эффективность регистрации и хорошую температурную стабильность.
УглеродЖизнь основана на химических и физических свойствах элемента углерода. Это немногое вещество, и оно составляет всего около 0,025 процента земной коры.Однако углерод реагирует с большим количеством других атомов и образует больше соединений, чем все остальные элементы вместе взятые.Чистый углерод можно найти в трех различных формах; алмаз, графит и сажа. Алмаз и графит являются кристаллическими, но различаются по способу расположения атомов. Алмаз — самое твердое известное природное вещество, тогда как графит мягкий и скользкий. Графит также является хорошим проводником как тепла, так и электричества и используется в качестве смазки и в качестве «грифа» карандашей.И алмаз, и графит можно получить искусственно, и он обычно инертен, но при определенных обстоятельствах его можно соединить с кислородом. Бриллианты горят. Технический углерод является аморфным. Соединения углеродаОколо 0,03 процента (по объему) земной атмосферы составляет углекислый газ, и больше углерода содержится в виде мрамора, известняка, мела, угля, нефти и природного газа в земной коре. Ученые-люди открыли или синтезировали более 1 000 000 соединений углерода, и каждый год к этому списку добавляется много новых. Это разнообразие органических форм проистекает из способности углерода
атомы объединяться не только с другими атомами углерода, но и с большим разнообразием других атомов.Соединения углерода и их химия представляют собой специализированную область исследований, называемую органической химией, названную так потому, что ранние химики считали, что все соединения углерода возникли в живых организмах. Органические соединения углерода составляют около 18 процентов всего вещества живых существ. В этих молекулах углерод соединяется с водородом, азотом, кислородом, фосфором и серой, образуя большие и малые строительные блоки жизни. |
Реакции элементов основной группы с карбонатами
Ионы карбонатов образуются при реакции угольной кислоты с металлами или органическими соединениями.В этом случае объясняется реакция карбонатов с элементами главной группы и ее продуктами – солями.
Рисунок 1: Карбонат-ион.Химические характеристики
В целом, наиболее распространенными элементами основной группы, используемыми в качестве карбонатов, являются щелочные и щелочные металлы. Все карбонаты основной группы, кроме Na, K, Rb и Cs, неустойчивы к нагреванию и нерастворимы в воде. Обычно все карбонаты растворимы в кислоте из-за образования бикарбонат-иона. Его обычный внешний вид представляет собой белый порошок.Карбонаты в основном используются в качестве сырья в различных промышленных процессах, таких как разработка лекарств, производство стекла, целлюлозно-бумажная промышленность, химические вещества натрия (силикаты), производство мыла и моющих средств, бумажная промышленность, умягчение воды, производство глины и бетона, среди прочего. . Другие карбонаты, такие как карбонат бериллия (BeCO 3 ) и карбонат таллия (Tl 2 CO 3 ), считаются токсичными и используются в производстве фунгицидов и ядов.
. Другие карбонаты, такие как карбонат бериллия (BeCO 3 ) и карбонат таллия (Tl 2 CO 3 ), считаются токсичными и используются в производстве фунгицидов и ядов.
Из элементов основной группы наиболее часто используются карбонат натрия (\(Na_2CO_3\)) и карбонат кальция (\(CaCO_3\)).
Карбонат натрия , известный как кальцинированная сода, является очень важным промышленным химическим веществом. В основном его получают методом Solvay process путем химической реакции известняка (CaCO3) и хлорида натрия (NaCl).
2 NaCl + CaCO 3 → Na 2 CO 3 + CaCl
Na 2 CO 3 обычно используется в производстве стекла, целлюлозно-бумажной промышленности, натриевых химикатах (силикаты), производстве мыла и моющих средств, бумажной промышленности и в умягчителях воды.
Карбонат кальция является основным компонентом известняка (осадочной породы), и его чистое состояние получают в три этапа путем прокаливания известняка и последующей реакции с водой и двуокисью углерода.
Ca(OH) 2 (т) + CO 2 (водн.) → CaCO 3 (т) + H 2 O(ж)
Карбонат кальция обычно используется в производстве стекла, текстиля, красок, бумаги и пластика, в производстве герметиков, для производства чернил и герметика.Он также используется в качестве пищевой добавки (не токсичен), для разработки лекарств и производства мела.
Карбонатная жесткость
Жесткая вода — это термин, используемый в отношении большого количества неорганических соединений, таких как карбонаты, бикарбонаты, сульфаты или хлориды в воде. Наличие высокого уровня карбонатов и бикарбонатов в воде называется временной жесткостью воды. Жесткой считается вода, когда концентрация этого неорганического соединения превышает приблизительные 100 мг/л, и это обычно выражается как количество карбоната кальция, присутствующего в воде.Это важно, когда вода используется в промышленных процессах или в целях очистки.
Осадки образуются, когда неорганические соединения в присутствии высокомолекулярных органических соединений (таких как мыла) образуют нежелательные нерастворимые осадки. Эти осадки являются причиной грязного или серовато-белого цвета и низкой эффективности чистящих средств.
Эти осадки являются причиной грязного или серовато-белого цвета и низкой эффективности чистящих средств.
Другим способом образования осадков является нагревание жесткой воды до высоких температур; его неорганические соединения, такие как карбонат кальция, выпадают в осадок, оставляя отложения в водопроводных трубах или над котлами.Вот пример того, что происходит:
Ca 2 + (водн.)+2HCO 3 − (водн.) → CaCO 3 (тв.) + H 2 O + CO 2
Одним из способов снижения временной жесткости, такой как ионы кальция, является кипячение или добавление гидроксида кальция (извести), но он используется нечасто. Лучший способ смягчить воду — добавить в воду кальцинированную соду или использовать ионообменную колонку.
Карбонаты в моющих средствах
Некоторые карбонаты, такие как карбонат натрия или карбонат калия, используются для изготовления некоторых моющих средств.Кальцинированная сода (другое название карбоната натрия) используется, так как с одной стороны она дешева, а также помогает смягчить воду за счет осаждения карбонатов кальция и магния. Карбонаты калия используются из-за его растворимости.
Карбонаты калия используются из-за его растворимости.
Карбонаты в стекольном производстве
Некоторые неорганические соединения, такие как карбонат кальция, карбонат натрия и карбонат калия, используются в качестве необработанного материала для производства стекла благодаря их химическим характеристикам, высокому качеству и низкой цене. Карбонаты кальция и карбонаты натрия используются в качестве сырья при производстве бумаги из-за их низкой стоимости за счет их использования вместо целлюлозы и для улучшения белизны и блеска бумаги.
Группа 1: Щелочные металлы и карбонаты (X
2 CO 3 )представляет собой реакцию между Li, Na, K, Rb и Cs с CO 3 . Все, кроме лития, растворимы в воде и устойчивы к нагреванию.
Карбонат лития ( Li 2 CO 3 )
- Использование: разработка лекарств.

- Химические характеристики:
- Низкая растворимость в воде.
- Неустойчив к нагреванию.
- Внешний вид: белый порошок без запаха
Карбонат натрия ( Na 2 CO 3 )
- Применение: производство стекла, целлюлозно-бумажная промышленность, химикаты натрия (силикаты), производство мыла и моющих средств, бумажная промышленность и умягчение воды.
- Известный как кальцинированная сода
- Очень важный промышленный химикат
- Химические характеристики:
- Гигроскопическое вещество
- Растворим в воде
- Термостойкий
- Внешний вид: кристально-белое твердое вещество
Карбонат калия ( K 2 CO 3 )
- Применение: производство стекла, производство мягкого мыла, химикаты для текстиля и фотографии.

- Характеристики:
- Гигроскопичен.
- Растворим в воде.
- Может нагреваться до высокой температуры. температуры.
- Внешний вид: белое твердое вещество
Карбонат рубидия ( Rb 2 CO 3 )50
- Применение: производство стекла, производство спирта с короткой цепью.
- Характеристики:
- Гигроскопическое вещество
- Растворим в воде.
- Растворим в воде.
- Может нагреваться до высоких температур.
- Внешний вид: белое твердое вещество.
Карбонат цезия ( Cs 2 CO 3 )50
- Использование: производство прочих солей цезия.

- Характеристики:
- Гигроскопичное вещество.
- Растворим в воде.
- Может нагреваться до высоких температур.
- Внешний вид: белый порошок.
Группа 2: Щелочноземельные металлы и карбонаты (XCO
3 )Это реакция между Be, Mg, Ca, Sr и Ba с CO3. Все они нерастворимы в воде и неустойчивы к нагреванию.
Карбонат бериллия ( BeCO 3 )
Карбонат магния ( MgCO 3 )
- Применение: средства по уходу за кожей, косметика, противопожарные средства, мел для скалолазания.
- Характеристики:
- Нерастворим в воде.
- Гигроскопичное вещество.
- Внешний вид: белое твердое вещество.
Карбонат кальция ( CaCO 3 )
- Использование: текстильная, лакокрасочная, бумажная, пластмассовая, герметизирующая промышленность, используемая для производства чернил и герметиков.
 Он используется в качестве пищевой добавки (не токсичен), для разработки лекарств и производства мела.
Он используется в качестве пищевой добавки (не токсичен), для разработки лекарств и производства мела. - Основной компонент известняка (осадочная порода).
- Характеристики:
- Ответственный за жесткую воду.
- Низкая растворимость в воде.
- Растворим в кислотах.
- Внешний вид: белый порошок.
Карбонат стронция ( SrCO 3 )
- Применение: производство фейерверков, магнитов и керамики.
- Характеристики:
- Низкая растворимость в воде.
- Реагирует с кислотами.
- Нейтрализовать кислоты.
- Гигроскопичное вещество.
- Внешний вид: белый порошок без запаха.
Карбонат бария ( BaCO 3 )
- Применение: производство стекла, цемента, керамики, фарфора, крысиного яда.

- Характеристики:
- Низкая растворимость в воде.
- Внешний вид: белые кристаллы.
Группа 13: Семейство бора и карбонаты (X
2 CO 3 )Является реакцией Al и Tl с CO 3 .Оба нерастворимы в воде и неустойчивы к нагреванию.
алюминиевый карбонат ( AL 2 ( CO 3 ) 3 )
- Использование: разработка лекарств.
- Химические характеристики:
- Внешний вид: белый порошок.
Карбонат таллия ( Tl 2CO 3 )
- Использование: производство фунгицидов.
- Характеристики:
- Токсичный.
- Внешний вид: белые кристаллы без запаха.

Группа 14: Семейство углерода и карбонаты (XCO
3 )Это реакция Pb с CO 3 . Нерастворим в воде и неустойчив к нагреванию
Карбонат свинца ( PbCO 3 )
- Применение: производство стекла, цемента, керамики, фарфора, крысиного яда.
- Характеристики:
- Токсичный.
- Низкая растворимость в воде.
- Внешний вид: белый порошок.
Каталожные номера
- Химия, Б. Ричард Зибринг, Нью-Йорк, 1965, Макмиллан
- Общая химия: принципы и современные приложения, Ральф Х. Петруччи, (10-е издание).
- Химическая энциклопедия Ван Ностранда, Гленн Д. Консидайн, Хобокен, Нью-Джерси: Wiley-Interscience, 5-е изд.
- www.omya.com
- www.nssga.org
Проблемы
1) Какие карбонаты обычно используются в качестве сырья?
Карбонат кальция и карбонат натрия
2) Растворимы ли карбонаты в воде?
Все карбонаты основной группы, кроме Na, K, Rb и Cs, нерастворимы в воде.
3) Какой карбонат отвечает за жесткость воды?
Наиболее распространенный карбонат кальция
4) Какой карбонат можно использовать в качестве умягчителя жесткой воды?
Карбонат натрия (кальцинированная сода)
Удельная теплоемкость обычных веществ
Удельная теплоемкость некоторых обычных продуктов приведены в таблице ниже.
См. также табличные значения для газов, продуктов питания и пищевых продуктов, металлов и полуметаллов, обычных жидкостей и жидкостей и обычных твердых веществ, а также значения молярной удельной теплоемкости для обычных органических веществ и неорганических веществ.
| Сущность | Специфическое тепло — C P — — (J / KG C °) 5 | 1 |
|---|---|---|
| Acetals | 1460 | |
| Air, сухой (море уровень) | 1005 | |
| Агатовые | 800 | |
| спирт, этиловый эфир | 2440 | |
| спирт, metyl дерево) | 2530 | |
| Алюминиевый | 897 | |
| Алюминиевая бронза | 436 | |
Глинозем, А. Л. 2 О 3 Л. 2 О 3 | 718 | |
| Аммиак, жидкий | 4700 | |
| Аммиак, газ | 2060 | |
| Сурьма | 209 | |
| Аргон | 520 | |
| Мышьяк | 348 | |
| Артифи CIAL шерсти | 1357 | |
| Асбест | 816 | |
| асфальтобетона (с наполнителем) | 920 | |
| Барий | 290 | |
| барит | 460 | |
| Бериллий | 1020 | |
| Висмут | 130 | |
| котла шкала | 800 | |
| Кость | 440 | |
| Бор | 960 | |
| нитрид бора | 720 | |
| Латунь | 375 | |
| Кирпич | 840 | |
| Бронзовый | 370 | |
| Браун железная руда | 670 | |
| Кадмий | 234 | |
| Кальций | 532 | |
| Кальциевая силиката, CaSiO 3 900 72 | 710 | |
| целлюлозы, хлопок, древесная целлюлоза и регенерируется | 1300 — 1500 | |
| ацетат целлюлозы, формованная | 1260 — 1800 | |
| ацетат целлюлозы, лист | 1260 — 2100 | |
| Целлюлоза нитрат, Целлулоида | 1300 — 1700 | |
| меловой | 750 | |
| уголь | 840 | |
| Хром | 452 | |
| Chrom оксида | 750 | |
| Клей, песчаный | 1381 | |
| Кобальт | 435 | |
| Кокс | 840 | |
| Бетон | 880 | |
| константан | 410 | |
| Медь | 385 | |
| Пробка | 2000 | |
| Алмаз (углерод) | 516 | |
| Duralium | 920 | |
| Эмери | 960 | |
| Эпоксидные литые смол | 1000 | |
| огнеупорного кирпича | 880 | |
| плавикового шпата CaF 2 | 830 | |
| Дихлордифторметан R 12, жидкий | 871 | |
| Дихлордифторметан R 12, пара | 595 | |
| Лед (0 о С) | 2093 | |
| каучук | 1250 | |
| Стекло, корона | 670 По | |
| стекло, Pyrex | 753 | |
| Стеклянная вата | 840 | |
| Золото | 129 | |
| Гранит | 790 | |
| графит (углерод) | 717 | |
| Гипс 9007 2 | 1090 | |
| Гелий 5193 | ||
| Водород 14304 | ||
| лед, снег (-5 о С) | 2090 | |
| Слиток железа | 490 | |
| Йод | 218 | |
| Иридий | 134 | |
| Железный | 449 | |
| Свинец | 129 | |
| Кожа | 1500 | |
| Известняк | 909 | |
| литий- | 3582 | |
| люсита | 1460 | |
| магнезия (оксид Mangnesium), MgO, | 874 | |
| магния | 1050 | |
| магниевого сплава | 1010 | |
| Марганец | 460 | |
| Мрамор | 880 90 072 | |
| Ртуть | 140 | |
| Слюда | 880 | |
| Молибден | 272 | |
| Неон | 1030 | |
| Никель | 461 | |
| Азот | 1040 | |
| нейлон-6 | 1600 | |
| Нейлон-66 | 1700 | |
| Оливковое масло | 1790 | |
| осмий | 130 | |
| Кислород | 918 | |
| Палладий | 240 | |
| Бумага | 1336 | |
| Парафин | 3260 | |
| Торф | 1900 | |
| Перлит | 387 | |
| Фенольные литой смолы | 1250 — 1670 | |
| Фенол -формальдегидное литье фунтов | 2500 — 6000 | |
| Phosphorbonze | 360 | |
| Фосфор | 800 | |
| Пинчбек | 380 | |
| Пит уголь | 1020 | |
| Платина | 133 | |
| плутонием | 140 | |
| Поликарбонаты | 1170 — 1250 | |
| Полиэтилентерефталат | 1250 | |
| полиимида ароматика | 1120 | |
| полиизопрен натуральный каучук | 1880 | |
| полиизопрен твердой резины | 1380 | 1380 |
| полиметилметакрилат | 1500 | |
| 19205 | ||
| Полистирол | 1300 — 1500 | |
| Polytetrafluethylele Moul динг соединение | +1 тысяче | |
| политетрафторэтилена (ПТФЭ) | тысяча сто семьдесят два | |
| Полиуретановые литые жидкости | 1800 | |
| Полиуретановый эластомер | 1800 | |
| Поливинилхлорид ПВХ | 840 — 1170 | |
| Фарфор | 1085 | |
| хлорид калия | +1 тысяча | |
| Калий | 680 | |
| ситалла | 710 | |
| кварца, SiO 2 | 730 | |
| Кварцевое стекло | 700 | |
| Красный металл | 381 | |
| рений 140 | ||
| родий 240 | ||
| Канифоль 1300 | ||
| рубидий 330 | ||
| Соль, NaCl | 880 | |
| Песок, кварц | 830 | |
| Песчаник | 710 | |
| скандия | 568 | |
| Селен | 330 | |
| кремния | 705 | |
| карбид кремния | 670 По | |
| Серебро | 235 | |
| шифера | 760 | |
| натрия | 1260 | |
| почвы, сухой | 800 | |
| почвы, влажные | 1480 | |
| Сажа | 840 | |
| снег | 2090 | |
| Стеатит | 830 | |
| Сталь | 490 | |
| Сера, кристаллический | 700 | |
| тантала | 138 | |
| Теллури гм | 201 | |
| Торий | 140 | |
| пиломатериалы, ольха | 1400 | |
| Древесина, золы | 1600 | |
| Древесина, береза | 1900 | |
| древесине лиственницы | +1400 | |
| Древесина, клен | 1600 | |
| пиломатериалы, дуб | две тысячи четыреста | |
| Древесина, pitchpine | +1300 | |
| Древесина, pockwood | 2500 | |
| Timber, красный бук | 1300 | |
| Пиломатериал, красной сосны | 1500 | |
| Пиломатериал, белая сосна | 1500 | |
| Пиломатериал, грецкий | 1400 | |
| Олово | 228 | |
| Titanium | 523 | |
| Вольфрам | 132 | вольфрамовый карбид | 171 | 171 |
| Uranium | 116 | |
| 50071 | 500 | |
| Вода, чистая жидкость (20 o C) | 4182 | |
| Вода, паров (27 O C) | 1864 | |
| 2512 | 2512 | |
| 13007 — 2400 | ||
| Zink | 388 |
- 1 Calorie = 4.
 186 Joules = 0.001 BTU / LB M O F
186 Joules = 0.001 BTU / LB M O F - 1 Cal / Gram C O = 4186 J / KG O C
- 1 J / KG C O = 10 -3 кДж/кг K = 10 -3 Дж/г C o = 10 -6 кДж/г C o = 2,389×10 -4 БТЕ/(фунт 3 м F)
Для перевода единиц используйте онлайн-конвертер единиц Удельная теплоемкость.
См. также табличные значения для газов, пищевых продуктов и пищевых продуктов, металлов и полуметаллов, обычных жидкостей и жидкостей и обычных твердых тел, а также значения молярной теплоемкости для обычных органических и неорганических веществ.
Сравнение трех методов определения содержания органического и неорганического углерода в известняковых почвах Северо-Западного Китая
Abstract
В связи с растущим интересом к углеродному циклу на засушливых землях возникает острая необходимость в количественном определении как почвенного органического углерода (SOC), так и неорганического углерода (SIC) для оценки различных методов. Здесь мы представляем исследование с использованием трех методов определения SOC и SIC в бассейне Яньци на северо-западе Китая. Мы используем элементный анализатор как для SOC, так и для SIC, метод Уокли-Блэка для SOC, модифицированный метод кальциметра давления для SIC и простую процедуру определения потерь при прокаливании (LOI) для определения SOC и SIC.Наш анализ показывает, что все три подхода дают последовательно низкие значения SOC (1–14 г/кг –1 ) и высокие значения SIC (8–53 г/кг –1 ). Метод Уолкли-Блэка обеспечивает точную оценку SOC со 100% извлечением для большинства образцов почвы. Метод кальциметра давления так же точен, как и элементный анализ для измерения SIC. Кроме того, SOC и SIC можно точно оценить, используя двухэтапный подход LOI, т. е. (1) сжигание при 375°C в течение 17 часов для оценки SOC и (2) последующее сжигание при 800°C в течение 12 часов для оценки НИЦ.Между элементным анализом и методом LOI существуют сильные линейные зависимости как для SOC, так и для SIC, что демонстрирует возможности двухэтапного метода LOI для оценки SOC и SIC в этом засушливом регионе.
Здесь мы представляем исследование с использованием трех методов определения SOC и SIC в бассейне Яньци на северо-западе Китая. Мы используем элементный анализатор как для SOC, так и для SIC, метод Уокли-Блэка для SOC, модифицированный метод кальциметра давления для SIC и простую процедуру определения потерь при прокаливании (LOI) для определения SOC и SIC.Наш анализ показывает, что все три подхода дают последовательно низкие значения SOC (1–14 г/кг –1 ) и высокие значения SIC (8–53 г/кг –1 ). Метод Уолкли-Блэка обеспечивает точную оценку SOC со 100% извлечением для большинства образцов почвы. Метод кальциметра давления так же точен, как и элементный анализ для измерения SIC. Кроме того, SOC и SIC можно точно оценить, используя двухэтапный подход LOI, т. е. (1) сжигание при 375°C в течение 17 часов для оценки SOC и (2) последующее сжигание при 800°C в течение 12 часов для оценки НИЦ.Между элементным анализом и методом LOI существуют сильные линейные зависимости как для SOC, так и для SIC, что демонстрирует возможности двухэтапного метода LOI для оценки SOC и SIC в этом засушливом регионе.
Образец цитирования: Wang X, Wang J, Zhang J (2012) Сравнение трех методов определения содержания органического и неорганического углерода в известняковых почвах Северо-Западного Китая. ПЛОС ОДИН 7(8): е44334. https://doi.org/10.1371/journal.pone.0044334
Редактор: Дэвид Л.Кирхман, Университет Делавэра, Соединенные Штаты Америки
Поступила в редакцию: 22 мая 2012 г.; Принято: 1 августа 2012 г.; Опубликовано: 31 августа 2012 г.
Авторское право: © Wang et al. Это статья с открытым доступом, распространяемая в соответствии с лицензией Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания оригинального автора и источника.
Финансирование: Это исследование финансируется Программой 100 талантливых молодых ученых Китайской академии наук (O972021001) (http://www.cas.cn/ggzy/rcpy/brjh/). Спонсоры не участвовали в разработке исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Конкурирующие интересы: Авторы заявили об отсутствии конкурирующих интересов.
Введение
Запасы углерода в почве, как третий по величине запас углерода в системе Земля, играют важную роль в глобальном углеродном цикле и изменении климата [1]. Большая часть углерода в большинстве почв содержится в виде почвенного органического углерода (ПОУ), тогда как в почвах засушливых и семизасушливых регионов наиболее распространенной формой является неорганический углерод, прежде всего карбонат [2].Количественная оценка как SOC, так и неорганического углерода почвы (SIC) необходима для нашего понимания углеродного цикла в региональном и глобальном масштабах.
Органический углерод в почве обычно измеряют путем сухого сжигания с помощью автоматических анализаторов или методом влажного химического окисления, т. е. методом Уокли и Блэка [3]. Автоматизированный метод прост и точен, но стоимость высока и может быть неосуществимой. Кроме того, этот подход часто включает предварительную обработку кислотой для удаления карбонатов известковых почв, что может привести к эрозии прибора и разрушению органических веществ в образцах почвы [4].С другой стороны, метод Уокли и Блэка использовался как один из стандартных методов определения SOC [5], особенно в Китае [6]. Этот метод дешевле, чем сухое сжигание. Однако эта процедура может привести к различному извлечению SOC [7], [8] и опасному Cr из-за использования дихромата.
Неорганический углерод в почве можно точно измерить несколькими методами [9]. Обычно SIC определяют путем измерения продукции CO 2 после добавления в почву кислоты HCl [10]–[13].Шеррод и др. [12] продемонстрировали, что модифицированный метод измерения давления с добавлением FeCl 2 для сведения к минимуму окисления органического вещества обеспечивает надежное измерение SIC. В качестве альтернативы для определения SIC можно использовать сухое сжигание с автоматическими анализаторами. Прямое измерение включает сухое сжигание почв, предварительно сожженных для удаления органического вещества в потоке O 2 [14]. Косвенное измерение заключается в определении общего углерода (без предварительной обработки кислотой для удаления карбоната) и SOC отдельно, а затем в вычислении разницы.Хотя автоматизированные подходы обеспечивают точные оценки SIC, они не могут широко использоваться из-за высоких затрат, связанных с приобретением и обслуживанием автоматических анализаторов.
Помимо этих традиционных методов, потеря при прокаливании (LOI) представляет собой альтернативный подход, который включает нагревание образцов почвы при высокой температуре для сжигания органического вещества почвы (SOM) или карбоната и измерение потери веса [15], [16]. Методы LOI просты, менее дороги и менее трудоемки по сравнению с автоматизированными методами и химическими методами.Таким образом, подходы LOI широко использовались для оценки SOM или SOC в сельскохозяйственных и лесных почвах и отложениях [16]–[21], а также для определения содержания карбонатов в отложениях [13], [15], [22], [23]. ]. Однако этот метод редко применяется к почвам с низким плодородием для измерения SOM или SOC или используется для измерения SIC, несмотря на некоторые исследования, показывающие, что метод LOI может дать точные оценки карбонатов в отложениях [13], [24]. Кроме того, мало используются методы LOI для оценки SOC и SIC в китайских почвах.
Засушливые и полузасушливые земли покрывают примерно 35 % земной поверхности и могут играть важную роль в глобальном углеродном цикле и смягчении последствий изменения климата [1], [25], [26]. В связи с недавним интересом к изучению углеродного цикла на засушливых землях [27] возникла необходимость в количественном определении как SOC, так и SIC засушливых почв для оценки различных методов. Здесь мы выбираем три метода для определения содержания SOC и SIC в известняковых почвах бассейна Янци на северо-западе Китая. Мы используем элементный анализатор для измерений SOC и SIC, мокрое окисление для SOC, модифицированный метод кальциметра под давлением для SIC и простую процедуру LOI для определения SOC и SIC.Целью данного исследования является изучение взаимосвязи между этими методами и проверка гипотезы о том, что метод LOI способен точно определять SOC и SIC в засушливых почвах.
Материалы и методы
Описание сайта
Для описываемых полевых исследований не требовалось специальных разрешений. Мы подтверждаем, что это место не находилось в частной собственности и не охранялось каким-либо образом, а в полевых исследованиях не участвовали исчезающие или охраняемые виды.Район нашего изучения расположен вдоль реки Кайду в бассейне Яньци (рис. 1), который расположен на юго-восточном склоне горы Тянь-Шань. Бурая пустынная почва является основным типом почвы, которая образовалась из исходного известнякового материала и классифицируется как Haplic Calcisol [28]. Территория отбора проб (примерно 2 200 км ) охватывает оба берега реки Кайду, которая используется в различных целях, включая пустыни, кустарники, пахотные земли и пастбища. В этом районе годовое количество осадков составляет менее 100 мм, а годовое испарение составляет около 2000 мм.Сельскохозяйственные угодья имеют ирригационные системы, которые извлекают воду из реки Кайду, тогда как другие земли зависят от дождевых и подземных вод. Среднегодовая температура колеблется от 7°C до 10°C. В среднем годовая максимальная температура составляет 38°С, а минимальная температура -35°С.
Отбор и анализ проб почвы
В ноябре 2010 г. мы собрали 70 образцов почвы из 15 профилей. Хотя эти профили различаются по текстуре и цвету из-за истории землепользования, мы взяли пробы пяти слоев на большинстве профилей, т.е.д., 0–5 см, 5–15 см, 15–30 см, 30–50 см, 50–100 см и определяли объемную плотность (BD). Для каждого слоя почвы высушивали на воздухе, тщательно перемешивали и просеивали для прохождения через 2-мм сито для измерения pH и электропроводности (EC). Основные свойства почв приведены в табл. 1. Вкратце, почвы этого региона характеризуются высоким рН (от 8 до 9,4) и высоким содержанием песка/ила. Объемная плотность в поверхностных почвах (0–15 см: 1,38–1,41 г см -3 ) немного ниже, чем в нижних (1,46–1,54 г см -3 ).Электропроводность имеет тенденцию к уменьшению с глубиной от 1,25–1,32 мс см -1 в диапазоне 0–15 см до 0,7 мс см -1 в диапазоне 50–100 см. Репрезентативные подобразцы измельчали для прохождения через сито 0,25 мм для измерения SOC и SIC с помощью следующих процедур.
Таблица 1. Средние значения и стандартные отклонения (в скобках) рН почвы, объемной плотности (BD, г кг -1 ) и электропроводности (ЕС, мс см -1 ) для каждого слоя, а также глины, ила и содержание песка (%) в верхнем слое почвы (0–30 см) из 8 случайно выбранных почвенных профилей.
https://doi.org/10.1371/journal.pone.0044334.t001
Модифицированный метод Уокли-Блэка для SOC
Этот метод является модификацией традиционного метода Уокли-Блэка [3]. Образец почвы (∼0,4 г) обрабатывают 5 мл концентрированной H 2 SO 4 в течение 4 часов, затем смешивают с 5 мл 0,5 MK 2 Cr 2 O 7. Смесь нагревают при 150-160°С в течение 5 минут, а затем охлаждают до комнатной температуры. Раствор переносят в треугольную колбу со 100 мл деионизированной воды.Непрореагировавший K 2 Cr 2 O 7 определяют титрованием 0,25 М FeSO 4 . Содержание органического углерода в почве рассчитывается без коэффициента извлечения по разнице в FeSO 4 , используемой между холостой пробой и почвенным раствором.
Метод измерения давления для SIC
Мы используем процедуру, аналогичную процедуре Шеррода [12]. На дно 100-мл реакционного сосуда помещают пробу почвы весом 1,0 г и маленькую бутылочку с 2 мл 6 М HCl, содержащую 3 мас.% FeCl 2 ·4H 2 O.После закупоривания сосуда пробкой из бутилкаучука с алюминиевым отрывным колпачком, мы смешиваем кислоту с почвой, поворачивая сосуд боком. Через два часа мы снимаем алюминиевый отрывной колпачок, а затем вводим иглу для подкожных инъекций 18-го калибра, прикрепленную к датчику давления и вольтметру. Мы записываем показания напряжения с точностью до двух знаков после запятой через 3–5 секунд, а затем рассчитываем концентрацию CO 2 , используя калибровочную кривую, полученную путем смешивания реактивного CaCO 3 с высушенным в печи лабораторным песком.Стандарты изготавливаются на основе конечной массы 1,0000 г смеси песка и CaCO 3 для получения концентраций неорганического углерода 1,2, 3,6, 6,0, 12,0, 18,0, 24,0, 30,0, 36,0, 42,0, 48,0, 54,0 и 60,0 г C. кг -1 соответственно.
Элементный анализатор для SOC и SIC
Мы использовали анализатор CNHS-O (EuroEA3000) для оценок SOC и SIC. Для измерения SOC 20 мг почвы предварительно обрабатывают 10 каплями H 3 PO 4 в течение 12 часов для удаления карбоната.Образец сжигают при 1020°C с постоянным потоком гелия, несущего чистый кислород, для обеспечения полного окисления органических материалов. Производство CO 2 определяется детектором по теплопроводности. Общий углерод почвы измеряется с использованием той же процедуры без предварительной обработки H 3 PO 4 . Неорганический углерод почвы рассчитывается как разница между общим углеродом почвы и SOC.
Процедура определения потерь при прокаливании (LOI) для SOM и SIC
Вслед за Wang et al.[16] и Ван и соавт. [15], сначала помещали 5,0000 г почвы в кварцевое стекло и нагревали при 105°С в течение 12 часов для удаления почвенной влаги. Затем мы сжигали почву в программируемой муфельной печи (S1849, KOYO LINDBEERE LTD) при 375°C в течение 17 часов и при 800°C в течение 12 часов. Органическое вещество почвы рассчитывается как потеря веса между 105°C и 375°C, а SIC как потеря веса между 375°C и 800°C:(1)(2)
Константа преобразования 0,273 в уравнении (2) применяется для преобразования массы CO 2 в массу углерода.
Результаты
Почвенный органический углерод
Сначала мы сравниваем измеренную SOC между автоматическим анализом ЦНС и модифицированным методом Уокли-Блэка и обнаруживаем сильную корреляцию (r 2 = 0,93, P<0,001) между двумя методами (таблица 2). Как показано на рис. 2, в этом регионе содержание SOC ниже 15 г·кг·–1·. Похоже, что модифицированный метод Уокли-Блэка завышает SOC, когда почва содержит чрезвычайно низкий SOC (<5 г/кг -1 ). Исключение этих данных дает усредненное восстановление, равное 0.993. Эти результаты показывают, что почти 100% SOC в бурой пустынной почве может быть окислено, что намного выше, чем ранее опубликованные показатели восстановления (менее 82%) для лесных почв региона Фландрии [7], но согласуется с данными ( ~100%) в большинстве почв Тасмании [16]. Высокое извлечение SOC и большой коэффициент корреляции в нашем исследовании позволяют предположить, что модифицированный метод Уокли-Блэка так же точен, как и автоматизированный метод CNS, за исключением почв с чрезвычайно низким SOC.
Затем мы сравниваем измеренное SOM с помощью метода LOI с SOC с помощью автоматизированной методики CNS (рис. 3).Как и ожидалось, значения SOM (0–27 г/кг -1 ) выше, чем значения SOC (<15 г кг -1 ). Большое значение пересечения 4,189 указывает на то, что во время воспламенения происходят некоторые потери веса, не связанные с SOM (например, из-за структурной воды и карбоната). Коэффициент преобразования 1,792 немного больше, чем традиционные значения 1,724. Мы находим, что коэффициент пересчета составляет 2,71 для тех образцов с низким содержанием ПОУ (<5 г/кг -1 ), которые в основном представляют собой подпочвы. Основываясь на всех 70 протестированных образцах почвы, SOC можно рассчитать из LOI при 375°C в течение 17 часов, используя следующее уравнение: (3)
На рис. 4 показано сравнение измеренной SOC по методу Уокли-Блэка и рассчитанной SOC по методу LOI с использованием уравнения (3).Чтобы избежать отрицательных значений в рассчитанном SOC, мы исключаем из этого сравнения образцы, которые содержат менее 4,189 г кг −1 SOM LOI . Значение наклона 0,949 и значительно высокий коэффициент корреляции (r 2 = 0,77, p<0,001) указывают на то, что метод LOI имеет потенциал для оценки SOC в этом засушливом регионе.
Почвенный неорганический углерод
Мы оцениваем измеренный SIC методом кальциметра давления и автоматическим анализом ЦНС (рис. 5). Ясно, что содержание SIC намного выше, чем SOC (<15 г/кг -1 ) в этом регионе.Метод кальциметра давления дает немного более низкие значения SIC (6-51 г кг -1 ), чем автоматизированный метод CNS (9-53 г кг -1 ). Однако существует высокая корреляция (r 2 = 0,99, p<0,001) между двумя методами. Значение наклона 0,996 и большой коэффициент корреляции указывают на то, что метод кальциметра давления так же точен, как и автоматизированный метод CNS для известняковых почв.
На рис. 6 представлено сравнение измеренного SIC между методом LOI и автоматическим анализом ЦНС.Оба метода дают очень похожий диапазон и формируют линейную зависимость: (4)
Значение пересечения 2,582 значительно отличается от 0, что позволяет предположить, что во время сгорания могут иметь место некоторые потери веса, не относящиеся к SIC (например, дегидратация из-за других соединений) [22], [23], [29]. Тем не менее, коэффициенты значения наклона, близкие к 1, и значительная корреляция указывают на то, что метод LOI может давать точные оценки SIC.
Как показано на рисунке 7, существует также линейная зависимость SIC между методом кальциметра давления и методом LOI: (5), которая показывает наклон, аналогичный наклону регрессии между методом LOI и анализом ЦНС (т.е., уравнение 4). Относительно большая точка пересечения в уравнении (5) отражает несколько более низкие значения SIC по методу кальциметра давления по сравнению с автоматическим анализом CNS (см. Таблицу 2).
Обсуждение
Оценка SOC
Измерение SOC было обычной процедурой в почвоведении. Доступно множество методов, каждый из которых имеет преимущества и недостатки с точки зрения точности, стоимости и удобства [5], [30]. Процедура Уокли-Блэка считается дешевой и простой в выполнении, но может давать различное извлечение, поэтому для определения общего содержания SOC в образце почвы часто применяется поправочный коэффициент.Например, Sleutel et al. [31] применили поправочный коэффициент 1,33 для оценки SOC по Walkley-Black без внешнего нагрева. Тем не менее, раннее исследование [16] показало, что без внешнего нагрева метод Уокли-Блэка обеспечивает примерно 100% восстановление SOC в большинстве почв Тасмании. Многие модифицированные методы окисления дихроматов, включающие внешний нагрев, не требуют поправочного коэффициента [32]. Наше исследование показывает, что по сравнению с автоматизированной методикой ЦНС модифицированный метод Уокли-Блэка с внешним подогревом дает почти 100% восстановление SOC в испытанных нами известняковых грунтах.Однако метод Уокли-Блэка может завышать SOC в почвах с крайне низким SOC [8], что, вероятно, связано с реакциями K 2 Cr 2 O 7 с неорганическими компонентами почвы [33].
Хотя метод LOI широко используется для оценки SOM и SOC, не существует стандартной процедуры в отношении продолжительности нагревания и температуры. В литературе описаны различные комбинации температур от 150°C до 900°C и продолжительности от 2 до 17 часов, таким образом, регрессия между LOI и SOC (измеренная автоматическим анализатором или методом Уокли-Блэка) широко варьируется. [16], [34], [35].В целом, с повышением температуры LOI увеличивается, тогда как коэффициент корреляции имеет тенденцию к снижению [35].
Одним из критических замечаний по поводу метода LOI является то, что он может привести к потере веса из-за структурной воды и карбоната во время нагревания [30], [34]. Эти потери веса, не связанные с SOM, могут существенно повлиять на оценки SOC, особенно в почвах с низким содержанием SOM и высоким содержанием глины. По мере уменьшения количества ПОВ возрастает вероятность дегидроксилирования глин [36]. Однако содержание глины в наших почвах невелико (см. табл. 1).Таким образом, потеря веса из-за дегидроксилирования глин может быть небольшой. С другой стороны, температура является доминирующим фактором, влияющим на LOI и его связь с SOC [35]. Поэтому крайне важно выбрать температуру, достаточно высокую для полного удаления ПОВ, но достаточно низкую для предотвращения дегидроксилирования глинистых минералов и окисления карбоната.
Несколько исследований показали, что сочетание 375°C и 16–17 часов приводит к хорошему соотношению LOI-SOC, таким образом, оно может обеспечить точные оценки SOC во многих группах почв [16], [37], [38].Наше исследование показывает, что существует тесная взаимосвязь между SOC и LOI при 375°C в течение 17 часов в испытанных известняковых почвах. Хотя ненулевое пересечение может отражать некоторые потери веса, отличные от SOM, сильная взаимосвязь указывает на возможность использования метода LOI для оценки SOC.
Оценка SIC
Содержание карбонатов в почве обычно определяется растворением кислоты в приведенной ниже реакции: (6) с определением либо потребления H + , либо производства CO 2 .Методы потребления H + , предполагающие реакцию с сильной кислотой, такие как добавление HCl и обратное титрование непрореагировавшей кислоты, могут быть проблематичными из-за поглощения H + другими компонентами почвы [9]. Действительно, наши собственные анализы с использованием подхода потребления H + приводят к значительному занижению SIC (на 20%) для протестированных нами почв (данные не показаны).
Существует множество методов, включающих определение образования CO 2 после растворения в кислоте [9].Хотя эти методы являются более предпочтительными, необходимо принять меры предосторожности, чтобы исключить влияние окисления органических веществ. Таким образом, ингибитор окисления (например, FeCl 2 ) часто используется для ограничения окисления органического вещества и последующего выделения CO 2 из этого источника. Наше исследование показывает сильную корреляцию между методом кальциметра давления и автоматическим анализом ЦНС. Учитывая, что содержание SIC, измеренное с помощью метода кальциметра давления, несколько ниже, но существенно не отличается от значений, полученных с помощью автоматизированного анализа CNS, мы делаем вывод, что подход с использованием кальциметра давления может обеспечить точное измерение SIC для известняковых почв этого засушливого региона.
В отличие от широкого использования метода LOI для оценок SOC, в литературе мало сведений о применении метода LOI для оценок SIC. Однако метод LOI использовался для измерения содержания карбонатов в отложениях после сжигания органического углерода при более низкой температуре [13], [15], [22], [23]. Простая двухэтапная процедура LOI для оценки органического углерода и карбонатов в отложениях [15] аналогична процедуре определения органического углерода и карбонатов в известняковых почвах методом сухого сжигания [14].Таким образом, это может быть удобной практикой для оценки SOC и SIC.
Насколько нам известно, это исследование является первой попыткой оценить метод LOI для измерения SIC. Наше исследование показывает достоверную (r 2 >0,96, P<0,001) линейную зависимость между расчетным SIC методом LOI и определенным SIC прямыми измерениями, т. е. автоматическим анализатором элементов и методом кальциметра давления. Несмотря на ненулевые пересечения и несколько более высокие значения SIC по методу LOI, значения наклона близки к единице, что согласуется с данными, полученными для анализа отложений [15].Наши результаты показывают, что метод LOI имеет потенциал для простой и точной оценки SIC в известняковых почвах засушливых регионов.
Выводы
Мы сравнили три метода определения концентраций SOC и SIC в известняковых почвах бассейна Яньци. Несмотря на широкий диапазон свойств почвы, SOC, как правило, низкий (1–14 г/кг 90 140 -1 90 141 ), тогда как SIC значительно выше (9–53 г кг 90 140 -1 90 141 ). Наше исследование показывает, что метод Уокли-Блэка с внешним подогревом может обеспечить точную оценку SOC (с почти 100% восстановлением) для большинства засушливых почв.Метод кальциметра давления так же точен, как и автоматизированный элементарный метод измерения SIC. В дополнение к этим традиционным методам мы также оценили двухэтапный подход LOI, то есть (1) сжигание при 375°C в течение 17 часов для оценки SOC и (2) последующее сжигание при 800°C в течение 12 часов для оценки НИЦ. Наше исследование показывает, что SOC и SIC можно оценить на основе LOI для известняковых почв, за исключением почв с чрезвычайно низким содержанием SOC или SIC. Это исследование демонстрирует, что двухэтапный метод LOI может быть использован в качестве достаточно точного метода для оценки SOC и SIC в засушливых почвах.Необходимы дальнейшие испытания на более широком диапазоне засушливых и полузасушливых почв.
Благодарности
Благодарим рецензента за конструктивные комментарии.
Вклад авторов
Задумал и разработал эксперименты: XW JW. Провели эксперименты: JW JZ. Проанализированы данные: XW. Предоставленные реагенты/материалы/инструменты для анализа: XW. Написал статью: XW.
Каталожные номера
- 1. Лал Р., Кимбл Дж. М. (2000) Педогенный карбонат и глобальный углеродный цикл.В: Lal R, Kimble JM, Eswaran H, Stewart BA, редакторы. Глобальное изменение климата и педогенность. Бока-Ратон, Флорида, США: CRC press. 1–14.
- 2. Эсваран Х., Райх П.Ф., Кимбл Дж.М., Бейнрот Ф.Х., Падманабхан Э. и др. (2000) Глобальные запасы углерода. В: Р.Л., Кимбл Дж.М., Эсваран Х., Стюарт Б.А., редакторы. Глобальное изменение климата и почвообразующие карбонаты. Бока-Ратон, Флорида: Издательство Льюиса. 15–27.
- 3. Уокли А., Блэк И.А. (1934) Исследование метода Дегтярева для определения органического вещества почвы и предложенная модификация метода титрования хромовой кислотой.Почвоведение 37: 29–38.
- 4. Байерс С.К., Миллс Э.Л., Стюарт П.Л. (1978) Сравнение методов определения органического углерода в морских отложениях с предложениями стандартного метода. Гидробиология 58: 43–47.
- 5. Нельсон Д.В., Соммерс Л.Е., Спаркс Д., Пейдж А., Хелмке П. и др. (1996) Общий углерод, органический углерод и органическое вещество. Методы анализа почвы Часть 3-химические методы: 961–1010.
- 6. Zhang WJ, Wang XJ, Xu MG, Huang SM, Liu H, et al.(2010)Динамика почвенного органического углерода при длительном внесении удобрений на пахотных землях северного Китая. Биогеонауки 7: 409–425.
- 7. Де Вос Б., Леттенс С., Муйс Б., Декерс Дж. А. (2007) Анализ органического углерода лесной почвы Уокли-Блэка: восстановление, ограничения и неопределенность. Использование и управление почвой 23: 221–229.
- 8. Коньерс М.К., Пойл Г.Дж., Оутс А.А., Уотерс Д., Чан К.Ю. (2011)Сравнение трех методов определения углерода на природных субстратах и последствия для количественного определения «почвенного углерода».Почвенные исследования 49: 27–33.
- 9. Лепперт Р., Суарес Д., Спаркс Д., Пейдж А., Хельмке П. и др. (1996) Карбонат и гипс. Методы анализа почвы Часть 3-химические методы: 437–474.
- 10. Пресли Б. (1975) Простой метод определения карбоната кальция в пробах отложений. J Осадочный бензин 45: 745–C746.
- 11. Дрейманис А. (1962) Количественное газометрическое определение кальцита и доломита с использованием прибора Читтика. Журнал осадочных исследований 32: 520.
- 12. Шеррод Л.А., Данн Г., Петерсон Г.А., Колберг Р.Л. (2002) Анализ неорганического углерода с помощью модифицированного метода измерения давления и кальциметра. Soil Sci Soc Am J 66: 299–305.
- 13. Хейри О., Лоттер А.Ф., Лемке Г. (2001) Потери при прокаливании как метод оценки содержания органических веществ и карбонатов в отложениях: воспроизводимость и сопоставимость результатов. Журнал палеолимнологии 25: 101–110.
- 14. Rabenhorst MC (1988) Определение содержания органического и карбонатного углерода в известняковых почвах с использованием сухого сжигания.Журнал Американского общества почвоведов 52: 965–969.
- 15. Wang QR, Li YC, Wang Y (2011) Оптимизация методологии потери веса при возгорании для количественного определения органического и карбонатного углерода в отложениях из различных источников. Мониторинг и оценка окружающей среды 174: 241–257.
- 16. Wang XJ, Smethurst PJ, Herbert AM (1996) Взаимосвязь между тремя показателями органического вещества или углерода в почвах эвкалиптовых плантаций в Тасмании. Австралийский журнал почвенных исследований 34: 545–553.
- 17. Дэвид М.Б. (1988) Использование потерь при возгорании для оценки почвенного органического углерода в лесных почвах. Связь в почвоведении и анализе растений. 19: 1593–1599.
- 18. Де Вос Б., Вандекастил Б., Декерс Дж., Мюйс Б. (2005) Возможность потери при возгорании как предиктор общего содержания органического углерода в некарбонатных лесных почвах. Сообщения в почвоведении и анализе растений 36: 2899–2921.
- 19. Райт А.Л., Ван И., Редди К.Р. (2008) Метод потерь при возгорании для оценки органического углерода почвы в известняковых водно-болотных угодьях Эверглейдс.Сообщения в почвоведении и анализе растений 39: 3074–3083.
- 20. Конен М.Е., Джейкобс П.М., Буррас С.Л., Талага Б.Дж., Мейсон Д.А. (2002) Уравнения для прогнозирования содержания органического углерода в почве с использованием потерь при возгорании для почв северной и центральной части США. Журнал Американского общества почвоведов 66: 1878–1881.
- 21. Болл Д.Ф. (1964) Потери при возгорании как оценка органического вещества и органического углерода в некарбонатных почвах. Журнал почвоведения 15: 84–92.
- 22. Дин В.Е. (1974) Определение карбонатов и органических веществ в известняковых отложениях и осадочных породах по потерям при прокаливании: сравнение с другими методами.Журнал осадочной петрологии 44: 242–248.
- 23. Сантистебан Д.И., Медиавилла Р., Лопес-Памо Э., Дабрио С.Дж., Запата МБР и др. (2004) Потери при прокаливании: качественный или количественный метод определения содержания органического вещества и карбонатных минералов в отложениях? Журнал палеолимнологии 32: 287–299.
- 24. Wang Q, Li Y, Wang Y (2011) Оптимизация методологии потери веса при возгорании для количественного определения органического и карбонатного углерода в отложениях из различных источников. Мониторинг и оценка окружающей среды 174: 241–257.
- 25. Шарпенсил Х.В., Мтимет А., Фрейтаг Дж. (2000) Неорганический углерод в почве и глобальные изменения. В: Lal R, Kimble JM, Eswaran H, Stewart BA, редакторы. Глобальное изменение климата и педогенные карбонаты. Бока-Ратон, Флорида: CRC Press. 27–42.
- 26. Xie JX, Li Y, Zhai CX, Li CH, Lan ZD (2009) CO 2 поглощение щелочными почвами и его влияние на глобальный углеродный цикл. Геология окружающей среды 56: 953–961.
- 27. Stone R (2008) Исследователи пустыни обнаружили скрытую петлю в углеродном цикле? Наука 320: 1409–1410.
- 28. ФАО-ЮНЕСКО (1988) почвенная карта мира: измененная легенда. Доклад № 60 о мировых почвенных ресурсах ФАО: Рим.
- 29. Эллисон Л., Блэк С. (1965) Методы анализа почвы. Часть 2. Химические и микробиологические свойства. Агрономическая монография 9: 1367–1378.
- 30. Чаттерджи А., Лал Р., Велопольски Л., Мартин М.З., Эбингер М.Х. (2009) Оценка различных методов определения углерода в почве. Критические обзоры в области наук о растениях 28: 164–178.
- 31.Sleutel S, De Neve S, Singier B, Hofman G (2007) Количественное определение органического углерода в почвах: сравнение методологий и оценка содержания углерода в органическом веществе. Сообщения в области почвоведения и анализа растений 38: 2647–2657.
- 32. Lettens S, De Vos B, Quataert P, van Wesemael B, Muys B, et al. (2007) Переменное восстановление углерода анализа Уокли-Блэка и последствия для национального учета органического углерода в почве. Европейский журнал почвоведения 58: 1244–1253.
- 33. Уолкли А. (1947) Критическое исследование экспресс-метода определения органического углерода в почвах – влияние изменений условий пищеварения и неорганических компонентов почвы. Почвоведение 63: 251–264.
- 34. Сава-Ковац Р. (2009) Повторный анализ взаимосвязи между органическим углеродом и потерями при возгорании в почве. Коммуникации в области почвоведения и анализа растений 40: 2712–2724.
- 35. Абелла С., Циммер Б. (2007) Оценка органического углерода по потерям при возгорании в лесных почвах северной Аризоны.Журнал Американского общества почвоведов 71: 545–550.
- 36. Pribyl DW (2010) Критический обзор обычного коэффициента преобразования SOC в SOM. Геодерма 156: 75–83.
- 37. McKeague J (1976) Руководство по отбору проб почвы и методам анализа.

 Однако это не так. Дело в том, что атомы одного и того же химического элемента могут образовывать не одно, а несколько различных простых веществ. Такое явление, как вы знаете, называют аллотропией. Причинами аллотропии может быть разное число атомов в молекуле (например, аллотропные модификации элемента кислорода – кислород О2 и озон О3), а также различное строение кристаллической решетки твердого вещества (например, уже знакомые вам аллотропные видоизменения углерода – алмаз и графит).
Однако это не так. Дело в том, что атомы одного и того же химического элемента могут образовывать не одно, а несколько различных простых веществ. Такое явление, как вы знаете, называют аллотропией. Причинами аллотропии может быть разное число атомов в молекуле (например, аллотропные модификации элемента кислорода – кислород О2 и озон О3), а также различное строение кристаллической решетки твердого вещества (например, уже знакомые вам аллотропные видоизменения углерода – алмаз и графит).

 Примеры включают древесный уголь, уголь и кокс, все из которых являются продуктами окисления и распада органических соединений. В качестве топлива используются уголь и кокс. Древесный уголь используется в качестве фильтрующего вещества, топлива и в составе пороха. Сажа также добавляется в резину в шинах, что продлевает срок службы шин.
Примеры включают древесный уголь, уголь и кокс, все из которых являются продуктами окисления и распада органических соединений. В качестве топлива используются уголь и кокс. Древесный уголь используется в качестве фильтрующего вещества, топлива и в составе пороха. Сажа также добавляется в резину в шинах, что продлевает срок службы шин.



 Он используется в качестве пищевой добавки (не токсичен), для разработки лекарств и производства мела.
Он используется в качестве пищевой добавки (не токсичен), для разработки лекарств и производства мела.

 186 Joules = 0.001 BTU / LB M O F
186 Joules = 0.001 BTU / LB M O F