Метан — это… Что такое Метан?
Мета́н (лат. Methanum) — простейший углеводород, бесцветный газ (в нормальных условиях) без запаха[2], химическая формула — CH4. Малорастворим в воде, легче воздуха. При использовании в быту, промышленности в метан обычно добавляют одоранты (обычно меркаптаны) со специфическим «запахом газа». Метан нетоксичен и неопасен для здоровья человека[3]. Однако имеются данные, что метан относится к токсическим веществам, действующим на центральную нервную систему[4]. Накапливаясь в закрытом помещении, метан взрывоопасен. Обогащение одорантами делается для того, чтобы человек вовремя заметил утечку газа. На промышленных производствах эту роль выполняют датчики и во многих случаях метан для лабораторий и промышленных производств остается без запаха.
Метан — первый член гомологического ряда насыщенных углеводородов (алканов), наиболее устойчив к химическим воздействиям. Подобно другим алканам вступает в реакции радикального замещения (галогенирования, сульфохлорирования, сульфоокисления, нитрования и др.), но обладает меньшей реакционной способностью. Специфична для метана реакция с парами воды, которая протекает на Ni/Al
Взрывоопасен при концентрации в воздухе от 4,4 % до 17 %[5]. Наиболее взрывоопасная концентрация 9,5 %. Является наркотиком; действие ослабляется ничтожной растворимостью в воде и крови. Класс опасности — четвёртый[6].
Источники
Основной компонент природных (77—99 %), попутных нефтяных (31—90 %), рудничного и болотного газов (отсюда другие названия метана — болотный или рудничный газ). В анаэробных условиях (в болотах, переувлажнённых почвах, рубце жвачных животных) образуется биогенно. Получается также при коксовании каменного угля, гидрировании угля, гидрогенолизе углеводородов в реакциях каталитического риформинга.
Классификация по происхождению:
- абиогенный — образован как результат химических реакций неорганических соединений;
- биогенный — образован как результат химической трансформации органического вещества;
- бактериальный (микробный) — образован в результате жизнедеятельности бактерий;
- термогенный — образован в ходе термохимических процессов.
Предположительно, что на поверхности Титана (спутник Сатурна) в условиях низких температур (−180 °C) существуют целые озёра и реки из жидкой метано[источник не указан 27 дней]-этановой смеси.
Получение
В лаборатории получают нагреванием натронной извести (смесь гидроксидов натрия и кальция) или безводного гидроксида натрия с ледяной уксусной кислотой.
Для этой реакции важно отсутствие воды, поэтому и используется гидроксид натрия, так как он менее гигроскопичен.
Возможно получение метана сплавлением ацетата натрия с гидроксидом натрия[7]:
Также для лабораторного получения метана используют гидролиз карбида алюминия или некоторых металлорганических соединений (например, метилмагнийбромида).
Химические свойства
Горит в воздухе голубоватым пламенем, при этом выделяется энергия около 39 МДж на 1 м³. С воздухом образует взрывоопасные смеси при объёмных концентрациях от 5 до 15 процентов. Точка замерзания −184oС (при нормальном давлении)
Вступает с галогенами в реакции замещения, которые проходят по свободно радикальному механизму:
Выше 1400 °C разлагается по реакции:
Окисляется до муравьиной кислоты при 150—200 °C и давлении 30—90 атм. по цепному радикальному механизму:
Соединения включения
Метан образует соединения включения — газовые гидраты, широко распространенные в природе.
Применение метана
- Топливо.
- Сырьё в органическом синтезе.
Физиологическое действие
Метан является самым физиологически безвредным газом в гомологическом ряду парафиновых углеводородов. Физиологическое действие метан не оказывает и не ядовит (из-за малой растворимости метана в воде и плазме крови и присущей парафинам химической инертности). Погибнуть человеку в воздухе, с высокой концентрацией метана можно только от недостатка кислорода в воздухе для дыхания при очень высоких концентрациях метана. Так, при содержании в воздухе 25—30 % метана появляются первые признаки асфиксии (учащение пульса, увеличение объёма дыхания, нарушение координации тонких мышечных движений и т. д.). Более высокие концентрации метана в воздухе вызывают у человека кислородное голодание — головную боль, одышку, — симптомы, сходные с горной болезнью.
Так как метан легче воздуха, он не скапливается в проветриваемых подземных сооружениях. Поэтому весьма редки случаи гибели людей от вдыхания смеси метана с воздухом, от асфиксии.
Первая помощь при тяжелой асфиксии: удаление пострадавшего из вредной атмосферы. При отсутствии дыхания немедленно (до прихода врача) искусственное дыхание изо рта в рот. При отсутствии пульса — непрямой массаж сердца.
Хроническое действие метана
У людей, работающих в шахтах или на производствах, где в воздухе присутствуют в незначительных количествах метан и другие газообразные парафиновые углеводороды, описаны заметные сдвиги со стороны вегетативной нервной системы (положительный глазо-сердечный рефлекс, резко выраженная атропиновая проба, гипотония) из-за весьма слабого наркотического действия этих веществ, сходного с наркотическим действием диэтилового эфира.
Метан и экология
Является парниковым газом, в этом отношении, более сильным, чем углекислый газ, из-за наличия глубоких вращательных полос поглощения его молекул в инфракрасном спектре. Если степень воздействия углекислого газа на климат условно принять за единицу, то парниковая активность метана составит 21 единицу [8].
ПДК метана в воздухе рабочей зоны составляет 7000 мг/м3[9].
Ссылки
Примечания
- ↑ Обзор: Растворимость некоторых газов в воде
- ↑ Статья «Метан» на сайте «Химик»
- ↑ З. Гауптман, Ю. Грефе, Х. Ремане «Органическая химия», М. «Химия», 1979, стр. 203.
- ↑ Куценко С. А. Основы токсикологии / С.А. Куценко. — СПб.: Фолиант, 2004.
- ↑ ГОСТ Р 52136-2003
- ↑ Газохроматографическое измерение массовых концентраций углеводородов: метана, этана, этилена, пропана, пропилена, н-бутана, альфа-бутилена, изопентана в воздухе рабочей зоны. Методические указания. МУК 4.1.1306-03 (УТВ. ГЛАВНЫМ ГОСУДАРСТВЕННЫМ САНИТАРНЫМ ВРАЧОМ РФ 30.03.2003)
- ↑ Б. А. Павлов, А. П. Терентьев. Курс органической химии. — Издание шестое, стереотипное. — M.: Химия, 1967. — С. 58.
- ↑ EBRD Methodology for Assessment of Greenhouse Gas Emissions, Version 3 February 2009 (англ.)
- ↑ Гигиенические нормативы ГН 2.2.5.1313-03 «Предельно допустимые концентрации (ПДК) вредных веществ в воздухе рабочей зоны»
Метан ⚗️ структурная формула газа, строение, химические и физические свойства, получение и применение, с какими веществами реагирует углеводород
Краткая характеристика
Природный метан образуется при гниении останков живых организмов. В переводе с английского «methane» означает «болотный газ», так как чаще всего его обнаруживают в болотах и каменноугольных шахтах.
Почти 95% реагента появляется в результате биологических процессов. Пятая часть годовых выбросов газа в атмосферу приходится на коз и коров, в желудках которых живут бактерии, вырабатывающие метан. В атмосферу он попадает, когда рогатый скот выводит из организма продукты своей жизнедеятельности.
Другими источниками вещества являются:
- термиты;
- рис-сырец;
- болотистые водоёмы;
- фильтрация природного газа;
- фотосинтез растений;
- вулканы;
- давно погибшие организмы.
Поскольку вещество обычно связано с живыми организмами, то учёные полагают, что его присутствие на планете указывает на наличие жизни. Так, когда этот газ был обнаружен в атмосферах Марса, специалисты начали тщательное изучение планеты именно на предмет существования живых организмов. Но дальнейшие исследования показали, что на удалённых планетах Солнечной системы метана значительно больше, хотя там он появился в результате химических реакций.
На Земле вещество просачивается через трещины в земной коре, находящиеся на океанском дне, в больших количествах выделяется во время горных разработок и при лесных пожарах. Кроме того, недавно учёными был обнаружен новый источник газа, который никогда ранее в таком ключе не рассматривался.
Физические качества
Метан представляет собой самый простой углеводород. Считается, что он имеет специфический запах, но это распространённое заблуждение. Чистый газ не имеет запаха, характерный аромат он приобретает благодаря специальным добавкам, которые добавляют в вещество для предупреждения о его утечке, ведь цвета химическое соединение также не имеет.
Кроме того, к физическим свойствам метана относятся:
- Горение голубым пламенем.
- Сгорание без выделения вредных продуктов.
- Плохая растворимость в воде.
- Он легче воздуха.
- Основная составляющая природных, попутных нефтяных, рудничного и болотного газов.
- Кипение при температуре -161 °C.
- Замерзание при температуре -183 °C.
- Молярная масса составляет 16,044 г/моль.
- Плотность — 0,656 кг/м³.
- При соединении с воздухом образуются взрывоопасные смеси.
- В жидком виде представляет собой бесцветную жидкость без запаха.
Наиболее опасен метан, который выделяется во время подземных разработок полезных ископаемых, а также на фабриках, занимающихся переработкой и обогащением угля. Когда количество газа в воздухе достигает 5−6%, то он начинает гореть рядом с источниками тепла.
Если уровень вещества поднимается до 14−16%, то может произойти взрыв. При увеличении концентрации вещество горит при постоянном поступлении кислорода. Если же в этот момент количество метана начнёт снижаться, то результатом также может стать взрыв. При взрыве огонь, подпитываемый газом, движется со скоростью от 500 до 700 м/сек. Давление же вещества в этот момент в замкнутом пространстве составляет 1 Мн/м2.
При соприкосновении с источником тепла метан воспламеняется с небольшой задержкой. Это свойство вещества применяется при изготовлении предохранительных взрывчатых веществ и электрооборудования, безопасного при взрывах. На всех объектах, где существует опасность выброса метана, действуют правила техники безопасности «газовый режим».
Химические свойства
В химии формула метана — Ch5. Соединение плохо вступает в химические связи.
В обычных условиях оно не реагирует со следующими веществами:
- концентрированные кислоты;
- расплавленные и концентрированные щелочи;
- щелочные металлические реагенты;
- галогены;
- перманганат калия;
- дихромат калия в кислой среде.
При температуре около 200 °C и давлении от 30 до 90 атмосфер болотный газ окисляется, преобразуясь в муравьиную кислоту. Вещество образует соединения, называемые газовыми гидратами, которые часто встречаются в природе.
По своим химическим свойствам метан схож с другими реагентами, относящимися к алканам. А потому он вступает в такие химические реакции, как:
- Конверсия в синтез-газ. Синтез-газ, который образуется в результате указанной реакции, используется для получения метанола, углеводородов и так далее.
- Галогенирование. Такая реакция является цепной. При ней молекула брома или йода подвергается воздействию света и распадается на радикалы, которое затем атакуют молекулы метана. В результате от соединения отрывается атом водорода, а газ становится свободным метилом Ch4. Получившееся вещество сталкивается с молекулами брома или йода, которые разрушаются, образуя новые радикалы этих реагентов.
- Нитрование.
- Окисление или горение. Эта реакция происходит при избытке кислорода и описывается следующим уравнением: Ch5 + 2O2 → CO2 + 2h3O. В этом случае пламя имеет голубой цвет. Если кислорода недостаточно, то результатом реакции становится выработка не углекислого газа, а оксида углерода. Если же кислорода ещё меньше, то взаимодействие веществ приведёт к выделению мелкодисперсного углерода.
- Сульфохлорирование.
- Сульфоокисление.
- Разложение.
- Дегидрирование.
- Каталитическое окисление. В подобных реакциях из болотного газа образуются карбоновые кислоты, спирты, альдегиды.
Получение в промышленности и лаборатории
В промышленных условиях вещество получают посредством нагревания углерода и водорода или синтеза водяного газа. Для того чтобы реакция протекала успешно, используют катализатор, обычно в этом качестве применяется никель. В США для добычи простейшего углеводорода используется специальная система, способная извлекать соединение из природного угля. Но также метан выделяется в виде подобного продукта при термической переработке нефти и нефтепродуктов, коксовании и гидрировании каменного угля.
В лаборатории для получения вещества применяются следующие методы:
- Реакция гидроксида натрия с ацетатом натрия.
- Взаимодействие карбида алюминия.
- Нагревание натристой извести с уксусной кислотой. Для этой реакции необходима безводная среда, а потому в ней применяется гидроксид натрия, который является наименее гигроскопичным.
Болотный газ самый термически устойчивый углеводород, а потому он широко применяется и в быту, и в промышленности. Хлорирование вещества даёт возможность получения метилхлорида, метиленхлорида, хлороформа, четырёххлористого углерода. Результатом его неполного сгорания является сажа, Если метан каталитически окисляется, то получается формальдегид. А его реакция с серой приводит к образованию сероуглерода.
К важным методам получения ацетилена из простейшего углеводорода относятся:
- термоокислительный крекинг,
- электрокрекинг.
Газ также применяется для производства синильной кислоты. Кроме того, он даёт водород, необходимый для выработки водяного газа, который, в свою очередь, применяется для создания углеводородов, альдегидов и тому подобного. Кроме того, метан необходим при производстве нитрометана.
В настоящее время газ стал часто использоваться в качестве автомобильного топлива. Но его плотность в 1000 раз меньше плотности бензина, а потому, чтобы заправить автомобиль метаном на тот же объём, что и бензином, при равном давлении необходим соответствующий бак. В таком случае для обычной поездки потребовалось бы возить прицеп с топливом.
Учёные решили эту проблему, увеличив плотность газа до 200−250 атмосфер. Сжатое вещество закачивается в специальные баллоны, установленные на автомобилях особой конструкции.
Парниковый эффект
Метан является одним из газов, создающих на планете парниковый эффект. Чтобы измерить уровень его парниковой активности, необходимо принять за единицу меру воздействия на климат нашей планеты диоксида углерода. При таком соотношении влияние метана будет равно 23. Специалисты в области изучения парникового эффекта отмечают, что количество указанного газа в земной атмосфере значительно выросло за последние два столетия.
Объём метана в современной атмосфере в среднем составляет 1,8 части на миллион. Это количество в 200 раз меньше того же показателя углекислого газа. Необходимо отметить, что молекулы соединения рассеивают и удерживают теплоту, которую излучает нагретая солнцем планета, гораздо лучше, чем молекулы углекислого газа. И также необходимо отметить, что углеводород поглощает земное излучение в тех спектральных областях, которые свободно проходят через другие газовые соединения, создающие эффект парника.
Но тем не менее такие газы планете необходимы. Без двуокиси углерода, водяных паров, метана и других составляющих атмосферы температура на поверхности Земли была бы значительно ниже средних 15 градусов тепла.
Влияние на организм человека
Человек может отравиться, надышавшись метаном при аварии на производстве или из-за неправильного обращения с приборами, работающими на этом газе. Возможна такая ситуация и при длительном нахождении на болоте, в шахте. Если концентрация вещества в воздухе составляет 20 и более процентов, то отравление может быть очень тяжёлым, вплоть до летального исхода.
Работники химических производств, рудников и шахт подвержены другому способу отравления углеводородом. Зачастую эти люди на протяжении длительного времени регулярно вдыхают небольшие дозы вещества.
Кроме того, хроническая интоксикация может наступить из-за заболеваний кишечника, например, дисбактериоза. В таких случаях в организме больного метан образуется в повышенном количестве. Этот газ не станет причиной серьёзной интоксикации, но всё же он может вызвать в организме разные нарушения, привести к желудочно-кишечному дискомфорту и общему ухудшению самочувствия.
Отличить острое отравление метаном можно по следующим признакам:
- головокружение;
- шум в ушах;
- сонливость;
- общая слабость;
- потеря координации;
- нарушение речи;
- резь в глазах;
- слезотечение;
- удушье;
- усиленное сердцебиение;
- понижение артериального давления;
- тошнота;
- приступы рвоты;
- синюшность кожных покровов и слизистых оболочек.
Если отравление тяжёлое, то человек теряет сознание, у него начинаются судороги, за которыми следует кома. А также возможна остановка дыхания и сердцебиения.
Если отравление метаном является хроническим, то пострадавший страдает от частых головных болей, общего недомогания, низкого артериального давления и снижения работоспособности. Человек становится бледным и вялым, испытывает упадок сил. Гипотония может вызывать обмороки. И также возможно истощение нервной системы, которое выражается в повышенной раздражительности, нервозности и тому подобном.
Метан известен, как один из самых опасных газов. Он токсичен, горюч и взрывоопасен. Вещество не имеет ни цвета, ни запаха, а потому обнаружить его в воздухе крайне сложно. Чтобы не подвергать своё здоровье и жизнь опасности, следует внимательно относится к технике безопасности и соблюдать осторожность при работе или бытовом использовании метана.
Органическое вещество Википедия
 Метан, CH4; одно из простейших органических веществ
Метан, CH4; одно из простейших органических веществОргани́ческие соединения, органические вещества́ — вещества, относящиеся к углеводородам или их производным, то есть это класс химических соединений, объединяющий почти все химические соединения, в состав которых входит углерод[1] (за исключением карбидов, угольной кислоты, карбонатов, некоторых оксидов углерода, роданидов, цианидов).
Органические соединения редки в земной коре, но обладают большой важностью, потому что все известные формы жизни основаны на органических соединениях. Такие вещества часто включены в дальнейший круговорот жизни, как например органические вещества почвы (к слову, годовая продукция биосферы составляет 380 млрд.т)[2]. Основные дистилляты нефти считаются строительными блоками органических соединений[3]. Органические соединения, кроме углерода (C), чаще всего содержат водород (H), кислород (O), азот (N), значительно реже — серу (S), фосфор (P), галогены (F, Cl, Br, I), бор (B) и некоторые металлы (порознь или в различных комбинациях)[4].
История[ | ]
Название органические вещества появилось на ранней стадии развития химии во времена господства виталистических воззрений, продолжавших традицию Аристотеля и Плиния Старшего о разделении мира на живое и неживое. В 1807 году шведский химик Якоб Берцелиус предложил назвать вещества, получаемые из организмов, органическими, а науку, изучающую их, — органической химией. Считалось, что для синтеза органических веществ необходима особая «жизненная сила» (лат. vis vitalis), присущая только живому, и поэтому синтез органических веществ из неорганических невозможен. Это представление было опровергнуто Фридрихом Вёлером, учеником Берцелиуса, в 1829 году путём синтеза «органической» мочевины из «минерального» цианата аммония, однако деление веществ на органические и неорганические сохранилось в химической
УГАРНЫЙ ГАЗ — Карта знаний
Связанные понятия
Карбоксигемоглобин (HbCO) — прочное соединение гемоглобина и угарного газа. Избыток карбоксигемоглобина в крови приводит к кислородному голоданию, головокружению, тошноте, рвоте или даже смерти, так как угарный газ, связанный с гемоглобином, лишает его возможности присоединять к себе кислород. С помощью измерительных газовых систем можно точно определять различные токсичные и взрывоопасные газы в воздухе и таким образом своевременно предупреждать ситуации, угрожающие жизни или здоровью людей (например, опасность взрыва или отравления выхлопными газами или сжиженным газом в зданиях, в автомобилях, на кораблях и в больницах, возможные отравления газообразным хлором в бассейнах, окисью углерода в подземных гаражах или диоксидом углерода в винных погребах).Подробнее: Газоизмерительная система
Озонирование — технология очистки, основанная на использовании газа озона — сильного окислителя. Озонатор вырабатывает озон из кислорода, содержащегося в атмосферном воздухе. При производстве озона необходимо удалять влагу из воздуха, иначе в озонаторе будет образовываться азотная кислота. При взаимодействии с окисляющимися химическими веществами и микроорганизмами. Вещества, подвергшиеся окислению, могут перейти в газообразную фазу, выпасть в осадок или не представлять такой опасности, как исходные… Мета́н (лат. methanum), Ch5 — простейший по составу предельный углеводород, бесцветный газ (в нормальных условиях) без запаха. Малорастворим в воде, легче воздуха. При использовании в быту, промышленности в метан обычно добавляют одоранты (обычно тиолы) со специфическим «запахом газа». Метан нетоксичен и неопасен для здоровья человека. Выхлопны́е га́зы (отходящие газы) — отработавшее в двигателе рабочее тело. Являются продуктами окисления и неполного сгорания углеводородного топлива. Выбросы выхлопных газов — основная причина превышения допустимых концентраций токсичных веществ и канцерогенов в атмосфере крупных городов, образования смогов, являющихся частой причиной отравления в замкнутых пространствах. Диокси́д углеро́да или двуо́кись углеро́да (также углеки́слый газ, углекислотá, окси́д углеро́да(IV), у́гольный ангидри́д) — бесцветный газ (в нормальных условиях), почти без запаха (в больших концентрациях с кисловатым «содовым» запахом), с химической формулой CO2. Пероксид натрия (перекись натрия), Na2O2 — желтовато-белые кристаллы с ионной кристаллической решеткой. Надперокси́д ка́лия (диоксид калия, супероксид калия; KO2) — неорганическое соединение жёлтого цвета, которое образуется в результате сгорания расплавленного калия в чистом кислороде. Используется во многих системах жизнеобеспечения. Молекулярный вес 71,10. Температура плавления при нормальном атмосферном давлении 490—530 °C, в вакууме (1—2 мм рт. ст.) 350—415 °C. Гигроскопичен, поглощает из воздуха водяные пары и углекислый газ. Реагирует с водой и этанолом. Плотность 2,158 г/см³. Тетрахлормета́н (четырёххлористый углерод, фреон-10, хладон-10) CCl4 — хлорорганическое соединение, галогеноалкан, бесцветная тяжёлая жидкость, по запаху напоминающая хлороформ. Негорюч. Ядовит. Нерастворим в воде, смешивается с большинством органических растворителей. Хлорамин — неорганическое соединение, хлорпроизводное аммиака, бесцветная маслянистая жидкость, растворимая в холодной воде, разлагается при температурах выше −40°С. Ортоксилол (о-ксилол, ИЮПАК: 1,2-диметилбензол, англ. o-xylene) — органическое вещество, ароматический углеводород. Это бесцветная жидкость, смешивается с этанолом, диэтиловым эфиром, ацетоном, хлороформом, бензолом; растворимость в воде менее 0,015 %. Обра́тная тя́га (опроки́дывание тяги) — отсутствие разрежённости в дымовом или вентиляционном канале, препятствующее удалению продуктов сгорания от работающих приборов (печь, камин, плита, котёл, колонка и др.) или удалению отработанного воздуха из помещения в атмосферу. Дибензантрацéн — или ДБА, полициклический ароматический углеводород с химической формулой С22h24 состоящий из 5 бензольных колец, обладающий канцерогенностью. Является изомером пентацена. Входит в состав смога, выхлопных газов, образуется при сжигании топлива и нефтепродуктов.Подробнее: Дибензантрацен
Фумига́ция (от лат. fumigare — окуривать, дымить) — уничтожение вредителей и возбудителей болезней растений путём отравления их ядовитыми парами или газами (фумига́нтами). Для фумигации используют приборы, называемые фумига́торами. Фосге́н (дихлорангидрид угольной кислоты) — химическое вещество с формулой COCl2, при нормальных условиях — бесцветный чрезвычайно токсичный и удушливый газ с запахом прелого сена. Синонимы: оксид-дихлорид углерода, карбонилхлорид, хлорокись углерода. Азо́тистоводоро́дная кислота́, азоими́д (азидоводород), HN3 — кислота, соединение азота с водородом. Бесцветная, летучая, чрезвычайно взрывоопасная (взрывается при нагреве, ударе или трении) ядовитая жидкость с резким запахом. Яд, отрава — вещество, приводящее в определенных дозах, даже небольших относительно массы тела, к нарушению жизнедеятельности организма: к отравлению, заболеваниям и иным болезненным состояниям и к смертельным исходам. Диметилсульфид — органическое соединение, простейший представитель класса тиоэфиров. Подвижная летучая жидкость с неприятным запахом. Циа́н, дициа́н, (CN)2 — динитрил щавелевой кислоты, бесцветный высокотоксичный и огнеопасный газ с резким запахом; температура плавления tпл=−27,8 °C; температура кипения tкип=−21,15 °C; ограниченно растворим в воде, лучше — в спирте, диэтиловом эфире, уксусной кислоте. Бута́н (C4h20) — органическое соединение, углеводород класса алканов. В химии название используется в основном для обозначения н-бутана. Такое же название имеет смесь н-бутана и его изомера изобутана CH(Ch4)3. Название происходит от корня «бут-» (французское название масляной кислоты — acide butyrique, от др.-греч. βούτῡρον, масло) и суффикса «-ан» (принадлежность к алканам). Вдыхание бутана вызывает дисфункцию лёгочно-дыхательного аппарата. Содержится в природном газе, образуется при крекинге нефтепродуктов… Парциа́льное давление (лат. partialis «частичный» от pars «часть») — давление отдельно взятого компонента газовой смеси. Общее давление газовой смеси является суммой парциальных давлений её компонентов. Окисли́тель — вещество, в состав которого входят атомы, присоединяющие к себе во время химической реакции электроны. Иными словами, окислитель — это акцептор электронов. Окисле́ние — это химический процесс, сопровождающийся увеличением степени окисления атома окисляемого вещества посредством передачи электронов от атома восстановителя (донора электронов) к атому окислителя (акцептору электронов). Скато́л (от др.-греч. σκῶρ, род.п. σκατός «экскременты», 3-метилиндол, 4-метил-2,3-бензпиррол) — органическое гетероциклическое соединение, производное индола (в-метилиндол). Бесцветные кристаллы с очень неприятным запахом. Бензантрацéн, или бензоантрацéн (также тетрафен, англ. tetraphene) — органическое соединение, полициклический ароматический углеводород с формулой С18h22, содержащий 4 конденсированных бензольных кольца, имеет несколько изомеров: тетрацен, трифенилен и хризен. Один из самых распространённых канцерогенов. Входит в состав выхлопных газов, сигаретного дыма, также образуется в результате риформинга, который происходит при процессах сгорания топлива и бытового мусора. В больших количествах содержится…Подробнее: Бензантрацен
Пропаналь (пропионовый альдегид, пропиональдегид) — альдегид пропионовой кислоты. Является изомером ацетона. Хлорофо́рм (он же трихлормета́н, метилтрихлори́д, хладо́н 20) — органическое химическое соединение с формулой CHCl3. При нормальных условиях — бесцветная летучая жидкость c эфирным запахом и сладким вкусом. Практически нерастворим в воде — образует с ней растворы с массовой долей до 0,23 %, — смешивается с большинством органических растворителей. Негорюч. Возможны отравления фосгеном при работе с хлороформом, который долго хранился на свету в тёплом месте. Хлорпикри́н (трихлорнитрометан) CCl3NO2 — жидкость с резким раздражающим запахом; технический продукт может иметь различные оттенки запаха в зависимости от чистоты и способа получения. Используется как компонент фумигантных смесей в сельском хозяйстве, в камерах газоокуривания для проверки герметичности изолирующих и фильтрующих противогазов. Метантио́л (метилмеркапта́н) Ch4SH — простейший представитель гомологического ряда тиолов, бесцветный ядовитый газ с сильным отвратительным запахом, при малых концентрациях напоминающий запах гнилой капусты. Кислоро́д (O, лат. oxygenium) — химический элемент 16-й группы, второго периода периодической системы, с атомным номером 8. Кислород — химически активный неметалл, является самым лёгким элементом из группы халькогенов. Как простое вещество при нормальных условиях представляет собой газ без цвета, вкуса и запаха, молекула которого состоит из двух атомов кислорода (формула O2), в связи с чем его также называют дикислород. Жидкий кислород имеет светло-голубой цвет, а твёрдый представляет собой кристаллы… Диоксид хлора — неорганическое химическое соединение хлора и кислорода, формула: ClO2. Азид таллия, TlN3, — жёлто-коричневое кристаллическое твёрдое вещество, нерастворимое в воде. Хотя оно не так чувствительно, как азиды свинца, меди или серебра, TlN3 может детонировать от искры или открытого огня. Хлорная кислота HClO4 — одноосновная кислота, одна из самых сильных (в водном растворе, pK ≈ −10), безводная — исключительно сильный окислитель, так как содержит хлор в высшей степени окисления +7. Соля́ная кислота́ (также хлороводоро́дная, хлористоводоро́дная кислота) — раствор хлороводорода (HCl) в воде, сильная одноосновная кислота. Бесцветная, прозрачная, едкая жидкость, «дымящаяся» на воздухе (техническая соляная кислота — желтоватого цвета из-за примесей железа, хлора и пр.). В концентрации около 0,5 % присутствует в желудке человека. Соли соляной кислоты называются хлоридами. Пиросульфит натрия (Na2S2O5), или метабисульфит натрия, или натрий пиросернистокислый — соль пиросернистой кислоты, белый или желтоватый кристаллический порошок с резким запахом. Иногда называют также бисульфит натрия, натрий пиросульфит, натрий метабисульфит. Цианиды — соли цианистоводородной (синильной) кислоты. В номенклатуре IUPAC к цианидам относят также C-производные синильной кислоты — нитрилы. Фториды азота — неорганические соединения азота со фтором. Известны трифторид азота NF3, Дифтордиазин N2F2, тетрафторгидразин N2F4, азид фтора FN3, а также оксифторид азота NOF. Попытки синтезировать пентафторид азота NF5 потерпели неудачу. Циани́д ка́лия, или циа́нистый ка́лий, — калиевая соль синильной кислоты, химическая формула KCN. Бесцветные кристаллы, по фактуре и размерам напоминающие сахарный песок. Чрезвычайно ядовит, один из сильнейших ядов. Хорошо растворим в воде (41,7 % по массе при 25 °C, 55 % при 100 °C). Плохо растворим в этаноле, не растворяется в углеводородах. Метилхолантрéн (сокр. МХА) — органическое соединение, известный полициклический ароматический углеводород, образующийся из продуктов сгорания топлива, нефтепродуктов, бытового мусора, в результате риформинга бензантрацена, происходящего при больших температурах. Входит в состав смога, сигаретного дыма. Сильнейший канцероген, приблизительно в 95 раз канцерогеннее бензола. Наиболее распространённый изомером является — 3-метилхолантрен, однако метильные группы могут возникать и в других положениях…Подробнее: Метилхолантрен
Гидрид калия — это неорганическое бинарное химическое соединение белого цвета. Химическая формула KH. Синильная кислота содержится в некоторых растениях, коксовом газе, табачном дыме, выделяется при термическом разложении нейлона, полиуретанов. Смешивается во всех соотношениях с водой, этанолом, диэтиловым эфиром. Фильтрационное горение — один из эффективных способов получения соединений металлов с газами: нитридов, оксидов, гидридов или фторидов. Сжи́женный газ — газ (вещество в обычных условиях, то есть при нормальной температуре и при нормальном атмосферном давлении), который при некоторых условиях может превращаться в жидкость. Хлормета́н (метилхлори́д) — органическое вещество, принадлежащее к группе галогеналканов. Впервые был получен французскими химиками Жаном Батистом Дюма и Эженом Пелиго в 1835 году кипячением смеси метанола, серной кислоты и хлорида натрия. Аналогичный способ используется и в наши дни. Хлорметан — бесцветный легколетучий ядовитый газ со сладковатым запахом. Из-за слабого запаха можно легко не заметить токсичной или взрывоопасной концентрации. Нитромета́н — химическое соединение с формулой СН3-NO2. Простейший представитель нитросоединений алифатического ряда. Нитрометан следует отличать от метилнитрата (эфира метилового спирта и азотной кислоты с формулой СН3ONO2) и изомерного ему метилнитрита с той же брутто-формулой СН3ONO. Тетраметилдигаллан — металлоорганическое соединение галлия с формулой Ga2h3(Ch4)4, летучая жидкость, реагирует с водой и кислородом воздуха.Как появилась нефть? — Мастерок.жж.рф — LiveJournal

Нефть – это маслянистая жидкость природного происхождения. Этот природный ресурс известен с древних времен. Раскопки свидетельствуют, что около 6000 лет до н.э. нефть применялась для связующего материала при строительстве, а в Древнем Египте ее использовали для бальзамирования умерших.
Как же она появилась на Земле?
Есть несколько основных теорий происхождения нефти.

Биогенная или органическая теория
Органическая теория происхождения нефти – классическая версия возникновения этого природного ресурса, которую поддерживают многие ученые.
Суть этой теории заключается в том, что нефть образуется в результате накопления остатков растений и животных на дне водоемов с пресной или морской водой. Когда этот осадок собирается, он уплотняется.
В результате естественных биохимических процессов осадок частично разлагается, при этом происходит выделение сероводорода, диоксида углерода и других соединений.
Когда процесс разложения завершается, осадок проникает на глубину 3-4,5 км. Здесь происходит отделение углеводородов от органической массы при температуре 140-160 градусов.
Впоследствии нефть проникает в подземные пустоты и заполняя их. Таким образом формируются месторождения полезного ископаемого.
В дальнейшем, по мере продвижения вниз, органический пласт подвергается воздействию все более высоких температур. Когда температура превышает показатели в 200 градусов, прекращается выделение углеводородов, но начинается активное выделение газа.
Биогенное происхождение нефти – идея, которую впервые четко описал М. Ломоносов.

Абиогенная или неорганическая теория происхождения
Сторонники абиогенной теории происхождения нефти считают, что образование жидких углеводородов обусловлено геологическими процессами, которые протекают в недрах Земли, и не имеет связи с биологическими процессами.
Согласно данной теории, этан и более тяжелые углеводороды, присутствующие в составе нефти, могут синтезироваться из неорганических соединений, присутствующих в верхней мантии Земли.
Ученые, которые придерживаются биогенной теории происхождения нефти, считают, что запасы этого ресурса невозобновляемые, поэтому их хватит только на следующие 100 лет. В отличие от них, сторонники неорганического происхождение нефти высказывают мнение, что, если пробурить пласты более глубоко, откроются настолько большие запасы, что существующие покажутся каплей в море.
Впервые такой вариант истории происхождения нефти был предложен французским химиком М. Бертло во второй половине 19 века. Он провел несколько экспериментов, в ходе которых выяснил, что углеводороды действительно синтезируются из неорганических веществ.
Разновидность абиогенной гипотезы — карбидная теория происхождения нефти. Она была предложена Д. Менделеевым и подразумевала, что этот ресурс образуется на больших глубинах при условиях высокой температуры, вследствие взаимодействия воды с карбидами металлов.

Теория космического происхождения нефти
Есть и такой вариант происхождения нефти в природе, как космический.
Такая теория рассматривает процесс образования нефти следующим образом: углеводороды этого вещества сформировались из рассеянных неорганических элементов, присутствующих в космическом пространстве и попавших в состав земного вещества еще на стадии формирования планеты.
По мере остывания Земли эти вещества поглощались расплавленной магмой. Таким образом углеводороды проникли в осадочные породы в газообразном состоянии, после чего конденсировались и образовали нефть.
Космическая теория происхождения нефти в конце 19 века В. Соколовым.
Альтернативные версии
Помимо трех основных теорий происхождения нефти существует еще несколько альтернативных версий. К ним относятся такие:
Животная гипотеза. Существует такая теория, которая кратко описывает происхождение нефти как процесс скопления жира морских животных. Сторонники этой гипотезы подвергали сухой перегонке жир китов и тюленей, подвергая его в этот момент высокому давлению;
«Органическая в неорганической». Эта теория носит смешанный характер и основывается на особенностях тектоники плит земли. Подразумевается втягивание органического вещества в глубокие неорганические зоны;
Магматическая теория происхождения нефти. Согласно этой гипотезе, нефть образуется в магме в небольших количествах, а после поднимается по разломам и трещинам, заполняя пористые песчаники;
Климатическая. Это одна из современных теорий происхождения нефти. Ее суть заключается в том, что мировые запасы этого ресурса формируются под влиянием такого фактора, как круговорот углеводорода и воды на земле. Сторонники этой гипотезы выражают мнение, что для формирования залежей нефти требуются не миллионы лет, а всего лишь несколько десятилетий.
Из метана. Известна гипотеза Томаса Голда о происхождении нефти из глубинного метана, исходящего из мантии Земли, основы которой публиковались в 1979—1998 годах. Голд допускал, что этот метан может частично перерабатываться при участии микроорганизмов (глубокая горячая биосфера), что, по его мнению, должно объяснять наличие биомаркеров в нефти.
Согласно информации Международного энергетического агентства, около 13% залежей нефти находится в Арктике.
МЕТАН — Карта знаний
Мета́н (лат. methanum), Ch5 — простейший по составу предельный углеводород, бесцветный газ (в нормальных условиях) без запаха. Малорастворим в воде, легче воздуха. При использовании в быту, промышленности в метан обычно добавляют одоранты (обычно тиолы) со специфическим «запахом газа». Метан нетоксичен и неопасен для здоровья человека. Гидрат метана — супрамолекулярное соединение метана с водой, устойчив при низких температурах и повышенных давлениях, наиболее широко распространённый в природе газовый гидрат. Метан угольных пластов — метан, содержащийся в сорбированном (связанном) состоянии в системе естественных трещин угля. При бурении скважин давление в устье скважины становится ниже, чем давление в пласте за счет чего происходит приток находящейся в трещинах жидкости, а в дальнейшем и метана. Для добычи угольного метана обычно бурятся вертикальные скважины на глубину значительно превышающую залегание водоносных горизонтов. Наиболее популярные методы интенсификации добычи — гидроразрыв пласта, бурение… Анаэробное окисление метана — процесс окисления метана до углекислого газа, производимый некультивируемыми (англ. VBNC) археями групп ANME-1, ANME-2 и ANME-3, близкими к Methanosarcinales при отсутствии в среде молекулярного кислорода. Биохимия и распространённость процесса в природе изучены пока недостаточно.Связанные понятия
Ацетиле́н (по ИЮПАК — этин) — органическое соединение, непредельный углеводород C2h3. Имеет тройную связь между атомами углерода, принадлежит к классу алкинов. При нормальных условиях — бесцветный, очень горючий газ. Монооксид алюминия — бинарное неорганическое соединение металла алюминия и халькогена кислорода с формулой AlO, образуется в виде газа при высокой температуре. Крипто́н — химический элемент с атомным номером 36. Принадлежит к 18-й группе периодической таблицы химических элементов (по устаревшей короткой форме периодической системы принадлежит к главной подгруппе VIII группы, или к группе VIIIA), находится в четвёртом периоде таблицы. Атомная масса элемента 83,798(2) а. е. м.. Обозначается символом Kr (от лат. Krypton). Простое вещество криптон — инертный одноатомный газ без цвета, вкуса и запаха. Болотный газ — бесцветный газ со слабым, но неприятным запахом, который выделяется со дна стоячих водоёмов в результате гниения ила и других остатков растительного и животного происхождения. Смешанный газ — газовая смесь, по составу промежуточная между генераторным и водяным газом. Состав его (в среднем, об. %) CO — 30, N2 — 50, CO2 — 5, h3 — 15. Теплотворная способность смешанного газа составляет около 1300 ккал/м³. Газо́йль (англ. gasoil) — продукт переработки нефти, смесь жидких углеводородов, преимущественно с количеством атомов углерода от 10 до 40 (додекана, декана и других), и примесей (главным образом серо-, азот- и кислородсодержащих) с пределами выкипания 200—500 °C и молекулярной массой 50—500 г/моль. Конве́рсия (от лат. conversio — превращение, изменение) — процесс переработки газов с целью изменения состава исходной газовой смеси. Конвертируют обычно газообразные углеводороды (метан и его гомологи) и оксид углерода (II) с целью получения водорода или его смесей с СО. Эти смеси используют для синтеза органических продуктов и в качестве газов-восстановителей в металлургии или перерабатываются для получения чистого водорода. Надперокси́д ка́лия (диоксид калия, супероксид калия; KO2) — неорганическое соединение жёлтого цвета, которое образуется в результате сгорания расплавленного калия в чистом кислороде. Используется во многих системах жизнеобеспечения. Молекулярный вес 71,10. Температура плавления при нормальном атмосферном давлении 490—530 °C, в вакууме (1—2 мм рт. ст.) 350—415 °C. Гигроскопичен, поглощает из воздуха водяные пары и углекислый газ. Реагирует с водой и этанолом. Плотность 2,158 г/см³. Окисле́ние — это химический процесс, сопровождающийся увеличением степени окисления атома окисляемого вещества посредством передачи электронов от атома восстановителя (донора электронов) к атому окислителя (акцептору электронов). Углеводоро́ды — органические соединения, состоящие из атомов углерода и водорода. Парциа́льное давление (лат. partialis «частичный» от pars «часть») — давление отдельно взятого компонента газовой смеси. Общее давление газовой смеси является суммой парциальных давлений её компонентов. Пероксид натрия (перекись натрия), Na2O2 — желтовато-белые кристаллы с ионной кристаллической решеткой. Гидроочистка — процесс химического превращения веществ под воздействием водорода при высоком давлении и температуре. Гидроочистка нефтяных фракций направлена на снижение содержания сернистых соединений в товарных нефтепродуктах. Побочно происходит насыщение непредельных углеводородов, снижение содержания смол, кислородсодержащих соединений, а также гидрокрекинг молекул углеводородов. Наиболее распространённый процесс нефтепереработки. Фильтрационное горение — один из эффективных способов получения соединений металлов с газами: нитридов, оксидов, гидридов или фторидов. Одноатомный газ — это такой газ, в котором атомы не образуют химических связей друг с другом. Атомы одноатомных газов иногда называют одноатомными молекулами. Бута́н (C4h20) — органическое соединение, углеводород класса алканов. В химии название используется в основном для обозначения н-бутана. Такое же название имеет смесь н-бутана и его изомера изобутана CH(Ch4)3. Название происходит от корня «бут-» (французское название масляной кислоты — acide butyrique, от др.-греч. βούτῡρον, масло) и суффикса «-ан» (принадлежность к алканам). Вдыхание бутана вызывает дисфункцию лёгочно-дыхательного аппарата. Содержится в природном газе, образуется при крекинге нефтепродуктов… Газифика́ция — преобразование органической части твёрдого или жидкого топлива в горючие газы при высокотемпературном (1000—2000 °C) нагреве с окислителем (кислород, воздух, водяной пар, CO2 или, чаще, их смесь). Полученный газ называют генераторным по названию аппаратов, в которых проводится процесс — газогенераторов. Ксено́н — элемент 8-й группы (по устаревшей классификации — элемент главной подгруппы VIII группы), пятого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 54. Обозначается символом Xe (лат. Xenon). Простое вещество ксенон — благородный одноатомный газ без цвета, вкуса и запаха. Коксовый газ — горючий газ, образующийся в процессе коксования каменного угля, то есть при нагревании его без доступа воздуха до 900—1100 °С. Коксовый газ содержит много ценных веществ. Кроме водорода, метана, оксидов углерода в его состав входят пары каменноугольной смолы, бензол, аммиак, сероводород и др. Парогазовая смесь выделяющихся летучих продуктов (до 25 % от общей массы перерабатываемого угля) отводится через газосборник для улавливания и переработки. Для разделения летучие продукты охлаждают… Диметилсульфид — органическое соединение, простейший представитель класса тиоэфиров. Подвижная летучая жидкость с неприятным запахом. Кислоро́д (O, лат. oxygenium) — химический элемент 16-й группы, второго периода периодической системы, с атомным номером 8. Кислород — химически активный неметалл, является самым лёгким элементом из группы халькогенов. Как простое вещество при нормальных условиях представляет собой газ без цвета, вкуса и запаха, молекула которого состоит из двух атомов кислорода (формула O2), в связи с чем его также называют дикислород. Жидкий кислород имеет светло-голубой цвет, а твёрдый представляет собой кристаллы… Окисли́тель — вещество, в состав которого входят атомы, присоединяющие к себе во время химической реакции электроны. Иными словами, окислитель — это акцептор электронов. Ортоксилол (о-ксилол, ИЮПАК: 1,2-диметилбензол, англ. o-xylene) — органическое вещество, ароматический углеводород. Это бесцветная жидкость, смешивается с этанолом, диэтиловым эфиром, ацетоном, хлороформом, бензолом; растворимость в воде менее 0,015 %. Парниковые газы — газы с высокой прозрачностью в видимом диапазоне и с высоким поглощением в дальнем инфракрасном диапазоне. Присутствие таких газов в атмосферах планет приводит к появлению парникового эффекта. Надперокси́д руби́дия (диоксид рубидия, супероксид рубидия; RbO2) — неорганическое вещество жёлтого цвета, которое образуется в результате сгорания расплавленного рубидия на воздухе. Фторуглероды (перфторуглеводороды) — углеводороды, в которых все атомы водорода замещены на атомы фтора. В названиях фторуглеродов часто используют приставку «перфтор» или символ «F», напр. (CF3)3CF — перфторизобутан, или F-изобутан. Низшие фторуглероды — бесцветные газы (до C5) или жидкости (табл.), не растворяются в воде, растворяются в углеводородах, плохо — в полярных органических растворителях. Фторуглероды отличаются от соответствующих углеводородов большей плотностью и, как правило, более… Циклогекса́н — органическое соединение из класса циклоалканов. Химическая формула — C6h22. Пентаны — насыщенные ациклические углеводороды класса алканов. Имеют пять атомов углерода в молекуле (от др.-греч. πέντε — пять). Сернистые соединения нефти — сложные смеси, состоящие из меркаптанов, сульфидов, а также дисульфидов и гетероциклических соединений. Сера является самым распространенным из гетероатомов в нефти и нефтепродуктах. Её содержание в нефти составляет от сотых долей процента (бакинские, туркменские, сахалинские нефти) до 5—6 % (нефти Урало-Поволжья и Сибири), реже до 14 % (месторождение Пойнт, США). Наиболее богатой сернистыми соединениями является нефть, залегающая среди карбонатных пород, а нефть песчаных… Проце́сс Га́бера (Ха́бера) — промышленный процесс (изобретен Фрицем Габером и Карлом Бошем), в котором атмосферный азот «связывается» путём синтеза аммиака. Смесь азота и водорода пропускается через нагретый катализатор под высоким давлением. При этом за счет высокого давления равновесие в реакции N2+3h3 ⇄ 2Nh4 смещается в сторону аммиака. Водород для получения аммиака извлекают из метана, обрабатывая его водяным паром. Фториды азота — неорганические соединения азота со фтором. Известны трифторид азота NF3, Дифтордиазин N2F2, тетрафторгидразин N2F4, азид фтора FN3, а также оксифторид азота NOF. Попытки синтезировать пентафторид азота NF5 потерпели неудачу. Гидрид калия — это неорганическое бинарное химическое соединение белого цвета. Химическая формула KH. Диоксид хлора — неорганическое химическое соединение хлора и кислорода, формула: ClO2. Сжиже́ние га́зов включает в себя несколько стадий, необходимых для перевода газа в жидкое состояние. Эти процессы используются для научных, промышленных и коммерческих целей. Нитрид плутония — бинарное неорганическое соединение азота и плутония с формулой PuN. Пропиле́н (пропен) СН2=СН-СН3 — непредельный (ненасыщенный) углеводород ряда этилена, горючий газ. Вещество с наркотическим действием более сильным, чем у этилена. Класс опасности — четвертый. Ги́дрелиокс; русское название — КВГС (Кислородно-водородно-гелиевая смесь) — обозначение дыхательных газовых смесей для подводных погружений, состоящих из гелия, водорода и кислорода. Тетраоксид диазота (азотный тетраоксид, АТ, «амил») — вещество с формулой N2O4, преобладающее в жидкости, полученной охлаждением диоксида азота ниже точки кипения. Это теоретически бесцветная, но на практике окрашенная в жёлто-коричневый цвет (обусловленный примесью мономерного диоксида азота) летучая ядовитая жидкость с едким запахом. Температура кипения при атмосферном давлении +21,15 °C, кристаллизации — −11 °C. В кристаллическом виде при температурах ниже −12 °C бесцветен. Процесс Клауса — процесс каталитической окислительной конверсии сероводорода. Источник сероводорода — природные и промышленные газы. Природными источниками являются месторождения нефти и газа, вулканическая деятельность, разложение биомассы и т.д. Промышленные источники — переработка нефти и газа (процессы гидроочистки и гидрокрекинга), металлургия и т.д. Диоксидифторид (дифтордиоксид) — бинарное соединение кислорода и фтора с химической формулой O2F2. Оксиды — весьма распространённый тип соединений, содержащихся в земной коре и во Вселенной вообще. Примерами таких соединений являются ржавчина, вода, песок, углекислый газ, ряд красителей. Оксидами также является класс минералов, представляющих собой соединения металла с кислородом (см. Окислы).Разница между органическими и неорганическими


Термины «органический» и «неорганический» в химии означают нечто иное, чем когда вы говорите о продуктах питания и продуктах. Органические и неорганические соединения составляют основу органической химии и неорганической химии. Химики-органики изучают органические молекулы, их синтез и реакции между ними.Химики-неорганики изучают все другие типы веществ, включая соли, металлы и минералы.
Основное различие между двумя классами веществ состоит в том, что органические соединения всегда содержат элемент углерод, в то время как в большинстве неорганических соединений этот элемент отсутствует. Поскольку существуют углеродсодержащие неорганические соединения, наличие углерода недостаточно для классификации соединения как органического! За очень немногими исключениями, органические соединения содержат атомы углерода, связанные с атомами водорода, образуя связи C-H.Многие органические соединения также содержат атомы кислорода.
Примеры органических соединений
Соединения, производимые в живых организмах, представляют собой органические молекулы. Основные классы органических соединений — это углеводы, жиры, белки и нуклеиновые кислоты.
Примеры органических веществ:
- Сахароза (столовый сахар), C 12 H 22 O 11
- Метан, CH 4
- ДНК
- Бензол, C 6 H 6
- Этанол (зерновой спирт), C 2 H 6 O
- Уголь
- Волосы и ногти (кератиновый белок)
- Целлюлоза
- Масло
- Ферменты
Органические соединения без связей CH
Есть несколько органических соединений, содержащих углерод, но без связи CH.Примеры включают:
- Тетрахлорид углерода, CCl 4
- Мочевина, CO (NH 2 ) 2
Примеры неорганических соединений
Неорганические вещества включают все чистые элементы, соли, многие кислоты и основания, металлы и сплавы, а также минералы. Соединения, в которых неуглеродный атом образует химическую связь с водородом, являются неорганическими.
Примеры неорганических веществ:
- Хлорид натрия (поваренная соль), NaCl
- Аргон, Ar
- Серебро, Ag
- Латунь
- Стекло, SiO 2
- Сера
Неорганические молекулы, содержащие углерод
Некоторые неорганические соединения содержат углерод.Примеры включают:
- Алмаз (чистый углерод)
- Диоксид углерода, CO 2
- Цианиды (связь CN)
- Карбиды (например, карбид бора, B 4 C)
- Дисульфид углерода, CS 2
- Фосген, COCl 2
Не все органические вещества происходят из жизни
Большинство органических соединений вырабатываются в живых организмах, но молекулы могут образовываться посредством других процессов. Например, органические соединения, обнаруженные на Марсе или в туманности, не обязательно являются признаком внеземной жизни.Солнечное излучение может поставлять энергию, необходимую для преобразования неорганических соединений в органические.
.метана | Определение, свойства, использование и факты
Метан , бесцветный газ без запаха, который часто встречается в природе и является продуктом определенной деятельности человека. Метан — простейший член парафинового ряда углеводородов и один из самых сильных парниковых газов. Его химическая формула — CH 4 .
метановый цикл Encyclopdia Britannica, Inc.Британская викторина
Ветер и воздух: факт или вымысел?
Пассаты дуют с севера на юг.
Химические свойства метана
Метан легче воздуха, его удельный вес составляет 0,554. Он слабо растворяется в воде. Легко горит на воздухе, образуя углекислый газ и водяной пар; пламя бледное, слегка яркое и очень горячее. Точка кипения метана составляет -162 ° C (-259,6 ° F), а точка плавления -182,5 ° C (-296,5 ° F). Метан в целом очень стабилен, но смеси метана и воздуха с содержанием метана от 5 до 14 процентов по объему взрывоопасны.Взрывы таких смесей часто случаются на угольных шахтах и угольных шахтах и являются причиной многих аварий на шахтах.
структура метана Тетраэдрическая структура метана (CH 4 ) объясняется в теории VSEPR (валентная оболочка-электронная пара отталкивания) молекулярной формы, предполагая, что четыре пары связывающих электронов (представленные серыми облаками) ) занимают позиции, сводящие к минимуму их взаимное отталкивание. Encyclopædia Britannica, Inc.Источники метана
В природе метан образуется в результате анаэробного бактериального разложения растительного вещества под водой (где его иногда называют болотным газом или болотным газом).Водно-болотные угодья являются основным естественным источником производимого таким образом метана. К другим важным природным источникам метана относятся термиты (в результате процессов пищеварения), вулканы, жерла на дне океана и отложения гидрата метана, которые встречаются вдоль окраин континентов и под антарктическими льдами и арктической вечной мерзлотой. Метан также является основным компонентом природного газа, который содержит от 50 до 90 процентов метана (в зависимости от источника) и встречается как компонент горючего газа (горючего газа) вдоль угольных пластов.
химическая структура метана Тетраэдрическая геометрия метана: (A) модель стержня и шарика и (B) диаграмма, показывающая валентные углы и расстояния. (Простые связи обозначают связи в плоскости изображения; клин и пунктир обозначают связи, направленные к зрителю и от него, соответственно.) Encyclopædia Britannica, Inc.Производство и сжигание природного газа и угля являются основными антропогенными факторами. (связанные с человеком) источники метана. Такие виды деятельности, как добыча и переработка природного газа и деструктивная перегонка битуминозного угля при производстве угольного газа и коксового газа, приводят к выбросу значительных количеств метана в атмосферу.Другая деятельность человека, связанная с производством метана, включает сжигание биомассы, животноводство и управление отходами (где бактерии производят метан, разлагая отстой на очистных сооружениях и разлагающиеся вещества на свалках).
Получите эксклюзивный доступ к контенту из нашего 1768 First Edition с подпиской. Подпишитесь сегодняИспользование метана
Метан — важный источник водорода и некоторых органических химикатов. Метан реагирует с паром при высоких температурах с образованием окиси углерода и водорода; последний используется при производстве аммиака для удобрений и взрывчатых веществ.Другие ценные химические вещества, полученные из метана, включают метанол, хлороформ, четыреххлористый углерод и нитрометан. При неполном сгорании метана образуется технический углерод, который широко используется в качестве армирующего агента в резине, используемой для автомобильных шин.
Роль как парниковый газ
Метан, который производится и выбрасывается в атмосферу, поглощается стоками метана, которые включают почву и процесс окисления метана в тропосфере (нижний уровень атмосферы).Большая часть метана, производимого естественным путем, компенсируется его поглощением в естественных стоках. Однако антропогенное производство метана может вызвать более быстрое увеличение концентраций метана, чем они компенсируются поглотителями. С 2007 года концентрация метана в атмосфере Земли увеличивалась на 6,8–10 частей на миллиард (ppb) в год. К 2020 году содержание метана в атмосфере достигло 1873,5 частей на миллиард, что примерно в два-три раза выше, чем доиндустриальные уровни, которые колебались на уровне 600-700 частей на миллиард.
Повышенная концентрация метана в атмосфере способствует парниковому эффекту, в результате чего парниковые газы (особенно углекислый газ, метан и водяной пар) поглощают инфракрасное излучение (чистую тепловую энергию) и переизлучают его обратно на поверхность Земли, потенциально задерживая тепло и производя существенные изменения климата.Повышенное содержание метана в атмосфере также косвенно усиливает парниковый эффект. Например, при окислении метана гидроксильные радикалы (OH —) удаляют метан, вступая с ним в реакцию с образованием диоксида углерода и водяного пара, а по мере увеличения концентрации атмосферного метана концентрация гидроксильных радикалов уменьшается, эффективно продлевая время жизни метана в атмосфере ,
The Editors of Encyclopaedia Britannica Эта статья была недавно отредактирована и обновлена редактором Джоном П. Рафферти.Узнайте больше в этих связанных статьях Britannica:
глобальное потепление: метан
Метан (CH 4 ) — второй по значимости парниковый газ. CH 4 более мощный, чем CO 2 , потому что радиационное воздействие, производимое на одну молекулу, больше.Кроме того, инфракрасное окно менее насыщено в диапазоне длин волн излучения, поглощаемого CH 4 , поэтому больше…
парниковый газ: метан
Метан (CH 4 ) — второй по значимости парниковый газ.CH 4 более мощный, чем CO 2 , потому что радиационное воздействие, производимое на одну молекулу, больше. Кроме того, инфракрасное окно менее насыщено в диапазоне длин волн излучения, поглощаемого CH 4 , поэтому больше…
Климат: Климат и жизнь
… пар, двуокись углерода, окись углерода, метан, озон, двуокись азота, азотная кислота, аммиак и ионы аммония, закись азота, двуокись серы, сероводород, карбонилсульфид, диметилсульфид и сложный набор неметановых углеводородов.Из них…
Органический и неорганический полистирол. 3.2. Сделать вывод о практическом применении органических и неорганических веществ на основе их химических и физических свойств.
Презентация на тему: «Органические и неорганические ПС. 3.2. Сделайте выводы о практическом применении органических и неорганических веществ на основе их химических и физических свойств». — Стенограмма презентации:
1
Органический vs.Неорганический ПС. 3.2. Сделать вывод о практическом применении органических и неорганических веществ на основе их химических и физических свойств. 
2
Органические соединения Соединения, в основном содержащиеся в живых существах и содержащие углерод. www.global-b2b-network.com/b2b/98/596/activat … www.canadian-diamonds-wholesale.com/ 
3
Углерод может образовывать множество органических соединений, потому что: он имеет 4 электрона на внешнем энергетическом уровне, поэтому он может образовывать четыре ковалентные связи с атомами углерода или других элементов.www.green-planet-solar-energy.com 
4
Углерод может образовывать множество органических соединений, потому что: Он может связываться вместе с другими атомами углерода во многих различных структурах, таких как цепи, разветвленные цепи или кольца. www4.nau.edu 
5
Углерод может образовывать множество органических соединений, потому что: Он может образовывать одинарные, двойные или тройные связи.Он может связываться с атомами других элементов, таких как водород и кислород. www.britannica.com/EBchecked/topic-art/278523 … 
6
Углеводородное соединение, состоящее только из атомов углерода и водорода. Производят более 90% энергии, потребляемой людьми. Примеры: –метан (CH 4), используемый для природного газа –Пропан (C 3 CH 8), используемый в уличных грилях и нагревателях в воздушных шарах. 
7
Полимеры Углеводороды образуют молекулы с длинной цепью, называемые полимерами.Используется для изготовления пластмасс и синтетических волокон. science.howstuffworks.com/question581.htm http://pslc.ws/macrog/kidsmac/nylon.htm 
8
Биологические соединения Биологические полимеры: огромные цепочечные молекулы, которые встречаются в живых организмах. 1. белки 2. нуклеиновые кислоты 3. углеводы 4. липиды 
9
Белки Крупные органические полимеры, образованные из органических мономеров, называемых аминокислотами.Содержит группы –Nh3 и -COOH www.nytimes.com/…/adam/19823Proteins.html 
10
Белки Белки составляют ваши мышцы, сухожилия, волосы и ногти. Ваше тело расщепляет белки на аминокислотные мономеры. Затем ваше тело использует эти аминокислотные мономеры для создания новых белков. 
11
Органические полимеры нуклеиновых кислот образованы из мономеров, называемых нуклеотидами.Контролируйте деятельность и размножение клеток. Включены РНК и ДНК www.concord.org/…/dna/dna_helix_code2.html 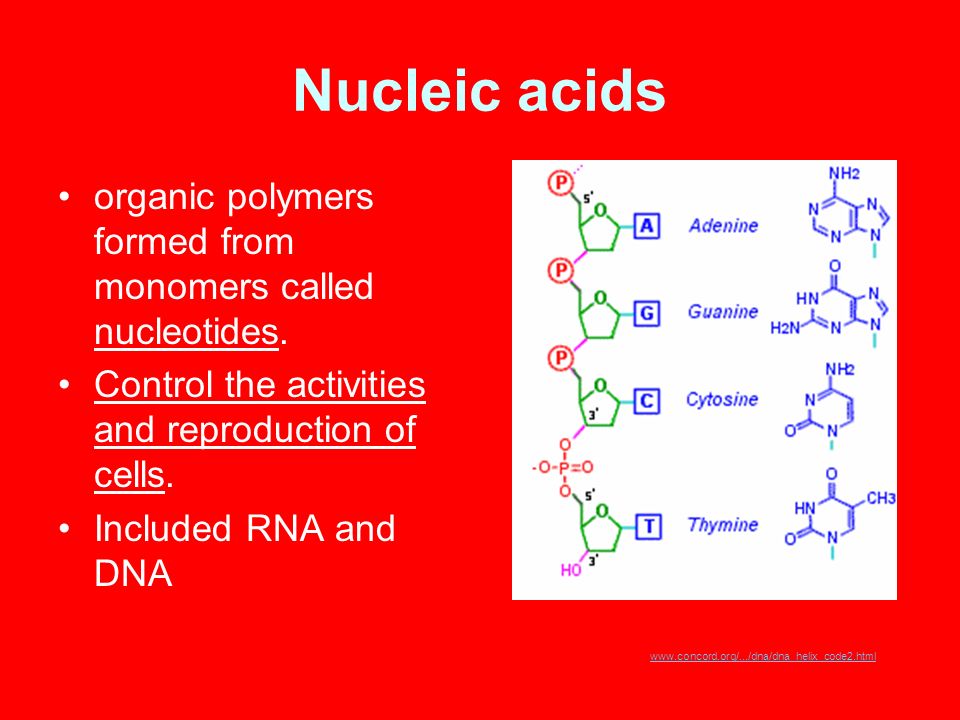
12
Углеводные соединения, содержащие углерод, водород и кислород. Отношение углерода к водороду составляет 2: 1 herkules.oulu.fi/isbn9514267990/html/x566.html 
морская вода | Состав, соленость, распределение и факты
Морская вода , вода, из которой состоят океаны и моря, покрывающая более 70 процентов поверхности Земли. Морская вода представляет собой сложную смесь 96,5% воды, 2,5% солей и меньшего количества других веществ, включая растворенные неорганические и органические материалы, твердые частицы и несколько атмосферных газов.
Чистая вода океана рядом с пляжем на острове Гранд Багама на Багамах. © Филип Кобленц — Digital Vision / Getty ImagesБританская викторина
Мировой океан: факт или вымысел?
Индийский океан — второй по величине в мире.
Морская вода представляет собой богатый источник различных коммерчески важных химических элементов. Большая часть мирового магния извлекается из морской воды, как и большие количества брома. В некоторых частях мира хлорид натрия (поваренная соль) по-прежнему получают путем испарения морской воды. Кроме того, опресненная морская вода может обеспечить безграничный запас питьевой воды. Многие крупные опреснительные установки были построены в засушливых районах на побережье Среднего Востока и в других местах, чтобы восполнить дефицит пресной воды.
Химические и физические свойства морской воды
Шесть самых распространенных ионов морской воды: хлорид (Cl — ), натрий (Na + ), сульфат (SO 2 4 — ), магний (Mg 2+ ), кальций ( Ca 2+ ) и калий (K + ). По весу эти ионы составляют около 99 процентов всех морских солей. Количество этих солей в объеме морской воды варьируется из-за местного добавления или удаления воды (например,г., за счет осаждения и испарения). Содержание соли в морской воде обозначается соленостью ( S ), которая определяется как количество соли в граммах, растворенной в одном килограмме морской воды, и выражается в частях на тысячу. Было замечено, что соленость в открытом океане колеблется от 34 до 37 частей на тысячу (0/00 или ppt), что также может быть выражено как от 34 до 37 практических единиц солености (psu).
Неорганический углерод, бромид, бор, стронций и фторид составляют другие основные растворенные вещества в морской воде.Из многих второстепенных растворенных химических компонентов неорганический фосфор и неорганический азот являются одними из самых заметных, поскольку они важны для роста организмов, населяющих океаны и моря. Морская вода также содержит различные растворенные атмосферные газы, в основном азот, кислород, аргон и диоксид углерода. Некоторые другие компоненты морской воды представляют собой растворенные органические вещества, такие как углеводы и аминокислоты, и частицы, богатые органическими веществами. Эти материалы происходят в основном в верхних 100 метрах (330 футов) океана, где растворенный неорганический углерод превращается в процессе фотосинтеза в органическое вещество.
Получите эксклюзивный доступ к контенту из нашего 1768 First Edition с подпиской. Подпишитесь сегодняМногие характеристики морской воды соответствуют характеристикам воды в целом из-за их общих химических и физических свойств. Например, молекулярная структура морской воды, как и пресной воды, способствует образованию связей между молекулами. Некоторые отличительные качества морской воды связаны с содержанием в ней соли. Вязкость (т.е. внутреннее сопротивление потоку) морской воды, например, выше, чем у пресной воды, из-за ее более высокой солености.Плотность морской воды также выше по той же причине. Температура замерзания морской воды ниже, чем у чистой воды, а точка кипения выше.
Химический состав
На химический состав морской воды влияет множество механизмов химического переноса. Реки добавляют растворенные химические вещества и твердые частицы к окраинам океана. Переносимые ветром частицы переносятся в районы срединного океана на тысячи километров от их континентальных источников. Гидротермальные растворы, которые циркулировали через материалы земной коры под морским дном, добавляют как растворенные, так и твердые вещества в глубину океана.Организмы в верхних слоях океана превращают растворенные вещества в твердые вещества, которые в конечном итоге оседают на больших океанских глубинах. Твердые частицы, попадающие на морское дно, а также материалы как на морском дне, так и внутри него, подвергаются химическому обмену с окружающими растворами. Благодаря этим локальным и региональным механизмам поступления и удаления химикатов каждый элемент в океанах имеет тенденцию проявлять пространственные и временные колебания концентрации. Физическое перемешивание в океанах (термохалинная и ветровая циркуляция) способствует гомогенизации химического состава морской воды.Противоположные влияния физического перемешивания и биогеохимических механизмов ввода и удаления приводят к существенному разнообразию химического распределения в океанах.
,