Алгоритм уравнивания овр методом полуреакций
1. Записать схему реакции, которую требуется уравнять:
Na2SO3 + KJO3 + H2SO4 → Na2SO4 + J2 + K2SO4 + H2O
2. Определить степени окисления всех атомов, участвующих в реакции. Найти элементы, меняющие степень окисления и определить, в состав каких молекул или ионов они входят:

3. Определить характер среды и составить схемы полуреакций окисления и восстановления. Определить число электронов, участвующих в полуреакциях. Для них найти наименьшее общее кратное и дополнительные множители (коэффициенты) для каждой полуреакции:
Среда кислая, т.к. одно из исходных веществ – серная кислота.
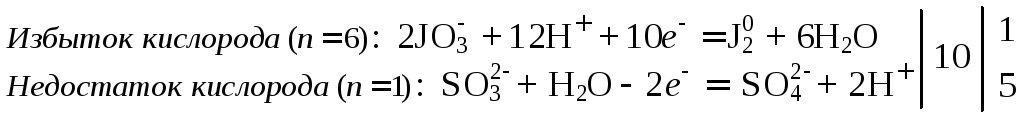
4. Сложить уравнения полуреакций с учетом дополнительных множителей и получить сокращенное ионное уравнение реакции. Электроны при этом сокращаются:

Одинаковые ионы в левой и правой частях можно сократить:
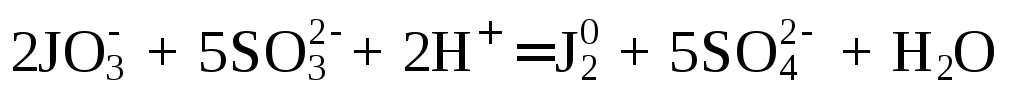
5. Каждый ион дополнить таким количеством соответствующих противоионов, чтобы в сумме они образовали нейтральные молекулы веществ из уравниваемой реакции.
Число противоионов, добавленных в левой и правой частях, должно быть одинаковым. Недостающие ионы необходимо прибавить отдельно:
В правой части не
хватает ионов 
 ,
их необходимо добавить отдельно:
,
их необходимо добавить отдельно:6. Составить молекулярное уравнение, объединив соответствующие ионы в молекулы, и расставить в нем коэффициенты:
2KJO3 +5Na2SO3 + H2SO4 = J2 + 5Na2SO4 + K2SO4 + H2O
Типы окислительно-восстановительных реакций
1. Межмолекулярные – ОВР, в которых окислитель и восстановитель находятся в разных молекулах:

В данной реакции 2 молекулы азотной кислоты идут на восстановление до NO, а еще 6 – на связывание трех ионов меди. Поэтому общий коэффициент перед азотной кислотой равен 8:
3Cu + 8HNO3(разб) = 3Cu(NO3)2 + 2NO + 4H2O
2. Внутримолекулярные – ОВР, в которых окислитель и восстановитель находятся в одной молекуле.
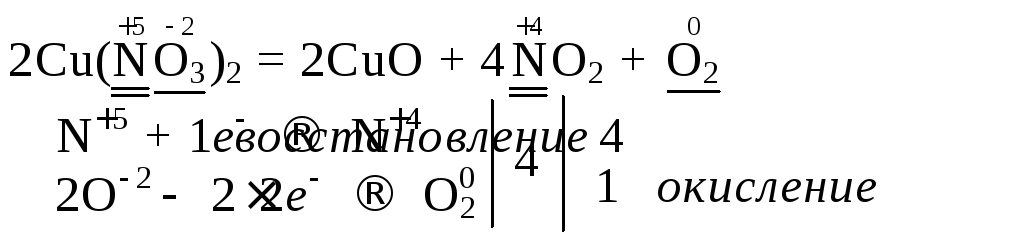
3. Реакции диспропорционирования – ОВР, в которых окислителем и восстановителем является одна и та же частица.
а) Дисмутация – одна часть атомов восстанавливается, а другая часть тех же атомов окисляется:

б) Коммутация – разные вещества, содержащие атомы одного элемента в разных степенях окисления, превращаются в одно и то же вещество:
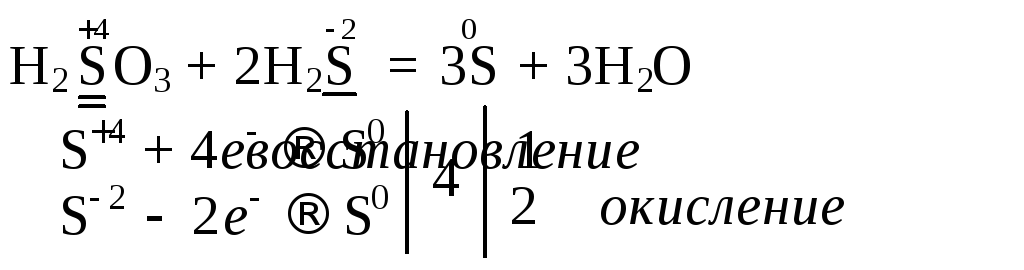
Экспериментальная часть
Цель работы:
Познакомиться с типами окислительно-восстановительных реакций. Изучить окислительно-восстановительные свойства некоторых веществ. Освоить методы уравнивания ОВР.
Оборудование и реактивы:
Растворы: йода J2 (спиртовый), сульфита натрия Na2SO3 (0,5н), дихромата калия K2Cr2O7 (0,5н), серной кислоты H2SO4 (2н), сульфата марганца(II) (0,5н), пероксида водорода H2O2 (3 %), перманганата калия KMnO4 (0,5н), гидроксида калия KOH (2н). Дихромат аммония (NH4)2Cr2O7 (тв.). Перманганат калия KMnO4 (тв.). Серная кислота H2SO4 (конц.). Вода.
Асбестированная сетка. Фарфоровая чашка. Пипетка. Стеклянная палочка. Спиртовка. Спички. Пробирки.
Восстановительные свойства сульфитов
В первую пробирку налить 1 мл водного раствора йода.
Во вторую налить 1 мл раствора дихромата калия и подкислить несколькими каплями разбавленной серной кислоты.
В каждую пробирку добавить по 1 мл раствора сульфита натрия. Отметить изменение окраски раствора в обеих пробирках.
Запись результатов опыта:
1. Расставить коэффициенты методом полуреакций:
а) Na2SO3 + J2 + H2O → Na2SO4 + HJ
б) Na2SO3+K2Cr2O7+H2SO4→Na2SO4+Cr2(SO4)3+K2SO4+H2O
2. Записать наблюдаемые явления.
3. Какая частица выполняет роль окислителя в каждом случае?
Окислительно-восстановительные свойства пероксида водорода и соединений марганца
В первую пробирку налить 1 мл раствора перманганата калия и подкислить его несколькими каплями разбавленной серной кислоты.
Во второй пробирке ионообменной реакцией получить нерастворимый гидроксид марганца(II).
В каждую пробирку добавить по 1 мл раствора пероксида водорода.
Отметить наблюдаемые изменения.
Запись результатов опыта:
1. Написать реакцию образования гидроксида марганца в ионной и молекулярной формах.
2. Расставить коэффициенты методом электронного баланса. Обозначить окислители и восстановители:
а) H2O2 + KMnO4 + H2SO4 → O2 + MnSO4 + K2SO4 + H2O
б) Mn(OH)2 + H2O2 → MnO2 + H2O
3. Написать реакцию разложения пероксида водорода, катализатором для которой является образующийся диоксид марганца. При этом образуется два вещества, в которых кислород проявляет степени окисления -2 и 0.
4. Почему пероксид водорода способен проявлять и окислительные, и восстановительные свойства?
5. Какие свойства – окислительные или восстановительные – могут проявлять соединения марганца KMnO4, MnO2 и Mn(OH)2? Ответ пояснить.
Влияние рН среды на окислительную способность перманганат-иона
В три пробирки налить по 1 мл раствора перманганата калия.
В первую добавить несколько капель разбавленной серной кислоты.
Вторую оставить без изменений.
В третью добавить несколько капель раствора гидроксида калия.
В каждую пробирку добавить по 1 мл раствора сульфита натрия. Отметить различные признаки реакции во всех пробирках.
Запись результатов опыта:
1. Расставить коэффициенты методом полуреакций:
а) Na2SO3 + KMnO4 + H2SO4 → Na2SO4 + MnSO4 + K2SO4 + H2O
б) Na2SO3 + KMnO4 + H2O → Na2SO4 + MnO2 + KOH
в) Na2SO3 + KMnO4 + KOH → Na2SO4 + K2MnO4 + H2O
2. Описать наблюдаемые явления в каждой пробирке.
3. В какой среде восстановление перманганат-иона протекает наиболее полно? Как рН среды влияет на окислительные способности окислителей?
Типы окислительно-восстановительных реакций
а) Взаимодействие перманганата калия с сульфатом марганца
В пробирку налить 1 мл раствора перманганата калия и добавить 1 мл раствора сульфата марганца.
Что наблюдается?
б) Взаимодействие йода с раствором щелочи
В пробирку налить 1 мл раствора йода. Прилить равный объем раствора гидроксида калия. Отметить изменение окраски.
в) Термическое разложение дихромата аммония («Вулкан»). ДЕМОНСТРАЦИОННЫЙ.
Проводить под тягой или в хорошо проветриваемом помещении!
На асбестированную сетку насыпать небольшую горку порошка дихромата аммония. Спичкой поджечь вершину горки до начала разложения соли. Что наблюдается?
Образовавшуюся рыхлую массу оксида хрома по окончании опыта собрать для дальнейшего использования.
Запись результатов опыта:
1. Расставить коэффициенты методом электронного баланса:
а) MnSO4 + KMnO4 + H2O → MnO2 + K2SO4 + H2SO4
б) J2 + KOH → KJ + KJO + H2O
в) (NH4)
2Cr2O7 → N2 + Cr2O3 + H2O2. Записать наблюдаемые явления в каждом случае.
3. Определить тип каждой из проделанных реакций.
Действие сильных окислителей на органические вещества. ДЕМОНСТРАЦИОННЫЙ
В фарфоровую чашку внести один микрошпатель кристаллического перманганата калия. Добавить несколько капель концентрированной серной кислоты до образования зеленой жидкости оксида марганца(VII).
В полученную жидкость обмакнуть стеклянную палочку. Коснуться палочкой фитиля спиртовки – спиртовка загорается (оксид марганца(VII) очень энергично реагирует со спиртом и тот возгорается).
В чашку с зеленой жидкостью добавить воды. О наличии каких ионов говорит цвет полученного раствора?
Запись результатов опыта:
1. Написать уравнения реакций, протекающих без изменения степеней окисления элементов:
а) Взаимодействия перманганата калия с концентрированной серной кислотой;
б) Разложения неустойчивой марганцевой кислоты.
2. Расставить коэффициенты методом электронного баланса:
Mn2O7 + C2H5OH → MnO2 + CO2 + H2O
3. Написать реакцию взаимодействия Mn2O7 с водой.
4. Записать все наблюдаемые явления.
6
studfile.net
Полуреакции — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 13 января 2017; проверки требуют 4 правки. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 13 января 2017; проверки требуют 4 правки.Полуреакции — реакции окисления или восстановления компонента окислительно-восстановительной реакции. Полуреакции происходят с учётом изменения степеней окисления отдельных веществ, участвующих в окислительно-восстановительной реакции[1]. Каждая полуреакция характеризуется электродным окислительно-восстановительным потенциалом, величина которого определяет лёгкость передачи электронов[2].
Часто понятие полуреакций используется для описания того, что происходит в электрохимической ячейке, например, в гальванической батарее. Полуреакции могут быть записаны для описания как металла, подвергающегося окислению (анод), так и металла, подвергающегося восстановлению (катод).
Полуреакции часто используются как метод балансировки окислительно-восстановительных реакций. Для окислительно-восстановительных реакций в кислотные условия, после того, как сбалансированы атомы и степени окисления, нужно будет добавить ионы H+, чтобы сбалансировать ионы водорода в полуреакции. Окислительно-восстановительные реакции в основных условиях, после того, как сбалансированы атомы и степени окисления, сначала рассматривают это в качестве кислотного раствора, а затем добавляют ионы ОН—, чтобы сбалансировать количество ионов Н+ в полуреакции (что дало бы H2O).
Когда происходит окислительно-восстановительная реакция, мы не видим перераспределение электронов. То, что мы видим — это реагенты (исходный материал) и конечные продукты. В любой окислительно-восстановительной реакции есть две полуреакции: полуреакция окисления и полуреакция восстановления. Сумма этих полуреакций является окислительно-восстановительной реакцией.
Пример: Zn и Cu — гальванические элементы[править | править код]
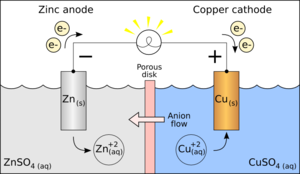
Рассмотрим гальванический элемент, показанный на соседнем изображении: он построен из куска цинка (Zn), погруженного в раствор сульфата цинка (ZnSO4), и куска меди (Cu), погруженного в раствор сульфата меди(II) (CuSO4).
На аноде (Zn) происходит окисление (металл теряет электроны).
- Zn−2e−⟶Zn2+{\displaystyle {\ce {Zn — 2 e- -> Zn^2+}}}
На катоде (Cu) происходит восстановление (электроны принимаются).
- Cu2++2e−⟶Cu{\displaystyle {\ce {Cu^2+ + 2e- -> Cu}}}
Рассмотрим реакцию:
- Cl2+2Fe2+⟶2Cl−+2Fe3+{\displaystyle {\ce {Cl2 + 2Fe^2+ -> 2Cl- + 2Fe^3+}}}
Участвуют два элемента — железо и хлор. У каждого изменяется степень окисления: у железа от +2 до +3, у хлора от 0 до −1. То есть, фактически протекают две полуреакции:
- Fe2+−e−⟶Fe3+{\displaystyle {\ce {Fe^2+ — e- -> Fe^3+}}}
- Cl2+2e−⟶2Cl−{\displaystyle {\ce {Cl2 + 2e- -> 2Cl-}}}
Разложение реакции на полуреакции является ключом к пониманию различных химических процессов. Например, для указанной выше реакции, можно показать, что это окислительно-восстановительная реакция, в которой восстановитель Fe окисляется (отдаёт электроны) и переходит в окисленную форму, а окислитель Cl восстанавливается (принимает электроны) и переходит в восстановленную форму. Обратите внимание на передачу электронов от Fe к Cl. Разложение на полуреакции — это также способ упростить балансировку химического уравнения.
Например:
- Fe2+−e−⟶Fe3+{\displaystyle {\ce {Fe^2+ — e- -> Fe^3+}}} становится 2Fe2+−2e−⟶2Fe3+{\displaystyle {\ce {2 Fe^2+ — 2 e- -> 2 Fe^3+}}}
- добавляется Cl2+2e−⟶2Cl−{\displaystyle {\ce {Cl2 + 2e- -> 2Cl-}}}
- и, наконец, становится Cl2+2Fe2+⟶2Cl−+2Fe3+{\displaystyle {\ce {Cl2 + 2Fe^2+ -> 2Cl- + 2Fe^3+}}}
ru.wikipedia.org
71 Составление овр методами электронного и ионно-электронного баланса (метод полуреакций).
Применяются два вида составления уравнений окислительно-восстановительных реакций:
1) Метод электронного баланса.
2) Метод полуреакций.
По методу электронного баланса сравнивают степени окисления атомов в исходных и конечных веществах, причем число электронов отданных восстановителем, должно ровняться числу электронов, присоединенных окислителем.
Метод полуреакций применяется для реакций между газообразными, твердыми или жидкими веществами, протекающих без электролитической диссоциации.
Например: 1) Метод электронного баланса
+3 +7 +5 +2
H3AsO3 + KMnO4 + H2SO4 →H3AsO4 + MnSO4 + K2SO4 + H2O
Ортомышьяковистая Ортомышьяковая
кислота кислота
Из схемы реакции видно, что степень окисления атома мышьяка до реакции +3 , после +5, степень окисления марганца изменилась от +7 до +2.
Отражаем это изменение степени окисления в электронных уравнениях.
Восстановитель As+3 – 2e— = As+5 5 процесс окисления
Окислитель Mn+7 +5e— = Mn+2 2 процесс восстановления
или методом полуреакций
MnO4— + 8H+ +5e = Mn+2 + 4H2O 2
H3AsO3 + H2O – 2e = H3AsO4 + 2H+ 5
Общее число электронов, отданных восстановителем, должно быть равно общему числу электронов, принятых окислителем. Найдя наименьшее общее кратное определяем, что молекул восстановителя должно быть 5, а молекул окислителя 2, т.е. находим соответствующие коэффициенты в уравнении.
Уравнение будет иметь вид:
5H3AsO3 + 2KMnO4 + 3H2SO4 = 5H3AsO4 + 2MnSO4 + K2SO4 + 3H2O
При составлении уравнений окислительно-восстановительной реакции соблюдают последовательность в исходных веществах записывают сначала восстановитель, затем окислитель и среду, а в продуктах реакции – продукт окисления восстановителя, продукт восстановления окислителя и побочные продукты.
2)Метод полуреакций
Правила составления уравнений ионно-электронным методом
1) Если исходные соединения или ионы содержат больше атомов кислорода, чем продукты реакции, то в кислых растворах избыток кислорода связывается ионами водорода с образованием молекул воды:
MnО—4 + 8H+ + 5e → Mn+2 + 4H2O,
а в нейтральных и щелочных – молекулами воды с образованием гидроксид ионов
NO—3 + 6H2O → NH3 + 9OH— (нейтральная или щелочная)
MnО—4 + 2H2O +3e → MnO2 ↓ + 4OH—
2) Если исходные соединения содержат меньше атомов кислорода, чем продукты реакции, то недостаток кислорода восполняется в кислой и нейтральной средах за счет молекул воды с образованием ионов водорода,
I2 + 6H2O →2 IO—3 + 12H+ +10e (кислая или нейтральная)
а в щелочной среде – за счет гидроксид-ионов, с образованием молекул воды.
CrO—2 + 4OH— = CrO-24 + 2H2O + 3e
SO3-2 + H2O – 2e → SO4-2 + 2H+
SO3-2 + 2OH— -2e → SO4-2 + H2O
Это же правило, но в более короткой формулировке:
если исходные вещества полуреакции содержат больше кислорода, чем продукты реакции, то в кислых растворах освобождающийся кислород связывается в воду, а в нейтральных и в щелочных в гидроксид ион (OH—)
O2-+2H+ = H 2O
O2-+HOH = 2OH—
2) если исходные вещества содержат меньше атомов кислорода, чем образующие, то недостаток их восполняется в кислых и нейтральных растворах за счет молекул воды, а в щелочных за счет гидроксид — ионов.
H2O = O2-+2H+
2OH— = O2-+ H2O
2KMnO4 + Na2SO3 + 2KOH = 2K2MnO4 + Na2SO4 + H2O
+
MnO4— + e = MnO42- 2
SO3-2 + 2OH — 2e = SO4-2+H2O 1
MnO43- + SO3-2 + 2OH— = 2MnO42 —+ SO42- + H2O
Метод полуреакций (электронно – ионный метод) применяют для реакций, протекающих в растворах.
Электронно-ионные уравнения точнее отражают истинные изменения веществ в процессе окислительно-восстановительной реакции и облегчают составление уравнений этих процессов в ионно-молекулярной формуле.
Ионно — электронный метод ( метод полуреакций ) – основан на составлении раздельных ионных уравнений полуреакций – процессов окисления и восстановления – с последующим их суммированием в общее ионное уравнение.
Главные этапы:
1)записывается общая молекулярная схема
K2Cr2O7 + Fe + H2SO4 →Cr2(SO4)3 + FeSO4 + H2O
2)составляется ионная схема реакции. При этом сильные электролиты представлены в виде ионов, а слабые электролиты, осадки и газы – в молекулярном виде. В схеме определяется частица, определяется характер среды ( H+,H2O или OH—)
Cr2O72- + Fe + H+ → Cr3+ + Fe2+
3) Cоставляются уравнения 2-х полуреакций.
а) уравнивается число всех атомов, кроме водорода и кислорода
Cr2O72- + H+ → 2Cr3+
Fe → Fe2+
б) уравнивается кислород с использованием молекул H2O или связывания его в H2O
Cr2O72- + 14H+ → 2Cr3+ + 7 H2O
в)уравниваются заряды с помощью прибавления электронов
Cr2O72- + 14H+ + 6e → 2Cr3+ + 7 H2O
Fe – 2e → Fe2+
4) уравнивается общее число участвующих электронов путем подбора дополнительных множителей по правилу наименьшего кратного и суммируются уравнения обеих полуреакций.
Cr2O72- + 14H+ + 6e →2Cr3+ + 7 H2O 2 1
Fe – 2e → Fe2+ 6 3
Cr2O72- + 3Fe + 14H+ → 2Cr3+ + 3Fe2+ + 7 H2O
5) записываются уравнения в молекулярной форме, с добавлением ионов, не участвующих в процессе окисления- восстановления.
K2Cr2O7 + 3Fe +7H2SO4 = Cr2(SO4)3 + FeSO4 + K2SO4 + + 7 H2O
Достоинства метода: видна роль среды, учитывается реальное состояние частиц в реакции, но применим лишь для реакций в растворах.
studfile.net
Составление уравнений ОВР методом полуреакций — Мегаобучалка
Метод полуреакций основан на составлении ионных уравнений для процессов окисления восстановителя и восстановления окислителя с последующим суммированием их в общее ионное уравнение. При составлении уравнений методом полуреакций необходимо руководствоваться следующими правилами.
1. Если участники ОВР — восстановитель, окислитель и продукты их взаимодействия — сильные электролиты, то они записываются в виде ионов; а слабые электролиты, газы и вещества, выпадающие в осадок — в виде молекул. Продукты реакции устанавливаются на основании известных свойств элементов.
2. Если исходное вещество содержит больше атомов кислорода, чем продукт реакции, то освобождающийся кислород связывается в кислых растворах ионами Н+ с образованием молекул воды, а в нейтральных и щелочных растворах — молекулами воды с образованием гидроксид-ионов, например:
MnO4— + 8H+ + 5 e ® Mn2+ +4H2o,
MnO4—+2H2O+3 e ® MnO2 + 4OH—.
3. Если исходное вещество содержит меньше атомов кислорода, чем продукт реакции, то недостаток их восполняется в кислых и нейтральных растворах за счет молекул воды, а в щелочных — за счет гидроксид-ионов. При этом образуются ионы водорода (в кислых и нейтральных растворах) и молекулы воды (в щелочной среде), например:
SO32-+H2O — 2 e ® SO42-+2H+ ,
SO32- + 2OH— — 2 e ® SO42-+H2O.
4. Коэффициенты для полуреакций окисления и восстановления подбираются таким образом, чтобы количество отданных и принятых электронов было одинаково.
5. Для каждой из полуреакций и суммарного уравнения ОВР должны выполняться правила сохранения материального баланса и баланса электрических зарядов — количество атомов каждого вида и суммарный заряд в левой и правой частях уравнений должны быть одинаковы.
Применение перечисленных правил поясним на примере. Если через подкисленный серной кислотой раствор перманганата калия KMnO4 пропускать сероводород H2S, то малиновая окраска исчезает и раствор мутнеет. Опыт показывает, что помутнение раствора происходит в результате образования элементарной серы: H2S ® S. Для уравнивания зарядов от молекулы сероводорода надо отнять два электрона (что полностью соответствует изменению степени окисления серы с -2 до 0) и в итоге получаем первую полуреакцию — процесса окисления восстановителя — сероводорода:
Н2S — 2 e ® S + 2H+ .
Обесцвечивание раствора перманганата калия связано с переходом иона MnO4— (имеет малиновую окраску) в ион Mn2+ (почти бесцветный), что можно выразить схемой MnO4— ® Mn2+. В кислом растворе кислород, входящий в состав ионов MnO4— , связывается ионами водорода Н+ в молекулы воды (на 4 атома кислорода в ионе MnO4— необходимо 8 Н+), что может быть записано в виде схемы:
MnO4— + 8 Н+ ® Mn2++4H2O .
Чтобы уравнять заряды (заряды исходных веществ — (+7), конечных — (+2)), необходимо к исходным веществам прибавить 5 электронов (что полностью согласуется с уменьшением степени окисления у марганца с (+7) до (+2)):
MnO4—+8H++5 e ® Mn2++4H2O.
Это есть вторая полуреакция — процесс восстановления окислителя — MnO4—.
Для составления общего уравнения реакции надо уравнения полуреакций почленно суммировать, предварительно уравняв число отданных и полученных электронов. Для этого определяют соответствующие множители (в приведенном примере 5 и 2), на которые умножаются полуреакции. Проведенные операции записываются следующим образом:
H2S — 2 e ® S + 2H+ ´5
MnO4— + 8H+ + 5 e ® Mn2++4H2O ´2
5H2S + 2MnO4— + 16H+ ® 5S +10H+ +2Mn2++8H2O
После приведения подобных членов (ионов Н+) окончательно получаем
5H2S + 2MnO4— +6H+ ® 5S + 2Mn2++8H2O.
Проверяем материальный баланс; баланс зарядов в левой и правой частях уравнения: -2+(+6) = 2×(2+).
Методом полуреакций составляется сокращенное ионное уравнение реакции. Чтобы от ионного уравнения перейти к молекулярному, необходимо в левой части ионного уравнения к каждому аниону и катиону подобрать соответствующий катион и анион. Затем такие же ионы в таком же количестве записываются в правой части уравнения, после чего ионы объединяются в молекулы, и окончательно получаем
2K++3SO42-+ 5H2S+2MnO4— +6H+ ® 2K++3SO42-+ 5S + 2Mn2++8H2O,
5H2S + 2KMnO4+3H2SO4 ® 5S+2MnSO4 + K2SO4 + 8H2O.
Реакции окисления-восстановления могут протекать в различных средах: в кислой (избыток Н+ — ионов), нейтральной (Н2О) и щелочной (избыток гидроксид-ионов ОН—). В зависимости от среды может изменяться характер протекания реакции между одними и теми же веществами; среда также влияет на изменение степени окисления атомов. Ниже приводятся схемы восстановления в зависимости от среды раствора наиболее типичных окислителей: KMnO4, H2O2, K2Cr2O7.
Перманганат калия в водных растворах полностью диссоциирует с образованием перманганат-иона MnO4—, который обуславливает окислительные свойства и малиновый цвет растворов. В кислой среде в присутствии восстановителей протекает реакция
MnO4—+8H++5 e— ® Mn2++4H2O,
раствор становится бесцветным. В нейтральной среде протекает другая реакция
MnO4—+ 2Н2О + 3 е— ® MnO2¯ + 4OH— ,
сопровождающаяся выделением бурого осадка MnO2. В нейтральной среде малиновый цвет меняется на светло-зеленый, обусловленный образованием манганат-ионов:
MnO4—+ е— ® MnO42-.
Обычно для создания в растворе кислой среды используют серную кислоту. Азотную и соляную кислоты применять не рекомендуется: азотная кислота сама является окислителем, соляная кислота способна окисляться. Для создания щелочной среды применяют растворы КОН и NaOH.
Пероксид водорода восстанавливается также по-разному в зависимости от среды:
кислая H2O2 + 2H+ + 2 e— ® 2H2O ,
щелочная и нейтральная H2O2 + 2 e— ® 2OH— .
Однако с очень сильными окислителями (KMnO4, K2Cr2O7, (NH4)2S2O8) пероксид водорода выступает как восстановитель:
Н2О2 — 2 е— ® О2 + 2Н+ .
Хром в своих соединениях имеет устойчивые степени окисления +6 и +3. В первом случае соединения хрома проявляют свойства окислителей, во втором — восстановителей. В зависимости от среды для соединений Cr (VI) имеет место равновесие :
2CrO42- + 2H+ « Cr2O72-+H2O; Cr2O72- +2OH— « 2CrO42- + H2O .
В кислой среде ионы Сr2O72- — сильные окислители, они восстанавливаются до соединений Cr3+:
Сr2O72- + 14H++6 e— ® 2Cr3++7H2O.
В щелочной среде ионы [Cr(OH)6]3- окисляются до ионов CrO42-:
[Cr(OH)6]3- + 2OH— — 3 e— ® CrO42- + 4H2O.
Достоинство метода полуреакций по сравнению с методом электронного баланса состоит в том, что в нем применяются не гипотетические ионы, а реально существующие. При методе полуреакций не нужно знать степеней окисления атомов, и видна роль среды как активного участника всего процесса. Наконец, при использовании метода полуреакций не нужно знать все получающиеся вещества: они появляются в уравнении реакции при выводе его.
ВНИМАНИЕ: основная ошибка, приводящая к неверным результатам, — проставление в полуреакциях не зарядов частиц, а степеней окисления атомов.
megaobuchalka.ru
Метод полуреакций при расстановке коэффициентов в ОВР
Закономерности протекания окислительно-восстановительных реакций. Влияние различных факторов на протекание окислительно-восстановительных реакций
ОВ-реакции – это такие реакции, которые протекают с переходом электронов от одних частиц (восстановителя) к другим (окислителю), например, при вытеснении цинком меди из раствора сульфата меди (II).
CuSO4 + Zn → Сu + ZnSO4
Можно дать и другое определение: ОВ-реакция – это реакция, протекающая с изменением степени окисления атомов реагирующих веществ.
При протекании ОВ-реакции происходит процесс окисления и процесс восстановления.
Окисление – это процесс отдачи электронов частицей (молекулой, атомом, ионом). Частица, отдавая электроны, окисляется, а сама является восстановителем по отношению к другой частице.
Zn° — 2e ® Zn2+ – процесс окисления, а цинк будет восстановителем.
При окислении степень окисления атома повышается (цинк повышает степень окисления от нуля до +2, то есть переходит из менее окисленного состояния Zno в более окисленное состояние Zn2+).
Восстановление – это процесс присоединения электронов частицей. Частица, присоединяя электроны, восстанавливается, а сама является окислителем по отношению к другой частице.
Cu2+ + 2e ® Cu° – процесс восстановления, а ион Cu2+ будет окислителем. При восстановлении степень окисления атома уменьшается (медь понижает степень окисления с +2 до нуля).
Окислительно-восстановительные свойства элементов зависят от строения атома данного элемента и определяются положением элемента в ПСЭ. В периоде слева направо (®) восстановительные свойства элементов уменьшаются, а окислительные свойства увеличиваются. В главных подгруппах сверху вниз восстановительные свойства элементов увеличиваются. Поэтому чем правее и выше находится элемент в ПСЭ, тем будет проявлять более сильные окислительные свойства. Самыми сильными окислителями поэтому являются галогены (кроме йода) и кислород. И наоборот, чем левее и ниже находится элемент в ПСЭ, тем сильнее проявляет восстановительные свойства. Поэтому самыми сильными восстановителями являются щелочные (Na, K, Cs и др.) и щелочноземельные (Ca, Sr, Ba) металлы.
Окислительно-восстановительные свойства зависят также от степени окисления элемента в веществе:
1) Если элемент (например, Mn и Cr) находится в высшей степени окисления (например, KMnO4, K2Cr2O7 и др.), то он может только понижать степень окисления, то есть только принимать электроны, являясь только окислителем.
2) Если элемент (например, йод и сера) находится в низшей степени окисления (KI, Na2S и др.), то может только повышать степень окисления, являясь только восстановителем.
3) Если элемент может проявлять в соединениях различную степень окисления и при этом в данном соединении имеет промежуточную степень окисления (Na2SO3, NaNO2, MnO2), то данный элемент может и повышать степень окисления, и понижать, то есть может и окисляться, и восстанавливаться, проявляя окислительно-восстановительную двойственность (то есть может быть и окислителем, и восстановителем).
Например, в КNO2 азот имеет промежуточную степень окисления, равную +3 и может повышать ее до +5 (окисляясь до КNO3), и понижать до +2 (NO), то есть КNO2 может быть и окислителем, и восстановителем.
Метод полуреакций при расстановке коэффициентов в ОВР
Этот метод, как и метод электронного баланса, основывается на том положении, что число электронов, отданных восстановителем, должно равняться числу электронов, присоединенных окислителем. Только метод электронного баланса рассматривает отдельные атомы элементов (Mn+7, Ag+, Cr+6, N-3), а метод полуреакций рассматривает частицы (ионы, молекулы), которые реально есть в растворе, в котором протекает ОВ-реакция.
Рассмотрим ОВ-реакцию, протекающую в кислой среде (среду создает H2SO4):
KMnO4 + KNO2 + H2SO4 ® MnSO4 + KNO3 + K2SO4 + H2O
Определяем степени окисления элементов, которые изменяют степени окисления (то есть марганца и азота), а затем определяем окислитель и восстановитель.
| KMn+7O4 + KN+3O2 + H2SO4 ® Mn+2SO4 + KN+5O3 + K2SO4 + К2SO4 + H2O окислитель восстановитель |
Далее записываем ионную схему реакции: сильные и хорошо растворимые электролиты записываем в виде ионов; слабые электролиты, неэлектролиты, газы и осадки записываем в виде молекул.
Затем составляем полуреакции окисления и восстановления, т.е. процессы окисления и восстановления.
Следует знать следующие два основных правила:
1. Полуреакции отщепления кислорода (восстановления) в кислой среде протекают за счет катионов водорода с образованием молекул воды; в нейтральной и щелочной средах – за счет молекул воды с образованием OH— ионов.
2. Полуреакции присоединения кислорода (окисления) в кислой и нейтральной средах протекают за счет молекул воды с образованием катионов водорода; щелочной среде – за счет OH— ионов с образованием молекул воды.
| MnO4— + 8Н+ | +5e ® | Mn2+ + 4H2O | полуреакция восстановления | |
| 1 + 8 = +7 | +2 + 4×0 = +2 | |||
| NO2— + H2O | –2e ® | NO3— + 2H+ | полуреакция окисления | |
| -1 + 0 = -1 | -1 + 2 = +1 |
Н2О и ионы Н+ есть слева и справа, поэтому сокращаем:
2MnO4— + 6H+ + 5NO2— ® 2Mn2+ + 3H2O + 5NO3—
Уравнение ОВ-реакции в молекулярной форме:
2KMnO4 + 5KNO2 + 3H2SO4 ® 2MnSO4 + 5KNO3 + K2SO4 + + 3H2O
Направление ОВ – реакции, как и любой реакции, можно определить по изменению энергии Гиббса этой реакции, т.е. по ΔG. Рассмотрим, например, ОВ-реакцию Zno + Cu2+ → Cuo + Zn2+. Изменение энергии Гиббса при стандартных условиях для любой ОВ-реакции будет равно:
ΔGореакции = -ZF (jоокисл. — jовосст.),
где F – число Фарадея, равное 96 500 Кулон/моль экв.,
Z – число электронов, участвующих в данной ОВ-реакции,
jоокисл. и jовосст. – стандартные электродные потенциалы окислительной (jоокисл.) и восстановительной (jовосст.) систем.
┌─2e─↓
Для ОВ-реакции Zno + Cu2+ → Cuo + Zn2+, окислительной системой будет медная, для которой jоCu+2/Cuo = + 0,34 в, а восстановительной системой будет цинковая, для которой jоZn2+/Zno = -0,76 в. При этом Z = 2, т.е. два электрона передаются в этой ОВ-реакции от цинка к ионам Cu2+. Поэтому получаем:
ΔGо = — ZF (jоокисл — jовосст) = — 2 ∙ 96 500 (+0,34 – (-0,76)) = -212 300 Дж.
Для данной ОВ-реакции получили ΔGо < 0, поэтому эта реакция будет протекать в прямом направлении, т.е. слева направо (→).
Таким образом, ОВ-реакция будет протекать в прямом направлении (т.е. ΔGо будет меньше нуля) в том случае, когда jоокисл > jовосст.
Читайте также:
Рекомендуемые страницы:
Поиск по сайту
poisk-ru.ru
19. ОВР методом полуреакций — 10 Июля 2013
Уравнивание ОВР методом электронного баланса хорош для реакций, протекающих в газовой среде. Так как большинство процессов, как в химической промышленности, так и в живой природе происходит в растворе, как правило, водном, то, следует поподробнее познакомится с методом полуреакций. Хотя и более сложным, но хорошо описывающем процессы, идущие в жидкой среде. Примеры решения ОВР. На наглядном примере познакомимся с некоторыми тонкостями этой методики. Вначале записываем уравнение реакции, как это сделано на рисунке 1. Затем расставим заряды на атомах, для этого потребуется ряд электроотрицательности элементов. Начнем с кислорода, так как правее кислорода только фтор, а его здесь нет, значит, кислород заберет электроны. На верхней орбитали кислорода только два свободных места, значит, во всех реакциях, кроме реакции с фтором и случаев образования перекиси, кислород имеет заряд 2-. Далее, водород, имея один электрон, он отдает его в любом случае, кроме гидридов металлов; здесь нет гидридов, поэтому, на водороде заряд 1+. Калий, как и все щелочные металлы, имеет один валентный электрон, и будучи металлом, отдает его в любом случае, на калии тоже 1+. Чтобы узнать заряд на сере, посмотрим, где она находится, в конце левой части уравнения видим молекулу серной кислоты. Так как все кислоты начинаются с атомов водорода, за ними следует кислотный остаток. В составе кислотного остатка 4 атома кислорода, по 2- на каждом, итого 8-. Заряд аниона 2-, значит на сере 6+, дабы компенсировать 6- из восьми на кислородах. Так как молекула всегда имеет заряд «0”, а с водородом мы уже определились, тогда кислотный остаток имеет заряд: SO42-, так как, при диссоциации теряет два положительных протона водорода. Кислотный остаток остается неизменным и в солях, как в левой, так и в правой частях уравнения. Раз, атом железа в левой части уравнения встает на место двух протонов водорода, то он должен заменить их по заряду, значит на железе 2+. В правой части уравнения, на два атома железа приходятся три кислотных остатка, значит, 3.(2-)=6-, которые должны компенсировать два атома железа, то есть по 3+ на каждом. Остается хром, в левой части он представлен солью, образованной кислотой на основе хрома («бихромат калия”). На двух калиях по 1+, на семи кислородах по 2-, итого (14-)+2=12-, которые должны компенсировать два атома хрома. То есть, по 6+ на каждом атоме хрома. Здесь я не употребляю слово «ион”, дабы не путать читателя, ибо, ион – свободно отделяемая, при диссоциации в воде частица. В случае солей диссоциация идет на катионы металла и анионы кислотных остатков, кислоты диссоциируют на протоны водорода и кислотные остатки.
Рисунок 1. Заряд на катионах хрома, в правой части уравнения, определяем аналогично, так как «сульфат хрома” то же соль. После определения зарядов на атомах, смотрим, кто изменил свой заряд: хром был 6+, стал 3+; железо было 2+, стало 3+. Значит, в этом уравнении железо – восстановитель, хром – окислитель. Выписываем те реально существующие в растворе частицы, в которых содержится окислитель и восстановитель, как до, так и после реакции. Хром, в ходе реакции, «переселяется” из аниона соли, и становится свободным катионом (анион соль имеет заряд 2-, но для упрощения, он здесь не указан). Железо, как было катионом соли, так им и осталось, только заряд изменился. Для соблюдения баланса материи, подставляем в левую часть полуреакции с хромом (две строки в середине называются – полуреакции, от них метод уравнивания ОВР, получил название: «метод полуреакций”) электроны и протоны для компенсации изменения заряда и связывания атомов кислорода. Так как среда кислотная, то добавлять в обе части полуреакций можем только протоны водорода или молекулы воды. Если бы среда была щелочная, тогда добавляли бы гидроксильные группы и молекулы воды. То есть, в любом случае, реально существующие в растворе «детальки”. Протоны водорода свяжут кислород бихромат аниона в молекулы воды. Для железа, только отнимаем лишний электрон. В результате получаем 6 электронов для полуреакции с хромом и 1 электрон для полуреакции с железом. Наименьшее общее кратное равно 6, записываем множители. Добавляем коэффициенты в исходное уравнение и проверяем материальный баланс, сколько было, столько же должно и остаться. Удобно проверять по неизменным частям, тех же сульфатных анионов, в левой части: 6 у железа и семь у серной кислоты; в правой части: один у калия, три у хрома и девять у железа. В сумме по тринадцать групп SO42-. Два калия пришли с бихроматом, ушли с сульфагруппой. Шесть атомов железа пришли с сульфаргуппами, ушли с ними же, в трех молекулах сульфата, по два железа в каждой. Водород пришел в семи молекулах серной кислоты, по два в каждой; ушел в семи молекулах воды, по две в каждой. Кислород бихромат аниона, как мы помним, связался в семь молекул воды. Этот пример относительно простой, но очень наглядный. Что бы, не было проблем, разберем несколько особых случаев полуреакций, которые могут Вам встретится. На рисунке 2 представлены два типичных представителя перекисных соединений: перекись водорода и перекись бария, вместо бария может быть любой щелочной или щелочноземельный металл. Перекиси – это соединения, имеющие группировку О22-, так как оба кислорода реализуют по одному валентному электрону на связь друг с другом, то эта связь ковалентная неполярная и по ней нет смещения электронной плотности. Эта связь, кстати, значительно прочнее, чем связи кислородов с ионами металлов или катионами водорода. Поэтому, в полуреакциях записываем молекулу перекиси, если это перекись водорода (маленькая константа диссоциации), и анион О22-, если это перекись металла. Перекись водорода в реакциях может выступать в роли окислителя, тогда перекисный кислород принимает электроны и становится обычным двухзарядным кислородом. Или восстановителем, отдавая электроны, и становясь нейтральной молекулой газообразного кислорода. Рисунок 2. Возможна реакция внутримолекулярного диспропорционирования (когда один и тот же элемент в одинаковых молекулах выступает одновременно и окислителем и восстановителем). В этом случае перекись водорода разлагается на молекулярный кислород и воду, без участия других веществ. Инициатором такой реакции служит нагрев, облучение светом или катализатор. Наиболее типичный пример реакции диспропорционирования – это взаимодействие хлора (или любого галогена) с водой или щелочью. Уравнение представлено на рисунке 3. Взаимодействие проводится при высокой температуре (кипящая щелочь), если щелочь будет холодной, то получится гипохлорит и хлорид. Так как реакция щелочная, то добавлять для соблюдения материального баланса в полуреакциях, можем только гидроксильные группы и молекулы воды. Рисунок 3. После уравнивания получили стехиометрические коэффициенты которые делятся на 2, это произошло из-за двухатомности молекулы хлора. Поэтому делим коэффициенты на 2, получаем (с лева на право): 3, 6, 5, 1, 3. Аналогично может диспропорционировать не только любой галоген, но и любой достаточно активный неметалл, например: белый фосфор, мышьяк или сера. Другой случай-исключение, гидриды металлов, все они достаточно неустойчивые соединения, и реакции в водной среде всегда начинаются с гидролиза до основания металла и молекул водорода. В гидридах металлов водород имеет заряд 1-, но гидролиз сведет этот заряд до атомарного водорода с нулевым зарядом. Гидриды металлов – сильные восстановители. Органические соединения могут вести себя по разному, но надо помнить, что связь углерод-водород малополярная, а связь двух одинаковых атомов (например, углерод-углерод) почти всегда неполярна. Поэтому, заряд на атомах водорода и углерода, связанных друг с другом (если эти связи не меняются в ходе реакции) принимается за ноль. В любом случае, проверяйте материальный баланс уравнения, учитывайте свойства реагирующих соединений и смотрите по ситуации. Впоследствии мы еще вернемся к ОВР.
|
www.chemfive.info
Окислительно-восстановительные реакции — Википедия
Окисли́тельно-восстанови́тельные реа́кции (ОВР), также редокс (сокр. англ. redox, от reduction-oxidation — восстановление-окисление) — встречно-параллельные химические реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ (или ионов веществ), реализующимся путём перераспределения электронов между атомом-окислителем (акцептором) и атомом-восстановителем (донором) .
Издавна учёные полагали, что окисление — потеря флогистона (особого невидимого горючего вещества, термин которого ввел Иоганн Бехер), а восстановление — его приобретение. Но, после создания А. Лавуазье в 1777 году кислородной теории горения, к началу XIX века химики стали считать окислением взаимодействие веществ с кислородом, а восстановлением их превращения под действием водорода. Тем не менее в качестве окислителя могут выступать и другие элементы, например
- Fe+2HCl→FeCl2+h3↑{\displaystyle {\mathsf {Fe+2HCl\rightarrow FeCl_{2}+H_{2}\uparrow }}}
В этой реакции окислитель — ион водорода[1] — H+, а железо выступает в роли восстановителя.
В соответствии с электронно-ионной теорией окисления-восстановления, разработанной Л. В. Писаржевским в 1914 г., окисление — процесс отщепления электронов от атомов или ионов элемента, который окисляется; Восстановлением называется процесс присоединения электронов к атомам или ионам элемента, каковой восстанавливается. Например, в реакции
- Zn0+Cl02→Zn+2Cl−12{\displaystyle {\mathsf {{\stackrel {0}{\mbox{Zn}}}+{\stackrel {0}{\mbox{Cl}}}_{2}\rightarrow {\stackrel {+2}{\mbox{Zn}}}{\stackrel {-1}{\mbox{Cl}}}_{2}}}}
атом цинка теряет два электрона, то есть окисляется, а молекула хлора присоединяет их, то есть восстанавливается.
В процессе окислительно-восстановительной реакции восстановитель отдаёт электроны, то есть окисляется; окислитель присоединяет электроны, то есть восстанавливается. Причём любая окислительно-восстановительная реакция представляет собой единство двух противоположных превращений — окисления и восстановления, происходящих одновременно и без отрыва одного от другого.[2]
Окисление[править | править код]
Окисление — процесс отдачи электронов с увеличением степени окисления.
При окисле́нии у веществ в результате отдачи электронов увеличивается степень окисления. Атомы окисляемого вещества называются донорами электронов, а атомы окислителя — акцепторами электронов.
В некоторых случаях при окислении молекула исходного вещества может стать нестабильной и распасться на более стабильные и более мелкие составные части (см. Свободные радикалы). При этом некоторые из атомов получившихся молекул имеют более высокую степень окисления, чем те же атомы в исходной молекуле.
Восстановитель, отдавая электроны, приобретает окислительные свойства, превращаясь в сопряжённый окислитель (сам процесс называется окислением):
- восстановитель — e− ↔ сопряжённый окислитель.
Несвязанный, свободный электрон является сильнейшим восстановителем.
Восстановление[править | править код]
Восстановле́ние — процесс присоединения электронов атомом вещества, при этом его степень окисления понижается.
При восстановлении атомы или ионы присоединяют электроны. При этом происходит понижение степени окисления элемента. Примеры: восстановление оксидов металлов до свободных металлов при помощи водорода, углерода, других веществ; восстановление органических кислот в альдегиды и спирты; гидрогенизация жиров и др.
Окислитель, принимая электроны, приобретает восстановительные свойства, превращаясь в сопряжённый восстановитель (сам процесс называют восстановлением):
- окислитель + e− ↔ сопряжённый восстановитель.
Окислительно-восстановительная пара[править | править код]
Окислитель и его восстановленная форма, либо восстановитель и его окисленная форма составляет сопряжённую окислительно-восстановительную пару, а их взаимопревращения являются окислительно-восстановительными полуреакциями.
В любой окислительно-восстановительной реакции принимают участие две сопряжённые окислительно-восстановительные пары, между которыми имеет место конкуренция за электроны, в результате чего протекают две полуреакции: одна связана с присоединением электронов, то есть восстановлением, другая — с отдачей электронов, то есть окислением.
Виды окислительно-восстановительных реакций[править | править код]
Межмолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах разных веществ, например:
- h3S+Cl2→S+2HCl{\displaystyle {\mathsf {H_{2}S+Cl_{2}\rightarrow S+2HCl}}}
Внутримолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах одного и того же вещества, например:
- 2h3O→2h3+O2{\displaystyle {\mathsf {2H_{2}O\rightarrow 2H_{2}+O_{2}}}}
Диспропорционирование (самоокисление-самовосстановление) — реакции, в которых один и тот же элемент выступает и как окислитель, и как восстановитель, например:
- h3O+Cl2→HCl+HOCl{\displaystyle {\mathsf {H_{2}O+Cl_{2}\rightarrow HCl+HOCl}}}
Репропорционирование (конпропорционирование) — реакции, в которых из двух различных степеней окисления одного и того же элемента получается одна степень окисления:
- SO2+2h3S→3S+2h3O{\displaystyle {\mathsf {SO_{2}+2H_{2}S\rightarrow 3S+2H_{2}O}}}
Окислительно-восстановительная реакция между водородом и фтором
- H02+F02→2H+1F−1{\displaystyle {\mathsf {{\stackrel {0}{\mbox{H}}}_{2}+{\stackrel {0}{\mbox{F}}}_{2}\rightarrow 2{\stackrel {+1}{\mbox{H}}}{\stackrel {-1}{\mbox{F}}}}}}
Разделяется на две полу-реакции:
1) Окисление:
- h30−2e−→2H+{\displaystyle {\mathsf {{\mbox{H}}_{2}^{0}-2{\mbox{e}}^{-}\rightarrow 2{\mbox{H}}^{+}}}}
2) Восстановление:
- F20+2e−→2F−{\displaystyle {\mathsf {{\mbox{F}}_{2}^{0}+2{\mbox{e}}^{-}\rightarrow 2{\mbox{F}}^{-}}}}
- h30−2e−→2H+{\displaystyle {\mathsf {{\mbox{H}}_{2}^{0}-2{\mbox{e}}^{-}\rightarrow 2{\mbox{H}}^{+}}}}
- S2−−2e−→S0↓{\displaystyle {\mathsf {{\mbox{S}}^{2-}-2{\mbox{e}}^{-}\rightarrow {\mbox{S}}^{0}\downarrow }}}
- Al0−3e−→Al3+{\displaystyle {\mathsf {{\mbox{Al}}^{0}-3{\mbox{e}}^{-}\rightarrow {\mbox{Al}}^{3+}}}}
- Fe2+−e−→Fe3+{\displaystyle {\mathsf {{\mbox{Fe}}^{2+}-{\mbox{e}}^{-}\rightarrow {\mbox{Fe}}^{3+}}}}
- 2Hal−−2e−→Hal20{\displaystyle {\mathsf {2{\mbox{Hal}}^{-}-2{\mbox{e}}^{-}\rightarrow {\mbox{Hal}}_{2}^{0}}}}
Процесс присоединения электронов — восстановление. При восстановлении степень окисления понижается:
- O20+4e−→2O2−{\displaystyle {\mathsf {{\mbox{O}}_{2}^{0}+4{\mbox{e}}^{-}\rightarrow 2{\mbox{O}}^{2-}}}}
- Mn7++5e−→Mn2+{\displaystyle {\mathsf {{\mbox{Mn}}^{7+}+5{\mbox{e}}^{-}\rightarrow {\mbox{Mn}}^{2+}}}}
- Mn4++2e−→Mn2+{\displaystyle {\mathsf {{\mbox{Mn}}^{4+}+2{\mbox{e}}^{-}\rightarrow {\mbox{Mn}}^{2+}}}}
- Cr6++6e−→Cr0{\displaystyle {\mathsf {{\mbox{Cr}}^{6+}+6{\mbox{e}}^{-}\rightarrow {\mbox{Cr}}^{0}}}}
Атомы или ионы, которые в данной реакции присоединяют электроны являются окислителями, а атомы или ионы, которые отдают электроны — восстановителями.
Для нахождения пропорции веществ, вступающих в химическую реакцию, часто требуется уравнять ОВР. Уравнивание ОВР сводится к нахождению стехиометрических коэффициентов (то есть, количества молей каждого соединения). Стехиометрические коэффициенты могут принимать только значения целых величин от 1 и выше, дробные стехиометрические коэффициенты допускаются лишь в некоторых случаях записи термохимических уравнениях из курса физической химии. Различают два методы уравнивания ОВР: метод полуреакций и метод электронного баланса. Метод электронного баланса более прост и используется в случае протекания реакции в газообразной среде (например, процессы горения или термического разложения соединений). Метод полуреакций более сложен и используется в случае протекания реакции в жидкой среде. Метод полуреакций оперирует не свободными атомами и одноатомными ионами, а реально существующими в растворе частицами, образовавшимися в результате процессов растворения и/или диссоциации реагирующих веществ. Оба метода занимают важное место в базовом курсе общей и неорганической химии, изучаемом студентами различных учебных заведений[3].
- ↑ В этом, как и во многих других случаях водород рассматривают как помещённый в VII группе периодической системы химических элементов над галогенами-окислителями.
- ↑ Несущественно, переходят ли электроны с одного атома на другой вполне (ионная связь) или же только более или менее оттягиваются (полярная ковалентная связь). Поэтому в данном случае мы будем говорить об отдаче или присоединении электронов независимо от действительного типа валентной связи. В общем, окислительно-восстановительные процессы можно определить как реакции, связанные с переходом электронов от одних атомов к другим. То есть валентности [ковалентных молекулярных соединений] в этих реакциях выступают как степени окисления. Более строго, в узком смысле под степенью окисления имеется в виду в том числе и валентности.
- ↑ ОВР методом полуреакций (неопр.). Химия и химическая технология в жизни (10.07.2013).
- Хомченко Г. П., Севастьянова К. И., Окислительно-восстановительные реакции, 2 изд., М., 1980;
- Кери Ф., Сандберг Р., Углублённый курс органической химии, пер. с англ., кн. 2, М., 1981, с. 119-41, 308-43;
- Марч Дж., Органическая химия, пер. с англ., т. 4, М., 1988, с. 259—341;
- Турьяи Я. И., Окислительно-восстановительные реакции и потенциалы в аналитической химии, М., 1989;
- Тодрес 3. В., Электронный перенос в органической и металлоорганической химии, в сб.: Итоги науки и техники. Сер. Органическая химия, т. 12, М., 1989. С. И. Дракин, З. В. Тодрес.
ru.wikipedia.org