Метод полуреакций ☑️ алгоритм и правила составления уравнений в окислительно-восстановительных реакциях, как расставлять коэффициенты, примеры полуреакций в кислой, нейтральной и щелочной средах

Сущность методики
Ее описывают как электронно-ионный баланс, заключающийся в распределении множителей коэффициентного типа. Основой метода полуреакций в нейтральной или щелочной среде является обмен отрицательно заряженных частиц, происходящий между анионами и катионами с различными значениями водородного показателя.

В реакциях, которые происходят с участием окислительных и восстановительных электролитов, имеются ионы с минусовым или положительным зарядом. Уравнения молекулярно-ионного типа, основой которых является метод полуреакций, наглядным образом покажет суть каждого процесса при помощи уравнивания и подбора необходимых коэффициентов.
Формирование баланса по определенному алгоритму происходит с применением электролитов сильного звена в виде ионных частиц и недиссоциированных молекул в виде слабых соединений. В уравнениях нужно указать частицы, в которых меняются степени окисления. Чтобы определить растворяющую среду, необходимо определить щелочные, кислые и нейтральные условия.
В ОВР метод полуреакций используется с той целью, чтобы расписать по отдельности выражения для восстановительных и окислительных процессов. Итоговым результатом химического разложения станет их суммирование калькулятором или обычным методом.
Исполнение алгоритма
В методе полуреакций примеры с решением имеют свои особенности решения. Основным способом является следование стандартному алгоритму. Сюда включают такие стадии:

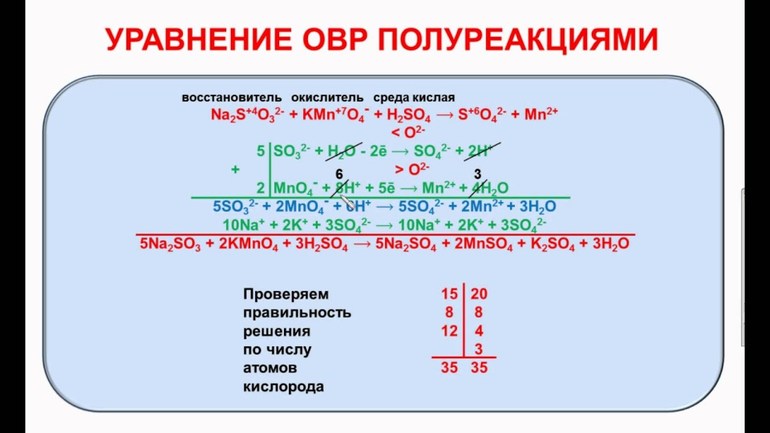
- Для начала нужно составить формулы всех реагирующих веществ химии. Пример одной из таких реакций h3S + KMnO4 + HCl.
- Далее, требуется править функцию отдельного составного процесса согласно принципам химии. Вторая составляющая в виде KMnO4 выступает как окислитель, восстановителем служит h3S, а HCl помогает в определении выражений по методу полуреакций в щелочной среде и определяет, насколько кислой является среда его действия.
- С нового абзаца записывают формулы ионных соединений с большим потенциалом электролитного типа, у которых в атомах может произойти смена степеней окисления.
- Найдя исходные компоненты, нужно расставлять окисленную и восстановленную форму для каждого реагента. В некоторых случаях конечные вещества уже расписаны по формуле, что значительно облегчает работу.
- Следующим этапом считается электрическая балансировка. Так как в левой части получается число 7, а в правой 2. необходимо расставить к изначальным веществам 5 отрицательно заряженных частиц и выходит MnO4+5e=4h3O+Mn. Это называют полуреакцией восстановительного свойства.
- Затем нужно уравнять процесс окисления с помощью добавления катионов водорода, а именно h3S-2e=2H+S. Тогда выходит полуреакция окислительного типа.
- Правильность получившегося баланса проверяют при помощи расчёта зарядов конечной и исходной части, а также атомов кислорода. Конечным этапом считается переход от ионной записи к молекулярной. Для каждой частицы из левой части баланса подбираются противоположно заряженный ион. После переноса в правую часть все ионы возможно собрать в молекулы.
Таким образом, метод полуреакций фактически сводится к написанию молекулярного уравнения путем следования заданному алгоритму. Он используется наравне с составлением баланса электронного вида, но может использоваться чаще за счет простоты.
Окислители и восстановители
Не менее важно для правильной записи уравнений как в традиционной, так и онлайн-форме, подобрать окислители и восстановители. От этого зависит, сколько нужно добавлять или вычитать электронов и ионов, а также сложность итоговых выражений.
К окислителям относят такие частицы, которые несут в себе отрицательно заряженные электроны. Они могут восстанавливаться и легко восполняют электронный недостаток. Сильными окисляющими реагентами считаются:
- Группы галогенов.
- Различные кислоты и калии.
- Золото и серебро с содержанием ионов.
- Оксиды марганца и свинца с валентностью 4.
- Соединения кислорода с содержанием газа.
Восстановители при участии в химических процессах передают отрицательный заряд. Окислительное действие претерпевают при расщеплении электронов. Подобными свойствами обладают различные органические и неорганические вещества:
- Ряд металлов и соединения серы, включая сероводород.
- Сульфаты железа, а также хрома и марганца.
- Азотсодержащие реагенты.
- Углерод природный плюс его оксид с валентностью 2.
- Молекулы водорода.
Также к указанной группе можно отнести кислоты с содержанием галогена и фосфористую кислоту. Роль восстановителей обычно играют ионные, атомарные частицы, а также молекулы.
Достоинства полуреакций
Для написания схемы окислительно-восстановительных реакций с учетом разных потенциалов полуреакции используют чаще по сравнению со способом электродного баланса. Преимущества такого метода состоят в следующем:

- Решать написанные уравнения, будь то обычные химические или гидролиз, легче за счет рассмотрения реальных ионов и соединений внутри раствора.
- Несмотря на отсутствие информации о получающихся веществах, их можно определить на последних стадиях.
- За счет такого метода можно узнать количество участвующих в полуреакциях электронов, а также изменения в коэффициентах водородного показателя раствора.
Кроме того, с помощью упрощенных ионных уравнений можно изучить особенности прохождения процессов и структуру созданных веществ. Также не всегда бывает необходима информация о степени окисления, поскольку ее можно установить в ходе работы с уравнениями и при необходимости уравнивать.
Нейтральная среда

Применяется метод полуреакций в нейтральной среде в тех случаях, когда происходит гидролиз солей при образовании слабокислого или слабощелочного раствора. Запись осуществляется в двух вариантах в соответствии с установленными таблицами веществ.
Первый метод позволяет не учитывать гидролиз солей. Среда считается нейтральной, слева приписывается молекулярная вода. Тогда одну полуреакцию нужно подбирать до установления щелочного состояния, а вторую до кислотного варианта.
А вот следующий способ является оптимальным для тех процессов, где можно примерно устанавливать значение водородного показателя. В этом случае реакции для электронно-ионного метода стоит рассматривать либо щелочи, либо в кислоте.
Примером нейтрального раствора может служить воссоединение сероводорода с дихроматом натрия в воде. Получается осадок серы, натрия и трехвалентного гидроксида хрома. Это считается типичной реакцией нейтрального раствора.
В конце реакции происходит образование голубого осадка из гидроксида хрома и желтой серы. Процесс идет в растворе щелочи с натриевым гидроксидом. При этом степень окисления серы изменяется на 0, заряд хрома уменьшается с 6 до 3.
Вышеописанная методика может включать в себя семь или более этапов в зависимости от сложности уравнений и требуемого результата. Его преимуществами считаются относительная простота и отсутствие необходимости в дополнительной информации по имеющимся элементам в уравнении. Правильное следование алгоритму и учет всех имеющихся факторов, включая валентность и степень заряда каждого химического элемента из таблицы Менделеева, позволит грамотно составить молекулярное выражение и отыскать все необходимые данные для созданных новых веществ.
nauka.club
Метод полуреакций: алгоритм
Многие химические процессы проходят с изменением окислительных степеней атомов, которые образуют реагирующие соединения. Написание уравнений реакций окислительно-восстановительного типа часто сопровождается трудностью при расстановке коэффициентов перед каждой формулой веществ. Для этих целей разработаны методики, связанные с электронным или электронно-ионным балансом распределения зарядов. В статье подробно описан второй способ составления уравнений.
Метод полуреакций, сущность
Он еще называется электронно-ионным балансом распределения коэффициентных множителей. Основан метод на обмене отрицательно заряженными частицами между анионами или катионами в растворенных средах с разным значением водородного показателя.

В реакциях электролитов окислительного и восстановительного типа участвуют ионы с отрицательным или положительным зарядом. Уравнения молекулярно-ионного вида, в основе которых задействован метод полуреакций, наглядно доказывают суть любого процесса.
Для формирования баланса используют специальное обозначение электролитов сильного звена в качестве ионных частиц, а слабых соединений, газов и осадков в виде недиссоциированных молекул. В составе схемы необходимо указывать частицы, в которых изменяются степени их окисления. Для определения растворяющей среды в балансе обозначают кислые (H+), щелочные (OH—) и нейтральные (H2O) условия.
Для чего используют?
В ОВР метод полуреакций направлен на написание уравнений ионных отдельно для процессов окислительных и восстановительных. Конечным балансом будет их суммирование.
Этапы выполнения
Своими особенностями написания обладает метод полуреакций. Алгоритм включает следующие стадии:
— Первым делом следует записать формулы всех реагирующих веществ. Например:
H2S + KMnO4 + HCl
— Затем необходимо установить функцию, с химической точки зрения, каждого составляющего процесса. В данной реакции KMnO4 выступает в роли окислителя, H2S является восстановителем, а HCl определяет кислотную среду.
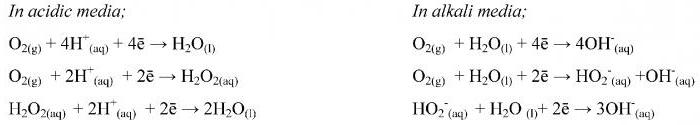
— Третьим этапом нужно записать с новой строки формулы ионные реагирующих соединений с сильным электролитным потенциалом, у атомов которых наблюдается смена степеней их окисления. В данном взаимодействии MnO4— выступает в роли окисляющего вещества, H2S является восстанавливающим реагентом, а H+ или оксониевый катион H3O+ определяет кислотную среду. Газообразные, твердые или слабые электролитические соединения выражают целыми формулами молекулярными.
Зная исходные компоненты, постараться определить, какая у окисляющего и восстанавливающего реагента будет восстановленная и окисленная форма соответственно. Иногда конечные вещества уже заданы в условиях, что облегчает работу. В последующих уравнениях указывают переход H2S (сероводорода) в S (серу), а аниона MnO4— в катион Mn2+.
Для баланса атомарных частиц в левом и правом участке в кислотную среду прибавляют водородный катион H+ или молекулярную воду. В раствор щелочной вносят ионы гидроксида OH— или H2O.
MnO4—→ Mn2+
В растворе атом кислорода из манганатных ионов совместно с H+ формируют молекулы воды. Для выравнивания количества элементов уравнение записывают так: 8H+ + MnO4— → 4H2O + Mn2+.
Затем проводят электрическую балансировку. Для этого считают общую сумму зарядов в левом участке, получается +7, а затем в правой стороне, выходит +2. Для уравновешивания процесса к исходным веществам добавляется пять отрицательных частиц: 8H+ + MnO4— + 5e— → 4H2O + Mn2+. Получается полуреакция восстановления.
Теперь уравнять по числу атомов следует процесс окисления. Для этого в правую часть добавляют водородные катионы: H2S → 2H+ + S.
После проводят уравнивание зарядов: H2S -2e— → 2H+ + S. Видно, что от исходных соединений отнимают две отрицательные частицы. Получается полуреакция окислительного процесса.

Записывают оба уравнения в столбик и выравнивают отданные и принятые заряды. По правилу определения наименьших кратных подбирают для каждой полуреакции свой множитель. На него умножается окислительное и восстановительное уравнение.
Теперь можно осуществить суммирование двух балансов, сложив левые и правые стороны между собой и сократив количество электронных частиц.
8H+ + MnO4— + 5e— → 4H2O + Mn2+ |2
H2S -2e— → 2H+ + S |5
16H+ + 2MnO4— + 5H2S → 8H2O + 2Mn2+ + 10H+ + 5S
В полученном уравнении можно число H+ сократить на 10: 6H+ + 2MnO4— + 5H2S → 8H2O + 2Mn2+ + 5S.
Проверяем правильность составления ионного баланса с помощью подсчета числа кислородных атомов до стрелки и после нее, которое равняется 8. Также необходимо сверить заряды конечной и исходной части баланса: (+6) + (-2) = +4. Если все совпадает, то он составлен правильно.
Метод полуреакций заканчивается переходом от ионной записи к уравнению молекулярному. Для каждой анионной и катионной частицы левой части баланса подбирается противоположный по заряду ион. Затем их переносят в правую сторону, в таком же количестве. Теперь ионы можно соединить в целые молекулы.
6H+ + 2MnO4— + 5H2S → 8H2O + 2Mn2+ + 5S
6Cl— + 2K+ → 6Cl— + 2K+
H2S + KMnO4 + 6HCl → 8H2O + 2MnCl2 + 5S + 2KCl.
Применять метод полуреакций, алгоритм которого сводится к написанию молекулярного уравнения, можно наряду с написанием балансов электронного типа.
Определение окислителей
Такая роль принадлежит ионным, атомарным или молекулярным частицам, которые принимают отрицательно заряженные электроны. Вещества окисляющие претерпевают восстановление в реакциях. Они обладают электронным недостатком, который легко можно восполнить. Такие процессы включают окислительно-восстановительные полуреакции.

Не у всех веществ имеется способность присоединять электроны. К сильным окисляющим реагентам относят:
- галогеновых представителей;
- кислоту типа азотной, селеновой и серной;
- калий перманганатный, дихроматный, манганатный, хроматный;
- марганцовые и свинцовые четырехвалентные оксиды;
- серебро и золото ионное;
- соединения газообразные кислорода;
- меди двухвалентной и серебра одновалентного оксиды;
- хлорсодержащие солевые компоненты;
- водку царскую;
- водорода перекись.
Определение восстановителей
Такая роль принадлежит ионным, атомарным или молекулярным частицам, которые отдают отрицательный заряд. В реакциях восстанавливающие вещества претерпевают окислительное действие при отщеплении электронов.
Восстановительными свойствами обладают:
- представители многих металлов;
- серы четырехвалентной соединения и сероводород;
- галогенсодержащие кислоты;
- железа, хрома и марганца сульфаты;
- олова двухвалентный хлорид;
- азотсодержащие реагенты типа кислоты азотистой, двухвалентного оксида, аммиака и гидразина;
- природный углерод и его оксид двухвалентный;
- водородные молекулы;
- кислота фосфористая.
Преимущества электронно-ионного способа
Чтобы написать окислительно-восстановительные реакции, метод полуреакций применяют чаще, чем баланс электронного вида.
Связано это с преимуществами электронно-ионного способа:
- Во время написания уравнения рассматривают реальные ионы и соединения, которые существуют в составе раствора.
- Можно изначально не иметь информации о получающихся веществах, их определяют на конечных этапах.
- Не всегда нужны данные об окислительной степени.
- Благодаря методу можно узнать число электронов, которые участвуют в полуреакциях, как меняется водородный показатель раствора.
- По сокращенным уравнениям ионного вида изучается особенность протекания процессов и структура получившихся веществ.
Полуреакции в кислом растворе
Проведение вычислений при избытке водородных ионов подчиняется основному алгоритму. Метод полуреакций в кислой среде начинают с записи составных частей любого процесса. Потом их выражают в форме уравнений ионного вида с соблюдением баланса атомарного и электронного заряда. Отдельно записывают процессы окислительного и восстановительного характера.
Для выравнивания атомарного кислорода в сторону реакций с его избытком привносят водородные катионы. Количества H+ должно хватить для получения молекулярной воды. В сторону недостатка кислорода приписывают H2O.
Затем проводят баланс водородных атомов и электронов.
Делают суммирование частей уравнений до и после стрелки с расстановкой коэффициентов.
Осуществляют сокращение одинаковых ионов и молекул. К уже записанным реагентам в суммарном уравнении выполняют добавление недостающих анионных и катионных частиц. Их количество после и до стрелочки должно совпадать.
Уравнение ОВР (метод полуреакций) считается выполненным при написании готового выражения молекулярного вида. Возле каждого компонента должен стоять определенный множитель.
Примеры для кислой среды
Взаимодействие нитрита натрия с кислотой хлорноватой приводит к получению натрия нитрата и кислоты соляной. Для расстановки коэффициентов используется метод полуреакций, примеры написания уравнений связаны с указанием кислой среды.
NaNO2 + HClO3 → NaNO3 + HCl
ClO3— + 6H+ + 6e— → 3H2O + Cl— |1
NO2— + H2O – 2e— → NO3— +2H+ |3
ClO3— + 6H+ + 3H2O + 3NO2— → 3H2O + Cl— + 3NO3— +6H+
ClO3— + 3NO2— → Cl— + 3NO3—
3Na+ + H+ → 3Na+ + H+
3NaNO2 + HClO3 → 3NaNO3 + HCl.
В данном процессе из нитрита получается нитрат натрия, а из хлорноватой образуется соляная кислота. Окислительная степень азота изменяется с +3 до +5, а заряд хлора +5 становится -1. Оба продукта не образуют осадка.
Полуреакции для щелочной среды
Проведение вычислений при избытке гидроксидных ионов соответствует расчетам для кислых растворов. Метод полуреакций в щелочной среде также начинают с выражения составных частей процесса в форме ионных уравнений. Отличия наблюдаются во время выравнивания числа атомарного кислорода. Так, в сторону реакции с его избытком привносят молекулярную воду, а в противоположную часть дописывают анионы гидроксида.
Коэффициент перед молекулой H2O показывает разницу в количестве кислорода после и до стрелки, а для ионов OH— его удваивают. В ходе окисления реагент, выполняющий роль восстановителя, отнимает атомы O от гидроксильных анионов.
Метод полуреакций заканчивается проведением оставшихся этапов алгоритма, которые совпадают с процессами, имеющими кислый избыток. Конечным результатом служит уравнение молекулярного вида.
Примеры для щелочной среды
При смешивании йода с натрия гидроксидом образуется натрия йодид и йодат, молекулы воды. Для получения баланса процесса используют метод полуреакций. Примеры для растворов щелочных имеют свою специфику, связанную с уравниванием атомарного кислорода.
NaOH + I2 →NaI + NaIO3 + H2O
I + e— → I— |5
6OH— + I — 5e— → I— + 3H2O + IO3— |1
I + 5I + 6OH— → 3H2O + 5I— + IO3—
6Na+ → Na+ + 5Na+
6NaOH + 3I2 →5NaI + NaIO3 + 3H2O.

Результатом реакции является исчезновение фиолетового окрашивания молекулярного йода. Происходит изменение степени окисления данного элемента с 0 до -1 и +5 с образованием йодида и йодата натрия.
Реакции в нейтральной среде
Обычно так называют процессы, проходящие при гидролизе солей с образованием слабокислого (с водородным показателем от 6 до 7) или слабощелочного (с pH от 7 до 8) раствора.
Метод полуреакций в нейтральной среде записывают несколькими вариантами.
В первом способе не учитывают солевой гидролиз. Среду принимают за нейтральную, а слева от стрелочки приписывают молекулярную воду. В таком варианте одну полуреакцию принимают за кислотную, а другую – за щелочную.
Второй способ подходит для процессов, в которых можно установить примерное значение водородного показателя. Тогда реакции для метода ионно-электронного рассматривают в щелочном или кислом растворе.
Пример с нейтральной средой
При соединении сероводорода с натрия дихроматом в воде получается осадок серы, натрия и хрома трехвалентного гидроксиды. Это типичная реакция для нейтрального раствора.
Na2Cr2O7 + H2S +h3O → NaOH + S + Cr(OH)3
H2S — 2e— → S + H+ |3
7H2O + Cr2O72- + 6e— → 8OH— + 2Cr(OH)3 |1
7H2O +3H2S + Cr2O72- → 3H+ +3S + 2Cr(OH)3 +8OH—. Катионы водорода и гидроксид-анионы, соединяясь, образуют 6 молекул воды. Их можно убрать в правой и левой части, оставив излишек перед стрелкой.
H2O +3H2S + Cr2O72- → 3S + 2Cr(OH)3 +2OH—
2Na+ → 2Na+
Na2Cr2O7 + 3H2S +H2O → 2NaOH + 3S + 2Cr(OH)3
В конце реакции образуется осадок из гидроксида хрома голубого цвета и желтой серы в щелочном растворе с гидроксидом натрия. Окислительная степень элемента S с -2 становится 0, а хрома заряд с +6 превращается в +3.
fb.ru
«Метод полуреакций, или электронно-ионного баланса»
Тема: метод полуреакций или электронно-ионного баланса
Цель: расширить и углубить знания об ОВР.
Задачи:
- научить определять возможность протекания ОВР между данными веществами;
- научить устанавливать продукты реакции с опорой на схемы;
- раскрыть сущность метода полуреакций;
- рассмотреть правила и алгоритмы составления уравнений ОВР;
- научить применять полученные знания для решения конкретных задач.
Формы обучения: разъяснение, рассуждение, общая характеристика.
Методы обучения: словесные (беседа, объяснение), наглядные (компьютерные), практические (упражнения).
Общедидактические методы: объяснительно-иллюстративный, частично-поисковый, проблемный.
Ход урока.
1. Проверка домашнего задания.
Опрос у доски:
1) Самостоятельная работа у доски : определите тип следующих ОВР:
Подготовка устного ответа: классификация ОВР.
2) Самостоятельная работа у доски: расставить коэффициенты методом электронного баланса, указать окислитель и восстановитель, процессы окисления и восстановления:
3) Устный ответ: теория ОВР.
2. Новый материал.
Сегодня на уроке мы познакомимся со способами прогнозирования продуктов в ОВР и новом методе расстановки коэффициентов в ОВР – методе полуреакций или электронно-ионного баланса.
Чтобы написать уравнение реакции, протекающей в смеси заданных веществ, нужно ответить на следующие вопросы:
а) возможна ли в принципе ОВР между данными веществами;
б) если да, то установить продукты реакции;
в) подобрать коэффициенты в уравнении реакции.
Рассмотрим эти вопросы по порядку.
Что касается первого из них, вспомним, что в любой ОВР один из участников окисляется, т.е. повышает свою валентность, а другой – восстанавливается, т.е. понижает валентность. Поэтому реакция невозможна, если оба ее участника находятся в состояниях наиболее высокой или наиболее низкой степени окисления.
Исходя из сказанного, попробуем предположить возможность протекания ОВР.
Например, определим возможна ли ОВР между .
Определите степени окисления элементов.
Учащиеся определяют степени окисления элементов по формулам соединений. Рассматривают строение атомов серы и хлора, определяют высшую и низшую степень окисления элементов.
Формулируем вывод: степени окисления серы (-2) и хлора (-1) являются для них предельно низкими, следовательно, и сера, и хлор могут выступать только в роли восстановителя. Т.е. реакция между невозможна.
Рассмотрим другой пример. Возможно ли взаимодействие между ионами ?
Учащиеся рассматривают степени окисления марганца и хрома в ионах, определяют исходя из строения атомов, что оба металла находятся в высшей степени окисления, следовательно, могут выступать только в роли окислителя. Делают вывод: реакция между ионами и невозможна.
Если же один из участников может повысить, а другой понизить свои степени окисления, реакция в принципе возможна.
Указать продукты реакции только из общих соображений в таких реакциях практически невозможно. Исследование химических свойств элементов как раз и представляет собой экспериментальное выяснение того, при каких условиях его соединения вступают в реакцию с другими элементами и соединениями и какие продукты при этом получаются.
Часто в ОВР участвуют соединения хрома и марганца. Особый интерес представляет поведение пероксида водорода в ОВР. Для прогнозирования продуктов реакций с их участием можно использовать следующие схемы.
Учитель проецирует с помощью видеопроектора схемы на экран, учащиеся для удобства имеют схемы на партах (Приложение 1).
Что касается собственно процедуры подбора коэффициентов в уравнениях, то для реакций в растворах удобен так называемый метод полуреакций, или электронно-ионный. В нем сначала записывают и уравнивают отдельно процессы окисления и восстановления, а полная реакция получается их сложением.
Учитель проецирует с помощью видеопроектора схемы на экран, учащиеся для удобства имеют схемы на партах (Приложение 2).
Кроме алгоритма составления полуреакций, необходимо придерживаться нескольких очевидных правил:
- В кислой среде ни в левой, ни в правой части не должно быть ионов Уравнивание осуществляется за счет ионов и молекул воды.
- В щелочной среде ни в левой, ни в правой части не должно быть ионов . Уравнивание осуществляется за счет ионов и молекул воды.
- В нейтральной среде ни ионов , ни в левой части быть не должно. Однако в правой части среди продуктов реакции они могут появиться.
Рассмотрим, как работают предложенные схемы на конкретных примерах.
Задача. Закончить уравнение реакции между бихроматом калия и соляной кислотой.
Ион содержит хром в его высшей степени окисления, следовательно, может выступать только в роли окислителя. По схеме составим полуреакцию, учитывая, что среда кислотная (HCl).
Полуреакция восстановления:
Ионы могут только окисляться, т.к. хлор имеет самую низшую степень окисления. Составим полуреакцию окисления:
Суммируем сначала левые, а затем правые части полуреакций, не забывая предварительно умножить множитель на коэффициент, если он стоит перед формулой.
Получили сокращенное ионное уравнение.
Добавляем недостающие катионы или анионы, учитывая, что количество добавляемых ионов в правую и левую части ионного уравнения должно быть одинаковым.
В данном случае источником ионов ─ была соль , поэтому с каждым молем в раствор попадает 2 моль ионов . В реакции они участия не принимают, поэтому в неизменном виде должны перейти в правую часть уравнения. Вместе с 14 моль ионов в раствор вносится 14 моль ионов . Из них 6 участвует в реакции в качестве восстановителя, а остальные 8, как и ионы , в неизменном виде остаются после реакции, т.е. дописываются в правую часть.
В результате получаем:
После этого можно объединить ионы в формулы реальных веществ:
Рассмотрим другой пример.
Задача. Закончить уравнение реакции → …
Ион содержит марганец в его высшей степени окисления, следовательно, может выступать только в роли окислителя. По схеме составим полуреакцию, учитывая, что среда нейтральная.
Полуреакция восстановления:
Если ион будет выступать в роли окислителя, то пероксид водорода — в роли восстановителя. По схеме составляем полуреакцию восстановления:
Оформляем уравнение ОВР, протекающей в нейтральной среде:
- Т.к в нейтральной среде ни ионов , ни в левой части быть не должно, значит, для уравнивания атомов кислорода в правую часть добавляем воду:
- Оформление полуреакции становится подобным оформлению полуреакции в щелочной среде: в противоположную часть добавляем удвоенное число гидроксид-ионов:
- Перед ставим коэффициент, показывающий разницу в числе атомов кислорода в правой и левой частях полуреакций, а перед — его удвоенный коэффициент:
- Подсчитываем заряды в полуреакциях, уравниваем заряд. Балансируем (уравниваем) число отданных и принятых электронов в полуреакциях:
- Суммируем сначала левые, а затем правые части полуреакций, не забывая предварительно умножить множитель на коэффициент, если он стоит перед формулой:
- Сокращаем в правой и левой части одинаковые молекулы и ионы:
Таким образом, получаем ионное уравнение.
- Добавляем недостающие катионы или анионы, учитывая, что количество добавляемых ионов в правую и левую части ионного уравнения должно быть одинаковым:
Также рассмотрим пример ОВР, протекающей с щелочной среде.
Задача. Закончить уравнение реакции:
Определяем окислитель и восстановитель в данной ОВР. В нитрате ртути (II) ртуть содержится в ее высшей степени окисления, следовательно, может выступать только в роли окислителя. Составим полуреакцию восстановления.
Полуреакция восстановления:
- Если ион будет выступать в роли окислителя, то пероксид водорода — в роли восстановителя. По схеме составляем полуреакцию восстановления пероксида водорода в щелочной среде:
- Оформляем уравнение ОВР, протекающей в щелочной среде:
- Добавляем недостающие катионы и анионы.
Преимущества электронно-ионного метода при составлении уравнений реакций и подборе коэффициентов в сравнении с методом электронного баланса особенно проявляются при составлении уравнений реакций с участием органических соединений.
Задача. Составьте уравнение окисления ацетилена раствором до щавелевой кислоты в нейтральной среде.
Составляем схему реакции:
выступаем в роли окислителя, т.к. содержит марганец в его высшей степени окисления.
Следовательно, схема полуреакции восстановления имеет вид:
Схема полуреакции окисления:
Оформляем уравнение ОВР, протекающей в нейтральной среде:
- Т.к в нейтральной среде ни ионов , ни в левой части быть не должно, значит, для уравнивания атомов кислорода в правую часть добавляем воду:
- Оформление полуреакции становится подобным оформлению полуреакции в щелочной среде: в противоположную часть добавляем удвоенное число гидроксид-ионов. Перед ставим коэффициент, показывающий разницу в числе атомов кислорода в правой и левой частях полуреакций, а перед его удвоенный коэффициент. Подсчитываем заряды в полуреакциях, уравниваем заряд. Балансируем (уравниваем) число отданных и принятых электронов в полуреакциях:
- Составляем ионное уравнение:
- Сокращаем в правой и левой части одинаковые молекулы, добавляем недостающие катионы:
Задача. Составьте уравнение реакции окисления фенола дихроматом калия в кислой среде до хинона:
Ион содержит хром в его высшей степени окисления, следовательно, может выступать только в роли окислителя. По схеме составим полуреакцию, учитывая, что среда кислотная .
Используем правила оформления уравнений ОВР, протекающих в кислотной среде.
Сокращаем в правой и левой части одинаковые молекулы, добавляем недостающие катионыи анионы:
Рассмотрев метод электронно-ионного баланса или метод полуреакций можно выделить следующие достоинства данного метода:
- Рассматриваются реально существующие ионы и вещества.
- Не нужно знать все получающиеся вещества, они появляются в уравнении реакции при его выводе.
- Необязательно знать степени окисления. Понятие степени окисления в органической химии употребляется реже, чем о неорганической химии.
- Этот метод дает сведения не только о числе электронов, участвующих в каждой полуреакции, но и о том, как изменяется среда.
- Сокращенные ионные уравнения лучше передают смысл протекающих процессов и позволяют делать определенные предположения о строении продуктов реакции.
Домашнее задание: Закончить уравнения:
В качестве проверочной работы по изученной теме предлагаю учащимся лабораторные опыты. Учащимся необходимо провести ОВР, объяснить происходящие явления, составив уравнения реакций с помощью метода полуреакций.
Лабораторные опыты «Окислительно-восстановительные реакции»
В три стакана налейте малиновый раствор перманганата калия. Добавьте в первый стакан немного раствора серной кислоты, во второй – воду, в третий – концентрированный раствор гидроксида калия. Окраска растворов при этом не изменяется. Добавьте во все стаканы по 5 мл сульфита калия и хорошо перемешайте смеси стеклянной палочкой.
Задание: объясните изменение окраски растворов, составив ОВР методом полуреакций.
Литература:
Д.Д. Друзцова, Л.Б. Бестаева Окислительно-восстановительные реакции. – М.:Дрофа,2005.
urok.1sept.ru
Метод полуреакций | Дистанционные уроки
09-Июл-2012 | комментариев 200 | Лолита Окольнова
Решаем Часть С задание №1
Дано уравнение:
h3S + K2Cr2O7 + h3SO4 → …
Как решать такие окислительно-восстановительные реакции?
Уравнивание окислительно-восстановительных реакций
Во-первых, давайте определимся, в каких случаях лучше использовать метод полуреакций:
- реакция происходит в растворе
- в реакции принимают участие больше чем 2 реагента, да и продуктов реакции больше, чем 2
Правила метода полуреакций
(проще всего будет объяснить их сразу на примере)
h3S + K2Cr2O7 + h3SO4 → …
1. Определяем участников окислительно-восстановительного процесса:
K2Cr2O7 — Сr находится в высшей степени окисления — +6, значит бихромат калия будет окислителем, т.е. сам будет восстанавливаться. Обычно, в кислой среде раствора он восстанавливается либо до Cr2O3, либо до Сr3+
Давайте думать логически.
Допустим, у нас образовался оксид, один из реагентов это серная кислота . Будет она реагировать с оксидом? Конечно! Мы получим Cr3+
Второй реагент — h3S. Сера находится в минимальной степени окисления — -2. Значит, она будет окисляться. До S°.
2. Выписываем участников овр в ионной форме (!) (Т.е., те вещества. которые нельзя разбить на ионы, пишем в том виде, в каком они представлены)
Сr2O7(2)- → Cr(3+)
S(2-) → S(0)
3. Уравниваем количество атомов:
Сr2O7(2-) → 2Cr3(+)
S(2- ) → S(0)
4. Определяем среду реакции. У нас один из реагентов — серная кислота, значит, среда у нас однозначно кислая.
В кислой среде раствора уравнивание недостающих атомов идет по схеме:
h3O → H(+)
Причем, воду мы прибавляем в ту часть уравнения, где недостаток кислорода (!)
Сr2O7(2-) → 2Cr(3+) + 7h3O
теперь у нас изменилось количество водорода, надо его уравнять
Сr2O7(2-) +14H(+) → 2Cr(3+) + 7h3O
5. Уравниваем заряды:
Сr2O7(2)- +14H(+) → 2Cr(3+) + 7h3O
итоговый заряд: +12 → +6
Сr2O7(2-) +14H(+) + 6е- → 2Cr(3+) + 7h3O
S2- → S°
-2 0
S(2-) -2е- → S(0)
6. Теперь надо уравнять реакции восстановления и окисления между собой ( чтобы “количество принятых электронов было равно количеству отданных”)
Сr2O7(2)- +14H(+) +6e- → 2Cr(3+) + 7h3O |*1
S(2- ) -2е- → S(0 ) |*3
7. Выписываем все реагенты с учетом коэффициентов и все продукты овр:
Сr2O7(2-) +14H(+) + 3S(2-) → 2Cr(3+) + 7h3O + 3S(0)
8. Дописываем к каждому иону его “половинку” с учетом коэффициентов и сочетаем продукты реакции:
Сr2O7(2-) +14H(+) + 3S(2-) → 2Cr(3+) + 7h3O + 3S(0)
+2K(+) +7SO4(2-) + 6H(+) → +2K(+) +7SO4(2-) + 6H(+)
____________________________________________
K2Cr2O7 + 7h3SO4 + 3h3S → Cr2(SO4)3 + 7h3O + 3S + K2SO4 + 3h3SO4
9. Сокращаем одинаковые молекулы слева и справа:
K2Cr2O7 + 4h3SO4 + 3h3S → Cr2(SO4)3 + 3S + K2SO4 + 7h3O
Метод полуреакций удобен тем, что можно легко предсказать продукты реакции и сочетания ионов. Да и уравнивать таким способом легче.
Естественно, этот метод подходит только для водных растворов.
Для решения овр такого типа нужно просто натренироваться, для этого предлагаю вам решить следующие овр методом полуреакций:
- MnO2 + O2 + KOH → …
- Cl2 + NaOH → NaClO3 + …
- CrCl3 + H2O2 + KOH → …
Как всегда, в заданиях такого типа (часть С №1) нужно предсказать продукты реакции и уравнять. Если что-то не будет получаться или возникнут вопросы, пишите в комментариях — обсудим.
Как решать окислительно-восстановительные реакции в кислой среде раствора мы разобрали, в щелочной — смотрите << здесь >>
- в ЕГЭ это вопрос C1 — примеры окислительно-восстановительных реакций
Еще на эту тему:
Обсуждение: «Метод Полуреакций»
distant-lessons.ru
Метод полуреакций щелочная среда | Дистанционные уроки
12-Июл-2012 | комментариев 14 | Лолита Окольнова
Как решать такие окислительно-восстановительные реакции?
В кислой среде раствора мы используем баланс: H+ \ H2O
В щелочной среде раствора : OH— \ h3O
Давайте разберем на примере:
Hg(NO3)2 + H2O2 + NaOH = O2 + Hg+
1. Определяем участников окислительно-восстановительного процесса:
H2O2 — O находится в степени окисления -1, в результате реакции становится O2, т.е. идет процесс окисления.
Ртуть — Hg2+
будет восстанавливаться до Hg+1
2. Выписываем участников овр в ионной форме (!) (Т.е., те вещества. которые нельзя разбить на ионы, пишем в том виде, в каком они представлены)
H2O2 →O2
Hg2+ → Hg+
3. Уравниваем количество атомов — участников овр (атомы — участники овр в данном случае — O и Hg) :
H2O2 →O2
Hg2+ → Hg+
4. Определяем среду реакции. У нас один из реагентов — NaOH, значит, среда раствора у нас однозначно щелочная.
В щелочной среде раствора уравнивание недостающих атомов идет по схеме: OH— \ h3O
H2O2 + 2OH— → O2 + 2H2O
5. Уравниваем заряды:
H2O2 + 2OH— → O2 + 2H2O
-2 → 0, значит, уравнение будет иметь вид:
H2O2 + 2OH— —2e—→ O2 + 2H2O
 
6. Теперь надо уравнять реакции восстановления и окисления между собой ( чтобы “количество принятых электронов было равно количеству отданных”)
1•| H2O2 + 2OH— —2e—→ O2 + 2H2O
2•| Hg2+ +1e—→ Hg+
7. Выписываем все реагенты с учетом коэффициентов и все продукты овр:
H2O2 + 2OH— + 2Hg2+→ O2 + 2H2O + 2Hg+
8. Дописываем к каждому иону его “половинку” с учетом коэффициентов и сочетаем продукты реакции:
H2O2 + 2OH— + 2Hg2+→ O2 + 2H2O + 2Hg+
+ 2Na+ + 4NO3— → + 2Na+ + 4NO3—
____________________________________________
H2O2 + 2NaOH + 2Hg(NO3)2 → O2 + 2H2O + Hg2(NO3)2 + 2NaNO3
Теперь вы знаете как решать такие окислительно-восстановительные реакции для щелочной среды раствора. Но, признаюсь честно, знать мало… надо УМЕТЬ решать такие примеры. А для того, чтобы уметь, надо тренироваться.
Вот несколько примеров для тренировки — решайте, будут вопросы, пишите в комментариях — все разберем.
- Cl2 + KOH = KClO3 + …
- K2Cr2O7 + Cl2 + NaOH = …
- KMnO4 + h3S + NaOH = …
- в ЕГЭ это вопрос C1 — примеры окислительно-восстановительных реакций
Еще на эту тему:
Обсуждение: «Метод полуреакций щелочная среда»
(Правила комментирования)distant-lessons.ru
2.Метод полуреакций, или ионно-электронный метод.
Данный метод основан на составлении ионных уравнений для процесса окисления и процесса восстановления с последующим суммирование их в общее уравнение. В качестве примера составим уравнение той же реакции. При пропускании сероводорода через подкисленный раствор перманганата калия малиновая окраска исчезает и раствор мутнеет. Опят показывает, что помутнение раствора происходит в результате образования элементарной серы, т.е. протекания процесса.
H2S → S + 2Н+
Эта схема уравнена по числу атомов. Для уравнения по числу зарядов надо от левой части схемы отнять два электрона, после чего можно стрелку заменить на знак равенства:
H2S — 2ē = S + 2Н+
Это первая полуреакция – процесс окисления восстановителя H2S. Обесцвечивание раствора связано с переходом иона MnO4— (имеет малиновую окраску) в ион Mn2+ (практически бесцветный и лишь при большой концентрации имеет слабо розовую окраску), что можно выразить схемой:
MnO4— → Mn2+
В кислом растворе кислород, входящий в состав ионов MnO4—, вместе с ионами водорода в конечном итоге образуют воду, поэтому процесс перехода записывается так:
MnO4— + 8Н+ → Mn2+ + 4Н2О
Чтобы стрелку заменить на знак равенства, надо уравнять и заряды. Поскольку исходные вещества имеют семь положительных зарядов (7+), а конечные – два положительных (2+), то для выполнения условия сохранения зарядов надо к левой части схемы прибавить пять электронов:
MnO4— + 8Н+ + 5ē = Mn2+ + 4Н2О
Это вторая полуреакция – процесс восстановления окислителя, т.е. перманганат-иона MnO4—.
Для составления общего уравнения реакции надо уравнения полурекций почленно сложить , предварительно уравняв числа отданных и полученных электронов. В этом случае по правилам нахождения наименьшего общего кратного определяют соответствующие множители, на которые умножаются уравнения полурекций. Сокращенно запись проводится так:
H2S — 2ē = S + 2Н+ 5
MnO4— + 8Н+ + 5ē = Mn2+ + 4Н2О 2
5H2S + 2MnO4— + 16Н+ = 5S + 10Н+ + 2Mn2+ + 8Н2О
И, сократив на 10Н+ , окончательно получим:
5H2S + 2MnO4— + 6Н+ = 5S + 2Mn2+ + 8Н2О
Проверяем правильность составленного в ионной форме уравнения: число атомов кислорода в левой части 8, в правой – 8; число зарядов: в левой части (2-) +(6+) = 4+, в правой 2(2+) = 4+. Уравнение составлено правильно, так как атомные заряды уравнены.
Методом полуреакций составляется уравнение реакций в ионной форме. Чтобы от него перейти к уравнению в молекулярной форме, поступаем так: в левой части ионного уравнения к каждому иону подбираем соответствующий катион, а каждому катиону – анион. Затем те же ионы в таком же числе записываем в правую часть уравнения, после чего ионы объединяем в молекулы:
5H2S + 2MnO4— + 6Н+ = 5S + 2Mn2+ + 8Н2О
2K+ + 3SO42- = 2K+ + 3SO42-______________
5H2S + 2KMnO4 + 3H2SO4 → 5S + 2MnSO4 + K2SO4 +8H2O
Таким образом, составление уравнений ОВР с помощью метода полуреакций приводит к тому же результату, что метод электронного баланса.
Сопоставим оба метода. Достоинство метода полуреакций по сравнению с методом электронного баланса в том, что в нем применяются не гипотетические ионы, а реально существующие. В самом деле, в растворе нет ионов Mn+7, Cr+6, S+6, S+4 , а есть ионы MnO4—, Cr2O72-, CrO42- , SO42- , SO32-. При методе полуреакций не нужно знать степень окисления атомов. Написание отдельных ионных уравнений полурекций необходимо для понимания химических процессов в гальваническом элементе и при электролизе. При этом методе видна роль среды как активного участника всего процесса. При использовании метода полурекций не нужно знать все получающиеся вещества, они появляются в уравнении реакции при его выводе. Поэтому методу полуреакций следует отдать предпочтение и применять его при составлении всех ОВР, протекающих в водных растворах.
studfile.net
ЕГЭ. Метод полуреакций
Метод полуреакций. Основное правило
В данном разделе приводится правило использования метода полуреакций для составления сложных окислительно-восстановительных реакций.
Важно отметить, что большинство реакций (или даже все реакции) из пособий для подготовки к экзамену от разработчиков ЕГЭ** не требуют применения этого метода. Достаточно знать основные закономерности поведения окислителей и восстановителей, т.е. правила написания реакций ОВР.
Этот метод часто необходим, чтобы понять, почему образуются те или иные продукты в реакциях, рассматриваемых в профильных классах или заданиях ЕГЭ прошлых лет, где необходимо было только вставить один пропущенный продукт и самый сложный компонент реакции уже был дан.
Этот метод также может быть интересен тем, кто хочет глубже понять законы протекания химических реакций.
** Это такие пособия как [2], [6] и [9].
Рассмотрим основное правило:
Правило:
1. Если имеем избыток атомов кислорода:
| а) кислая среда: | +H+ → H2O, | т.е. лишние атомы кислорода будут связываться с атомами водорода в виде молекул воды |
| б) нейтральная и щелочная среды: | +H2O → OH–, | т.е. лишние атомы кислорода и молекулы воды будут связываться в виде гидроксид-ионов |
2. Если имеем недостаток атомов кислорода:
| в) кислая и нейтральные среды: | +H2O → H+, | т.е. недостающие атомы кислорода берем из воды |
| г) щелочная среда: | +OH– → H2O, | т.е. недостающие атомы кислорода берем из гидроксид-иона |
Для закрепления материала полезно потренировать составление реакций с помощью тренажера реакций. Успехов в изучении!
chemrise.ru