Метод электронного баланса и ионно-электронный метод (метод полуреакций)
Спецификой многих ОВР является то, что при составлении их уравнений подбор коэффициентов вызывает затруднение.
Для облегчения подбора коэффициентов чаще всего используют метод электронного баланса и ионно-электронный метод (метод полуреакций). Рассмотрим применение каждого из этих методов на примерах.
Метод электронного баланса
В его основе метода электронного баланса лежит следующее правило: общее число электронов, отдаваемое атомами-восстановителями, должно совпадать с общим числом электронов, которые принимают атомы-окислители.
В качестве примера составления ОВР рассмотрим процесс взаимодействия сульфита натрия с перманганатом калия в кислой среде.
1) Составить схему реакции:
Записать исходные вещества и продукты реакции, учитывая, что в кислой среде MnO4— восстанавливается до Mn2+ (см. схему):
схему):
Na2SO3 + KMnO4 + H2SO4 = Na2SO4 + MnSO4 + K2SO4 + H2O
2) Определить окислитель и восстановитель
Найдем степень окисления элементов:
Na2S+4O3 + KMn+7O4 + H2SO4 = Na2S+6O4 + Mn+2SO4 + K2SO4 + H2O
Из приведенной схемы понятно, что в процессе реакции происходит увеличение степени окисления серы с +4 до +6. S+4 отдает 2 электрона и является восстановителем. Степень окисления марганца уменьшилась от +7 до +2, т.е. Mn+7 принимает 5 электронов и является окислителем.
3) Составить электронные уравнения и найти коэффициенты при окислителе и восстановителе.
S+4 – 2e— = S+6 | 5 восстановитель, процесс окисления
Mn+7 +5e— = Mn+2 | 2 окислитель, процесс восстановления
Чтобы число электронов, отданных восстановителем, было равно числу электронов, принятых восстановителем, необходимо:
- Число электронов, отданных восстановителем, поставить коэффициентом перед окислителем.
- Число электронов, принятых окислителем, поставить коэффициентом перед восстановителем.
Таким образом, 5 электронов, принимаемых окислителем Mn+7, ставим коэффициентом перед восстановителем, а 2 электрона, отдаваемых восстановителем S+4 коэффициентом перед окислителем:
5Na2S+4O3 + 2KMn+7O4 + H2SO4 = 5Na2S+6O4 + 2Mn+2SO4 + K2SO4 + H2O
4) Уравнять количества атомов элементов, не изменяющих степень окисления
Соблюдаем последовательность: число атомов металлов, кислотных остатков, количество молекул среды (кислоты или щелочи). В последнюю очередь подсчитывают количество молекул образовавшейся воды.
В последнюю очередь подсчитывают количество молекул образовавшейся воды.
Итак, в нашем случае число атомов металлов в правой и левой частях совпадают.
По числу кислотных остатков в правой части уравнения найдем коэффициент для кислоты.
В результате реакции образуется 8 кислотных остатков SO42-, из которых 5 – за счет превращения 5SO32- → 5SO42-, а 3 – за счет молекул серной кислоты 8SO42-— 5SO42- = 3SO42-.
Таким образом, серной кислоты надо взять 3 молекулы:
5Na2SO3 + 2KMnO4 + 3H2SO4 = 5Na2SO4 + 2MnSO4 + K2SO4 + H2O
Аналогично, находим коэффициент для воды по числу ионов водорода, во взятом количестве кислоты
6H+ + 3O-2 = 3H2O
Окончательный вид уравнения следующий:
5Na2SO3 + 2KMnO4 + 3H2SO4 = 5Na2SO4 + 2MnSO4 + K2SO4 + 3H2O
Признаком того, что коэффициенты расставлены правильно является равное количество атомов каждого из элементов в обеих частях уравнения.
Ионно-электронный метод (метод полуреакций)
Реакции окисления-восстановления, также как и реакции обмена, в растворах электролитов происходят с участием ионов. Именно поэтому ионно-молекулярные уравнения ОВР более наглядно отражают сущность реакций окисления-восстановления.
При написании ионно-молекулярных уравнений, сильные электролиты записывают в виде ионов, а слабые электролиты, осадки и газы записывают в виде молекул (в недиссоциированном виде).
При написании полуреакций в ионной схеме указывают частицы, подвергающиеся изменению их степеней окисления, а также характеризующие среду, частицы:
H+ — кислая среда, OH— — щелочная среда и H2O – нейтральная среда.
Пример 1.
Рассмотрим пример составления уравнения реакции между сульфитом натрия и перманганатом калия в кислой среде.
1) Составить схему реакции:
Записать исходные вещества и продукты реакции:
Na2SO3 + KMnO4 + H2SO4 = Na2SO4 + MnSO4 + K2SO4 + H2O
2) Записать уравнение в ионном виде
В уравнении сократим те ионы, которые не принимают участие в процессе окисления-восстановления:
SO32- + MnO4— + 2H+ = Mn2+ + SO42- + H2O
3) Определить окислитель и восстановитель и составить полуреакции процессов восстановления и окисления.
В приведенной реакции окислитель — MnO4— принимает 5 электронов восстанавливаясь в кислой среде до Mn2+. При этом освобождается кислород, входящий в состав MnO4—, который, соединяясь с H+ образует воду:
MnO4— + 8H+ + 5e— = Mn2+ + 4H2O
Восстановитель SO32- — окисляется до SO42-, отдав 2 электрона. Как видно образовавшийся ион SO42- содержит больше кислорода, чем исходный SO32-. Недостаток кислорода восполняется за счет молекул воды и в результате этого происходит выделение 2H+:
SO32- + H2O — 2e— = SO42- + 2H+
4) Найти коэффициенты для окислителя и восстановителя
Необходимо учесть, что окислитель присоединяет столько электронов, сколько отдает восстановитель в процессе окисления-восстановления:
MnO4— + 8H+ + 5e— = Mn2+ + 4H2O |2 окислитель, процесс восстановления
SO32- + H2O — 2e— = SO42- + 2H+ |5 восстановитель, процесс окисления
5) Просуммировать обе полуреакции
Предварительно умножая на найденные коэффициенты, получаем:
2MnO4— + 16H+ + 5SO32- + 5H2O = 2Mn2+ + 8H2O + 5SO42- + 10H+
Сократив подобные члены, находим ионное уравнение:
2MnO4— + 5SO32- + 6H+ = 2Mn2+ + 5SO42- + 3H2O
6) Записать молекулярное уравнение
Молекулярное уравнение имеет следующий вид:
5Na2SO3 + 2KMnO4 + 3H2SO4 = 5Na2SO4 + 2MnSO4 + K2SO4 + 3H2O
Пример 2.
Далее рассмотрим пример составления уравнения реакции между сульфитом натрия и перманганатом калия в нейтральной среде.
Na2SO3 + KMnO4 + H2O = Na2SO4 + MnO2 + KOH
В ионном виде уравнение принимает вид:
SO32- + MnO4— + H2O = MnO2 + SO42- + OH—
Также, как и предыдущем примере, окислителем является MnO4—, а восстановителем SO32-.
В нейтральной и слабощелочной среде MnO4— принимает 3 электрона и восстанавливается до MnО2. SO32-— окисляется до SO42-, отдав 2 электрона.
Полуреакции имеют следующий вид:
MnO4— + 2H2O + 3e— = MnО2 + 4OH— |2 окислитель, процесс восстановления
SO32- + 2OH—— 2e— = SO42- + H2O |3 восстановитель, процесс окисления
Запишем ионное и молекулярное уравнения, учитывая коэффициенты при окислителе и восстановителе:
3SO32- + 2MnO4— + H2O =2MnO2 + 3SO42- + 2OH—
3Na2SO3 + 2KMnO4 + H2O = 2MnO2 + 3Na2SO4 + 2KOH
Пример 3.
Составление уравнения реакции между сульфитом натрия и перманганатом калия в щелочной среде.
Na2SO3 + KMnO4 + KOH = Na2SO4 + K2MnO4 + H2O
В ионном виде уравнение принимает вид:
SO32- + MnO4— + OH— = MnO2 + SO42- + H2O
В щелочной среде окислитель MnO4— принимает 1 электрон и восстанавливается до MnО42-. Восстановитель SO32-— окисляется до SO42-, отдав 2 электрона.
Полуреакции имеют следующий вид:
MnO4— + e— = MnО2 |2 окислитель, процесс восстановления
SO32- + 2OH—— 2e— = SO42- + H2O |1 восстановитель, процесс окисления
Запишем ионное и молекулярное уравнения, учитывая коэффициенты при окислителе и восстановителе:
SO32- + 2MnO4— + 2OH— = 2MnО42- + SO42- + H2O
Na2SO3 + 2KMnO4 + H2O = 2K2MnO4 + 3Na2SO4 + 2KOH
Необходимо отметить, что не всегда при наличии окислителя и восстановителя, возможно самопроизвольное протекание ОВР. Поэтому для количественной характеристики силы окислителя и восстановителя и для определения направления реакции пользуются значениями окислительно-восстановительных потенциалов.
Поэтому для количественной характеристики силы окислителя и восстановителя и для определения направления реакции пользуются значениями окислительно-восстановительных потенциалов.
Еще больше примеров составления окислительно-восстановительных реакций приведены в разделе Задачи к разделу Окислительно-восстановительные реакции. Также в разделе тест Окислительно-восстановительные реакции
Метод полуреакций | Химик.ПРО – решение задач по химии бесплатно
Методом полуреакций подберите коэффициенты в следующей окислительно-восстановительной реакции. Укажите окислитель и восстановитель. Какой из элементов окисляется, какой восстанавливается?
I2 + KOH → KI + KIO3 + h3O
Решение задачи
Метод полуреакций применим к окислительно-восстановительным реакциям, протекающим в водных растворах. Он основан на составлении электронно-ионных балансов двух полуреакций: одной — для процесса окисления и другой – для процесса восстановления. Затем проводится суммирование этих полуреакций. В результате получается общее ионно-молекулярное уравнение окислительно-восстановительной реакции.
Затем проводится суммирование этих полуреакций. В результате получается общее ионно-молекулярное уравнение окислительно-восстановительной реакции.
Записывают схему реакции в ионно-молекулярной форме и определяют ионы и молекулы которые изменяют степень окисления:
Участие в реакции ионов OH— говорит о том, что процесс протекает в щелочной среде.
Рассмотрим порядок действий при составлении уравнений полуреакций в щелочной среде.
1. В ионно-молекулярном уравнении каждой полуреакции уравнивают числа атомов всех элементов.
Полуреакции имеют вид:
Метод полуреакций Следует обратить внимание на следующие моменты. Если исходный ион или молекула содержит больше атомов кислорода, чем продукт реакции, избыток атомов кислорода в щелочной среде связывают молекулами воды в группы OH-. Если исходный ион или молекула содержит меньше число атомов кислорода, чем продукт реакции, то недостаток атомов кислорода в щелочных растворах компенсируется за счет молекул ионов OH-.
В данном случае среда щелочная, поэтому ионно-молекулярное уравнение полуреакции имеет вид:
2. Составляют электронно-ионные уравнения полуреакций. Для этого в левую часть каждой полуреакции добавляют (или вычитают) электроны с таким расчетом, чтобы суммарый заряд в левой и правой частях уравнений стал одинаковым. Метод полуреакций
Получаем:
3. Умножают полученные уравнения на наименьшие множители, для баланса по электронам.
Потом суммируют электронно-ионное уравнение:
4. Метод полуреакций Сокращают подобные члены и получают ионно-молекулярное уравнение окислительно-восстановительной реакции в щелочной среде:
5. По полученному ионно-молекулярному уравнению окислительно-восстановительной реакции составляют молекулярное уравнение. Для этого по схеме реакции определяют, из каких молекул получены данные ионы. Метод полуреакций
Ответ:
Конспект урока «Окислительно-восстановительные реакции»
Урок №1-2
Устранение пробелов знаний уч-ся по результатам пробного тестирования.
«Окислительно-восстановительные реакции»
Миллер Екатерина Иннокентьевна КГУ «СШ№10 с.Николаевка» Осакаровского района Карагандиской области
Цели урока:
сформировать понятие об окислительно-восстановительных реакциях;
научить учащихся уравнивать записи ОВР методом электронного баланса.
Научить учащихся уравнивать записи ОВР методом полуреакций.
Задачи урока:
повторить известные признаки классификации химических реакций;
повторить правила расчета степеней окисления в соединениях;
ввести понятия «окислительно-восстановительные реакции», «окисление», «восстановление», «окислитель», «восстановитель»;
научиться уравнивать записи ОВР методом электронного баланса и методом полуреакций.
Тип урока:урок закрепления знаний с использованием технологии критического мышления .
Оборудование: учебник «Химия », технологическая карта урока, рабочие листы, оценочные листы.
Формы работы:
индивидуальная работа, работа в парах, самопроверка и взаимопроверка, самооценка и взаимооценка.
Девиз урока:
Спорьте, заблуждайтесь , ошибайтесь , но ради бога – размышляйте и хотя криво –да сами. Г.Лессинг
Ход урока:
1.Организационно-мотивированный момент.
1.Взаимное приветствие.
2.Настрой на урок.
3.Мотивация.
Вспомните и запишите в тетрадь ,все что вам известно о химических реакциях. Поделитесь своими знаниями с соседом по парте.(заполнение кластера). На стадии вызова используем механизм ЗХУ (знаю, хочу узнать, узнал):
Должен знать
Еще не знаю
Знаю
Могу объяснить, помочь
Коллективная актуализация знаний. Заполним таблицу, знаком «плюс»- знаем ,»?»- -хочу узнать. В конце урока выясним , на все ли вопросы вы нашли ответ и заполним третью колонку таблицы «узнал».
В конце урока выясним , на все ли вопросы вы нашли ответ и заполним третью колонку таблицы «узнал».
2.Операционно-испольнительный этап.
Используем стратегию « чтение с остановками».
Первая остановка « Какие химические реакции бывают?»
Все химические реакции можно разделить на два типа. К первому из них относятся реакции, протекающие без изменения степени окисления атомов, входящих в состав реагирующих веществ.
Например:
=
=
Как видно, степень окисления каждого из атомов до и после реакции осталась без изменения.
Ко второму типу относятся реакции, идущие с изменением степени окисления атомов реагирующих веществ.
Например:
=
=
Здесь в первой реакции атомы хлора и кислорода, а во второй — атомы брома и хлора изменяют степень окисления.
Реакции, протекающие с изменением степени окисления атомов, входящих в состав реагирующих веществ, называются окислительно-восстановительными.
Изменение степени окисления связано с оттягиванием или перемещением электронов.
Окислительно-восстановительные реакции — самые распространенные и играют большую роль в природе и технике.
Рассмотрим основные положения теории окислительно-восстановительных реакций.
1. Окислением называется процесс отдачи электронов атомом, молекулой или ионом.
Например:
Al – 3e— = Al3+ Fe2+ — e— = Fe3+
H2 – 2e— = 2H+ 2Cl— — 2e— = Cl2
При окислении степень окисления повышается.
2. Восстановлением называется процесс присоединения электронов атомом, молекулой или ионом.
Например:
S + 2е— = S2- Сl2 + 2е- = 2Сl— Fe3+ + e- = Fe2+
При восстановлении степень окисления понижается.
3. Атомы, молекулы или ионы, отдающие электроны называются восстановителями. Во время реакции они окисляются. Атомы, молекулы или ионы, присоединяющие электроны, называются окислителями. Во время реакции они восстанавливаются. Так как атомы, молекулы и ионы входят в состав определенных веществ, то и эти вещества соответственно называются восстановителями или окислителями.
4. Окисление всегда сопровождается восстановлением, и наоборот, восстановление всегда связано с окислением, что можно выразить уравнениями:
Восстановитель – е—Окислитель
Окислитель + е—Восстановитель
Поэтому окислительно-восстановительные реакции представляют собой единство двух противоположных процессов — окисления и восстановления.
Число электронов, отдаваемых восстановителем, равно числу электронов, присоединяемых окислителем.
При этом, независимо от того, переходят ли электроны с одного атома на другой полностью или же лишь частично оттягиваются к одному из атомов, условно говорят только об отдаче и присоединении электронов.
Процессы окисления и восстановления можно физически отделить друг от друга и осуществить перенос электронов по внешней электрической цепи.
Вторая остановка «Метод электронного баланса»
Метод электронного баланса
В этом методе сравнивают степени окисления атомов в исходных и конечных веществах, руководствуясь правилом: число электронов, отданных восстановителем, должно равняться числу электронов, присоединенных окислителем. Для составления уравнения надо знать формулы реагирующих веществ и продуктов реакции. Последние определяются либо опытным путем, либо на основе известных свойств элементов. Рассмотрим применение этого метода на примерах.
Пример 1. Составление уравнения реакции меди с раствором нитрата палладия (II). Запишем формулы исходных и конечных веществ реакции и покажем изменения степеней окисления:
Медь, образуя ион меди, отдает два электрона, ее степень окисления повышается от 0 до +2.
из которых следует, что при восстановителе и окислителе коэффициенты равны 1. Окончательное уравнение реакции:
Cu + Pd(NO3)2 = Cu(NO3)2 + Pd
Как видно, в суммарном уравнении реакции электроны не фигурируют.
Чтобы проверить правильность составленного уравнения, подсчитываем число атомов каждого элемента в его правой и левой частях. Например, в правой части 6 атомов кислорода, в левой также 6 атомов; палладия 1 и 1; меди тоже 1 и 1. Значит, уравнение составлено правильно.
Переписываем это уравнение в ионной форме:
Cu + Pd2+ + 2NO3— = Cu2+ + 2NO3— + Рd
И после сокращения одинаковых ионов получим
Cu + Pd2+ = Cu2+ + Pd
Пример 2. Составление уравнения реакции взаимодействия оксида марганца (IV) с концентрированной соляной кислотой (с помощью этой реакции в лабораторных условиях получают хлор).
Составление уравнения реакции взаимодействия оксида марганца (IV) с концентрированной соляной кислотой (с помощью этой реакции в лабораторных условиях получают хлор).
Запишем формулы исходных и конечных веществ реакции:
НCl + МnО2 → Сl2 + MnСl2 + Н2О
Покажем изменение степеней окисления атомов до и после реакции:
Эта реакция окислительно-восстановительная, так как изменяются степени окисления атомов хлора и марганца. НCl — восстановитель, MnО2 — окислитель. Составляем электронные уравнения:
и находим коэффициенты при восстановителе и окислителе. Они соответственно равны 2 и 1. Коэффициент 2 (а не 1) ставится потому, что 2 атома хлора со степенью окисления -1 отдают 2 электрона. Этот коэффициент уже стоит в электронном уравнении:
2НСl + MnO2 → Сl2 + MnСl2 + Н2О
Находим коэффициенты для других реагирующих веществ. Из электронных уравнений видно, что на 2 моль HCl приходится 1 моль MnО2. Однако, учитывая, что для связывания образующегося двухзарядного иона марганца нужно еще 2 моль кислоты, перед восстановителем следует поставить коэффициент 4. Тогда воды получится 2 моль. Окончательное уравнение имеет вид
Из электронных уравнений видно, что на 2 моль HCl приходится 1 моль MnО2. Однако, учитывая, что для связывания образующегося двухзарядного иона марганца нужно еще 2 моль кислоты, перед восстановителем следует поставить коэффициент 4. Тогда воды получится 2 моль. Окончательное уравнение имеет вид
4НCl + МnО2 = Сl2 + MnСl2 + 2Н2О
Проверку правильности написания уравнения можно ограничить подсчетом числа атомов одного какого-либо элемента, например хлора: в левой части 4 и в правой 2 + 2 = 4.
Поскольку в методе электронного баланса изображаются уравнения реакций в молекулярной форме, то после составления и проверки их следует написать в ионной форме.
Перепишем составленное уравнение в ионной форме:
4Н+ + 4Сl— + МnО2 = Сl2 + Мn2+ + 2Сl— + 2Н2О
и после сокращения одинаковых ионов в обеих частях уравнения получим
4Н+ + 2Cl— + MnO2 = Сl2 + Mn2+ + 2Н2О
Пример 3. Составление уравнения реакции взаимодействия сероводорода с подкисленным раствором перманганата калия.
Составление уравнения реакции взаимодействия сероводорода с подкисленным раствором перманганата калия.
Напишем схему реакции — формулы исходных и полученных веществ:
Н2S + КМnO4 + Н2SО4 → S + МnSО4 + К2SO4 + Н2О
Затем покажем изменение степеней окисления атомов до и после реакции:
Изменяются степени окисления у атомов серы и марганца (Н2S — восстановитель, КМnО4 — окислитель). Составляем электронные уравнения, т.е. изображаем процессы отдачи и присоединения электронов:
И наконец, находим коэффициенты при окислителе и восстановителе, а затем при других реагирующих веществах. Из электронных уравнений видно, что надо взять 5 моль Н2S и 2 моль КМnО4, тогда получим 5 моль атомов S и 2 моль МnSО4. Кроме того, из сопоставления атомов в левой и правой частях уравнения, найдем, что образуется также 1 моль К2SО4 и 8 моль воды. Окончательное уравнение реакции будет иметь вид
Окончательное уравнение реакции будет иметь вид
5Н2S + 2КМnО4 + ЗН2SО4 = 5S + 2МnSО4 + К2SО4 + 8Н2О
Правильность написания уравнения подтверждается подсчетом атомов одного элемента, например кислорода; в левой части их 2.4 + 3.4 = 20 и в правой части 2.4 + 4 + 8 = 20.
Переписываем уравнение в ионной форме:
5Н2S + 2MnO4— + 6H+ = 5S + 2Мn2+ + 8Н2О
Известно, что правильно написанное уравнение реакции является выражением закона сохранения массы веществ. Поэтому число одних и тех же атомов в исходных веществах и продуктах реакции должно быть одинаковым. Должны сохраняться и заряды. Сумма зарядов исходных веществ всегда должна быть равна сумме зарядов продуктов реакции.
Третья остановка « Важнейшие восстановители и окислители»
Важнейшие восстановители и окислители
Восстановители
Окислители
Металлы, водород, уголь
Оксид углерода (II) CO
Сероводород H2S, оксид серы (IV) SO2, сернистая кислота H2SO3 и ее соли
Иодоводородная кислота HI, бромоводородная кислота HBr, соляная кислота HCl
Хлорид олова (II) SnCl2, сульфат железа (II) FeSO4, сульфат марганца (II) MnSO4, сульфат хрома (III) Cr2(SO4)3
Азотистая кислота HNO2, аммиак NH3, гидразин N2H4, оксид азота (II) NO
Фосфористая кислота H3PO3
Альдегиды, спирты, муравьиная и щавелевая кислоты, глюкоза
Катод при электролизе
Галогены
Перманганат калия KMnO4, манганат калия K2MnO4, оксид марганца (IV) MnO2
Дихромат калия K2Cr2O7, хромат калия K2CrO4
Азотная кислота HNO3
Кислород O2, озон О3,
пероксид водорода Н2О2
Серная кислота H2SO4 (конц.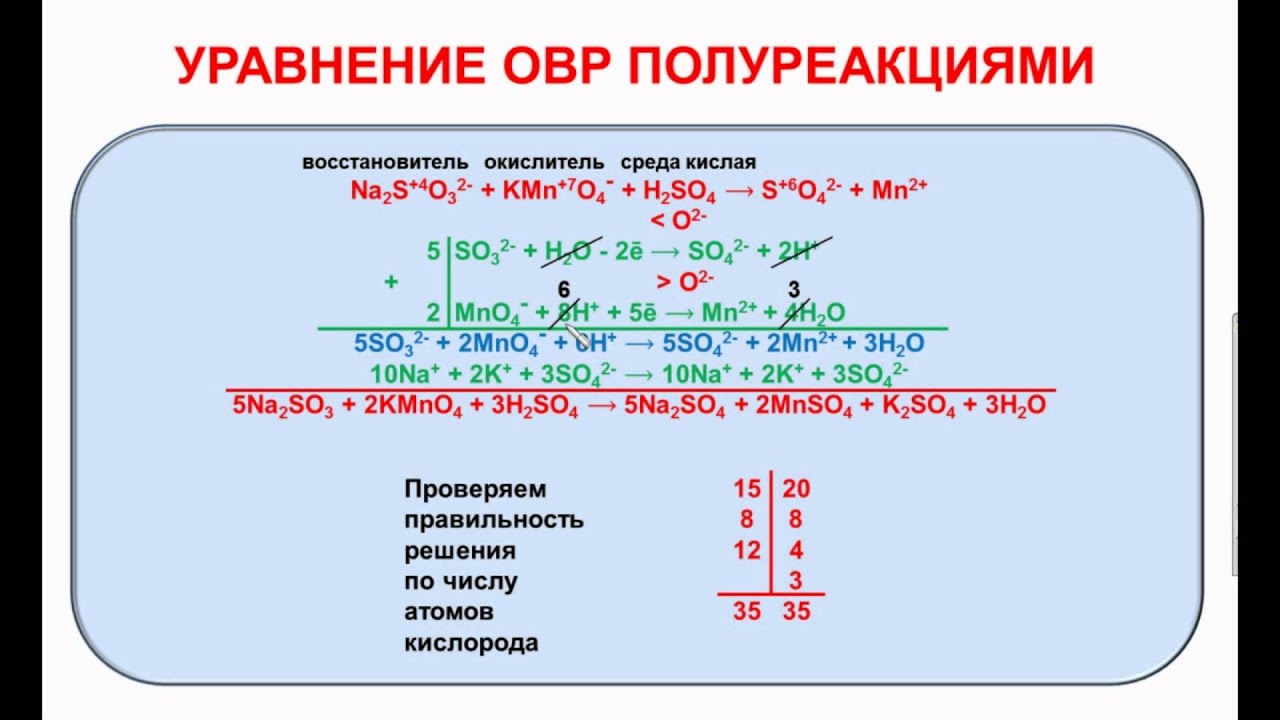 ), селеновая кислота H2SeO4
), селеновая кислота H2SeO4
Оксид меди (II) CuO, оксид серебра (I) Ag2O, оксид свинца (IV) PbO2
Ионы благородных металлов
(Ag+, Au3+ и др.)
Хлорид железа (III) FeCl3
Гипохлориты, хлораты и перхлораты
Царская водка, смесь концентрированной азотной и плавиковой кислот
Четвертая остановка « Метод полуреакций».
Метод полуреакций
Как показывает само название, этот метод основан на составлении ионных уравнений для процесса окисления и процесса восстановления с последующим суммированием их в общее уравнение. В качестве примера составим уравнение той же реакции, которую использовали при объяснении метода электронного баланса. При пропускании сероводорода Н2S через подкисленный раствор перманганата калия КМnО4 малиновая окраска исчезает и раствор мутнеет. Опыт показывает, что помутнение раствора происходит в результате образования элементной серы, т.е. протекания процесса:
Опыт показывает, что помутнение раствора происходит в результате образования элементной серы, т.е. протекания процесса:
Н2S → S + 2H+
Эта схема уравнена по числу атомов. Для уравнивания по числу зарядов надо от левой части схемы отнять два электрона, после чего можно стрелку заменить на знак равенства:
Н2S — 2е— = S + 2H+
Это первая полуреакция — процесс окисления восстановителя Н2S.
Обесцвечивание раствора связано с переходом иона MnO4— (он имеет малиновую окраску) в ион Mn2+ (практически бесцветный и лишь при большой концентрации имеет слабо-розовую окраску), что можно выразить схемой
MnO4— → Mn2+
В кислом растворе кислород, входящий в состав ионов МnО4, вместе с ионами водорода в конечном итоге образует воду. Поэтому процесс перехода записываем так:
MnO4— + 8Н+→ Мn2+ + 4Н2О
Чтобы стрелку заменить на знак равенства, надо уравнять и заряды. Поскольку исходные вещества имеют семь положительных зарядов (7+), а конечные — два положительных (2+), то для выполнения условия сохранения зарядов надо к левой части схемы прибавить пять электронов:
Поскольку исходные вещества имеют семь положительных зарядов (7+), а конечные — два положительных (2+), то для выполнения условия сохранения зарядов надо к левой части схемы прибавить пять электронов:
MnO4— + 8Н+ + 5e—= Mn2+ + 4Н2О
Это вторая полуреакция — процесс восстановления окислителя, т.е. перманганат-иона
Для составления общего уравнения реакции надо уравнения полуреакцийпочленно сложить, предварительно уравняв числа отданных и полученных электронов. В этом случае по правилам нахождения наименьшего кратного определяют соответствующие множители, на которые умножаются уравнения полуреакций. Сокращенно запись проводится так:
И, сократив на 10Н+, окончательно получим
5Н2S + 2MnO4— + 6H+ = 5S + 2Mn2+ + 8Н2О
Проверяем правильность составленного в ионной форме уравнения: число атомов кислорода в левой части 8, в правой 8; число зарядов: в левой части (2-)+(6+) = 4+, в правой 2(2+) = 4+. Уравнение составлено правильно, так как атомы и заряды уравнены.
Уравнение составлено правильно, так как атомы и заряды уравнены.
Методом полуреакций составляется уравнение реакции в ионной форме. Чтобы от него перейти к уравнению в молекулярной форме, поступаем так: в левой части ионного уравнения к каждому аниону подбираем соответствующий катион, а к каждому катиону — анион. Затем те же ионы в таком же числе записываем в правую часть уравнения, после чего ионы объединяем в молекулы:
Таким образом, составление уравнений окислительно-восстановительных реакций с помощью метода полуреакций приводит к тому результату, что и метод электронного баланса.
Сопоставим оба метода. Достоинство метода полуреакций по сравнению с методом электронного баланса в том.что в нем применяются не гипотетические ионы, а реально существующие. В самом деле, в растворе нет ионова есть ионы
При методе полуреакций не нужно знать степень окисления атомов. Написание отдельных ионных уравнений полуреакций необходимо для понимания химических процессов в гальваническом элементе и при электролизе. При этом методе видна роль среды как активного участника всего процесса. Наконец, при использовании метода полуреакций не нужно знать все получающиеся вещества, они появляются в уравнении реакции при выводе его. Поэтому методу полуреакций следует отдать предпочтение и применять его при составлении уравнений всех окислительно-восстановительных реакций, протекающих в водных растворах.
При этом методе видна роль среды как активного участника всего процесса. Наконец, при использовании метода полуреакций не нужно знать все получающиеся вещества, они появляются в уравнении реакции при выводе его. Поэтому методу полуреакций следует отдать предпочтение и применять его при составлении уравнений всех окислительно-восстановительных реакций, протекающих в водных растворах.
3этап. Осмысление.
Задача 1. Напишите уравнение реакции окисления дисульфида железа (II) концентрированной азотной кислотой. Составьте: схемы электронного и электронно-ионного баланса.
Решение. НNО3 — сильный окислитель, поэтому сера будет окисляться до максимальной степени окисления S+6, а железо до Fe+3, при этом НNО3 может восстанавливаться до NO или NO2. Рассмотрим случай восстановления до NО2.
FеS2 + НNO3(конц) → Fе(NO3)3 + Н2SО4 + NО2.
Где будет находиться Н2О (в левой или правой части), пока неизвестно.
Уравняем данную реакцию методом электронного баланса. Процесс восстановления описывается схемой:
N+5 + e → N+4
В полуреакцию окисления вступают сразу два элемента — Fe и S. Железо в дисульфиде имеет степень окисления +2, а сера -1. Необходимо учесть, что на один атом Fе приходится два атома S:
Fe+2 – e → Fe+3
2S— — 14e → 2S+6.
Вместе железо и сера отдают 15 электронов. Полный баланс имеет вид:
15 молекул НNО3 идут на окисление FеS2, и еще 3 молекулы НNО3 необходимы для образования Fе(NО3)3:
FеS2 + 18НNО3 → Fе(NО3)3 + 2Н2SО4 + 15NО2 .
Чтобы уравнять водород и кислород, в правую часть надо добавить 7 молекул Н2О:
FeS2 + 18НNО3(конц) = Fе(NО3)3 + 2Н2SО4 + 15NО2 + 7Н2О.
Используем теперь метод электронно-ионного баланса. Рассмотрим полуреакцию окисления. Молекула FеS2 превращается в ион Fе3+ (Fе(NО3)3 полностью диссоциирует на ионы) и два иона SO42- (диссоциация H2SO4):
FeS2 → Fe3+ + 2SO24-.
Для того, чтобы уравнять кислород, в левую часть, добавим 8 молекул H2O, а в правую – 16 ионов Н+ (среда кислая!):
FeS2 + 8H2O → Fe3+ + 2SO42- + 16H+.
Заряд левой части равен 0, заряд правой +15, поэтому FеS2 должен отдать 15 электронов:
FеS2 + 8Н2О — 15е → Fе3+ + 2SО42- + 16Н+.
Рассмотрим теперь полуреакцию восстановления нитрат-иона:
NO-3 → NO2.
Необходимо отнять у NО3— один атом О. Для этого к левой части добавим 2 иона Н+ (кислая среда), а к правой — одну молекулу Н2О:
NО3— + 2Н+ → NО2 + Н2О.
Для уравнивания заряда к левой части (заряд +1) добавим один электрон:
NО3— + 2Н+ + е → NO2 + Н2О.
Полный электронно-ионный баланс имеет вид:
Сократив обе части на 16Н+ и 8Н2О, получим сокращенное ионное уравнение окислительно-восстановительной реакции:
FеS2 + 15NО3— + 14Н+ = Fе3+ + 2SО42- + 15NО2 + 7Н2О.
Добавив в обе части уравнения соответствующее количество ионов по три иона NО3— и Н+, находим молекулярное уравнение реакции:
FеS2 + 18НNО3(конц) = Fе(NО3)3 + 2Н2SО4 + 15NО2 + 7Н2О.
Задача 2. Напишите уравнения реакций, протекающих в водной среде:
а) Na2SО3 + КМnО4 + Н2SО4 → X + …
б) Х + КОН → …
Решение.
а) Перманганат калия в кислой среде восстанавливается в соль марганца (II), а сульфит натрия окисляется до сульфата натрия:
5Nа2SО3 + 2КМnО4 + ЗН2SО4 = 5Nа2SО4 + К2SО4 + 2МnSО4 + ЗН2О.
б) Из продуктов реакции а) только сульфат марганца (II) (вещество X) реагирует со щелочью в водном растворе:
MnSО4 + 2КОН = Мn(ОН)2↓+ К2SО4.
Задача 3. Электролиз 400 г 8,5%-ного раствора нитрата серебра продолжали до тех пор, пока масса раствора не уменьшилась на 25 г. Вычислите массовые доли соединений в растворе, полученном после окончания электролиза, и массы веществ, выделившихся на инертных электродах.
Решение. При электролизе водного раствора АgNО3 на катоде происходит восстановление ионов Аg+, а на аноде — окисление молекул воды:
Катод: Аg+ + е = Аg.
Анод: 2Н2О — 4е = 4Н+ + О2.
Суммарное уравнение:
4AgNО3 + 2Н2О = 4Ag↓ + 4НNО3 + О2↑.
v(АgNО3) = 400.0,085 / 170 = 0,2 моль. При полном электролитическом разложении данного количества соли выделяется 0,2 моль Аg массой 0,2.108 = 21,6 г и 0,05 моль О2 массой 0,05.32 = 1,6 г. Общее уменьшение массы раствора за счет серебра и кислорода составит 21,6+1,6 = 23,2 г.
При электролизе образовавшегося раствора азотной кислоты разлагается вода:
2H2O = 2Н2↑ + O2↑.
Потеря массы раствора за счет электролиза воды составляет 25 — 23,2 = 1,8 г. Количество разложившейся воды равно: v(Н20) = 1,8/18 = 0,1. На электродах выделилось 0,1 моль Н2 массой 0,1.2 = 0,2 г и 0,1/2 = 0,05 моль О2 массой 0,05.32 = 1,6 г. Общая масса кислорода, выделившегося на аноде в двух процессах, равна 1,6+1,6 = 3,2 г.
Количество разложившейся воды равно: v(Н20) = 1,8/18 = 0,1. На электродах выделилось 0,1 моль Н2 массой 0,1.2 = 0,2 г и 0,1/2 = 0,05 моль О2 массой 0,05.32 = 1,6 г. Общая масса кислорода, выделившегося на аноде в двух процессах, равна 1,6+1,6 = 3,2 г.
В оставшемся растворе содержится азотная кислота: v(НNO3) = v(AgNО3) = 0,2 моль, m(НNО3) = 0,2.63 = 12,6 г. Масса раствора после окончания электролиза равна 400-25 = 375 г. Массовая доля азотной кислоты: ω(НNО3) = 12,6/375 = 0,0336, или 3,36%.
Ответ. ω(НNО3) = 3,36%, на катоде выделилось 21,6 г Аg и 0,2 г Н2, на аноде — 3,2 г О2.
Задача 4. Составить уравнение реакции восстановления Fe3O4 водородом.
Решение. Запишем схему процесса с указанием изменения степеней окисления элементов:
Составляем электронные уравнения:
Найденные коэффициенты проставляем в схему процесса, заменяя стрелку на знак равенства:
Fе3О4 + 4Н2 = ЗFе + 4Н2О
Задача 5. Составьте схемы электролиза водных растворов: а) сульфата меди б) хлорида магния; в) сульфата калия.
Составьте схемы электролиза водных растворов: а) сульфата меди б) хлорида магния; в) сульфата калия.
Во всех случаях электролиз проводится с использованием угольных электродов.
Решение.
а) В растворе сульфат меди диссоциирует на ионы:
СuSО4 Сu2+ + SO42-
Ионы меди могут восстанавливаться, на катоде в водном растворе. Сульфат-ионы в водном растворе не окисляются, поэтому на аноде будет протекать окисление воды. Схема электролиза:
б) Диссоциация хлорида магния в водном растворе:
MgCl2+Mg2++2Сl—
Ионы магния не могут восстанавливаться в водном растворе (идет восстановление воды), хлорид-ионы — окисляются. Схема электролиза:
в) Диссоциация сульфата калия в водном растворе:
К2SО42К+ + SO42-
Ионы калия и сульфат-ионы не могут разряжаться на электродах в водном растворе, следовательно, на катоде будет протекать восстановление, а на аноде — окисление воды. Схема электролиза:
Схема электролиза:
или, учитывая, что 4Н+ + 4ОН— = 4Н2О (осуществляется при перемешивании),
2H2O2H2 + O2
4 этап.Рефлексия
Синквейн — способ творческой рефлексии — “стихотворение”, написанное по определенным правилам:
1 строка — одно существительное,
2-ая — два прилагательных,
3-я — три глагола,
4-ая — крылатая фраза,
5-ая — одно существительное, которое выражает суть.
5этап.Итоги урока.
Выставление оценок за урок.
Творческое задание –написать эссе на тему « Окислительно-восстановительные реакции».
Список рекомендованной литературы
1. Микитюк А.Д. Сборник задач и упражнений по химии. 8-11 классы / А.Д. Микитюк. – М.: Изд. «Экзамен», 2009. (с.68-71)
2. Оржековский П.А. Химия: 9-й класс: учеб.дляобщеобраз. учрежд. / П.А. Оржековский, Л.М. Мещерякова, Л.С. Понтак. – М.: АСТ: Астрель, 2007. (§22)
/ П.А. Оржековский, Л.М. Мещерякова, Л.С. Понтак. – М.: АСТ: Астрель, 2007. (§22)
3. Рудзитис Г.Е. Химия: неорган. химия. Орган.химия: учеб. для 9 кл. / Г.Е. Рудзитис, Ф.Г. Фельдман. – М.: Просвещение, ОАО «Московские учебники», 2009. (§5)
4. Химия. 8-11 классы: тренинги и тесты с ответами по теме «Окислительно-восстановительные реакции» / авт.-сост. Т.М. Солдатова. – Волгоград: Учитель, 2007. (с.12-20)
5. Хомченко И.Д. Сборник задач и упражнений по химии для средней школы. – М.: РИА «Новая волна»: Издатель Умеренков, 2008. (с.55)
6. Энциклопедия для детей. Том 17. Химия / Глав.ред. В.А. Володин, вед. науч. ред. И. Леенсон. – М.: Аванта+, 2003. (с.70-77)
Окислительно-восстановительные реакции (ОВР) — что это такое? Примеры и реакции
Что такое ОВР
Окислительно-восстановительная реакция (ОВР) — это реакция, которая протекает с изменением степеней окисления.
В такой реакции всегда участвуют вещество-окислитель и вещество-восстановитель. Другие вещества могут выступать в качестве среды, в которой протекает данная реакция.
Другие вещества могут выступать в качестве среды, в которой протекает данная реакция.
Конечно, в каждом правиле есть исключения. Например, реакция диспропорционирования галогенов в горячем растворе щелочи выглядит так: Br2 + KOH = KBrO3 + KBr + H2O. Здесь и окислителем, и восстановителем является простое вещество бром (Br2).
Теперь посмотрим внимательнее на вещества — участники окислительно-восстановительных реакций.
Окислитель — вещество, в состав которого входит ион или атом, который в процессе реакции будет принимать электроны, тем самым понижая свою степень окисления.
Восстановитель — вещество, в состав которого входит ион или атом, который в процессе реакции будет отдавать электроны, тем самым повышая свою степень окисления.
Из определений понятно, что реакция включает два противоположных по действиям явления: процесс окисления и процесс восстановления. Процесс восстановления — это процесс принятия электронов, а процесс окисления — процесс отдачи электронов. Оба процесса протекают одновременно: окислитель восстанавливается, а восстановитель окисляется.
Процесс восстановления — это процесс принятия электронов, а процесс окисления — процесс отдачи электронов. Оба процесса протекают одновременно: окислитель восстанавливается, а восстановитель окисляется.
Вот мы и узнали общие закономерности протекания окислительно-восстановительных реакций. Теперь давайте разберемся, какие вещества могут быть окислителями, а какие — восстановителями, и может ли одно вещество проявлять те и другие свойства.
Примеры веществ-окислителей
Только окислителями могут быть элементы в высшей своей степени окисления. Например, S+6 в серной кислоте (H2SO4), N+5 в азотной кислоте (HNO3) или солях-нитратах, Cr+6 в хроматах (CrO42−) и дихроматах (Cr2O72−) соответственно, а также Mn+7 (MnO4−).
В зависимости от среды проведения реакции Mn+7 и Cr+6 ведут себя по-разному. Рассмотрим на схемах:
Рассмотрим на схемах:
И марганец, и хром в кислой среде (H+) образуют соли той кислоты, которая образовывала среду. В нейтральной среде (H2O) марганец превращается в оксид бурого цвета, а хром — в серо-зеленый нерастворимый в воде гидроксид. В щелочной среде (OH−) марганец превращается в манганат (MnO42−), а хром — в комплексное соединение светло-зеленого цвета.
Только окислителями могут быть простые вещества-неметаллы. Например, представители VIIA группы — галогены. Проявляя окислительные свойства в кислой среде, галогены восстанавливаются до соответствующих им галогеноводородных кислот: HF, HCl, HBr, HI. В щелочной среде образуются соли галогеноводородных кислот.
Кислород превращается в анион с устойчивой степенью окисления −2. А сера ведет себя как окислитель по отношению к водороду и металлам, образуя при этом сероводород и сульфиды.
Только окислителями могут быть и протон водорода (H+) и катионы металлов в их высших степенях окисления при нескольких возможных. Ион Н+ при взаимодействии с восстановителями переходит в газообразный водород (H2), а катионы металлов — в ионы с более низкой степенью окисления: 2CuCl2 + 2KI = CuCl + 2KCl + I2.
Ион Н+ при взаимодействии с восстановителями переходит в газообразный водород (H2), а катионы металлов — в ионы с более низкой степенью окисления: 2CuCl2 + 2KI = CuCl + 2KCl + I2.
Рассмотрим как ведут себя сильные кислоты-окислители — азотная и серная. В зависимости от их концентрации меняются и продукты реакции.
Запоминаем!
Разбавленная азотная кислота никогда не реагирует с металлами с выделением водорода в отличие от разбавленной серной кислоты. Обе эти кислоты реагируют с металлами, стоящими в ряду активности после водорода.
Эти кислоты проявляют окислительные способности и с некоторыми неметаллами, окисляя их до соответствующих кислот в высшей степени окисления неметалла-восстановителя.
Для удобства мы собрали цвета переходов важнейших веществ-окислителей в одном месте.
Примеры веществ-восстановителей
Типичными восстановителями могут быть щелочные (IA) и щелочноземельные (IIA) металлы, цинк и алюминий, а также катионы металлов в своих низших степенях окисления при нескольких возможных. Например:
Например:
Fe + H2SO4 (разб) = FeSO4 + H2
6СuCl + K2Cr2O7 + 14HCl (разб) = 6CuCl2 + 2CrCl3 + 2KCl + 7H2O.
Типичными восстановителями также могут быть бескислородные кислоты и их соли. Например, H2S + 4Cl2 + 4H2O = 8HCl + H2SO4.
Гидриды активных металлов (щелочных и щелочноземельных) тоже являются типичными восстановителями. Например, NaH + H2O = NaOH + H2.
Для удобства мы собрали цвета переходов важнейших веществ-восстановителей в одном месте.
Окислительно-восстановительная двойственность
Окислительно-восстановительная двойственность — это способность атома проявлять как свойства окислителя, так и свойства восстановителя в зависимости от условия протекания химической реакции.
Разберем вещества, атомы которых обладают окислительно-восстановительной двойственностью.
Сера
По отношению к водороду и металлам сера играет роль окислителя: S + H2 = H2S.
При взаимодействии с сильными окислителями повышает свою степень окисления до +4 или +6: S + KMnO4 = K2SO4 + MnO2.
Кислородсодержащие соединения серы в степени окисления +4
Сера в сульфитах и сернистой кислоте при взаимодействии с сильными окислителями повышает степень окисления до +6: SO2 + 2HNO3 (конц) = H2SO4 + 2NO2.
С восстановителями соединения серы проявляют окислительные свойства, восстанавливаясь до степени окисления 0 или −2: SO2 + C = CO2 + S.
Пероксид водорода
Атом кислорода в пероксиде водорода находится в промежуточной степени окисления –1, и в присутствии восстановителей может понижать степень окисления до –2: 4H2O2 + PbS = PbSO4 + 4H2O.
Атом кислорода в пероксиде водорода находится в промежуточной степени окисления –1, и в присутствии окислителей может повышать степень окисления до 0: 3H2O2 + 2KMnO4 = 3O2 + 2MnO2 + 2KOH + 2H2O.
Простое вещество йод
Окислительная способность проявляется у йода в реакции с такими восстановителями, как сероводород, фосфор и металлы: I2 + H2S = S + 2HI.
Йод при взаимодействии с более сильными окислителями играет роль восстановителя: I2 + 5Cl2 + 6H2O = 2HIO3 + 10HCl.
Азотистая кислота и нитриты
При взаимодействии с более сильными окислителями азот повышает степень окисления до +5 и превращается либо в азотную кислоту из азотистой, либо в нитрат-анион из нитрит-аниона: 5NaNO2 + 2KMnO4 + 3H2SO4 = 5NaNO3 + 2MnSO4 + K2SO4 + 3H2O.
При взаимодействии с сильными восстановителями обычно происходит восстановление до NO (иногда до других соединений азота в более низких степенях окисления): 2HNO2 + 2HI = 2NO + I2 + 2H2O.
Для удобства мы собрали представителей типичных окислителей и восстановителей в одну схему.
Классификация окислительно-восстановительных реакций
Окислительно-восстановительные реакции можно поделить на четыре типа:
межмолекулярные ОВР;
внутримолекулярные ОВР;
реакции диспропорционирования;
реакции контрпропорционирования.
Рассмотрим каждую по отдельности.
Межмолекулярная ОВР — это реакция, окислитель и восстановитель которой являются различными веществами.
2KI + Br2 = 2KBr + I2, где Br2 — окислитель, а KI — восстановитель (за счёт I−1).
Внутримолекулярная ОВР — это реакция, в которой один атом является окислителем, а другой восстановителем в рамках одного соединения.
Пример такой окислительно-восстановительной реакции:
где Cl+5 — окислитель, а O−2 — восстановитель.
Термическое разложение нитратов — это внутримолекулярная ОВР. Вот схема разложения нитратов в зависимости от металла, входящего в состав соли.
Исключение — разложение нитрата железа (II): 4Fe(NO3)2 = 2Fe2O3 + 8NO2 + O2. Здесь железо окисляется до +3 вопреки правилам. Иначе разлагается при нагревании и нитрат аммония: NH4NO3 = N2O + 2H2O.
Окислительно-восстановительная реакция диспропорционирования — это реакция, в ходе которой один и тот же атом является и окислителем, и восстановителем. Например, 3HNO2 = HNO3 + 2NO + H2O, где N+3 переходит в N+5, являясь восстановителем, и N+3 переходит в N+2, являясь окислителем.
Окислительно-восстановительная реакция контрпропорционирования — это реакция, в которой атомы одного и того же химического элемента в разных степенях окисления входят в состав разных веществ, при этом образуя новые молекулы одного и того же продукта.
Основные правила составления ОВР
Подобрать среди исходных веществ окислитель и восстановитель, а также вещество, которое отвечает за среду — при необходимости. Для этого нужно расставить степени окисления элементов и сравнить их окислительно-восстановительные свойства.
Составить уравнение реакции и записать продукты реакции. Следует помнить, что в кислой среде образуются соли одно-, двух- и трехзарядных катионов, а для создания среды чаще всего используют серную кислоту. В кислой среде невозможно образование оснóвных оксидов и гидроксидов, так как они вступят в реакцию с кислотой. В щелочной среде не могут образовываться кислоты и кислотные оксиды, а образуются соли.

Уравнять методом электронного баланса или методом полуреакций.
Составим алгоритм для уравнивания окислительно-восстановительных реакций методом электронного баланса.
Главное условие протекания ОВР — общее число электронов, отданных восстановителем, должно быть равно общему числу электронов, принятых окислителем.
Определите атомы, которые меняют свои степени окисления в ходе реакции.
Выпишите, сколько электронов принял окислитель и отдал восстановитель. Если восстановителей несколько, выписываем все.
Найдите НОК для суммарно отданных/принятых электронов.
Расставьте первые полученные коэффициенты перед окислителем и одним или несколькими восстановителями.
Уравняйте все присутствующие металлы в уравнении реакции.
Уравняйте кислотные остатки.
Уравняйте водород — в обеих частях его должно быть одинаковое количество.

Проверьте себя по кислороду — если все посчитано верно, то он сойдется.
22.10: Балансировка окислительно-восстановительных реакций – метод полуреакций
На рисунке ниже показан один из двух аттракционов «Громовой дельфин». У этого поезда оранжевая полоса, а у его попутчика — желтая. Пигменты этих цветов часто изготавливаются из дихроматной соли (обычно дихромата натрия или калия). Эти ярко окрашенные соединения служат сильными окислителями в химических реакциях.
Балансировка окислительно-восстановительных уравнений: метод полуреакций
Другой метод уравновешивания окислительно-восстановительных реакций использует полуреакции.Напомним, что полуреакция — это либо окисление, либо восстановление, происходящее отдельно. Метод полуреакции работает лучше, чем метод степени окисления, когда вещества в реакции находятся в водном растворе. Водный раствор обычно либо кислый, либо щелочной, поэтому в нем присутствуют ионы водорода или гидроксид-ионы.
Обычно полуреакции сначала уравновешиваются атомами по отдельности. Электроны включаются в полуреакции. Затем они уравновешиваются, так что количество потерянных электронов равно количеству полученных электронов.{3+}} \left( aq \right) + 7 \ce{H_2O} \left( l \right) \end{align}\]
Шаг 7: Проверьте балансировку. В приведенном выше уравнении есть \(14 \: \ce{H}\), \(6 \: \ce{Fe}\), \(2 \: \ce{Cr}\) и \( 7 \: \ce{O}\) с обеих сторон. Чистая плата составляет \(24+\) с обеих сторон. Уравнение сбалансировано.
Определение балансировки окислительно-восстановительных реакций
Чтобы сбалансировать уравнение окислительно-восстановительной реакции
Выполните следующие шаги. Поначалу это может показаться немного сложным, но вам поможет пример ниже на странице:- Напишите полууравнения несбалансированного окисления и восстановления.
- Сбалансируйте каждую половину уравнения.
- Сбалансируйте окисляемые и восстанавливаемые элементы, игнорируя H и O на этом этапе.

- Сбалансируйте атомы O добавлением H 2 O.
- Затем сбалансируйте H одним из следующих способов:
- с добавлением H + (для кислых растворов) или
- с добавлением OH — (для основных растворов).
- Сбалансируйте заряд в левой и правой частях каждого полууравнения, добавляя электроны, если это необходимо.
- Умножьте половинные уравнения на соответствующие коэффициенты так, чтобы каждое из них включало передачу одинакового количества электронов.
- Объедините половинные реакции, чтобы исключить электроны из общей реакции.
Пример
Вот окислительно-восстановительная реакция в растворе кислоты, которую мы собираемся сбалансировать:
Fe 2+ (AQ) + MNO 4
2 — (AQ) → FE 3+ + MN 2+ + MN 2+
(AQ) Шаг A
Напишите неуравновешенные полууравнения:
Fe 2+ (водн. ) → Fe 3+ (водн.) (окисление)
) → Fe 3+ (водн.) (окисление)
MnO 4 — (водн.) → Mn 2+ (водн.) (восстановление)
Этап B
Сбалансируйте каждую половину реакции.
Железная полуреакция: Чтобы сбалансировать это уравнение, нам просто нужно добавить электрон в правую часть уравнения.
Fe 2+ (водн.) → Fe 3+ (водн.) ) + e —
Перманганат Половина Реакция: Мы левый.
MnO 4 — (водн.) → Mn 2+ (водн.) + 4H 2 O
Затем, чтобы сбалансировать восемь атомов водорода в воде, мы добавляем слева 8H + (водн.) .
MnO 4 — (водн.) + 8H + (водн.) → Mn 2+ (водн.) 90 290 +
Теперь, глядя на приведенное выше уравнение, мы видим, что заряды не сбалансированы слева и справа. Общий заряд слева +7, справа +2.
Чтобы сбалансировать заряд, нам нужно добавить пять электронов в левую часть уравнения.
Общий заряд слева +7, справа +2.
Чтобы сбалансировать заряд, нам нужно добавить пять электронов в левую часть уравнения.
MNO 4 MNO 4 — (AQ) + 8H + (AQ) + 5E — → MN 2+
Шаг C
Умножьте полууравнения на соответствующие числа, чтобы каждое из них содержало одинаковое количество свободных электронов с каждой стороны.В этом случае мы должны умножить реакцию железа на 5.
Этап D
Добавьте полуреакции. Электроны на каждой стороне компенсируются, что дает общую реакцию:
5FE 2+ (AQ) + MNO 4 — (AQ) + 8H + (AQ) → 5fe 3+ (AQ) ) + MN 2+ (водный) + 4H 2 O
13.2 Написание окислительно-восстановительных и полуреакций | Электрохимические реакции
ионы перманганата(VII) ( \(\text{MnO}_{4}^{-}\)) окисляются
перекись водорода ( \(\text{H}_{2}\text{O}_{2}\)) до
кислородный газ. {2+}(\text{aq}) +
8\текст{Н}_{2}\текст{О}(\текст{ℓ})\)
{2+}(\text{aq}) +
8\текст{Н}_{2}\текст{О}(\текст{ℓ})\)
Как уравновесить окислительно-восстановительные реакции в основном растворе?
ВНИМАНИЕ — это длинный ответ.
В основном растворе вы уравновешиваете окислительно-восстановительные уравнения так, как если бы они были в кислоте. В конце вы используете OH⁻ для преобразования в основу.
ПРИМЕР :
Сбалансируйте следующее уравнение в основном растворе:
MnO₄⁻ + CN⁻ → MnO₂ + CNO⁻
Решение :
Шаг 1: Разделите уравнение на две полуреакции.
MnO₄⁻ → MnO₂
CN⁻ → CNO⁻
Шаг 2: Сбалансируйте все атомы, кроме H и O.
Выполнено
Шаг 3: Сбалансируйте O, добавив H₂O к дефицитной стороне.
MnO₄⁻ → MnO₂+ 2H₂O
CN⁻+ H₂O → CNO⁻
Шаг 4: Сбалансируйте H, добавив H⁺ к недостающей стороне.
MnO₄⁻+ 4H⁺ → MnO₂+ 2H₂O
CN⁻+ H₂O → CNO⁻ + 2H⁺
Шаг 5: Сбалансируйте заряд, добавив электроны к более положительной стороне.
MnO₄⁻+ 4H⁺ + 3e⁻ → MnO₂+ 2H₂O
CN⁻+ H₂O → CNO⁻ + 2H⁺ + 2e⁻
Шаг 6: Умножьте каждую полуреакцию на коэффициент, который дает наименьшее общее кратное переданных электронов.
В этом случае наименьшее общее кратное 3 и 2 равно 6.
Умножаем первую полуреакцию на 2, а вторую полуреакцию на 3.
2 × [MnO₄⁻+ 4H⁺ + 3e⁻ → MnO2+ 2H₂O]
3 × [CN⁻+ H2O → CNO⁻ + 2H⁺ + 2e⁻]
Шаг 7: Сложите две полуреакции, отменив одинаковые члены.
2MnO₄⁻+ 3CN⁻+ 2H⁺ → 2MnO₂ + 3CNO⁻ + H₂O
Это сбалансированное уравнение в растворе кислоты . Теперь мы должны преобразовать решение в base .
Шаг 8: Добавьте достаточно кратных уравнений H⁺ + OH⁻ → H₂O или
H₂O → H⁺ + OH⁻, чтобы исключить H⁺ в окислительно-восстановительном уравнении, сокращая аналогичные члены.
2MnO₄⁻+ 3CN⁻+ 2H⁺ → 2MnO₂ + 3CNO⁻ + H₂O
2H₂O → 2H⁺ + 2OH⁻
2MnO₄⁻+ 3CN⁻+ H₂O → 2MnO₂ + 3CNO⁻ + 2OH⁻
Шаг 9: Проверьте баланс атомов.
Слева: 2 Мн; 9 О; 3 С; 3 Н; 2 Н
Справа: 2 Мн; 9 О; 3 С; 3 Н; 2 ч
Шаг 10: Проверьте баланс средств.
Слева: 2- + 3- = 5-
Справа: 3- + 2- = 5-
Сбалансированное уравнение:
2MnO₄⁻+ 3CN⁻+ H₂O → 2MnO₂ + 3CNO⁻ + 2OH⁻
Уравновешивание окислительно-восстановительных реакций
14.2 Балансировка окислительно-восстановительных реакций
Цели обучения
- Научитесь уравновешивать простые окислительно-восстановительные реакции путем осмотра.
- Научитесь уравновешивать сложные окислительно-восстановительные реакции методом половинной реакции.
- Используйте растворитель или его части в качестве реагента или продукта для уравновешивания окислительно-восстановительной реакции.
Уравновешивание простых окислительно-восстановительных реакций может заключаться в простом переключении между продуктами и реагентами.Например, в окислительно-восстановительной реакции Na и Cl 2 :
Na + Cl 2 → NaCl сразу должно быть ясно, что атомы Cl не уравновешены. Мы можем исправить это, поставив перед произведением коэффициент 2:
Мы можем исправить это, поставив перед произведением коэффициент 2:
Однако теперь натрий несбалансирован. Это можно исправить, включив коэффициент 2 перед реагентом Na:
. 2Na + Cl 2 → 2NaClТеперь эта реакция уравновешена.Это было довольно просто; мы говорим, что можем уравновесить реакцию проверкой . Многие простые окислительно-восстановительные реакции можно сбалансировать путем проверки.
Пример 3
Сбалансируйте эту окислительно-восстановительную реакцию осмотром.
SO 2 + O 2 → SO 3Решение
В обеих частях уравнения есть по одному атому серы, поэтому сера уравновешена. Однако сторона реагента имеет четыре атома O, а сторона продукта — три.Очевидно, что нам нужно больше атомов O на стороне продукта, поэтому давайте начнем с включения коэффициента 2 в SO 3 :
. SO 2 + O 2 → 2SO 3
SO 2 + O 2 → 2SO 3 Теперь это дает нам шесть атомов O на стороне продукта, а также дисбаланс атомов S. Мы можем сбалансировать оба элемента, добавив коэффициент 2 к SO 2 на стороне реагента:
2SO 2 + O 2 → 2SO 3Это дает нам два атома S с обеих сторон и всего шесть атомов O с обеих сторон химического уравнения.Эта окислительно-восстановительная реакция теперь уравновешена.
Проверь себя
Сбалансируйте эту окислительно-восстановительную реакцию осмотром.
Al + O 2 → Al 2 O 3Ответить
4Al + 3O 2 → 2Al 2 O 3
Первое, что вы должны сделать, столкнувшись с несбалансированной окислительно-восстановительной реакцией, это попытаться сбалансировать ее путем проверки.
Некоторые окислительно-восстановительные реакции нелегко сбалансировать путем проверки. Рассмотрим эту окислительно-восстановительную реакцию:
Рассмотрим эту окислительно-восстановительную реакцию:
На первый взгляд это уравнение кажется сбалансированным: с обеих сторон имеется по одному атому Ag и по одному атому Al с обеих сторон. Однако, если вы посмотрите на общий заряд с каждой стороны, вы увидите дисбаланс заряда: на стороне реагента общий заряд 1+, а на стороне продукта общий заряд 3+. Что-то не так с этим химическим уравнением; несмотря на равное количество атомов с каждой стороны, он не уравновешен.
Фундаментальным моментом в отношении окислительно-восстановительных реакций, который ранее не возникал, является то, что общее число потерянных электронов должно равняться общему числу приобретаемых электронов , чтобы окислительно-восстановительная реакция была сбалансированной. Это не относится к реакции алюминия и серебра: атом Al теряет три электрона, чтобы стать ионом Al 3+ , в то время как ион Ag + получает только один электрон, чтобы стать элементарным серебром.
Чтобы сбалансировать это, мы запишем каждую реакцию окисления и восстановления отдельно, указав количество электронов в каждой из них.По отдельности реакции окисления и восстановления называются половинными реакциями. Отдельная реакция окисления или восстановления окислительно-восстановительной реакции. Затем мы будем брать кратные каждой реакции до тех пор, пока количество электронов на каждой стороне полностью не сократится, и объединять половинные реакции в общую реакцию, который затем должен быть уравновешен. Этот метод уравновешивания окислительно-восстановительных реакций называется методом половинных реакций. Метод уравновешивания окислительно-восстановительных реакций путем записи и уравновешивания отдельных полуреакций.. (Существуют и другие способы уравновешивания окислительно-восстановительных реакций, но это единственный, который будет использоваться в этом тексте. Причина этого будет рассмотрена в главе 14 «Окисление и восстановление», раздел 14.3 «Применение окислительно-восстановительных реакций: гальванические элементы». «.)
«.)
В полуреакции окисления участвует алюминий, который окисляется:
Al → Al 3+Эта полуреакция не полностью уравновешена, потому что общие заряды на каждой стороне не равны. Когда атом Al окисляется до Al 3+ , он теряет три электрона.Мы можем явно записать эти электроны как произведения:
Al → Al 3+ + 3e −Теперь эта полуреакция уравновешена — как по атомам, так и по зарядам.
В полуреакции восстановления участвует серебро:
Ag + → AgОбщий заряд не сбалансирован с обеих сторон. Но мы можем это исправить, добавив один электрон со стороны реагента, потому что ион Ag + должен принять один электрон, чтобы стать нейтральным атомом Ag:
Ag + + e − → AgЭта полуреакция теперь также уравновешена.
При объединении двух полуреакций в сбалансированное химическое уравнение ключевым является то, что общее количество электронов должно компенсировать , поэтому количество электронов, потерянных атомами, равно количеству электронов, полученных другими атомами. Для этого может потребоваться умножить одну или обе полуреакции на целое число, чтобы количество электронов с каждой стороны было равным. С тремя электронами в качестве продуктов и одним в качестве реагента наименьшее общее кратное этих двух чисел равно трем: мы можем использовать одну реакцию с алюминием, но должны взять в три раза больше реакции с серебром:
Для этого может потребоваться умножить одну или обе полуреакции на целое число, чтобы количество электронов с каждой стороны было равным. С тремя электронами в качестве продуктов и одним в качестве реагента наименьшее общее кратное этих двух чисел равно трем: мы можем использовать одну реакцию с алюминием, но должны взять в три раза больше реакции с серебром:
3 во второй реакции распространяется на все виды в реакции:
Al → Al 3+ + 3e − 3Ag + + 3e − → 3AgТеперь две полуреакции можно сложить так же, как два алгебраических уравнения, со стрелкой в качестве знака равенства.Одинаковые виды по разные стороны стрелки можно отменить:
Al + 3Ag++ 3e-→Al3++ 3Ag + 3e-Итоговая сбалансированная окислительно-восстановительная реакция выглядит следующим образом:
Al + 3Ag + → Al 3+ + 3Ag В каждой части химического уравнения по-прежнему есть только один атом Al, но теперь есть три атома Ag, а общий заряд в каждой части уравнения одинаков (3+ для обеих сторон). Эта окислительно-восстановительная реакция сбалансирована. Использование метода половинной реакции потребовало больше усилий, чем проверка, но была получена правильная сбалансированная окислительно-восстановительная реакция.
Эта окислительно-восстановительная реакция сбалансирована. Использование метода половинной реакции потребовало больше усилий, чем проверка, но была получена правильная сбалансированная окислительно-восстановительная реакция.
Пример 4
Сбалансируйте эту окислительно-восстановительную реакцию, используя метод полуреакции.
Fe 2+ + Cr → Fe + Cr 3+Решение
Начнем с записи двух полуреакций. Хром окисляется, а железо восстанавливается:
Cr → Cr 3+ окисление Fe 2+ → восстановление FeЗатем мы включаем соответствующее количество электронов с правильной стороны, чтобы сбалансировать заряды для каждой реакции:
Cr → Cr 3+ + 3e − Fe 2+ + 2e − → FeВ первой реакции участвуют три электрона, а во второй реакции участвуют два электрона.Наименьшее общее кратное этих двух чисел равно шести, поэтому, чтобы получить шесть электронов в каждой реакции, нам нужно удвоить первую реакцию и утроить вторую:
. 2 × [Cr → Cr 3+ + 3e − ] = 2Cr → 2Cr 3+ + 6e − 3 × [Fe 2+ + 2e — → Fe] = 3Fe 2+ + 6e — → 3Fe
2 × [Cr → Cr 3+ + 3e − ] = 2Cr → 2Cr 3+ + 6e − 3 × [Fe 2+ + 2e — → Fe] = 3Fe 2+ + 6e — → 3FeМы можем объединить две последние реакции, заметив, что электроны сокращаются:
2Cr + 3Fe2++ 6e−→2Cr3++ 3Fe + 6e−Общая сбалансированная окислительно-восстановительная реакция
2Cr + 3Fe 2+ → 2Cr 3+ + 3FeПроверь себя
Сбалансируйте эту окислительно-восстановительную реакцию, используя метод полуреакции.
O 2− + F 2 → O 2 + F −Ответить
2O 2− + 2F 2 → O 2 + 4F −
Многие окислительно-восстановительные реакции протекают в водном растворе — в воде. Благодаря этому во многих случаях H 2 O или фрагмент молекулы H 2 O (в частности, H + или OH − ) могут участвовать в окислительно-восстановительной реакции. Таким образом, нам нужно научиться включать растворитель в сбалансированное окислительно-восстановительное уравнение.
Таким образом, нам нужно научиться включать растворитель в сбалансированное окислительно-восстановительное уравнение.
Рассмотрим следующую полуреакцию окисления в водном растворе, который имеет по одному атому Cr с каждой стороны:
Cr 3+ → CrO 4 −Здесь атом Cr переходит из степени окисления +3 в +7. Для этого атом Cr должен потерять четыре электрона. Начнем с перечисления четырех электронов как произведений:
. Cr 3+ → CrO 4 − + 4e −Но откуда берутся атомы О? Они происходят из молекул воды или общего фрагмента молекулы воды, содержащего атом О: ион ОН — .Когда мы уравновешиваем эту полуреакцию, мы должны свободно включать любой из этих видов в реакцию, чтобы сбалансировать элементы. Давайте использовать H 2 O для баланса атомов O; нам нужно включить четыре молекулы воды, чтобы сбалансировать четыре атома O в продуктах:
4H 2 O + Cr 3+ → CrO 4 − + 4e − Это уравновешивает атомы O, но теперь в реакцию вводится водород. Мы можем сбалансировать атомы H, добавив ион H + , который является еще одним фрагментом молекулы воды.Нам нужно добавить восемь ионов H + на сторону продукта:
Мы можем сбалансировать атомы H, добавив ион H + , который является еще одним фрагментом молекулы воды.Нам нужно добавить восемь ионов H + на сторону продукта:
Сбалансированы атомы Cr, сбалансированы атомы O и сбалансированы атомы H; если мы проверим общий заряд с обеих сторон химического уравнения, они будут одинаковыми (в данном случае 3+). Эта полуреакция теперь уравновешена, используя молекулы воды и части молекул воды в качестве реагентов и продуктов.
Реакции восстановления можно уравновесить аналогичным образом. Когда полуреакции окисления и восстановления уравновешены по отдельности, их можно комбинировать так же, как и раньше: взяв кратное количество каждой полуреакции, необходимое для компенсации всех электронов. Другие разновидности, такие как H + , OH — и H 2 O , также могут быть исключены в окончательной сбалансированной реакции.
Если не указано иное, не имеет значения, добавляете ли вы H 2 O или OH − в качестве источника атомов O, хотя реакция может указывать кислый раствор или щелочной раствор в качестве намека на то, какие виды следует использовать. использовать или какие виды следует избегать.Ионы OH — не очень распространены в кислых растворах, поэтому их следует избегать в таких обстоятельствах.
Пример 5
Сбалансируйте эту окислительно-восстановительную реакцию. Предположим базовое решение.
MnO 2 + CrO 3 − → Mn + CrO 4 −Решение
Мы начинаем с разделения процессов окисления и восстановления, чтобы мы могли сбалансировать каждую полуреакцию отдельно. Реакция окисления выглядит следующим образом:
CrO 3 − → CrO 4 − Атом Cr переходит из степени окисления +5 в +7 и теряет при этом два электрона. Мы добавляем эти два электрона к продукту:
Мы добавляем эти два электрона к продукту:
Теперь мы должны сбалансировать атомы O. Поскольку раствор является основным, мы должны использовать OH − , а не H 2 O:
. OH − + CrO 3 − → CrO 4 − + 2e −Мы ввели атомы H в составе реагентов; мы можем сбалансировать их, добавив H + в качестве продуктов:
OH − + CrO 3 − → CrO 4 − + 2e − + H +Если мы проверим атомы и общий заряд с обеих сторон, мы увидим, что эта реакция сбалансирована.Однако, если реакция протекает в щелочном растворе, маловероятно, что ионы Н + будут присутствовать в количестве. Способ решить эту проблему состоит в том, чтобы добавить дополнительный ион OH − к каждой стороне уравнения:
OH − + CrO 3 − + OH − → CrO 4 − + 2e − + H + + Два иона OH — слева можно сгруппировать как 2OH — . С правой стороны ионы H + и OH − можно сгруппировать в молекулу H 2 O:
С правой стороны ионы H + и OH − можно сгруппировать в молекулу H 2 O:
Это более подходящая форма для базового раствора.
Теперь уравновешиваем реакцию восстановления:
MnO 2 → MnСтепень окисления атома Mn меняется с +4 до 0, что требует прироста четырех электронов:
4e − + MnO 2 → MnЗатем мы уравновешиваем атомы O, а затем атомы H:
4e − + MnO 2 → Mn + 2OH − 2H + + 4e − + MnO 2 → Mn + 2OH −Добавляем по два иона OH − с каждой стороны, чтобы удалить ион H + из реагентов; реагенты объединяются, образуя две молекулы воды, а количество ионов ОН — в продукте увеличивается до четырех:
2H 2 O + 4e − + MnO 2 → Mn + 4OH − Эта реакция сбалансирована для основного раствора.
Теперь объединим две уравновешенные полуреакции. В реакции окисления два электрона, в реакции восстановления четыре. Наименьшее общее кратное этих двух чисел равно четырем, поэтому умножаем реакцию окисления на 2, чтобы электроны были сбалансированы:
2 × [2OH − + CrO 3 − → CrO 4 − + 2e − + H 2 O] 2H 2 O + 4e − + MnO 2 → Mn + 4OH −Объединение этих двух уравнений приводит к следующему уравнению:
4OH — + 2 CRO 3 — + 2H 2 O + 4E 2 + MNO 2 → 2 CRO 4 — + 4E — + 2H 2 O + MN + 4ОН —Четыре электрона компенсируются.То же самое делают две молекулы H 2 O и четыре иона OH − . Остается
2CrO 3 − + MnO 2 → 2CrO 4 − + Mn, который является нашей последней сбалансированной окислительно-восстановительной реакцией.
Проверь себя
Сбалансируйте эту окислительно-восстановительную реакцию. Предположим базовое решение.
Cl − + MnO 4 − → MnO 2 + ClO 3 −Ответить
H 2 O + Cl − + 2MnO 4 − → 2MnO 2 + ClO 3 − + 2OH
Ключевые выводы
- Окислительно-восстановительные реакции могут быть уравновешены путем проверки или методом полуреакции.
- Растворитель может участвовать в окислительно-восстановительных реакциях; в водных растворах H 2 O, H + и OH — могут быть реагентами или продуктами.
Упражнения
Сбалансируйте эти окислительно-восстановительные реакции путем проверки.

- Na + F 2 → NaF
- Al 2 O 3 + H 2 → Al + H 2 O
Сбалансируйте эти окислительно-восстановительные реакции путем проверки.
- Fe 2 S 3 + O 2 → Fe 2 O 3 + S
- Cu 2 O + H 2 → Cu + H 2 O
Сбалансируйте эти окислительно-восстановительные реакции путем проверки.
- CH 4 + O 2 → CO 2 + H 2 O
- P 2 O 5 + Cl 2 → PCl 3 + O 2
Сбалансируйте эти окислительно-восстановительные реакции путем проверки.

- PbCl 2 + FeCl 3 → PbCl 4 + FeCl 2
- SO 2 + F 2 → SF 4 + OF 2
Сбалансируйте эти окислительно-восстановительные реакции методом половинной реакции.
- Ca + H + → Ca 2+ + H 2
- Sn 2+ → Sn + Sn 4+ (Подсказка: обе полуреакции начнутся с одним и тем же реагентом.)
Сбалансируйте эти окислительно-восстановительные реакции методом половинной реакции.
- Fe 3+ + Sn 2+ → Fe + Sn 4+
- Pb 2+ → Pb + Pb 4+ (Подсказка: обе полуреакции начнутся с одним и тем же реагентом.
 )
)
Сбалансируйте эти окислительно-восстановительные реакции методом половинной реакции.
- Na + Hg 2 Cl 2 → NaCl + Hg
- Al 2 O 3 + C → Al + CO 2
Сбалансируйте эти окислительно-восстановительные реакции методом половинной реакции.
- Br − + I 2 → I − + Br 2
- CrCl 3 + F 2 → CrF 3 + Cl 2
Сбалансируйте эти окислительно-восстановительные реакции, происходящие в водном растворе.
 Используйте любые виды, полученные из воды, которые необходимы; может быть более одного правильного сбалансированного уравнения.
Используйте любые виды, полученные из воды, которые необходимы; может быть более одного правильного сбалансированного уравнения.- Cu + NO 3 − → Cu 2+ + NO 2
- Fe + MnO 4 − → Fe 3+ + Mn
Сбалансируйте эти окислительно-восстановительные реакции, происходящие в водном растворе.Используйте любые виды, полученные из воды, которые необходимы; может быть более одного правильного сбалансированного уравнения.
- CrO 3 + Ni 2+ → Cr 3+ + Ni 3+
- OsO 4 + C 2 H 4 → Os + CO 2
Сбалансируйте эти окислительно-восстановительные реакции, происходящие в водном растворе.
 Используйте любые виды, полученные из воды, которые необходимы; может быть более одного правильного сбалансированного уравнения.
Используйте любые виды, полученные из воды, которые необходимы; может быть более одного правильного сбалансированного уравнения.- ClO − + Ti 2+ → Ti 4+ + Cl −
- BrO 3 − + Ag → Ag + + BrO 2
Сбалансируйте эти окислительно-восстановительные реакции, происходящие в водном растворе.Используйте любые виды, полученные из воды, которые необходимы; может быть более одного правильного сбалансированного уравнения.
- H 2 O 2 + NO → N 2 O 3 + H 2 O
- VO 2 + + НО → V 3+ + НО 2
Объясните, почему это химическое уравнение не сбалансировано, и сбалансируйте его, если его можно сбалансировать.
Cr 2+ + Cl 2 → Cr 3+ + 2Cl −
Объясните, почему это уравнение не сбалансировано, и сбалансируйте его, если его можно сбалансировать.
O 2 + 2H 2 O + Br 2 → 4OH — + 2Br —
Ответы
- 2Na + F 2 → 2NaF
- Al 2 O 3 + 3H 2 → 2Al + 3H 2 O
- CH 4 + 2O 2 → CO 2 + 2H 2 O
- 2P 2 O 5 + 6Cl 2 → 4PCl 3 + 5O 2
- Ca + 2H + → Ca 2+ + H 2
- 2Sn 2+ → Sn + Sn 4+
- 2Na + Hg 2 Cl 2 → 2NaCl + 2Hg
- 2Al 2 O 3 + 3C → 4Al + 3CO 2
- 4H + + Cu + 2NO 3 − → Cu 2+ + 2NO 2 + 2H 2 O в кислом растворе; 2H 2 O + Cu + 2NO 3 − → Cu 2+ + 2NO 2 + 4OH − в основном растворе
- 24H + + 3MnO 4 − + 7Fe → 7Fe 3+ + 3Mn + 12H 2 O в кислом растворе; 12H 2 O + 3MnO 4 − + 7Fe → 7Fe 3+ + 3Mn + 24OH − в основном растворе
- 2H + + ClO − + Ti 2+ → Cl − + H 2 O + Ti 4+ в кислом растворе; H 2 O + ClO − + Ti 2+ → Cl − + Ti 4+ + 2OH − в основном растворе
- 2H + + BrO 3 − + Ag → BrO 2 + H 2 O + Ag + в кислом растворе; H 2 O + BrO 3 − + Ag → BrO 2 + Ag + + 2OH − в основном растворе
Заряды не сбалансированы должным образом.
 Правильное сбалансированное уравнение: 2Cr 2+ + Cl 2 → 2Cr 3+ + 2Cl − .
Правильное сбалансированное уравнение: 2Cr 2+ + Cl 2 → 2Cr 3+ + 2Cl − .
17.1 Обзор Redox Chemistry – Химия 2e
Цели обучения
К концу этого раздела вы сможете:
- Описать определяющие черты окислительно-восстановительной химии
- Определите окислитель и восстановитель окислительно-восстановительной реакции
- Баланс химических уравнений для окислительно-восстановительных реакций методом полуреакций
Поскольку реакции, связанные с переносом электрона, важны для темы электрохимии, здесь представлен краткий обзор окислительно-восстановительной химии, который обобщает и расширяет содержание предыдущей текстовой главы (см. главу о стехиометрии реакций).Читатели, желающие получить дополнительный обзор, могут обратиться к текстовой главе, посвященной стехиометрии реакции.
Номера окисления
По определению, окислительно-восстановительная реакция — это реакция, которая влечет за собой изменения степени окисления (или степени окисления ) для одного или нескольких участвующих элементов. Степень окисления элемента в соединении, по сути, является оценкой того, насколько электронное окружение его атомов отличается от атомов чистого элемента. По этому описанию степень окисления атома в элементе равна нулю .Для атома в соединении степень окисления равна заряду, который атом имел бы в соединении, если бы соединение было ионным . В соответствии с этими правилами сумма степеней окисления для всех атомов в молекуле равна заряду молекулы . Чтобы проиллюстрировать этот формализм, будут рассмотрены примеры из двух классов соединений, ионных и ковалентных.
Простые ионные соединения представляют собой простейшие примеры, иллюстрирующие этот формализм, поскольку по определению степени окисления элементов численно эквивалентны зарядам ионов. Хлорид натрия, NaCl, состоит из катионов Na + и анионов Cl — , поэтому степени окисления натрия и хлора равны +1 и -1 соответственно. Фторид кальция, CaF 2 , состоит из катионов Ca 2+ и анионов F — , поэтому степени окисления кальция и фтора равны +2 и -1 соответственно.
Хлорид натрия, NaCl, состоит из катионов Na + и анионов Cl — , поэтому степени окисления натрия и хлора равны +1 и -1 соответственно. Фторид кальция, CaF 2 , состоит из катионов Ca 2+ и анионов F — , поэтому степени окисления кальция и фтора равны +2 и -1 соответственно.
Ковалентные соединения требуют более сложного использования формализма. Вода представляет собой ковалентное соединение, молекулы которого состоят из двух атомов Н, связанных отдельно с центральным атомом О через полярные ковалентные связи О-Н.Общие электроны, составляющие связь O-H, сильнее притягиваются к более электроотрицательному атому O, и поэтому он приобретает частичный отрицательный заряд в молекуле воды (относительно атома O в элементарном кислороде). Следовательно, атомы H в молекуле воды обладают частичными положительными зарядами по сравнению с атомами H в элементарном водороде. Сумма частичных отрицательных и частичных положительных зарядов каждой молекулы воды равна нулю, и молекула воды нейтральна.
Представьте себе, что поляризация общих электронов в связях O-H воды завершена на 100 % — результатом будет перенос электронов от H к O, а вода будет ионным соединением, состоящим из O 2− анионов. катионы H + .Итак, степени окисления кислорода и водорода в воде равны -2 и +1 соответственно. Применяя ту же логику к четыреххлористому углероду, CCl 4 , мы получаем степень окисления +4 для углерода и -1 для хлора. В нитрат-ионе NO3-NO3- степень окисления азота равна +5, а кислорода -2, что в сумме дает заряд 1- на молекуле:
(1Натом)(+5Натом)+(3Оатом)(-2Оатом)=+5+-6=-1(1Натом)(+5Натом)+(3Оатом)(-2Оатом)=+5+-6=-1Балансировка окислительно-восстановительных уравнений
Приведенное ниже несбалансированное уравнение описывает разложение расплавленного хлорида натрия:
NaCl(ж)⟶Na(ж)+Cl2(г)несбалансированныйNaCl(ж)⟶Na(ж)+Cl2(г)несбалансированный Эта реакция удовлетворяет критерию окислительно-восстановительной классификации, поскольку степень окисления Na уменьшается с +1 до 0 (он подвергается восстановлению ), а Cl увеличивается с -1 до 0 (он подвергается окислению ). Уравнение в этом случае легко уравновешивается проверкой, требуя стехиометрических коэффициентов 2 для NaCl и Na:
Уравнение в этом случае легко уравновешивается проверкой, требуя стехиометрических коэффициентов 2 для NaCl и Na:
Окислительно-восстановительные реакции, которые происходят в водных растворах, обычно встречаются в электрохимии, и многие из них включают воду или ее характерные ионы, H + ( aq ) и OH — ( aq ), в качестве реагентов или продуктов. В этих случаях уравнения, представляющие окислительно-восстановительную реакцию, может быть очень сложно сбалансировать путем проверки, и полезно использовать систематический подход, называемый методом полуреакции .Этот подход включает следующие шаги:
- Напишите скелетные уравнения для полуреакций окисления и восстановления.
- Сбалансируйте каждую полуреакцию для всех элементов, кроме H и O.
- Сбалансируйте каждую полуреакцию для O, добавив H 2 O.

- Уравновесьте каждую полуреакцию для H, добавив H + .
- Сбалансируйте заряд каждой полуреакции добавлением электронов.
- Если необходимо, умножьте одну или обе полуреакции так, чтобы количество электронов, израсходованных в одной, было равно количеству электронов, образовавшихся в другой.
- Сложите две полуреакции и упростите.
- Если реакция протекает в щелочной среде, добавьте ионы OH − к уравнению, полученному на шаге 7, чтобы нейтрализовать ионы H + (добавьте равные количества к обеим частям уравнения) и упростите.
Приведенные ниже примеры демонстрируют применение этого метода к уравновешиванию уравнений для окислительно-восстановительных реакций в воде.
Пример 17.1
Уравнения баланса для окислительно-восстановительных реакций в кислых растворах
Напишите сбалансированное уравнение, представляющее реакцию между твердой медью и азотной кислотой с образованием водного раствора ионов меди (II) и газообразного монооксида азота.
Решение
Следуя шагам метода полуреакции:- Напишите скелетные уравнения для полуреакций окисления и восстановления.
окисление: Cu(s)⟶Cu2+(водн.)окисление:Cu(s)⟶Cu2+(водн.)
восстановление:HNO3(водн.)⟶NO(г)восстановление:HNO3(водн.)⟶NO(г) - Сбалансируйте каждую полуреакцию для всех элементов, кроме H и O.
окисление: Cu(s)⟶Cu2+(водн.)окисление:Cu(s)⟶Cu2+(водн.)
восстановление:HNO3(водн.)⟶NO(г)восстановление:HNO3(водн.)⟶NO(г) - Сбалансируйте каждую полуреакцию для O, добавив H 2 O.
окисление: Cu(s)⟶Cu2+(водн.)окисление:Cu(s)⟶Cu2+(водн.)
восстановление:HNO3(водн.)⟶NO(г)+2h3O(л)восстановление:HNO3(водн.)⟶NO(г)+2h3O(ж) - Уравновесьте каждую полуреакцию для H, добавив H + .
окисление: Cu(s)⟶Cu2+(водн.)окисление:Cu(s)⟶Cu2+(водн. )
)
восстановление: 3H+(водн.)+HNO3(водн.)⟶NO(г)+2h3O(л)восстановление:3H+(водн.)+HNO3(водн.)⟶NO(г)+2h3O(ж) - Уравновешивайте каждую полуреакцию для получения заряда, добавляя электроны.
окисление: Cu(s)⟶Cu2+(водн.)+2e-окисление: Cu(s)⟶Cu2+(водн.)+2e-
восстановление:3e-+3H+(водн.)+HNO3(водн.)⟶NO(г)+2h3O(л)восстановление:3e-+3H+(водн.)+HNO3(водн.)⟶NO(г)+2h3O(ж) - При необходимости умножьте одну или обе полуреакции так, чтобы количество электронов, израсходованных в одной, было равно количеству электронов, образовавшихся в другой.
окисление (×3):3Cu(т)⟶3Cu2+(водн.)+62e−окисление (×3):3Cu(т)⟶3Cu2+(водн.)+62e−
восстановление (×2):63e-+63H+(водн.)+2HNO3(водн.)⟶2NO(г)+42h3O(л)восстановление (×2):63e-+63H+(водн.)+2HNO3(водн.)⟶2NO(г )+42х3О(л) - Сложите две полуреакции и упростите.
3Cu(т)+6e-+6H+(водн.)+2HNO3(водн.)⟶3Cu2+(водн.)+6e-+2NO(г)+4h3O(ж)3Cu(тв. )+6e-+6H+(водн.)+2HNO3( водный)⟶3Cu2+(водный)+6e−+2NO(г)+4h3O(ж)
)+6e-+6H+(водн.)+2HNO3( водный)⟶3Cu2+(водный)+6e−+2NO(г)+4h3O(ж)
3Cu(т)+6H+(водн.)+2HNO3(водн.)⟶3Cu2+(водн.)+2NO(г)+4h3O(ж)3Cu(т)+6H+(водн.)+2HNO3(водн.)⟶3Cu2+(водн.)+2NO (г)+4х3О(л) - Если реакция протекает в щелочной среде, добавьте ионы OH − к уравнению, полученному на шаге 7, чтобы нейтрализовать ионы H + (добавьте равные количества к обеим частям уравнения) и упростите.
Этот шаг необязателен, так как раствор должен быть кислым.
Сбалансированное уравнение реакции в кислом растворе будет тогда
3Cu(т)+6H+(водн.)+2HNO3(водн.)⟶3Cu2+(водн.)+2NO(г)+4h3O(ж)3Cu(т)+6H+(водн.)+2HNO3(водн.)⟶3Cu2+(водн.)+2NO (г)+4ч3О(л)Проверьте свои знания
Вышеуказанная реакция происходит при использовании относительно разбавленной азотной кислоты. При использовании концентрированной азотной кислоты вместо монооксида азота образуется диоксид азота. Напишите сбалансированное уравнение этой реакции.
Отвечать:
Cu(т)+2H+(водн.)+2HNO3(водн.)⟶Cu2+(водн.)+2NO2(г)+2h3O(л)Cu(тв.)+2H+(водн.)+2HNO3(водн.)⟶Cu2+(водн.)+ 2NO2(г)+2h3O(ж)
Пример 17.2
Уравнения баланса для окислительно-восстановительных реакций в основных растворах
Напишите сбалансированное уравнение, описывающее реакцию между водным ионом перманганата, MnO4-MnO4-, и твердым гидроксидом хрома (III), Cr(OH) 3 , с образованием твердого оксида марганца (IV), MnO 2 , и водным ионом хромата , CrO42-CrO42- Реакция протекает в основном растворе.Решение
Следуя шагам метода полуреакции:- Напишите скелетные уравнения для полуреакций окисления и восстановления.
окисление: Cr(OH)3(т)⟶CrO42-(водн.)окисление:Cr(OH)3(т)⟶CrO42-(водн.)
восстановление: MnO4-(водн.)⟶MnO2(т)восстановление:MnO4-(водн.)⟶MnO2(тв) - Сбалансируйте каждую полуреакцию для всех элементов, кроме H и O.

окисление: Cr(OH)3(т)⟶CrO42-(водн.)окисление:Cr(OH)3(т)⟶CrO42-(водн.)
восстановление: MnO4-(водн.)⟶MnO2(т)восстановление:MnO4-(водн.)⟶MnO2(тв) - Сбалансируйте каждую полуреакцию для O, добавив H 2 O.
окисление: h3O(ж)+Cr(OH)3(т)⟶CrO42-(водн.)окисление:h3O(ж)+Cr(OH)3(т)⟶CrO42-(водн.)
восстановление: MnO4-(водн.)⟶MnO2(т)+2h3O(ж) восстановление: MnO4-(водн.)⟶MnO2(т)+2h3O(ж) - Уравновесьте каждую полуреакцию для H, добавив H + .
окисление: h3O(ж)+Cr(OH)3(т)⟶CrO42-(водн.)+5H+(водн.)окисление: h3O(ж)+Cr(OH)3(т)⟶CrO42-(водн.)+5H+( вк)
восстановление: 4H+(водн.)+MnO4-(водн.)⟶MnO2(т)+2h3O(ж)восстановление:4H+(водн.)+MnO4-(водн.)⟶MnO2(т)+2h3O(ж) - Уравновешивайте каждую полуреакцию для получения заряда, добавляя электроны.
окисление: h3O(ж)+Cr(OH)3(т)⟶CrO42-(водн.)+5H+(водн.)+3e-окисление: h3O(ж)+Cr(OH)3(т)⟶CrO42-(водн. ) +5H+(водн.)+3e-
) +5H+(водн.)+3e-
восстановление: 3e-+4H+(водн.)+MnO4-(водн.)⟶MnO2(т)+2h3O(л) восстановление: 3e-+4H+(водн.)+MnO4-(водн.)⟶MnO2(тв)+2h3O(ж) - При необходимости умножьте одну или обе полуреакции так, чтобы количество электронов, израсходованных в одной, было равно количеству электронов, образовавшихся в другой.
В этом шаге нет необходимости, так как количество электронов уже уравновешено. - Сложите две полуреакции и упростите.
h3O(ж)+Cr(OH)3(т)+3e-+4H+(водн.)+MnO4-(водн.)⟶CrO42-(водн.)+5H+(водн.)+3e-+MnO2(тв.)+2h3O(ж. )h3O(ж)+Cr(OH)3(т)+3e-+4H+(водн.)+MnO4-(водн.)⟶CrO42-(водн.)+5H+(водн.)+3e-+MnO2(тв.)+2h3O( л)
Cr(OH)3(т)+MnO4-(водн.)⟶CrO42-(водн.)+H+(водн.)+MnO2(т)+h3O(ж)Cr(OH)3(т)+MnO4-(водн.)⟶ CrO42−(водн.)+H+(водн.)+MnO2(т)+h3O(ж) - Если реакция протекает в щелочной среде, добавьте ионы OH − к уравнению, полученному на шаге 7, чтобы нейтрализовать ионы H + (добавьте равные количества к обеим частям уравнения) и упростите.

OH-(водн.)+Cr(OH)3(т)+MnO4-(водн.)⟶CrO42-(водн.)+H+(водн.)+OH-(водн.)+MnO2(т)+h3O(л)OH-( водн.)+Cr(OH)3(т)+MnO4-(водн.)⟶CrO42-(водн.)+H+(водн.)+OH-(водн.)+MnO2(тв.)+h3O(ж)
OH-(водн.)+Cr(OH)3(т)+MnO4-(водн.)⟶CrO42-(водн.)+MnO2(т)+2h3O(ж)OH-(водн.)+Cr(OH)3(т) +MnO4-(водн.)⟶CrO42-(водн.)+MnO2(т)+2h3O(ж)
Проверьте свои знания
Водный перманганат-ион также может быть восстановлен с использованием водного бромид-иона, Br — , продуктами этой реакции являются твердый оксид марганца (IV) и водный бромат-ион, BrO 3 — .Напишите уравнение этой реакции, протекающей в щелочной среде.Отвечать:
h3O(ж)+2MnO4-(водн.)+Br-(водн.)⟶2MnO2(т)+BrO3-(водн.)+2OH-(водн.)h3O(ж)+2MnO4-(водн.)+Br-(водн.) ⟶2MnO2(т)+BrO3-(водн.)+2OH-(водн.)
Балансировка окислительно-восстановительных уравнений с использованием ионно-электронного метода_CrackAP.com
Следующие шаги могут быть использованы для балансировки уравнений окисления-восстановления (окислительно-восстановительных) с помощью ионно-электронного метода (полуреакции). Хотя другие методы могут быть успешными, ни один из них не является столь успешным, как этот конкретный метод.Используемые в этом процессе полуреакции будут необходимы и при рассмотрении других электрохимических явлений; таким образом, полезность полуреакций выходит за рамки уравновешивания окислительно-восстановительных уравнений.
Хотя другие методы могут быть успешными, ни один из них не является столь успешным, как этот конкретный метод.Используемые в этом процессе полуреакции будут необходимы и при рассмотрении других электрохимических явлений; таким образом, полезность полуреакций выходит за рамки уравновешивания окислительно-восстановительных уравнений.
Основная идея этого метода состоит в том, чтобы разбить «сложное» уравнение на две части, называемые полуреакциями. Эти более простые части затем уравновешиваются по отдельности и рекомбинируются для получения сбалансированного общего уравнения. Разделение производится таким образом, что одна из полуреакций имеет дело только с окислительной частью окислительно-восстановительного процесса, тогда как другая касается только восстановительной части.Что связывает две половины вместе, так это тот факт, что общее количество электронов, потерянных в процессе окисления, ДОЛЖНО равняться общему количеству электронов, полученных в процессе восстановления (шаг 6).
Очень важно полностью по порядку выполнить каждый из перечисленных ниже шагов; не пытайтесь срезать путь. Существует множество модификаций этого метода. Например, модификация позволяет сбалансировать все реакции, как если бы они были в кислом растворе, с последующей стадией, когда это необходимо, для преобразования в основной раствор.Переход на модификацию до полного понимания этого метода очень часто приводит к путанице и неверному результату.
1. Присвойте номера окисления и начните полуреакции, одну для окисления и одну для восстановления
Начиная со следующего примера (фазы для простоты опущены):
CH 3 OH + Cr 2 O 7 2 − + H + → HCOOH + Cr 3 + + H
(Для многих реакций окисляемое вещество и восстанавливаемое вещество будут очевидны, поэтому этот шаг можно упростить.Однако на всякий случай сделайте хотя бы частичную проверку, чтобы подтвердить свои прогнозы. Примечание. Одно вещество может быть как окисленным, так и восстановленным; пусть вас не удивляет такая ситуация — это называется диспропорциональностью.)
Примечание. Одно вещество может быть как окисленным, так и восстановленным; пусть вас не удивляет такая ситуация — это называется диспропорциональностью.)
При необходимости просмотрите правила присвоения степеней окисления в главе «Основы». Эти числа используются только на этом шаге. Не заставляйте их выполнять шаг 5.
Начните полуреакции со всеми молекулами или ионами из чистой ионной формы реакции.Не возвращайтесь к молекулярной форме реакции или просто вырывайте атомы из соответствующих молекул или ионов. Таким образом, из приведенного выше примера начальные полуреакции должны быть:
CH 3 ОН → HCOOH
Cr 2 O 7 2 − → Cr 3 +
Углерод окисляется (C 2 − до C 2 + ), а хром восстанавливается (Cr 6 + до Cr 3 + + )Убедитесь, что вы получили одинаковые степени окисления для углерода и хрома (водород и кислород равны +1 и -2 соответственно).
2. Сбалансируйте все атомы, кроме кислорода и водорода 90–120.
(Во многих реакциях это делается на шаге 1; из-за этого многие люди забывают проверить этот шаг. Это очень распространенная причина, по которой люди получают неверный результат.)
В приведенном выше примере следует учитывать углерод (C) и хром (Cr).Углерод сбалансирован, поэтому в первой полуреакции не требуется никаких изменений. Хром необходимо сбалансировать, поэтому вторая полуреакция принимает вид:
.Cr 2 O 7 2 − → 2 Cr 3 +
Примечание: Чтобы правильно выполнить следующие два шага, необходимо знать, является ли раствор кислотным или щелочным. Основной раствор — это тот, о котором вам специально говорят, что он является основным, или тот, который содержит основание ОН — в любом месте реакции.Предположим, что все остальные растворы кислые (даже если кислоты нет).
3.
 Баланс атомов кислорода
Баланс атомов кислородаа. В кислых растворах добавить 1 H 2 O/O на сторону, нуждающуюся в кислороде
б. В базовых решениях добавьте 2 OH − для каждого кислорода, необходимого на стороне с дефицитом кислорода, плюс 1 H 2 O/O на противоположной стороне
Не забывайте, что в щелочной раствор нужно добавить две вещи (OH − и H 2 O).Также они должны быть добавлены к противоположным сторонам.
Пример кислоты:
кислота:
Cr 2 O 7 2 − → 2 Cr 3 +
становится:
Cr 2 O 7 2 − → > 2 Cr 3 + + 7 H 2 O
Пример базы:
база:
Cr 2 O 7 2 − → 2 CrO 2 −
становится:
3 H 2 O + Cr 2 O 7 2 − → 2 CrO 2 − + 6 OH − а. В кислых растворах добавить H + (водный) б. В базовых решениях добавьте 1 H 2 O/H, плюс 1 OH − /H на противоположной стороне Опять же, не забывайте, что в основные растворы необходимо добавить две вещи (OH − и H 2 O). В этом случае они все равно добавляются к противоположным сторонам, но с другим соотношением. Пример кислоты: кислота: Cr 2 O 7 2 − → 2 Cr 3 + + 7 H 2 O становится: 14 H + (водный) + Cr 2 O 7 2 − → 2 Cr 3 + + 7 H 2 9003 2 Пример базы: база: 6 OH − + C 2 H 5 OH → 2 CO 2 + 3 H 2 O становится: 6 OH − + 6 OH − + C 2 H 5 OH → 2 CO 2 + 3 H 2 O + 6 H 2 O Если основной шаг выполнен правильно, кислород должен оставаться сбалансированным. Электроны должны появиться на противоположных сторонах двух полуреакций. Они появятся слева для восстановления и справа для окисления. После добавления убедитесь, что вы проверили, чтобы общая сумма заряда на каждой стороне была одинаковой. Отсутствие осторожности на этом этапе является основной причиной неправильных ответов. Не забудьте использовать как коэффициенты, так и общие заряды ионов (не степени окисления из шага 1). Примеры: Кислота: 6 е — + 14 H + (AQ) + CR 2 O 7 2 — → 2 CR 3 2 +
+ 7 ч 2 o 4.
 Баланс атомов водорода
Баланс атомов водорода Это может быть использовано в качестве проверки на данном этапе.
Это может быть использовано в качестве проверки на данном этапе. 5. Уравновешивание зарядов путем добавления электронов 90–120
База: 6 О — + 6 ОН
2 — + C 2 H 5 OH → 2 CO 2 + 3 H 2 O + 6 H 2 O + 12 E —
6.
 Отрегулируйте полуреакции так, чтобы они обе имели одинаковое количество электронов 90–120.
Отрегулируйте полуреакции так, чтобы они обе имели одинаковое количество электронов 90–120.(Найдите наименьшее общее кратное и умножьте каждую из полуреакций на соответствующий коэффициент, чтобы получить это значение.Это ключевой шаг, так как количество потерянных электронов ДОЛЖНО равняться числу полученных.)
Пример:
Наименьшее общее кратное = 12
3 × (H 2 O + CH 3 OH → HCOOH + 4 H + (водн.) + 4 e — )
2 × (6 E — + 14 H + (AQ) + CR 2 O 7 2 — → 2 CR 3 + + 7 ч 2 o)
дача:
3 H 2 O + 3 CH 3 OH → 3 HCOOH + 12 H + (водн.) + 12 e −
12 E — + 28 H + (AQ) + 2 CR 2 O 7
2 2 — → 4 CR 3 + + 14 ч 2 o
7.
 Добавьте полуреакции и отмените
Добавьте полуреакции и отмените(Электроны должны компенсироваться.)
Пример (из шага 6):
12 E — + 3 H 2 O + 3 CH 3 OH + 28 H + (AQ) + 2 CR 2 O 7 2 — → 4 CR 3 + + 14 H 2 O + 3 HCOOH + 12 H + (водный) + 12 e −
становится:
3 CH 3 OH + 16 H + (AQ) + 2 CR 2 O 7
2 2
2 — → 4 CR 3 + + 11 ч 2 o + 3 Hcooh8.Проверьте, все ли атомы сбалансированы и общий заряд на каждой стороне одинаков
Этот шаг позволит вам узнать, все ли вы сделали правильно.
Если все атомы и заряды не уравновешены, вы совершили ошибку. Посмотрите на свою работу. Если вы допустили очевидную ошибку, то вам следует ее исправить.





 )
) Используйте любые виды, полученные из воды, которые необходимы; может быть более одного правильного сбалансированного уравнения.
Используйте любые виды, полученные из воды, которые необходимы; может быть более одного правильного сбалансированного уравнения. Используйте любые виды, полученные из воды, которые необходимы; может быть более одного правильного сбалансированного уравнения.
Используйте любые виды, полученные из воды, которые необходимы; может быть более одного правильного сбалансированного уравнения.
 Правильное сбалансированное уравнение: 2Cr 2+ + Cl 2 → 2Cr 3+ + 2Cl − .
Правильное сбалансированное уравнение: 2Cr 2+ + Cl 2 → 2Cr 3+ + 2Cl − .
 )
)  )+6e-+6H+(водн.)+2HNO3( водный)⟶3Cu2+(водный)+6e−+2NO(г)+4h3O(ж)
)+6e-+6H+(водн.)+2HNO3( водный)⟶3Cu2+(водный)+6e−+2NO(г)+4h3O(ж) 
 ) +5H+(водн.)+3e-
) +5H+(водн.)+3e- 