» Молекулярная кислота
На днях я пересмотрел фильмы “Чужой” и “Чужие” в полной версии. Насладился качеством картинки, оценил звук, поглядел выброшенные при монтаже сцены. С ними, кстати, вторая серия стало более полной и осмысленной что ли. Но сейчас не об этом.
Фишка в том, что в обоих фильмах разные переводы. Один от Гоблина, другой от какой-то сборной команды (полный дубляж). И в обоих фильмах фигурирует “молекулярная кислота“. Так произносят и русские переводчики, и английские актеры.
Dallas: [looks at a pen being dissolved by alien’s body fluid] I haven’t seen anything like that except, uh, molecular acid.
Brett: It must be using it for blood.
Parker: It’s got a wonderful defense mechanism. You don’t dare kill it.Link
Молекулярная кислота интересна не только тем, что она у Чужих вместо крови, но и тем, что на российских форумах она считается выдуманным термином. Цитирую:
“Так как ни одна из неорганических кислот не может быть такой едкой, её решили назвать молекулярной. ..
Link
В фильмах она, действительно, демонстрирует чудеса едкости. Особенно в первом, где крошечная струйка прожигает два перекрытия подряд. И это на космическом-то корабле! Во втором фильме едкость заметно ниже, но эффект все равно впечатляет. Особенно в начале, где показывают проплавленные дырки на несколько этажей.
Я заинтересовался происхождением этого термина и решил погуглить. Русскоязычный поиск выбросил множество ссылок на обсуждение фильма, а также на книги по фильмам от Алана Дина Фостера. А вот английский показал нечто более интересное. Ссылки на “Чужих” были встречались куда реже, а основную массу составляли научные публикации. Встречались даже тесты, из которых стало ясно, что в англоязычной химии кислоты делятся на два типа: “molecular” и “ionic” (Link и “открыть все вопросы”).
Выводы:
Выходит, Алан Дин Фостер ничего не придумывал, как и авторы фильма! Но они в качестве крови Чужого указали не какую-то конкретную кислоту, а целый класс (или тип) кислот. Я пытался найти соответствие этому классу в русском языке, но не хватило познаний в химии. Если кто знает — подскажите, буду только благодарен.
Среди молекулярных кислот упоминают следующие: HCl (соляная), HBr, HNO3 (азотная), H2SO4 (серная), and Perchloric (HClO4) . Link.
Последнее обновление:
на данный момент я предполагаю, что Molecular Acid — это на самом деле обычная кислота, а Ionic Acid — это просто жидкость, обогащенная ионами. Кто скажет точнее, тому и пряник. Я сдаюсь.
В любом случае — термин “молекулярная кислота” оказался реальным.PS: Бонус 1 — Обсуждение теории крови Чужих на англоязычном форуме. Интересные гипотезы.
PPS: Бонус 2 — Zerg acid is molecular acid….
Рубрика Язык, Наука, Книги
Wednesday, January 23rd, 2008 — 6:30 pm
kvisaz.ru
Кислоты — это… Что такое Кислоты?
КИСЛОТЫ — КИСЛОТЫ, группа веществ, физически весьма различных, но обладающих характерными химич. свойствами. Первоначальное мнение Лавуазье (Lavoisier), что для К. лоты характерно присутствие Оа, давно изменено после открытия бескислородных к т (HCN… … Большая медицинская энциклопедия
КИСЛОТЫ — (соляная, серная, азотная, борная и др.) довольно распространенная группа загрязнителей, поступающих со сточными водами металлургических, машиностроительных, текстильных, химических и целлюлозно бумажных предприятий. Они выпадают также с… … Болезни рыб: Справочник
КИСЛОТЫ — химические соединения, обычно характеризующиеся диссоциацией в водном растворе с образованием ионов Н+ (точнее ионов гидроксония Н3О+ ). Присутствие этих ионов обусловливает характерный острый вкус кислот и их способность изменять окраску… … Большой Энциклопедический словарь
Кислоты — (хим.). К. называется группа соединений с известной,довольно определенной химической функцией, которая резко выражена втаких типичных представителях этой группы, как серная К. h3SO4 азотнаяК. HNO3, соляная К. НСl и пр. Сделать характеристику их в … Энциклопедия Брокгауза и Ефрона
КИСЛОТЫ — электролиты, диссоциирующие в водных растворах с образованием положительно заряженного иона водорода Н+ (HNO3 Н+ + NO3 , h3SO4 2H++SO42 , Ch4COOH H+ + Ch4COO ). В зависимости от числа атомов водорода, способных заме … Геологическая энциклопедия
КИСЛОТЫ — обширный класс хим. соединений; обычно это электролиты, образующие при диссоциации (см.) водорода (Н+), а точнее ионы гидроксония Н30+, и анион. Водород, входящий в состав К., способен замещаться металлами с образованием солей. По числу… … Большая политехническая энциклопедия
кислоты — химические соединения, обычно характеризующиеся диссоциацией в водном растворе с образованием гидратированных ионов Н+. Присутствие этих ионов обусловливает характерный острый вкус килот и их способность изменять окраску индикаторов химических.… … Энциклопедический словарь
Кислоты — химические соединения, содержащие водород, способный замещаться металлом с образованием солей, и диссоциирующие при растворении в воде с образованием ионов Н+ (протонов) или, точнее, ионов гидроксония h4O+. По современным представлениям,… … Большая советская энциклопедия
Кислоты — (хим.) К. называется группа соединений с известной, довольно определенной химической функцией, которая резко выражена в таких типичных представителях этой группы, как серная К. h3SO4, азотная К. HNO3, соляная К. HCl и проч. Сделать характеристику … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
КИСЛОТЫ — класс хим. соединений. Обычно К. наз. в ва, содержащие водород и диссоциирующие в воде с образованием ионов Н+ (точнее, ионов гид роксония Н3О+). Присутствие этих ионов обусловливает характерный острый вкус К. и их способность изменять окраску… … Большой энциклопедический политехнический словарь
dic.academic.ru
Нуклеиновые кислоты
☰
Нуклеиновые кислоты
Мономерами нуклеиновых кислот являются нуклеотиды, таким образом они сами представляют полинуклеотиды.
Строение нуклеотидов
Каждый нуклеотид, входящий в состав нуклеиновой кислоты, состоит из трех частей:
пятиуглеродного сахара (пентозы),
азотистого основания,
фосфорной кислоты.
Химические связи между частями нуклеотида ковалентные, образующиеся в результате реакций конденсации (т. е. с выделением молекул воды). Конденсация обратна гидролизу.
В нуклеотиде первый атом углерода пентозы связан с азотистым основанием (связь C-N), а пятый — с фосфорной кислотой (фосфоэфирная связь: C-O-P).
Существуют два основных типа нуклеиновых кислот — ДНК (дезоксирибонуклеиновая кислота) и РНК (рибонуклеиновая кислота). В составе РНК сахар представлен рибозой, а в ДНК — дезоксирибозой. В обоих случаях в нуклеиновых кислотах встречается циклический вариант пентоз. Дезоксирибоза отличается от рибозы отсутствием атома кислорода при втором атоме углерода.
Наличие дополнительной гидроксильной группы (-OH) у рибозы делает РНК молекулой, легче вступающей в химические реакции.
В составе нуклеотидов нуклеиновых кислот обычно встречаются следующие азотистые основания: аденин (А), гуанин (Г, G), цитозин (Ц, C), тимин (Т), урацил (У, U).
Аденин и гуанин относятся к пуринам, остальные — к пиримидинам. В молекуле пуринов имеется два кольца, а у пиримидинов только одно. Урацил почти не встречается в ДНК, а тимин весьма редок для РНК. То есть для ДНК характерны аденин, гуанин, тимин и цитозин. Для РНК — аденин, гуанин, урацил и цитозин. Тимин схож с урацилом, отличатся от него лишь метилированным (имеющим группу -CH
Химическое соединение сахара с азотистым основанием называется нуклеозидом. Ниже представлены нуклеозиды, где в качестве сахара выступает рибоза.
Нуклеозид, реагируя с фосфорной кислотой, образует нуклеотид. Ниже представлен нуклеотид, где в качестве сахара выступает дезоксирибоза, а в качестве азотистого основания — аденин.
Именно наличие остатков фосфорной кислоты в молекулах нуклеиновых кислот определяет их кислотные свойства.
Строение нуклеиновых кислот
Нуклеотиды линейно соединяются между собой, образуя длинные молекулы нуклеиновых кислот. Цепочки многих молекул ДНК являются самыми длинными существующими полимерами. Длина молекул РНК обычно существенно меньше ДНК, но при этом различна, т. к. зависит от типа РНК.
При образовании полинуклеотида (нуклеиновой кислоты) остаток фосфорной кислоты предыдущего нуклеотида соединяется с 3-м атомом углерода пентозы следующего нуклеотида. Связь образуется такая же как между 5-м атомом углерода сахара и фосфорной кислотой в самом нуклеотиде – ковалентная фосфоэфирная.
Таким образом, остов молекул нуклеиновых кислот составляют пентозы, между которыми образуются фосфодиэфирные мостики (по-сути остатки пентоз и фосфорных кислот чередуются). От остова в сторону отходят азотистые основания. На рисунке ниже представлена часть молекулы рибонуклеиновой кислоты.
Следует отметить, что молекулы ДНК обычно не только длиннее РНК, но и состоят из двух цепей, соединенных между собой водородными связями, возникающими между азотистыми основаниями. Причем данные связи образуются согласно принципу комплементарности, по которому аденин комплементарен тимину, а гуанин — цитозину.
Подобные связи могут возникать и в РНК (но здесь аденин комплементарен урацилу). Однако в РНК водородные связи образуются между нуклеотидами одной цепи, в результате чего молекула нуклеиновой кислоты сворачивается различным образом.
biology.su
Строение молекулы
Неразбавленная серная кислота представляет собой ковалентное соединение.
В молекуле серная кислота тетраэдрически окружена четырьмя атомами кислорода, два из которых входят в состав гидроксильных групп. Связи S – O – двойные, а S – OH – одинарные.
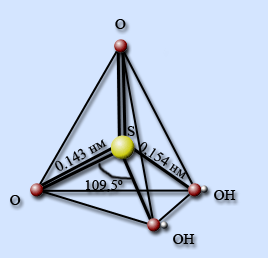
Бесцветные, похожие на лед кристаллы имеют слоистую структуру: каждая молекула H2SO4 соединена с четырьмя соседними прочными водородными связями, образуя единый пространственный каркас.
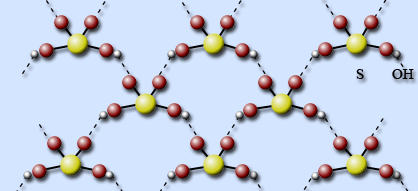
Структура жидкой серной кислоты похожа на структуру твердой, только целостность пространственного каркаса нарушена.
Физические свойства серной кислоты
При обычных условиях серная кислота – тяжёлая маслянистая жидкость без цвета и запаха. В технике серной кислотой называют её смеси как с водой, так и с серным ангидридом. Если молярное отношение SO3: Н2О меньше 1, то это водный раствор серной кислоты, если больше 1, – раствор SO3 в серной кислоте.
100 %-ная H2SO4 кристаллизуется при 10,45 °С; Ткип = 296,2 °С; плотность 1,98 г/см3. H2SO4 смешивается с Н2О и SO3 в любых соотношениях с образованием гидратов, теплота гидратации настолько велика, что смесь может вскипать, разбрызгиваться и вызывать ожоги. Поэтому необходимо добавлять кислоту к воде, а не наоборот, поскольку при добавлении воды к кислоте более легкая вода окажется на поверхности кислоты, где и сосредоточится вся выделяющаяся теплота.
При нагревании и кипении водных растворов серной кислоты, содержащих до 70 % H2SO4, в паровую фазу выделяются только пары воды. Над более концентрированными растворами появляются и пары серной кислоты.
По структурным особенностям и аномалиям жидкая серная кислота похожа на воду. Здесь та же система водородных связей, почти такой же пространственный каркас.
Химические свойства серной кислоты
Серная кислота – одна из самых сильных минеральных кислот, из-за высокой полярности связь Н – О легко разрывается.
В водном растворе серная кислота диссоциирует, образуя ион водорода и кислотный остаток:
H2SO4 = H+ + HSO4—;
HSO4— = H+ + SO42-.
Суммарное уравнение:
H2SO4 = 2H+ + SO42-.
Проявляет свойства кислот, реагирует с металлами, оксидами металлов, основаниями и солями.
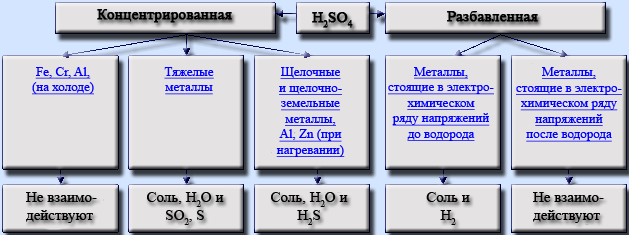
Разбавленная серная кислота не проявляет окислительных свойств, при ее взаимодействии с металлами выделяется водород и соль, содержащая металл в низшей степени окисления. На холоде кислота инертна по отношению к таким металлам, как железо, алюминий и даже барий.
Концентрированная кислота обладает окислительными свойствами. Возможные продукты взаимодействия простых веществ с концентрированной серной кислотой приведены в таблице. Показана зависимость продукта восстановления от концентрации кислоты и степени активности металла: чем активнее металл, тем глубже он восстанавливает сульфат-ион серной кислоты.
Взаимодействие с оксидами:
CaO + H2SO4 = CaSO4 = H2O.
Взаимодействие с основаниями:
2NaOH + H2SO4 = Na2SO4 + 2H2O.
Взаимодействие с солями:
Na2CO3 + H2SO4 = Na2SO4 + CO2 + H2O.
Окислительные свойства
Серная кислота окисляет HI и НВг до свободных галогенов:
H2SO4 + 2HI = I2 + 2H2O + SO2.
Серная кислота отнимает химически связанную воду от органических соединений, содержащих гидроксильные группы. Дегидратация этилового спирта в присутствии концентрированной серной кислоты приводит к получению этилена:
С2Н5ОН = С2Н4 + Н2О.
Обугливание сахара, целлюлозы, крахмала и др. углеводов при контакте с серной кислотой объясняется также их обезвоживанием:
C6H12O6 + 12H2SO4 = 18H2O + 12SO2↑ + 6CO2↑.
studfile.net