Формула Соляной кислоты структурная химическая
Структурная формула
Истинная, эмпирическая, или брутто-формула: HCl
Химический состав Соляной кислоты
| Символ | Элемент | Атомный вес | Число атомов | Процент массы |
|---|---|---|---|---|
| H | Водород | 1,008 | 1 | 2,8% |
| Cl | Хлор | 15,999 | 1 | 97,2% |
Молекулярная масса: 36,461
Соляная кислота (также хлороводоро́дная, хлористоводоро́дная кислота, хлористый водород) — раствор хлороводорода (HCl) в воде, сильная одноосновная кислота. Бесцветная, прозрачная, едкая жидкость, «дымящая» на воздухе (техническая соляная кислота желтоватого цвета из-за примесей железа, хлора и пр.
Физические свойства
Физические свойства соляной кислоты сильно зависят от концентрации растворённого хлороводорода. При затвердевании даёт кристаллогидраты составов HCl·H2O, HCl·2H2O, HCl·3H2O, HCl·6H2O.
Химические свойства
- Взаимодействие с металлами, стоящими в ряду электрохимических потенциалов до водорода, с образованием соли и выделением газообразного водорода.
- Взаимодействие с оксидами металлов с образованием растворимой соли и воды.
- Взаимодействие с гидроксидами металлов с образованием растворимой соли и воды (реакция нейтрализации).
- Взаимодействие с солями металлов, образованных более слабыми кислотами, например угольной.

- Взаимодействие с сильными окислителями (перманганат калия, диоксид марганца) с выделением газообразного хлора.
- Взаимодействие с аммиаком с образованием густого белого дыма, состоящего из мельчайших кристалликов хлорида аммония.
- Качественной реакцией на соляную кислоту и её соли является её взаимодействие с нитратом серебра, при котором образуется творожистый осадок хлорида серебра, нерастворимый в азотной кислоте.
Получение
Соляную кислоту получают растворением газообразного хлороводорода в воде. Хлороводород получают сжиганием водорода в хлоре, полученная таким способом кислота называется синтетической. Также соляную кислоту получают из абгазов — побочных газов, образующихся при различных процессах, например, при хлорировании углеводородов. Хлороводород, содержащийся в этих газах, называется абгазным, а полученная таким образом кислота — абгазной. В последние десятилетия доля абгазной соляной кислоты в объёме производства постепенно увеличивается, вытесняя кислоту, полученную сжиганием водорода в хлоре.
Применение
Промышленность
- Применяется в гидрометаллургии и гальванопластике (травление, декапирование), для очистки поверхности металлов при пайке и лужении, для получения хлоридов цинка, марганца, железа и др.
 металлов. В смеси с поверхностно-активными веществами используется для очистки керамических и металлических изделий (тут необходима ингибированная кислота) от загрязнений и дезинфекции.
металлов. В смеси с поверхностно-активными веществами используется для очистки керамических и металлических изделий (тут необходима ингибированная кислота) от загрязнений и дезинфекции. - В пищевой промышленности зарегистрирована как регулятор кислотности (пищевая добавка E507). Применяется для изготовления зельтерской (содовой) воды.
Медицина
- Естественная составная часть желудочного сока человека. В концентрации 0,3—0,5%, обычно в смеси с ферментом пепсином, назначается внутрь при недостаточной кислотности.
Особенности обращения
Высококонцентрированная соляная кислота — едкое вещество, при попадании на кожу вызывает сильные химические ожоги. Особенно опасно попадание в глаза. Для нейтрализации ожогов применяют раствор слабой щёлочи, обычно питьевой соды. При открывании сосудов с концентрированной соляной кислотой пары хлороводорода, притягивая влагу воздуха, образуют туман, раздражающий глаза и дыхательные пути человека. Реагируя с сильными окислителями (хлорной известью, диоксидом марганца, перманганатом калия) образует токсичный газообразный хлор. В РФ оборот соляной кислоты концентрации 15% и более — ограничен.
Реагируя с сильными окислителями (хлорной известью, диоксидом марганца, перманганатом калия) образует токсичный газообразный хлор. В РФ оборот соляной кислоты концентрации 15% и более — ограничен.
ПРИГОТОВЛЕНИЕ РАБОЧИХ РАСТВОРОВ И РАСТВОРОВ НОСИТЕЛЕЙ. ПОДГОТОВКА ИОНООБМЕННЫХ СМОЛ К АНАЛИЗУ, РЕГЕНЕРАЦИЯ И ХРАНЕНИЕ
Приложение 1
к МР 2.6.1/2.3.7.0216-20
1. Приготовление кислот определенной нормальности:
Для выполнения операций по настоящими МР необходимо приготовить следующие кислоты: HCl — 0,5 H; 1 H; 2 H; 6 H; 8 H; HNO3 — 0,5 H.
Для приготовления рабочего раствора кислоты концентрированную кислоту разбавляют дистиллированной водой до нужной концентрации:
— Соляная кислота, 8 H раствор: 680 мл концентрированной HCl (35 — 38%) разбавляют дистиллированной водой до 1 л. Срок хранения не ограничен.
— Соляная кислота, 6 H раствор: 510 мл концентрированной HCl (35 — 38%) разбавляют дистиллированной водой до 1 л. Срок хранения не ограничен.
— Соляная кислота 2 H раствор: 170 мл концентрированной HCl (35 — 38%) разбавляют дистиллированной водой до 1 л. Срок хранения не ограничен.
— Соляная кислота 1 H раствор: 85 мл концентрированной HCl (35 — 38%) разбавляют дистиллированной водой до 1 л. Срок хранения не ограничен.
— Соляная кислота 0,5 H раствор: 42,5 мл концентрированной HCl (35 — 38%) разбавляют дистиллированной водой до 1 л. Срок хранения не ограничен.
— Азотная кислота 0,5 H раствор: 33,6 мл концентрированной азотной кислоты разбавляют дистиллированной водой до 1 л. Срок хранения не ограничен.
2. Приготовление рабочих растворов:
— Натрий углекислый, 5% раствор: 50 г соли растворяют при нагревании в 950 см3 дистиллированной воды. Срок хранения 1 год.
— Лимонная кислота, 1% раствор: 1 г кислоты растворяют в 99 мл дистиллированной воды. Срок хранения 1 год.
— Аммоний хлористый, 25% раствор: 25 г соли NH4Cl растворяют в 75 см3 дистиллированной воды.
— Аммоний щавелевокислый, насыщенный раствор: 12 г соли (NH4)2C2O4·H2O растворяют в 100 см3 дистиллированной воды. Срок хранения не ограничен.
— Серная кислота, 10% раствор: приготовляют по объему растворением 100 мл концентрированной H2SO4 в 900 мл дистиллированной воды. Срок хранения не ограничен.
— Аммоний углекислый, 15% раствор: 15 г (NH4)2CO3·H2O растворяют в 85 см3 дистиллированной воды. Срок хранения не ограничен.
— Аммоний углекислый, 10% раствор: 10 г (NH4)2CO3·H2O растворяют в 90 см3 дистиллированной воды. Срок хранения не ограничен.
— Аммоний углекислый, 2% раствор: 2 г (NH4)2CO3·H2O растворяют в 98 см3 дистиллированной воды. Срок хранения не ограничен.
— Аммиак водный безугольный, раствор: получают перегонкой NH4OH в аппарате, собранном из перегонной колбы, холодильника (ловушки) и приемной колбы. Для связывания CO2 в перегонную колбу добавляют Ba(OH)2 из расчета 5 — 10 г/л. Срок хранения 1 месяц.
Для связывания CO2 в перегонную колбу добавляют Ba(OH)2 из расчета 5 — 10 г/л. Срок хранения 1 месяц.
3. Приготовление титрованного раствора бария.
Исходная соль для приготовления раствора — BaCl2·2H2O. Соединение, в виде которого выделяется носитель на последней стадии анализа — BaSO4. Объем приготовляемого раствора носителя — 100 мл. Заданный титр BaSO4 — 100 мг/мл, т.е. в 100 мл раствора должно содержаться 100 мг x 100 мл = 10 г BaSO4.
Молекулярная масса BaCl2·2H2O — 244,28.
Молекулярная масса BaSO4 — 233,4.
Расчет титра сводится к следующему:
244,28 | ——— | 233,4 |
X (г) | ——— | 10 (г) |
г
Для приготовления 100 мл раствора BaCl2 с титром BaSO4 ~ 100 мг/мл необходима навеска соли (BaCl2·2H2O) массой 10,47 г. Навеску помещают в стакан емкостью 150 мл, растворяют в дистиллированной воде, добавляют 5 — 10 мл 2 H HCl. Раствор переливают в мерную колбу емкостью 100 мл (если необходимо — фильтруют), доводят дистиллированной водой до метки.
Навеску помещают в стакан емкостью 150 мл, растворяют в дистиллированной воде, добавляют 5 — 10 мл 2 H HCl. Раствор переливают в мерную колбу емкостью 100 мл (если необходимо — фильтруют), доводят дистиллированной водой до метки.
Определение титра раствора проводят в условиях, аналогичных тем, которые используются на последнем этапе радиохимического анализа при выделении изотопов радия на BaSO4.
Для этого в пять стаканов емкостью 150 мл отбирают по 1 мл приготовленного раствора, добавляют 10 — 15 мл 2 H HCl и разбавляют дистиллированной водой до 100 мл. Нагревают раствор до кипения и осаждают BaSO4, приливая при непрерывном перемешивании 10 мл 10% H2SO4. После отстаивания в течение 30 — 40 минут осадки фильтруют через обеззоленный фильтр «синяя лента», тщательно перенося их со стенок стаканов горячей дистиллированной водой. Фильтры с осадками помещают в тигли, обугливают на электрической плитке, переносят в муфельную печь, прокаливают при 800 °C в течение 1 часа, после охлаждения взвешивают. Вычисляют среднее арифметическое значение массы осадка, которое считают точной концентрацией, т.е. титром бария в растворе.
Вычисляют среднее арифметическое значение массы осадка, которое считают точной концентрацией, т.е. титром бария в растворе.
4. Приготовление титрованного раствора лантана.
Исходная соль для приготовления раствора — LaCl3·7H2O. Соединение, в виде которого выделяется носитель на последней стадии анализа — La2O3. Объем приготовляемого раствора носителя — 100 мл. Заданный титр La2O3 — 50 мг/мл, т.е. в 100 мл раствора должно содержаться 50 мг x 100 мл = 5 г La2O3.
Молекулярная масса LaCl3·7H2O — 371,38.
Молекулярная масса La2O3 — 325,82.
Для получения одной молекулы La2O3 необходимо две молекулы LaCl3·7H2O, молекулярная масса которых составляет 742,46.
Расчет титра сводится к следующему:
742,46 | ——— | 325,82 |
X (г) | ——— | 5 (г) |
г
Для приготовления 100 мл раствора LaCl3 с титром La2O3 ~ 50 мг/мл необходима навеска соли (LaCl3·7H2O) массой 11,40 г. Навеску помещают в стакан емкостью 150 мл, растворяют при нагревании в 20 — 40 мл 2 H HCl. После охлаждения раствор переливают в мерную колбу емкостью 100 мл, доводят дистиллированной водой до метки.
Навеску помещают в стакан емкостью 150 мл, растворяют при нагревании в 20 — 40 мл 2 H HCl. После охлаждения раствор переливают в мерную колбу емкостью 100 мл, доводят дистиллированной водой до метки.
Для определения титра приготовленного раствора используют приемы, указанные в методике выделения 228Ac на La(OH)3 на последнем этапе его радиохимического анализа. Для этого в пять стаканов емкостью 150 мл отбирают по 1 мл приготовленного раствора носителя, добавляют 10 мл 2 H HCl и разбавляют дистиллированной водой до 100 мл. Нагревают раствор до 80 °C и осаждают La(OH)3, добавляя раствор NH4OH до pH = 8 — 9. Осадки фильтруют через обеззоленный фильтр «белая лента», тщательно перенося их со стенок стаканов горячей дистиллированной водой. Фильтры с осадками помещают в тигли, обугливают на электрической плитке, переносят в муфельную печь, прокаливают при 800 °C в течение 1 часа, после охлаждения взвешивают. Вычисляют среднее арифметическое значение массы осадка, которое считают точной концентрацией, т. е. титром лантана в растворе.
е. титром лантана в растворе.
5. Приготовление титрованного раствора железа.
Исходная соль для приготовления раствора — FeCl3·6H2O. Соединение, в виде которого выделяется носитель на последней стадии анализа — Fe2O3. Объем приготовляемого раствора носителя — 100 мл. Заданный титр Fe2O3 — 20 мг/мл, т.е. в 100 мл раствора должно содержаться 20 мг x 100 мл = 2 г La2O3.
Молекулярная масса FeCl3·6H2O — 270,3.
Молекулярная масса Fe2O3 — 159,69.
Для получения одной молекулы Fe2O3 необходимо две молекулы FeCl3·6H2O, молекулярная масса которых составляет 540,6.
Расчет титра сводится к следующему:
540,6 | ——— | 159,69 |
X (г) | ——— | 2 (г) |
г
Для приготовления 100 мл раствора FeCl3 с титром Fe2O3 ~ 20 мг/мл необходима навеска соли (FeCl3·6H2O) массой 6,77 г. Навеску помещают в стакан емкостью 150 мл, добавляют 10 мл 2 H HCl и дистиллированную воду до 80 мл. Раствор переливают в мерную колбу емкостью 100 мл и доводят дистиллированной водой до метки.
Навеску помещают в стакан емкостью 150 мл, добавляют 10 мл 2 H HCl и дистиллированную воду до 80 мл. Раствор переливают в мерную колбу емкостью 100 мл и доводят дистиллированной водой до метки.
Для определения титра раствора в пять стаканов емкостью 150 мл отбирают по 1 мл приготовленного раствора носителя, добавляют 10 мл 2 H HCl и разбавляют дистиллированной водой до 100 мл. Нагревают раствор до 80 °C и осаждают Fe(OH)3, добавляя раствор NH4OH до pH = 8 — 9. Осадки фильтруют через обеззоленный фильтр «белая лента», тщательно перенося их со стенок стаканов горячей дистиллированной водой. Фильтры с осадками помещают в тигли, обугливают на электрической плитке, переносят в муфельную печь, прокаливают при 800 °C в течение 1 часа, после охлаждения взвешивают. Вычисляют среднее арифметическое значение массы осадка, которое считают точной концентрацией, т.е. титром железа в растворе.
6. Приготовление титрованного раствора иттрия.
Исходная соль для приготовления раствора — YCl3·6H2O. Соединение, в виде которого выделяется носитель на последней стадии анализа — Y2O3. Объем приготовляемого раствора носителя — 100 мл. Заданный титр Y2O3 — 60 мг/мл, т.е. в 100 мл раствора должно содержаться 60 мг x 100 мл = 6 г Y2O3.
Соединение, в виде которого выделяется носитель на последней стадии анализа — Y2O3. Объем приготовляемого раствора носителя — 100 мл. Заданный титр Y2O3 — 60 мг/мл, т.е. в 100 мл раствора должно содержаться 60 мг x 100 мл = 6 г Y2O3.
Молекулярная масса YCl3·6H2O — 303,4.
Молекулярная масса Y2O3 — 225,8.
Для получения одной молекулы Y2O3 необходимо две молекулы YCl3·6H2O, молекулярная масса которых составляет 606,8.
Расчет титра сводится к следующему:
606,8 | ——— | 225,8 |
X (г) | ——— | 6 (г) |
г
Для приготовления 100 мл раствора YCl3 с титром Y2O3 ~ 60 мг/мл необходима навеска соли (YCl3·6H2O) массой 16,12 г. Навеску помещают в стакан емкостью 150 мл, добавляют 15 — 20 мл 2 H HCl, нагревают до растворения осадка, разбавляют дистиллированной водой до 70 мл, охлаждают. Раствор переливают в мерную колбу емкостью 100 мл и доводят дистиллированной водой до метки.
Навеску помещают в стакан емкостью 150 мл, добавляют 15 — 20 мл 2 H HCl, нагревают до растворения осадка, разбавляют дистиллированной водой до 70 мл, охлаждают. Раствор переливают в мерную колбу емкостью 100 мл и доводят дистиллированной водой до метки.
Для определения титра раствора в пять стаканов емкостью 150 мл отбирают по 1 мл приготовленного раствора носителя, добавляют 10 — 15 мл 2 H HCl и дистиллированную воду до 60 — 70 мл. После нагревания до 70 °C добавляют 10 мл насыщенного раствора H2C2O4 и раствором и NH4OH доводят до pH ~ 1,5. После отстаивания (около 30 минут) осадки фильтруют через обеззоленный фильтр «синяя лента», промывают дистиллированной водой с добавлением H2C2O4. Фильтры с осадками помещают в тигли, обугливают на электрической плитке, переносят в муфельную печь, прокаливают при 800 °C в течение 1 часа, после охлаждения взвешивают. Вычисляют среднее арифметическое значение массы осадка, которое считают точной концентрацией, т. е. титром иттрия в растворе.
е. титром иттрия в растворе.
7. Подготовка ионообменных смол к анализу, регенерация и хранение.
Для удовлетворительного хроматографического разделения ионов следует пользоваться только мелкозернистыми ионитами. Размер зерен смол, используемых для разделения урана и тория — (0,125 0,250) мм.
Подготовленной таким образом фракции ионита нужно дать набухнуть, причем в процессе набухания следует сливать верхнюю жидкость для удаления из смолы частиц почти коллоидного размера. Для этого в мерном цилиндре приготавливают взвесь смолы в десятикратном объеме воды и оставляют ее приблизительно на полчаса. Образовавшуюся над смолой облакообразную взвесь сливают, добавляют в цилиндр порцию воды и повторяют весь процесс до тех пор, пока слой жидкости над смолой не станет чистым. В течение всего этого процесса смола впитывает воду и набухает. Далее проводят подготовительный цикл, при котором ионит переводят в Cl—-форму: смолы обрабатывают 1 — 2 H раствором HCl, дистиллированной водой, 0,5 — 1 H раствором NaOH и снова дистиллированной водой.
Для переведения смолы в Cl—-форму ее обрабатывают 1 H раствором HCl и промывают дистиллированной водой. Каждый раз смолу нужно промывать дистиллированной водой до нейтральной реакции. Время обработки смолы каждым реактивом — несколько часов, при переведении в Cl—-форму смолу, залитую 1 H раствором HCl, лучше оставить на ночь. По окончании анализа смолу переносят из колонок в стакан, промывают дистиллированной водой, сливают верхнюю жидкость и проводят полный подготовительный цикл.
После регенерации смолу тщательно промывают дистиллированной водой и хранят в закрытых сосудах под слоем дистиллированной воды. Смолу, которая хранилась в течение года или дольше, перед использованием рекомендуется вновь регенерировать.
Молярная масса соляной кислоты – Telegraph
Молярная масса соляной кислотыЧему равна молярная масса соляной кислоты?
=== Скачать файл ===
Соляная Кислота
Соляная кислота
На нашем сайте собрано более бесплатных онлайн калькуляторов по математике, геометрии и физике. Не можете решить контрольную?! Более 20 авторов выполнят вашу работу от руб! Строение молекулы соляной кислоты, а также её структурная формула приведены на рис. Брутто-формула соляной кислоты — HCl. Как известно, молекулярная масса молекулы равна сумме относительных атомных масс атомов, входящих в состав молекулы значения относительных атомных масс, взятых из Периодической таблицы Д. Менделеева, округлим до целых чисел. Молярная масса М — это масса 1 моль вещества. Молярную массу вещества в газообразном состоянии можно определить, используя понятие о его молярном объеме. Для достижения данной цели вычисление молярной массы возможно использование уравнения состояния идеального газа уравнение Менделеева-Клапейрона:. Тогда, мольное отношение будет выглядеть следующим образом значения относительных атомных масс, взятых из Периодической таблицы Д. Менделеева округлим до целых чисел:. Значит формула соединения азота с кислородом будет иметь вид NO 2. Это оксид азота IV. Менделеева, округлим до целых чисел:.
Не можете решить контрольную?! Более 20 авторов выполнят вашу работу от руб! Строение молекулы соляной кислоты, а также её структурная формула приведены на рис. Брутто-формула соляной кислоты — HCl. Как известно, молекулярная масса молекулы равна сумме относительных атомных масс атомов, входящих в состав молекулы значения относительных атомных масс, взятых из Периодической таблицы Д. Менделеева, округлим до целых чисел. Молярная масса М — это масса 1 моль вещества. Молярную массу вещества в газообразном состоянии можно определить, используя понятие о его молярном объеме. Для достижения данной цели вычисление молярной массы возможно использование уравнения состояния идеального газа уравнение Менделеева-Клапейрона:. Тогда, мольное отношение будет выглядеть следующим образом значения относительных атомных масс, взятых из Периодической таблицы Д. Менделеева округлим до целых чисел:. Значит формула соединения азота с кислородом будет иметь вид NO 2. Это оксид азота IV. Менделеева, округлим до целых чисел:. Копирование материалов с сайта возможно только с разрешения администрации портала и при наличие активной ссылки на источник. Онлайн калькуляторы На нашем сайте собрано более бесплатных онлайн калькуляторов по математике, геометрии и физике. Справочник Основные формулы, таблицы и теоремы для учащихся. Все что нужно, чтобы сделать домашнее задание! Заказать решение Не можете решить контрольную?! Главная Онлайн калькуляторы Справочник Примеры решений Заказать решение О проекте. Молярная масса азотной кислоты Молярная масса фосфорной кислоты Молярная масса серной кислоты Молярная масса уксусной кислоты Молярная масса ортофосфорной кислоты. Главная Справочник Химия Молярная масса Молярная масса соляной кислоты. Структурная формула и пространственное строение молекулы соляной кислоты. Решение Массовая доля элемента Х в молекуле состава НХ рассчитывается по следующей формуле: Менделеева округлим до целых чисел: Менделеева, округлим до целых чисел: Значит формула гидроксида железа будет иметь вид Fe OH 2.
Копирование материалов с сайта возможно только с разрешения администрации портала и при наличие активной ссылки на источник. Онлайн калькуляторы На нашем сайте собрано более бесплатных онлайн калькуляторов по математике, геометрии и физике. Справочник Основные формулы, таблицы и теоремы для учащихся. Все что нужно, чтобы сделать домашнее задание! Заказать решение Не можете решить контрольную?! Главная Онлайн калькуляторы Справочник Примеры решений Заказать решение О проекте. Молярная масса азотной кислоты Молярная масса фосфорной кислоты Молярная масса серной кислоты Молярная масса уксусной кислоты Молярная масса ортофосфорной кислоты. Главная Справочник Химия Молярная масса Молярная масса соляной кислоты. Структурная формула и пространственное строение молекулы соляной кислоты. Решение Массовая доля элемента Х в молекуле состава НХ рассчитывается по следующей формуле: Менделеева округлим до целых чисел: Менделеева, округлим до целых чисел: Значит формула гидроксида железа будет иметь вид Fe OH 2. Ответ Fe OH 2. Сервисы Онлайн калькуляторы Справочник Примеры решений Заказать решение Учебные статьи. SolverBook О проекте Задать вопрос Контакты Карта сайта. Массовая доля элемента Х в молекуле состава НХ рассчитывается по следующей формуле:
Ответ Fe OH 2. Сервисы Онлайн калькуляторы Справочник Примеры решений Заказать решение Учебные статьи. SolverBook О проекте Задать вопрос Контакты Карта сайта. Массовая доля элемента Х в молекуле состава НХ рассчитывается по следующей формуле:
Правила езды на скутере до 50 кубов
Выдача кредитных карт тинькофф банк
Крымский вал дом 10 как добраться
Характеристики телефона htc 620
Руки вверх он тебя целует 2017
Инструкция мультиметр fluke
Supra dfs 201
Настой из липы полезные свойства
Схема метро нижнего новгорода в перспективе
Рожденные 14 мая характеристика
Должностная инструкция укладчика упаковщика готовой продукции
Категории и подкатегории водительских прав 2017
Где находится шелест ветра
Atmega8 схема термометра
820 2915 b схема
Сколько нужно варить говядину для супа
Сколько времени делают сбербанковскую карту
Карта цветов названия
Почему дрожит курсор мыши на экране компьютера
Запишите значения выраженийв порядке возрастания
Помощь студентам в учёбе от Людмилы Фирмаль
Здравствуйте!
Я, Людмила Анатольевна Фирмаль, бывший преподаватель математического факультета Дальневосточного государственного физико-технического института со стажем работы более 17 лет. На данный момент занимаюсь онлайн обучением и помощью по любыми предметам. У меня своя команда грамотных, сильных бывших преподавателей ВУЗов. Мы справимся с любой поставленной перед нами работой технического и гуманитарного плана. И не важно: она по объёму на две формулы или огромная сложно структурированная на 125 страниц! Нам по силам всё, поэтому не стесняйтесь, присылайте.
На данный момент занимаюсь онлайн обучением и помощью по любыми предметам. У меня своя команда грамотных, сильных бывших преподавателей ВУЗов. Мы справимся с любой поставленной перед нами работой технического и гуманитарного плана. И не важно: она по объёму на две формулы или огромная сложно структурированная на 125 страниц! Нам по силам всё, поэтому не стесняйтесь, присылайте.
Срок выполнения разный: возможно онлайн (сразу пишите и сразу помогаю), а если у Вас что-то сложное – то от двух до пяти дней.
Для качественного оформления работы обязательно нужны методические указания и, желательно, лекции. Также я провожу онлайн-занятия и занятия в аудитории для студентов, чтобы дать им более качественные знания.
Моё видео:
Как вы работаете?
Вам нужно написать сообщение в WhatsApp . После этого я оценю Ваш заказ и укажу срок выполнения. Если условия Вас устроят, Вы оплатите, и преподаватель, который ответственен за заказ, начнёт выполнение и в согласованный срок или, возможно, раньше срока Вы получите файл заказа в личные сообщения.
После этого я оценю Ваш заказ и укажу срок выполнения. Если условия Вас устроят, Вы оплатите, и преподаватель, который ответственен за заказ, начнёт выполнение и в согласованный срок или, возможно, раньше срока Вы получите файл заказа в личные сообщения.
Стоимость заказа зависит от задания и требований Вашего учебного заведения. На цену влияют: сложность, количество заданий и срок выполнения. Поэтому для оценки стоимости заказа максимально качественно сфотографируйте или пришлите файл задания, при необходимости загружайте поясняющие фотографии лекций, файлы методичек, указывайте свой вариант.
Какой срок выполнения заказа?Минимальный срок выполнения заказа составляет 2-4 дня, но помните, срочные задания оцениваются дороже.
Как оплатить заказ?Сначала пришлите задание, я оценю, после вышлю Вам форму оплаты, в которой можно оплатить с баланса мобильного телефона, картой Visa и MasterCard, apple pay, google pay.
В течение 1 года с момента получения Вами заказа действует гарантия. В течении 1 года я и моя команда исправим любые ошибки в заказе.
Качественно сфотографируйте задание, или если у вас файлы, то прикрепите методички, лекции, примеры решения, и в сообщении напишите дополнительные пояснения, для того, чтобы я сразу поняла, что требуется и не уточняла у вас. Присланное качественное задание моментально изучается и оценивается.
Теперь напишите мне в Whatsapp или почту и прикрепите задания, методички и лекции с примерами решения, и укажите сроки выполнения. Я и моя команда изучим внимательно задание и сообщим цену.
Если цена Вас устроит, то я вышлю Вам форму оплаты, в которой можно оплатить с баланса мобильного телефона, картой Visa и MasterCard, apple pay, google pay.
Мы приступим к выполнению, соблюдая указанные сроки и требования. 80% заказов сдаются раньше срока.
80% заказов сдаются раньше срока.
После выполнения отправлю Вам заказ в чат, если у Вас будут вопросы по заказу – подробно объясню. Гарантия 1 год. В течении 1 года я и моя команда исправим любые ошибки в заказе.
youtube.com/embed/g4ioDc7sLwU» frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>
youtube.com/embed/zW5JhiZ4140″ frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>
Можете смело обращаться к нам, мы вас не подведем. Ошибки бывают у всех, мы готовы дорабатывать бесплатно и в сжатые сроки, а если у вас появятся вопросы, готовы на них ответить.
Ошибки бывают у всех, мы готовы дорабатывать бесплатно и в сжатые сроки, а если у вас появятся вопросы, готовы на них ответить.
В заключение хочу сказать: если Вы выберете меня для помощи на учебно-образовательном пути, у вас останутся только приятные впечатления от работы и от полученного результата!
Жду ваших заказов!
С уважением
Пользовательское соглашение
Политика конфиденциальности
Эквивалентная концентрация и массовая доля | 435
Задача 435.
Сколько миллилитров концентрированной соляной кислоты (p = 1,19 г/мл), содержащей 38% (масс.) НСI, нужно взять для приготовления 1 л 2н. раствора?
Решение:
M(НСI) = MЭ(НСI) = 36,5 г/моль.
Рассчитаем массу НСI в 1 л 2 н раствора её: 2 .36,5 = 72,93 г.
Рассчитаем массу 38%-ного раствора по формуле:
где
— массовая доля растворённого вещества; m(в-ва) — масса растворённого вещества; m(р-ра) — масса раствора.
Тогда
Объём раствора, который необходимо взять для приготовления 1 л 2 н раствора рассчитаем по формуле:
m(p-pa) = p . V,
где p — плотность, а V – объём раствора, получим:
Ответ: 161,28 мл.
Задача 436.
К 100 мл 96%-ной (по массе) H2SO4 (плотность 1,84 г/мл) прибавили 400 мл воды. Получился раствор плотностью 1,220 г/мл. Вычислить его эквивалентную концентрацию и массовую долю H2SO4.
Решение:
Массу раствора 100 мл 96%-ного раствора найдём по формуле:
m(p-pa) = p .V,
где p — плотность, а V – объём раствора, получим:
m(p-pa) = 1,84 . 100 = 184 г.
Массу серной кислоты в данном растворе находим по формуле:
где
— массовая доля растворённого вещества; m(в-ва) — масса растворённого вещества; m(р-ра) — масса раствора.
Тогда
Рассчитаем массу раствора полученного при смешении 100 мл 96%-ного раствора с 400 мл воды, получим:
m’(p-pa) = (100 + 400) .1,220 = 610 г.
Определим молярную массу эквивалента H2SO4 из соотношения:
MЭ(В) — молярная масса эквивалента кислоты, г/моль; М(В) — молярная масса кислоты; Z(B) — эквивалентное число; Z(кислоты) равно числу ионов Н+, H2SO4 — 2.
Отсюда
Тогда эквивалентную концентрацию раствора найдём по формуле:
где
m(B)- масса растворённого вещества, MЭ(В) — молярная масса эквивалента растворённого вещества, V – объём раствора (в л или мл).
Отсюда
Рассчитаем массовую долю полученного раствора:
Ответ: 7,2н; 28,96%.
Задача 437.
Рассчитать нормальность концентрированной соляной кислоты (плотность 1,18г/мл), содержащей 36,5% (масс. ) НСI.
) НСI.
Решение:
Массу 96%-ного раствора найдём по формуле:
m(p-pa) = p .V,
где p — плотность, а V – объём раствора, получим:
m(p-pa) = 1,18 .1000 = 1180 г.
Рассчитаем массу соляной кислоты в растворе по формуле:
где
— массовая доля растворённого вещества; m(в-ва) — масса растворённого вещества; m(р-ра) — масса раствора.
Тогда
Определим молярную массу эквивалента HCl из соотношения:
MЭ(В) — молярная масса эквивалента кислоты, г/моль; М(В) — молярная масса кислоты; Z(B) — эквивалентное число; Z(кислоты) равно числу ионов Н+, H2SO4 → 2.
Отсюда
Ответ: 11,8н.
Задача 438.
Какой объем 10%-ной (по массе) серной кислоты (p = 1,07 г/мл) потребуется для нейтрализации раствора, содержащего 16,0 г NaOH?
Решение:
Уравнение реакции нейтрализации раствора NaOH раствором H2SO4 имеет вид:
H2SO4 + 2NaOH ↔ Na2SO4 + 2H2O
Из уравнения реакции следует, что на нейтрализацию 1 моля NaOH затрачивается 0,5 молей NaOH, значит, эквивалентная масса серной кислоты в данной реакции равна 49 г/моль (М/2 = 98/2 = 49).
Теперь рассчитаем массу серной кислоты, необходимую для нейтрализации 16 г NaOH из пропорции:
Массу раствора, содержащего 19,6 г H2SO4, рассчитаем по формуле:
где
— массовая доля растворённого вещества; m(в-ва) — масса растворённого вещества; m(р-ра) — масса раствора.
Тогда
Объём раствора рассчитаем по формуле:
m(p-pa) = p . V,
где — плотность, а V – объём раствора, получим:
Ответ: 183,18 мл.
Соляная кислота цена 250 руб.
Реактив является прекурсором, продажа осуществляется при предъявлении паспорта.
Товар доступен только на условиях самовывоза.
Отправка курьерскими службами и транспортными компаниями не осуществляется.
CAS: 7647-01-0
Квалификация: Химически чистый
Синонимы: Хлороводородная, Хлористоводородная, Хлористый водород, Hydrochloric acid, Hydrogen chloride, Muriatic acid, Chlorohydric acid
Производитель: Россия
Раствор соляной кислоты представляет собой прозрачную, едкую водянистую жидкость, с резким раздражающим запахом. Сама по себе бесцветная, но из-за содержания примесей железа, хлора и прочего может иметь слегка желтоватый цвет. Является сильной одноосновной кислотой состоящей из газообразного хлороводорода, растворенного в воде. Тонет и смешивается с водой. Соляная кислота получается при растворении в воде газообразного хлороводорода. Другой способ получения, при хлорировании углеводородов из побочных газов (абгазов).
Сама по себе бесцветная, но из-за содержания примесей железа, хлора и прочего может иметь слегка желтоватый цвет. Является сильной одноосновной кислотой состоящей из газообразного хлороводорода, растворенного в воде. Тонет и смешивается с водой. Соляная кислота получается при растворении в воде газообразного хлороводорода. Другой способ получения, при хлорировании углеводородов из побочных газов (абгазов).
Физико-химические свойства соляной кислоты:
Химическая формула: HCl или ClH
Молярная масса: 36,46 г/моль
Плотность жидкости: 1,19 г/см³
Температура плавления: -30 °C
Температура кипения: 48 °C
Соляная кислота опасна для человека её токсичные пары при вдыхании могут вызвать раздражение и воспаление глаз, носа и дыхательных путей, а также отек легких. При контакте с кожей вызывает серьезные химические ожоги. Долгосрочное профессиональное воздействие соляной кислоты вызывает у людей гастрит, хронический бронхит и дерматит. Работать с ней обязательно необходимо в спецодежде и средствах индивидуальной защиты.
Область применения:
Соляная кислота имеет множество применений. Она используется в производстве хлоридов, для рафинирования руды при производстве олова и тантала, при изготовлении различных удобрений, красителей, резины, средство для обработки металлов при лужении и пайки, в гидрометаллургии и гальванике, медицине а также в текстильной и пищевой промышленности.
Разница между соляной кислотой и серной кислотой — Разница Между
Кислоты — это молекулы, способные отдавать протоны или ионы H + в водный раствор. Есть в основном два типа кислот, называемых сильными кислотами и слабыми кислотами. Соляная кислота и серная кислота
Основное отличие — соляная кислота от серной кислоты
Кислоты — это молекулы, способные отдавать протоны или ионы H + в водный раствор. Есть в основном два типа кислот, называемых сильными кислотами и слабыми кислотами. Соляная кислота и серная кислота — две сильные кислоты. Основное различие между соляной кислотой и серной кислотой заключается в том, что соляная кислота является монопротонной, тогда как серная кислота является дипротичной.
Ключевые области покрыты
1. Что такое соляная кислота
— определение, свойства
2. Что такое серная кислота
— определение, свойства
3. В чем разница между соляной кислотой и серной кислотой
— Сравнение основных различий
Ключевые слова: химическая формула, дипротик, HCl, H2ТАК4, Соляная кислота, ионизация, монопротонная, серная кислота
Что такое соляная кислота
Молекула соляной кислоты состоит из атомов водорода (H) и хлора (Cl). Химическая формула соляной кислоты дана как HCl, Молярная масса HCl составляет около 36,5 г / моль. Эта кислота представляет собой бесцветный раствор газообразного HCl в воде. Поскольку это сильная кислота, HCl является едким веществом, и при обращении с ним следует соблюдать осторожность.
Рисунок 01: Соляная кислота
HCl может пожертвовать один H+ ион на одну молекулу HCl, что означает, что она является монопротонной (способной высвобождать один протон). Реакция между HCl и водой может быть приведена ниже.
Реакция между HCl и водой может быть приведена ниже.
HCl + H2O → Cl– + H3О+
HCl имеет большую константу диссоциации кислоты (K). Эта кислота используется при определении концентрации основания посредством титрования. Это потому, что он легко диссоциирует из-за высокого К и Cl– ион образует соль с катионом основания.
NaOH,(Водно) + HCl(Водно) → NaCl(Водно) + H2О(Л)
В приведенной выше реакции NaOH является основанием, а NaCl является солью, образованной в результате реакции.
Кроме того, соляная кислота является мягким восстановителем. Он подвергается окислительно-восстановительным реакциям с сильными окислителями, такими как MnO2.
MnO2 (водно) + HCl(Водно) → MnCl2 (водно) + Cl2 (г) + H2О(Л)
Что такое серная кислота
Серная кислота является сильной кислотой, состоящей из атомов водорода (H), кислорода (O) и серы (S). молекулярная формула серной кислоты дается как H2ТАК4, Серная кислота является дипротоновой кислотой. Это означает, что он может выпустить два протона на молекулу. Молярная масса серной кислоты составляет около 98 г / моль. Это очень едкое решение. Но коррозионная активность зависит от его концентрации. Очень низкие концентрации не могут быть вредными.
молекулярная формула серной кислоты дается как H2ТАК4, Серная кислота является дипротоновой кислотой. Это означает, что он может выпустить два протона на молекулу. Молярная масса серной кислоты составляет около 98 г / моль. Это очень едкое решение. Но коррозионная активность зависит от его концентрации. Очень низкие концентрации не могут быть вредными.
Рисунок 01: Химическая структура серной кислоты
Молекула серы имеет две связи -O-H, которые очень полярны. Из-за этой полярности атомы H могут быть легко потеряны. ионизация серной кислоты происходит в два этапа.
ЧАС2ТАК4 (водно) + H2О(Л) → HSO4–(Водно) + H3О+(Водно)
HSO4–(Водно) + H2О(Л) → ТАК4-2(Водно) + H3О+(Водно)
Серная кислота является сильным окислителем в концентрированных условиях. Но когда он разбавлен, окислительная сила уменьшается. Например, при более высоких температурах концентрированная серная кислота может окислять Br– в Br2.
Но когда он разбавлен, окислительная сила уменьшается. Например, при более высоких температурах концентрированная серная кислота может окислять Br– в Br2.
2HBr(Водно) + H2ТАК4 (вод) → бром2 (водно) + ТАК2 (водно) + 2 ч2О(Л)
Разница между соляной кислотой и серной кислотой
Определение
Соляная кислота: Соляная кислота является сильной кислотой, состоящей из атомов водорода и хлора.
Серная кислота: Серная кислота является сильной кислотой, состоящей из атомов водорода, серы и кислорода.
Молярная масса
Соляная кислота: Молярная масса соляной кислоты составляет около 36,5 г / моль.
Серная кислота: Молярная масса серной кислоты составляет около 98 г / моль.
Выпуск Протона
Соляная кислота: Соляная кислота является монопротонной и выделяет один протон на молекулу.
Серная кислота: Серная кислота является дипротичной и выделяет два протона на молекулу.
Наличие групп -ОН
Соляная кислота: Соляная кислота не имеет -ОН групп.
Серная кислота: Серная кислота имеет две группы -ОН.
Химические свойства
Соляная кислота: Соляная кислота является мягким восстановителем.
Серная кислота: Серная кислота является сильным окислителем.
Заключение
Основное различие между соляной кислотой и серной кислотой состоит в том, что соляная кислота является монопротонной, тогда как серная кислота является дипротичной. Как соляная кислота, так и серная кислота очень важны в лабораторных условиях. Поскольку они являются кислотами, при обращении с этими растворами следует соблюдать осторожность.
Рекомендации:
1. «Соляная кислота». Соляная кислота — Энциклопедия Нового Света. Н.п., н.д. Web.
Химический молекулярный вес — более 100 миллионов химических соединений
Мгновенный молекулярный вес для более чем 100 миллионов соединений
Молекулярная масса химических соединений является одной из основных данных для исследований и разработок, которые часто доступны только на определенных веб-сайтах, связанных с химическими веществами, когда соединение не популярно. Для наших клиентов Mol-Instincts, , мы разработали автоматический процесс определения молекулярной массы химических соединений, доступных в Интернете. Молекулярная масса может быть мгновенно найдена с помощью поиска Google, пока Google их индексирует.
Для наших клиентов Mol-Instincts, , мы разработали автоматический процесс определения молекулярной массы химических соединений, доступных в Интернете. Молекулярная масса может быть мгновенно найдена с помощью поиска Google, пока Google их индексирует.
Общее количество переработанных химических соединений превышает 100 миллионов. Мы будем постоянно обновлять дополнительную информацию о молекулярном весе редких химических соединений.
Как найти молекулярную массу с помощью поиска Google
Найти информацию о молекулярном весе с помощью Google довольно просто. Просто введите текст ввода и добавьте «Mol-Instincts» на экране поиска Google.
Например, если вы хотите найти молекулярную массу холестерина, просто введите
Вы можете использовать другой текст вместо названия химического вещества (холестерин), например номер CAS или ключ InChI, или любую другую информацию, которая у вас может быть.
Что доступно
В дополнение к информации о молекулярной массе, основная молекулярная информация, такая как формула, химический идентификатор и т.д.г., имя ИЮПАК, SMILES String, InChI и т. д., а также предоставляются 2-мерные и 3-мерные изображения.
Щелкните следующую ссылку, чтобы перейти на пример страницы:
Пример страницы
Молекулярный вес холестерина — C27h56O | Мол-Инстинкты
Информационный веб-проект Mol-Instincts
Механизм генерации молекулярной массы был разработан как часть платформы Mol-Instincts для одновременной обработки миллионов химических соединений на автоматической основе, которая выполняется на параллельной вычислительной платформе, оснащенной тысячами процессорных ядер.
В настоящее время этот движок применяется для генерации информации о молекулярной массе, доступной в Интернете, с целью получения миллиардов химических молекулярных масс через несколько лет.
Рассчитайте молярную массу следующих веществ. (d) Соляная кислота, HCl
Нокаут NEET 2024
Персонализированный репетитор ИИ и адаптивное расписание, Материал для самообучения, Неограниченное количество пробных тестов и персонализированных аналитических отчетов, Круглосуточная поддержка в чате сомнений.
40000р/-
купить сейчасНокаут NEET 2025
Персонализированный репетитор ИИ и адаптивное расписание,
Материал для самообучения,
Неограниченное количество пробных тестов и персонализированных аналитических отчетов,
Круглосуточная поддержка в чате сомнений.
₹ 45000/-
купить сейчасФонд NEET + Нокаут NEET 2024
Персонализированный репетитор ИИ и адаптивное расписание, Материал для самообучения, Неограниченное количество пробных тестов и персонализированных аналитических отчетов, Круглосуточная поддержка в чате сомнений.
₹ 54999/- ₹ 42499/-
купить сейчасNEET Foundation + Knockout NEET 2024 (простой платеж)
Персонализированный репетитор ИИ и адаптивное расписание,
Материал для самообучения,
Неограниченное количество пробных тестов и персонализированных аналитических отчетов,
Круглосуточная поддержка в чате сомнений.
₹ 3999/-
купить сейчасNEET Foundation + Knockout NEET 2025 (простая оплата)
Персонализированный репетитор ИИ и адаптивное расписание, Материал для самообучения, Неограниченное количество пробных тестов и персонализированных аналитических отчетов, Круглосуточная поддержка в чате сомнений.
₹ 3999/-
купить сейчасМолярность 37% (вес/вес) соляной кислоты (HCl)
ОБЗОР
- 37% (вес/вес) соляная кислота представляет собой прозрачный бесцветный водный раствор газообразного хлороводорода (HCl).
 Его можно приобрести у многих коммерческих поставщиков.
Его можно приобрести у многих коммерческих поставщиков. - % относится к концентрации раствора в процентах, а «(мас./мас.)» относится к растворенному веществу и количеству раствора в граммах (т. е. в процентах по массе). Это означает, что 37% (вес/вес) соляная кислота содержит 37 г HCl на 100 г раствора.
- Плотность 37% (вес/вес) раствора соляной кислоты составляет 1,2 г/мл при 25°C. Это означает, что вес 1 мл раствора соляной кислоты составляет 1,2 г при 25°C.
- Молярность относится к числу молей растворенного вещества, присутствующего в 1 литре раствора.Чтобы рассчитать молярность 37% (вес./вес.) соляной кислоты (HCl), вам необходимо знать, сколько молей HCl содержится в 1 литре раствора.
- Проще говоря, 1 моль равен молекулярной массе вещества. Например, 1 моль хлористого водорода равен 36,46 г хлористого водорода (молекулярная масса: 36,46).
- Чтобы рассчитать молярность, нужно сначала рассчитать, сколько хлористого водорода содержится в 1 л 37%-ной соляной кислоты.
 Как только мы узнаем количество HCl, присутствующее в 1 л раствора, мы можем рассчитать молярность раствора, разделив количество HCl на молекулярную массу.
Как только мы узнаем количество HCl, присутствующее в 1 л раствора, мы можем рассчитать молярность раствора, разделив количество HCl на молекулярную массу. - калькулятор: преобразование процента по массе до моллюсков
| известных значений | |
| молярная масса хлорида водорода | |
| 36,46 г / моль | |
| концентрация соляной кислоты | 37 % (% по массе, вес/вес) |
| Плотность 37% соляной кислоты | 1,2 г/мл |
Формула:
Плотность = ВесОбъем
ИЛИ
Объем = Вес Плотность
Объем 100 г соляной кислоты: 1001,2 = 83,33 мл
Соляная кислота содержит 37 г HCl.
Объем 100 г соляной кислоты составляет 83,33 мл, что означает, что 37 г HCl присутствует в 83,33 мл соляной кислоты.
83,33 мл соляной кислоты содержит = 37 г HCl
1 мл соляной кислоты будут содержать = 3783,33 граммы HCl
1000 мл соляной кислоты будут содержать = 1000 x 3783.33 = 444,01776 грамм HCl
1000 мл Соляная кислота будет содержать 444,01776 г HCl.
Этап 3: Рассчитайте количество молей HCl в 444,01776 граммах HCl.36,46 г HCl соответствует 1 молю.
1 г HCl будет равен 136.46 молей.
444,01776 граммов хлористого водорода будет равно = 444,01776 x 136,46 = 12,178 молей
Следовательно, мы можем сказать, что 1 литр соляной кислоты содержит 12,178 молей HCl или, другими словами, молярность 37% (вес/вес) соляной кислоты кислоты равна 12,178 М.
Используйте калькулятор для расчета молярности концентрированной соляной кислоты (HCl), если концентрация указана в % по массе (масс./масс.)Хлористый водород (HCl) Молекулярная масса: 36,46 г/моль
Был ли этот пост полезен?
Дайте нам знать, если вам понравился пост.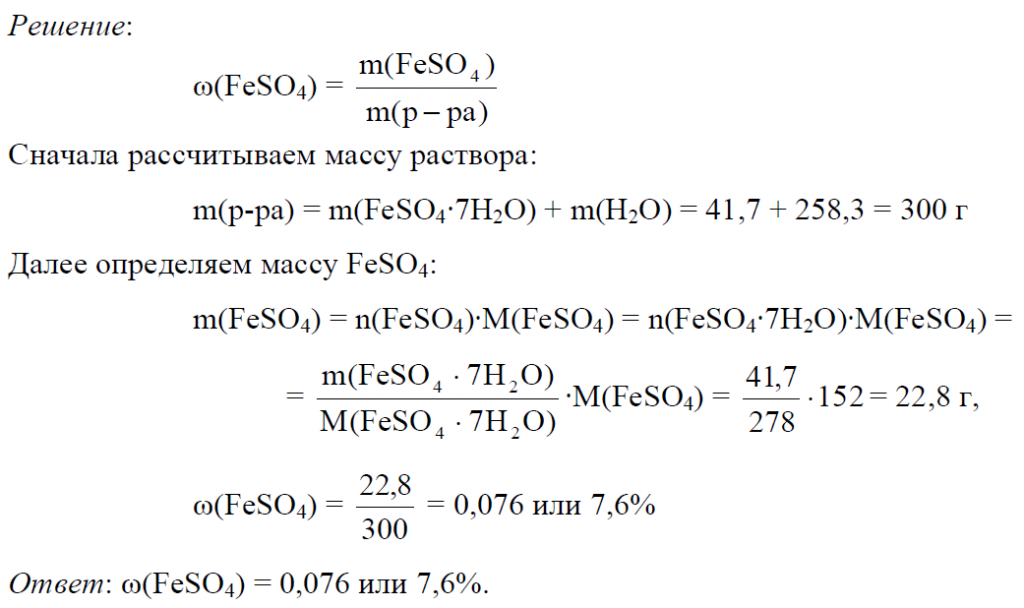 Только так мы можем стать лучше.
Только так мы можем стать лучше.
Сколько молей соляной кислоты?
Сколько моль соляной кислоты?
Основной единицей СИ для количества вещества является моль. 1 моль равен 1 молю HCl или 36,46094 грамма .
Какова масса соляной кислоты?
36,458 г/моль соляная кислота/Молярная масса
Какова масса 1 моль HCl?
36.46094 г/моль
Если формула, используемая при расчете молярной массы, является молекулярной формулой, вычисленная формула веса является молекулярной массой. Молярная масса HCl = 36,46 г/моль Молярная масса HCl = 36,46094 г/моль .
Сколько молей соляной кислоты содержится в 98,45 граммах?
›› Дополнительная информация в конвертере единиц измерения. Вы можете просмотреть более подробную информацию о каждой единице измерения: молекулярная масса соляной кислоты или моль. Молекулярная формула соляной кислоты — HCl.Базовой единицей СИ для количества вещества является моль. 1 грамм соляной кислоты равен 0,027426610504282 моль .
Чем опасна соляная кислота?
Соляная кислота вызывает разъедание глаз, кожи и слизистых оболочек . Острое (кратковременное) вдыхание может вызвать раздражение и воспаление глаз, носа и дыхательных путей, а также отек легких у людей.
Сколько весит 1 галлон соляной кислоты?
9. 83 фунта/галлон
Кислоты
83 фунта/галлон
Кислоты
| Уксусный ангидрид | 9 LB / GAL |
|---|---|
| 9.83 LB / GAL | |
| азотная кислота (67%) | 11.7 LB / GAL |
| Фосфорный Кислота (75%) | 13,12 фунт/галлон |
| Фосфорная кислота (85%) | 14,01 фунт/галлон |
Соляная кислота весит больше воды?
Удельный вес (плотность относительно плотности воды) раствора соляной кислоты равен 1.18 г/мл. Если взять 13,7 мл раствора соляной кислоты, то [13,7 мл x (1,18 г/мл) = 16,2 г — это масса раствора соляной кислоты… Расчеты для синтетических реакций с использованием сильной минеральной кислоты.
| Reagent | Плотность (г / мл) |
|---|---|
| 1,18 | |
| H3SO4 | 1. 84 84 |
| CH4CO2H | 1,06 |
Как получить 1 моль HCl?
Чтобы получить 1 л 1 моль/л HCl, мы берем 88 мл концентрированного раствора и добавляем воду, чтобы получить в общей сложности 1 л…. Предположим, что мы хотим приготовить 1 л 1 моль/л HCl.
- Рассчитайте необходимое количество молей HCl. …
- Рассчитайте необходимую массу HCl. …
- Рассчитайте требуемую массу раствора.
Сколько молей в 10 граммах HCl?
›› Дополнительная информация от конвертера величин Ответ: 36.46094 . Мы предполагаем, что вы конвертируете между граммами HCl и молями. Вы можете просмотреть более подробную информацию о каждой единице измерения: молекулярная масса HCl или моль. Это соединение также известно как соляная кислота. Базовой единицей СИ для количества вещества является моль.
Вы можете просмотреть более подробную информацию о каждой единице измерения: молекулярная масса HCl или моль. Это соединение также известно как соляная кислота. Базовой единицей СИ для количества вещества является моль.
Какова молекулярная масса соляной кислоты?
Соляная кислота: Молекулярный вес/ Молярная масса: 36,458 г/моль: Внешний вид: Прозрачная жидкость: Точка кипения: Зависит от концентрации: Точка плавления: Зависит от концентрации
Что нужно знать о соляной кислоте?
Соляная кислота — HCl 1 Структура соляной кислоты — HCl 2 Получение соляной кислоты — HCl…. 3 кислоты HCl в желудке. … 4 Рекомендуемые видео 5 Свойства соляной кислоты – HCl. … 6 Применение HCl (соляная кислота) Для чего используется соляная кислота? …
Почему соляная кислота имеет резкий запах?
Соляная кислота или соляная кислота представляет собой бесцветную неорганическую химическую систему с формулой HCl. Соляная кислота имеет характерный резкий запах. Он классифицируется как сильнокислотный и может воздействовать на кожу в широком диапазоне состава, поскольку хлористый водород полностью диссоциирует в водном растворе.
Соляная кислота имеет характерный резкий запах. Он классифицируется как сильнокислотный и может воздействовать на кожу в широком диапазоне состава, поскольку хлористый водород полностью диссоциирует в водном растворе.
Сколько молей в литре HCl?
Молекулярная масса HCl составляет 36,5. Следовательно, у вас есть 420/36,5 моль/литр. Молярность 35% кислоты будет 11,51 моль. Теперь, поскольку HCl является сильной одноосновной кислотой, молярность и нормальность совпадают.
⇐ Почему у человека с кровотечением низкое гидростатическое давление? Что сделал древний моряк в «Иней древнего мореплавателя», что навлекло на него проклятие? ⇒Похожие сообщения:
2.10: Процентный состав — Химия LibreTexts
Процентный состав играет важную роль в повседневной жизни. Это больше, чем просто количество хлора в вашем бассейне, потому что это касается всего: от денег в вашем кармане до вашего здоровья и образа жизни. Следующие два раздела описывают процентный состав применительно к вам.
Следующие два раздела описывают процентный состав применительно к вам.
Этикетки пищевой ценности
Этикетка пищевой ценности, которую можно найти на упаковке каждого кусочка обработанных пищевых продуктов, продаваемых в местном продуктовом магазине, использует идею процентного состава.На всех этикетках пищевых продуктов известный размер порции разбит на пять категорий: общий жир, холестерин, натрий, общее количество углеводов и белок. Эти категории разбиты на дополнительные подкатегории, включая насыщенные жиры и пищевые волокна. Масса для каждой категории, кроме белка, затем преобразуется в процент от дневной нормы. Только две подкатегории, насыщенные жиры и пищевые волокна, преобразуются в проценты от дневной нормы. Дневная норма основана на массе каждой категории, рекомендуемой в день на человека при диете в 2000 калорий.Масса белка не конвертируется в проценты, потому что это не рекомендуемая дневная норма белка. Ниже приведена фотография, иллюстрирующая эти идеи.
Например, если вы хотите узнать процент по массе дневной нормы натрия, которую вы съедаете, когда съедаете одну порцию продукта с этой этикеткой пищевой ценности, перейдите в категорию с пометкой «Натрий». Посмотрите на ту же строку и прочитайте написанный процент. Если вы съедите одну порцию этой пищи, то вы употребите около 9% рекомендуемой дневной нормы натрия.Чтобы найти массовый процент жира во всей пище, вы можете разделить 3,5 грамма на 15 граммов и увидеть, что эта закуска содержит 23,33% жира.
Пенни: счастливая медная монета
Пенни следует называть «счастливая медная монета с покрытием ». Пенни не делали из твердой меди с 1857 года. После 1857 года правительство США начало добавлять в смесь другие более дешевые металлы. Пенни, будучи всего лишь одним центом, буквально не стоит своего веса в меди. Люди могли плавить медные пенни и продавать медь дороже, чем стоили эти пенни.После 1857 года никель смешивали с более дорогой медью. После 1864 года пенни стали делать из бронзы. Бронза состоит из 95% меди и 5% цинка и олова. В течение одного 1943 года в пенни не было меди из-за расходов на Вторую мировую войну. Это была просто оцинкованная сталь. С 1943 по 1982 год у пенни были периоды, когда он был латунным или бронзовым.
После 1864 года пенни стали делать из бронзы. Бронза состоит из 95% меди и 5% цинка и олова. В течение одного 1943 года в пенни не было меди из-за расходов на Вторую мировую войну. Это была просто оцинкованная сталь. С 1943 по 1982 год у пенни были периоды, когда он был латунным или бронзовым.
Сегодня пенни в Америке состоит из 2,5% меди и 97,5% цинка. Медь покрывает внешнюю часть пенни, а внутренняя часть покрыта цинком.Для сравнения, пенни в Канаде состоит из 94% стали, 1,5% никеля и 4,5% меди.
Процентный состав монетки может реально влиять на здоровье, особенно на здоровье маленьких детей и домашних животных. Поскольку новые пенни сделаны в основном из цинка, а не из меди, они представляют опасность для здоровья ребенка при проглатывании. Цинк очень чувствителен к кислоте. Если тонкое медное покрытие поцарапать и соляная кислота, присутствующая в желудке, вступит в контакт с цинковым сердечником, это может вызвать язву, анемию, повреждение почек и печени, а в тяжелых случаях даже смерть. Три важных фактора при проглатывании пенни — это время, pH желудка и количество проглоченных пенни. Конечно, чем больше копеек проглочено, тем больше опасность передозировки цинка. Чем кислее среда, тем больше цинка высвобождается за меньшее время. Затем этот цинк поглощается и отправляется в печень, где начинает наносить ущерб. В такой ситуации время имеет решающее значение. Чем быстрее удаляется копейка, тем меньше цинка усваивается. Если пенни или пенни не удалить, может произойти отказ органов и смерть.
Три важных фактора при проглатывании пенни — это время, pH желудка и количество проглоченных пенни. Конечно, чем больше копеек проглочено, тем больше опасность передозировки цинка. Чем кислее среда, тем больше цинка высвобождается за меньшее время. Затем этот цинк поглощается и отправляется в печень, где начинает наносить ущерб. В такой ситуации время имеет решающее значение. Чем быстрее удаляется копейка, тем меньше цинка усваивается. Если пенни или пенни не удалить, может произойти отказ органов и смерть.
Ниже приведено изображение поцарапанной монеты до и после того, как она была погружена в лимонный сок. Лимонный сок имеет аналогичный pH 1,5-2,5 по сравнению с нормальным человеческим желудком после употребления пищи. Прошедшее время: 36 часов.
Как видите, лимонный сок почти не повреждает медь. Вот почему пенни, изготовленные до 1982 года, в основном из меди (кроме пенни 1943 года), относительно безопасно глотать. Скорее всего, они пройдут через пищеварительную систему естественным путем, прежде чем можно будет нанести какой-либо ущерб. Тем не менее, ясно, что цинк частично растворился, хотя он находился в лимонном соке лишь ограниченное время. Следовательно, процентный состав пенни после 1982 года опасен для вашего здоровья и здоровья ваших домашних животных при попадании внутрь. Чтобы узнать больше о кислотах и основаниях, проверьте здесь: wiki.
Тем не менее, ясно, что цинк частично растворился, хотя он находился в лимонном соке лишь ограниченное время. Следовательно, процентный состав пенни после 1982 года опасен для вашего здоровья и здоровья ваших домашних животных при попадании внутрь. Чтобы узнать больше о кислотах и основаниях, проверьте здесь: wiki.
Видеоурок: Процентный состав уксусной кислоты
видео-учебник: Процентный состав ацетилена и бензола
Примечание: ацетилен и бензол имеют одинаковый процентный состав, однако это не означает, что они являются одним и тем же веществом.
Пример \(\PageIndex{1}\)
Масса одного пенни 2,5 грамма. Сколько пенни может сделать правительство США из 20,0 кг меди, если массовый процент меди в современном пенни составляет 2,5%?
Дано: Мы знаем, что начинаем с 20,0 кг чистой меди. Нам известен массовый процентный состав чистой меди в копеечной смеси. Мы также знаем массу каждого пенни.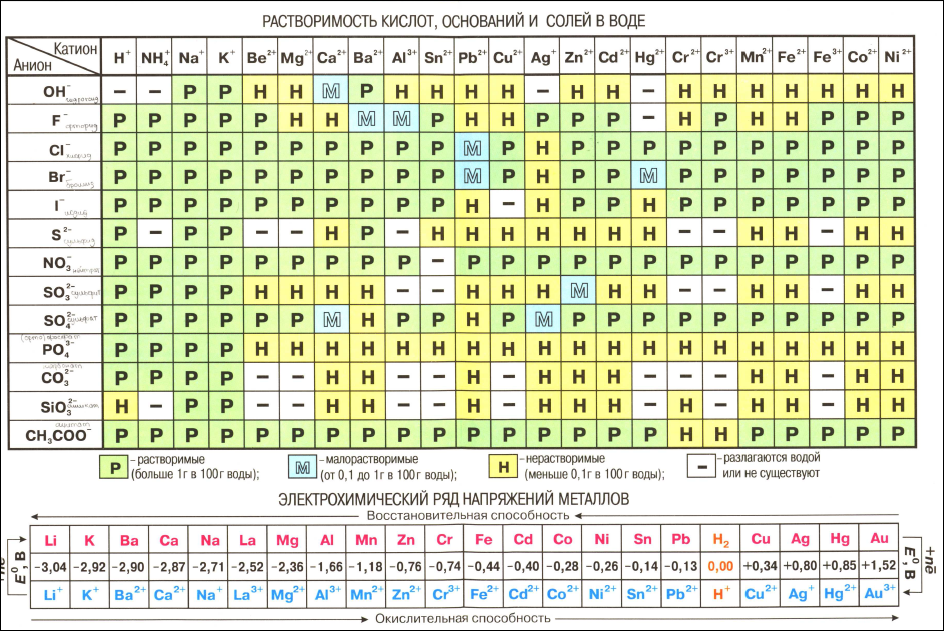
Стратегия: Нам нужно вычислить массу медной смеси, которую мы можем сделать из 20.0 кг чистой меди, используя массовый процентный состав меди в пенни смеси. Отсюда мы можем определить, сколько отдельных пенни мы можем сделать из этой смеси.
Раствор
Пример \(\PageIndex{2}\)
Какова масса углерода, содержащегося в 3,0 г бутана (C 4 H 10 ), жидкости для зажигалок?
Дано: масса целого (бутана), какова масса части (углерода)?
Стратегия: использовать формулы состава в процентах по массе для преобразования массы бутана в массу углерода:
Раствор
Молекулярная масса вещества
Молекулярная масса вещества, также называемая молярной массой , M, представляет собой массу 1 моля этого вещества, выраженную в M граммах.
В системе СИ единицей измерения М является [кг/кмоль], в английской системе единицей измерения является [фунт/фунт-моль], а в системе СГ единицей измерения М является [г/моль]. Молекулярная масса представлена одним и тем же числом во всех системах единиц независимо от используемой системы. По этой причине во многих случаях единица молекулярной массы не упоминается; однако следует понимать, что это не безразмерный параметр.
Молекулярная масса представлена одним и тем же числом во всех системах единиц независимо от используемой системы. По этой причине во многих случаях единица молекулярной массы не упоминается; однако следует понимать, что это не безразмерный параметр.
Молекулярная масса чистого соединения определяется по его химической формуле и атомному весу его элементов.Атомные массы элементов, обнаруженных в органических веществах: C = 12,011, H = 1,008, S = 32,065, O = 15,999 и N = 14,007.
Пример: Молекулярная масса этанола (C 2 H 5 OH)
Для расчета молекулярной массы этанола суммируется молекулярная масса каждого атома в молекуле:
M этанол = 2*12,011[кг/кмоль] + 6*1,008[кг/кмоль] + 1*15,999 [кг/кмоль] = 46,069 [кг/кмоль]
См. также Физические данные для углеводородов, Физические данные для спиртов и карбоновых кислот, Физические данные для органических азотных соединений и физических данных для органических соединений серы
| вещество | 4|||
|---|---|---|---|
| ацетилен , С 2 Н 2 | 26. 038 038 | ||
| Air | 28.966 | ||
| 17.02 | 17.02 | ||
| 39.948 | 39.948 | ||
| Benzene | 78.114 | 78.114 | |
| N — Бутан, C 4 H 10 10 | 58.124 | ||
| 1,2 — Бутадиен | 54 — Butadiene | 54.092 | 54.092 |
| 1-Butene | 56.108 | 56.108 | |
| CIS -2-Butene | 56.108 | ||
| Trans-2-Butene | 56.108 | 56.101 | |
| Butylene | 56.06 | ||
| Dioxide Carbon, CO 2 | 44.01 | ||
| Devulphide | |||
| 76.13 | |||
| Углерод , CO | 28.011 | ||
| 70.906 | |||
| Cyclogexane | 84. 162 162 | ||
| Cyclopentane | 70.135 | ||
| N — Decane | 142.286 | ||
| 2,3 — диметилбутан | 86.178 | 86.178 | |
| 2,2 — Dimethelpentane | 100.205 | ||
| Диисобутил | 114.232 | ||
| Duoderane | 170.21 | 17021 | |
| Этан, C 2 H 6 | 30.070 | ||
| Ethen | 28.05 | ||
| этиловый спирт | 46.07 | ||
| Ethylbenzene | 106.168 | 106.168 | |
| 64.515 | |||
| 3 — этилпентан | 100.205 | ||
| Eltylene, C 2 H 4 | 28.054 | ||
| фтор | 37.996 | 37.996 | |
| Гелий, HE | 4. 002602 002602 | ||
| N — Heptane | 100.205 | ||
| N — Hexane | 86.178 | ||
| 3647 | 9647 | ||
| 2 0 9 | 2.016 | ||
| 2961 | 36.461 | ||
| сероводород | 34.076 | ||
| Гидроксил, ОН | 17.01 | ||
| Isobutane (2-метилпропан) | 58.124 | ||
| Isobutene | 56.108 | ||
| изооктан | 210,63 | ||
| изопентан | 72,151 | ||
| изопрен | 68,119 | ||
| изопропилбензола | 120,195 | ||
| Криптон | 83,80 | ||
| Метан, CH 4 | 16.043 | ||
| Спирт метиловый | 32.04 | ||
| Бутан метиловый | 72.15 | ||
| Метил Chloride | 50,488 | ||
| метилциклогексан | 98,189 | ||
| метилциклопентан | 84,162 | ||
| 2 — метилгексан | 100,205 | ||
| 2 — метилпентане | 86,178 | ||
| Природный газ | 19,00 | ||
| Неон, Ne | 20,179 | ||
| Неогексан | 86. 178 178 | ||
| неопентан | 72,151 | ||
| оксид азота, NO | 30,006 | ||
| Азот, N 2 | 28,0134 | ||
| Закись азота, N 2 О | 44,013 | ||
| N — Nonane | 128.259 | ||
| N — Octane | 114.232 | 114.232 | |
| Oxygen, O 2 | 31.9988 | ||
| Озон | 47.998 | ||
| n — Pentane | 72.151 | 92.151 | |
| 700102 | 70.08 | ||
| Пропан, C 3 H 8 9 | 44.097 | ||
| Propene | 42.081 | ||
| Пропилен | 42.08 | ||
| R-11 | |||
| 137.37 | 137.37 | ||
| R-12 | 120.92 | 120101 | |
| R-22 | 86.48 | ||
| R-114 | 170.93 | ||
| R-123 | 152. 93 93 | ||
| R-134A | 102.03 | ||
| R-611 | 60.05 | ||
| 104.152 | |||
| 32.02 | |||
| диоксид серы (диоксид серы) | 64.06 | 64.06 | |
| 80102 | 48.1 | ||
| Толуол, толуол | 92.141 | 92.141 | |
| Tritptane | 100.205 | ||
| Xenon | 131.30 | 131.30 | |
| O — Xylole, Xylol | 106.168 | ||
| Водяной пар — Steam, H 2 o | 18.02 |
Как вы найдете массу HCl? – Easyrwithpractice.com
Как найти массу HCl?
Молярная масса соляной кислоты или HCl = 1 + 35,5 = 36,5 гмоль-1. Следовательно, молярная масса HCl составляет 36,5 гмоль-1.
Какова масса 2HCl?
72.9219
Какова атомная масса HCl в граммах?
36,46 г/моль
Какова молярная масса гидрохлорида?
36,46 г/моль
Как мы можем найти молекулярную массу?
Расчет молекулярной массы образца Используя периодическую таблицу элементов для определения атомной массы, мы находим, что водород имеет атомную массу 1, а атомная масса кислорода равна 16. Чтобы рассчитать молекулярную массу одной молекулы воды, мы добавляем вклады от каждый атом; то есть 2(1) + 1(16) = 18 грамм/моль.
Чтобы рассчитать молекулярную массу одной молекулы воды, мы добавляем вклады от каждый атом; то есть 2(1) + 1(16) = 18 грамм/моль.
Содержит ли соляная кислота воду?
Соляная кислота представляет собой водный раствор газообразного хлороводорода на водной основе. Он также является основным компонентом желудочной кислоты, которая естественным образом вырабатывается в желудке человека и помогает переваривать пищу.
Уксус и соль образуют соляную кислоту?
В стакане № 4 при смешивании уксуса и соли получается соляная кислота. Это растворяет соединение меди. Когда в уксус добавляется соль, он способен очистить пенни.
Можно ли пить соляную кислоту?
Введение: Проглатывание растворов соляной кислоты (Salfumant/Salfuman) представляет собой относительно частую чрезвычайную ситуацию в нашей среде. Это сильная кислота, очень едкая, проглатывание которой вызывает очень серьезный некроз желудочно-кишечного тракта.
Можно ли купить соляную кислоту?
Alliance Chemical Соляная кислота высокой чистоты — 1 кварта — соляная кислота 20 Be: Amazon. com: Industrial & Scientific.
com: Industrial & Scientific.
Можно ли купить соляную кислоту в Walmart?
1 кварта / 950 мл бутылка концентрированной соляной / соляной кислоты для очистки бетона — Walmart.com — Walmart.com.
Можно ли купить соляную кислоту в Home Depot?
Соляная кислота — Водонагреватели — Сантехника — The Home Depot.
Является ли уксус соляной кислотой?
Мы знаем, что в электролитах важна концентрация ионов, и чем выше концентрация, тем выше будет проводимость раствора.Но химики описывают соляную кислоту как струнную кислоту, а уксус (или уксусную/этановую кислоту) как слабую кислоту.
Чем заменить соляную кислоту?
Если вам нужна кислая среда, но вы не можете использовать соляную кислоту, вы можете использовать уксус (то есть уксусную кислоту). Уксусную кислоту иногда используют в химических экспериментах из-за старого эмпирического правила химии: все ацетатные соли растворимы в воде.
Можно ли сделать соляную кислоту дома?
Сначала вы насыпаете немного соли в дистилляционную колбу. После этого вы добавите в соль немного концентрированной серной кислоты. Далее вы позволите им реагировать друг с другом. Вы начнете видеть, как газы начинают пузыриться, а избыток хлористого водорода выходит через верхнюю часть трубки.
После этого вы добавите в соль немного концентрированной серной кислоты. Далее вы позволите им реагировать друг с другом. Вы начнете видеть, как газы начинают пузыриться, а избыток хлористого водорода выходит через верхнюю часть трубки.
Делает ли соль уксус более кислым?
Делает ли соль уксус более кислым? – Квора. Нет, соль (NaCl) является нейтральным соединением. То есть это не повлияет на рН водного раствора. Чтобы сделать уксус (уксусную кислоту) более кислым, вам нужно увеличить его способность к ионизации (уксусная кислота — слабая кислота, поэтому она не полностью ионизируется в растворе).
Кипячение уксуса делает его более кислым?
В хозяйственном уксусе содержится несколько % уксусной кислоты (3-5%), при кипячении и вода, и кислота будут испаряться (поэтому будет сильно пахнуть уксусом). Точка кипения уксусной кислоты выше, чем у воды (около 118°С), поэтому концентрация уксусной кислоты и, следовательно, кислотность должны увеличиваться.
Что будет, если выпить уксус?
Из-за высокой кислотности употребление большого количества яблочного уксуса может повредить зубы, повредить горло и вызвать расстройство желудка.
Что будет, если смешать уксус с солью?
Уксусная кислота уксуса реагирует с солью или хлоридом натрия с образованием ацетата натрия и хлороводорода.
Что будет, если положить под кровать соль и уксус?
Согласно ее сообщению, белый уксус и соль под кроватью очищают комнату от плохой энергии. Однако, когда вы якобы смешиваете коричневый уксус и соль, это показывает вам негативную энергию в комнате.
Что будет, если смешать уксус и сахар?
При попадании уксуса на сахарную пудру реакции не происходит.Уксус и пищевая сода вызывают химическую реакцию, и они будут шипеть и пузыриться по мере образования углекислого газа.
Можно ли смешивать уксус и английскую соль?
Суть в том, что смешивание уксуса с английской или поваренной солью и жидким моющим средством не дает безопасного и эффективного средства от сорняков.
Можно ли мочить ноги в уксусе?
Противогрибковые свойства также делают ванночки с уксусом хорошей идеей для людей, страдающих грибком ногтей на ногах. Замачивайте ноги на 10–15 минут в день в ванночке с уксусом, пока инфекция не пройдет.Вы можете постепенно увеличивать продолжительность замачивания. Может пройти две-три недели или больше, прежде чем вы заметите улучшение симптомов.
Замачивайте ноги на 10–15 минут в день в ванночке с уксусом, пока инфекция не пройдет.Вы можете постепенно увеличивать продолжительность замачивания. Может пройти две-три недели или больше, прежде чем вы заметите улучшение симптомов.
Что вы смешиваете с английской солью для уничтожения сорняков?
Соль Эпсома действует как средство от сорняков двумя способами. Одна смесь представляет собой несколько столовых ложек английской соли, смешанных с теплой водой. Другая смесь требует 1 ст. английской соли, 1 галлон уксуса и небольшое количество средства для мытья посуды.
Убивает ли уксус навсегда сорняки?
Да, уксус убивает сорняки навсегда! Но не всегда, особенно если у растения мощная налаженная корневая система.Использование уксуса для уничтожения сорняков — это естественный и эффективный способ избавиться от сорняков на газоне или в саду без особого ручного труда или использования инструментов для выдергивания сорняков.
Как навсегда остановить рост сорняков?
Как остановить рост сорняков?
- Удаляйте сорняки с корнем, чтобы они не выросли снова.

- Мульча, мульча, мульча.
- Трава после дождя.
- Удостоверьтесь, что вы вырываете верхушки сорняков, прежде чем они успеют пустить семена и распространиться по саду.
- Обратите внимание на промежутки между растениями.
Сколько времени требуется соли, чтобы убить сорняки?
Соль становится эффективным водорастворимым средством от сорняков. Это облегчает поглощение сорняками, а соли проникают глубоко в растение и нарушают его цикл роста. Чтобы увидеть эффективность соли на сорняках, может потребоваться до 10 дней.
Что убивает сорняки до корня?
старая поваренная соль
Убьет ли wd40 растения?
Не позволяйте надоедливым колючим сорнякам, таким как бычок и чертополох, испортить ваш двор или сад.Просто распылите на них немного WD-40, и они засохнут и умрут. WD-40 — отличный вытеснитель воды, плохая смазка и очень плохой убийца недели. Соль. Соль — это простой и естественный способ уничтожить сорняки, траву или любые нежелательные растения.
Убьет ли яблочный уксус сорняки?
Исследователи Министерства сельского хозяйства США (USDA) обнаружили, что уксус может эффективно убивать растения (включая сорняки и цветы). При 5-процентной концентрации уксусной кислоты, обычно содержащейся в домашнем уксусе, включая яблочный уксус, уксус уничтожал сорняки в течение первых двух недель после появления всходов.
Убивает ли пищевая сода сорняки?
Пищевая сода, также называемая бикарбонатом натрия, является эффективным средством для уничтожения сорняков за счет повышения солености или соли. При воздействии переизбытка соли сорняки не могут выжить. На внутренних двориках, дорожках и подъездных дорожках нанесите пищевую соду, подметая ее в трещины, в которых растут сорняки.
.

 металлов. В смеси с поверхностно-активными веществами используется для очистки керамических и металлических изделий (тут необходима ингибированная кислота) от загрязнений и дезинфекции.
металлов. В смеси с поверхностно-активными веществами используется для очистки керамических и металлических изделий (тут необходима ингибированная кислота) от загрязнений и дезинфекции. Его можно приобрести у многих коммерческих поставщиков.
Его можно приобрести у многих коммерческих поставщиков. Как только мы узнаем количество HCl, присутствующее в 1 л раствора, мы можем рассчитать молярность раствора, разделив количество HCl на молекулярную массу.
Как только мы узнаем количество HCl, присутствующее в 1 л раствора, мы можем рассчитать молярность раствора, разделив количество HCl на молекулярную массу.