Молярный объём — Википедия
Материал из Википедии — свободной энциклопедии
Моля́рный объём Vm — отношение объёма вещества к его количеству, численно равен объёму одного моля вещества. Термин «молярный объём» может быть применен к простым веществам, химическим соединениям и смесям. В общем случае он зависит от температуры, давления и агрегатного состояния вещества. Молярный объем также можно получить делением молярной массы M вещества на его плотность ρ: таким образом, Vm = V/n = M/ρ. Молярный объём характеризует плотность упаковки молекул в данном веществе. Для простых веществ иногда используется термин атомный объём[1].
В Международной системе единиц (СИ) единицей измерения молярного объёма является кубический метр на моль (русское обозначение: м3/моль; международное: m3/mol).
Для смеси веществ, при расчете молярного объёма, количеством вещества считают сумму количеств всех веществ, составляющих смесь. Если известна плотность плотность смеси ρ
- Vm=V∑ni=M¯ρc=∑i=1NxiMiρc.{\displaystyle V_{\rm {m}}={\frac {V}{\sum n_{i}}}={\frac {\overline {M}}{\rho _{\mathrm {c} }}}={\frac {\displaystyle \sum _{i=1}^{N}x_{i}M_{i}}{\rho _{\mathrm {c} }}}.}
Согласно закону Авогадро, одинаковые количества газов при одинаковых условиях занимают одинаковый объём. Молярный объём идеального газа рассчитается по формуле, выводящейся из уравнения состояния идеального газа
- Vm=RTp{\displaystyle V_{\rm {m}}={\frac {RT}{p}}},
где T — термодинамическая температура, p — давление, R — универсальная газовая постоянная.
При нормальных условиях (T = 273,15 K, p = 101 325 Па) молярный объем газов Vm = 22,41396954… л/моль[2]. Молярные объёмы реальных газов в той или иной степени отличаются от молярного объёма идеального газа, однако во многих случаях для практических вычислений отклонениями от идеальности можно пренебречь.
Объём Vя элементарной ячейки кристалла можно вычислить из параметров кристаллической структуры, которые определяются с помощью рентгеноструктурного анализа. Объём ячейки связан с молярным объёмом следующим образом:
- Vm = VяNA/Z,
где Z — количество формульных единиц в элементарной ячейке.
Значения молярного объёма химических элементов[править | править код]
Ниже приведены значения молярного (атомного) объёма простых веществ в см3/моль (10−6 м3/моль, 10−3 л/моль) при нормальных условиях либо (для элементов, газообразных при н.у.) при температуре конденсации и нормальном давлении.
| Группа | I A (1) | II A (2) | III B (3) | IV B (4) | V B (5) | VI B (6) | VII B (7) | VIII B (8) | VIII B (9) | VIII B (10) | I B (11) | II B (12) | III A (13) | IV A (14) | V A (15) | VI A (16) | VII A (17) | VIII A (18) | |
| Период | |||||||||||||||||||
| 1 | H 14,0 | He 31,8 | |||||||||||||||||
| 2 | Li 13,1 | Be 5 | B 4,6 | C 5,3 | N 17,3 | O 14 | F 17,1 | Ne 16,8 | |||||||||||
| 3 | Na 23,7 | Mg 14 | Al 10 | Si 12,1 | P 17 | S 15,5 | Cl 18,7 | 24,2 | |||||||||||
| 4 | K 45,3 | Ca 29,9 | Sc 15 | Ti 10,6 | V 8,35 | Cr 7,23 | Mn 7,39 | Fe 7,1 | Co 6,7 | Ni 6,6 | Cu 7,1 | Zn 9,2 | Ga 11,8 | Ge 13,6 | As 13,1 | Se 16,5 | Br 23,5 | Kr 32,2 | |
| 5 | Rb 55,9 | Sr 33,7 | Y 19,8 | Zr 14,1 | Nb 10,8 | Mo 9,4 | Tc 8,5 | Ru 8,3 | Rh 8,3 | Pd 8,9 | Ag 10,3 | Cd 13,1 | In 15,7 | Sn 16,3 | Sb 18,4 | Te 20,5 | I 25,7 | Xe 42,9 | |
| 6 | Cs 70 | Ba 39 | * | Hf 13,6 | Ta 10,9 | W 9,53 | Re 8,85 | Os 8,43 | Ir 8,54 | Pt 9,1 | Au 10,2 | 14,8 | Tl 17,2 | Pb 18,3 | Bi 21,3 | Po 22,7 | At н/д | Rn н/д | |
| 7 | Fr н/д | Ra 45 | ** | Rf н/д | Db н/д | Sg н/д | Bh н/д | Hs н/д | Mt н/д | Ds н/д | Rg н/д | Cn н/д | Nh н/д | Fl н/д | Mc н/д | Lv н/д | Ts н/д | Og н/д | |
| Лантаноиды | * | La 22,5 | Ce 21 | Pr 20,8 | Nd 20,6 | Pm 19,96 | Sm 19,9 | Eu 28,9 | Gd 19,9 | Tb 19,2 | Dy 19 | Ho 18,7 | Er 18,4 | Tm 18,1 | Yb 24,8 | Lu 17,8 | |||
| Актиноиды | ** | Ac 22,54 | Th 19,8 | Pa 15 | U 12,5 | Np 21,1 | Pu 12,12 | 20,8 | Cm 18,28 | Bk 16,8 | Cf 16,5 | Es н/д | Fm н/д | Md н/д | No н/д | Lr н/д | |||
- ↑ Следует отметить, что для молекулярных кристаллов простых веществ молярный объём, определяемый через 1 моль молекул, не равен атомному объёму, поскольку количество атомов не равно количеству молекул. В этих случаях необходимо уточнять, относится ли указанная величина к молекулярному или к атомному молярному объёму. Так, атомный молярный объём иода (кристаллы, состоящие из двухатомных молекул I2) вдвое меньше молекулярного молярного объёма.
- ↑ CODATA Value: molar volume of ideal gas (273.15 K, 101.325 kPa)
Молярный объём — это… Что такое Молярный объём?
Моля́рный объём
— объём одного моля вещества, величина, получающаяся от деления молярной массы на плотность. Характеризует плотность упаковки молекул.Значение NA = 6,022…×1023 называется числом Авогадро в честь итальянского химика Амедео Авогадро. Это универсальная постоянная для мельчайших частиц любого вещества.
Именно такое количество молекул содержит 1 моль кислорода О2, такое же количество атомов в 1 моле железа (Fe), молекул в 1 моле воды H2O и т. д.
Согласно закону Авогадро, 1 моль идеального газа при нормальных условиях имеет один и тот же объём Vm = 22,413 996(39) л[1]. При нормальных условиях большинство газов близки к идеальным, поэтому вся справочная информация о молярном объёме химических элементов относится к их конденсированным фазам, если не оговорено обратное.
Значения молярного объёма химических элементов
| Группа | I A | II A | III B | IV B | V B | VI B | VII B | VIII B | VIII B | VIII B | I B | II B | III A | IV A | V A | VI A | VII A | VIII A | |
| Период | |||||||||||||||||||
| 1 | H 14,1 | He 31,8 | |||||||||||||||||
| 2 | Li 13,1 | Be 5 | B 4,6 | C 5,3 | N 17,3 | O 14 | F 17,1 | Ne 16,8 | |||||||||||
| 3 | Na 23,7 | Mg 14 | Al 10 | Si 12,1 | P 17 | S 15,5 | Cl 18,7 | Ar 24,2 | |||||||||||
| 4 | K 45,3 | Ca 29,9 | Sc 15 | Ti 10,6 | V 8,35 | Cr 7,23 | Mn 7,39 | Fe 7,1 | Co 6,7 | Ni 6,6 | Cu 7,1 | Zn 9,2 | Ga 11,8 | Ge 13,6 | As 13,1 | Se 16,5 | Br 23,5 | 32,2 | |
| 5 | Rb 55,9 | Sr 33,7 | Y 19,8 | Zr 14,1 | Nb 10,8 | Mo 9,4 | Tc 8,5 | Ru 8,3 | Rh 8,3 | Pd 8,9 | Ag 10,3 | Cd 13,1 | In 15,7 | Sn 16,3 | Sb 18,4 | Te 20,5 | I 25,7 | Xe 42,9 | |
| 6 | Cs 70 | Ba 39 | * | Hf 13,6 | Ta 10,9 | W 9,53 | Re 8,85 | Os 8,43 | Ir 8,54 | Pt 9,1 | Au 10,2 | Hg 14,8 | Tl 17,2 | Pb 18,3 | Bi 21,3 | Po 22,7 | At н/д | Rn н/д | |
| 7 | Fr н/д | Ra 45 | ** | Rf н/д | Db н/д | Sg н/д | Bh н/д | Hs н/д | Mt н/д | Ds н/д | Rg н/д | Cn н/д | Uut н/д | Fl н/д | Uup н/д | Lv н/д | Uus н/д | Uuo н/д | |
| Лантаноиды | * | La 22,5 | Ce 21 | Pr 20,8 | Nd 20,6 | Pm 19,96 | Sm 19,9 | Eu 28,9 | Gd 19,9 | Tb 19,2 | Dy 19 | Ho 18,7 | Er 18,4 | Tm 18,1 | Yb 24,8 | Lu 17,8 | |||
| Актиноиды | ** | Ac 22,54 | Th 19,8 | Pa 15 | U 12,5 | Np 21,1 | Pu 12,12 | Am 20,8 | Cm 18,28 | Bk н/д | Cf н/д | Es н/д | Fm н/д | Md н/д | No н/д | Lr н/д | |||
См. также
Примечания
Молярный объём — Википедия. Что такое Молярный объём
Материал из Википедии — свободной энциклопедииМоля́рный объём Vm — объём одного моля вещества (простого вещества, химического соединения или смеси) при данной температуре и давлении; величина, получающаяся от деления молярной массы M вещества на его плотность ρ: таким образом, Vm = M/ρ. Молярный объём характеризует плотность упаковки молекул в данном веществе. Для простых веществ иногда используется термин атомный объём[1].
В Международной системе единиц (СИ) единицей измерения молярного объёма является кубический метр на моль (русское обозначение: м3/моль; международное: m3/mol).
Молярный объём смеси
Молярный объём смеси веществ, имеющей плотность ρc и содержащей N компонентов с массовыми долями xi и молярными массами Mi, равен
- Vc=∑i=1NxiMiρc.{\displaystyle V_{\rm {c}}={\frac {\displaystyle \sum _{i=1}^{N}x_{i}M_{i}}{\rho _{\mathrm {c} }}}.}
Стандартный молярный объём
Согласно закону Авогадро, 1 моль идеального газа при нормальных условиях (T = 273,15 K, P = 101 325 Па) имеет один и тот же объём Vm = RT/P= 22,413962(13) л/моль[2], называемый молярным объёмом идеального газа (здесь T — абсолютная температура, P — давление, R — универсальная газовая постоянная).
Молярный объём кристаллов
Объём Vя элементарной ячейки кристалла можно вычислить из параметров кристаллической структуры, которые определяются с помощью рентгеноструктурного анализа. Объём ячейки связан с молярным объёмом следующим образом:
- Vm = VяNA/Z,
где Z — количество формульных единиц в элементарной ячейке.
Значения молярного объёма химических элементов
Ниже приведены значения молярного (атомного) объёма простых веществ в см3/моль (10−6 м3/моль, 10−3 л/моль) при нормальных условиях либо (для элементов, газообразных при н.у.) при температуре конденсации и нормальном давлении.
| Группа | I A (1) | II A (2) | III B (3) | IV B (4) | V B (5) | VI B (6) | VII B (7) | VIII B (8) | VIII B (9) | VIII B (10) | I B (11) | II B (12) | III A (13) | IV A (14) | V A (15) | VI A (16) | VII A (17) | VIII A (18) | |
| Период | |||||||||||||||||||
| 1 | H 14,0 | He 31,8 | |||||||||||||||||
| 2 | Li 13,1 | Be 5 | B 4,6 | C 5,3 | N 17,3 | O 14 | F 17,1 | Ne 16,8 | |||||||||||
| 3 | Na 23,7 | Mg 14 | Al 10 | Si 12,1 | P 17 | S 15,5 | Cl 18,7 | Ar 24,2 | |||||||||||
| 4 | K 45,3 | Ca 29,9 | Sc 15 | Ti 10,6 | V 8,35 | Cr 7,23 | Mn 7,39 | Fe 7,1 | Co 6,7 | Ni 6,6 | Cu 7,1 | Zn 9,2 | Ga 11,8 | Ge 13,6 | As 13,1 | Se 16,5 | Br 23,5 | Kr 32,2 | |
| 5 | Rb 55,9 | Sr 33,7 | Y 19,8 | Zr 14,1 | Nb 10,8 | Mo 9,4 | Tc 8,5 | Ru 8,3 | Rh 8,3 | Pd 8,9 | Ag 10,3 | Cd 13,1 | In 15,7 | Sn 16,3 | Sb 18,4 | Te 20,5 | I 25,7 | Xe 42,9 | |
| 6 | Cs 70 | Ba 39 | * | Hf 13,6 | Ta 10,9 | W 9,53 | Re 8,85 | Os 8,43 | Ir 8,54 | Pt 9,1 | Au 10,2 | Hg 14,8 | Tl 17,2 | Pb 18,3 | Bi 21,3 | Po 22,7 | At н/д | Rn н/д | |
| 7 | Fr н/д | Ra 45 | ** | Rf н/д | Db н/д | Sg н/д | Bh н/д | Hs н/д | Mt н/д | Ds н/д | Rg н/д | Cn н/д | Uut н/д | Fl н/д | Uup н/д | Lv н/д | Ts н/д | Og н/д | |
| Лантаноиды | * | La 22,5 | Ce 21 | Pr 20,8 | Nd 20,6 | Pm 19,96 | Sm 19,9 | Eu 28,9 | Gd 19,9 | Tb 19,2 | Dy 19 | Ho 18,7 | Er 18,4 | Tm 18,1 | Yb 24,8 | Lu 17,8 | |||
| Актиноиды | ** | Ac 22,54 | Th 19,8 | Pa 15 | U 12,5 | Np 21,1 | Pu 12,12 | Am 20,8 | Cm 18,28 | Bk н/д | Cf н/д | Es н/д | Fm н/д | Md н/д | No н/д | Lr н/д | |||
См. также
Примечания
- ↑ Следует отметить, что для молекулярных кристаллов простых веществ молярный объём, определяемый через 1 моль молекул, не равен атомному объёму, поскольку количество атомов не равно количеству молекул. В этих случаях необходимо уточнять, относится ли указанная величина к молекулярному или к атомному молярному объёму. Так, атомный молярный объём иода (кристаллы, состоящие из двухатомных молекул I2) вдвое меньше молекулярного молярного объёма.
- ↑ CODATA Value: molar volume of ideal gas (273.15 K, 101.325 kPa)
1.3.3. Моль, молярная масса, молярный объем
Одной из основных единиц в Международной системе единиц (СИ) является единица количества вещества – моль.
Моль – это такое количество вещества, которое содержит столько структурных единиц данного вещества (молекул, атомов, ионов и др.), сколько атомов углерода содержится в 0,012 кг (12 г) изотопа углерода 12С.
Учитывая, что значение абсолютной атомной массы для углерода равно m(C) = 1,99·1026 кг, можно рассчитать число атомов углерода NА, содержащееся в 0,012 кг углерода.
Моль любого вещества содержит одно и то же число частиц этого вещества (структурных единиц). Число структурных единиц, содержащихся в веществе количеством один моль равно 6,02·1023 и называется числом Авогадро (NА).
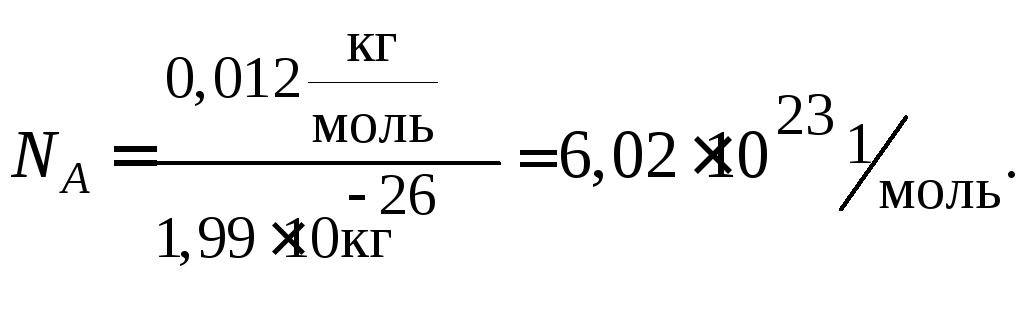
Например, один моль меди содержит 6,02·1023 атомов меди (Cu), а один моль водорода (H2) – 6,02·1023 молекул водорода.
Молярной массой (M) называется масса вещества, взятого в количестве 1 моль.
Молярная масса обозначается буквой М и имеет размерность [г/моль]. В физике пользуются размерностью [кг/кмоль].
В общем случае численное значение молярной массы вещества численно совпадает со значением его относительной молекулярной (относительной атомной) массы.
Например, относительная молекулярная масса воды равна:
Мr(Н2О) = 2Аr (Н) + Аr (O) = 2∙1 + 16 = 18 а.е.м.
Молярная масса воды имеет ту же величину, но выражена в г/моль:
М (Н2О) = 18 г/моль.
Таким образом, моль воды, содержащий 6,02·1023 молекул воды (соответственно 2·6,02·1023 атомов водорода и 6,02·1023 атомов кислорода), имеет массу 18 граммов. В воде, количеством вещества 1 моль, содержится 2 моль атомов водорода и один моль атомов кислорода.
1.3.4. Связь между массой вещества и его количеством
Зная массу вещества и его химическую формулу, а значит и значение его молярной массы, можно определить количество вещества и, наоборот, зная количество вещества, можно определить его массу. Для подобных расчетов следует пользоваться формулами:
ν = m / M,
m = ν · M,
где ν – количество вещества, [моль]; m – масса вещества, [г] или [кг]; М – молярная масса вещества, [г/моль] или [кг/кмоль].
Например, для нахождения массы сульфата натрия (Na2SO4) количеством 5 моль найдем:
1) значение относительной молекулярной массы Na2SO4, представляющую собой сумму округленных значений относительных атомных масс:
Мr(Na2SO4) = 2Аr(Na) + Аr(S) + 4Аr(O) = 142,
2) численно равное ей значение молярной массы вещества:
М(Na2SO4) = 142 г/моль,
3) и, наконец, массу 5 моль сульфата натрия:
m = ν · M = 5 моль · 142 г/моль = 710 г.
Ответ: 710.
1.3.5. Связь между объемом вещества и его количеством
При нормальных условиях (н.у.), т.е. при давлении р, равном 101325 Па (760 мм. рт. ст.), и температуре Т, равной 273,15 К (0С), один моль различных газов и паров занимает один и тот же объем, равный 22,4 л.
Объем, занимаемый 1 моль газа или пара при н.у., называется молярным объемом газа и имеет размерность литр на моль.
Vмол = 22,4 л/моль.
Зная количество газообразного вещества (ν) и значение молярного объема (Vмол) можно рассчитать его объем (V) при нормальных условиях:
V = ν · Vмол,
где ν – количество вещества [моль]; V – объем газообразного вещества [л]; Vмол = 22,4 л/моль.
И, наоборот, зная объем (V) газообразного вещества при нормальных условиях, можно рассчитать его количество (ν):
ν = V /Vмол.
Молярный объём Википедия
Моля́рный объём Vm — отношение объёма вещества к его количеству, численно равен объёму одного моля вещества. Термин «молярный объём» может быть применен к простым веществам, химическим соединениям и смесям. В общем случае он зависит от температуры, давления и агрегатного состояния вещества. Молярный объем также можно получить делением молярной массы M вещества на его плотность ρ: таким образом, Vm = V/n = M/ρ. Молярный объём характеризует плотность упаковки молекул в данном веществе. Для простых веществ иногда используется термин атомный объём[1].
В Международной системе единиц (СИ) единицей измерения молярного объёма является кубический метр на моль (русское обозначение: м3/моль; международное: m3/mol).
Молярный объём смеси[ | ]
Для смеси веществ, при расчете молярного объёма, количеством вещества считают сумму количеств всех веществ, составляющих смесь. Если известна плотность плотность смеси ρc, мольные доли компонентов xi и их молярные массы Mi, молярный объём смеси можно найти как отношение средней молярной массы смеси (суммы молярных масс её компонентов, умноженных на их мольные доли) к плотности смеси.
- Vm=V∑ni=M¯ρc=∑i=1NxiMiρc.{\displaystyle V_{\rm {m}}={\frac {V}{\sum n_{i}}}={\frac {\overline {M}}{\rho _{\mathrm {c} }}}={\frac {\displaystyle \sum _{i=1}^{N}x_{i}M_{i}}{\rho _{\mathrm {c} }}}.}
Молярный объём газов[ | ]
Согласно закону Авогадро, одинаковые количества газов при одинаковых условиях занимают одинаковый объём. Молярный объём идеального газа рассчитается по формуле, выводящейся из уравнения состояния идеального газа
- Vm=RTp{\displaystyle V_{\rm {m}}={\frac {RT}{p}}},
где T — термодинамическая температура, p — давление, R — универсальная газовая постоянная.
При нормальных условиях (T = 273,15 K, p = 101 325 Па) молярный объем газов Vm = 22,41396954… л/моль[2]. Молярные объёмы реальных газов в той или иной степени отличаются от молярного объёма идеального газа, однако во многих случаях для практических вычислений отклонениями от идеальности можно пренебречь.
Молярный объём кристаллов
Молярный объем
Молярный объём – это объём 1 моль вещества. Понятие молярного объема применимо для газов. Например, если взять 1 моль воды, то мы не взвешиваем на весах 18 г воды, т.к. это совершенно неудобно, а зная, что плотность воды 1 г/мл, мы измеряем её объем цилиндром или мензуркой.

Молярный объем воды в таком случае будет равен 18 мл/моль. Молярный объём твёрдых веществ и жидкостей зависит от их плотности. Молярный объём воды, кислоты, сахара и соли отличается между собой, потому что и плотности их тоже отличаются.

Если взять 1 моль кислорода, 1 моль углекислого газа, 1 моль водорода, то при одинаковых нормальных условиях они будут занимать одинаковый объем, равный 22,4 л. Эти газы также будут содержать и одинаковое число частиц, т.е. 6,02 · 1023. Нормальными условиями или н.у. принято считать температуру 0 0С (градусов по Цельсию) и давление 760 мм. рт. ст. (миллиметров ртутного столба) или 101,3 кПа (килопаскаля).

Следовательно, молярный объём – это объём газа количеством 1 моль. Обозначается молярный объём, как и любой другой объем, но с символом Vm.
Кроме того, молярный объём – это физическая величина, равная отношению объёма вещества к количеству вещества. Это можно записать в виде формулы:
Vm= 
V – это объём газа, n – это количество вещества.
Из этого выражения можно найти и V.
V= n · Vm
Единицей измерения молярного объёма является л/моль, и т.к. это величина постоянная при нормальных условиях, то молярный объём равен 22,4 л/моль.

Объём 1 кмоля называют киломолярным объёмом и измеряют в м3/кмоль, т.е. он равен 22,4 м3/кмоль, а объём 1 ммоля называют миллимолярным объёмом, измеряют его в мл/ммоль, т.е. миллимолярный объём равен 22, 4 мл/ммоль.
Используя новые формулы, решим задачи.
1. Найдите объём азота (N2) количеством 2 моль.
Найдем объем азота (N2) количеством 2 моль. По условию нам дано количество вещества азота – 2 моль. Найти необходимо его объем. Для решения задачи используем формулу нахождения объема газа через количество вещества, т.е. нужно молярный объем умножить на количество вещества. Подставляем значения в формулу, т.е. 22,4 литра на моль умножаем на 2 моль, в результате получаем 44,8 литра. Следовательно, 2 моль азота занимает объем 44,8 л.

2. Найдите количество вещества озона (O3) объёмом 67,2 л.
По условию задачи нам дан объем озона – 67,2 литра, найти нужно количество вещества озона. Для решения задачи используем формулу: объем, разделенный на молярный объем, подставим значения в формулу, т.е. 67,2 литра делим на 22,4 литра на моль, получаем результат – 3 моль. Поэтому 3 моль озона занимают объем 67,2 л.

Молярный объем Википедия
Моля́рный объём Vm — отношение объёма вещества к его количеству, численно равен объёму одного моля вещества. Термин «молярный объём» может быть применен к простым веществам, химическим соединениям и смесям. В общем случае он зависит от температуры, давления и агрегатного состояния вещества. Молярный объем также можно получить делением молярной массы M вещества на его плотность ρ: таким образом, Vm = V/n = M/ρ. Молярный объём характеризует плотность упаковки молекул в данном веществе. Для простых веществ иногда используется термин атомный объём[1].
В Международной системе единиц (СИ) единицей измерения молярного объёма является кубический метр на моль (русское обозначение: м3/моль; международное: m3/mol).
Молярный объём смеси[ | ]
Для смеси веществ, при расчете молярного объёма, количеством вещества считают сумму количеств всех веществ, составляющих смесь. Если известна плотность плотность смеси ρc, мольные доли компонентов xi и их молярные массы Mi, молярный объём смеси можно найти как отношение средней молярной массы смеси (суммы молярных масс её компонентов, умноженных на их мольные доли) к плотности смеси.
- Vm=V∑ni=M¯ρc=∑i=1NxiMiρc.{\displaystyle V_{\rm {m}}={\frac {V}{\sum n_{i}}}={\frac {\overline {M}}{\rho _{\mathrm {c} }}}={\frac {\displaystyle \sum _{i=1}^{N}x_{i}M_{i}}{\rho _{\mathrm {c} }}}.}
Молярный объём газов[ | ]
Согласно закону Авогадро, одинаковые количества газов при одинаковых условиях занимают одинаковый объём. Молярный объём идеального газа рассчитается по формуле, выводящейся из уравнения состояния идеального газа
- Vm=RTp{\displaystyle V_{\rm {m}}={\frac {RT}{p}}},
где T — термодинамическая температура, p — давление, R — универсальная газовая постоянная.
При нормальных условиях (T = 273,15 K, p = 101 325 Па) молярный объем газов Vm = 22,41396954… л/моль[2]. Молярные объёмы реальных газов в той или иной степени отличаются от молярного объёма идеального газа, однако во многих случаях для практических вычислений отклонениями от идеальности можно пренебречь.