Типы химических реакций. Видеоурок. Химия 9 Класс
Данный видеоурок посвящен изучению типов химических реакций по различным признакам. Вы узнаете, как определить тип химической реакции по числу и составу ее участников, по тепловому эффекту, по обратимости, по изменению степеней окисления и по участию катализатора.
Типы реакций по числу и составу участников реакции
В зависимости от состава и числа участников реакций среди всех химических процессов можно выделить 4 типа реакций: разложения, соединения, замещения и обмена.

Примеры реакций:
1) CaCO3 = CaO + CO2 (реакция разложения)
2) 2Mg + O2 = 2MgO (реакция соединения)
3) Fe2O3 + 2Al = Al2O3 + 2Fe (реакция замещения)
4) NaOH + HCl = NaCl + H2O
К данным типам можно отнести не все известные реакции. Например, взаимодействие оксида углерода(IV) с гидроксидом калия
CO2 + 2KOH = K2CO3 + H2O
не относится ни к одному из перечисленных типов. Несмотря на то, что в реакцию вступают два сложных вещества, обмена составными частями не происходит, поэтому к реакциям обмена данное превращение не относится.
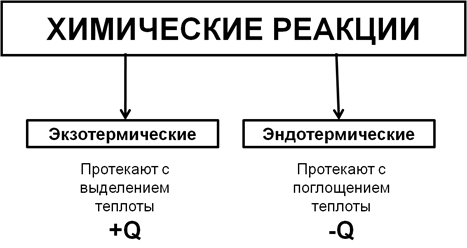
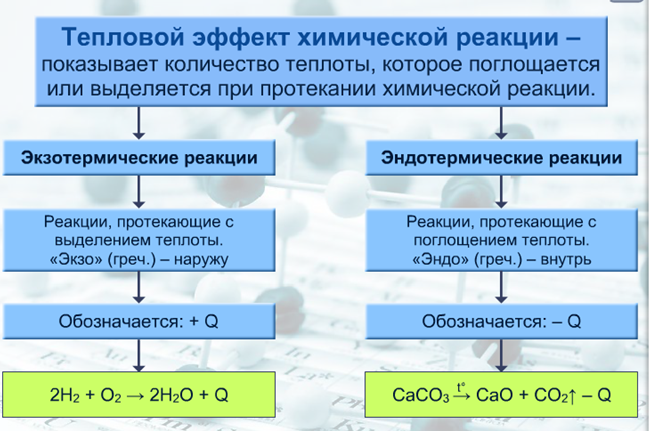
Типы реакций по тепловому эффекту
В зависимости от теплового эффекта реакции подразделяют на экзотермические (протекают с выделением теплоты) и эндотермические (протекают с поглощением теплоты).
Примеры реакций:
1) С + О2 = СО2+Q (экзотермическая)
2) CaCO3 = CaO + CO2— Q (эндотермическая)
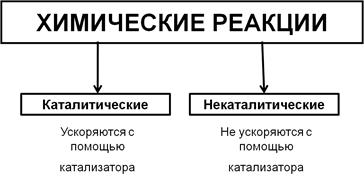
Типы реакций по участию катализатора
В зависимости от того, может ли реакция быть ускорена с помощью катализатора, выделяют два типа реакций – каталитические и некаталитические.
Примеры реакций:
1) Разложение пероксида водорода без катализатора протекает очень медленно. Добавление оксида марганца(IV) значительно ускоряет данную реакцию.
 (каталитическая)
(каталитическая)
2) Взаимодействие раствора гидроксида натрия с соляной кислотой протекает практически мгновенно и без участия катализатора. Это пример некаталитической реакции.
NaOH + HCl = NaCl + H2O (некаталитическая)
Типы реакций по изменению степеней окисления
Многие химические реакции протекают с изменением степеней окисления химических элементов. По этому признаку их выделяют в отдельный тип – окислительно-восстановительные реакции.

Примеры реакций:
1)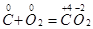 (окислительно-восстановительная)
(окислительно-восстановительная)
2) 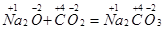 (неокислительно-восстановительная)
(неокислительно-восстановительная)
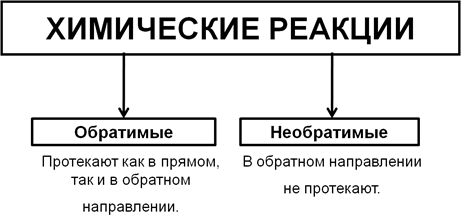
Типы реакций по обратимости
Многие химические реакции могут протекать как в прямом, так и в обратном направлении. Такие реакции называют обратимыми. Если реакция в обратном направлении не протекает, то ее называют необратимой.
Примеры реакций:
1) N2 + O2 ↔ 2NO (обратимая)
2) СаСl2 + Na2CO3 = 2NaCl + CaCO3↓ (необратимая)
Список рекомендованной литературы
- Оржековский П.А. Химия: 9-ый класс: учеб для общеобр. учрежд. / П.А. Оржековский, Л.М. Мещерякова, М.М. Шалашова. – М.: Астрель, 2013. (§15)
- Рудзитис Г.Е. Химия: неорган. химия. Орган. химия: учеб. для 9 кл. / Г.Е. Рудзитис, Ф.Г. Фельдман. – М.: Просвещение, ОАО «Московские учебники», 2016. (§20-21).
- Хомченко И.Д. Сборник задач и упражнений по химии для средней школы. – М.: РИА «Новая волна»: Издатель Умеренков, 2008.
- Энциклопедия для детей. Том 17. Химия / Глав. ред. В.А. Володин, вед. науч. ред. И. Леенсон. – М.: Аванта+, 2003.
Дополнительные веб-ресурсы
- Единая коллекция цифровых образовательных ресурсов (видеоопыты по теме) (Источник).
- Himhelp.ru (Источник).
- Электронная версия журнала «Химия и жизнь» (Источник).
- с. 105 №№ 3, 4, А1, А2 из учебника П.А. Оржековского «Химия: 9-ый класс» / П.А. Оржековский, Л.М. Мещерякова, М.М. Шалашова. – М.: Астрель, 2013.
- К каким типам по разным признакам относится реакция образования воды из водорода и кислорода?
interneturok.ru
| 1. |
Экзотермические реакции
Сложность: лёгкое |
1 |
| 2. |
Эндотермические реакции
Сложность: лёгкое |
1 |
| 3. |
Тепловой эффект реакций
Сложность: среднее |
2 |
| 4. |
Термохимические уравнения экзотермических реакций
Сложность: среднее |
2 |
| 5. |
Термохимические уравнения эндотермических реакций
Сложность: среднее |
2 |
| 6. |
Запись термохимических уравнений
Сложность: сложное |
4 |
| 7. | Расчёт количества теплоты по известному тепловому эффекту Сложность: сложное | 4 |
| 8. |
Расчёт теплового эффекта реакции по количеству выделившейся теплоты
Сложность: сложное |
4 |
| 9. |
Расчёт объема газа по теплоте, выделившейся в ходе реакции
Сложность: сложное |
5 |
| 10. |
Расчёт массы вещества по теплоте, выделившейся в ходе реакции
Сложность: сложное |
5 |
www.yaklass.ru
Классификация химических реакций. Характеристика по тепловому эффекту. Сравниваем химические реакции по изменению степени окисления
Химия | ПРЕДМЕТ |
11 класс | КЛАСС |
Занятие 4. Химические реакции | НАЗВАНИЕ ИНТЕРНЕТ-ЗАНЯТИЯ |
Интернет-урок 1. Классификация химических реакций | НАЗВАНИЕ ИНТЕРНЕТ-УРОКА |
Тележинская Е.Л. | АВТОР-РАЗРАБОТЧИК |
Интернет-урок 1. Классификация химических реакций
Ключевой вопрос Интернет-урока
Основным инструментом химика является химическая реакция. Изучая курс химии, вы познакомились с шестью классическими типами классификации химических реакций. Систематизируйте данную классификацию. Приведите пример химической реакции, которую можно охарактеризовать по всем основным типам химических реакций.
п/пСодержание
Связанные элементы правого поля
4.
Характеризуем химические реакции по тепловому эффекту
Подводка
Впомните определения теплового эффекта реакции, экзо- и эндотермической реакций. Как вы думаете, может одна и та же реакция протекать как с выделением, так и с поглощением тепла? Приведите аргументы своего ответа.
Гиперссылка Экзотермические и эндотермические реакции.:
Объект 1С
http://online.obr.1c.ru/library.html#searchMode=0&searchState=2&id=4392&type=1&title=%25D0%25A2%25D0%25B5%25D0%25BF%25D0%25BB%25D0%25BE%25D0%25B2%25D0%25BE%25D0%25B9+%25D1%258D%25D1%2584%25D1%2584%25D0%25B5%25D0%25BA%25D1%2582+%25D1%2585%25D0%25B8%25D0%25BC%25D0%25B8%25D1%2587%25D0%25B5%25D1%2581%25D0%25BA%25D0%25BE%25D0%25B9+%25D1%2580%25D0%25B5%25D0%25B0%25D0%25BA%25D1%2586%25D0%25B8%25D0%25B8&resource-type=dlr&simpleSearchQuery=%25D1%258D%25D0%25BA%25D0%25B7%25D0%25BE%25D1%2582%25D0%25B5%25D1%2580%25D0%25BC%25D0%25B8%25D1%2587%25D0%25B5%25D1%2581%25D0%25BA%25D0%25B0%25D1%258F+%25D1%2580%25D0%25B5%25D0%25B0%25D0%25BA%25D1%2586%25D0%25B8%25D1%258F&view=search
Верстальщику: это PrintSc страницы 1С с нужным определением и схемой. Необходимо вставить сам интерактивный объект
Свой ответ запишите здесь.
(4.1.) Алгоритм решения задач на тепловой эффект реакции. Тренируемся
(4.2). Задание с открытым ответом.
Решите задачи.
5.
Сравниваем химические реакции по изменению степени окисления
Подводка
Просмотрите видеоролик о расстановке коэффициентов в химическом уравнении реакции методом электронного баланса. Освоение данного метода может пригодиться экономисту при составлении годового или квартального отчета по финансам предприятия, так как данный химический метод ориентирован на переход электронов (денежных потоков): окислитель – это дебет предприятия, восстановитель – это кредит предприятия и отражает суть переходов электронов (денежных потоков) по дебеторским и кредиторским счетам предприятия. Попробуйте самостоятельно расставить коэффициенты методом электронного баланса в предложенных химических реакциях.
Гиперссылка. Расстановка коэффициентов в окислительно- восстановительных реакциях.
Объект 1С
http://online.obr.1c.ru/library.html#searchMode=0&searchState=2&id=4629&type=1&title=%25D0%25A0%25D0%25B0%25D1%2581%25D1%2581%25D1%2582%25D0%25B0%25D0%25BD%25D0%25BE%25D0%25B2%25D0%25BA%25D0%25B0+%25D0%25BA%25D0%25BE%25D1%258D%25D1%2584%25D1%2584%25D0%25B8%25D1%2586%25D0%25B8%25D0%25B5%25D0%25BD%25D1%2582%25D0%25BE%25D0%25B2+%25D0%25B2+%25D0%25BE%25D0%25BA%25D0%25B8%25D1%2581%25D0%25BB%25D0%25B8%25D1%2582%25D0%25B5%25D0%25BB%25D1%258C%25D0%25BD%25D0%25BE-%25D0%25B2%25D0%25BE%25D1%2581%25D1%2581%25D1%2582%25D0%25B0%25D0%25BD%25D0%25BE%25D0%25B2%25D0%25B8%25D1%2582%25D0%25B5%25D0%25BB%25D1%258C%25D0%25BD%25D1%258B%25D1%2585+%25D1%2580%25D0%25B5%25D0%25B0%25D0%25BA%25D1%2586%25D0%25B8%25D1%258F%25D1%2585&resource-type=dlr&simpleSearchQuery=%25D0%25BE%25D0%25BA%25D0%25B8%25D1%2581%25D0%25BB%25D0%25B8%25D1%2582%25D0%25B5%25D0%25BB%25D1%258C%25D0%25BD%25D0%25BE-%25D0%25B2%25D0%25BE%25D1%2581%25D1%2581%25D1%2582%25D0%25B0%25D0%25BD%25D0%25BE%25D0%25B2%25D0%25B8%25D1%2582%25D0%25B5%25D0%25BB%25D1%258C%25D0%25BD%25D1%258B%25D0%25B5+%25D1%2580%25D0%25B5%25D0%25B0%25D0%25BA%25D1%2586%25D0%25B8%25D0%25B8&view=search
Конец гиперссылки
Блок В практической плоскости
Задание с открытым ответом.
Окислители в быту
Многие компании, выпускающие моющие средства и порошки, рассказывают в рекламе об «активном кислороде», как о сильном окислителе. Подготовьте план веб страницы «активного кислорода». О каких полезных качествах окислителей в бытовых процессах вы можете рассказать своим читателям блога? Приведите примеры. Для визуализации своего рассказа можно использовать рисунки или схемы.
Приступить к выполнению
Конец объекта
(5.1.) В фокусе лабораторного эксперимента. ОВР
(4.1)Решаем вместе Алгоритм решения задач на тепловой эффект реакции
Гиперссылка: Алгоритм решения задач на тепловой эффект реакции. Тренируемся
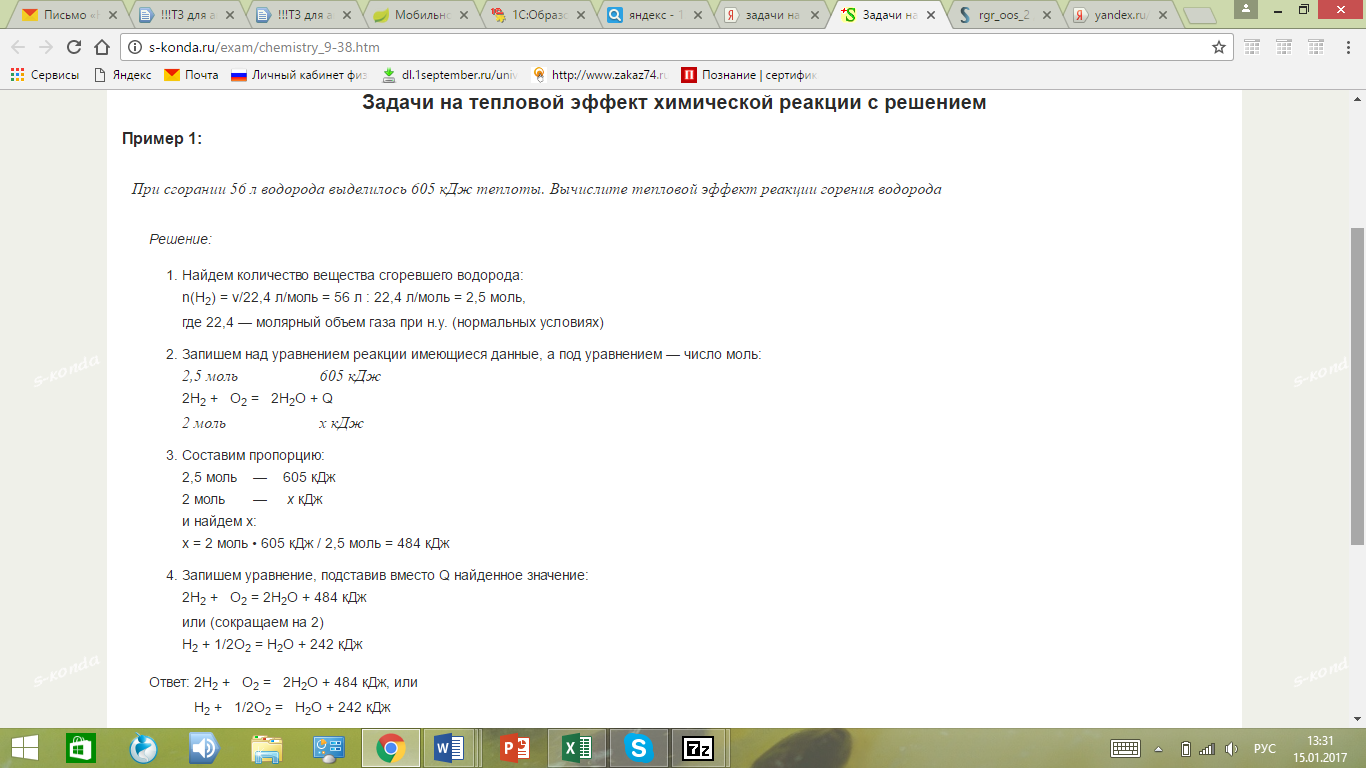
Пример задачи: При сгорании 56 л водорода выделилось 605 кДж теплоты. Вычислите тепловой эффект реакции горения водорода
Решение:
Найдем количество вещества сгоревшего водорода:
n(H2) = v/22,4 л/моль = 56 л : 22,4 л/моль = 2,5 моль,
где 22,4 — молярный объем газа при н.у. (нормальных условиях)Напоминаем вам, что количество вещества может быть связано с массой, тогда целесообразно использовать формулу: n=m/Mr. В любом случае важно понимать: тепловой эффект реакции зависит от количества вещества.
Запишем над уравнением реакции имеющиеся данные, а под уравнением — число моль:
2,5 моль 605 кДж
2H2 + O2 = 2H2O + Q
2 моль х кДжСоставим пропорцию:
2,5 моль — 605 кДж
2 моль — х кДж
и найдем x:
x = 2 моль • 605 кДж / 2,5 моль = 484 кДжЗапишем уравнение, подставив вместо Q найденное значение:
2H2 + O2 = 2H2O + 484 кДж
или (сокращаем на 2)
H2 + 1/2O2 = H2O + 242 кДж
Ответ: 2H2 + O2 = 2H2O + 484 кДж, или
H2 + 1/2O2 = H2O + 242 кДж
Конец гиперссылки
Верстальщику: Алгоритм решения (см. материал выше) должен выглядеть так:
(4.2). Тип объекта: Задание с открытым ответом/ЗОО
Название: Решить задачу
Содержание объекта:
Составьте термохимическое уравнение реакции горения магния, если известно, что при сгорании магния массой 12 г выделилось количество теплоты 307,2 кДж.
Приступить к выполнению
Конец объекта
Тип объекта: Задание с открытым ответом/ЗОО
Название: Решить задачу
Содержание объекта:
Вычислите по термохимическому уравнению 4P(к) + 5O2(г) = 2P2O5(к) + 3010 кДж количество теплоты, выделяемой при сгорании 31 г фосфора.
Приступить к выполнению
Тип объекта: Задание с открытым ответом/ЗОО
Название: Решить задачу
Содержание объекта:
По термохимическому уравнению CaCO3(к) = CaO(к) + СO2(г) — 157 кДж вычислите массу разложившегося известняка, если известно, что на его разложение затрачено 1570 кДж.
Приступить к выполнению
(5.1.) В фокусе лабораторного эксперимента. ОВР
Посмотрите видео эксперименты, составьте соответствующие уравнения реакций.
Вставить объект из коллекции 1С:
Гиперссылка: Реакция йода с щелочью: http://online.obr.1c.ru/library.html#searchMode=0&searchState=2&id=4641&type=1&title=%25D0%25A0%25D0%25B5%25D0%25B0%25D0%25BA%25D1%2586%25D0%25B8%25D1%258F+%25D0%25B8%25D0%25BE%25D0%25B4%25D0%25B0+%25D1%2581%25D0%25BE+%25D1%2589%25D0%25B5%25D0%25BB%25D0%25BE%25D1%2587%25D1%258C%25D1%258E&resource-type=dlr&simpleSearchQuery=%25D0%25BE%25D0%25BA%25D0%25B8%25D1%2581%25D0%25BB%25D0%25B8%25D1%2582%25D0%25B5%25D0%25BB%25D1%258C%25D0%25BD%25D0%25BE-%25D0%25B2%25D0%25BE%25D1%2581%25D1%2581%25D1%2582%25D0%25B0%25D0%25BD%25D0%25BE%25D0%25B2%25D0%25B8%25D1%2582%25D0%25B5%25D0%25BB%25D1%258C%25D0%25BD%25D1%258B%25D0%25B5+%25D1%2580%25D0%25B5%25D0%25B0%25D0%25BA%25D1%2586%25D0%25B8%25D0%25B8&view=search
Гиперссылка: Реакция хлорида железа III с иодидом калия: http://online.obr.1c.ru/library.html#searchMode=0&searchState=2&id=4653&type=1&title=%25D0%25A0%25D0%25B5%25D0%25B0%25D0%25BA%25D1%2586%25D0%25B8%25D1%258F+%25D1%2585%25D0%25BB%25D0%25BE%25D1%2580%25D0%25B8%25D0%25B4%25D0%25B0+%25D0%25B6%25D0%25B5%25D0%25BB%25D0%25B5%25D0%25B7%25D0%25B0+III+%25D1%2581+%25D0%25B8%25D0%25BE%25D0%25B4%25D0%25B8%25D0%25B4%25D0%25BE%25D0%25BC+%25D0%25BA%25D0%25B0%25D0%25BB%25D0%25B8%25D1%258F&resource-type=dlr&simpleSearchQuery=%25D0%25BE%25D0%25BA%25D0%25B8%25D1%2581%25D0%25BB%25D0%25B8%25D1%2582%25D0%25B5%25D0%25BB%25D1%258C%25D0%25BD%25D0%25BE-%25D0%25B2%25D0%25BE%25D1%2581%25D1%2581%25D1%2582%25D0%25B0%25D0%25BD%25D0%25BE%25D0%25B2%25D0%25B8%25D1%2582%25D0%25B5%25D0%25BB%25D1%258C%25D0%25BD%25D1%258B%25D0%25B5+%25D1%2580%25D0%25B5%25D0%25B0%25D0%25BA%25D1%2586%25D0%25B8%25D0%25B8&view=search
Гиперссылка: Тест на восстановители: http://online.obr.1c.ru/library.html#searchMode=0&searchState=2&id=4679&type=1&title=%25D0%25A2%25D0%25B5%25D1%2581%25D1%2582+%25D0%25BD%25D0%25B0+%25D0%25B2%25D0%25BE%25D1%2581%25D1%2581%25D1%2582%25D0%25B0%25D0%25BD%25D0%25BE%25D0%25B2%25D0%25B8%25D1%2582%25D0%25B5%25D0%25BB%25D0%25B8&resource-type=dlr&simpleSearchQuery=%25D0%25BE%25D0%25BA%25D0%25B8%25D1%2581%25D0%25BB%25D0%25B8%25D1%2582%25D0%25B5%25D0%25BB%25D1%258C%25D0%25BD%25D0%25BE-%25D0%25B2%25D0%25BE%25D1%2581%25D1%2581%25D1%2582%25D0%25B0%25D0%25BD%25D0%25BE%25D0%25B2%25D0%25B8%25D1%2582%25D0%25B5%25D0%25BB%25D1%258C%25D0%25BD%25D1%258B%25D0%25B5+%25D1%2580%25D0%25B5%25D0%25B0%25D0%25BA%25D1%2586%25D0%25B8%25D0%25B8&view=search
Гиперссылка: Реакции металлов с азотной кислотой: http://online.obr.1c.ru/library.html#searchMode=0&searchState=2&id=4637&type=1&title=%25D0%25A0%25D0%25B5%25D0%25B0%25D0%25BA%25D1%2586%25D0%25B8%25D0%25B8+%25D0%25BC%25D0%25B5%25D1%2582%25D0%25B0%25D0%25BB%25D0%25BB%25D0%25BE%25D0%25B2+%25D1%2581+%25D0%25B0%25D0%25B7%25D0%25BE%25D1%2582%25D0%25BD%25D0%25BE%25D0%25B9+%25D0%25BA%25D0%25B8%25D1%2581%25D0%25BB%25D0%25BE%25D1%2582%25D0%25BE%25D0%25B9&resource-type=dlr&simpleSearchQuery=%25D0%25BE%25D0%25BA%25D0%25B8%25D1%2581%25D0%25BB%25D0%25B8%25D1%2582%25D0%25B5%25D0%25BB%25D1%258C%25D0%25BD%25D0%25BE-%25D0%25B2%25D0%25BE%25D1%2581%25D1%2581%25D1%2582%25D0%25B0%25D0%25BD%25D0%25BE%25D0%25B2%25D0%25B8%25D1%2582%25D0%25B5%25D0%25BB%25D1%258C%25D0%25BD%25D1%258B%25D0%25B5+%25D1%2580%25D0%25B5%25D0%25B0%25D0%25BA%25D1%2586%25D0%25B8%25D0%25B8&view=search
infourok.ru
Классификация реакций, подготовка к ЕГЭ по химии
Существует несколько классификаций реакций, протекающих в неорганической и органической химии.
По характеру процесса
- Соединения
- Разложения
- Замещения
- Обмена
Так называют химические реакции, где из нескольких простых или сложных веществ получается одно сложное вещество. Примеры:
4Na + O2 = 2Na2O
P2O5 + 3H2O = 2H3PO4
В результате реакции разложения сложное вещество распадается на несколько сложных или простых веществ. Примеры:
2KMnO4 = K2MnO4 + MnO2 + 2O2
Сa(OH)2 = CaO + H2O
В ходе реакций замещения атом или группа атомов в молекуле замещаются на другой атом или группу атомов. Примеры:
CuSO4 + Fe = FeSO4 + Cu
2KI + Cl2 = 2KCl + I2
К реакциям обмена относятся те, которые протекают без изменения степеней окисления и выражаются в обмене компонентов между веществами. Часто обмен происходит анионами/катионами:
2KOH + MgCl2 = Mg(OH)2↓ + 2KCl
AgF + NaCl = AgCl↓ + NaF

Окислительно-восстановительные реакции (ОВР)
Это те химические реакции, в процессе которых происходит изменение степеней окисления химических элементов, входящих в состав исходных веществ. ОВР подразделяются на:
- Межмолекулярные — атомы окислителя и восстановителя входят в состав разных молекул. Примеры:
- Внутримолекулярные — атомы окислителя и восстановителя в составе одного сложного вещества. Примеры:
- Диспропорционирование — один и тот же атом является и окислителем, и восстановителем
KMnO4 + HCl → KCl + MnCl2 + Cl2 + H2O
K2SO3 + K2Cr2O7 + H2SO4 → K2SO4 + Cr2(SO4)3 + H2O
KMnO4 → K2MnO4 + MnO2 + O2
KClO3 → KCl + O2
KOH + Cl2 → (t) KCl + KClO3 + H2O
KOH + Cl2 → KCl + KClO + H2O

Замечу, что окислителем и восстановителем могут являться только исходные вещества (а не продукты!) Окислитель всегда понижает свою СО, принимая электроны в процессе восстановления. Восстановитель всегда повышает свою СО, отдавая электроны в процессе окисления.
От обилия информации можно запутаться. Я рекомендую сформулировать четко: «Окислитель — понижает СО, восстановитель — повышает СО». Запомнив эту информацию таким образом, вы не будете путаться.

ОВР уравнивают методом электронного баланса, с которым мы подробно познакомимся в разделе «Решения задач».
Обратимые и необратимые реакции
Обратимые реакции — такие химические реакции, которые протекают одновременно в двух противоположных направлениях: прямом и обратном. При записи реакции в таких случаях вместо знака «=» ставят знак обратимости «⇆».
Классическим примером обратимой реакции является синтез аммиака и реакция этерификации (из органической химии):
N2 + 3H2 ⇆ 2NH3
CH3COOH + C2H5OH ⇆ CH3COOC2H5 + H2O
Необратимые реакции протекают только в одном направлении, до полного расходования одного из исходных веществ. Главное отличие их от обратимых реакций в том, что образовавшиеся продукты реакции не взаимодействуют между собой с образованием исходных веществ.
Иногда сложно бывает отличить обратимую реакцию от необратимой, однако я дам несколько советов, которые советую взять на вооружение. В результате необратимых реакций:
- Образуются малодиссоциирующие вещества (например — вода, однако есть исключения — реакция этерификации)
- Реакция сопровождается выделение большого количества тепла
- В ходе реакции образуется газ или выпадает осадок
Примеры необратимых реакций:
BaCl2 + H2SO4 = BaSO4↓ + 2HCl (выпадает осадок)
NaOH + HCl = NaCl + H2O (образуется вода)
2Na + 2H2O = 2NaOH + H2 (сопровождается выделением большого количества тепла)

Реакции и агрегатное состояние фаз
Фазой в химии называют часть объема равновесной системы, однородную во всех своих точках по химическому составу и физическим свойствам и отделенную от других частей того же объема поверхностью раздела. Фаза бывает жидкой, твердой и газообразной.
Все реакции можно разделить на гетеро- и гомогенные. Гетерогенные реакции (греч. heterogenes — разнородный) — реакции, протекающие на границе раздела фаз, в неоднородной среде. Скорость таких реакций зависит от площади соприкосновения реагирующих веществ.
К гетерогенным реакциям относятся следующие реакции (примеры): жидкость + газ, газ + твердое вещество, твердое вещество + жидкость. Примером такой реакции может послужить взаимодействие твердого цинка и раствора соляной кислоты:
Zn(тв.) + 2HCl(р-р.) = ZnCl2(р-р.) + H2(газ.)↑

Гомогенные реакции (греч. homogenes — однородный) — реакции, протекающие между веществами, находящимися в одной фазе.
К гомогенным реакциям относятся (примеры): жидкость + жидкость, газ + газ, твердое вещество + твердое вещество. Примером такой реакции может служить взаимодействие между растворами уксусной кислоты и едкого натра.
NaOH(р-р.) + CH3COOH(р-р.) = CH3COONa(р-р.) + H2O(р-р.)

Реакции и их тепловой эффект
Все реакции можно разделить на те, в ходе которых тепло поглощается, или, наоборот, тепло выделяется. Представьте пробирку, охлаждающуюся или нагревающуюся в вашей руке — это и есть тот самый тепловой эффект. Иногда тепла выделяется так много, что реакции сопровождаются воспламенением или взрывом (натрий с водой).
- Экзотермические реакции
- Эндотермические реакции
Экзотермические реакции (греч. exo — вне) — химические реакции, сопровождающиеся потерей энергии системой и выделением тепла (той самой энергии) во внешнюю среду. При написании химических реакций в конце экзотермических ставят «+ Q» (Q — тепло), иногда бывает указано точное количество выделяющегося тепла. Например:
2Mg + O2 = 2MgO + Q
NaOH + HCl = NaCl + H2O + 56 кДж

К экзотермическим реакциям часто относятся реакции горения, соединения. Исключением является взаимодействие азота и кислорода, при котором тепло поглощается:
N2 + O2 ⇄ 2NO — Q
Как уже было отмечено выше, если тепло выделяется во внешнюю среду, значит, система реагирующих веществ потеряло это тепло. Поэтому не должно казаться противоречием, что внутренняя энергия веществ в результате экзотермической реакции уменьшается.
Энтальпией называют (обозначение Н), количество термодинамической (тепловой) энергии, содержащееся в веществе. Иногда с целью «запутывания» в реакции вместо явного +Q при экзотермической реакции могут написать ΔH < 0. Например:
2Na + 2H2O = 2NaOH + H2; ΔH < 0 (это значит, что тепло выделяется — реакция экзотермическая)

Эндотермические реакции (греч. ἔνδον — внутри) — химические реакции, сопровождающиеся поглощением тепла, в результате которых образуются вещества с более высоким энергетическим уровнем (их внутренняя энергия увеличивается).
К таким реакциям наиболее часто относятся реакции разложения. При написании эндотермических реакций в конце ставят «-Q», либо указывают точное количество поглощенной энергии. Примеры таких реакций:
2HgO = Hg + O2 — Q
4NH3 + 5O2 = 4NO + 6H2O — Q
CaCO3 = CaO + CO2↑ — Q
С целью «запутывания» может быть дана энтальпия, она при таких реакциях всегда: ΔH > 0, так как внутренняя энергия веществ увеличивается. Например:
CaCO3 = CaO + CO2↑ ; ΔH > 0 (значит реакция эндотермическая, так как внутренняя энергия увеличивается)

Замечу, что не все реакции разложения являются эндотермическими. Широко известная реакция разложения дихромата аммония («вулканчик») является примером экзотермического разложения, при котором тепло выделяется.

©Беллевич Юрий Сергеевич
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
studarium.ru
числу и составу исходных и полученных веществ, изменению степеней окисления химических элементов, поглощению и выделению энергии – HIMI4KA

Классификацию химических реакций в неорганической и органической химии осуществляют на основании различных классифицирующих признаков.
По числу и составу исходных и полученных веществ различают реакции соединения, разложения, обмена и замещения.
Реакциями соединения называют химические реакции, в результате которых сложные молекулы получаются из двух и более простых, например:


Реакциями разложения называют химические реакции, в результате которых простые молекулы получаются из более сложных, например:


Реакциями замещения называют химические реакции, в результате которых атом или группа атомов в молекуле вещества замещается на другой атом или группу атомов, например:


Реакциями обмена называют химические реакции, протекающие без изменения степеней окисления элементов и приводящие к обмену составных частей реагентов, например:


По изменению степеней окисления химических элементов, входящих в состав реагирующих веществ, реакции делят на окислительно-восстановительные и не окислительно-восстановительные.
Окислительно-восстановительными называют реакции, сопровождающиеся изменением степеней окисления химических элементов, входящих в состав реагентов:


Не окислительно-восстановительными называют реакции, в которых степень окисления химических элементов, входящих в состав реагентов, не изменяется.


Окислительно-восстановительные реакции разделяют на следующие основные типы: реакции межмолекулярного окисления-восстановления, реакции внутримолекулярного окисления-восстановления, реакции диспропорционирования и реакции конмутации.
Реакциями межмолекулярного окисления-восстановления называют реакции, в которых обмен электронами происходит между различными атомами, молекулами или ионами, например:


(сера — окислитель, магний — восстановитель).


(бром — окислитель, водород — восстановитель).


(окислитель — азотистая кислота, восстановитель — сероводород).
Таким образом, атом-окислитель и атом-восстановитель в данных реакциях принадлежат разным веществам.
Реакциями внутримолекулярного окисления-восстановления называют реакции, в которых атом-окислитель и атом-восстановитель входят в состав одной и той же молекулы.


(окислитель — атом хлора в степени окисления +5, восстановитель — атом кислорода в степени окисления –2).


(окислитель — атом хрома в степени окисления +6, восстановитель — атом азота в степени окисления –3).


(окислители — атомы серебра в степени окисления +1 и азота в степени окисления +5, восстановитель — атом кислорода в степени окисления –2).
Реакциями диспропорционирования называют реакции, в которых молекулы или ионы одного и того же вещества реагируют друг с другом как окислитель и восстановитель. При этом содержащиеся в данном соединении атомы с переменной промежуточной степенью окисления переходят один в высшую, другой — в низшую степень окисления, например:


Реакциями конмутации называют реакции окисления-восстановления, в результате которых происходит выравнивание степеней окисления атомов одного и того же элемента, например:


(окислитель — атом азота в степени окисления +5, восстановитель — атом азота в степени окислителя –3).


(окислитель — атом азота в степени окисления +3, восстановитель — атом азота в степени окислителя –3).
По тепловому эффекту, сопровождающему химические реакции, их разделяют на экзотермические и эндотермические.
Экзотермическими называют химические реакции, идущие с выделением теплоты. Условное обозначение изменения энтальпии ΔH, а теплового эффекта реакции Q. Для экзотермических реакций Q > 0, а ΔH < 0.
Эндотермическими называют химические реакции, идущие с поглощением теплоты. Для эндотермических реакций Q < 0, а ΔH > 0.
В соответствии с агрегатным состоянием реагентов различают гомогенные и гетерогенные химические реакции.
Гомогенными называют реакции, протекающие в однородной среде.
Гетерогенными называют реакции, протекающие в неоднородной среде, на поверхности соприкосновения реагирующих веществ, находящихся в разных фазах, например твёрдой и газообразной, жидкой и газообразной, в двух несмешивающихся жидкостях.
Тренировочные задания
1. Реакция 3CaО + P2O5 = Ca3(PO4)2 относится к реакциям
1) разложения
2) соединения
3) обмена
4) замещения
2. Реакция Na2SO4 + Ba(OH)2 = BaSO4 + 2NaOH относится к реакциям
1) разложения
2) соединения
3) обмена
4) замещения
3. Реакция H2SO4 + Fe = FeSO4 + H2 относится к реакциям
1) разложения
2) соединения
3) обмена
4) замещения
4. Реакция CaCO3 = CaO + CO2 относится к реакциям
1) разложения
2) соединения
3) обмена
4) замещения
5. Реакция разложения описана уравнением
1) Cu(OH)2 = CuO + H2O
2) BaO + H2O = Ba(OH)2
3) Na2SO4 + BaCl2 = ZnCl2 + BaSO4
4) FeO + H2 = Fe + H2O
6. Реакция соединения описана уравнением
1) Br2 + H2 = 2HBr
2) H2SO4+ 2NaOH = Na2SO4 + 2H2O
3) ZnS + 2HCl = ZnCl2 + H2S
4) HI + NaOH = NaI + H2O
7. К каталитическим процессам относят реакцию между
1) калием и водой
2) серой и хлором
3) азотом и литием
4) азотом и водородом
8. К экзотермическим реакциям относится взаимодействие
1) азота с кислородом
2) углерода с углекислым газом
3) воды с углеродом
4) углерода с кислородом
9. К окислительно-восстановительным реакциям не относится взаимодействие
1) натрия и хлора
2) брома и водорода
3) гидроксида калия и уксусной кислоты
4) кальция и уксусной кислоты
10. К реакциям замещения относится взаимодействие
1) серной кислоты и гидроксида натрия
2) серной кислоты и железа
3) серной кислоты и оксида натрия
4) серной кислоты и хлорида бария
11. К экзотермическим реакциям относится
1) взаимодействие соляной кислоты и гидроксида калия
2) взаимодействие азота и кислорода
3) гидролиз сульфата меди
4) разложение карбоната натрия
12. К эндотермическим реакциям относится
1) взаимодействие азота и кислорода
2) взаимодействие азотной кислоты и гидроксида лития
3) взаимодействие кислорода и водорода
4) взаимодействие воды и оксида калия
13. К окислительно-восстановительным реакциям не относится взаимодействие
1) натрия и брома
2) натрия и кислорода
3) оксида калия и воды
4) натрия и уксусной кислоты
14. Взаимодействие брома с гидроксидом калия относится к реакциям
1) нейтрализации
2) межмолекулярного окисления-восстановления
3) диспропорционирования
4) обмена
15. Взаимодействие азота и кислорода относится к реакциям
1) соединения, эндотермическим
2) соединения, экзотермическим
3) разложения, эндотермическим
4) обмена, экзотермическим
16. К эндотермическим реакциям относится взаимодействие
1) азота и лития
2) азота и кислорода
3) кислорода и кальция
4) углерода и кислорода
17. Взаимодействие оксида кальция и воды относится к реакциям
1) каталитическим, экзотермическим
2) разложения, эндотермическим
3) соединения, экзотермическим
4) обмена, эндотермическим
18. К каталитическим экзотермическим реакциям относится
1) получение фосфорной кислоты из оксида фосфора (V) и воды
2) разложение карбоната кальция
3) синтез аммиака из простых веществ
4) получение соляной кислоты из хлора и водорода
19. При нагревании нитрата серебра происходит реакция
1) соединения
2) разложения
3) замещения
4) обмена
20. Реакция, протекающая по схеме: CaCO3 = CaO + CO2 − Q, является реакцией
1) экзотермического разложения
2) разложения
3) замещения
4) эндотермического разложения
Ответы


himi4ka.ru