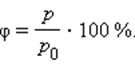Испарение, конденсация, кипение. Насыщенные и ненасыщенные пары
Любое вещество при определенных условиях может находиться в различных агрегатных состояниях – твердом, жидком и газообразном. Переход из одного состояния в другое называется фазовым переходом. Испарение и конденсация являются примерами фазовых переходов.
Все реальные газы (кислород, азот, водород и т. д.) при определенных условиях способны превращаться в жидкость. Однако такое превращение может происходить только при температурах ниже определенной, так называемой критической температуры Tкр. Например, для воды критическая температура равна 647,3 К, для азота 126 К, для кислорода 154,3 К. При комнатной температуре (≈ 300 К) вода может находиться и в жидком, и в газообразном состояниях, а азот и кислород существуют только в виде газов.
Испарением называется фазовый переход из жидкого состояния в газообразное. С точки зрения молекулярно-кинетической теории, испарение – это процесс, при котором с поверхности жидкости вылетают наиболее быстрые молекулы, кинетическая энергия которых превышает энергию их связи с остальными молекулами жидкости. Это приводит к уменьшению средней кинетической энергии оставшихся молекул, т. е. к охлаждению жидкости (если нет подвода энергии от окружающих тел).
Конденсация – это процесс, обратный процессу испарения. При конденсации молекулы пара возвращаются в жидкость.
 |
Модель. Испарение и конденсация. |
В закрытом сосуде жидкость и ее пар могут находиться в состоянии динамического равновесия, когда число молекул, вылетающих из жидкости, равно числу молекул, возвращающихся в жидкость из пара, т. е. когда скорости процессов испарения и конденсации одинаковы. Такую систему называют двухфазной. Пар, находящийся в равновесии со своей жидкостью, называют насыщенным.
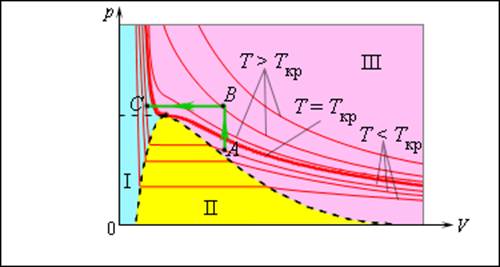
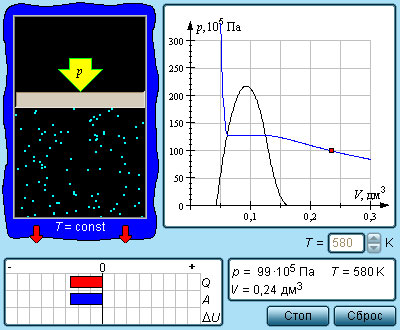
Число молекул, вылетающих с единицы площади поверхности жидкости за одну секунду, зависит от температуры жидкости. Число молекул, возвращающихся из пара в жидкость, зависит от концентрации молекул пара и от средней скорости их теплового движения, которая определяется температурой пара. Отсюда следует, что для данного вещества концентрация молекул пара при равновесии жидкости и ее пара определяется их равновесной температурой. Установление динамического равновесия между процессами испарения и конденсации при повышении температуры происходит при более высоких концентрациях молекул пара. Так как давление газа (пара) определяется его концентрацией и температурой, то можно сделать вывод: давление насыщенного пара p0 данного вещества зависит только от его температуры и не зависит от объема. Поэтому изотермы реальных газов на плоскости (p, V) содержат горизонтальные участки, соответствующие двухфазной системе (рис. 3.4.1).
|
Рисунок 3.4.1. Изотермы реального газа. Область I – жидкость, область II – двухфазная система «жидкость + насыщенный пар», область III – газообразное вещество. K – критическая точка |
При повышении температуры давление насыщенного пара и его плотность возрастают, а плотность жидкости уменьшается из-за теплового расширения. При температуре, равной критической температуре Tкр для данного вещества, плотности пара и жидкости становятся одинаковыми. При T > Tкр исчезают физические различия между жидкостью и ее насыщенным паром.
Если изотермически сжимать ненасыщенный пар при T < Tкр, то его давление будет возрастать, пока не станет равным давлению насыщенного пара. При дальнейшем уменьшении объема на дне сосуда образуется жидкость и устанавливается динамическое равновесие между жидкостью и ее насыщенным паром. С уменьшением объема все большая часть пара конденсируется, а его давление остается неизменным (горизонтальный участок на изотерме). Когда весь пар превращается в жидкость, давление резко возрастает при дальнейшем уменьшении объема вследствие малой сжимаемости жидкости.
Из газообразного состояния в жидкое можно перейти, минуя двухфазную область. Для этого нужно совершить процесс в обход критической точки K. Один из возможных процессов такого рода показан на рис. 3.4.1 ломаной линией ABC.
 |
Модель. Изотермы реального газа. |
В атмосферном воздухе всегда присутствуют пары воды при некотором парциальном давлении p, которое, как правило, меньше давления насыщенного пара p0. Отношение p / p0, выраженное в процентах, называется относительной влажностью воздуха.
|
Ненасыщенный пар можно теоретически описывать с помощью уравнения состояния идеального газа при обычных для реальных газов ограничениях: давление пара должно быть не слишком велико (практически p ≤ (106–107) Па), а его температура выше некоторого определенного для каждого вещества значения. К насыщенному пару также можно приближенно применять законы идеального газа при условии, что для каждой температуры T давление p0 насыщенного пара определяется по кривой равновесия p0(T) для данного вещества.
Давление p0 насыщенного пара очень быстро возрастает с ростом температуры T. Зависимость p0 (T) нельзя получить из законов идеального газа. Давление газа при постоянной концентрации молекул растет прямо пропорционально температуре. В насыщенном паре при повышении температуры возрастает не только средняя кинетическая энергия движения молекул, но и их концентрация. Поэтому давление насыщенного пара при повышении температуры возрастает быстрее, чем давление идеального газа при постоянной концентрации молекул.
Испарение может происходить не только с поверхности, но и в объеме жидкости. В жидкости всегда имеются мельчайшие пузырьки газа. Если давление насыщенного пара жидкости равно внешнему давлению (т. е. давлению газа в пузырьках) или превышает его, жидкость будет испаряться внутрь пузырьков. Пузырьки, наполненные паром, расширяются и всплывают на поверхность. Этот процесс называется кипением. Таким образом, кипение жидкости начинается при такой температуре, при которой давление ее насыщенных паров становится равным внешнему давлению.
В частности, при нормальном атмосферном давлении вода кипит при температуре 100 °С. Это значит, что при такой температуре давление насыщенных паров воды равно 1 атм. При подъеме в горы атмосферное давление уменьшается, и поэтому температура кипения воды понижается (приблизительно на 1 °С на каждые 300 метров высоты). На высоте 7 км давление составляет примерно 0,4 атм, и температура кипения понижается до 70 °С.
В герметически закрытом сосуде жидкость кипеть не может, т. к. при каждом значении температуры устанавливается равновесие между жидкостью и ее насыщенным паром. По кривой равновесия p0 (T) можно определять температуру кипения жидкости при различных давлениях.
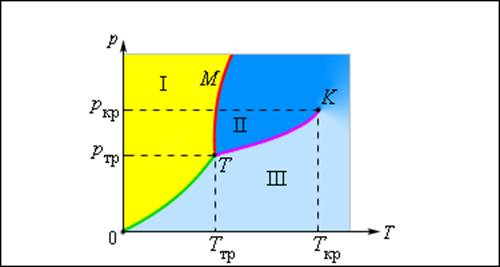
Изображенная на рис. 3.4.1 картина изотерм реального газа описывает процессы испарения и конденсации, т. е. фазовый переход между газообразной и жидкой фазами вещества. На самом деле эта картина является неполной, т. к. из газообразного и жидкого любое вещество может перейти в твердое состояние. При заданной температуре T термодинамическое равновесие между двумя фазами одного и того же вещества возможно лишь при определенном значении давления в системе. Зависимость равновесного давления от температуры называется кривой фазового равновесия. Примером может служить кривая равновесия p0 (T) насыщенного пара и жидкости. Если кривые равновесия между различными фазами данного вещества построить на плоскости (p, T), то они разбивают эту плоскость на отдельные области, в которых вещество существует в однородном агрегатном состоянии – твердом, жидком или газообразном (рис. 3.4.2). Изображенные в координатной системе (p, T) кривые равновесия называются фазовой диаграммой.
|
Рисунок 3.4.2. Типичная фазовая диаграмма вещества. K – критическая точка, T – тройная точка. Область I – твердое тело, область II – жидкость, область III – газообразное вещество |
Кривая 0T, соответствующая равновесию между твердой и газообразной фазами, называется кривой сублимации. Кривая TK равновесия между жидкостью и паром называется кривой испарения, она обрывается в критической точке K. Кривая TM равновесия между твердым телом и жидкостью называется кривой плавления.
Кривые равновесия сходятся в точке T, в которой могут сосуществовать в равновесии все три фазы. Эта точка называется тройной точкой.
Для многих веществ давление pтр в тройной точке меньше 1 атм ≈ 105 Па. Такие вещества при нагревании при атмосферном давлении плавятся. Например, тройная точка воды имеет координаты Tтр = 273,16 К, pтр = 6,02·102 Па и используется в качестве опорной для калибровки абсолютной температурной шкалы Кельвина. Существуют, однако, и такие вещества, у которых pтр превышает 1 атм. Так для углекислоты (CO2) давление pтр = 5,11 атм и температура Tтр = 216,5 К. Поэтому при атмосферном давлении твердая углекислота может существовать только при низкой температуре, а в жидком состоянии при p = 1 атм она вообще не существует. В твердом состоянии в равновесии со своим паром при атмосферном давлении углекислота находится при температуре 173 К или –80 °С. Это широко применяемый «сухой лед», который никогда не плавится, а только испаряется (сублимирует).
Типы пара | TLV — Наша компания
Если вода нагревается выше точки кипения, она становится паром или водой в газообразном состоянии. Однако все виды пара разные, и их свойства существенно варьируются в зависимости от давления и температуры.
В статье Основные сферы применения пара, мы рассмотрели различные процессы, в которых используется пар. А теперь поговорим о типах пара, применяемых в этих процессах.
Соотношение давления и температуры воды и пара
Для просмотра анимации кликните на слово

Насыщенный (сухой) пар возникает, когда вода нагревается до температуры кипения (контактное тепло), а затем испаряется с помощью дополнительного подогрева (скрытое тепло). Если этот пар далее нагревается выше точки насыщения, он становится перегретым паром (контактное тепло).
Насыщенный (сухой) пар
Черная линия вышеприведенного графика показывает, что насыщенный пар появляется при такой температуре и давлении, при которых пар (газ) и вода (жидкость) могут сосуществовать. Другими словами, он образуется тогда, когда скорость испарения воды равна скорости конденсации.
Преимущества использования насыщенного пара для подогрева
Свойства насыщенного пара делают из него отличный источник тепла особенно при температуре 100 °C и выше. Вот некоторые из этих свойств:
| Свойства | Преимущества |
| Обеспечивает быстрое и равномерное нагревание за счет передачи скрытой теплоты | Улучшает качество продукта и повышает производительность |
| Давление может контролировать температуру | Температура устанавливается быстро и точно |
| Гарантирует высокий коэффициент теплопередачи | Требуемая площадь теплообмена меньше, что позволяет снизить первоначальные затраты на оборудование |
| Образовывается из воды | Безопасный, чистый и недорогой |
Полезные советы
С учетом сказанного, при подогреве насыщенным паром необходимо помнить о следующих моментах:- эффективность подогрева может уменьшиться, если в данном процессе используется любой другой пар, кроме сухого. Вопреки общераспространенному мнению, фактически весь пар, производимый в котле — это не сухой насыщенный пар, а влажный, содержащий часть неиспарившихся молекул воды.
- Потеря теплового излучения приводит к тому, что часть пара конденсируется. Получившийся влажный пар становится еще более влажным, к тому же образуется конденсат, который надо удалить, установив там, где это необходимо, конденсатоотводчики.
- Образованный из пара тяжелый конденсат может быть выведен конденсатоотводчиками в специальные коллекторы. Однако этот влажный пар снизит эффективность нагрева, поэтому его следует удалить через устройства очистки или распределительные сборники.
- В паре, в котором снижается давление за счет трения в трубопроводе и т.д., также может понизиться температура.
Ненасыщенный (влажный) пар
Это наиболее распространенная форма пара, которая используется на большинстве заводов. Когда при работе котла образуется пар, он, как правило, влажный из-за неиспарившихся молекул воды, которые в нем присутствуют. Даже лучшие котлы могут выпускать пар, чья влажность будет составлять от 3% до 5%. Когда вода приближается к состоянию насыщения и начинает испаряться, часть ее, обычно в форме водяной пыли или капелек, попадает в поднимающийся пар и распределяется дальше. Это одна из основных причин, по которой сепарация используется для удаления конденсата из распределенного пара.
Перегретый пар
Перегретый пар получается в результате дополнительного нагревания влажного или насыщенного пара до точки кипения выше, чем для последнего. Так, при идентичном давлении, что и у насыщенного пара, его температура будет выше, а плотность ниже. Перегретый пар в основном используется для сообщения движения, например, в турбинах, но не применяется в процессах теплопередачи.
Преимущества использования перегретого пара в приводных турбинах:
- Обеспечивает сухость пара в паровом оборудовании, производительность которого может ухудшиться от присутствия конденсата
- Улучшает тепловую эффективность и производительность при переходе от перегретого состоянии к снижению давления и даже вакууму в определенном удельном объеме.
Предпочтительно и подавать, и выпускать пар в перегретом состоянии, т.к. конденсат не будет образовываться во время нормальной работы парового оборудования, что снизит риск повреждений от эрозии или коррозии, вызванной влиянием углекислого газа. Кроме того, теоретический тепловой КПД турбины рассчитывается с учетом показателей энтальпии во впускном и выпускном отверстиях; это увеличивает градус перегрева, давление поднимает энтальпию со стороны входного отверстия турбины, что эффективно улучшает тепловой КПД.
Недостатки использования перегретого пара для подогрева:
| Свойства | Недостатки |
| Низкий коэффициент передачи тепла | Снижается производительность |
| Требуется большая площадь поверхности теплопередачи | |
| Нестабильная температура пара даже при постоянном давлении | Перегретому пару надо поддерживать высокую скорость, в противном случае температура будет падать по мере потери тепла из оборудования. |
| Контактное тепло используется для передачи тепловой энергии | Падение температуры может отрицательно сказаться на качестве продукта |
| Температура может быть необычайно велика | Могут понадобиться более стойкие строительные материалы, требующие более высоких первоначальных затрат на оборудование |
По этой и другим причинам, насыщенный пар предпочтительнее перегретого пара, если он выступает в качестве рабочей среды теплообменников или иного оборудования для теплопередачи. С другой стороны, если рассматривать его как источник тепла для прямого нагрева, как высокотемпературный газ, обнаружится преимущество над горячим воздухом, благодаря возможности подогрева даже в условиях отсутствия кислорода. Также проводятся исследования по использованию пара в пищевой промышленности для приготовления еды и для сушки.
Сверхкритическая вода
Сверхкритическая вода — это вода в состоянии, превышающем ее критическую точку: 22,1 МПа, 374 °C. В критической точке, скрытое тепло пара равняется нулю, а его удельный объем точно такой же, как для жидкого или газообразного состояния. Другими словами, вода с давлением и температурой большими, чем в критической точке, находится в своеобразном состоянии, которое нельзя назвать ни жидким, ни газообразным.
Сверхкритическая вода используется для работы турбин на электростанциях, которые требуют более высокой эффективности. Исследования сверхкритической воды проводятся с упором на ее использование в качестве текущей среды, обладающей свойствами как жидкости, так и газа, а также на ее пригодность в качестве растворителя для химических реакций.
Различные состояния воды
Ненасыщенная вода

Эта вода находится в самом узнаваемом ее состоянии. Приблизительно 70% человеческого веса — это вода. Когда она находится в жидком состоянии, водородные связи держат молекулы ее вместе. В результате ненасыщенная вода имеет относительно компактную, плотную и стабильную структуру.
Насыщенный пар
Молекулы насыщенного пара невидимы. Когда насыщенный пар выпускается в атмосферу из трубопровода, часть его конденсируется, передавая свое тепло окружающему воздуху и образовывая облака белого пара (крошечные капли воды). Если в паре есть такие капельки, то он называется влажным.
В паровых системах пар, выходящий из конденсатоотводчиков часто ошибочно принимается за насыщенный (острый) пар, в действительности же это – выпар. Разница между ними состоит в том, что насыщенный пар мнгновенно становится невидимым уже на уровне выпускного отверстия трубы, тогда как выпар содержит мелкие капли воды в момент образования.
Перегретый пар
Пока перегретый пар находится в своем перегретом состоянии, он не будет конденсироваться, даже если вступит в контакт с атмосферой, а его температура упадет. В результате, клубы пара образовываться не будут. Перегретый пар содержит больше тепла, чем насыщенный пар при том же давлении, а его молекулы двигаются быстрее, поэтому его плотность ниже (т.е. его удельный объем больше).
Сверхкритическая вода

Хотя визуальное наблюдение не представляется возможным, но эта вода находится в состоянии, которое не является ни жидким, ни газообразным. В общих чертах, молекулярное движение ближе к газу, а плотность больше похожа на плотность жидкости.
Насыщенные и ненасыщенные пары — FizikatTYT
Пар называется насыщенным, если количество молекул вещества, переходящих в газообразное состояние, равно количеству молекул, возвращающихся в жидкую или твердую фазу. Это состояние динамического равновесия.
Если количество испаряющихся молекул больше, чем конденсирующихся, то пар ненасыщенный. Процесс испарения продолжается до тех пор, пока будет достигнуто состояние динамического равновесия, или пока все вещество не испарится.
Давление пара – что это?
Насыщенный и ненасыщенный пар прежде всего ассоциируется с водяным паром. Содержание пара в воздухе – важная характеристика климата, погодных условий, санитарно-гигиенических условий помещения. В то же время давление пара – это техническая характеристика состояния термодинамической системы.
При испарении в герметично закрытом сосуде пар оказывает давление на поверхность жидкости. Чем выше температура, тем выше давление пара. Оно может и железный котел разорвать, если слишком сильно повышать температуру.
Водяной пар: чем холоднее погода, тем суше воздух
Абсолютная влажность – это количество водяных паров, содержащихся в единице объема воздуха. При низких температурах в воздухе мало водяного пара, в абсолютном исчислении, но при этом пар может быть насыщенным или имеет относительную влажность более 90 \%. При нагревании воздуха до 20° С абсолютное содержание остается прежним, но относительная влажность резко снижается, воздух становится сухим, абсолютная влажность может составлять 15-20 \%.
Поэтому зимой в отапливаемом помещении чересчур сухой воздух, и это не связано с видом обогревателя, а связано лишь с разницей температур на улице и в помещении.
Насыщенный пар в термодинамике
Давление насыщенного пара при повышении температуры растет значительно быстрее, чем давление идеального газа при повышении температуры в замкнутом объеме. Именно поэтому для первых тепловых двигателей использовался водяной пар, а точнее система вода-пар. При нагревании такой системы увеличивается не только давление пара, но и количество молекул пара, их концентрация.
Перегретый пар — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 28 апреля 2017; проверки требуют 3 правки. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 28 апреля 2017; проверки требуют 3 правки.Перегре́тый пар — пар, нагретый до температуры, превышающей температуру кипения при данном давлении. Перегретый пар используется в циклах различных тепловых машин с целью повышения их КПД. Получение перегретого пара происходит в специальных устройствах — пароперегревателях.
Если насыщенный пар продолжать нагревать в отдельном объёме, не имеющем воды, то получится перегретый пар. При этом сначала испарится влага, содержащаяся в паре, а затем начнётся повышение температуры и увеличение удельного его объёма.
В современных паротурбинных установках используют перегретый пар с температурой значительно выше критической (374°C).
Перегретый пар обладает следующими основными свойствами и преимуществами:
- при одинаковом давлении с насыщенным паром имеет значительно бо́льшую температуру и теплосодержание;
- имеет больший удельный объём в сравнении с насыщенным паром, то есть объём 1 кг перегретого пара при том же давлении больше объема 1 кг насыщенного пара. Поэтому в паровых машинах для получения необходимой мощности перегретого пара по массе потребуется меньше, что даёт экономию в расходе воды и топлива;
- перегретый пар при охлаждении не конденсируется; конденсация при охлаждении наступает лишь тогда, когда температура перегретого пара станет ниже температуры насыщенного пара при данном давлении.
Автоматическое регулирование температуры перегретого пара в котлоагрегатах[править | править код]
Качество регулирования температуры перегретого пара зависит от динамических свойств регулируемых участков. Обычно, это те элементы и части пароперегревателя, которые распложены между местом приложения регулирующего воздействия и местом отбора главного импульса по температуре пара.[1]