Какая кристаллическая решетка у натрия. Сказка про ионную связь. В коммунальном хозяйстве. Техническая соль
Твердые вещества, как правило, имеют кристаллическое строение. Оно характеризуется правильным расположением частиц в строго определенных точках пространства. При мысленном соединении этих точек пересекающимися прямыми линиями образуется пространственный каркас, который называюткристаллической решеткой . Точки, в которых размещены частицы, называются узлами кристаллической решетки . В узлах воображаемой решетки могут находиться ионы, атомы или молекулы. Они совершают колебательные движения. С повышением температуры амплитуда колебаний возрастает, что проявляется в тепловом расширении тел.
В зависимости от вида частиц и характера связи между ними различают 4 вида кристаллических решеток: ионные (NaCl, KCl), атомные, молекулярные и металлические.
Кристаллические
решетки, состоящие из ионов, называются ионными .
Их образуют вещества с ионной связью. Примером может служить кристалл хлорида
натрия, в котором каждый ион натрия
окружен 6 хлорид-ионами, а каждый
хлорид-ион 6 ионами-натрия.
Примером может служить кристалл хлорида
натрия, в котором каждый ион натрия
окружен 6 хлорид-ионами, а каждый
хлорид-ион 6 ионами-натрия.
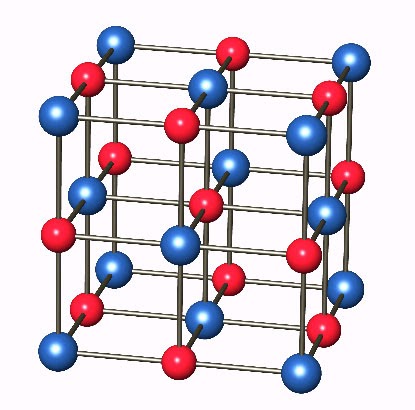
Кристаллическая решетка NaCl
Число ближайших соседних частиц, вплотную примыкающих к данной частице в кристалле или отдельной молекуле называется координационным число .
В решетке NaCl координационные числа обоих ионов равны 6. И так, в кристалле NaCl нельзя выделить отдельные молекулы соли. Их нет. Весь кристалл следует рассматривать как гигантскую макромолекулу, состоящую из равного числа ионов Na + и Cl — , Na n Cl n – где n большое число. Связи между ионами в таком кристалле весьма прочны. Поэтому вещества с ионной решеткой обладают сравнительно высокой твердостью. Они тугоплавки и малолетучи.
Плавление
ионных кристаллов приводит к нарушению
геометрически правильной ориентации
ионов относительно друг друга и уменьшению
прочности связи между ними. Поэтому
расплавы их проводят электрический
ток. Ионные соединения, как правило,
легко растворяются в жидкостях, состоящих
из полярных молекул, например, воде.
Кристаллические решетки, в узлах которых находятся отдельные атомы, называются атомными . Атомы в таких решетках соединены между собой прочными ковалентными связями. Примером может служить алмаз — одна из модификаций углерода. Алмаз состоит из атомов углерода, каждый из которых связан с 4 соседними атомами. Координационное число углерода в алмазе равно 4. Вещества с атомной кристаллической решеткой имеют высокую температуру плавления (у алмаза свыше 3500 о С), прочны и тверды, практически не растворимы в воде.
Кристаллические
решетки, состоящие из молекул (полярных
и неполярных), называются молекулярными .
Молекулы в таких решетках соединены
между собой сравнительно слабыми
межмолекулярными силами. Поэтому
вещества с молекулярной решеткой имеют
малую твердость и низкую температуру
плавления, нерастворимы или малорастворимы
в воде, их растворы почти не проводят
электрический ток. Примерами их являются
лед, твердый СО 2
(«сухой лед»), галогены, кристаллы
водорода, кислорода, азота, благородных
газов и др.
Валентность
Важной количественной характеристикой, показывающей число взаимодействующих между собой атомов в образовавшейся молекуле, является валентность – свойство атомов одного элемента присоединять определенное число атомов других элементов.
Количественно валентность определяется числом атомов водорода, которое данный элемент может присоединять или замещать. Так, например, в плавиковой кислоте (HF) фтор одновалентен, в аммиаке (NH 3) азот трехвалентен, в кремневодороде (SiH 4 – силан) кремний четырехвалентен и т.д.
Позже,
с развитием представлений о строении
атомов, валентность элементов стали
связывать с числом неспаренных электронов
(валентных), благодаря которым
осуществляется связь между атомами.
Таким образом, валентностьопределяется
числом неспаренных электронов в атоме,
принимающих участие в образовании
химической связи (в основном или
возбужденном состоянии). В общем случае
валентность
равна числу электронных
пар, связывающих
данный атом с атомами других элементов.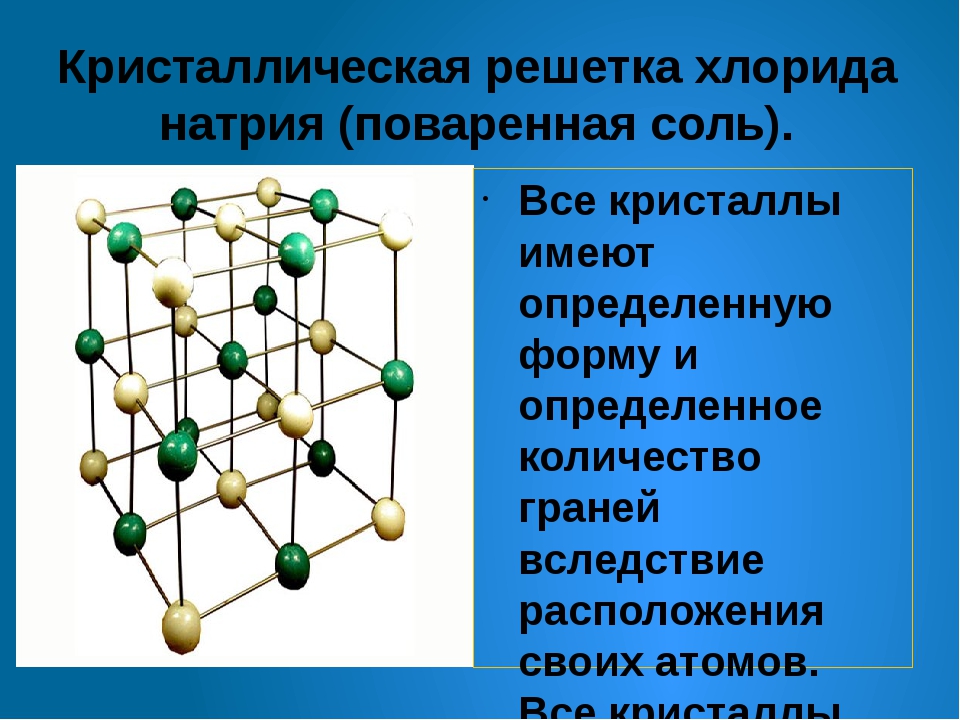
Координационные структуры. Координационными называются решетки, Б которых каждый атом (нон) окружен определенным числом соседей, находящихся на равных расстояниях и удерживаемых одинаковым типом химической связи (ионной, ковалентной, металлической). К координационным относятся ранее рассмотренные решетки хлорида натрия и хлорида цезия (см. рис. 58), алмаза (см. рис. 64) и металлов (см. рис. 65).
В больщинстве случаев поляризующее влияние катиона и поляризуемость анионов (особенно таких, как анион иода, серы,кислорода) приводят к увеличению ковалентного характера связей. Другим фактором, оказывающим действие на состояние связей, является степень экранирования катиона соединенными с ним анионами. Так, например, в решетке хлорида натрия анионы хлора в гораздо меньшей степени экранируют катион, чем в решетке хлорида алюминия или олова (IV). Решетка хлорида алюминия, возникшая при конденсации газообразного хлорида, имеет все шансы сохранить в узлах молекулы — ее ионный характер выражен очень слабо.
Кристаллические решетки, в узлах которых находятся отделе-ные атомы, называют атомными. Атомы в таких решетках соединены между собой прочными ковалентными связями. Примером можег служить алмаз — одна из модификаций углерода. Алмаз состоит из атомов углерода, каждый из которых связан с четырьмя соседними атомами. Координационное число углерода в алмазе равно 4. Структура алмаза приведена на с. 127. В решетке алмаза, как и в решетке хлорида натрия, молекулы отсутствуют. Весь кристалл следует рассматривать как гигантскую макромолекулу. Число веществ с атомной кристаллической решеткой в неорганической химии велико. Они имеют высокие температуры плавления (у алмаза свыше 3500 °С), прочны и тверды, практически нерастворимы в жидкостях.
Упрощенная модель ионной решетки хлорида натрия.
Для оценки точности формулы (11. 6) представляет интерес сопоставить АСкаС с изменением энтальпии в ходе разрушения кристаллической решетки хлорида натрия АВ аа- Величину A/fsaa можно определить при помощи следующего термодинамического цикла
6) представляет интерес сопоставить АСкаС с изменением энтальпии в ходе разрушения кристаллической решетки хлорида натрия АВ аа- Величину A/fsaa можно определить при помощи следующего термодинамического цикла
Чем отличаются ионы, содержащиеся в кристаллической решетке хлорида натрия и гидроксида натрия, от ионов, содержащихся в растворах этих веществ
Рассмотрим структуру типичных неорганических веществ. На рис. 1 приведена кристаллическая решетка хлорида натрия. Приня-
Дефекты этого типа наблюдаются, например, в решетке хлорида натрия — некоторые узлы, отвечающие катионам и анионам, остаются пустыми. Анионы вообще редко смещаются в междоузлия, так как они, как правило, крупнее катионов. Для катионов возможны оба типа дефектов.
В другом цикле, предложенном Майером (1930), используются энергии сублимации галогенидов шелочных металлов, энергии диссоциации их газообразных молекул и некоторые другие термохимические величины, уже фигурировавшие в цикле Габера — Борна.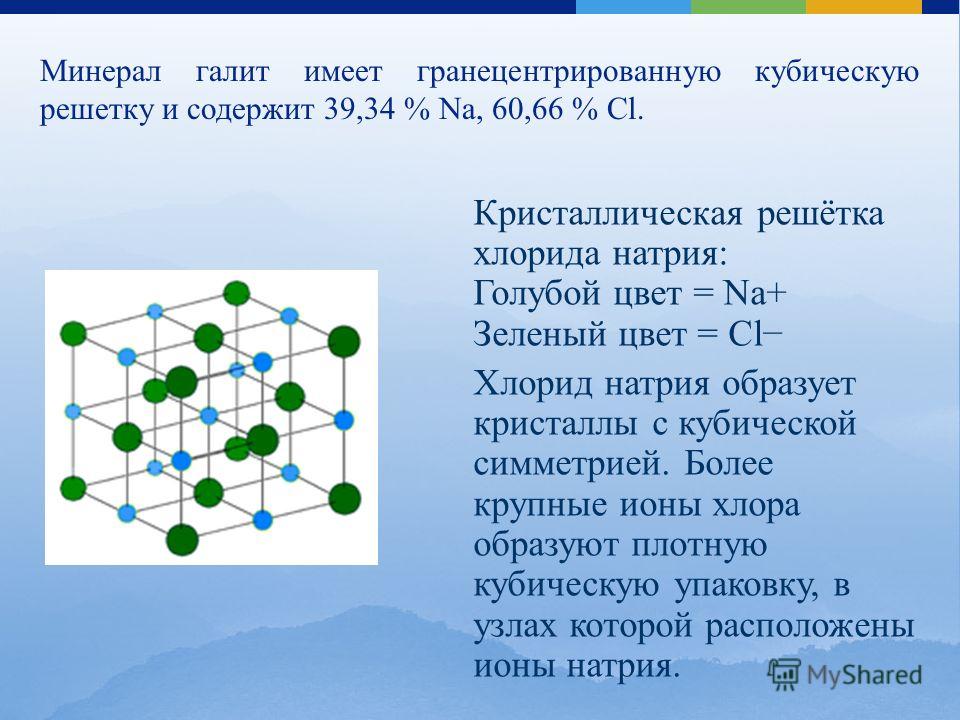 Для Na l этот цикл дает AG = 75(5 кДж-м оль. Таким образом, можно полагать, что энергия решетки хлорида натрия должна лежать в пределах от 760 до 790 кДж-моль, куда попадают значения, подсчитанные по уравнениям. (1.23) и (1.25) величину 762 кДж-моль- можно считать наиболее вероятным значением энергии решетки Na l.
Для Na l этот цикл дает AG = 75(5 кДж-м оль. Таким образом, можно полагать, что энергия решетки хлорида натрия должна лежать в пределах от 760 до 790 кДж-моль, куда попадают значения, подсчитанные по уравнениям. (1.23) и (1.25) величину 762 кДж-моль- можно считать наиболее вероятным значением энергии решетки Na l.
Кристаллические решетки, в узлах которых находятся отдельные атомы, называют атомными. Атомы в таких решетках соединены между собой прочными ковалентными связями. Примером может служить алмаз — одна из модификаций углерода. Алмаз состоит из атомов углерода, каждый из которых связан с четырьмя соседними атомами. Координационное число углерода в алмазе равно 4. Структура алмаза приведена на рис. 84. В решетке алмаза, как и в решетке хлорида натрия, молекулы отсутствуют. Весь кристалл следует рассматривать как гигантскую макромолекулу.
Тепловой эффект здееь характеризует энергию кристаллической решетки хлорида натрия.
Способ образования ионных решеток приводит к тому, что они обладают компактной структурой.
В решетке хлорида натрия координационные числа обоих ион зв равны 6. Итак, в кристалле хлорида натрия нельзя выделить отдельные молекулы соли. Их нет. Весь кристалл следует рассматривать как гигантскую макромолекулу, состоящую из равного числа ионов Ка+ и С1 , На С1 , где/г — большое число (см. рис. 3.15). Связи между ионами в таком кристалле весьма прочны. Поэтому вещества с ионной решеткой обладают сравнительно высокой твердостью. Они тугоплавки и малолетучи.
Некоторые электролиты уже до растворения состоят из ионов. Так, например, кристаллическая решетка хлорида натрия построена из ионов натрия и хлорид-ионов, решетка нитрата калия — из. ионов калия и нитрат-ионов и т. п. При растворении таких веществ ионы сольватируются и переходят в жидкую фазу. В растворе нет молекул растворенного вещества, имеются только ионы.
Воспол11зуемся приведенными уравЕ(ениямн для оценки энергии решетки хлорида натрия. Формула Борна (1.23) после подстановки численных значений всех входящих в нее величин дает для энергии решетки
Энергии и теплоты сольватации электролитов были рассчитаны впервые Борном и Габером (1919) фи помощи циклов, основанных на термохимическом законе Гесса. Так, например, при вычислении теплоты гидратации хлорида натрия 1 моль твердой кристаллической соли мысленно переводят в бесконечно большсш объем воды при зтом выделяется теплота растворения -AHl, = Qь Тот же раствор хлорида натрия можно получить, если сначала разрушить кристаллическую решетку с образованием ионов натрия и хлора в газовой фазе на это затрачивается элергия, равная энергии решетки хлорида натрия -Д(5р = — V Затем эти ионы переводят в бесконечно большой объем воды, при этом освобождается суммарная теплота гидратации ионов натрия и хлора — Д/У, +
Энтропия метанола, СН3ОН, при растворении возрастает лишь незначительно, поскольку моль молекул метанола, диспергированных между молекулами воды, оказывается нена шого больше неупорядоченным, чем моль чистого жидкого метанола. Растворение муравьиной кислоты, НСООН, приводит к большему возрастанию энтропии, поскольку ее молекулы частично диссоциируют на протоны и формиат-ионы, НСОО в результате чего из одной частицы образуются две. Кристаллическая решетка хлорида натрия при растворении полностью разрушается, и при этом образуются гидратированные ионы Na и С1 , что обусловливает значительное возрастание неупорядоченности, хотя часть молекул воды оказывается связанной вследствие гидратирования ионов. Заметим, что энтропия раствора Na l получена из данньк приложения 3 путем сум шрования энтропий водных растворов двух ионов
Растворение муравьиной кислоты, НСООН, приводит к большему возрастанию энтропии, поскольку ее молекулы частично диссоциируют на протоны и формиат-ионы, НСОО в результате чего из одной частицы образуются две. Кристаллическая решетка хлорида натрия при растворении полностью разрушается, и при этом образуются гидратированные ионы Na и С1 , что обусловливает значительное возрастание неупорядоченности, хотя часть молекул воды оказывается связанной вследствие гидратирования ионов. Заметим, что энтропия раствора Na l получена из данньк приложения 3 путем сум шрования энтропий водных растворов двух ионов
Следовательно, энергия кулононского взаимодействия одною иона со всеми другими ионами в решетке хлорида натрия в а раз превышает энергию взаимодействия двух однозарядных иоков, находящихся на расстоянии г. Таким образом, коэффициент Маделунга а для Na l равен 1,7475. Аналогичным методом можно вычислить эти величины и для других кристаллических решеток. Значения коэффициентов Маделунга для некоторых типов кристаллических структур приведены в табл. 24.
24.
Помимо типов связи кристаллы отличаются своей геометрией. Кубическая решетка хлорида натрия является простейшим примером. Кристалл СзС1 образует так называемую объемно-центрированную кубическую решетку. В вершинах куба, образующего элементарную ячейку, находятся одноименно заряженные ионы, скажем, ионы С1 , а в центре куба — ион Сз+. В то же время этот центр может рассматриваться, как вершина другого куба, в вершинах которого находятся ионы цезия, а в центре-анион С1 . В этом варианте каждый ион окружен восемью (а не шестью, как в случае ЫаС1) противоионами, т. е. координационное число равно восьми (рис. 55).
Для галидов щелочных и щелочноземельных металлов харак-кулярных, образующих молекулярные решетки. Степень ковалент-рированная решетка хлорида натрия. Хлорид, бромид и иодид цезия кристаллизуются в решетке типа объемно центрированного куба. Тип решетки ионного кристалла определяется правилом, основанным на простых геометрических соображениях отношение радиусов катиона и аниона 0,2 соответствует решетке типа сульфида цинка если это отношение лежит в пределах от 0,22 до 0,41, мож-
Число ближайших соседних частиц, вплотную примыкающих к данной частице в кристалле или в отдельной молекуле, назысается координационным числом.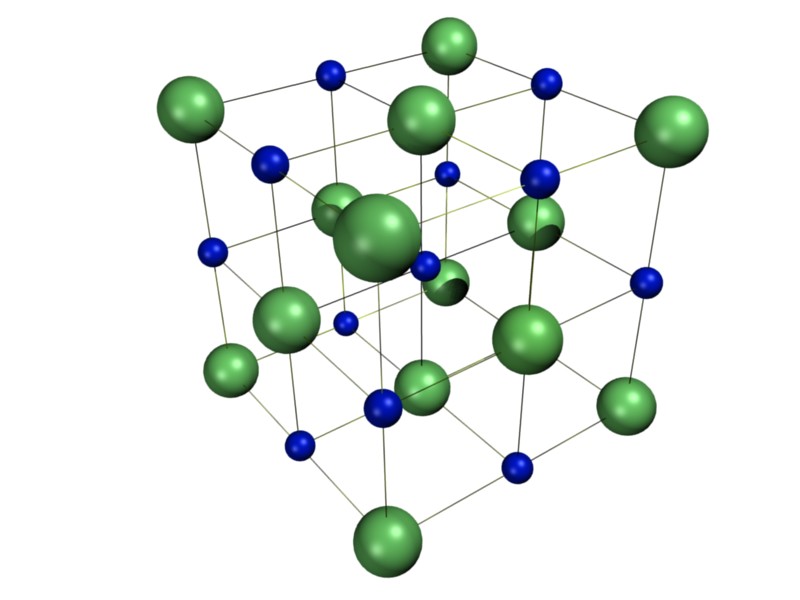 В решетке хлорида натрия координационные числа обоих ионов равны 6. Итак, в кристалле хлорида натрия нельзя выделить отдельные ионные молекулы соли. Их нет. Весь кристалл следует рассматривать как гигантскую макромолекулу, состоящую из равного числа ионов и С1 , например Ыа,Х, где п- большое число (см. рис. 1.21). Связи между ионами в таком кристалле весьма прочны. Поэтому вещества с ионной решеткой обладают сравнительно высоко11 твердостью. Они тугоплавки и малолетучи.
В решетке хлорида натрия координационные числа обоих ионов равны 6. Итак, в кристалле хлорида натрия нельзя выделить отдельные ионные молекулы соли. Их нет. Весь кристалл следует рассматривать как гигантскую макромолекулу, состоящую из равного числа ионов и С1 , например Ыа,Х, где п- большое число (см. рис. 1.21). Связи между ионами в таком кристалле весьма прочны. Поэтому вещества с ионной решеткой обладают сравнительно высоко11 твердостью. Они тугоплавки и малолетучи.
Существенно то, что в структуре поваренной соли нельзя очертить отдельные молекулы ЫаС1, так как их нет. Атомы натрия и хлора в решетке хлорида натрия не связаны попарно между собой. Между тем в условиях повышенной температуры в парах хлорида натрия существуют молекулы ЫаС1. При этом равновесное расстояние между натрием и хлором в кристалле на 15% больше, чем в газообразной молекуле Na l, т. е. последняя менее ионна.
Таким образом, во всех рассмотренных структурах нельзя выделить обособленные молекулы в кристаллической решетке.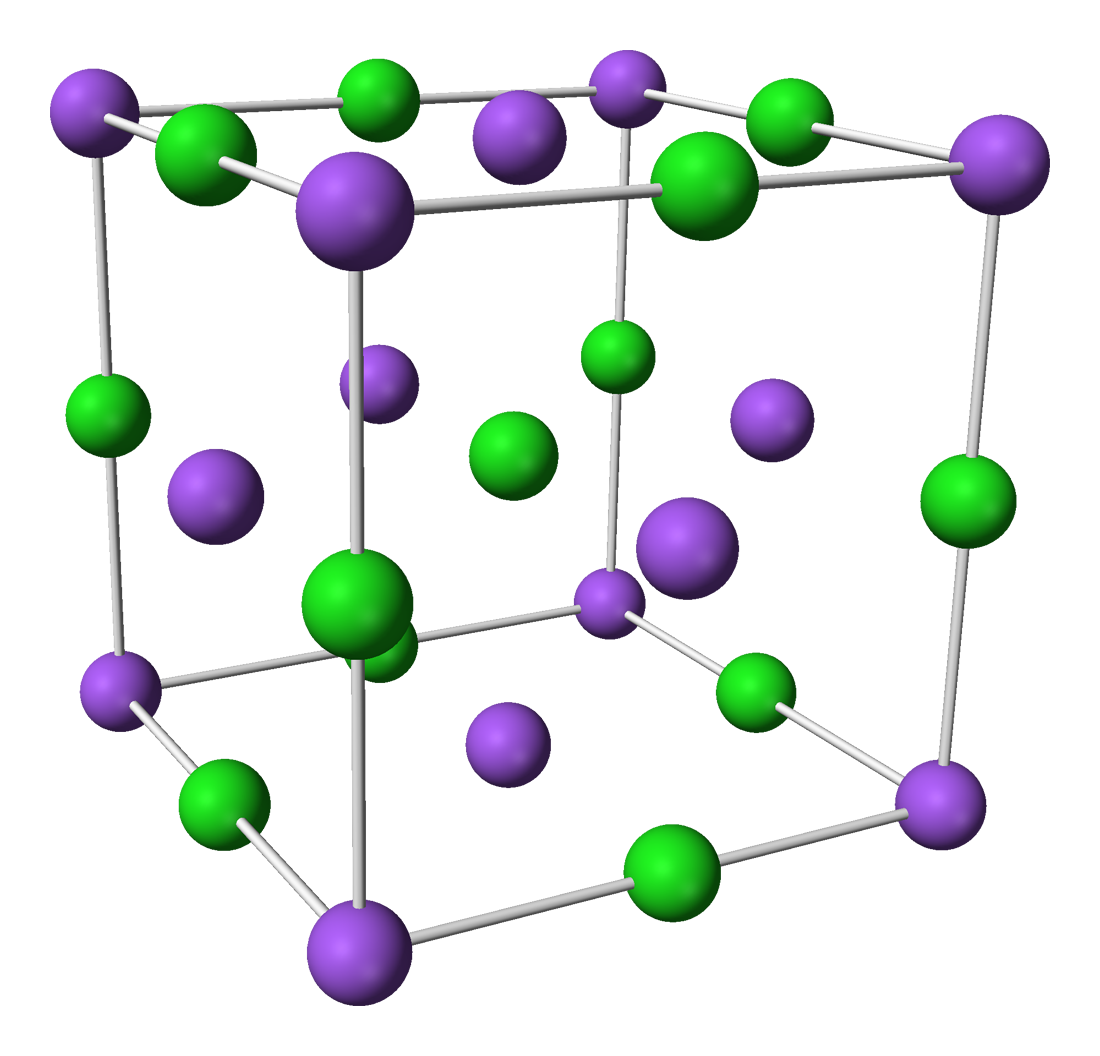 Такие кристаллические решетки, в которых отсутствуют дискретные молекулы, называются координационными решетками. Для большинства неорганических веществ (более 95%) характерны именно координационные решетки. К ним относятся условно ионные, металлические и ковалентные решетки. К условно ионным решеткам принадлежит решетка хлорида натрия, металлическим — решетка натрия и ковалентным — решетки кремния и сульфида цинка. Это деление, основанное на преобладающем типе химической связи, условно. В реальных кристаллах сосуществуют различные типы химической связи, и можно рассматривать решетки ионно-ко-валентные, ковалентно-металлические и т. п. На рис. 5 для сравнения приведены элементарные ячейки м.о. 1екулярных решеток иода (а) и диоксида углерода (б). Их важнейшей особенностью в отличие от предыдущих типов кристаллов является то, что в узлах кристаллической решетки находятся не атомы, а молекулы. При этом расстояния между атомами в молекуле меньше, чем межмолекулярные расстояния в кристалле, в то время как в координационных решетках все расстояния одинаковы.
Такие кристаллические решетки, в которых отсутствуют дискретные молекулы, называются координационными решетками. Для большинства неорганических веществ (более 95%) характерны именно координационные решетки. К ним относятся условно ионные, металлические и ковалентные решетки. К условно ионным решеткам принадлежит решетка хлорида натрия, металлическим — решетка натрия и ковалентным — решетки кремния и сульфида цинка. Это деление, основанное на преобладающем типе химической связи, условно. В реальных кристаллах сосуществуют различные типы химической связи, и можно рассматривать решетки ионно-ко-валентные, ковалентно-металлические и т. п. На рис. 5 для сравнения приведены элементарные ячейки м.о. 1екулярных решеток иода (а) и диоксида углерода (б). Их важнейшей особенностью в отличие от предыдущих типов кристаллов является то, что в узлах кристаллической решетки находятся не атомы, а молекулы. При этом расстояния между атомами в молекуле меньше, чем межмолекулярные расстояния в кристалле, в то время как в координационных решетках все расстояния одинаковы. Однако молекулярные решетки не характерны для твердых неорганических веществ. В неорганической химии молекулы являются типичной формой существования химического соединения в наро- и газообразном состоянии.
Однако молекулярные решетки не характерны для твердых неорганических веществ. В неорганической химии молекулы являются типичной формой существования химического соединения в наро- и газообразном состоянии.
Отсюда Ещ, = -772,4 кДж/моль. Большая отрицательная величина энергии кристаллической решетки хлорида натрия указывает на экзотермичность процесса образования и значительную стабильность кристаллического Na l. Расчеты по приведенной схеме, называемой циклом Борна — Габера, крайне важны в неорганической химии, поскольку позволяют оценить энергию связи в соединении и другие важные энергетические характеристики твердых тел.
Отсюда и = -772,А кДж/моль. Большая отрицательная величина энергии кристаллической решетки хлорида натрия указывает на экзотермичность процесса образования и значительную стабильность кристаллического Na l.
Термохимический цикл для расчета эиергаи кристаллической решетки хлорида натрия складывается из следующих реакций
Смотреть страницы где упоминается термин Решетка хлорида натрия : Общая химия (1968) — [
Большинство твёрдых веществ имеет кристаллическое
строение, которое характеризуется строго определённым расположением частиц
. Если соединить частицы условными линиями, то получится пространственный каркас, называемый кристаллической решёткой
. Точки, в которых размещены частицы кристалла, называют узлами решётки
. В узлах воображаемой решётки могут находиться атомы
, ионы
или молекулы
.
Если соединить частицы условными линиями, то получится пространственный каркас, называемый кристаллической решёткой
. Точки, в которых размещены частицы кристалла, называют узлами решётки
. В узлах воображаемой решётки могут находиться атомы
, ионы
или молекулы
.
В зависимости от природы частиц, расположенных в узлах, и характера связи между ними различают четыре типа кристаллических решёток: ионную , металлическую , атомную и молекулярную .
Ионными называют решётки, в узлах которых находятся ионы.
Их образуют вещества с ионной связью. В узлах такой решётки располагаются положительные и отрицательные ионы, связанные между собой электростатическим взаимодействием.
Ионные кристаллические решётки имеют соли
, щёлочи
, оксиды активных металлов
. Ионы могут быть простые или сложные. Например, в узлах кристаллической решётки хлорида натрия находятся простые ионы натрия Na + и хлора Cl − , а в узлах решётки сульфата калия чередуются простые ионы калия K + и сложные сульфат-ионы S O 4 2 − .
Связи между ионами в таких кристаллах прочные. Поэтому ионные вещества твёрдые , тугоплавкие , нелетучие . Такие вещества хорошо растворяются в воде .
Кристаллическая решётка хлорида натрия
Кристалл хлорида натрия
Металлическими называют решётки, которые состоят из положительных ионов и атомов металла и свободных электронов.
Их образуют вещества с металлической связью. В узлах металлической решётки находятся атомы и ионы (то атомы, то ионы, в которые легко превращаются атомы, отдавая свои внешние электроны в общее пользование).
Такие кристаллические решётки характерны для простых веществ металлов и сплавов .
Температуры плавления металлов могут быть разными (от \(–37\) °С у ртути до двух-трёх тысяч градусов). Но все металлы имеют характерный металлический блеск , ковкость , пластичность , хорошо проводят электрический ток и тепло .
Металлическая кристаллическая решётка
Металлические изделия
Атомными
называют кристаллические решётки, в узлах которых находятся отдельные атомы, соединённые ковалентными связями.
Такой тип решётки имеет алмаз — одно из аллотропных видоизменений углерода. К веществам с атомной кристаллической решёткой относятся графит , кремний , бор и германий , а также сложные вещества, например, карборунд SiC и кремнезём , кварц , горный хрусталь , песок , в состав которых входит оксид кремния(\(IV\)) Si O 2 .
Таким веществам характерны высокая прочность и твёрдость . Так, алмаз является самым твёрдым природным веществом. У веществ с атомной кристаллической решёткой очень высокие температуры плавления и кипения . Например, температура плавления кремнезёма — \(1728\) °С, а у графита она выше — \(4000\) °С. Атомные кристаллы практически нерастворимы .
Кристаллическая решётка алмаза
Алмаз
Молекулярными называют решётки, в узлах которых находятся молекулы, связанные слабым межмолекулярным взаимодействием.
Несмотря на то, что внутри молекул атомы соединены очень прочными ковалентными связями, между самими молекулами действуют слабые силы межмолекулярного притяжения. Поэтому молекулярные кристаллы имеют небольшую прочность
и твёрдость
, низкие температуры плавления
и кипения
. Многие молекулярные вещества при комнатной температуре представляют собой жидкости
и газы
. Такие вещества летучи
. Например, кристаллические иод и твёрдый оксид углерода(\(IV\)) («сухой лёд») испаряются, не переходя в жидкое состояние. Некоторые молекулярные вещества имеют запах
.
Поэтому молекулярные кристаллы имеют небольшую прочность
и твёрдость
, низкие температуры плавления
и кипения
. Многие молекулярные вещества при комнатной температуре представляют собой жидкости
и газы
. Такие вещества летучи
. Например, кристаллические иод и твёрдый оксид углерода(\(IV\)) («сухой лёд») испаряются, не переходя в жидкое состояние. Некоторые молекулярные вещества имеют запах
.
Такой тип решётки имеют простые вещества в твёрдом агрегатном состоянии: благородные газы с одноатомными молекулами (He , Ne , Ar , Kr , Xe , Rn ), а также неметаллы с двух- и многоатомными молекулами ( H 2 , O 2 , N 2 , Cl 2 , I 2 , O 3 , P 4 , S 8).
Молекулярную кристаллическую решётку имеют также вещества с ковалентными полярными связями: вода — лёд , твёрдые аммиак , кислоты , оксиды неметаллов . Большинство органических соединений тоже представляют собой молекулярные кристаллы (нафталин , сахар , глюкоза ).
Раздел 3. ХИМИЧЕСКИЙ СВЯЗЬ
§ 3.7. Типы кристаллических решеток
Твердые вещества, как правило, имеют
кристаллическое строение. Она характеризуется правильным расположением частиц в
четко определенных точках пространства. При мысленном соединении этих точек прямыми
линиями, которые пересекаются, образуется пространственный каркас, который называют
кристаллической решеткой. Точки, в которых размещены частицы, называются узлами
кристаллической решетки. В узлах воображаемой решетки Могут находиться ионы, атомы
или молекулы. Они совершают колебательное движение. С повышением температуры
амплитуда колебаний увеличивается, что проявляется в тепловом расширении тел.
Она характеризуется правильным расположением частиц в
четко определенных точках пространства. При мысленном соединении этих точек прямыми
линиями, которые пересекаются, образуется пространственный каркас, который называют
кристаллической решеткой. Точки, в которых размещены частицы, называются узлами
кристаллической решетки. В узлах воображаемой решетки Могут находиться ионы, атомы
или молекулы. Они совершают колебательное движение. С повышением температуры
амплитуда колебаний увеличивается, что проявляется в тепловом расширении тел.
В зависимости от вида частиц и характера связи между ними различают четыре типа кристаллических решеток: ионные, атомные, молекулярные и металлические.
Кристаллические решетки, состоящие
из ионов, называются іонними. их образуют вещества с ионными связями.
Примером может быть кристалл хлорида натрия, в котором, как уже отмечалось, каждый
ион натрия окружен шестью хлорид-ионами, а каждый хлорид-ион — шестью ионами
натрия. Такому размещению отвечает самая плотная упаковка, если ионы представить в
виде шаров, размещенных в кристалле (рис. 3.15). Очень часто кристаллические решетки
изображают так, как показано на рис. 3.16, где указано лишь взаимное размещение
частиц, но не их размеры.
3.15). Очень часто кристаллические решетки
изображают так, как показано на рис. 3.16, где указано лишь взаимное размещение
частиц, но не их размеры.
Число ближайших соседних частиц, плотно присоединяются к данной частицы в кристалле или в отдельной молекуле, называется координационным числом.
В решетке хлорида натрия координационные числа обоих ионов равны 6. Следовательно, в кристалле хлорида натрия невозможно выделить отдельные молекулы соли. их нет. Весь кристалл следует рассматривать как гігантськумакромолекулу, состоящая из одинакового числа ионов Na + и С l — , Na n Cl n , где n — большое число (см. рис. 3.15). Связи между ионами в таком кристалле достаточно прочные. Поэтому вещества с ионной решеткой имеют сравнительно высокую твердость. Они тугоплавкие и малолеткі.
Плавления ионных кристаллов вызывает
в нарушение геометрически правильной ориентации ионов относительно друг друга и
уменьшение прочности связи между ними. Поэтому их расплавы проводят электрический
ток. Ионные соединения, как правило, легко растворяются в жидкостях, состоящих
из полярных молекул, например в воде.
Ионные соединения, как правило, легко растворяются в жидкостях, состоящих
из полярных молекул, например в воде.
Рис. 3.15. Пространственное размещение ионов в ионной решетке NaCl (мелкие шарики — ионы натрия)
Рис. 3.16. Кристаллическая решетка NaCl
Кристаллические решетки,в узлах которых
размещаются отдельные атомы, называются атомными. Атомы в таких решетках
соединенные между собой прочными ковалентними связями. Примером может служить алмаз —
одна из модификаций углерода. Алмаз состоит из атомов углерода, каждый из которых
связан с четырьмя соседними атомами. Координационное число углерода в алмазе —
4. Структура алмаза представлена на рис. 11.1. В решетке алмаза, как и в решетке
хлорида натрия, молекул нет. Весь кристалл следует рассматривать как гигантскую
молекулу. В неорганической химии известная значительное количество веществ с атомной
кристаллической решеткой. Они имеют высокие температуры плавления (для алмаза
свыше 500°С), крепкие и твердые, практически не растворимые в жидкостях.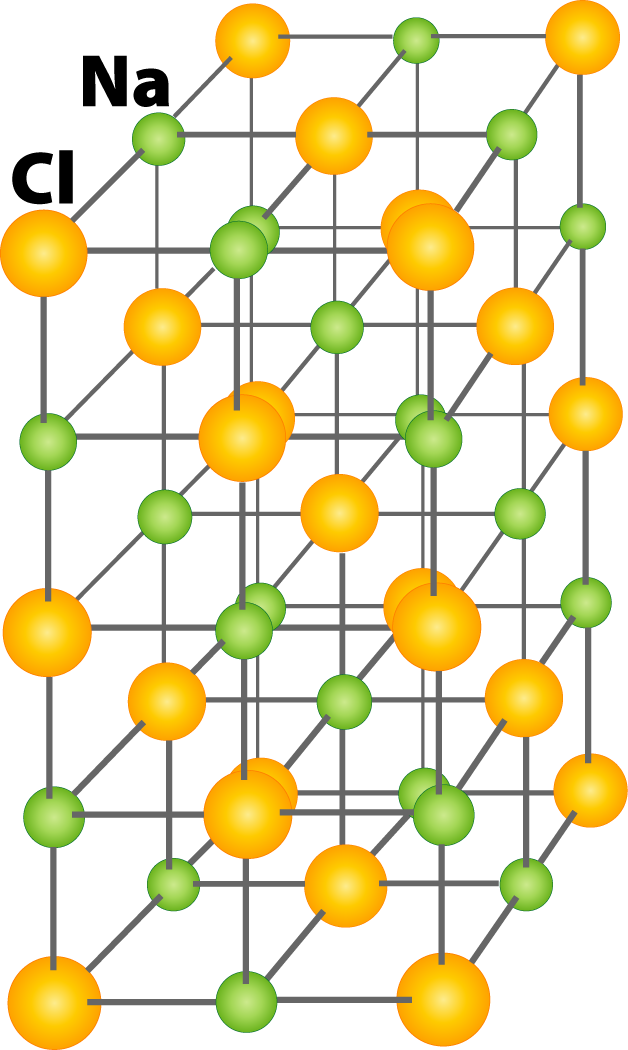 Атомная
кристаллическая решетка характерна для твердого бора, кремния, германия и соединений
некоторых элементов с карбоном и силіцієм. Кристаллические решетки,
состоящие из молекул (полярных и неполярных), называются молекулярными.
Молекулы в таких решетках соединены между собой сравнительно слабыми
межмолекулярными силами. Поэтому вещества с молекулярной решеткой имеют малую
твердость, низкие температуры плавления, нерастворимые или малорастворимые в воде,
их растворы почти не проводят электрического тока. Число неорганических веществ с
молекулярной решеткой незначительное. Примерами их являются лед, твердый оксид углерода(И
V
) (“сухой лед”), твердые
галогеноводні, твердые простые вещества, образованные одно- (благородные газы), двух-
(F
2
, С
l
2
,
r
2
,
l
2
, Н 2 , О 2 ,
N
2
), трех- (О 3), четырех-
(Г 4), восьми- (S
8)
атомными молекулами. Молекулярная кристаллическая решетка йода представлена на рис. 3.17.
Большинство кристаллических органических соединений имеют молекулярную решетку.
Атомная
кристаллическая решетка характерна для твердого бора, кремния, германия и соединений
некоторых элементов с карбоном и силіцієм. Кристаллические решетки,
состоящие из молекул (полярных и неполярных), называются молекулярными.
Молекулы в таких решетках соединены между собой сравнительно слабыми
межмолекулярными силами. Поэтому вещества с молекулярной решеткой имеют малую
твердость, низкие температуры плавления, нерастворимые или малорастворимые в воде,
их растворы почти не проводят электрического тока. Число неорганических веществ с
молекулярной решеткой незначительное. Примерами их являются лед, твердый оксид углерода(И
V
) (“сухой лед”), твердые
галогеноводні, твердые простые вещества, образованные одно- (благородные газы), двух-
(F
2
, С
l
2
,
r
2
,
l
2
, Н 2 , О 2 ,
N
2
), трех- (О 3), четырех-
(Г 4), восьми- (S
8)
атомными молекулами. Молекулярная кристаллическая решетка йода представлена на рис. 3.17.
Большинство кристаллических органических соединений имеют молекулярную решетку.
Рис. 3.17. Кристаллическая решетка йода
Рис. 3.18. Схематическое изображение металлической решетки
В твердом состоянии металлы образуют металлические кристаллические решетки. Последние обычно описывают как сочетание катионов металла, соединенных в одно целое валентными электронами, то есть негативно заряженным “электронным газом”. Электроны электростатически притягиваются катионами, что обеспечивает стабильность решетки. На рис. 3.18 представлено схематическое изображение металлической решетки. На рис. 3.18 представлено схематическое изображение металлической решетки (свободные электроны изображены точками). Сравните ее с другими типами кристаллических решеток.
Большинство твердых веществ имеют кристаллическую структуру , в которой частицы, из которых она «построена» находятся в определенном порядке, создавая тем самым кристаллическую решетку . Она строится из повторяющихся одинаковых структурных единиц — элементарных ячеек , которая связывается с соседними ячейками, образуя дополнительные узлы. В результате существует 14 различных кристаллических решеток.
В результате существует 14 различных кристаллических решеток.
Типы кристаллических решеток.
В зависимости от частиц, которые стоят в узлах решетки, различают:
- металлическую кристаллическую решетку;
- ионную кристаллическую решетку;
- молекулярную кристаллическую решетку;
- макромолекулярную (атомную) кристаллическую решетку.
Металлическая связь в кристаллических решетках.
Ионные кристаллы обладают повышенной хрупкостью, т.к. сдвиг в решетке кристалла (даже незначительный) приводит к тому, что одноименно заряженные ионы начинают отталкиваться друг от друга, и связи рвутся, образуются трещины и расколы.
Молекулярная связь кристаллических решеток.
Основная особенность межмолекулярной связи заключается в ее «слабости» (ван-дер-ваальсовые, водородные).
Это структура льда. Каждая молекула воды связана водородными связями с 4-мя окружающими ее молекулами, в результате структура имеет тетраэдрический характер.
Водородная связь объясняет высокую температуру кипения, плавления и малую плотность;
Макромолекулярная связь кристаллических решеток.
В узлах кристаллической решетки находятся атомы. Эти кристаллы разделяются на 3 вида:
- каркасные;
- цепочечные;
- слоистые структуры.
Каркасной структурой обладает алмаз — одно их самых твердых веществ в природе. Атом углерода образует 4 одинаковые ковалентные связи, что говорит о форме правильного тетраэдра (sp 3 — гибридизация). Каждый атом имеет неподеленную пару электронов, которые также могут связываться с соседними атомами. В результате чего образуется трехмерная решетка, в узлах которой только атомы углерода.
Энергии для разрушения такой структуры требуется очень много, температура плавления таких соединений высока (у алмаза она составляет 3500°С).
Слоистые структуры говорят о наличии ковалентных связях внутри каждого слоя и слабых ван-дер-ваальсовых — между слоями.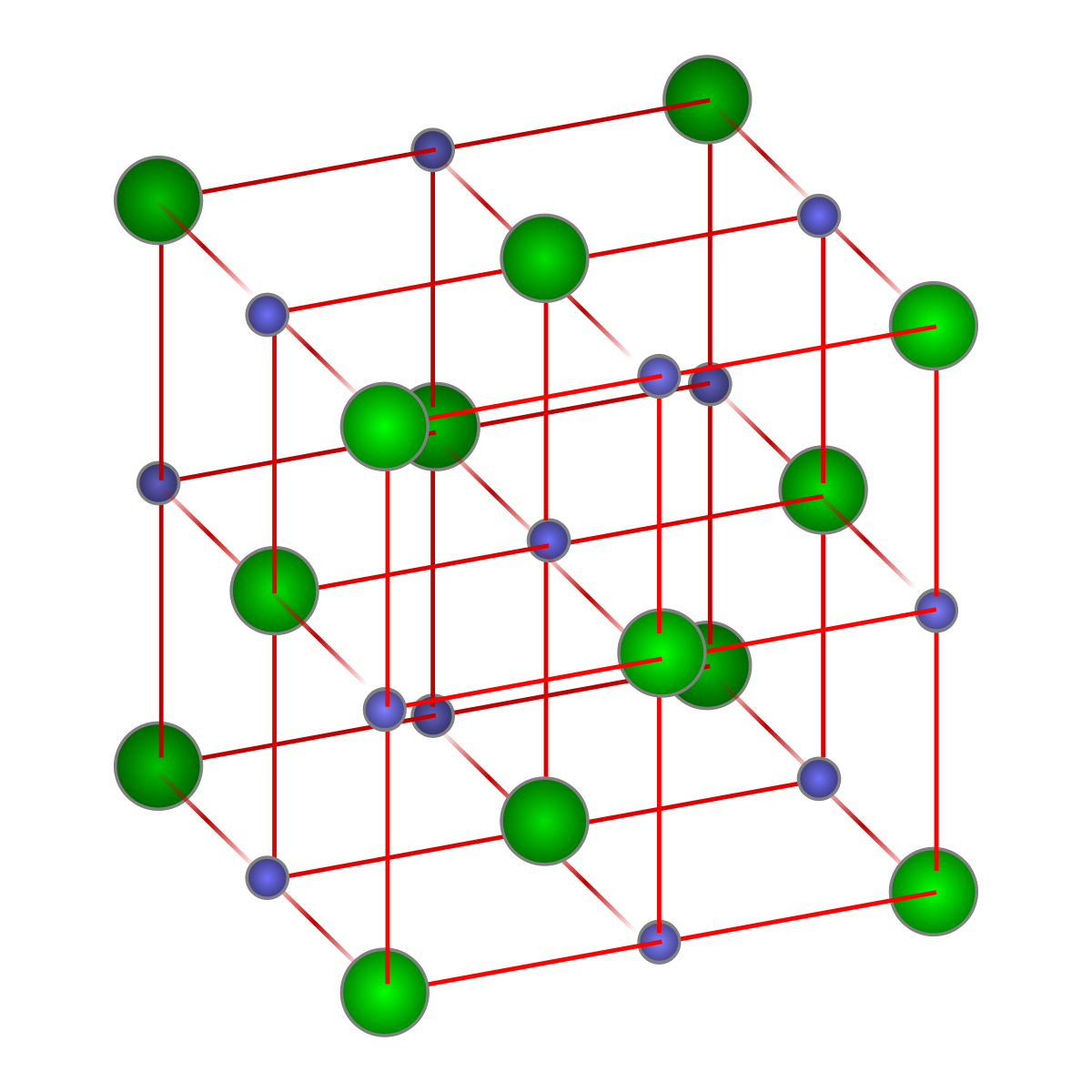
Рассмотрим пример: графит. Каждый атом углерода находится в sp 2 — гибридизации. 4-ый неспаренный электрон образует ван-дер-ваальсовую связь между слоями. Поэтому 4ый слой очень подвижен:
Связи слабые, поэтому их легко разорвать, что можно наблюдать у карандаша — «пишущее свойство» — 4ый слой остается на бумаге.
Графит — отличный проводник электрического тока (электроны способны перемещаться вдоль плоскости слоя).
Цепочечными структурами обладают оксиды (например, SO 3 ), который кристаллизуется в виде блестящих иголок, полимеры, некоторые аморфные вещества, силикаты (асбест).
Натрий Кристаллическая структура — Энциклопедия по машиностроению XXL
Во многих случаях силы, которые связывают отдельные атомы в кристаллы, по своей природе такие же, как и силы, действующие при образовании молекул. Например, в твердом хлористом натрии кристаллическая структура (рис.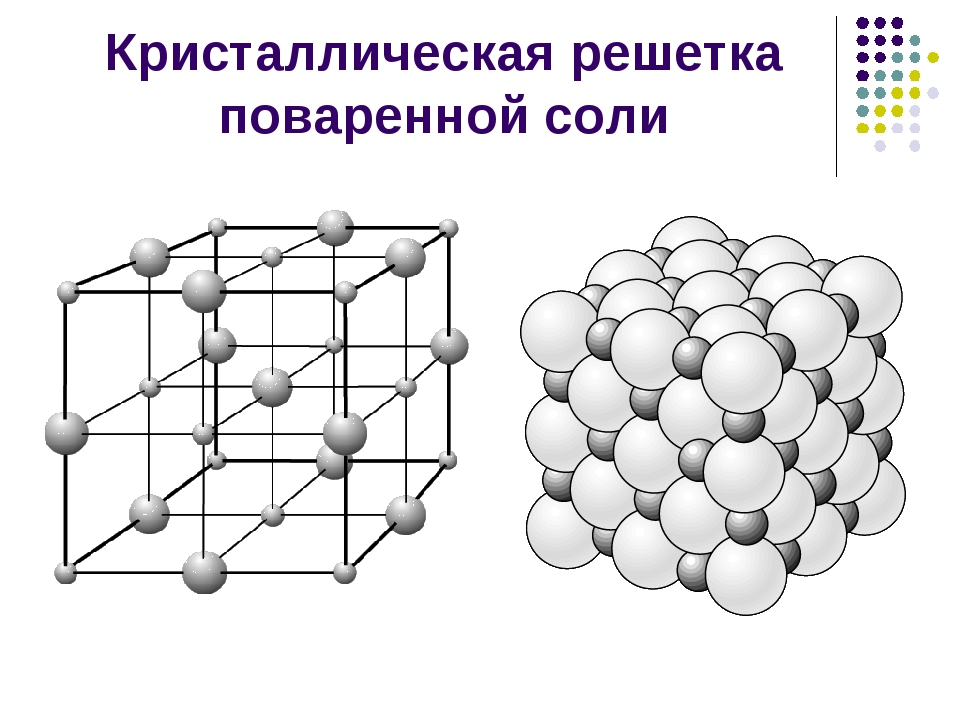 4) образуется
[c.27]
4) образуется
[c.27]Белые куски (20—40 мм) с кристаллической структурой в изломе. Наряду с влагой хорошо поглощает углекислыи газ. Едкий натр, впитывая влагу, быстро расплывается и закрывает каналы для прохода газа. Едкое кали, поглощая углекислоту, покрывается коркой двууглекислого калия, замедляющей дальнейшее поглощение влаги. Едкое кали лучше поглощает влагу, а едкий натр—углекислый газ [c.143]
При снижении потенциала пленка растворяется в электролите и анод вновь становится активным. Исключение составляет кривая, полученная в электролите с низкой концентрацией едкого натра. В этом случае во всем диапазоне плотностей тока анод остается пассивным. Во всех других случаях аноды имели серовато-золотистый цвет, свидетельствующий о наличии на их поверхности пленки, и сильно выявленную кристаллическую структуру. По-видимому, в электролите с малой концентрацией едкого натра изменяется характер анодной пленки и ее растворимость в электролите понижается.
 [c.101]
[c.101]С увеличением упорядоченности кристаллической структуры графита повышается температура начала реакции. Катализаторами процесса окисления могут быть примеси, особенно железо, ванадий, натрий. В присутствии примесей окисление носит локальный характер. При уменьшении содержания примесей окисление становится более равномерным и снижается разброс его значений. Повышение стойкости графита к окислению предусматривает введение в него некоторых элементов, например кремния, фосфора и др. Резко (на один порядок) снижает скорость окисления добавка хлора в количестве 1— 1,5% к кислороду [25]. [c.79]
Кристаллическая структура. По данным [5] натрий, входя в твердый раствор, уменьшает постоянную кристаллической решетки золота от а = = 4,0700 до а = 4,046 кХ. Наряду с этим постоянную кристаллической решетки для закаленного сплава с предельным содержанием натрия в твердом растворе в работе [3] определили равной а = 4,075 кХ. [c.127]
Сплавы Со—Р, содержащие до 6 % Р, имеют кристаллическую структуру и являются твердым раствором фосфора в гексагональном кобальте. Коэрцитивная сила сплава уменьшается с увеличением толщины покрытия и возрастает с повышением температуры рабочего раствора. Увеличение содержания в нем гипофосфита натрия сопровождается понижением коэрцитивной силы осадков, что меньше проявляется при высоком значении pH. Микротвердость химически полученного сплава Со—Р выше, чем формированного электрохимическим или металлургическим способом, и составляет 4000—7500 МПа. Увеличение содержания в осадке фосфора способствует повышению микротвердости.
[c.215]
Коэрцитивная сила сплава уменьшается с увеличением толщины покрытия и возрастает с повышением температуры рабочего раствора. Увеличение содержания в нем гипофосфита натрия сопровождается понижением коэрцитивной силы осадков, что меньше проявляется при высоком значении pH. Микротвердость химически полученного сплава Со—Р выше, чем формированного электрохимическим или металлургическим способом, и составляет 4000—7500 МПа. Увеличение содержания в осадке фосфора способствует повышению микротвердости.
[c.215]
Ниже мы кратко опишем некоторые простые кристаллические структуры, представляющие общий интерес к ним относятся, в частности, структуры хлористого натрия, хлористого цезия, гексагональная структура с плотной упаковкой, структура алмаза и кубическая структура сульфида цинка. [c.40]
Энергетическую зону, возникающую из 35-состояния атома натрия, можно приближенно описать как s-зону, построенную для соответствующей кристаллической структуры, что изображено на фиг. 55. В ионном кристалле эта (незанятая) 5-зона натрия
[c.178]
55. В ионном кристалле эта (незанятая) 5-зона натрия
[c.178]
Первая реальная попытка сравнения энергий различных кристаллических структур была предпринята в работе [211 для натрия, магния и алюминия. Перед этим впервые была определена функция Р д) для тех же металлов [строго говоря, еще раньше был проведен расчет для цинка, в котором использовалась довольно грубая функция Р д), полученная вручную ]. Сравнивались энергии гранецентрированной кубической, объемноцентрированной и гексагональной плотно упакованной структур. Поскольку величина отношения осей с1а в гексагональной плотно упакованной структуре не определяется симметрией, необходимо было рассчитать энергию этой структуры для ряда значений с а и выбрать то из них, которому отвечает минимум энергии. Результаты расчетов оказались удивительно хорошими. Было найдено, что как в натрии, так и в магнии наименьшей энергией обладает гексагональная плотно упакованная структура.
 При низкой температуре оба металла действительно являются гексагональными. Для алюминия наиболее энергетически выгодной оказалась гранецентрированная кубическая решетка, наблюдаемая при низких температурах. Интересно, что для гексагональных структур такие расчеты дают дополнительную информацию. В частности, как в натрии, так и в магнии значения с а, отвечающие минимуму энергии, оказались близкими к наблюдаемым. Кроме того, из изменения энергии при изменении с а можно непосредственно определить одну из упругих сдвиговых постоянных. Для магния вычисленная и найденная из эксперимента упругие постоянные оказались исключительно близкими для натрия в гексагональной модификации соответствующие экспериментальные данные отсутствуют, но теоретическое значение можно считать вполне разумным.
[c.491]
При низкой температуре оба металла действительно являются гексагональными. Для алюминия наиболее энергетически выгодной оказалась гранецентрированная кубическая решетка, наблюдаемая при низких температурах. Интересно, что для гексагональных структур такие расчеты дают дополнительную информацию. В частности, как в натрии, так и в магнии значения с а, отвечающие минимуму энергии, оказались близкими к наблюдаемым. Кроме того, из изменения энергии при изменении с а можно непосредственно определить одну из упругих сдвиговых постоянных. Для магния вычисленная и найденная из эксперимента упругие постоянные оказались исключительно близкими для натрия в гексагональной модификации соответствующие экспериментальные данные отсутствуют, но теоретическое значение можно считать вполне разумным.
[c.491]КУБИЧЕСКИЕ РЕШЕТКИ ПРИМИТИВНАЯ ЯЧЕЙКА, ЯЧЕЙКА ВИГНЕРА — ЗЕЙТЦА И УСЛОВНАЯ ЯЧЕЙКА КРИСТАЛЛИЧЕСКИЕ СТРУКТУРЫ И РЕШЕТКИ С БАЗИСОМ ГЕКСАГОНАЛЬНАЯ ПЛОТНОУПАКОВАННАЯ СТРУКТУРА И СТРУКТУРА ТИПА АЛМАЗА СТРУКТУРЫ ТИПА ХЛОРИДА НАТРИЯ, ХЛОРИДА ЦЕЗИЯ И ЦИНКОВОЙ ОБМАНКИ
[c. 76]
76]
Кристаллическая структура металлов. Хорошо известно, что атомы металлов, так же, как и солей, расположены в определенном порядке. Но кристалл соли, который растет из раствора, обычно принимает определенную форму (куб в случае хлористого натрия), которая сразу дает представление об определенном расположении атомов в кристаллической решетке (или трехмерном образце) металлическое же [c.335]
Щелочи (едкий натр и едкое кали)—твердые вещества кристаллической структуры (а также н в виде концентрированных растворов) обладают сильными [c.235]
Калий. В кристаллическом состоянии калий, так же как и натрий, имеет объемно-центрированную решетку. В жидком состоянии вплоть до 390° С координационное, число равняется 8, т. е. объемно-центрированная структура сохраняется. [c.7]
Кристаллический нитрат калия имеет ромбическую структуру арагонита [Л. 6] каждый катион-металл окружен девятью соседними ионами кислорода, в то время как каждый ион кислорода связан с тремя ионами металла и с ионом металлоида кислотного остатка. Структура нитрата калия более устойчива при высоких температурах, чем структура нитрата натрия.
[c.33]
Структура нитрата калия более устойчива при высоких температурах, чем структура нитрата натрия.
[c.33]
Поскольку рассеяние тепловых нейтронов вообще не зависит явно от атомного номера исследуемого вещества, то с помощью дифракции нейтронов легко выявляется различие атомов с близкими. Z (например, при исследовании упорядочения атомов Fe и Со в системе Fe — Со), что трудно сделать рентгенографически и электронографически. При использовании дифракции нейтронов возможно изучение изотопических (часто рассеивающие способности изотопов одного и того же элемента значительно различаются) и спиновых различий атомов, входящих в решетку, причем такие различия не замечают ни рентгеновские лучи, ни электроны. В то же время при дифракции нейтронов могут оказаться неразличимыми (имеющими приблизительно равную амплитуду рассеяния) совершенно разные атомы. Так как легкие вещества рассеивают нейтроны также эффективно, как и тяжелые, то с помощью нейтронографии успешно проводят изучение кристаллической структуры веществ, в состав которых входят одновременно атомы легких и тяжелых элементов (атомы водорода в гидриде циркония, углерода в аустените), а также структур из легких элементов (льда, гидрида натрия, дейтерита натрия, графита). Такие структуры нельзя исследовать с помощью рентгеновских лучей и затруднительно с помощью электронов нз-за незначительного рассеяния их легкими элементами.
[c.37]
Такие структуры нельзя исследовать с помощью рентгеновских лучей и затруднительно с помощью электронов нз-за незначительного рассеяния их легкими элементами.
[c.37]
Во втором варианте создаются твердые электролиты с нужными свойствами. Некоторые окислы из-за особенностей их кристаллической структуры при высоких температурах обладают очень хорошей анионной проводимостью. Это явление известно уже более 80 лет. Смесь, состоящая из 85 % ZrOg и 15 % Y2O3, изучается начиная примерно с 1900 г. Точный механизм увеличения анионной проводимости стал ясен лишь в последнее время. Это позволило получить кристаллическую структуру бета-глинозема. С помощью рентгеноструктурного анализа было установлено, что кристаллическая структура бета-глинозема представляет собой отдельные кристаллические площадки, слабо связанные друг с другом, как в графите. Зазоры между кристаллическими площадками, по-видимому, обеспечивают свободное перемещение ионов щелочного металла внутри кристалла.
 Проводимость возрастает, если в глиноземе имеется примесь щелочного металла, например натрия. Атомы натрия располагаются, в промежутках между
[c.91]
Проводимость возрастает, если в глиноземе имеется примесь щелочного металла, например натрия. Атомы натрия располагаются, в промежутках между
[c.91]Рентгенографические и нейтронографические исследования жидких металлов показывают, что упаковка атомов в жидком металле определенным образом связана с кристаллической структурой, т. е. с пространственным размещением атомов данного металла в твердом состоянии. Например, у натрия, олова и других металлов в жидком состоянии тип упаковки сохраняется при температурах, не только близких к точке плавления, но и при более высоких. Другими словами, жидкие металлы квазианизотропны. Пространственная структура вещества характеризуется так называемым координационным числом, представляющим собой среднее число атомов, находящихся на поверхности сферы, описанной из центра какого-либо атома с радиусом, равным расстоянию до соседнего атома. При переходе из кристаллического состояния в жидкое, т. е. после плавления, [c.6]
Первая подгруппа—литий, натрий и калий — ист и н-ные металлы — имеют простые кристаллические структуры и обладают в большей или меньшей степени св ойствам и, характерными дляметалличеокогосостояния. [c.20]
[c.20]
Деолитовые насосы. Принцип действия этого типа сорбционных насосов основан на поглощении газов развитой поверхностью цеолитов — алюмосиликатов натрия, кальция и бария. После прогрева цеолитов из них удаляется кристаллизационная вода без изменения кристаллической структуры цеолита, вследствие чего получается весьма пористый Материал с размерами пор от 0,4 до [c.370]
Более важным примером нам представляется сушка гипосульфита натрия. Пусть этот продукт, находящийся в кристаллической форме, желательно привести в безводную форму. Во избежание быстрого расплавления, необходимо ограничить облучение с тем, чтобы температура не превышала 40° С. При этом условии МзаЗгОз-бНаО хорошо переходит в ЫагЗгОз. Операция заканчивается, когда продукт с начальной кристаллической структурой теряет 40% своего веса. Если лампы находятся в 40 см от объекта сушки, производится перемешивание, имеет место аэрация, а толщина слоя не превышает 1 см, то удается избежать расплавления и получить белый, однородный порошок хорошего качества [Л. 476].
[c.263]
476].
[c.263]
Конфигурации s, sp, sp в молекулах приводят к одной, двум и трем валентным связям, что противоречит высоким координационным числам в ОЦК К = S), ПГ и ГЦК (/С=12) металлах [32]. Фактические данные о структурах не удовлетворяют гипотезе Энгеля Брюэра. Благородные газы (s p ) имеют ГЦК структуру. Литий и натрий (s ) при низких температурах имеют плотные упаковки. Медь, серебро и золото с одним s-электроном имеют ГЦК структуру. Барий, радий, европий с двумя s-электронами имеют ОЦК структуру. Бор s p ) не имеет ГЦК структуры. Этой гипотезе противоречит большинство данных о структурах металлов [29, 32]. Модели кристаллических структур рассмотрены в [33—35]. [c.8]
Высокоглиноземистый алюминат натрия хи 2 — -112 глинозем) получается кристаллизацией соответствующего расплава. Кристаллы относятся к гексагональной системе с показателями светопреломления ]Уо=1.668, е= 1.630. Плотность 3.249 г/см . Кристаллическая структура Ка202-11А120з изучена Адельскольдом [6].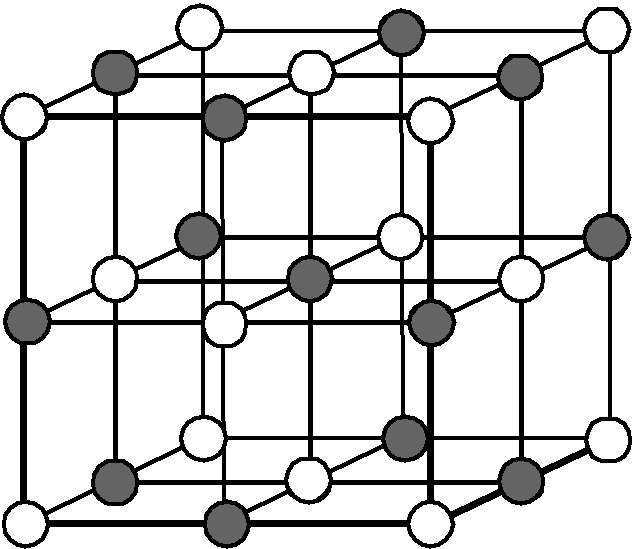 Кристаллическая решетка характеризуется следующими параметрами а=5.59, с=22.49 А.
[c.201]
Кристаллическая решетка характеризуется следующими параметрами а=5.59, с=22.49 А.
[c.201]
Для получения мелкокристаллической структуры и сниже ния массы фосфатного покрытия в ванну вместе с нитритом натрия иногда вводят 10%-ный раствор сегнетовой соли. Для содействия формированию мелкой кристаллической структуры цинкфосфатного покрытия (при фосфатировании распылением) в моющие композиции КМ-1 вводят активатор АФ-1 (смесь три полифосфата натрия с фтортитанатом калия) в количестве 0,4- 0,8 г/л. Уменьшение массы покрытия и размера кристаллов особенно важно при фосфатировании стали перед окраской методом электроосаждения. [c.95]
Исследование образования и адгезионных свойств накипи в котлах приводит ко многим интересным наблюдениям. Накипь появляется непосредственно на нагретой поверхности металла и, как правило, состоит из столбчатых кристаллов [27], растущих перпендикулярно к поверхности. Шлам же не имеет кристаллической структуры. Осадки алюмосиликата натрия, магнетита и фосфата магния относятся к наиболее плотным [32] и вызывают наиболее сильное снижение теплопередачи.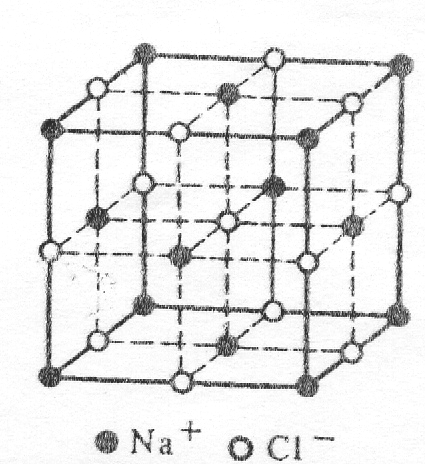 Самилов и Смирнов [33] показали, что имеется, по-видимому, критическая температура, близкая к 243° С, при которой независимо от давления происходит превращение гидроокиси кальция в окись кальция. При этой температуре наблюдается заметное уменьшение количества кальция, уносимого с генерируемым паром, в связи с переходом этого элемента в новое состояние.
[c.33]
Самилов и Смирнов [33] показали, что имеется, по-видимому, критическая температура, близкая к 243° С, при которой независимо от давления происходит превращение гидроокиси кальция в окись кальция. При этой температуре наблюдается заметное уменьшение количества кальция, уносимого с генерируемым паром, в связи с переходом этого элемента в новое состояние.
[c.33]
ППМ в виду развитой поверхности и возможности получения материала с большим количеством несовершенств в кристаллической структуре находят все более широкое применение при реализации каталитических процессов (например, получении азотно-водородной смеси каталитическим разложением аммиака). В работах [188, 189] приведены результаты исследований получения катализаторов из порошка железа № 4029 фирмы Хегенес (Швеция) с промотирующими и структурообразующими добавками порошков меди, алюминия, а также бикарбонатов натрия и калия. Исследования каталитических свойств проводили на образцах в виде втулок диаметром и длиной. 50 мм на специально созданной аппаратуре в температурном интервале 600 — 700°С при объемных скоростях 1500 до 3000 ч . При этом достигнута высокая каталитическая активность катализатора, обеспечивающая 99,8 % разложения аммиака при снижении рабочей температуры. диссоциатора с 900 до 700°С. На базе созданного катализатора разработаны конструкции типового ряда диссоциато-ров с производительностью от 2 до 40 м /г.
[c.231]
50 мм на специально созданной аппаратуре в температурном интервале 600 — 700°С при объемных скоростях 1500 до 3000 ч . При этом достигнута высокая каталитическая активность катализатора, обеспечивающая 99,8 % разложения аммиака при снижении рабочей температуры. диссоциатора с 900 до 700°С. На базе созданного катализатора разработаны конструкции типового ряда диссоциато-ров с производительностью от 2 до 40 м /г.
[c.231]
Растворы, применяемые для химического никелирования, в качестве восстановителей ионов металла включают в себя гипофосфит или борсодержащие соединения, чаще всего боран натрия ЫаВН4. Соответственно реакция выделения металла сопровождается формированием сплавов N1—Р или N1—В, а это, естественно, отражается на свойствах покрытий, технологии и экономике процессов их получения. Осадки сплава N1—Р отличаются слоистым строением, что объясняют неравномерным распределением фосфора.
 Структура их связана с содержанием в сплаве этого компонента. При массовой доле менее 4—5 % Р сплав имеет кристаллическую структуру, более 8—9 % Р — смешанную аморфную и кристаллическую. Термообработка сплава приводит к существенному изменению его строения — распаду твердого раствора, переходу фазы -N1 в р-Ы , выделению фосфида Ы1зР.
[c.207]
Структура их связана с содержанием в сплаве этого компонента. При массовой доле менее 4—5 % Р сплав имеет кристаллическую структуру, более 8—9 % Р — смешанную аморфную и кристаллическую. Термообработка сплава приводит к существенному изменению его строения — распаду твердого раствора, переходу фазы -N1 в р-Ы , выделению фосфида Ы1зР.
[c.207]Поверхность подготавливают под оксидирование шлифованием, зачисткой абразивными лентами, обдувкой металлическим песком и т. д. Необходимо помнить, что качество механической обработки поверхностей деталей оказывает существенное влияние как на внешний вид, так и на время образования оксидной пленки. Известно, что на поверхностях деталей, обработанных шлифованием или полированием, оксидная пленка образуется быстрее и имеет более красивый внешний вид по сравнению с поверхностями деталей, обработанных более грубыми способами механической обработки (фрезерование, точение и т. п.). После механической обработки детали промывают в проточной воде для удаления механических загрязнений и подвергают в течение 10—15 мин обезжириванию в горячем растворе едкого натра и кальцинированной соды (50% NaOH и 30% Na. Og). Далее детали снова промывают и производят так называемое декапирование, т. е. травление в 5—10%-ном растворе серной (h3SO4) или соляной (НС1) кислоты в течение 0,5—2 мин. Декапирование применяют для быстрого удаления легкого слоя естественной пленки окислов, образующихся на поверхности детали, подготовленной к покрытию, а также для выявления основной кристаллической структуры поверхностного слоя металла, что способствует получению более качественной пленки. Подготовленные таким образом детали промывают в проточной воде и подают на оксидирование.
[c.366]
Og). Далее детали снова промывают и производят так называемое декапирование, т. е. травление в 5—10%-ном растворе серной (h3SO4) или соляной (НС1) кислоты в течение 0,5—2 мин. Декапирование применяют для быстрого удаления легкого слоя естественной пленки окислов, образующихся на поверхности детали, подготовленной к покрытию, а также для выявления основной кристаллической структуры поверхностного слоя металла, что способствует получению более качественной пленки. Подготовленные таким образом детали промывают в проточной воде и подают на оксидирование.
[c.366]
Рентгеноструктурные измерения Барретта, прямые металлографические измерения Халла и Розенберга, измерения электросопротивления Дагдейла и, наконец, исследования теплоемкости Мартина и др. [8—13] показали, что литий и натрий претерпевают полиморфные превращения при температурах соответственно порядка 80 и 35° К. При охлаждении ниже этих температур металл частично изменяет свою объемно-центрированную кубическую кристаллическую структуру на плотно-упакованную гексагональную. При охлаледении металла до 4° К (с предварительным отжигом до комнатных температур) в гексагональную фазу переходит 50% На и 80% Ы. Теплоты фазового перехода равны для На 10 ккал1кмоль при 7 35° К п для Ь1 14 ккал кмоль при 7 ь 80°К эти величины, отнесенные к 0° К, дают соответственно 3,5 и 6,7 ккал1кмоль. Температуры Дебая фаз для Ма равны при 20—160° К (гексагональная) и 153°К (кубическая), для Ы при 60—390°К (гексагональная ) и 371° К (кубическая). Результатами фазового перехода в твердых литии и натрии являются, во-первых, аномалия теплоемкости, начинающаяся у этих металлов при 80° К (Ы) и 35° К (Ма) и, во-вторых, зависимость теплоемкости в двухфазной
[c.135]
При охлаледении металла до 4° К (с предварительным отжигом до комнатных температур) в гексагональную фазу переходит 50% На и 80% Ы. Теплоты фазового перехода равны для На 10 ккал1кмоль при 7 35° К п для Ь1 14 ккал кмоль при 7 ь 80°К эти величины, отнесенные к 0° К, дают соответственно 3,5 и 6,7 ккал1кмоль. Температуры Дебая фаз для Ма равны при 20—160° К (гексагональная) и 153°К (кубическая), для Ы при 60—390°К (гексагональная ) и 371° К (кубическая). Результатами фазового перехода в твердых литии и натрии являются, во-первых, аномалия теплоемкости, начинающаяся у этих металлов при 80° К (Ы) и 35° К (Ма) и, во-вторых, зависимость теплоемкости в двухфазной
[c.135]
Работам по изучению механизма действия света на галогенное серебро, используемое в фотографических слоях, предшествовали исследования фотохимических реакций в кристаллах галогенощелочных солей — хлористого натрия, бромистого натрия, бромистого калия и др. Выбор для исследований именно этих солей объясняется тем, что образуемые из них кристаллы отличаются большой чистотой и значительными размерами (рис. 59). При обработке им может быть придана любая форма. Химическое строение этих солей и кристаллическая структура сходны со строением и структурой галогенного серебра. Действие излучений на них также одинаково.
[c.71]
59). При обработке им может быть придана любая форма. Химическое строение этих солей и кристаллическая структура сходны со строением и структурой галогенного серебра. Действие излучений на них также одинаково.
[c.71]
Интересный метод подготовки поверхности найлона перед металлизацией предложен Абу-Иса [62]. Поверхность обрабатывают 0,5—5 мин 0,25—0,5 моль/л водным раствором иода с иоди-дом калия при 20—45 °С. Избыток иода удаляют 0,3% раствором тиосульфата натрия в этиленгликоле в течение 4—20 мин при 20—80 °С и промывают водой. Под влиянием иода изменяется кристаллическая структура поверхностных слоев, и она становится микрошероховатой, что обеспечивает прочность сцепления химически осажденного никеля до 5 кН/м. [c.45]
Случай 1. Обе фазы являются соответственно катодом и анодом. Наиболее вероятно, что этот случай имеет место лишь тогда, когда жидкость, в которой протекает корразия, поддерживается весьма однородной по своему составу, например, при помощи перемешивания. Предположим сперва, что система такова, что образуются растворимые как анодные, так и катодные продукты коррозии, которые соединяются, давая малорастворимый вторичный продукт. Например, при погружении сплава в раствор хлористого натрия пол чаются в качестве первичных продуктов растворимые хлорид металла и едкий натрий, которые при взаимодействии дают гидрат окиси металла. Очевидно, что если кристаллическая структура обеих фаз становится мельче, то увеличивается вероятность того, что осадок будет оседать так близко к металлу, что затруднит дальнейший процесс, или препятствуя разрушению анода, или же защищая катодные поверхности от доступа какого-либо деполяризатора (например, кислорода). Таким образом можно ожидать, что в случае такого типа разрушение будет уменьшаться с уменьшением величины структурных составляющих, совершенно прекращаясь, когда величина составляющих уменьшится до молекулярных размеров, так что в конце концов сплав станет однофазным (коррозия других типов остается, конечно, возможной).
Предположим сперва, что система такова, что образуются растворимые как анодные, так и катодные продукты коррозии, которые соединяются, давая малорастворимый вторичный продукт. Например, при погружении сплава в раствор хлористого натрия пол чаются в качестве первичных продуктов растворимые хлорид металла и едкий натрий, которые при взаимодействии дают гидрат окиси металла. Очевидно, что если кристаллическая структура обеих фаз становится мельче, то увеличивается вероятность того, что осадок будет оседать так близко к металлу, что затруднит дальнейший процесс, или препятствуя разрушению анода, или же защищая катодные поверхности от доступа какого-либо деполяризатора (например, кислорода). Таким образом можно ожидать, что в случае такого типа разрушение будет уменьшаться с уменьшением величины структурных составляющих, совершенно прекращаясь, когда величина составляющих уменьшится до молекулярных размеров, так что в конце концов сплав станет однофазным (коррозия других типов остается, конечно, возможной).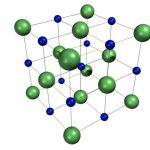 Действительно, разрушение сплавов, подобных чугуну, повидимому, замедляется с уменьшением величины составляющих. Однако упомянутый случай один из многих возможных, и затруднительно указать пример, не усложненный другими явлениями.
[c.466]
Действительно, разрушение сплавов, подобных чугуну, повидимому, замедляется с уменьшением величины составляющих. Однако упомянутый случай один из многих возможных, и затруднительно указать пример, не усложненный другими явлениями.
[c.466]
Фосфатные пленки стойки против атмосферной коррозии и воды. Стойкость их значительно повышается после дополнительной обработки пленки различными препаратами с целью ее уплотнения. Так, известен способ обработки пленки двуххромовокислым натрием или калием. Предложенный метод обработки основан на способности фосфатной пленки, имеющей кристаллическую структуру, адсорбировать из водного раствора бихроматы этих металлов. Бихромат заполняет поры и пассивирует нефос- [c.289]
Обсуждая стабильность кристаллических структур, необходимо иметь в виду и другие аспекты. Описанный выше расчет дает нам внутреннюю энергию системы при нулевой температуре для различных структур. На самом же деле важно знать полную свободную энергию. При конечной температуре возбуждаются колебания решетки, дающие вклад в свободную энергию. Даже при абсолютном нуле текшературы необходимо учитывать вклад во внутреннюю энергию нулевых колебаний системы. Введение в предыдущий расчет поправок на нулевые колебания не влияет на результаты для натрия, магния и алюминия, но это не значит, что соответствующими вкладами в энергию всегда можно пренебречь. Энергия нуле-, вых колебаний равна сумме по всем модам колебаний величин /пЬ(Лд. В очень рыхлой решетке все частоты будут низкими, а энергия нулевых колебаний — малой это выгодно для данной структуры. С повышением температуры энтропия более рыхлой решетки увеличивается быстрее, и в результате свободная энергия становится меньше, чем у жесткой решетки. Например, в объемноцентрированной кубической структуре натрия зона поперечных акустических колебаний лежит в области довольно низких частот. Обычно считают,
[c.492]
На самом же деле важно знать полную свободную энергию. При конечной температуре возбуждаются колебания решетки, дающие вклад в свободную энергию. Даже при абсолютном нуле текшературы необходимо учитывать вклад во внутреннюю энергию нулевых колебаний системы. Введение в предыдущий расчет поправок на нулевые колебания не влияет на результаты для натрия, магния и алюминия, но это не значит, что соответствующими вкладами в энергию всегда можно пренебречь. Энергия нуле-, вых колебаний равна сумме по всем модам колебаний величин /пЬ(Лд. В очень рыхлой решетке все частоты будут низкими, а энергия нулевых колебаний — малой это выгодно для данной структуры. С повышением температуры энтропия более рыхлой решетки увеличивается быстрее, и в результате свободная энергия становится меньше, чем у жесткой решетки. Например, в объемноцентрированной кубической структуре натрия зона поперечных акустических колебаний лежит в области довольно низких частот. Обычно считают,
[c.492]
Интересно отметить, что кристаллическая структура висмута (и двух других полуметаллов) представляет собой лишь слабое искажение простой кубической моноатомной решетки Бравэ, поскольку ее можно построить следующим образом взять структуру хлорида натрия (см.
 фиг. 4.24), слегка растянуть ее вдоль направления (111), так чтобы оси куба образовали друг с другом равные углы, несколько меньшие 90°, и немного сместить узлы хлора на одно и то же расстояние в направлении (111). Б структуре висмута расположено по одному атому висмута в каждом из получаюш 1хся узлов натрия и хлора .
[c.306]
фиг. 4.24), слегка растянуть ее вдоль направления (111), так чтобы оси куба образовали друг с другом равные углы, несколько меньшие 90°, и немного сместить узлы хлора на одно и то же расстояние в направлении (111). Б структуре висмута расположено по одному атому висмута в каждом из получаюш 1хся узлов натрия и хлора .
[c.306]В настоящее время установлено, что все вещества, активные в аморфном состоянии (расплавленные или растворенные), активны и в виде кристаллов, хотя постоянная вращения для кристаллических форм может сильно отличаться от ее величины для аморфных наоборот, существует ряд веществ, неактивных в аморфном виде и вращающих в кристаллическом состоянии. Таким образом, оптическая активность может определяться как строением молекулы, так и расположением молекул в кристаллической решетке. Действительно, исследование соответствующих кристаллов (кварц, хлорноватистокислый натрий) при помощи рентгеновских лучей показывает особенности структуры, позволяющие истолковать.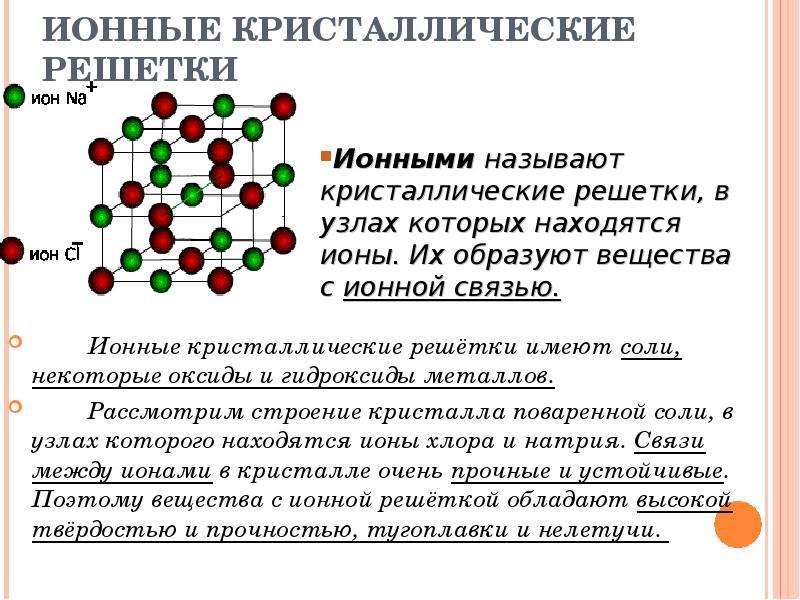 их оптическую активность.
[c.614]
их оптическую активность.
[c.614]
Металлический натрий в отличие от поваренной соли образует объемноцентрированную кубическую рещетку. На рис. 7 приведена кристаллическая рещетка натрия с выделением одной элементарной ячейки (защтрихован-ная часть), под которой понимают наименьшую часть кристаллической решетки, отражающей все особенности ее структуры. В этом смысле рис. 6 представляет собой элементарную ячейку кристаллической решетки МаС1. Как видно из рис. 7, в решетке натрия также отсутствуют молекулы. В парах же натрия обнаружены молекулы Наг с межатомным [c.15]
В неорганической химии молекулы являются типичной формой существования химического соединения в паро- и газообразном состоянии. Поэтому во всех рассмотренных структурах нельзя выделить обособленные молекулы в кристаллической рещетке. Такие кристаллические рещетки, в которых отсутствуют дискретные молекулы, называются координационными. К ним относятся ионные, металлические и атомные решетки. К ионным принадлежит решетка ЫаС1, к металлическим — решетка натрия, к атомным — решетки кремния и сульфида цинка. На,рис. 10 для сравнения приведена элементарная ячейка молекулярной решетки кристалла йода.
[c.16]
К ионным принадлежит решетка ЫаС1, к металлическим — решетка натрия, к атомным — решетки кремния и сульфида цинка. На,рис. 10 для сравнения приведена элементарная ячейка молекулярной решетки кристалла йода.
[c.16]
Атомпып номер натрия 11, атомная масса 22,99, атомный радиус 0,192 нм. Известно 6 изотопов, стабильный с атомной массой 23. Электронное строение [Ме]3з. Электроотрицательность 0,5. Потенциал ионизации 5,138 эВ. Кристаллическая решетка — о. ц. к. с параметром 0,429 им /пл=98°С, яп = 878°С. Плотность 0,97 т/мз. При температуре ниже —233 °С — структура п. г. с периодом а = 0,3767 нм. [c.67]
Рентгенографическим, нейтронографич в им и другими методами исследования установлено квазианизотропное строение жидкпх металлов. При переходе из твердого в жидкое состояние координационное число и тип кристаллической решетки в большинстве случаев сохраняются (например, у натрия, калия, свинца и ртути). Плавление некоторых металлов, в частности висмута и галлия, сопровождается образованием структуры с более плотной упаковкой атомов. Об этом можно судить пО изменению плотности у твердого висмута при 20° С р = = 9,80 тогда как у жидкого при 280°С р= 10,05 г/см -,
[c.7]
Об этом можно судить пО изменению плотности у твердого висмута при 20° С р = = 9,80 тогда как у жидкого при 280°С р= 10,05 г/см -,
[c.7]
Рассмотрим несколько примеров. Щелочной металл натрий (2= И) имеет электронную структуру ls 2s2p 3s . Уровни п = 1 и rt = 2 в атоме полностью заняты, соответственно они будут заполнены и в кристаллическом теле. Зона п = 3 не занята полностью. В зоне 3s имеется 2N состояний, из которых заняты только N, а в зоне Зр, которая, как показывают расчеты, перекрывается с зоной 3s, имеется 6Af свободных состояний. По указанным причинам натрий — хороший проводник. Даже приложение слабого электрического поля (или тепловой, световой, магнитной энергии) приводит к возбуждению огромного количества электронов и переходу их на свободные орбиты. Другой щелочной металл — бериллий (г = 4) имеет электронную структуру s 2s -, зоны Is и 2s заполнены, но зона 2р, свободная от электронов, перекрывается с зоной 2s, вследствие чего возникают условия, необходимые для металлической проводимости. [c.30]
[c.30]
Кристаллические решетки
Содержание:
Кристаллические решетки
- Кристаллическая решетка Кристаллические и аморфные вещества. Если вы будете механически измельчать сахар, серу, графит, слюду и многие другие твердые вещества, вы заметите, что они трескаются и образуют небольшие кристаллы определенной формы. Такие вещества называются кристаллами.
- Однако известны твердые частицы (стекло, кусочки смолы), которые при ударе образуют нерегулярные формы мусора. Возникает вопрос. Как объяснить существование твердых тел с такими разнообразными свойствами? Кристаллические вещества трескаются при ударе в определенной плоскости, но почему аморфный материал не обладает этим свойством?
Такие вещества называются аморфными, то есть бесформенными. Людмила Фирмаль
Поскольку свойства вещества зависят от его структуры, то в кристаллическом веществе можно предположить, что составляющие его частицы (ионы, атомы, молекулы) ближе друг к другу в одном направлении, а в другом-в другом.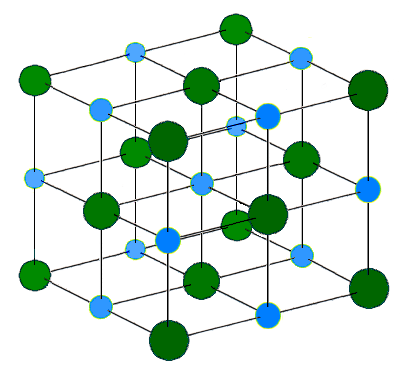 other-farther. In дело в том, что ученые доказали, что в кристаллических веществах, например, графите, с одной стороны атомы углерода находятся близко друг к другу, а с другой (на плоскости, расположенной вертикально)-на большем расстоянии (рис.57).
other-farther. In дело в том, что ученые доказали, что в кристаллических веществах, например, графите, с одной стороны атомы углерода находятся близко друг к другу, а с другой (на плоскости, расположенной вертикально)-на большем расстоянии (рис.57).
Именно на плоскости, где атомы углерода отделены друг от друга, графит легко расщепляется на хлопья. Такими свойствами обладают, например, слюда и другие кристаллические вещества. В кристаллических веществах ионы, атомы или молекулы располагаются строго и регулярно на определенном расстоянии.
Это регулярное расположение частиц в Кристалле напоминает структуру обычной решетки с чередующимися узлами. Отсюда и родилось название «кристаллическая решетка».В зависимости от того, какой узел находится в этом узле Диаграмма 57.Расположение атомов углерода рисунок 58.Структурная схема представляет собой кристалл графита.
Решетка хлорида натрия. Он различает решетки, ионы, атомы, молекулярные кристаллические решетки. Известны также металлические решетки(II, с. 81). В отличие от кристаллов, такое расположение регулярных частиц не наблюдается в аморфной материи. Ионная кристаллическая решетка является особенностью ионной compounds. In в узлах их решеток имеются противоположно заряженные ионы.
81). В отличие от кристаллов, такое расположение регулярных частиц не наблюдается в аморфной материи. Ионная кристаллическая решетка является особенностью ионной compounds. In в узлах их решеток имеются противоположно заряженные ионы.
Представителем этих соединений являются соли. Например, в узлах кристаллической решетки хлорида натрия присутствуют ионы натрия и хлорид-ионы (рис. 58). в кристаллах хлорида натрия отсутствуют отдельные молекулы хлорида натрия. Весь Кристалл похож на огромный molecule. In хлорид натрия, каждый ион объединен(в 3 вертикальных плоскостях) в 6 противоположно заряженных ионов. Эти ионы.
Это равноудаленные друг от друга, образуя кубической формы кристалла (рис. 58). Как и хлорид натрия, большинство солей состоят из отдельных ионов, а не молекул. В кристаллах соли нет отдельных молекул, но на самом деле принято говорить о молекулах. Например, используются такие термины, как»молекула хлорида натрия»,»молекула нитрата калия», но в этих случаях слово»молекула»употребляется условно.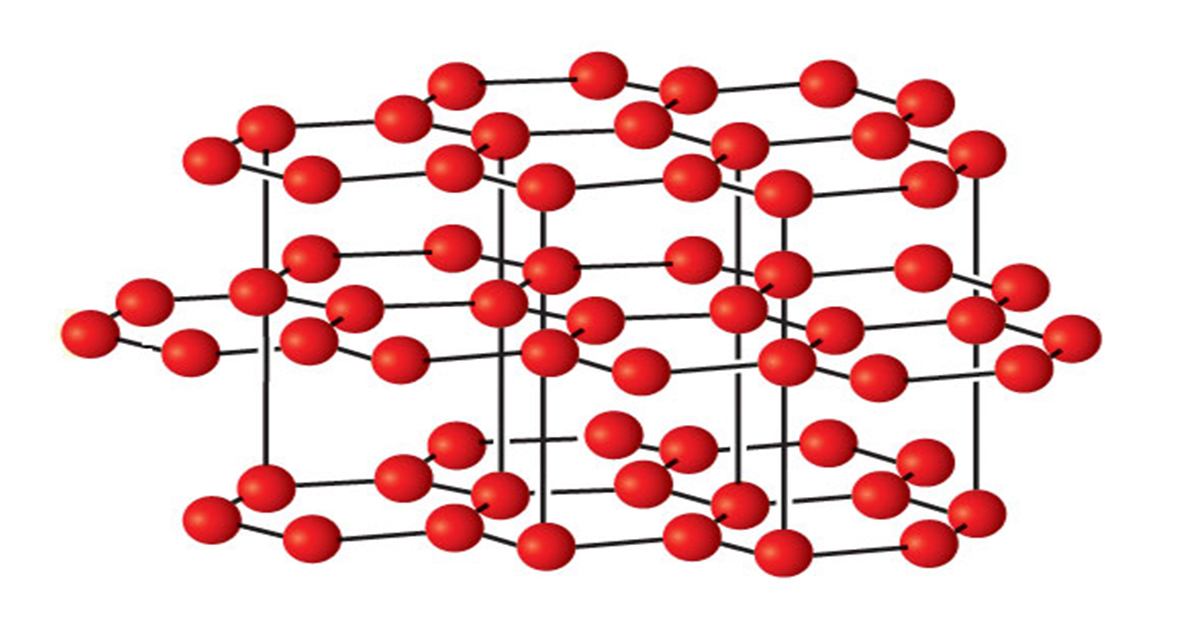
С солями молекулы находятся фактически только в газообразном состоянии. Атомный Кристалл lattice. In в узлах атомной кристаллической решетки имеются отдельные атомы, связанные между собой ковалентными связями. Атомы, как и ионы, могут располагаться в пространстве по-разному, поэтому в этих случаях образуются кристаллы разной формы.
Например, алмаз (рис. 59) и узлы кристаллической решетки графита (Инжир. 57) расположены одни и те же атомы углерода, но из-за различного расположения атомов кристаллы алмаза имеют форму октаэдров, а кристаллы графита-форму призматических столбиков. Молекулярный Кристалл lattice. At в узле молекулярной кристаллической решетки находятся неполярные или полярные молекулы.
- Например, узел кристаллической решетки кислорода (температура ниже −219°С) имеет неполярную молекулу 02, а узел кристаллической решетки твердого хлористого водорода (ниже −114°С) имеет полярную молекулу HC1.As в предыдущем случае кристаллы различной формы образуются в зависимости от относительного положения молекулы в пространстве.

Зависимость некоторых физических свойств вещества от типа кристаллической решетки. Существуют следующие закономерности: если структура вещества известна, то его характеристики можно предсказать. Верно и обратное. Воспользуемся этой закономерностью для того, чтобы приблизительно предсказать, сколько составляет температура плавления фторида натрия NaF, фтора F2 и фторводорода HF.
Если свойства вещества известны, то структуру можно определить. Людмила Фирмаль
Узловыми точками кристаллической решетки фторида натрия являются ион натрия (Na*) и фторид〜Ион (F -).Между ними возникает электростатическое притяжение. Эти силы относительно large. To растворяя фторид натрия, необходимо преодолеть эти силы и разрушить кристаллическую решетку.
Поэтому температура плавления фторида натрия должна быть high. At в узле кристаллической решетки фтора присутствуют неполярные молекулы. Адгезия между ними невелика. Поэтому температура плавления фтора должна быть очень низкой.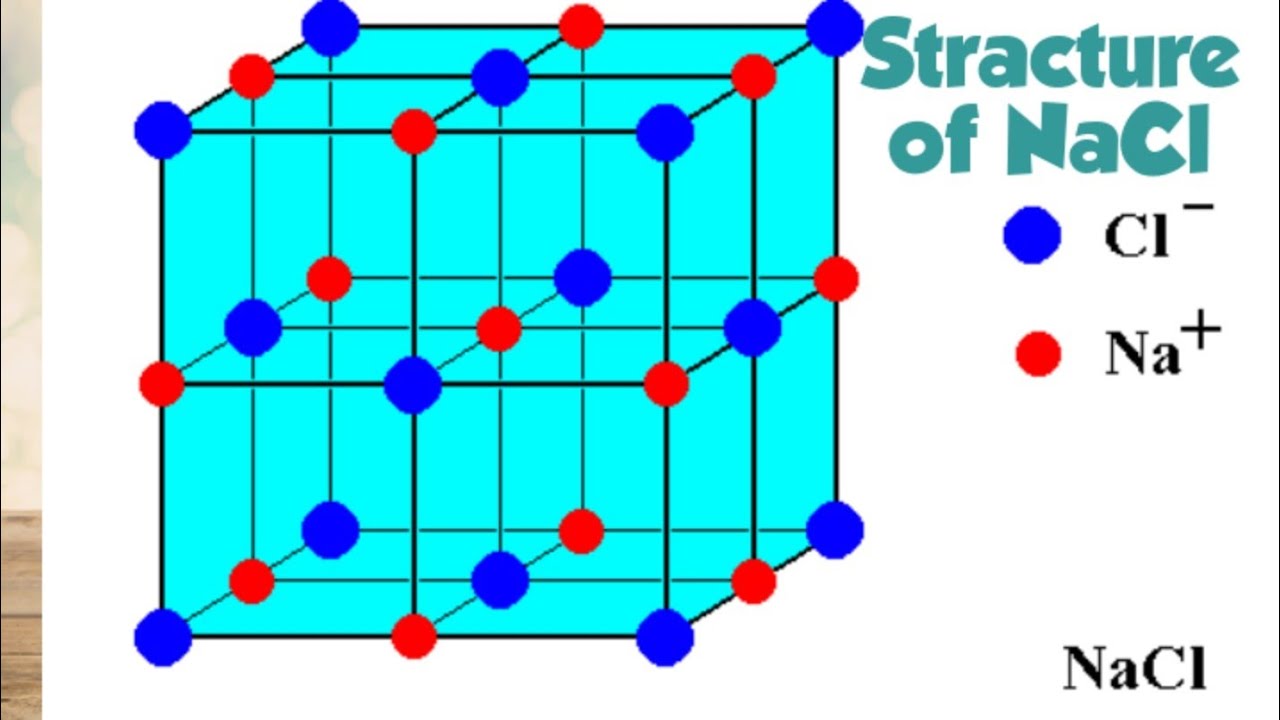 Узлы кристаллической решетки фтористого водорода имеют полярные молекулы. Сцепление между ними гораздо меньше, чем между ионами, но больше, чем между неполярными молекулами.
Узлы кристаллической решетки фтористого водорода имеют полярные молекулы. Сцепление между ними гораздо меньше, чем между ионами, но больше, чем между неполярными молекулами.
Поэтому температура плавления фтористого водорода составляет Наименование материала температура плавления(®С) Фторид натрия NaF фтор F2 фтористый водород HF 995-220-83% Рисунок 59.An расположение атомов углерода в кристалле алмаза. Значительно ниже, чем фторид натрия, но выше, чем фторид. Экспериментальные данные подтверждают это предположение (см. таблицу). Считается, что вещество с атомной решеткой характеризуется высокой температурой плавления, так как ковалентные связи между атомами очень прочны.
Это также подтверждается на практике. Например, алмаз и графит плавятся при высоком давлении и очень высоких температурах. Ответьте на вопрос, Упражнение 9-II (стр. 134).И валентность элементов в свете электронной теории Как вы уже знаете(стр. 25), валентность-это способность атома одного элемента связывать определенное количество атомов другого элемента. Это понятие достаточно сложное, но электронная теория позволяет раскрыть его суть.
Это понятие достаточно сложное, но электронная теория позволяет раскрыть его суть.
В общих соединениях, и в большинстве из них, валентность обычно определяется числом связей, образованных между атомами. Поэтому для того, чтобы понять сущность валентности, необходимо понять суть процесса образования химических связей. Мы уже знаем, что в большинстве случаев ковалентная связь образуется общей парой электронов(стр. 125).в большинстве случаев оба реагирующих атома участвуют в образовании общей пары электронов(каждый обеспечивает 1 электрон).
Однако только 1 атом может обеспечить общую пару электронов связи. Мы рассмотрим такие примеры чуть позже(II, с. 8). Так, валентность в наиболее общем случае определяется числом общих электронных пар, которые связываются с атомами того или иного соединения. Например, электронная формула метана SI4 представлена следующим образом: н Н: С: Н •• И В молекулах метана атомы углерода имеют 4 общие электронные пары. Это означает, что углерод является четырехвалентным.
Каждый атом водорода имеет 1 общую пару электронов. То есть водород является одновалентным. Общие электронные пары могут быть представлены в виде тире: Н Ч — (Л-Ч) Я н Аналогичное описание сущности понятия «валентность» можно отнести к ионным соединениям в определенной степени, так как отсутствует отдача и адгезия полная (100%) electrons. So например, в хлориде натрия существует 1 общая электронная пара между ионами, которая сильно смещена против хлорид-ионов. Na.’ИЦ’•••
В результате каждый ион имеет 1 общую пару электронов. То есть и натрий, и хлор являются одновалентными. Некоторые ученые указывают валентность ионного соединения, называемого ионным числом. Однако ионные соединения не имеют отдельных молекул(с. 129), их валентность не соответствует числу связей. Наиболее типичные случаи выражения валентности были рассмотрены и объяснены с точки зрения электронной теории.
Смотрите также:
Решение задач по химии
Если вам потребуется заказать решение по химии вы всегда можете написать мне в whatsapp.
Ионная связь — определение, образование и примеры
Общие сведения о химических связях
Давайте вспомним, как образуются химические связи. Для этого представим атом: он состоит из ядра с положительным зарядом и набора отрицательно заряженных электронов, которые располагаются на нескольких уровнях. Внешний уровень называется валентным, на нем располагаются валентные электроны. Они могут образовывать пары или быть свободными, т. е. неспаренными.
Во взаимодействии двух атомов участвуют свободные электроны внешней оболочки. Сколько таких электронов имеется у атома — столько химических связей он может образовать.
При этом каждый атом стремится приобрести устойчивую конфигурацию — двух- или восьмиэлектронную внешнюю оболочку, подобную той, что есть у инертного газа. Атом может достичь ее, отдавая или принимая часть электронов, а также образуя общую электронную пару с другим атомом. Если в результате получается два разноименно заряженных иона, говорят об ионном типе связи. Он характерен для взаимодействия атомов металла и неметалла.
Он характерен для взаимодействия атомов металла и неметалла.
Определение ионной связи
Рассмотрим этот тип связи на примере реакции натрия и водорода, в результате которой получается гидрид натрия. У атома натрия Na есть один свободный электрон на внешнем уровне, в то время как атому водорода H не хватает одного электрона, чтобы завершить внешнюю оболочку и принять стабильную форму. Поскольку натрий имеет более низкую электроотрицательность, чем водород, он отдает свой валентный электрон и получает отрицательный заряд. Водород принимает этот электрон и получает положительный заряд. В итоге образуется два иона — катион Na+ и анион H—.
Между положительным ионом Na+ и отрицательным H— возникает электростатическое притяжение, которое и удерживает их вместе. Так образуется ионная связь в гидриде натрия.
Ионная связь — это тип химической связи, характерный для разноименно заряженных ионов, которые образовались в результате отдачи и присоединения электронов атомами. В нее вступают элементы с большой разностью электроотрицательности. Обычно так взаимодействуют атомы металла и неметалла.
В нее вступают элементы с большой разностью электроотрицательности. Обычно так взаимодействуют атомы металла и неметалла.
Чаще всего именно так связаны в соединениях щелочные и щелочноземельные металлы с галогенами. Поскольку у щелочных металлов электроотрицательность ниже, их атомы становятся катионами, а атомы галогенов — анионами.
Механизм образования ионной связи похож на донорно-акцепторный механизм ковалентной связи. Первую даже называют крайним выражением второй.
Важно!
Соли аммония NH4NO3, NH4Cl, (NH4)2SO4 хоть и не являются соединениями металла и неметалла, но также образованы с помощью ионной связи.
Координационное число
Вернемся к нашему примеру с гидридом натрия и посмотрим на кристаллическую решетку, которую имеет это ионное соединение. Каждый ион Na+ контактирует с шестью ионами H—. Это максимально возможное для данного иона число химических связей, оно называется координационным.
Координационное число — это количество ближайших соседей иона в ионной кристаллической решетке. По сути это количество связей, которые образует каждый ион в составе сложного вещества.
Обратите внимание
При рассмотрении ковалентной химической связи говорят о валентности — она характеризует, сколько связей есть у конкретного атома с другими атомами. Но к ионным соединениям это понятие не применяют, потому что все ионы в кристаллической решетке взаимодействуют друг с другом. Вместо этого есть координационное число, и оно отражает количество таких взаимодействий.
Примеры веществ с ионной связью
Таким же образом, как в гидриде натрия, ионы образуются и в других подобных ему соединениях. Например, в хлориде натрия NaCl атом натрия имеет один свободный электрон и отдает его атому хлора. В итоге оба завершают свой внешний уровень. Образуется ион натрия с положительным зарядом и отрицательно заряженный ион хлора.
Другой пример ионной химической связи — сульфид натрия Na2S. В данном случае у нас также есть натрий с одним свободным электроном и сера, у которой на внешнем уровне есть 2 свободных электрона из 6. Таким образом, чтобы завершить уровень и обрести стабильную форму, сере нужно 2 электрона. Поэтому в формуле сульфида серы присутствует два атома натрия.
Характеристики ионной связи
Мы узнали, как образуется ионная связь, а теперь поговорим о ее характеристиках. Она существенно отличается от других типов связи между атомами.
Ионная связь:
Разберемся в каждом пункте и начнем с направленности. Ковалентная полярная связь направлена, потому что она подразумевает смещение общей электронной пары к тому атому, который имеет большую электроотрицательность. В случае с ионами все иначе. Согласно закону Кулона притяжение между отрицательным и положительным ионом идет по прямой, соединяющей эти заряженные частицы. В кристаллической решетке все разноименно заряженные ионы взаимодействуют друг с другом и притяжение распределяется равномерно, поэтому говорят, что ионная связь не направлена.
В кристаллической решетке все разноименно заряженные ионы взаимодействуют друг с другом и притяжение распределяется равномерно, поэтому говорят, что ионная связь не направлена.
А как насчет насыщаемости? Эта характеристика указывает на то, что атом может вступить в ограниченное количество химических связей, поскольку имеет ограниченное число неспаренных электронов. Но ионная связь — это не процесс соединения свободных электронов в пары, а взаимное притяжение ионов. Каждый ион может притягивать к себе неограниченное число ближайших соседей, поэтому нет смысла говорить о насыщаемости.
Из вышесказанного понятно, что ионная связь не имеет и кратности. Эта характеристика означает число общих электронных пар у атома, но в данном случае мы рассматриваем притяжение между ионами.
Физические свойства ионной связи
Между ионами в молекуле всегда образуется достаточно сильное притяжение, поэтому вещества с ионной связью в обычных условиях твердые и нелетучие. Такие соединения сложно разрушить при помощи тепловой энергии, что обуславливает высокую температуру кипения и плавления. При этом ионы имеют небольшой радиус взаимодействия — это придает веществам хрупкость.
Такие соединения сложно разрушить при помощи тепловой энергии, что обуславливает высокую температуру кипения и плавления. При этом ионы имеют небольшой радиус взаимодействия — это придает веществам хрупкость.
Свойства ионных соединений:
твердость,
хрупкость,
нелетучесть,
тугоплавкость,
растворимость в воде,
электропроводность.
Типичным веществом с ионными связями можно считать хлорид натрия NaCl или поваренную соль. Ее кристаллы в точности соответствуют всем характеристикам.
Как определить ионную связь
Чтобы быстро понять, является ли нужное нам соединение ионным, выполните следующие действия:
Посмотрите, какие элементы входят в состав соединения. Формула вещества с ионной связью должна включать металл и неметалл. Если это щелочной металл (I группа таблицы Менделеева) и галоген (VII группа), то связь между ними точно ионная.

По шкале Полинга определите электроотрицательности обоих элементов соединения. Если разница между ними больше 1,7 — связь ионная. Это объясняется тем, что такой тип связи характерен для веществ, у которых сильно отличаются показатели электроотрицательности.
Дополнительным способом убедиться в правильности результата может стать оценка физических свойств вещества. Если оно имеет высокую температуру кипения или плавления и проводит электроток — связь скорее всего ионная.
Вопросы для самопроверки:
Опишите, как образуется ионная связь. Какие условия для этого необходимы?
Что такое координационное число элемента в ионном соединении?
Каковы основные физические свойства ионных соединений?
В чем разница между характеристиками ионной и ковалентной связей?
Как можно определить ионную связь, зная электроотрицательность элементов в соединении?
Тема 13.
 Соединения щелочных металлов.
Соединения щелочных металлов.Часть I
1. Оксиды – M2O.
1) Тип связи – ионная.
Схема ее образования:
Тип кристаллической решетки: ионная.
2) Характер оксидов – основный.
Химические свойства оксидов:
а) M2 O + кислотный оксид→соль
б) M2 O + h3O → щелочь
в) M2 O + HNO3→ соль MNO3 + h3O
3) Получение:
а) 4LI + O2→2Li2O;
б) Na→X→Na2O.
Запишите уравнения соответствующих реакций.
2Na + O2→Na2O2
Na2O2 + 2Na→2Na2O
2. Гидроксиды МОН.
1) Тип кристаллической решетки – ионный. Состоят из катионов М+ и анионов ОН-. Физические свойства: твердые белые вещества, гигроскопичны.
Растворы – это щелочи.
2) Химические свойства (составьте уравнения возможных реакций – молекулярные, полные и сокращенные ионные):
а) пример реакции нейтрализации:
б) Взаимодействуют с кислотными оксидами.
в) Взаимодействуют с солями, если образуется осадок:
г) взаимодействует с солями, если образуется газ:
д) Взаимодействуют с амфотерными оксидами:
е) Взаимодействует с амфотерными гидроксидами.
3) Получение:
a) 2M + 2HOH→2MOH + h3
б) M2O + HOH→2MOH
4) Заполните таблицу «Щелочи и их применение».
3. Соли имеют ионную кристаллическую решетку.
Заполните таблицу «Названия и применение солей металлов IA группы».
4. Заполните таблицу «Окрашивание пламени ионами щелочных металлов».
Часть II
1. Заполните таблицу «Биологическая роль катионов натрия и калия».
2. Дополните цепочку переходов. Запишите уравнения реакций, с помощью которых можно осуществить превращения по схеме:
3. Заполните схему «Области применения хлорида натрия».
Заполните схему «Области применения хлорида натрия».
4. Для соединения NaH укажите:
1) Название гидрид натрия
2) Тип связи и кристаллическую решетку — ионная связь, ионная кристаллическая решетка
3) Схему образования связи на основе реакции получения (синтеза) 2Na + h3→ 2NaН.
4) Уравнение реакции взаимодействия с водой (рассмотрите ОВР)
5. Пероксид натрия Na2O2 имеет структурную формулу:
Na – O – O – Na.
Укажите тип связи между атомами:
а) натрия и кислорода ионная
б) кислорода и кислорода ковалентная неполярная
Наличие разных типов связи в одном соединении говорит о единой природе химической связи.
6. По образцу сочинения, приведённого в заданиях учебного параграфа, напишите сочинение на тему «Художественный образ соединения щелочного металла» в особой тетради.
Кристаллическая решетка хлорида натрия
Кристаллическая решетка хлорида натрия НАТРИЯ ХЛОРИДХлорид натрия также кристаллизуется в кубической решетке, но с другую элементарную ячейку.
 (Na + — синие, а Cl — красные). Нажмите на элементарную ячейку вверху, чтобы посмотреть, как она вращается.
(Na + — синие, а Cl — красные). Нажмите на элементарную ячейку вверху, чтобы посмотреть, как она вращается. Эти стек так: Нажмите на изображения ниже, чтобы увидеть структуру решетки NaCl вращающийся. по горизонтали по вертикали
Однако плотно упакованные структуры затрудняют просмотреть внутренние отношения. Та же структура, но с более удаленными друг от друга ионами позволяет интерьер для просмотра. Нажмите на изображения ниже, чтобы увидеть вращающуюся открытую конструкцию. по горизонтали по вертикали Если мы возьмем элементарную ячейку NaCl и удалим все красные ионы Cl, мы остался только синий Na. Если мы сравним это с блоком fcc/ccp ячейки, видно, что они идентичны. Таким образом, Na находится в подрешетке ГЦК.

Поскольку схемы повторения Na и Cl одинаковы в решетке, подрешетка Cl также должна быть ГЦК/ЦКП. Напомним, что может быть более одного способа разделить решетку на элементарные ячейки. Несмотря на то что это может быть неочевидно, красные Cl представляют другую единицу fcc / ccp клетка.
Обратите внимание, что 6 Cl окружают Na и 6 Na вокруг каждого. Кл. Мы можем рассматривать NaCl как состоящий из взаимопроникающих решеток ГЦК/ЦКП. Na занимают октаэдрические позиции в подрешетке Cl, а Cl занимают октаэдрические позиции в подрешетке Na.Нажмите здесь, чтобы перейти на следующую страницу. Структура кристаллов Кристаллические решетки Элементарные ячейки От элементарной ячейки к решетке От решетки к элементарной ячейке Стехиометрия Упаковка и геометрия Простые кубические металлы Плотно упакованные конструкции Объемно-центрированный куб Хлорид цезия Натрий хлорид Оксид рения Оксид ниобия Если не указано иное, все изображения, фильмы и VRML являются собственностью и авторскими правами по Др.
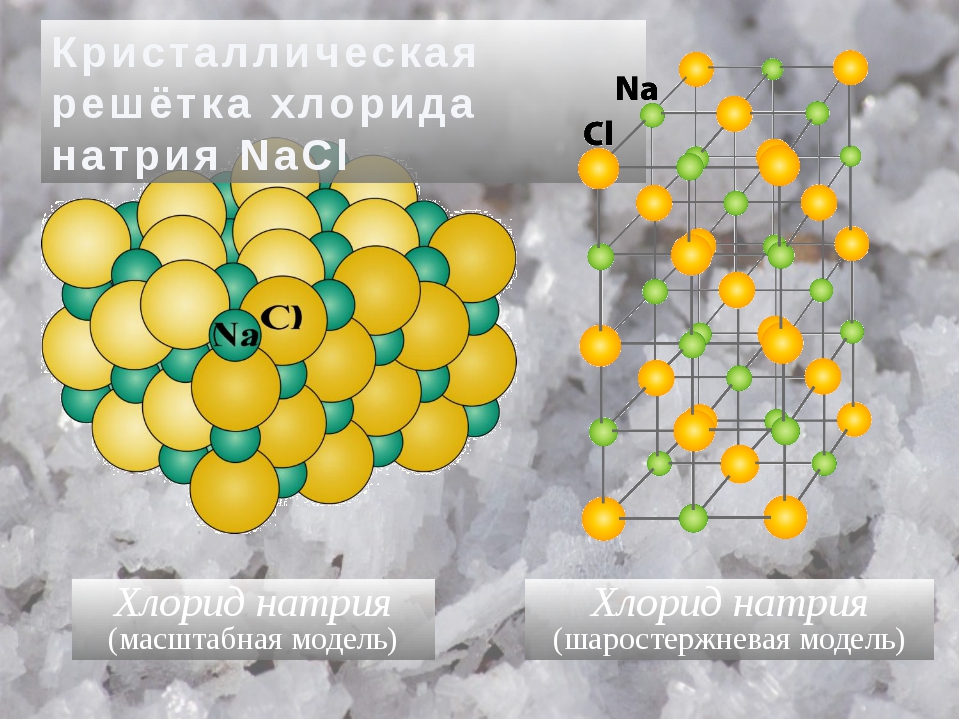 Барбара Л. Солс и доктор Фредерик С. Солс
1998. Свяжитесь с владельцами для получения индивидуального разрешения
использовать. barbarasauls@kings.edu
Барбара Л. Солс и доктор Фредерик С. Солс
1998. Свяжитесь с владельцами для получения индивидуального разрешения
использовать. barbarasauls@kings.edu Мир структуры: NaCl
Мир структуры: NaClСтруктура хлорида натрия
Общие примечания
NaCl имеет кубическую элементарную ячейку.Лучше всего представить его как гранецентрированный кубический массив анионов с взаимопроникающей катионной решеткой ГЦК (или наоборот). Клетка выглядит одинаково, независимо от того, начинаете ли вы с анионов или катионов в углах. Каждый ион является 6-координатным и имеет локальную октаэдрическую геометрию.Структурная информация
| NaCl Статистика естественного движения населения | |
|---|---|
| Формула | NaCl |
| Цистал-система | Кубический |
| Тип решетки | Лицево-центрированный |
| Космическая группа | Fm3m, №225 |
| Параметры ячейки | а = 5,6402 Å, Z=4 |
| Атомные позиции | Cl: 0, 0, 0 Na: 0,5, 0,5, 0,5 (при желании можно заменить) |
| Плотность | 2,17 |
| Точка плавления | 804 градуса Цельсия |
| Альтернативные имена | Галит, каменная соль, морская соль, поваренная соль, соль |
| Изоструктурные Соединения | MgO, TiO, TiC, LaN, NaI KCl, RbF, AgCl, SrS |
Структура
Рис.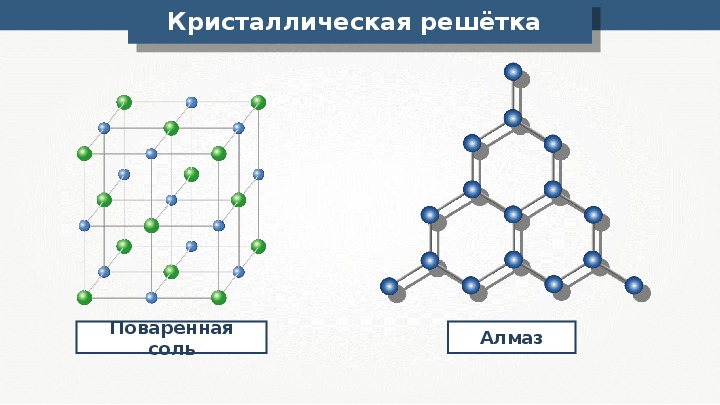 1 Элементарная ячейка NaCl 1 Элементарная ячейка NaCl | Рис. 2 Решетка 3x3x3 из NaCl |
Ниже показаны две кристаллографические плоскости в NaCl. Обратите внимание, что плоскость (111) гексагонально плотно упакована.
| Рис. 3 Плоскость (111) NaCl. | Рис. 4 (100 плоскость NaCl. |
Новичков удивляет то, что плоскость 111 не содержит объемно-центрированного атома.Начинающему студенту важно понять, что плоскость 111 не разрезает на 1/2, 1/2, 1/2! Взгляните на модели выше и ниже, чтобы убедиться в этом очень важном факте!
Вот многогранное изображение элементарной ячейки NaCl. Мы могли бы нарисовать октаэдры вокруг любого из двух атомов. В приведенном ниже случае мы нарисовали их вокруг угловых атомов и изменили цвет, чтобы улучшить контрастность изображения:
Модели колокольчиков
Здесь показана модель Chime, которую можно вращать и манипулировать. (Мне нужно обновить их до jmol, просто еще не нашел время) Обратите внимание, что вы можете видеть чередующиеся слои hcp, которые содержат только атомы Na и только атомы Cl, если вы правильно манипулируете ими. См. рисунок плоскости 100, показанный выше, если эта ориентация не ясна.
(Мне нужно обновить их до jmol, просто еще не нашел время) Обратите внимание, что вы можете видеть чередующиеся слои hcp, которые содержат только атомы Na и только атомы Cl, если вы правильно манипулируете ими. См. рисунок плоскости 100, показанный выше, если эта ориентация не ясна.
| Рис. 5 Одиночная элементарная ячейка NaCl. | Рис. 6 Скоро появится большой кусок NaCl. |
[Домашняя страница мира структуры]
Последнее обновление этой страницы Среда, 2 декабря 2020 г.
Авторские права на этот документ и связанные с ним рисунки принадлежат Робу Тореки с 1996 по 2022 год.Все права защищены.
6.11A: Структура – каменная соль (NaCl)
- Последнее обновление
- Сохранить как PDF
- Введение
- Структура
- Элементарная ячейка
- Внешние ссылки
- Ссылки
- Авторы и авторство
Каменная соль, также известная как NaCl, представляет собой ионное соединение. Встречается в природе в виде белых кубических кристаллов. Структура NaCl образована повторением элементарной ячейки. Он имеет организованную структуру и имеет соотношение Na:Cl 1:1.
Встречается в природе в виде белых кубических кристаллов. Структура NaCl образована повторением элементарной ячейки. Он имеет организованную структуру и имеет соотношение Na:Cl 1:1.
Введение
Каменная соль (\(\ce{NaCl}\)) представляет собой ионное соединение, встречающееся в природе в виде белых кристаллов. Его извлекают из минеральной формы галита или выпариванием морской воды. Структура NaCl образована повторением элементарной гранецентрированной кубической ячейки. Он имеет стехиометрическое соотношение Na:Cl 1:1 с молярной массой 58.4 г/моль. Соединения со структурой хлорида натрия включают щелочные галогениды и оксиды металлов и соединения переходных металлов. Важную роль во многих важных приложениях играют структура и динамика воды. Некоторые приложения включают кристаллизацию белков и конформационное поведение пептидов и нуклеиновых кислот.
Структура
На рисунке \(\PageIndex{1}\) показано, как ионы Na + и Cl — занимают пространство.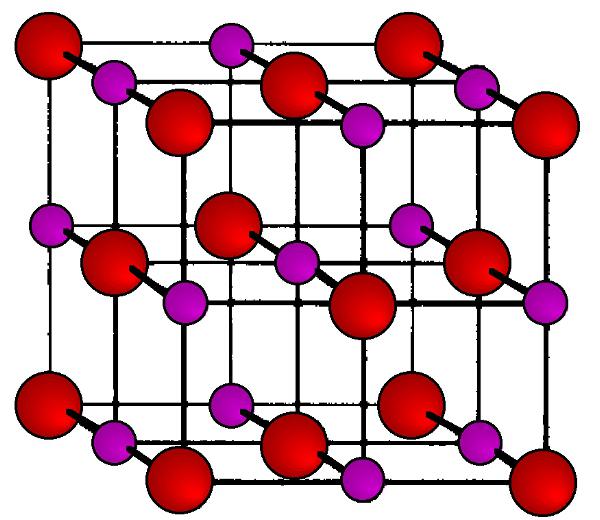 {-}}\).{-}}\) ионов. Существует четыре типа позиций: уникальная центральная позиция, гранная позиция, краевые позиции и угловая позиция, которые используются для определения количества ионов Na + и ионов Cl — в элементарной ячейке NaCl. При подсчете количества ионов угловой участок будет общим для 7 других элементарных ячеек. Следовательно, 1 угол будет равен 1/8 части иона. Аналогичное явление происходит с гранями и краевыми узлами. Для лицевого участка он является общим для 1 другой элементарной ячейки, а для краевого узла ион используется 3 другими элементарными ячейками.{-}}\): \[4_{грань} \times \dfrac{1}{2} + 8_{угол} \times \dfrac{1}{8} = 4\, \text{всего ионов хлора на ячейку } \номер\]
{-}}\).{-}}\) ионов. Существует четыре типа позиций: уникальная центральная позиция, гранная позиция, краевые позиции и угловая позиция, которые используются для определения количества ионов Na + и ионов Cl — в элементарной ячейке NaCl. При подсчете количества ионов угловой участок будет общим для 7 других элементарных ячеек. Следовательно, 1 угол будет равен 1/8 части иона. Аналогичное явление происходит с гранями и краевыми узлами. Для лицевого участка он является общим для 1 другой элементарной ячейки, а для краевого узла ион используется 3 другими элементарными ячейками.{-}}\): \[4_{грань} \times \dfrac{1}{2} + 8_{угол} \times \dfrac{1}{8} = 4\, \text{всего ионов хлора на ячейку } \номер\]
Каждый ион в этой решетке имеет шесть ионов другого типа в качестве ближайших соседей и двенадцать ионов того же типа в качестве вторых ближайших соседей. Есть много ионных соединений, которые принимают эту структуру, включая все другие галогениды Na, Li, K и Rb. CsF, AgF, AgCl, BaO, CoO и SrS также входят в число многих, которые образуют структуры, подобные NaCl.
CsF, AgF, AgCl, BaO, CoO и SrS также входят в число многих, которые образуют структуры, подобные NaCl.
Каталожные номера
- Гао, Х.Х., Л.-М. Пэн и Дж. М. Цзо. «Динамика решетки и факторы Дебая-Валлера некоторых соединений со структурой хлорида натрия». Acta Crystallographica: Section A (Wiley-Blackwell) 55.6 (1999): 1014. Академический поиск завершен . ЭБСКО. Веб.
- Хаускрофт, Кэтрин Э. и Алан Г. Шарп. Неорганическая химия . 3-е изд. Харлоу: Pearson Education, 2008. Печать.
- Джун Су, Ким и Йетирадж Арун.«Диффузионная аномалия воды в водных растворах хлорида натрия при низких температурах». Журнал физической химии B 112.6 (2008): 1729-1735. Академический поиск завершен . ЭБСКО. Веб.
Авторы и авторство
Категория: Кристаллическая структура хлорида натрия
Среда в категории «Кристаллическая структура хлорида натрия»
В эту категорию входят следующие 52 файла из 52.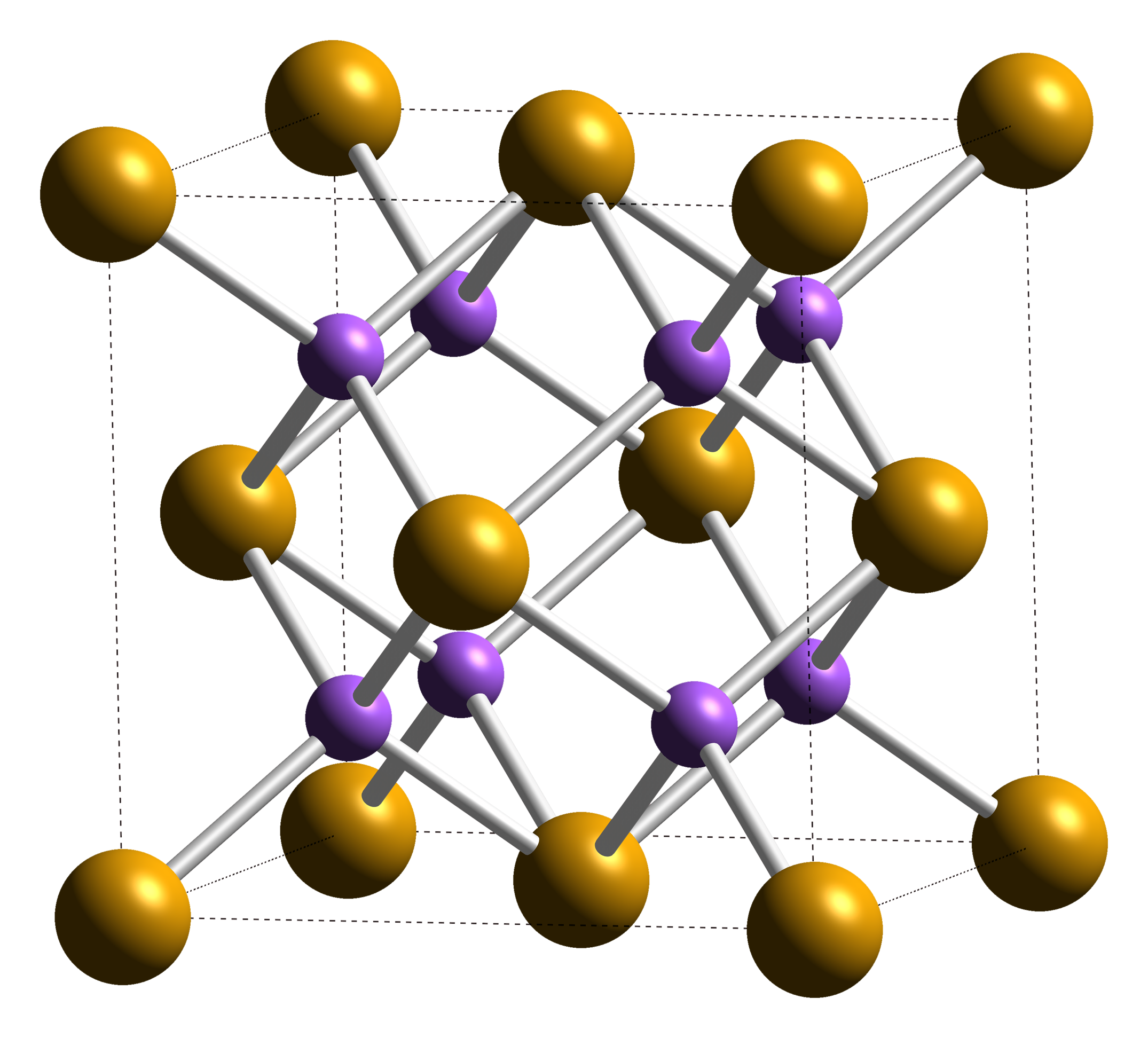
- Блаузен 0660 NaCl.png
1422 × 1600; 1,4 МБ
- CNX UPhysics 09 06 NaCI.png
534 × 571; 226 КБ
- Кристалл NaCl — структура.png
587 × 410; 13 КБ
- Образование граней кристалла.svg
1820 × 648; 167 КБ
- Изображение0IH.jpg
440 × 200; 38 КБ
- Ionlattice-fcc.svg
520 × 500; 44 КБ
- Решетка-энтальпия-NaCl-3D-ionic.png
1100 × 636; 130 КБ
- Legame chimico ionico.PNG
387 × 231; 5 КБ
- Линейная модель кристалла NaCl.png
627 × 167; 6 КБ
- Мотив nacl.jpg
242 × 246; 16 КБ
- NaCl — F 2-center.jpg
1050 × 700; 328 КБ
- NaCl — F A-center.jpg
1050 × 700; 296 КБ
- NaCl — F B-center.jpg
1050 × 700; 298 КБ
- NaCl — F-center.jpg
1050 × 700; 294 КБ
- NaCl — дефект Френкеля.jpg
1050 × 700; 269 КБ
- NaCl — дефект Шоттки.jpg
1050 × 700; 247 КБ
- NaCl — Дефект вакансии.
 jpg
1050 × 700; 248 КБ
jpg
1050 × 700; 248 КБ - Облигации NaCl.svg
1152 × 1001; 1,93 МБ
- Кристаллическая структура NaCl D2.jpg
1050 × 700; 259 КБ
- Кристаллическая структура NaCl.png
960 × 803; 97 КБ
- NaCl ГЦК ром.png
1654 × 1417; 439 КБ
- Модель NaCl с.jpg
400 × 424; 203 КБ
- Октаэдры NaCl и часть crystal.svg
1152 × 1001; 1,8 МБ
- Октаэдры NaCl в crystal.svg
1152 × 1001; 2 МБ
- Октаэдры NaCl.svg
1152 × 1001; 1,28 МБ
- Полиэдры NaCl.png
1654 × 1417; 739 КБ
- Полиэдры NaCl.svg
1147 × 960; 532 КБ
- NaCl-estructura cristalina.svg
500 × 500; 86 КБ
- NaCl-Ионэнгиттер.png
555 × 572; 46 КБ
- NaCl-Ionengitter.svg
555 × 572; 3 КБ
- NaCl-Ionengitter2.png
752 × 778; 113 КБ
- NaCl-ionlattice-madelung.png
752 × 778; 88 КБ
- NaCl-layers.png
401 × 358; 100 КБ
- Nacl-структура.
 jpg
800 × 600; 48 КБ
jpg
800 × 600; 48 КБ - NaCl.png
629 × 599; 291 КБ
- Дефект Накльфренкеля.svg
389 × 272; 25 КБ
- Nacllattice.svg
389 × 272; 28 КБ
- Naclschottkydefect.svg
389 × 272; 9 КБ
- Natriumchloridtyp.jpg
251 × 257; 14 КБ
- Natriumkloridionegittermodell.png
1833 × 1769; 1,17 МБ
- NNaCl.png
457 × 370; 53 КБ
- Модель межатомной связи ритмодинамики.gif
500 × 500; 4,79 МБ
- Salze Natriumchloridgitter Kugeln.svg
404 × 343; 195 КБ
- Salze Natriumchloridgitter Loesen.svg
520 × 350; 74 КБ
- Кристалл хлорида натрия.png
410 × 372; 37 КБ
- Хлорид натрия-3D-ionic-2.png
762 × 750; 170 КБ
- Хлорид натрия-3D-ionic.png
1000 × 948; 628 КБ
- Хлорид натрия-3D-vdW.png
1100 × 1082; 645 КБ
- 3D-шарики-и-палочки-элементарной-ячейки-хлорида натрия-изменены в размерах.png
201×200; 52 КБ
- Натрий-хлорид-элементарная-ячейка-3D-balls-and-sticks.
 png
1100 × 1093; 517 КБ
png
1100 × 1093; 517 КБ - Натрий-хлорид-элементарная-ячейка-3D-balls.png
1100 × 1056; 359 КБ
- Хлорид натрия-элементарная-ячейка-3D-ionic.png
1100 × 1093; 416 КБ
Центральная наука, глава 11, раздел 7
Химия: основная наука, глава 11, раздел 7В оставшейся части этой главы мы сосредоточимся на том, как свойства твердых тел связаны с их структурой и связью.Твердые тела могут быть как кристаллическими, так и аморфными (некристаллическими). Кристаллическое твердое тело — это твердое тело, в котором атомы, ионы или молекулы упорядочены в строго определенном порядке. Эти твердые тела обычно имеют плоские поверхности или грани, образующие определенные углы друг с другом. Упорядоченные стопки частиц, образующие эти грани, также приводят к тому, что твердые тела имеют очень правильную форму (рис. 11.27). Кварц и алмаз являются примерами кристаллических твердых тел.
Аморфное твердое тело (от греческих слов «бесформенный») — это твердое тело, частицы которого не имеют упорядоченной структуры.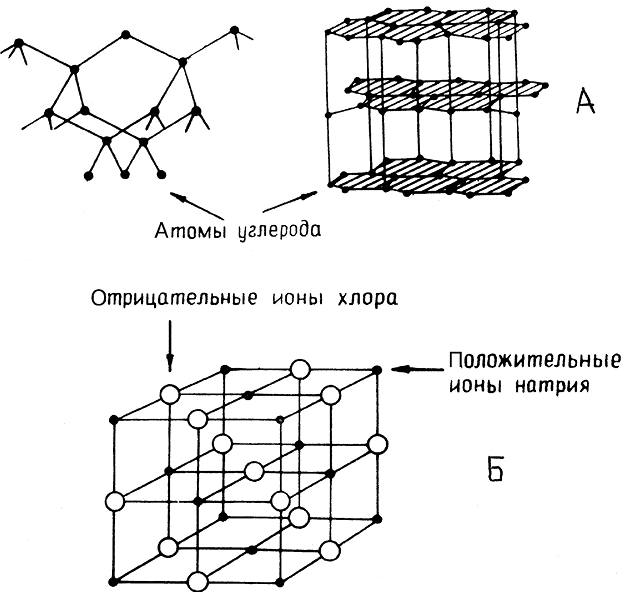 У этих твердых тел отсутствуют четко определенные грани и формы. Многие аморфные твердые тела представляют собой смеси молекул, которые плохо складываются друг с другом. Большинство других состоят из больших сложных молекул. Знакомые аморфные твердые тела включают каучук и стекло.
У этих твердых тел отсутствуют четко определенные грани и формы. Многие аморфные твердые тела представляют собой смеси молекул, которые плохо складываются друг с другом. Большинство других состоят из больших сложных молекул. Знакомые аморфные твердые тела включают каучук и стекло.
Кварц, SiO 2 , представляет собой кристаллическое твердое вещество с трехмерной структурой, подобной той, что показана на рис. 11.28 (а). Когда кварц плавится (примерно при 1600°С), он становится вязкой, липкой жидкостью. Хотя кремний-кислородная сеть остается в значительной степени неповрежденной, многие связи SiO разорваны, и твердая упорядоченность кварца утрачена.Если расплав быстро охладить, атомы не смогут вернуться к упорядоченному расположению. В результате получается аморфное твердое вещество, известное как кварцевое стекло или кварцевое стекло [рис. 11.28(b)].
Рисунок 11.28 Схематическое сравнение (а) кристаллического SiO 2 (кварц) и (б) аморфного SiO 2 (кварцевое стекло). Синие сферы представляют атомы кремния; красные сферы представляют атомы кислорода. Структура на самом деле трехмерная, а не плоская, как нарисовано.Единица, показанная как основной строительный блок (кремний и три атома кислорода), на самом деле состоит из четырех атомов кислорода, четвертый выходит из плоскости бумаги и способен связываться с другими атомами кремния.
Синие сферы представляют атомы кремния; красные сферы представляют атомы кислорода. Структура на самом деле трехмерная, а не плоская, как нарисовано.Единица, показанная как основной строительный блок (кремний и три атома кислорода), на самом деле состоит из четырех атомов кислорода, четвертый выходит из плоскости бумаги и способен связываться с другими атомами кремния.
Поскольку в частицах аморфного твердого тела отсутствует какой-либо дальний порядок, межмолекулярные силы различаются по силе по всему образцу. Таким образом, аморфные твердые тела не плавятся при определенных температурах. Вместо этого они размягчаются в диапазоне температур, когда преодолеваются межмолекулярные силы различной силы.Кристаллическое твердое вещество, напротив, плавится при определенной температуре.
Элементарные ячейки Характерный порядок кристаллических тел позволяет передать картину всего кристалла, взглянув лишь на небольшую его часть. Мы можем думать о твердом теле как о построенном из одинаковых строительных блоков, так же как кирпичная стена формируется из отдельных одинаковых кирпичей.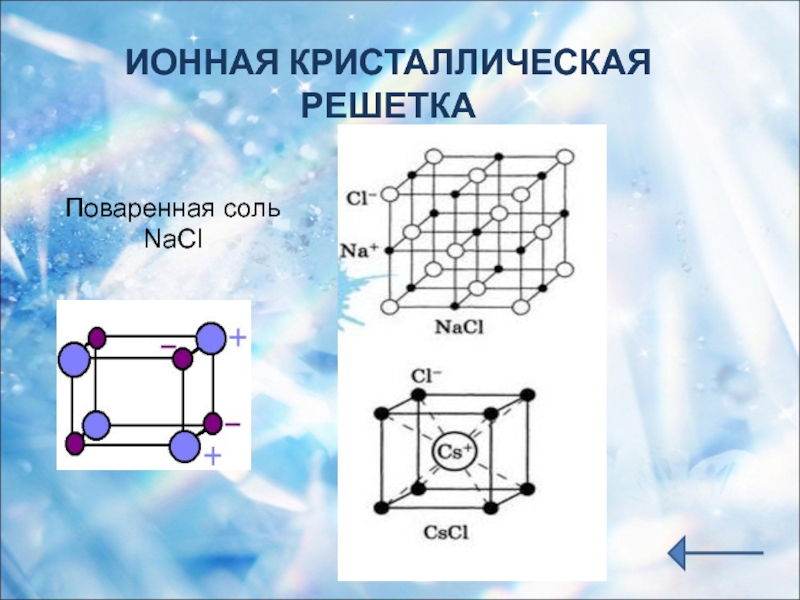 Повторяющаяся единица твердого тела, кристаллический «кирпичик», известна как элементарная ячейка .Простой двумерный пример показан на листе обоев, показанном на рис. 11.29. Существует несколько способов выбора повторяющегося узора или элементарной ячейки рисунка, но обычно выбирают наименьший вариант, который ясно показывает симметрию, характерную для всего узора.
Повторяющаяся единица твердого тела, кристаллический «кирпичик», известна как элементарная ячейка .Простой двумерный пример показан на листе обоев, показанном на рис. 11.29. Существует несколько способов выбора повторяющегося узора или элементарной ячейки рисунка, но обычно выбирают наименьший вариант, который ясно показывает симметрию, характерную для всего узора.
Рисунок 11.29 Дизайн обоев с характерным повторяющимся узором. Каждый заштрихованный синий квадрат обозначает элементарную ячейку повторяющегося шаблона. Элементарную ячейку с таким же успехом можно было бы выделить красными фигурами по углам.
Кристаллическое твердое тело может быть представлено трехмерным массивом точек, каждая из которых представляет идентичную среду внутри кристалла. Такой массив точек называется кристаллической решеткой . Мы можем представить формирование всей кристаллической структуры путем неоднократного размещения содержимого элементарной ячейки на кристаллической решетке.
На рис. 11.30 показана кристаллическая решетка и связанная с ней элементарная ячейка. В общем случае элементарные ячейки представляют собой параллелепипеды (шестигранные фигуры, грани которых представляют собой параллелограммы).Каждая элементарная ячейка может быть описана длинами ребер ячейки и углами между этими ребрами. Решетки всех кристаллических соединений можно описать с помощью семи основных типов элементарных ячеек. Простейшей из них является кубическая элементарная ячейка, у которой все стороны равны по длине и все углы равны 90°.
Рис. 11.30 Простая кристаллическая решетка и связанная с ней элементарная ячейка.
Как показано на рисунке 11, существует три вида кубических элементарных ячеек.31. Когда точки решетки находятся только в углах, элементарная ячейка описывается как примитивная кубическая . Когда точка решетки также находится в центре элементарной ячейки, ячейка известна как объемно-центрированная кубическая (рис. 11.32). Третий тип кубических ячеек имеет точки решетки в центре каждой грани, а также в каждом углу, расположение, известное как гранецентрированная кубическая .
11.32). Третий тип кубических ячеек имеет точки решетки в центре каждой грани, а также в каждом углу, расположение, известное как гранецентрированная кубическая .
Рис. 11.31 Три типа элементарных ячеек кубических решеток.Каждая точка решетки представляет идентичную среду в твердом теле.
Простейшие кристаллические структуры представляют собой кубические элементарные ячейки только с одним атомом в центре каждой точки решетки. Большинство металлов имеют такие структуры. Например, никель имеет гранецентрированную кубическую элементарную ячейку, тогда как натрий имеет объемно-центрированную кубическую ячейку. На рис. 11.33 показано, как атомы заполняют элементарные кубические ячейки. Обратите внимание, что атомы на углах и гранях не лежат полностью внутри элементарной ячейки. Вместо этого эти атомы являются общими для элементарных ячеек.В таблице 11.5 приведена доля атома, занимающего элементарную ячейку, когда атомы являются общими для элементарных ячеек.
Рисунок 11.33 Вид кубических элементарных ячеек, заполняющий пространство. Показана только часть каждого атома, принадлежащая элементарной ячейке.
Кристаллическая структура хлорида натрияКогда мы исследуем кристаллическую структуру NaCl (рис. 11.34), мы видим, что мы можем центрировать либо ионы Na + , либо ионы Cl – в узлах решетки гранецентрированной кубической элементарной ячейки.Таким образом, мы описываем структуру как гранецентрированную кубическую.
Рисунок 11.34 Часть кристаллической решетки NaCl, иллюстрирующая два способа определения его элементарной ячейки. Серые сферы представляют ионы Na + , а зеленые сферы представляют ионы Cl – . Красные линии определяют элементарную ячейку. На (а) ионы Cl – находятся в углах элементарной ячейки. На (б) ионы Na + находятся в углах элементарной ячейки. Оба эти варианта элементарной ячейки приемлемы; оба имеют одинаковый объем, и в обоих случаях одинаковые точки расположены гранецентрированным кубическим образом.
На рис. 11.34 ионы Na + и Cl – раздвинуты, так что симметрия структуры видна более отчетливо. В этом представлении не уделяется внимания относительным размерам ионов. Напротив, на рис. 11.35 представлено представление, показывающее относительные размеры ионов и то, как они заполняют элементарную ячейку. Обратите внимание, что частицы на углах, краях и гранях являются общими для других элементарных ячеек.
Рисунок 11.35 Элементарная ячейка NaCl, показывающая относительные размеры ионов Na + (серые) и ионов Cl – (зеленые). Лишь части большинства ионов лежат в пределах одной элементарной ячейки.
Общее отношение катионов к анионам элементарной ячейки должно быть таким же, как и для всего кристалла. Поэтому в элементарной ячейке NaCl должно быть равное количество ионов Na + и Cl – . Точно так же элементарная ячейка для CaCl 2 будет иметь один Ca 2+ на каждые два Cl – и так далее.
Определить суммарное количество ионов Na + и Cl – в элементарной ячейке NaCl (рис. 11.35).
РЕШЕНИЕ На каждом ребре находится одна четвертая числа Na + , целое число Na + в центре куба (см. также рис. 11.34), одна восьмая числа Cl – на каждом углу и по половине Cl – на каждой грани.Таким образом, мы имеем следующее:
Таким образом, элементарная ячейка содержит четыре Na + и четыре Cl – . Этот результат согласуется со стехиометрией соединения: один Na + на каждый Cl – .
ПРАКТИЧЕСКОЕ УПРАЖНЕНИЕЭлемент железо кристаллизуется в форме, называемой -железом, которая имеет объемно-центрированную кубическую элементарную ячейку. Сколько атомов железа содержится в элементарной ячейке? Ответ: два
ОБРАЗЕЦ УПРАЖНЕНИЯ 11.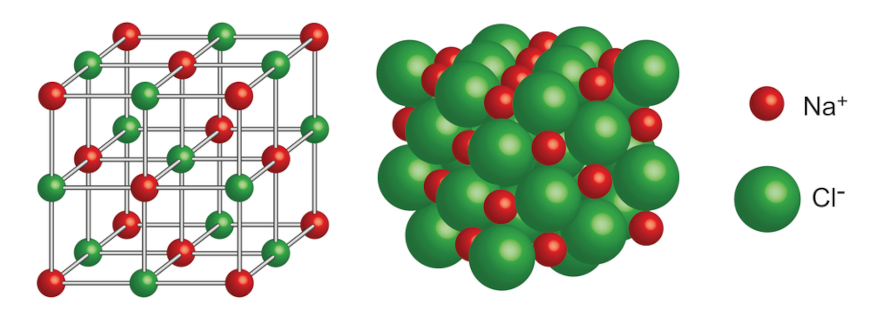 8
8 Геометрическое расположение ионов в кристаллах LiF такое же, как и в NaCl. Элементарная ячейка LiF составляет 4,02 Å на ребре. Рассчитайте плотность LiF.
РЕШЕНИЕ Поскольку расположение ионов в LiF такое же, как и в NaCl, элементарная ячейка LiF будет содержать четыре иона Li + и четыре иона F – (примерное упражнение 11.7). Плотность – это измерение массы на единицу объема. Таким образом, мы можем рассчитать плотность LiF по массе, содержащейся в элементарной ячейке, и объему элементарной ячейки.Масса, содержащаяся в одной элементарной ячейке, равна
Объем куба длины a на ребре равен a 3 , поэтому объем элементарной ячейки равен (4,02 Å) 3 . Теперь мы можем рассчитать плотность, переведя ее в общепринятые единицы г/см 3 :
Это значение согласуется со значением, найденным простыми измерениями плотности. Таким образом, размер и содержимое элементарной ячейки согласуются с макроскопической плотностью вещества.
Объемно-центрированная кубическая элементарная ячейка конкретной кристаллической формы железа составляет 2,8664 Å с каждой стороны. Вычислите плотность этой формы железа. Ответ: 7,8753 г/см 3
Плотная упаковка сферСтруктуры, принятые кристаллическими твердыми телами, — это те, которые приводят частицы в тесный контакт, чтобы максимизировать силы притяжения между ними.Во многих случаях частицы, из которых состоят твердые тела, имеют сферическую или приблизительно сферическую форму. Так обстоит дело с атомами в металлических твердых телах. Поэтому полезно рассмотреть, как сферы одинакового размера могут упаковываться наиболее эффективно (то есть с минимальным количеством пустого пространства).
Наиболее эффективное расположение слоя сфер одинакового размера показано на рис. 11.36(а). Каждая сфера окружена шестью другими в слое. Второй слой сфер можно разместить в углублениях поверх первого слоя. Затем можно добавить третий слой поверх второго со сферами, расположенными в углублениях второго слоя. Однако есть два типа впадин для этого третьего слоя, и они приводят к разным структурам, как показано на рис. 11.36 (b) и (c).
Затем можно добавить третий слой поверх второго со сферами, расположенными в углублениях второго слоя. Однако есть два типа впадин для этого третьего слоя, и они приводят к разным структурам, как показано на рис. 11.36 (b) и (c).
Рисунок 11.36 (a) Плотная упаковка одного слоя сфер одинакового размера. (б) В гексагональной плотноупакованной структуре атомы третьего слоя лежат непосредственно над атомами первого слоя. Порядок слоев ABAB.в) в кубической плотноупакованной структуре атомы в третьем слое не располагаются над атомами в первом слое. Вместо этого они немного смещены, и именно четвертый слой лежит непосредственно над первым. Таким образом, порядок слоев ABCA.
Если сферы третьего слоя разместить на одной линии со сферами первого слоя, как показано на рис. 11.36(b), в результате получится структура, известная как гексагональная плотная упаковка . Третий слой повторяет первый слой, четвертый слой повторяет второй слой и так далее, что дает последовательность слоев, которую мы обозначаем ABAB.
Однако сферы третьего слоя можно расположить немного в другом положении, чтобы они не располагались над сферами первого слоя. Получившаяся структура, показанная на рис. 11.36(с), известна как кубическая плотная упаковка . В этом случае четвертый слой повторяет первый слой, а последовательность слоев — ABCA. Хотя это не видно на рис. 11.36(с), элементарная ячейка кубической плотноупакованной структуры является гранецентрированной кубической.
В обеих плотноупакованных структурах каждая сфера имеет 12 равноудаленных ближайших соседей: 6 в одной плоскости, 3 над этой плоскостью и 3 внизу.Мы говорим, что каждая сфера имеет координационное число из 12. Координационное число — это число частиц, непосредственно окружающих частицу в кристаллической структуре. В обоих типах плотной упаковки 74% всего объема структуры занимают сферы; 26 процентов — это пустое пространство между сферами. Для сравнения, каждая сфера в объемно-центрированной кубической структуре имеет координационное число 8, и занято только 68 процентов пространства.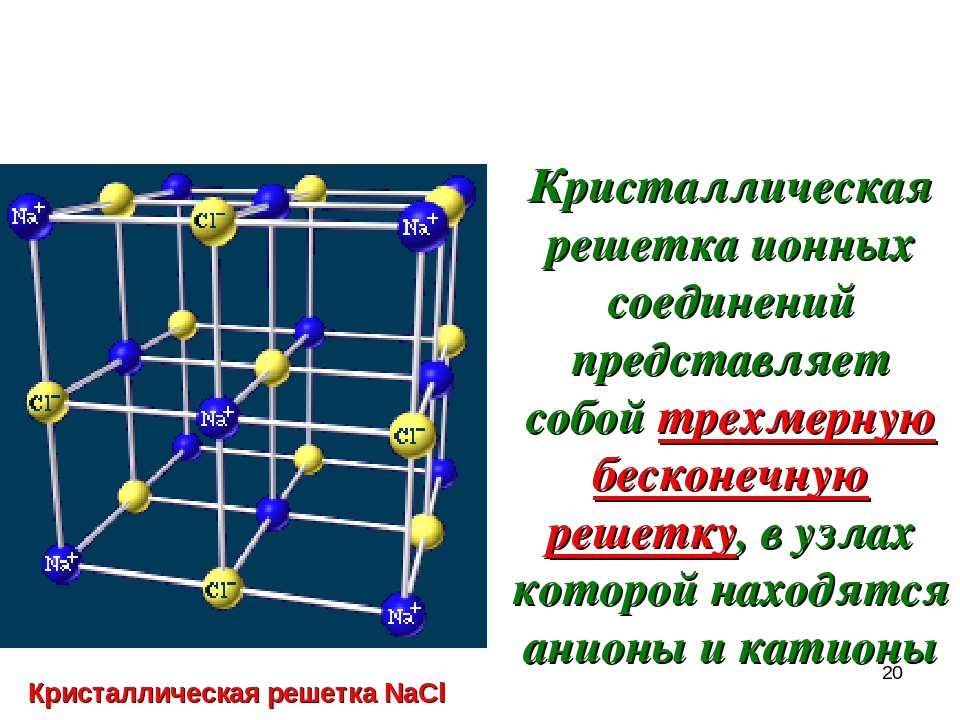 В простой кубической структуре координационное число равно 6, и занято только 52 процента пространства.
В простой кубической структуре координационное число равно 6, и занято только 52 процента пространства.
Когда сферы разного размера упакованы в решетку, более крупные частицы иногда принимают одно из плотно упакованных расположений, при этом более мелкие частицы занимают отверстия между большими сферами. Например, в Li 2 O более крупные ионы оксида принимают кубическую плотноупакованную структуру, а более мелкие ионы Li + занимают небольшие полости, существующие между ионами оксида.
Кристаллическая структура натрий-калиевого насоса
Скоу, Дж.C. Влияние некоторых катионов на аденозинтрифосфатазу периферических нервов. Биохим. Биофиз. Acta 1000 , 439–446 (1957)
Google Scholar
Post, RL, Hegyvary, C. & Kume, S. Активация аденозинтрифосфатом в кинетике фосфорилирования аденозинтрифосфатазы, транспортирующей ионы натрия и калия. Дж. Биол. хим. 247 , 6530–6540 (1972)
Дж. Биол. хим. 247 , 6530–6540 (1972)
КАС пабмед Google Scholar
Глинн И.М. Ежегодная обзорная лекция. «Все руки к натриевой помпе». J. Physiol. (Лондон.) 462 , 1–30 (1993)
CAS Статья Google Scholar
Гэдсби, Д. К., Раковски, Р. Ф. и Де Веер, П. Внеклеточный доступ к Na,K-насосу: путь, аналогичный ионному каналу. Наука 260 , 100–103 (1993)
CAS Статья ОБЪЯВЛЕНИЯ Google Scholar
Апелль, Х.J. & Karlish, SJ. Функциональные свойства Na, K-АТФазы и их структурные последствия, обнаруженные с помощью биофизических методов. Дж. Мембр. биол. 180 , 1–9 (2001)
CAS Статья Google Scholar
Геринг, К.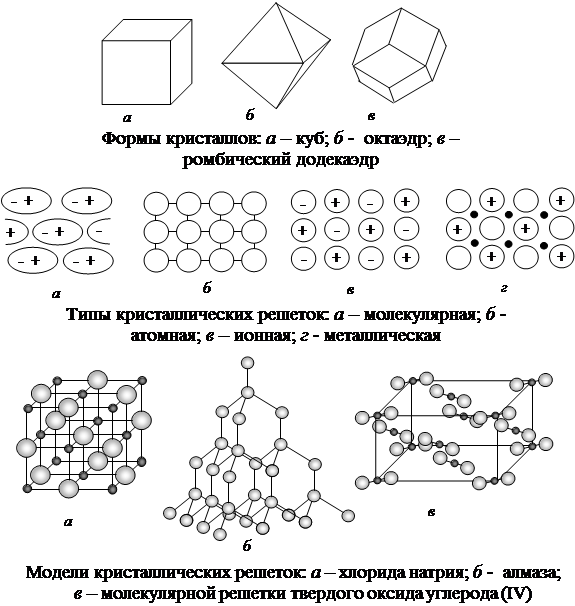 Функциональная роль субъединиц β в олигомерных АТФазах Р-типа. Дж. Биоэнергия. биомембрана 33 , 425–438 (2001)
Функциональная роль субъединиц β в олигомерных АТФазах Р-типа. Дж. Биоэнергия. биомембрана 33 , 425–438 (2001)
КАС Статья Google Scholar
Луценко С.и Каплан, Дж. Х. Важная роль внеклеточного домена β-субъединицы Na, K-АТФазы в окклюзии катионов. Биохимия 32 , 6737–6743 (1993)
CAS Статья Google Scholar
Гарти, Х. и Карлиш, С.Дж. Роль белков FXYD в переносе ионов. год. Преподобный Физиол. 68 , 431–459 (2006)
КАС Статья Google Scholar
Териен, А.Г. и Блостайн Р. Механизмы регуляции натриевой помпы. утра. Дж. Физиол. Клеточная физиол. 279 , C541–C566 (2000)
КАС Статья Google Scholar
Тойошима, К. , Накасако, М., Номура, Х. и Огава, Х. Кристаллическая структура кальциевого насоса саркоплазматического ретикулума с разрешением 2,6 А. Природа 405 , 647–655 (2000)
, Накасако, М., Номура, Х. и Огава, Х. Кристаллическая структура кальциевого насоса саркоплазматического ретикулума с разрешением 2,6 А. Природа 405 , 647–655 (2000)
CAS Статья ОБЪЯВЛЕНИЯ Google Scholar
Соренсен, Т.Л., Моллер, Дж. В. и Ниссен, П. Перенос фосфорила и окклюзия ионов кальция в кальциевом насосе. Наука 304 , 1672–1675 (2004)
CAS Статья ОБЪЯВЛЕНИЯ Google Scholar
Тойошима, К., Номура, Х. и Цуда, Т. Люменальный механизм ворот, обнаруженный в кристаллических структурах кальциевого насоса с аналогами фосфата. Природа 432 , 361–368 (2004)
CAS Статья ОБЪЯВЛЕНИЯ Google Scholar
Олесен, К., Соренсен Т.Л., Нильсен Р.К., Моллер Дж.В. и Ниссен П. Дефосфорилирование кальциевого насоса в сочетании с окклюзией противоиона. Наука 306 , 2251–2255 (2004)
Наука 306 , 2251–2255 (2004)
CAS Статья ОБЪЯВЛЕНИЯ Google Scholar
Vilsen, B., Andersen, JP, Petersen, J. & Jørgensen, PL Окклюзия 22 Na + и 86 Rb + в мембраносвязанных и растворимых протомерах Na α ,К-АТФаза. Дж. Биол. хим. 262 , 10511–10517 (1987)
КАС пабмед Google Scholar
Данко, С., Ямасаки, К., Дайхо, Т. и Сузуки, Х. Различная природа связанных фторидом бериллия, фторидом алюминия и фторидом магния стабильных аналогов нечувствительного к АДФ промежуточного фосфофермента саркоплазматического ретикулума Са 2+ -АТФаза: изменения каталитических и транспортных центров при гидролизе фосфоферментов. Дж. Биол. хим. 279 , 14991–14998 (2004)
КАС Статья Google Scholar
Vilsen, B. & Andersen, JP Мутация глутамата в четвертом сегменте мембраны Na + ,K + — АТФаза и Ca 2+ -АТФаза влияет на связывание катионов с обеих сторон мембраны и дестабилизирует окклюзированные формы фермента. Биохимия 37 , 10961–10971 (1998)
& Andersen, JP Мутация глутамата в четвертом сегменте мембраны Na + ,K + — АТФаза и Ca 2+ -АТФаза влияет на связывание катионов с обеих сторон мембраны и дестабилизирует окклюзированные формы фермента. Биохимия 37 , 10961–10971 (1998)
CAS Статья Google Scholar
Эйнхольм, А.P., Andersen, JP & Vilsen, B. Важность Leu 99 в трансмембранном сегменте M1 Na + , K + -АТФазы в связывании и окклюзии K + . Дж. Биол. хим. 282 , 23854–23866 (2007)
КАС Статья Google Scholar
Vilsen, B. Мутант Glu781Ala почки крысы Na + ,K + -АТФаза проявляет низкое сродство к катионам и катализирует гидролиз АТФ с высокой скоростью в отсутствие ионов калия. Биохимия 34 , 1455–1463 (1995)
CAS Статья Google Scholar
Kuntzweiler, T. A., Arguello, J.M. & Lingrel, JB. Дж. Биол. хим. 271 , 29682–29687 (1996)
A., Arguello, J.M. & Lingrel, JB. Дж. Биол. хим. 271 , 29682–29687 (1996)
КАС Статья Google Scholar
Блостайн Р., Wilczynska, A., Karlish, SJ, Arguello, JM & Lingrel, JB. Доказательства того, что Ser 775 в α-субъединице Na,K-АТФазы является остатком в кармане связывания катиона. Дж. Биол. хим. 272 , 24987–24993 (1997)
КАС Статья Google Scholar
Pedersen, PA, Nielsen, JM, Rasmussen, JH & Jorgensen, PL вклад в TL + , K + , и Na + , SER 775 , SER 775 , THR 774 , Thr 772 и Tyr 771 в цитоплазматической части пятого трансмембранного сегмента α-субъединицы почечной Na,K-АТФазы. Биохимия 37 , 17818–17827 (1998)
CAS Статья Google Scholar
Олесен, К. и др. Структурные основы транспорта кальция кальциевым насосом. Природа doi: 10.1038/nature06418. (данный выпуск)
и др. Структурные основы транспорта кальция кальциевым насосом. Природа doi: 10.1038/nature06418. (данный выпуск)
CAS Статья ОБЪЯВЛЕНИЯ Google Scholar
Кларк, Д. М., Лу, Т. В., Инеси, Г. и МакЛеннан, Д.H. Расположение сайтов связывания Ca 2+ с высоким сродством в предсказанном трансмембранном домене саркоплазматического ретикулума Ca 2+ -ATPase. Природа 339 , 476–478 (1989)
CAS Статья ОБЪЯВЛЕНИЯ Google Scholar
Andersen, J. P. & Vilsen, B. Аминокислоты Asn 796 и Thr 799 Ca 2+ -АТФаза саркоплазматического ретикулума связывают Ca 2+ в разных сайтах. Дж. Биол. хим. 269 , 15931–15936 (1994)
КАС пабмед Google Scholar
Jardetzky, O.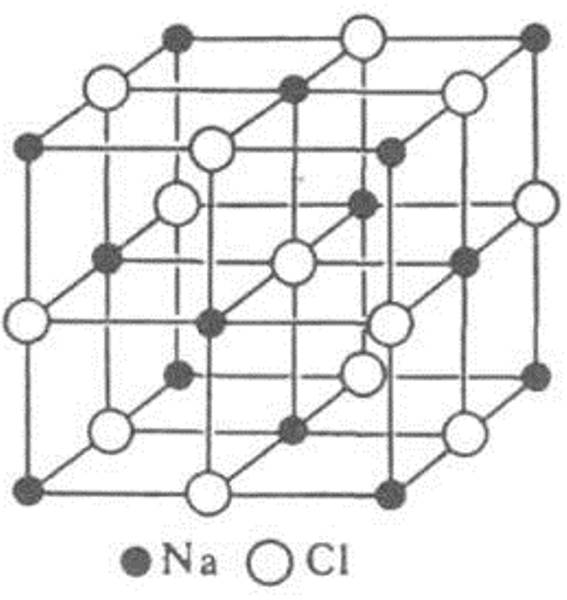 Простая аллостерическая модель для мембранных насосов. Природа 211 , 969–970 (1966)
Простая аллостерическая модель для мембранных насосов. Природа 211 , 969–970 (1966)
CAS Статья ОБЪЯВЛЕНИЯ Google Scholar
Доннет С., Арыстархова Э. и Свиднер К. Дж. Термическая денатурация Na,K-АТФазы свидетельствует об олигомерном взаимодействии α-α и ассоциации γ-субъединицы с С-концевым доменом. Дж. Биол. хим. 276 , 7357–7365 (2001)
КАС Статья Google Scholar
Колонна, Т. Е., Хьюн, Л. и Фамбро, Д. М. Взаимодействия субъединиц в Na,K-АТФазе исследованы с двухгибридной системой дрожжей. Дж. Биол. хим. 272 , 12366–12372 (1997)
КАС Статья Google Scholar
Райс, В.J., Young, HS, Martin, DW, Sachs, JR & Stokes, DL Структура Na + , K + -АТФазы при разрешении 11 Å: сравнение с Ca 2+ -АТФазой в E1 и Е2 заявляет. Биофиз. J. 80 , 2187–2197 (2001)
Биофиз. J. 80 , 2187–2197 (2001)
CAS Статья Google Scholar
Хеберт Х., Пурхонен П., Ворум Х., Томсен К. и Маунсбах А.Б. Трехмерная структура почечной Na,K-АТФазы по данным криоэлектронной микроскопии двумерных кристаллов. Дж. Мол. биол. 314 , 478–494 (2001)
Статья Google Scholar
Мурата Т., Ямато И., Какинума Ю., Лесли А. Г. и Уокер Дж. Э. Структура ротора Na + -АТФазы V-типа из Enterococcus hirae . Наука 308 , 654–659 (2005)
CAS Статья ОБЪЯВЛЕНИЯ Google Scholar
Териете, П., Franzin, C.M., Choi, J. & Marassi, FM. Структура регуляторного белка Na,K-АТФазы FXYD1 в мицеллах. Биохимия 46 , 6774–6783 (2007)
CAS Статья Google Scholar
Li, C. et al. Сайты структурных и функциональных взаимодействий между Na + ,K + -АТФазой и белками FXYD. Дж. Биол. хим. 279 , 38895–38902 (2004)
et al. Сайты структурных и функциональных взаимодействий между Na + ,K + -АТФазой и белками FXYD. Дж. Биол. хим. 279 , 38895–38902 (2004)
КАС Статья Google Scholar
Мейдж, И.С. и др. Доминирующая изолированная потеря магния почками вызвана неправильным направлением γ-субъединицы Na + ,K + -АТФазы. Природа Жене. 26 , 265–266 (2000)
КАС Статья Google Scholar
Einholm, AP, Toustrup-Jensen, M., Andersen, JP & Vilsen, B. Мутация Gly-94 в трансмембранном сегменте M1 Na + , K + -АТФаза взаимодействует с Na + и связывание K + в конформации E2P. Проц. Натл акад. науч. США 102 , 11254–11259 (2005)
CAS Статья ОБЪЯВЛЕНИЯ Google Scholar
Педерсен Б.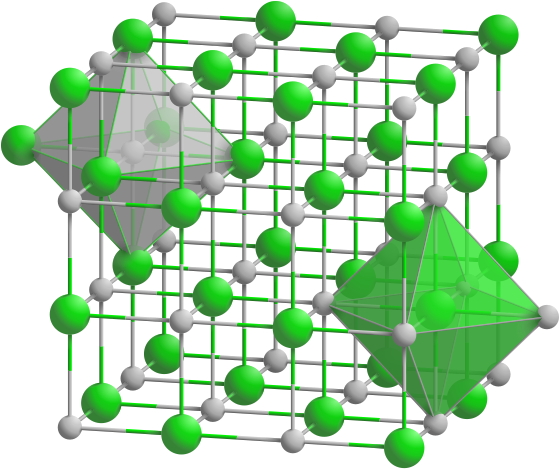 П., Бух-Педерсен М.Дж., Морт Дж.П., Палмгрен М.Г. и Ниссен П. Кристаллическая структура протонного насоса плазматической мембраны. doi: 10/1038/nature06417 Природа . (данный выпуск)
П., Бух-Педерсен М.Дж., Морт Дж.П., Палмгрен М.Г. и Ниссен П. Кристаллическая структура протонного насоса плазматической мембраны. doi: 10/1038/nature06417 Природа . (данный выпуск)
Хоканссон, К.О. Кристаллографическая структура N-домена Na,K-АТФазы в положении 2.разрешение 6 Å. Дж. Мол. биол. 332 , 1175–1182 (2003)
Артикул Google Scholar
Хильге, М. и др. АТФ-индуцированные конформационные изменения нуклеотидсвязывающего домена Na,K-АТФазы. Природная структура. биол. 10 , 468–474 (2003)
КАС Статья Google Scholar
Свиднер К.Дж. и Фещенко М.S. Прогнозируемое расположение и ограниченная доступность сайта фосфорилирования протеинкиназы А на Na-K-АТФазе. утра. Дж. Физиол. Клеточная физиол. 280 , C1017–C1026 (2001)
КАС Статья Google Scholar
Вилсен, Б. , Рамлов, Д. и Андерсен, Дж. П. Функциональные последствия мутаций в трансмембранной центральной области для перемещения катионов и передачи энергии в Na + ,K + -АТФазе и SR Ca 2+ -АТФаза. Энн. Академик Нью-Йорка науч. 834 , 297–309 (1997)
, Рамлов, Д. и Андерсен, Дж. П. Функциональные последствия мутаций в трансмембранной центральной области для перемещения катионов и передачи энергии в Na + ,K + -АТФазе и SR Ca 2+ -АТФаза. Энн. Академик Нью-Йорка науч. 834 , 297–309 (1997)
CAS Статья ОБЪЯВЛЕНИЯ Google Scholar
Ogawa, H. & Toyoshima, C. Моделирование гомологии сайтов связывания катионов Na + K + -АТФазы. Проц. Натл акад. науч. США 99 , 15977–15982 (2002)
CAS Статья ОБЪЯВЛЕНИЯ Google Scholar
Ли, К., Capendeguy, O., Geering, K. & Horisberger, JD. Третий сайт связывания Na + в натриевом насосе. Проц. Натл акад. науч. США 102 , 12706–12711 (2005)
CAS Статья ОБЪЯВЛЕНИЯ Google Scholar
Имагава Т. , Ямамото Т., Кая С., Сакагути К. и Танигучи К. Thr-774 (трансмембранный сегмент M5), Val-920 (M8) и Glu-954 (M9) ) участвуют в транспорте Na + , а Gln-923 (M8) необходим для активности Na,K-АТФазы. Дж. Биол. хим. 280 , 18736–18744 (2005)
, Ямамото Т., Кая С., Сакагути К. и Танигучи К. Thr-774 (трансмембранный сегмент M5), Val-920 (M8) и Glu-954 (M9) ) участвуют в транспорте Na + , а Gln-923 (M8) необходим для активности Na,K-АТФазы. Дж. Биол. хим. 280 , 18736–18744 (2005)
КАС Статья Google Scholar
Цзян Ю., Рута В., Чен Дж., Ли А. и Маккиннон Р. Принцип управления движением заряда в канале K + , зависящем от напряжения. Природа 423 , 42–48 (2003)
CAS Статья ОБЪЯВЛЕНИЯ Google Scholar
Басс Р.B., Strop, P., Barclay, M. & Rees, D.C. Кристаллическая структура Escherichia coli MscS, механочувствительный канал с модуляцией напряжения. Наука 298 , 1582–1587 (2002)
CAS Статья ОБЪЯВЛЕНИЯ Google Scholar
Crambert, G. et al. Транспортные и фармакологические свойства девяти различных изоферментов Na, K-АТФазы человека. Дж. Биол. хим. 275 , 1976–1986 (2000)
et al. Транспортные и фармакологические свойства девяти различных изоферментов Na, K-АТФазы человека. Дж. Биол. хим. 275 , 1976–1986 (2000)
КАС Статья Google Scholar
Йоргенсен, П.L. Очистка и характеристика (Na + + K + )-АТФазы. III. Очистка наружного мозгового вещества почки млекопитающих после селективного удаления компонентов мембраны с помощью SDS. Биохим. Биофиз. Acta 356 , 36–52 (1974)
Статья Google Scholar
Rodacker, V., Toustrup-Jensen, M. & Vilsen, B. Мутации Phe 785 Leu и Thr 618 Встречается в Na + ,K + -рапид, связанный с фаАТФмилазой начало дистонии паркинсонизма, мешают взаимодействию Na + по различным механизмам. Дж. Биол. хим. 281 , 18539–18548 (2006)
КАС Статья Google Scholar
Kabsch, W. Автоматическая обработка данных ротационной дифракции от кристаллов с изначально неизвестной симметрией и константами ячейки. Дж. Заявл. Кристалл. 26 , 795–800 (1993)
Автоматическая обработка данных ротационной дифракции от кристаллов с изначально неизвестной симметрией и константами ячейки. Дж. Заявл. Кристалл. 26 , 795–800 (1993)
КАС Статья Google Scholar
Маккой, А. Дж., Гроссе-Кунстлеве, Р.В., Сторони, Л. К. и Рид, Р. Дж. Функции быстрого перевода с расширенным правдоподобием. Акта Кристаллогр. Д 61 , 458–464 (2005)
Статья Google Scholar
Vonrhein, C., Blanc, E., Roversi, P. & Bricogne, G. Автоматизированное структурное решение с autoSHARP. Методы Мол. биол. 364 , 215–230 (2006)
Google Scholar
Коутан, К.Д. и Мэйн, П. Комбинация фаз и перекрестная проверка в повторяющихся расчетах модификации плотности. Акта Кристаллогр. D 52 , 43–48 (1996)
КАС Статья Google Scholar
Terwilliger, T. C. Модификация плотности максимального правдоподобия. Акта Кристаллогр. D 56 , 965–972 (2000)
C. Модификация плотности максимального правдоподобия. Акта Кристаллогр. D 56 , 965–972 (2000)
CAS Статья Google Scholar
Джонс, Т.А., Зоу, Дж. Ю., Коуэн, С. В. и Кьельдгаард, М. Улучшенные методы построения моделей белков на картах электронной плотности и определение местоположения ошибок в этих моделях. Акта Кристаллогр. А 47 , 110–119 (1991)
Артикул Google Scholar
Brunger, A. T. et al. Система кристаллографии и ЯМР: новый пакет программного обеспечения для определения структуры макромолекул. Акта Кристаллогр. D 54 , 905–921 (1998)
CAS Статья Google Scholar
%PDF-1.5 % 51 0 объект > эндообъект внешняя ссылка 51 80 0000000016 00000 н 0000002622 00000 н 0000002721 00000 н 0000003251 00000 н 0000003387 00000 н 0000003521 00000 н 0000003650 00000 н 0000003685 00000 н 0000003798 00000 н 0000003909 00000 н 0000003934 00000 н 0000004386 00000 н 0000004889 00000 н 0000004914 00000 н 0000005565 00000 н 0000005590 00000 н 0000006202 00000 н 0000006756 00000 н 0000006896 00000 н 0000007368 00000 н 0000007394 00000 н 0000007932 00000 н 0000008418 00000 н 0000008945 00000 н 0000009392 00000 н 0000009525 00000 н 0000009551 00000 н 0000009962 00000 н 0000010082 00000 н 0000010117 00000 н 0000010260 00000 н 0000010899 00000 н 0000012560 00000 н 0000012760 00000 н 0000015409 00000 н 0000015478 00000 н 0000015558 00000 н 0000031571 00000 н 0000031839 00000 н 0000032149 00000 н 0000032218 00000 н 0000032298 00000 н 0000039338 00000 н 0000039609 00000 н 0000061934 00000 н 0000062201 00000 н 0000062576 00000 н 0000062645 00000 н 0000063168 00000 н 0000063237 00000 н 0000063318 00000 н 0000084354 00000 н 0000084632 00000 н 0000084980 00000 н 0000085243 00000 н 0000118543 00000 н 0000118624 00000 н 0000119012 00000 н 0000119400 00000 н 0000119470 00000 н 0000119769 00000 н 0000120157 00000 н 0000120527 00000 н 0000120648 00000 н 0000120793 00000 н 0000121193 00000 н 0000121274 00000 н 0000121427 00000 н 0000121579 00000 н 0000124087 00000 н 0000135710 00000 н 0000140037 00000 н 0000145423 00000 н 0000145520 00000 н 0000149814 00000 н 0000157022 00000 н 0000162013 00000 н 0000163563 00000 н 0000168088 00000 н 0000001896 00000 н трейлер ]/предыдущая 365687>> startxref 0 %%EOF 130 0 объект >поток hb«`b«?Ab,8ZDȚkQZשg70XY$»1w0E\ƤP%4lWEx»:^[}~qAP7f/yV,&đXK_Ⱥ8uqU
UG@#SOA,])dR2Ewb_l%rЁ;qHNNVxz8i/vM}ₜSA6H[f8zm= ЭЗ.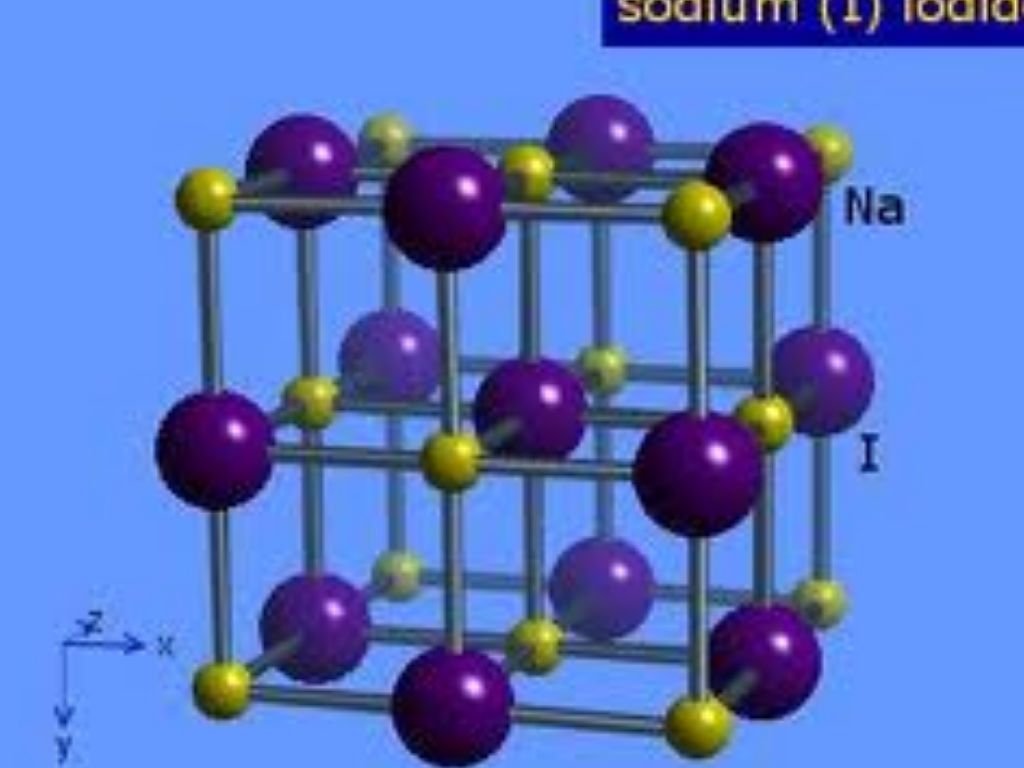


 jpg
1050 × 700; 248 КБ
jpg
1050 × 700; 248 КБ  jpg
800 × 600; 48 КБ
jpg
800 × 600; 48 КБ  png
1100 × 1093; 517 КБ
png
1100 × 1093; 517 КБ