4.2. Гидролиз солей слабых оснований и сильных кислот.
Пример 4.2.1 Гидролиз NH4I (соль образована нейтрализацией слабого основания NH4OH сильной кислотой HI).
Развёрнутое ионно-молекулярное уравнение гидролиза:
NH4+ +I— +HOH=NH4OH+I— +H+.
Сокращённое ионно-молекулярное уравнение:
NH4+ +HOH=NH4OH+H+.
Как видно из
уравнения, в результате гидролиза ионы
ОН— воды связываются в молекулы слабого
основания NH4OH,
тогда как ионы Н
Молекулярное уравнение в данном случае очевидно:
NH4I+HOH=NH4OH+HI.
Пример 4.2.2. Гидролиз СоSO4 (соль образована слабым основанием- гидроксидом кобальта (II) Co(OH)2 и сильной серной кислотой H2SO4).
Развёрнутое ионно-молекулярное уравнение гидролиза:
Со2+ +SO42- +HOH=CoOH+ +SO42- +H+.
Сокращённое ионно-молекулярное уравнение:
Co2+ +HOH=CoOH+
+H+.Опять же, как и в примере 4.2.1, ионы ОН— воды связываются катионами слабого основания, а ионы Н+ накапливаются в растворе в свободном виде, придавая раствору кислый характер (рН<7). Из уравнения видно, что в результате связывания ионов ОН— образуется не нейтральное основание Со(ОН)2, а заряженный гидроксокатион СоОН+, то есть гидролиз протекает по первой ступени.
Некоторую сложность в рассматриваемом примере представляет составление молекулярного уравнения по развёрнутому ионно- молекулярному. Т.к. в правой части уравнения фигурируют катионы 2-х типов, а анион один, для составления нейтральных комбинаций с каждым из 2-х катионов необходимо иметь также 2 аниона Поэтому, чтобы составить молекулярное уравнение, развёрнутое ионно-молекулярное уравнение необходимо удвоить:
Соответственно преобразованному ионно-молекулярному уравнению молекулярное уравнение гидролиза записывается:
2CoSO4+2HOH=(CoOH)2SO4+H2SO4.
Как видно из молекулярного уравнения, при гидролизе соли CoSO4 по первой ступени образуется не гидроксид кобальта (II) Co(OH)2, а основная соль-гидроксосульфат кобальта (II). Это общее правило: при гидролизе солей слабых оснований многозарядных катионов и сильных кислот образуются основные соли.
Общим для солей слабых оснований и сильных кислот является то, что вследствие гидролиза их растворы приобретают кислый характер (рН<7), то есть растворы солей данного типа являются фактически кислотами.
4.3. Гидролиз солей сильных оснований и сильных кислот.
Пример 4.3.1. Взаимодействие КСl с водой (соль образована сильным основанием КОН и сильной кислотой HСl).
Развёрнутое ионно-молекулярное уравнение:
К+ +Cl— +HOH=K+ +OH— +Cl— +H+.
Уравнение показывает, что ионы соли не участвуют в реакции: не происходит связывания ни ионовН+, ни ионов ОН—.
Сокращённое ионно-молекулярное уравнение:
НОН=ОН— +Н+.
Из сокращённого уравнения видно, что в водном растворе KСl процесс сводится к диссоциации самой воды, вследствие которой образуются ионы Н
Несмотря на отсутствие гидролиза, оформление рассматриваемого процесса закончим записью молекулярного уравнения:
KCl+HOH=KOH+HCl.
Записанное молекулярное уравнение лишний раз свидетельствует в пользу того, что при рассмотрении любой реакции ионного обмена не следует ограничиваться молекулярным уравнением, а обязательно необходимо записывать ионно-молекулярное уравнение, т.к. только оно даёт истинную информацию о реакции. На самом деле, молекулярное уравнение взаимодействия КСl с водой указывает на наличие реакции, тогда как ионно-молекулярное уравнение приводит к однозначному выводу: KСl гидролизу не подвергается.
Итак, соли сильных кислот и сильных оснований гидролизу не подвергаются; рН растворов этих солей равен 7.
1Эквивалентом вещества называется его реальная или условная частица, которая в химических реакциях эквивалентна 1 атому или 1 иону водорода. Например, КОН эквивалентен 1 иону Н+, что хорошо видно из реакции КОН+НCl=KCl+H2O; в реакцииFe+2HCl=FeCl2+H2 атомFe эквивалентен двум ионам Н+, т.е. эквивалентом железа является условная частица – половина его атома.
2Множитель 10-3в знаменателе – коэффициент перевода объёма раствора из миллилитров в литры.
3Множитель 10-3в знаменателе – коэффициент перевода объёма раствора из см3в литры.
4Множитель 10-3– коэффициент для перевода объёма из миллилитров в литры.
5Множитель 103– коэффициент для перевода объёма из литров в см3.
6Численные значения констант диссоциации слабых электролитов – табличные данные.
7Амфотерные гидроксиды в контрольной работе не рассматриваются.
8О комплексных соединениях см. также методические указания к контрольной работе №1.
9Гидролиз солей слабых кислот и слабых оснований в контрольной работе не рассматривается.
10Оформление реакций гидролиза целесообразно начинать с записи развёрнутого ионно-молекулярного уравнения. При этом, как обычно, сильные электролиты записываются в виде свободных ионов, слабые — в молекулярном виде. Очевидно, что вода в ионно-молекулярных уравнениях гидролиза должна всегда записываться в виде молекул Н2О.
Т.к. гидролиз солей заключается во взаимодействии ионов соли с ионами Н+и ОН—воды, целесообразно в уравнениях гидролиза молекулярную форму воды представлять как связанную совокупность этих ионов: НОН.
studfile.net
Гидролиз, подготовка к ЕГЭ по химии
Гидролиз (греч. hydor — вода и lysis — разрушение) — процесс расщепления молекул сложных химических веществ за счет реакции с молекулами воды.
В химии, как и в жизни, разрушается чаще всего нестойкое и слабое (стойкое и сильное выдерживает удар). Запомните, что гидролиз (вода) разрушает «слабое» — это правило вам очень пригодится.

Любая соль состоит из остатка основания и кислоты. Абсолютно любая:
- NaCl — производное основания NaOH и кислоты HCl
- KNO3 — производное основания KOH и кислоты HNO3
- CuSO4 — производное основания Cu(OH)2 и кислоты H2SO4
- Al3PO4 — производное основания Al(OH)3
- Ca(NO2)2 — производное основания Ca(OH)2 и кислоты HNO2
Чтобы успешно решать задания по теме гидролиза и писать реакции, вам следует запомнить, какие основания и кислоты являются слабыми, а какие — сильными.
При изучении гидролиза я рекомендую ученикам сохранить на гаджет схему, которую вы видите ниже. Для того, чтобы приобрести нужный опыт — она незаменима. Пользуйтесь ей как можно чаще, подглядывайте в нее и она незаметно окажется в вашем интеллектуальном составляющем 😉

По катиону, по аниону или нет гидролиза?
Итак, если в состав соли входит остаток сильного основания и остаток сильной кислоты — гидролиза не происходит. Примеры: NaCl, KBr, CaSO4. Также гидролиза не происходит, если соль нерастворима (вне зависимости от того, чем она образована): AlPO 4, FeSO3, CaSO3.
Если в состав соли входит остаток слабого основания и остаток сильной кислоты, то гидролиз идет по катиону. Помните, что гидролиз разрушает слабое, в данном случае — катион. Примеры: AlCl3, MgBr2, Cr2SO4, NH4NO3.
Катион NH4+ и его основание NH4OH , несмотря на растворимость, является слабым, поэтому гидролиз будет идти по катиону в соли NH4Cl. Замечу также, что Ca(OH)2 считается растворимым основанием, поэтому гидролиза соли CaCl2 не происходит.
Если в состав соли входит остаток сильного основания и остаток слабой кислоты, то гидролиз идет по аниону. Примеры: K3PO4, NaNO2, Ca(OCl)2
Если соль образована остатком слабого основания и слабой кислоты, то гидролиз идет и по катиону, и по аниону. Примеры: Mg(NO2)2, Al2S3, Cr2(SO3)3, CH3COONH4.

Самостоятельно определите тип гидролиза для CuBr2, CaI2, Li2SiO3, Zn(H2PO4)2. Ниже вы найдете решение.
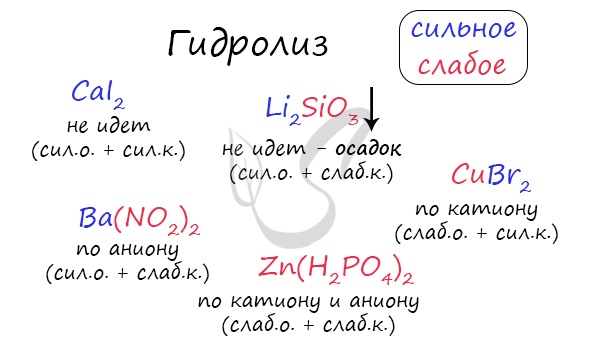
Среда раствора
Среда раствора может быть нейтральной, кислой или щелочной. Определяется типом гидролиза. Некоторые задания могут быть построены так, что, увидев соль, вы должны будете определить ее тип раствора.
Обрадую вас: если вы усвоили тему гидролиза, сделать это проще простого. В случае, когда гидролиз не идет или идет и по катиону, и по аниону среда раствора — нейтральная.
Если гидролиз идет по катиону (разрушается остаток основания) среда — кислая, если гидролиз идет по аниону (разрушается остаток кислоты), то среда раствора будет щелочная. Изучите примеры.
Однако замечу, что в дигидрофосфатах, гидрофосфатах гидросульфитах и гидросульфатах среда всегда кислая из-за особенностей диссоциации. Примеры: NH4H2PO4, NaHSO3, LiHSO4.

Попробуйте определить среду раствора для соединений из самостоятельного задания, которое вы только что решили. Ниже будет располагаться решение.

С целью запутать в заданиях часто бывают даны синонимы. Так «среду раствора» могут заменить водородным показателем pH.
Запомните, что кислая среда характеризуется pH < 7. В нейтральной pH = 7. В щелочной pH > 7.

Например, в соли CaCl2 среда раствора будет нейтральной (pH=7), а в растворе AlCl3 — кислой (pH < 7).
Индикаторы (лат. indicator — указатель)
Индикатор — вещество, используемое в химии для определения среды раствора. В зависимости от среды раствора индикатор способен менять его цвет, что наглядно отражает характер среды в определенный момент времени.
Наиболее известные и широко применяемые индикаторы: лакмус, фенолфталеиновый и метиловый оранжевый. В зависимости от среды раствора их окраска меняется, что отражает приведенная ниже таблица.

Для тех, кто обладает хорошей зрительной памятью, будет несложно запомнить эту схему. Но что делать аудиалам и кинестетикам? 🙂 От волнения на экзамене такая таблица легко может раствориться и перепутаться в океане мыслей, поэтому своим ученикам я рекомендую запомнить индикаторы по стихам.
Только представьте, как приятно будет прочитать стих на экзамене, и убедиться в его безошибочности. Это придаст уверенности и поднимет настроение 😉
Лакмус
Индикатор лакмус красный
Кислоту укажет ясно.
Индикатор лакмус синий —
Щелочь здесь, не будь разиней!
Когда ж нейтральная среда,
Он фиолетовый всегда.
Фенолфталеин
Фенолфталеиновый
В щелочах малиновый
Несмотря на это —
В кислотах он без цвета.
Метиловый оранжевый
От щелочи я желт как в лихорадке
Я розовею от кислот, как от стыда
И я бросаюсь в воду без оглядки —
Здесь я оранжевый практически всегда!

©Беллевич Юрий Сергеевич
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
studarium.ru
Тема №36 «Гидролиз солей» | CHEM-MIND.com
Оглавление
- Реакция гидролиза
- Классификация солей
- Значение гидролиза
- Шпаргалка
- Задания для самопроверки
Согласно теории электролитической диссоциации в водном растворе частицы растворенного вещества взаимодействуют с молекулами воды. Такое взаимодействие может привести к реакции гидролиза.
Гидролиз — это реакция обменного разложения вещества водой.

Гидролизу подвергаются различные вещества: неорганические — соли, карбиды и гидриды металлов, галогениды неметаллов; органические — галогеналканы, сложные эфиры и жиры, углеводы, белки, полинуклеотиды.
Водные растворы солей имеют разные значения рН и различные типы сред — кислотную (рН < 7), щелочную (рН > 7), нейтральную (рН = 7). Это объясняется тем, что соли в водных растворах могут подвергаться гидролизу.
Сущность гидролиза сводится к обменному химическому взаимодействию катионов или анионов соли с молекулами воды. В результате этого взаимодействия образуется малодиссоциирующее соединение (слабый электролит). А в водном растворе соли появляется избыток свободных ионов Н+ или ОН— , и раствор соли становится кислотным или щелочным соответственно.
Классификация солей
Любую соль можно представить как продукт взаимодействия основания с кислотой. Например, соль KClO образована сильным основанием KOH и слабой кислотой HClO.
В зависимости от силы основания и кислоты можно выделить четыре типа солей.
Рассмотрим поведение солей различных типов в растворе.
1. Соли, образованные сильным основанием и слабой кислотой.
Например, соль цианид калия KCN образована сильным основанием KOH и слабой кислотой HCN:
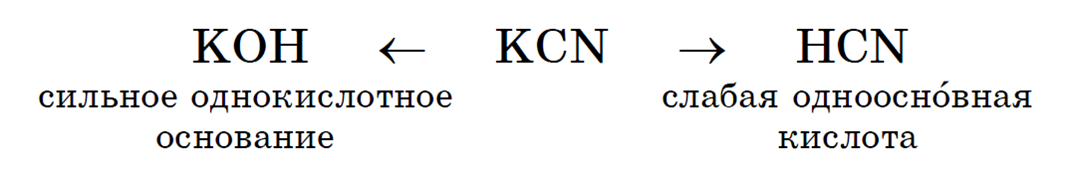
В водном растворе соли происходят два процесса:
1) незначительная обратимая диссоциация молекул воды (очень слабого амфотерного электролита), которую упрощенн
www.chem-mind.com
Как узнать-сильное или слабое основание,сильная или слабая кислота???
Все сильные основания -это гидроксиды металлов 1 группы, Ва Са. и магния Все остальные образуют слабые основания. С кислотами посложнее. Сильные-серная, азотная, хлорная, соляная, уксусная, остальные -слабые.
Сколько имеет энергитических уравней
Про индикаторы не забывайте
Все сильные основания -это гидроксиды металлов 1 группы, Ва Са. и магния Все остальные образуют слабые основания. С кислотами посложнее. Сильные-серная, азотная, хлорная, соляная, уксусная, остальные -слабые.
touch.otvet.mail.ru
