Задания 4. Валентности и степени окисления элементов.
Задание №1
EBA347
Степень окисления +2 во всех соединениях проявляет
1) олово
2) фосфор
3) железо
4) цинк
РешениеОтвет: 4
Пояснение:
Из всех предложенных вариантов степень окисления +2 в сложных соединениях проявляет только цинк, являясь элементом побочной подгруппы второй группы, где максимальная степень окисления равна номеру группы.
Олово – элемент главной подгруппы IV группы, металл, проявляет степени окисления 0 (в простом веществе), +2, +4 (номер группы).
Фосфор – элемент главной подгруппы главной группы, являясь неметаллом, проявляет степени окисления от -3 (номер группы – 8) до +5 (номер группы).
Железо – металл, элемент расположен в побочной подгруппе главной группы. Для железа характерны степени окисления: 0, +2, +3, +6.
Задание №2
F45DFA
Соединение состава KЭО4 образует каждый из двух элементов:
1) фосфор и хлор
2) фтор и марганец
3) хлор и марганец
4) кремний и бром
РешениеОтвет: 3
Пояснение:
Соль состава KЭО4 содержит кислотный остаток ЭО4—, где кислород обладает степенью окисления -2, следовательно, степень окисления элемента Э в этом кислотном остатке равна +7. Из предложенных вариантов подходят хлор и марганец – элементы главной и побочной подгруппы VII группы соответственно.
Фтор – также элемент главной подгруппы VII группы, однако, являясь самым электроотрицательным элементом, не проявляет положительных степеней окисления (0 и -1).
Бор, кремний и фосфор – элементы главных подгрупп 3, 4 и 5 групп соответственно, поэтому в солях проявляют соответствующие максимальные степени окисления +3, +4, +5.
Задание №3
BA7EFF
Одинаковую высшую степень окисления в соединениях проявляют
- 1. Zn и Cr
- 2. Si и B
- 3. Fe и Mn
- 4. P и As
Ответ: 4
Пояснение:
Одинаковую высшую степень окисления в соединениях, равную номеру группы (+5), проявляют P и As. Это элементы расположены в главной подгруппе V группы.
Zn и Cr – элементы побочных подгрупп II и VI групп соответственно. В соединениях цинк проявляет высшую степень окисления +2, хром — +6.
Fe и Mn – элементы побочных подгруппы VIII и VII групп соответственно. Высшая степень окисления у железа составляет +6, у марганца — +7.
Задание №4
DC98F9
Одинаковую высшую степень окисления в соединениях проявляют
- 1. Hg и Cr
- 2. Si и Al
- 3. F и Mn
- 4. P и N
Пояснение:
Одинаковую высшую степень окисления в соединениях, равную номеру группы (+5), проявляют P и N. Эти элементы расположены в главной подгруппе V группы.
Hg и Cr – элементы побочных подгрупп II и VI групп соответственно. В соединениях ртуть проявляет высшую степень окисления +2, хром – +6.
Si и Al − элементы главных подгруппы IV и III групп соответственно. Следовательно, для кремния максимальная степень окисления в сложных соединениях равна +4 (номер группы, где расположен кремний), для алюминия − +3 (номер группы, где расположен алюминия).
F и Mn – элементы главной и побочной подгрупп VII групп соответственно. Однако фтор, являясь самым электроотрицательным элементом Периодической системы химических элементов, не проявляет положительных степеней окисления: в сложных соединения его степень окисления равна −1 (номер группы−8). Высшая степень окисления марганца составляет +7.
Задание №5
C0E0FE
Степень окисления +3 азот проявляет в каждом из двух веществ:
- 1. HNO2 и NH3
- 2. NH4Cl и N2О3
- 3. NaNO2 и NF3
- 4. HNO3 и N2
Ответ: 3
Пояснение:
В азотистой кислоте HNO2 степень окисления кислорода в кислотном остатке равна -2, у водорода — +1, следовательно, чтобы молекула оставалась электронейтральной, степень окисления азота составляет +3. В аммиаке NH3 азот является более электроотрицательным элементом, поэтому он оттягивает на себя электронную пару ковалентной полярной связи и обладает отрицательной степенью окисления -3, степень окисления водорода в аммиаке составляет +1.
Хлорид аммония NH4Cl является аммонийной солью, поэтому степень окисления азота такая же, как в аммиаке, т.е. равна -3. В оксидах степень окисления кислорода всегда равна -2, поэтому у азота она составляет +3.
В нитрите натрия NaNO2 (соли азотистой кислоты) степень окисления азота такая же, как в азота в азотистой кислоте, т.к. составляет +3. Во фториде азота степень окисления азота +3, поскольку фтор является самым электроотрицательным элементом Периодической системы и в сложных соединениях проявляет отрицательную степень окисления -1. Данный вариант ответа удовлетворяет условию задания.
В азотной кислоте азот обладает высшей степенью окисления, равной номеру группы (+5). Азот как простое соединение (поскольку состоит из атомов одного химического элемента) обладает степенью окисления 0.
Задание №6
EDD5FF
Высшему оксиду элемента VI группы соответствует формула
- 1. Э4O6
- 2. ЭO4
- 3. ЭO2
- 4. ЭО3
Ответ: 4
Пояснение:
Высшим оксидом элемента является оксид элемента с его максимальной степени окисления. В группе наивысшая степень окисления элемента равна номеру группы, следовательно, в VI группе максимальная степень окисления элемента равна +6. В оксидах кислород проявляет степень окисления -2. Цифры, стоящие под символом элемента, называются индексами и указывает на количество атомов этого элемента в молекуле.
Первый вариант является неверным, т.к. элемент обладает степенью окисления 0-(-2)⋅6/4 = +3.
Во втором варианте элемент обладает степенью окисления 0-(-2) ⋅ 4 = +8.
В третьем варианте степень окисления элемента Э: 0-(-2) ⋅ 2 = +4.
В четвертом варианте степень окисления элемента Э: 0-(-2) ⋅ 3 = +6, т.е. это искомый ответ.
Задание №7
EFF6F9
Степень окисления хрома в дихромате аммония (NH4)2Cr2O7 равна
РешениеОтвет: 1
Пояснение:
В бихромате аммония (NH4)2Cr2O7 в катионе аммония NH4+ азот как более электроотрицательный элемент обладает низшей степенью окисления -3, водород заряжен положительно +1. Следовательно, весь катион обладает зарядом +1, но, поскольку этих катионов 2, то общий заряд составляет +2.
Для того чтобы молекула оставалась электронейтральной, у кислотного остатка Cr2O72− заряд должен быть -2. Кислород в кислотных остатках кислот и солей всегда обладает зарядом -2, поэтому 7 атомов кислорода, входящих в состав молекулы бихромата аммония, заряжены -14. Атомов хрома Cr в молекулы 2, следовательно, если заряд хрома обозначить за x, то имеем:
2x + 7 ⋅ (-2) = -2, где x = +6. Заряд хрома в молекуле бихромата аммония равен +6.
Задание №8
3FC0F3
Степень окисления +5 возможна для каждого из двух элементов:
1) кислорода и фосфора
2) углерода и брома
3) хлора и фосфора
4) серы и кремния
РешениеОтвет: 3
Пояснение:
В первом предложенном варианте ответов только фосфор как элемент главной подгруппы V группы может проявлять степень окисления +5, которая является для него максимальной. Кислород (элемент главной подгруппы VI группы), являясь элементом с высокой электроотрицательностью, в оксидах проявляет степень окисления -2, как простое вещество – 0 и в соединении со фтором OF2 – +1. Степень окисления +5 для него не характерна.
Углерод и бром – элементы главных подгрупп IV и VII групп соответственно. Для углерода характерна максимальная степень окисления +4 (равна номеру группы), а бром проявляет степени окисления -1, 0 (в простом соединении Br2), +1, +3, +5 и +7.
Хлор и фосфор – элементы главных подгрупп VII и V групп соответственно. Фосфор проявляется максимальную степень окисления +5 (равную номеру группы), для хлора аналогично брому характерны степени окисления -1, 0 (в простом соединении Cl2), +1, +3, +5, +7.
Сера и кремний – элементы главных подгрупп VI и IV групп соответственно. Сера проявляет широкий спектр степеней окисления от -2 (номер группы − 8) до +6 (номер группы). Для кремния максимальная степень окисления равна +4 (номер группы).
Задание №9
44E50C
Высшую степень окисления азот проявляет в соединении, формула которого
- 1. NaNO3
- 2. NaNO2
- 3. NH4Cl
- 4. NO
Ответ: 1
Пояснение:
Азот – элемент главной подгруппы V группы, следовательно, он может проявлять максимальную степень окисления, равную номеру группы, т.е. +5.
В нитрате натрия NaNO3 натрий имеет степень окисления +1 (элемент I группы), атомов кислорода в кислотном остатке 3, каждый из которых имеет степень окисления −2, следовательно, чтобы молекула оставалась электронейтральной, азот должен иметь степень окисления: 0 − (+1) − (−2)·3 = +5.
В нитрите натрия NaNO2 атом натрий также имеет степень окисления +1 (элемент I группы), атомов кислорода в кислотном остатке 2, каждый из которых имеет степень окисления −2, следовательно, чтобы молекула оставалась электронейтральной, азот должен обладать степенью окисления: 0 − (+1) − (−2)·2 = +3.
NH4Cl − хлорид аммония. В хлоридах атомы хлора имеют степень окисления −1, атомы водорода, которого в молекуле 4, заряжен положительно, следовательно, чтобы молекула оставалась электронейтральной, степень окисления азота: 0 − (−1) − 4 ·(+1) = −3. В аммиаке и катионах аммонийных солей азот имеет минимальную степень окисления −3 (номер группы, в которой расположен элемент, − 8).
В молекуле оксида азота NO кислород проявляет минимальную степень окисления −2, как во всех оксидах, следовательно, степень окисления азота равна +2.
Задание №10
0EB205
Высшую степень окисления азот проявляет в соединении, формула которого
- 1. Fe(NO3)3
- 2. NaNO2
- 3. (NH4)2SO4
- 4. NO2
Ответ: 1
Пояснение:
Азот – элемент главной подгруппы V группы, следовательно, он может проявлять максимальную степень окисления, равную номеру группы, т.е. +5.
Одна структурная единица нитрата железа Fe(NO3)3 состоит из одного иона Fe3+ и трех нитрат-ионов. В нитрат-ионах атомы азота независимо от типа противоиона имеют степень окисления +5.
В нитрите натрия NaNO2 натрий имеет степень окисления +1 (элемент главной подгруппы I группы), атомов кислорода в кислотном остатке 2, каждый из которых имеет степень окисления −2, следовательно, чтобы молекула оставалась электронейтральной, азот должен обладать степенью окисления 0 − (+1) − (−2)⋅2 = +3.
(NH4)2SO4 – сульфат аммония. В солях серной кислоты анион SO42− имеет заряд 2−, следовательно, каждый катион аммония заряжен 1+. На водороде заряд +1, поэтому на азоте −3 (азот более электроотрицателен, поэтому оттягивает на себя общую электронную пару связи N−H). В аммиаке и катионах аммонийных солей азот имеет минимальную степень окисления −3 (номер группы, в которой расположен элемент, − 8).
В молекуле оксида азота NO2 кислород проявляет минимальную степень окисления −2, как во всех оксидах, следовательно, степень окисления азота равна +4.
Задание №11
28910EВ соединениях состава Fe(NO3)3 и CF4 степень окисления азота и углерода равна соответственно
1) +3 и –2
2) +3 и +4
3) –3 и –4
4) +5 и +4
РешениеОтвет: 4
Пояснение:
Одна структурная единица нитрата железа (III) Fe(NO3)3 состоит из одного иона железа Fe3+ и трех нитрат-ионов NO3−. В нитрат-ионах азот всегда имеет степень окисления +5.
Во фториде углерода CF4 фтор является более электроотрицательным элементом и оттягивает на себя общую электронную пару связи C-F, проявляя степень окисления -1. Следовательно, углерод C имеет степень окисления +4.
Задание №12
A32B0BСтепень окисления +7 хлор проявляет в каждом из двух соединений:
- 1. Ca(OCl)2 и Cl2O7
- 2. KClO3 и ClO2
- 3. BaCl2 и HClO4
- 4. Mg(ClO4)2 и Cl2O7
Ответ: 4
Пояснение:
В первом варианте атомы хлора обладают степенями окисления +1 и +7 соответственно. Одна структурная единица гипохлорита кальция Ca(OCl)2 состоит из одного иона кальция Ca2+ (Ca — элемент главной подгруппы II группы) и двух гипохлорит-ионов OCl−, каждый из которых имеет заряд 1−. В сложных соединениях, кроме OF2 и различных перекисей, кислород всегда имеет степень окисления −2, поэтому, очевидно, что хлор имеет заряд +1. В оксиде хлора Cl2O7, как и во всех оксидах, кислород обладает степенью окисления −2, следовательно, на хлор в этом соединении имеет степень окисления +7.
В хлорате калия KClO3 атом калия имеет степень окисления +1, а кислород — −2. Для того чтобы молекула оставалась электронейтральной, хлор должен проявлять степень окисления +5. В оксиде хлора ClO2 кислород, как и в любом другом оксиде, обладает степенью окисления −2, следовательно, для хлора его степень окисления равна +4.
В третьем варианте катион бария в сложном соединении заряжен +2, следовательно, на каждом анионе хлора в соли BaCl2 сосредоточен отрицательный заряд −1. В хлорной кислоте HClO4 общий заряд 4 атомов кислорода составляет −2⋅4 = −8, на катионе водорода заряд +1. Чтобы молекула оставалась электронейтральной, заряд хлора должен составлять +7.
В четвертом варианте в молекуле перхлората магния Mg(ClO4)2 заряд магния +2 (во всех сложных соединениях магний проявляет степень окисления +2), поэтому на каждый анион ClO4−приходится заряд 1−. В общем 4 иона кислорода, где каждый проявляет степень окисления −2, заряжены −8. Следовательно, чтобы общий заряд аниона составлял 1−, на хлоре должен быть заряд +7. В оксиде хлора Cl2O7, как было объяснено выше, заряд хлора составляет +7.
scienceforyou.ru
Электроотрицательность. Степень окисления и валентность химических элементов. » HimEge.ru
Электроотрицательность. Степень окисления и валентность химических элементов.
Реакции окислительно-восстановительные.
1) Установите соответствие между схемой изменения степени окисления элемента и уравнением реакции, в которой это изменение происходит.
| ИЗМЕНЕНИЕ СО ЭЛЕМЕНТА | СХЕМА РЕАКЦИИ |
| А) S-2 → S+6 Б) S-2 → S+4 В) S+6→ S+4 Г) S+6→ S-2 | 1) 2H2SO4(конц) + C = 2H2O + CO2 + 2SO2 2) 2H2S + 3O2 = 2SO2 + 2H2O 3) 5H2SO4(конц) +4Zn = 4ZnSO4 + H2 4) H2S + 2NaOH = Na2S + 2H2O 5) PbS + 4H2O2 = PbSO4 +4H2O |
2) Установите соответствие между формулой вещества и степенью окисления азота в нем.
| ФОРМУЛА ВЕЩЕСТВА А) NOF Б) (CH3)2NH В) NH4Br Г) N2H4 | СТЕПЕНЬ ОКИСЛЕНИЯ АЗОТА 1) -3 2) -2 3) +2 4) +3 5) +4 6) +5 |
3) Установите соответствие между уравнением окислительно-восстановительной реакции и свойством азота, которое он проявляет в этой реакции.
| УРАВНЕНИЕ РЕАКЦИИ А) 2NO + O2 = 2 NO2 Б) 3CuO + 2NH 3 = N2+ 3Cu + 3H2O В) 4NH3 + 5O2 = 4NO + 6H2O Г) 6Li + N2 → 2Li3N | СВОЙСТВО АЗОТА |
| 1) окислитель 2) восстановитель 3) и окислитель, и восстановитель 4) не проявляет окислительно-восстановительных св-в |
4) Установите соответствие между формулой вещества и степенью окисления хлора в нем.
| ФОРМУЛА ВЕЩЕСТВА А) Сa(OCl)2 В) КClO3 В) НClO2 Г) FeCl3 | СТЕПЕНЬ ОКИСЛЕНИЯ ХЛОРА 1) +1 2) +2 3) +3 4) +5 5) -1 |
5) Установите соответствие между уравнением реакции и изменением степени окисления окислителя.
| СХЕМА РЕАКЦИИ А) SO2+ NO2 → SO3 + NO В) 2NH3 + 2Na → 2NaNH2 + H2 В) 4NO + O2 + 2H2O → 4HNO3 Г) 4NH3 + 6NO → 5N2 + 6H2O | ИЗМЕНЕНИЕ СО ОКИСЛИТЕЛЯ | |
| 1) –1 → 0 2) 0 → —2 3) +4 → +2 4) +1 → 0 5) +2 → 0 6) 0 → -1 | ||
6) Установите соответствие между свойствами азота и уравнением окислительно-восстановительной реакции, в которой он проявляет в эти свойства.
| СВОЙСТВО АЗОТА А) только окислитель Б) только восстановитель В) и окислитель, и восстановитель Г) ни окислитель, ни восстановитель | УРАВНЕНИЕ РЕАКЦИИ |
| 1) 4NH3 + 5O2 = 4NO + 6H2O 2) 6Li + N2 → 2Li3N 3) 2NH4Cl + Ca(OH)2 = 2NH3 + CaCl2 + 2H2O 4) 3NO2 + H2O = 2HNO3 + NO |
7) Установите соответствие между формулой вещества и степенью окисления азота в нем.
| ФОРМУЛА ВЕЩЕСТВА А) NaNO2 Б) NH4NO3 В) NH4NO2 Г) HNO3 | СТЕПЕНЬ ОКИСЛЕНИЯ АЗОТА 1) +5 2) +3 3) –3, +5 4) 0, +2 5) –3, +3 6) +4, +2 |
8) Установите соответствие между схемой реакции и изменением степени окисления окислителя в ней.
| СХЕМА РЕАКЦИИ А) Cu + HNO3(конц) → Сu(NO3)2 + NO2 + H2O Б) NH4NO2 → N2 + H2O В) CuO + NH3 → Cu + N2 + H2O Г) NaNO3 → NaNO2 + O2 | ИЗМЕНЕНИЕ СО ОКИСЛИТЕЛЯ | |
| 1) Cu+2 → Cu0 2) N+3 →N0 3) N+5 → N+4 4) N—3 → N0 5) Cu0 → Cu+2 6) N+5 → N+3 | ||
9) Установите соответствие между формулой соли и степенью окисления углерода в ней.
| ФОРМУЛА СОЛИ А) K2CO3 Б) Ca(HCO 3)2 В) HCOONa Г) NaHC2O4 | СТЕПЕНЬ ОКИСЛЕНИЯ УГЛЕРОДА 1) -4 2) -2 3) 0 4) +2 5) +3 6) +4 |
10. Установите соответствие между формулой соли и степенью окисления хрома в ней.
| ФОРМУЛА СОЛИ А) K2CrO4 Б) CaCr2O7 В) CrO2F2 Г) Ba3[Cr(OH)6]2 | СТЕПЕНЬ ОКИСЛЕНИЯ ХРОМА 1) 0 5) +5 2) +2 6) +6 3) +3 4) +4 |
11. Установите соответствие между схемой реакции и формулой окислителя в ней
| СХЕМА РЕАКЦИИ А) K2CO3 + Br2 Б) Br2 + Cl2 → BrCl В) Br2 + I2 → IBr Г) HBr + HBrO3 → Br2 + H2O | ФОРМУЛА ОКИСЛИТЕЛЯ | |
| 1) K2CO3 2) Br2 3) Cl2 4) I2 5) HBr 6) HBrO3 | ||
12. Установите соответствие между схемой реакции и формулой восстановителя в ней
| СХЕМА РЕАКЦИИ А) K2CO3 + Br2 → KBr + KBrO3 + CO2 Б) Br2 + Cl2 → BrCl В) Br2 + I2 → IBr Г) HBr + HBrO3 → Br2 + H2O | ФОРМУЛА ВОССТАНОВИТЕЛЯ | |
| 1) K2CO3 2) Br2 3) Cl2 4) I2 5) HBr 6) HBrO3 | ||
13. Установите соответствие между схемой реакции и формулой окислителя в ней
| СХЕМА РЕАКЦИИ А) NaOH + Br2 → NaBr + NaOBr + H2O Б) Br2 + O3 → BrO2 + O2 В) Cl2 + I2 → ICl Г) HCl+ HClO3 → Cl2 + H2O | ФОРМУЛА ОКИСЛИТЕЛЯ | |
| 1) NaOH 2) Br2 3) Cl2 4) I2 5) HClO3 6) O3 | ||
14. Установите соответствие между формулой вещества и степенью окисления азота в нем.
| ФОРМУЛА ВЕЩЕСТВА А) (NH4)2HPO4 Б) NO2F В) NOCl Г) BaN2O2 | СТЕПЕНЬ ОКИСЛЕНИЯ АЗОТА 1) -3 2) -2 3) -1 4) +1 5) +3 6) +5 |
15. Установите соответствие между формулой вещества и степенью окисления серы в нем.
| ФОРМУЛА ВЕЩЕСТВА А) K2S2O7 Б) NaHSO3 В) SO2Cl2 Г) S2O | СТЕПЕНЬ ОКИСЛЕНИЯ СЕРЫ 1) -2 5) +5 2) -1 6) +6 3) +1 4) +4 |
16. Установите соответствие между формулой соли и степенью окисления хрома в ней.
| ФОРМУЛА СОЛИ А) KCrO3Сl Б) Na2Cr2O7 В) CrOF Г) Na3[Cr(OH)6] | СТЕПЕНЬ ОКИСЛЕНИЯ ХРОМА 1) 0 5) +5 2) +2 6) +6 3) +3 4) +4 |
17. Установите соответствие между схемой реакции и формулой окислителя в ней
| СХЕМА РЕАКЦИИ А) SO2 + O2 → SO3 Б) SO2 + H2S→ S + H2O В) SO2 + Cl2 → SO2Cl2 Г) K2SO3 → K2S + K2SO4 | ФОРМУЛА ОКИСЛИТЕЛЯ | |
| 1) O 2) SO2 3) H2S 4) K2SO3 | 5) Cl2 | |
18. Установите соответствие между схемой реакции и формулой восстановителя в ней
| СХЕМА РЕАКЦИИ А) Ca+ H2 → CaH2 Б) NH3 +Ca → Ca(NH2)2 + H2 В) N2 + H2 → NH3 Г) NH3 + Cl2 → NH4Cl + N2 | ФОРМУЛА ВОССТАНОВИТЕЛЯ | |
| 1) кальций 2) водород 3) аммиак 4) азот | 5) хлор | |
19. Установите соответствие между схемой реакции и изменением степени окисления восстановителя.
| СХЕМА РЕАКЦИИ А) Cl2 + P → PCl5 Б) HCl+ KMnO4 → Cl2 + MnCl2 + KCl + H2O В) HClO + H2O2 → O2 + H2O + HCl Г) Cl2 + KOH → KCl + KClO3 + H2O | ИЗМЕНЕНИЕ СО ВОССТАНОВИТЕЛЯ | |
| 1) Cl0 → Cl-1 2) Cl-1 →Cl0 3) Cl0 → Cl+1 4) O-1 → O0 | 5) Cl0 → Cl+5 6) Mn+7 → Mn+2 7) P0 → P+5 | |
20. Установите соответствие между схемой реакции и изменением степени окисления окислителя.
| СХЕМА РЕАКЦИИ А) Na2SO3 + I2 +NaOH → Na2SO4 + NaI + H2O Б) I2 + H2S → S + HI В) SO2 + NaIO3 + H2O → H2SO4 + NaI Г) H2S + SO2 → S + H2O | ИЗМЕНЕНИЕ СО ОКИСЛИТЕЛЯ | |
| 1) S-2 → S0 2) S+4 →S0 3) S+4→ S+6 4) S0 → S-2 | 5) I+5 → I-1 6) I-1 → I0 7) I0 → I-1 | |
21. Установите соответствие между схемой реакции и изменением степени окисления восстановителя.
| СХЕМА РЕАКЦИИ А) HI + Cl2 → HCl + I2 Б) Na2SO3 + I2 + NaOH → Na2SO4 + NaI + H2O В) HIO → HIO3 + I2 + H2O Г) KIO3 + H2O2 → O2 + H2O + KI | ИЗМЕНЕНИЕ СО ВОССТАНОВИТЕЛЯ | |
| 1) I+5 → I-1 2) I-1 → I0 3) I+1 → I0 4) I+1 → I+5 | 5) I0 → I+5 6) O-1 → O0 7) S+4 → S+6 8) Cl+5 → Cl0 | |
22. Установите соответствие между формулой вещества и степенью окисления хлора в нем.
| ФОРМУЛА ВЕЩЕСТВА А) Ba(ClO3)2 Б) LiClO4 В) Ca(ClO)2 Г) Cl2O | СТЕПЕНЬ ОКИСЛЕНИЯ ХЛОРА 1) -1 5) +5 2) 0 6) +7 3) +1 4) +3 |
23. Установите соответствие между формулой вещества и степенью окисления хрома в нем.
| ФОРМУЛА ВЕЩЕСТВА А) Cr(NO3)3 Б) [Cr(NH3)6]Cl3 В) Cr(OH)2 Г) (NH4)2Cr2O7 | СТЕПЕНЬ ОКИСЛЕНИЯ ХРОМА 1) +2 5) +7 2) +3 3) +4 4) +6 |
24. Установите соответствие между формулой вещества и степенью окисления азота в нем.
| ФОРМУЛА ВЕЩЕСТВА А) NaNO3 Б) N2H4 В) NO2 Г) NH4Cl | СТЕПЕНЬ ОКИСЛЕНИЯ АЗОТА 1) -3 5) +3 2) -2 6) +4 3) -1 7) +5 4) +2 |
25. Установите соответствие между схемой реакции и изменением степени окисления восстановителя.
| СХЕМА РЕАКЦИИ А) PCl3 + O2 → POCl3 Б) Ca3(PO4)2 + C + SiO2 → P4 + CaSIO3 + CO В) P4+ H2SO4 +KMnO4 → KH2PO4 + MnSO4 Г) P4 + AgNO3 + H2O → Ag + H3PO4 + HNO3 | ИЗМЕНЕНИЕ СО ВОССТАНОВИТЕЛЯ | |
| 1) P0 → P+5 2) P+5 →P0 3) P+3 → P+5 4) Ag+1 → Ag0 | 5) C0 → C+2 6) Cu0 → Cu+1 7) Cl0 → Cl-1 | |
26. Установите соответствие между формулой вещества и коэффициентом перед ней в уравнении реакции: HIO → HIO3 + I2 + H2O
| ФОРМУЛА ВЕЩЕСТВА А) HIO Б) HIO3 В) I2 Г) H2O | КОЭФФИЦИЕНТ 1) 1 5) 5 2) 2 6) 6 3) 3 4) 4 |
27. Установите соответствие между схемой реакции и изменением степени окисления окислителя.
| СХЕМА РЕАКЦИИ А) HNO3 + S → H2SO4 + NO2 + H2O Б) KNO2 + Br2 + H2O → KNO3 + HBr В) NH4NO2 → H2O + N2 Г) NO2 + H5IO6 → HNO3 + HIO3 + H2O | ИЗМЕНЕНИЕ СО ОКИСЛИТЕЛЯ | |
| 1) N+3 → N0 2) N+3 →N+5 3) I+7→ I+5 4) N+4 → N+5 | 5) O-2 → O0 6) Br0 → Br-1 7) N+5 → N+4 | |
28. Установите соответствие между формулой вещества и коэффициентом перед ней в уравнении реакции: HNO3 + S → H2SO4 + NO2 + H2O
| ФОРМУЛА ВЕЩЕСТВА А) HNO3 Б) S В) H2SO4 Г) NO2 | КОЭФФИЦИЕНТ 1) 1 5) 5 2) 2 6) 6 3) 3 7) 7 4) 4 8) 8 |
himege.ru
Валентность (химия) — Valence (chemistry)
В химии , то валентность или валентность из элемента является мерой его объединяющей силы с другими атомами , когда она образует химические соединения или молекулу . Понятие валентности разработано во второй половине 19 — го века и помог успешно объяснить молекулярную структуру неорганических и органических соединений. Поиски основных причин валентности привели к современной теории химической связи, в том числе кубического атома (1902), структуры Льюиса (1916), теория валентных связей (1927), молекулярные орбитали (1928), валентная оболочка электроны теория пары отталкивания (1958), и все современные методы квантовой химии .
Описание
Сочетание мощности, или сродство атома данного элемента определяется числом атомов водорода , что она сочетает в себе с. В метан , углерод имеет валентность 4; в аммиак , азот имеет валентность 3; в воде, кислород имеет валентность 2; и хлористый водород, хлор имеет валентность 1. хлора, так как она имеет валентность одного, может быть замещен водородом, так что фосфор имеет валентность 5 в пентахлориде фосфора , PCl 5 . Валентные схемы соединения представляют собой соединения элементов, с линиями , проходящими между двумя элементами, которые иногда называют облигации, представляющие собой насыщенную валентность для каждого элемента. Два приведенных ниже таблицах показаны некоторые примеры различных соединений, их валентные диаграммы и валентности для каждого элемента соединения.
Валентность описывает только соединение; она не описывает геометрию молекулярных соединений, или то , что в настоящее время известно, что ионные соединения или гигантские ковалентные структуры . Линия между атомами не представляет собой пару электронов , как это происходит в диаграммах Льюиса .
Современные определения
Валентность определяется ИЮПАК , как:
- Максимальное число одновалентных атомов (первоначально атомы водорода или хлора), которые могут быть объединены с атомом рассматриваемого элемента, или с фрагментом, или для которых атом этого элемента может быть замещено.
Альтернативой современное описание:
- Число атомов водорода, которые можно комбинировать с элементом в виде двоичного гидрида или удвоенным числом атомов кислорода, сочетающих с элементом в его оксида или оксидов.
Это определение отличается от определения ИЮПАК, как элемент, можно сказать, чтобы иметь более чем одну валентность.
Историческое развитие
Этимологии из слов валентности (множественное число валентностей ) и валентности (множественное число валентностей ) восходит к 1425 году , что означает «экстракт, препарат», от латинского Валентии «сила, способность», от ранее доблесть «стоит, значение», так и химические вещества это означает , со ссылкой на «сочетающую силу элемента» записываются с 1884 г., из немецкого Valenz .
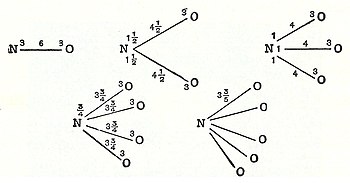
В 1789 году Уильям Хиггинс опубликовал взгляды на то , что он назвал сочетания «последних» частиц, которые предвещали понятие валентных связей . Если, например, в соответствии с Higgins, сила , действующими между конечной частицей кислорода и конечной частицей азота было 6, то сила силы будет разделено соответствующим образом , и также для других комбинаций конечных частиц (смотрите рисунок) ,
Точную момента создания, однако, теория химических валентностей , может быть прослежена к 1852 статье Эдварда Франкленд , в котором он объединил старые теории свободных радикалов с мыслями о химическом сродстве , чтобы показать , что некоторые элементы имеют тенденцию сочетать с другими элементы с образованием соединений , содержащих 3, то есть в группах 3-атома (например, NO 3 , NH 3 , NI 3 и т.д.) , или 5, то есть, в группах по 5-атома (например, NO 5 , NH 4 O , PO 5 , и т.д.), эквиваленты присоединенных элементов. По его словам, это способ, которым их сродство лучше всего удовлетворено, и следующие примеры и постулаты, он заявляет о том , как это и очевидно , что
| « | Тенденция или закон превалирует (здесь), и что, независимо от того , какими могут быть персонажи атомов объединяющих, то комбинируя мощность притягивающего элемента, если мне будет позволено термин, всегда выполняется одним и тем же числом этих атомов , | » |
Это «комбинируя власть» впоследствии называли quantivalence или валентность (и валентность американскими химиками). В 1857 году Кекула предложила фиксированные валентности для многих элементов, такие как 4 для углерода, и использовала их , чтобы предложить структурные формулы для многих органических молекул, которые все еще приняты сегодня.
Большинство химиков 19-го века определяется валентность элемента , так как количество его облигаций без выделения различных типов валентности или связи. Тем не менее, в 1893 году Альфред Вернер описал переходные металлы координационных комплексы , такие как [Co (NH 3 ) 6 ] Cl 3 , в котором он выделил основные и вспомогательные валентности (немецкие: «Hauptvalenz» и «Nebenvalenz»), что соответствует современным концепциям степень окисления и координационное число соответственно.
Для главных групп элементов , в 1904 году Абегг считается положительные и отрицательные валентности (состояний максимальное и минимальное окисление), и предложил правило ABEGG в о том , что их разность часто 8.
Электроны и валентность
Модель Резерфорда ядерного атома (1911) показала , что внешний вид атома занимают электроны , что свидетельствует , что электроны ответственны за взаимодействие атомов и образование химических связей. В 1916 годе Гилберт Н. Льюис объяснена валентность и химическая связь с точкой зрения тенденции (главной группа) атомы , чтобы достичь стабильного октета 8 электронов валентной оболочки. По словам Льюиса, ковалентная связь приводит к октетов путем обмена электронов и ионной связи приводит к октетов путем переноса электронов от одного атома к другому. Термин ковалентность приписывается Irving Ленгмюра , который утверждал в 1919 , что «число пар электронов , которые любой данный атом акций с соседними атомами называется ковалентность этого атома». Префикс CO- означает «вместе», так что со-валентная связь означает , что атомы разделяют валентность. После этого, он теперь чаще говорить о ковалентных связей , а не валентности , упавшей из использования в работе более высокого уровня из достижений в теории химической связи, но она до сих пор широко используется в начальных исследованиях, где она обеспечивает эвристическое введение в предмет.
В 1930 — е годы, Полинг предложил , что существуют также полярные ковалентные связи , которые являются промежуточными между ковалентной и ионной, и что степень ионности зависит от разности электроотрицательности двух связанных атомов.
Полинг также считаются гипервалентных молекулы , в которых главной группы элементов имеют очевидные валентности больше , чем максимальный из 4 разрешенных по правилу октета. Например, в гексафторида серы молекулы (SF 6 ), Полинг считал , что сера образует 6 истинные двухэлектронные связи с использованием SP 3 D 2 гибридные атомные орбитали , которые сочетают в себе один с, три р и два d — орбитали. Однако в последнее время , квантово-механические расчеты на этом и подобных молекул показали , что роль -орбиталей в связи минимальна, и что SF 6 молекула должна быть описан как имеющий 6 полярную ковалентную (частично ионные) связи сделаны из только четыре орбитали на серу (S один и три р) в соответствии с правилом октета, вместе с шестью орбиталей на атомами фтора. Аналогичные расчеты на молекулах переходных металлов показывают , что роль р — орбиталей является незначительным, так что один и пять лет г орбитали на металле достаточно , чтобы описать связывание.
Общие валентности
Для элементов в основных группах в периодической таблице , валентность может варьироваться от 1 до 7.
Многие элементы имеют общую валентность , связанную с их положением в периодической таблице, и в настоящее время это рационализировать по правилу октета . Греческие / латинские числовые префиксы (моно- / одно-, ди- / би-, три- / тер-, и так далее) используются для описания ионов в зарядовых состояниях 1, 2, 3 и так далее, соответственно. Поливалентность или многозначность относится к видам , которые не ограничено конкретным числом валентных связей . Виды с одного заряда однолистны (моновалентная). Например, Cs + катион представляет собой одновалентный или одновалентный катион, в то время как Са 2+ катион представляет собой двухвалентный катион, и Fe 3+ катион представляет собой трехвалентный катион. В отличии от Cs и Са, Fe может также существовать в других зарядовых состояниях, в частности , 2+ и 4+, и, таким образом , известен как поливалентный (поливалентный ион). Переходные металлы и металлы справа , как правило , многовалентные но не простой шаблона прогнозирование их валентности.
† Те же прилагательные также используется в медицине для обозначения вакцины валентности, с небольшой разницей , что в последнем смысле четырехугольник является более распространенным , чем тетра- .
‡ Как показали хит подсчетов в Google веб-поиска и Google Книги поиска корпусов (доступ 2017).
§ Несколько других форм можно найти в большом английском языке корпусах (например, * quintavalent, * quintivalent, * decivalent ), но они не являются традиционно сложившимися формами на английском языке и , таким образом , не вводятся в основных словарях.
Валентность по сравнению со степенью окисления
Из-за неопределенности термина валентности, в настоящее время предпочтительными другие обозначения. Помимо системы окислительных чисел в качестве используемой в фондовой номенклатуре для координационных соединений , и лямбды — нотации, как он используется в IUPAC номенклатуре неорганической химии , степень окисления является более четким указанием электронного состояния атомов в молекуле.
Окисления состояние атома в молекуле дает число валентных электронов он получил или потерял. В отличии от числа валентности, степень окисления может быть положительной (для электроположительного атома) или отрицательной (для электроотрицательного атома).
Элементы в состоянии высокой степени окисления могут иметь валентность выше , чем четыре. Например, в перхлоратах , хлор имеет семь валентных связей и рутений , в состоянии окисления +8 в рутении , имеет восемь валентных связей.
Примеры
* Об однолистный перхлорат ион (ClO 4 — ) имеет валентность 1.
** Оксид железа появляется в кристаллической структуре , так что нет типичной молекулы не может быть идентифицирована.
В закиси железа, Fe имеет ряд окисления II, в окиси железа, окисление число III.
| Соединение | формула | Валентность | состояние Окисление |
|---|---|---|---|
| хлор | Cl 2 | Cl = 1 | Cl = 0 |
| Пероксид водорода | Н 2 О 2 | Н = 1 О = 2 | Н = +1, -1 = О |
| Ацетилен | С 2 Н 2 | С = 4 Н = 1 | С = -1 Н = +1 |
| Ртуть (I), хлорид | Hg 2 Cl 2 | Hg = Cl 2 = 1 | Hg = Cl + 1 = -1 |
Валентности могут также отличаться от абсолютных значений состояний окисления из — за различную полярность связей. Так , например, в дихлорметане , СН 2 Cl 2 , углерод имеет валентность 4 , но состояние окисления 0.
определение «Максимальное число связей»
Франкленд высказал мнение , что валентность (он использовал термин «атомарность») элемента было одно значение , что соответствует максимальному значению наблюдаемого. Количество неиспользованных валентностей на атомах того , что теперь называют р-блочные элементы , как правило , даже и Франкленд предположил , что неиспользованные валентности насыщенный друг друга. Так , например, азот имеет максимальную валентность 5, при формировании аммиака две валентности влево неприсоединённой; серы имеют максимальную валентность 6, в формировании сероводорода четыре валентности левой фракции.
Международный союз теоретической и прикладной химии (ИЮПАК) сделал несколько попыток , чтобы прийти к однозначному определению валентности. Текущая версия, принятая в 1994 году:
- Максимальное число одновалентных атомов (первоначально атомы водорода или хлора), которые могут быть объединены с атомом рассматриваемого элемента, или с фрагментом, или для которых атом этого элемента может быть замещено.
Водород и хлора первоначально были использованы в качестве примеров одновалентных атомов, из — за своей природы , чтобы образовать только одну простую связь. Водород имеет только один валентный электрон и может образовать только одну связь с атомом , который имеет неполную внешнюю оболочку . Хлор имеет семь валентных электронов и может образовать только одну связь с атомом , который жертвует валентный электрон , чтобы завершить внешнюю оболочку хлора в. Тем не менее, хлор может также иметь степень окисления от +1 до +7 и могут образовывать более чем одну связь, пожертвовав валентных электронов .
Водород имеет только один валентный электрон, но могут образовывать связи с более чем одним атомом. В бифторида иона ( [HF
2 ] —
), Например, он образует три-четыре центра-электронов связи с двумя атомами фтора:
- [F-HF — ↔ F — ВЧ]
Другим примером является трехцентровой двухэлектронная связью в диборан (В 2 Н 6 ).
Максимальные валентности элементов
Максимальные валентности для элементов основаны на данных из списка окислительных состояний элементов .
Смотрите также
Рекомендации
ru.qwertyu.wiki
Проверочная работа «Валентность»
Проверочная работа
Вариант 1
1. Запишите формулы химических формул следующих соединений:
а) аш-два-эс-о -три
б) пэ-два-о-пять
в) магний-хлор-два
г) купрум-фтор-два
2. Выпишите формулы сложных веществ:
SiO2, PH3, N2, MgO, Fe, Cu2O, P4, Mn2O7
3. Определите валентность элементов в соединениях:
CaH2, I2O5, MnO2, N2O, BaO
4. Составьте химические формулы соединений:
а) цинк и бром (I)
б) железо (III) и кислород
в) кремний (IV) и водород
г) сера (VI) и кислород
5. Рассчитайте массу атома серы, если его относительная атомная масса равна 32.
Вариант 2
1. Запишите формулы химических формул следующих соединений:
а) аш-три-пэ-о-четыре
б) эн-два-о-три
в) кальций-бром-два
г) барий-йод-два
2. Выпишите формулы сложных веществ:
CaH2, Cu, I2O5, H2, MnO2, N2O, O3, BaO
3. Определите валентность элементов в соединениях:
SiO2, PH3, MgO, Cu2O, Mn2O7
4. Составьте химические формулы соединений:
а) магний и хлор (I)
б) углерод (IV) и водород
в) алюминий и кислород
г) сера (IV) и кислород
5. Рассчитайте массу атома натрия, если его относительная атомная масса равна 23.
Проверочная работа
Вариант 3
1. Запишите формулы химических формул следующих соединений:
а) аш-два-эс-о -четыре
б) пэ-два-о-три
в) алюминий-хлор-три
г) барий-фтор-два
2. Выпишите формулы простых веществ:
SiO2, PH3, MgO, Cu2O, Mn2O7
3. Определите валентность элементов в соединениях:
SO2, CH4, FeO, K2O, Br2O7
4. Составьте химические формулы соединений:
а) кальций и бром (I)
б) сера (VI) и кислород
в) азот (III) и водород
г) цинк и кислород
5. Рассчитайте массу атома калия, если его относительная атомная масса равна 39.
Вариант 4
1.Запишите формулы химических формул следующих соединений:
а) аш-эн-о-три
б) алюминий-два-о-три
в) феррум-бром-два
г) купрум-йод-два
2. Выпишите формулы простых веществ:
CaH2, Cu, I2O5, H2, MnO2, N2O, O3, BaO
3. Определите валентность элементов в соединениях:
SO3, NH3, CaO, Na2O, Mn2O5
4. Составьте химические формулы соединений:
а) барий и кислород
б) сера (IV) и кислород
в) фосфор (III) и водород
г) хлор (I) и кислород
5. Рассчитайте массу атома азота, если его относительная атомная масса равна 14.
videouroki.net