Энергетический уровень — Википедия
Материал из Википедии — свободной энциклопедии
Энергетический уровень — собственные значения энергии квантовых систем, то есть систем, состоящих из микрочастиц (электронов, протонов и других элементарных частиц) и подчиняющихся законам квантовой механики. Каждый уровень характеризуется определённым состоянием системы, или подмножеством таковых в случае вырождения. Понятие применимо к атомам (электронные уровни), молекулам (различные уровни, соответствующие колебаниям и вращениям — колебательные и вращательные уровни), атомным ядрам (внутриядерные энергетические уровни) и т. д.
Все квантовые состояния с энергетическим уровнем, превышающим энергию основного состояния квантовой системы, описываются как возбуждённое состояние.
В современном понятии об орбитальной модели атома, электроны в атоме способны обладать лишь определёнными величинами энергии, и переходить с одного энергетического уровня на другой лишь скачком. Разница между энергетическими уровнями определяет частоту кванта света, выделяемого или поглощаемого при переходе. Каждой паре значений главного квантового числа
Главные энергетические уровни атома — это совокупности атомных орбиталей, имеющих одинаковые значения главного квантового числа. Число таких энергетических уровней в атоме равно номеру периода, в котором расположен соответствующий химический элемент. Например, калий — элемент четвёртого периода, следовательно, его атом имеет 4 основных энергетических уровня (n = 4).
Каждый главный энергетический уровень в атоме расщеплён на подуровни (s-, p-, d-, f-, g-орбитали), соответствующие изменениям орбитального квантового числа. В достаточно сильных магнитных полях можно обнаружить расщепление этих подуровней на отдельные состояния, соответствующие различным значениям магнитного квантового числа.
Внутриядерные энергетические уровни[править | править код]
Термин появился благодаря исследованию радиоактивности. Радиационное излучение разделяется на три части: альфа-лучи, бета-лучи и гамма-лучи. Исследования показали, что альфа-излучение состоит из ядер гелия-4 (см. альфа-частица), бета-излучение является потоком быстро движущихся электронов, а гамма-лучи — это вид электромагнитного излучения (фотоны). Поскольку энергии переходов между различными электронными уровнями недостаточно для возникновения гамма-лучей, стало понятно, что их источник нужно искать внутри атомного ядра: ядро атома само может обладать различными энергетическими уровнями, при переходах между которыми и происходит излучение гамма-квантов. Гамма-лучи расширили спектр известных электромагнитных волн, и все волны короче 10−3 нм называются гамма-лучами.
- Уровни энергии // Физическая энциклопедия. — М.: Большая Российская Энциклопедия, 1998. — Т. 5. — С. 238.
- Уровни энергии // Энциклопедия физики и техники
Что такое энергетический уровень в химии?
Строение веществ было интересно людям с той поры, как возникла возможность не беспокоиться о пропитании и изучать окружающий мир. Такие явления, как засухи, наводнения, молнии, ужасали человечество. Незнание их объяснений порождало веру в различных злых богов, требующих жертв. Именно поэтому люди начали изучать природные явления, стремясь к их предсказанию, и углубляться в строение веществ. Они изучили строение атома и ввели следующие два важных понятия в химии: энергетический уровень и подуровень.

Предпосылки к открытию мельчайших химических веществ
О маленьких частицах, из которых состоят вещества, догадались еще древние греки. Они сделали странное открытие: мраморные ступени, по которым за несколько десятилетий прошло множество людей, изменили свою форму! Это привело к выводу о том, что ступня прошедшего забирает какую-то частичку камня с собой. Данное явление далеко от понимания существования энергетического уровня в химии, но именно с него все началось. Наука начала прогрессивно развиваться и углубляться в строение химических элементов и их соединений.
Начало изучения строения атома
В начале XX века посредством опытов с электричеством был открыт атом. Он считался электронейтральным, но имел положительные и отрицательные составные частицы. Ученые хотели выяснить их распределение внутри атома. Было предложено несколько моделей, одна из которых даже имела название «булочка с изюмом». Британский физик Эрнест Резерфорд провел опыт, который показал, что в центре атома расположено положительное ядро, а отрицательный заряд находится в маленьких электронах, вращающихся вокруг него.
Открытие энергетического уровня в химии стало большим прорывом в изучении строения веществ и явлений.
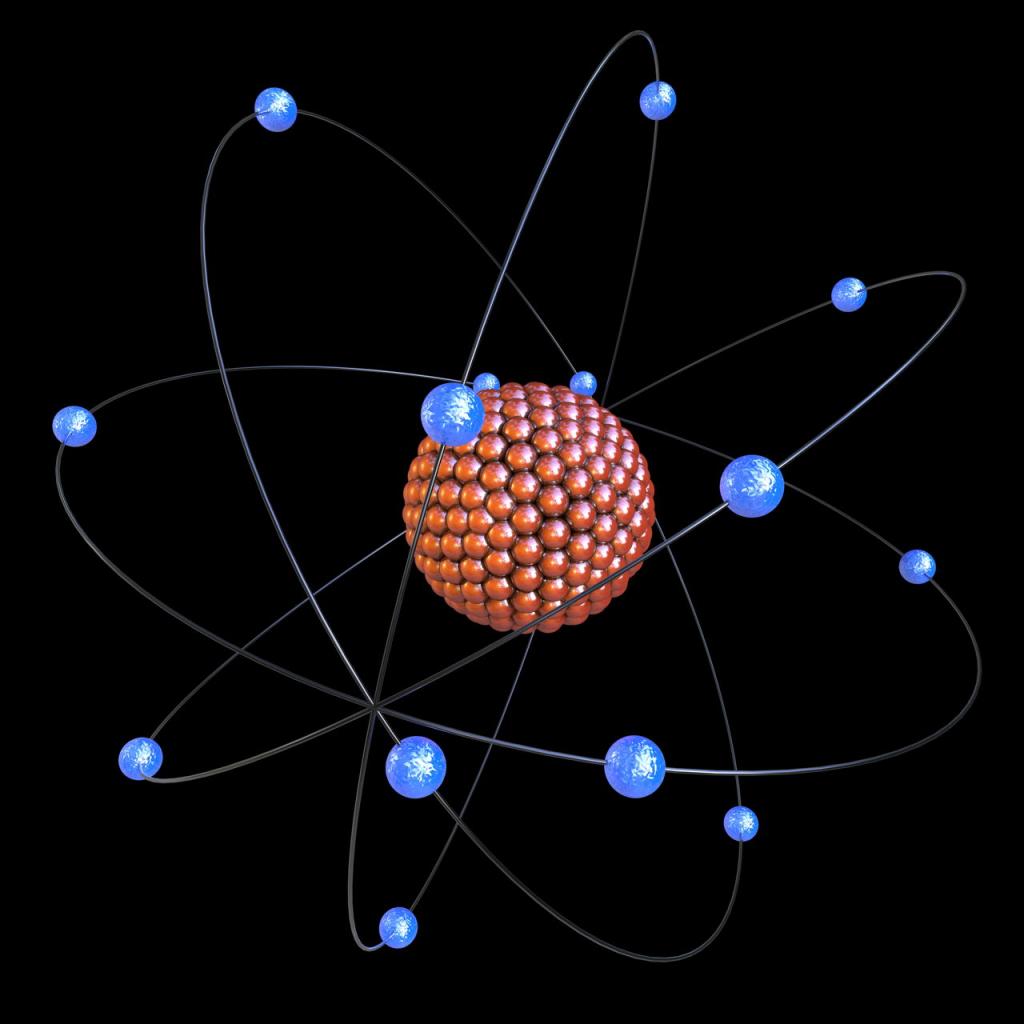
Энергетический уровень
В ходе изучения свойств химических веществ выяснилось, что каждый элемент имеет свои уровни. Например, у кислорода схема строения одна, а у азота совсем другая, хотя номера их атомов различны лишь на единицу. Так что такое энергетический уровень? Это электронные слои, состоящие из электронов, которые образуются по причине различной силы их притяжения к ядру атома. Одни находятся ближе, а другие — дальше. То есть верхние электроны «давят» на нижние.
Число энергетических уровней в химии равняется номеру периода в Периодической таблице Д. И. Менделеева. Наибольшее количество электронов, которые находятся на данном энергетическом уровне, определяется по следующей формуле: 2n2, где n — это номер уровня. Таким образом, на первом энергетическом уровне может быть расположено не более двух электронов, на втором — не более восьми, на третьем — восемнадцати и так далее.
У каждого атома есть уровень, находящийся от его ядра дальше других. Он является крайним, или последним, и называется внешним энергетическим уровнем. Число электронов на нем для элементов главных подгрупп равняется номеру группы.
Для построения схемы атома и его энергетических уровней в химии нужно следовать такому плану:
- определите число всех электронов атома данного элемента, которое равно его порядковому номеру;
- определите число энергетических уровней по номеру периода;
- определите число электронов на каждом энергетическом уровне.
Примеры схем строения энергетических уровней некоторых элементов смотрите ниже.

Энергетические подуровни
В атомах, помимо энергетических уровней, существуют еще и подуровни. На каждом уровне, в зависимости от числа электронов на нем, заполняются определенные подуровни. От того, как подуровень заполняется, различают четыре типа элементов:
- S-элементы. Происходит заполнение s-подуровней, на которых могут находиться не более двух электронов. К ним относятся первые два элемента от каждого периода;
- P-элементы. В данных элементах может быть не более шести электронов, расположенных на p-подуровне;
- D-элементы. К ним относятся элементы больших периодов (декад), находящиеся между s- и p-элементами;
- F-элементы. Заполнение f-подуровня происходит у актиноидов и лантоноидов, находящихся в шестом и седьмом периодах.
Электронная конфигурация атома — Электронный учебник K-tree
Общая химия
1 . Вещество
Вещество и его строение, модель атома
2. Электронная конфигурация атома
Сколько электронов в атоме и где их искать?
3 . Ион
Ионы — заряженые частицы, катионы и анионы
4 . Единицы измерения
А.е.м., моль, концентрация
5 . Химическая связь
Молекулы, химические соединения
6 . Окислительно-восстановительные реакции
Степень окисления. Окислитель. Восстановитель. Редокс
7 . Электрохимия
Электрохимия. Электролиз. Гальванические элементы
8 . Термохимия
Химическая термодинамика, система, энтальпия
9 . Скорость химической реакции
Сколько времени займёт реакция? Что влияет на скорость реакции?
10 . Химическое равновесие
Равновесие обратимых реакций. Принцип Ле Шателье. Влияние внешних факторов на равновесие
11 . Законы термодинамики
12 . Классы соединений
Основные классы химических соединений. Классификация
Неорганическая химия
Органическая химия
Прикладная химия
Описание элемента по положению в Периодической системе элементов Д.И. Менделеева
Тема: Периодический закон и Периодическая система химических элементов Д. И. Менделеева
Урок: Описание элемента по положению в Периодической системе элементов Д. И. Менделеева

В 1869 году Д.И.Менделеев на основе данных накопленных о химических элементах сформулировал свой периодический закон. Тогда он звучал так: « Свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных масс элементов». Очень долго физический смысл закона Д.И.Менделеева был непонятен. Всё встало на свои места после открытия в XX веке строения атома.
Современная формулировка периодического закона: « Свойства простых веществ, также формы и свойства соединений элементов находятся в периодической зависимости от величины заряда ядра атома».
Заряд ядра атома равен числу протонов в ядре. Число протонов уравновешивается числом электронов в атоме. Таким образом, атом электронейтрален.
Заряд ядра атома в Периодической таблице – это порядковый номер элемента.
Номер периода показывает число энергетических уровней, на которых вращаются электроны.
Номер группы показывает число валентных электронов. Для элементов главных подгрупп число валентных электронов равно числу электронов на внешнем энергетическом уровне. Именно валентные электроны отвечают за образование химических связей элемента.
Химические элементы 8 группы – инертные газы имеют на внешней электронной оболочке 8 электронов. Такая электронная оболочка энергетически выгодна. Все атомы стремятся заполнить свою внешнюю электронную оболочку до 8 электронов.
Какие же характеристики атома меняются в Периодической системе периодически?
— Повторяется строение внешнего электронного уровня.
— Периодически меняется радиус атома.
В группе радиус увеличивается с увеличением номера периода, так как увеличивается число энергетических уровней. В периоде слева направо будет происходить рост атомного ядра, но притяжение к ядру будет больше и поэтому радиус атома уменьшается.— Каждый атом стремится завершить последний энергетический уровень У элементов 1 группы на последнем слое 1 электрон. Поэтому им легче его отдать. А элементам 7 группы легче притянуть 1 недостающий до октета электрон. В группе способность отдавать электроны будет увеличиваться сверху вниз, так ка увеличивается радиус атома и притяжение к ядру меньше. В периоде слева направо способность отдавать электроны уменьшается, потому что уменьшается радиус атома.
— Чем легче элемент отдает электроны с внешнего уровня, тем большими металлическими свойствами он обладает, а его оксиды и гидроксиды обладают большими основными свойствами. Значит, металлические свойства в группах увеличиваются сверху вниз, а в периодах справа налево. С неметаллическими свойствами все наоборот.

Рис. 1. Положение магния в таблице
В группе магний соседствует с бериллием и кальцием. Рис.1. Магний стоит ниже, чем бериллий, но выше кальция в группе. У магния больше металлические свойства, чем у бериллия, но меньше чем у кальция. Основные свойства его оксидов и гидроксидов изменяются также. В периоде натрий стоит левее, а алюминий правее магния. Натрий будет проявлять больше металлические свойства, чем магний, а магний больше, чес алюминий. Таким образом, можно сравнить любой элемент с соседями его по группе и периоду.
Кислотные и неметаллические свойства изменяются противоположно основным и металлическим свойствам.
Характеристика хлора по его положению в периодической системе Д.И.Менделеева.

Рис. 4. Положение хлора в таблице
 . Значение порядкового номера 17 показывает число протонов17 и электронов17 в атоме. Рис.4. Атомная масса 35 поможет вычислить число нейтронов (35-17 = 18). Хлор находится в третьем периоде, значит число энергетических уровней в атоме равно 3. Стоит в 7 –А группе, относится к р- элементам. Это неметалл. Сравниваем хлор с его соседями по группе и по периоду. Неметаллические свойства хлора больше чем у серы, но меньше, чем у аргона. Хлор обладает меньшими неметаллическими свойствами, чем фтор и большими чем бром. Распределим электроны по энергетическим уровням и напишем электронную формулу. Общее распределение электронов будет иметь такой вид. См.Рис. 5
. Значение порядкового номера 17 показывает число протонов17 и электронов17 в атоме. Рис.4. Атомная масса 35 поможет вычислить число нейтронов (35-17 = 18). Хлор находится в третьем периоде, значит число энергетических уровней в атоме равно 3. Стоит в 7 –А группе, относится к р- элементам. Это неметалл. Сравниваем хлор с его соседями по группе и по периоду. Неметаллические свойства хлора больше чем у серы, но меньше, чем у аргона. Хлор обладает меньшими неметаллическими свойствами, чем фтор и большими чем бром. Распределим электроны по энергетическим уровням и напишем электронную формулу. Общее распределение электронов будет иметь такой вид. См.Рис. 5
|
|
|
Рис. 5. Распределение электронов атома хлора по энергетическим уровням
Определяем высшую и низшую степень окисления хлора. Высшая степень окисления равна +7, так как он может отдать с последнего электронного слоя 7 электронов. Низшая степень окисления равна -1, потому что хлору до завершения необходим 1 электрон. Формула высшего оксида Cl2O7 (кислотный оксид), водородного соединения HCl.
В процессе отдачи или присоединения электронов атом приобретает условный заряд. Этот условный заряд называется степенью окисления.
— Простые вещества обладают степенью окисления равной нулю.
— Элементы могут проявлять максимальную степень окисления и минимальную. Максимальную степень окисления элемент проявляет тогда, когда отдает все свои валентные электроны с внешнего электронного уровня. Если число валентных электронов равно номеру группы, то и максимальная степень окисления равна номеру группы.

Рис. 2. Положение мышьяка в таблице
Минимальную степень окисления элемент будет проявлять тогда, когда он примет все возможные электроны для завершения электронного слоя.
Рассмотрим на примере элемента №33 значения степеней окисления.
Это мышьяк As.Он находится в пятой главной подгруппе.Рис.2. На последнем электронном уровне у него пять электронов. Значит, отдавая их, он будет иметь степень окисления +5. До завершения электронного слоя атому As не хватает 3 электрона. Притягивая их, он будет иметь степень окисления -3.
Положение элементов металлов и неметаллов в Периодической системе Д.И. Менделеева.

Рис. 3. Положение металлов и неметаллов в таблице
В побочных подгруппах находятся все металлы. Если мысленно провести диагональ от бора к астату, то выше этой диагонали в главных подгруппах будут все неметаллы, а ниже этой диагонали — все металлы. Рис.3.
Используя Периодическую систему можно очень много сказать об элементе. Можно сравнить его с другими элементами, определить строение его атома, электронной оболочки атома.
1. Символ элемента
2. Порядковый номер элемента
3. Значение относительной атомной массы элемента.
4. Число протонов, электронов, нейтронов.
5. Номер периода.
6. Номер и тип группы (тип элемента s -, p -,d -,f — элемент)
7. Металл или неметалл
8. Сравнение свойств элемента (металлических и неметаллических) с соседними элементами по периоду и группе.
9. Написать распределение электронов по атомным орбиталям – квантовую диаграмму.
10. Написать электронную формулу.
11. Зарисовать распределение электронов по энергетическим уровням
12. Определить высшую степень окисления атома и формулу его высшего оксида. Определить характер оксида (основной, кислотный, амфотерный).
13. Определить низшую степень окисления элемента и формулу его водородного соединения (если такое есть).
Подведение итога урока
На этом уроке вы узнали о Периодическом законе Менделеева, который описывает изменение свойств простых тел, а также формы и свойства соединений элементов в зависимости от величины их атомных масс. Рассмотрели, как по положению в Периодической системе можно описать химический элемент.
Список рекомендованной литературы
1. Рудзитис Г.Е. Неорганическая и органическая химия. 8 класс: учебник для общеобразовательных учреждений: базовый уровень/ Г. Е. Рудзитис, Ф.Г. Фельдман. М.: Просвещение. 2011 г.176с.:ил.
2. Попель П.П.Химия:8 кл.: учебник для общеобразовательных учебных заведений/П.П. Попель, Л.С.Кривля. -К.: ИЦ «Академия»,2008.-240 с.: ил.
3. Габриелян О.С. Химия. 9 класс. Учебник. Издательство: Дрофа.:2001. 224с .
Рекомендованные ссылки на ресурсы интернет
1. Chemport.ru (Источник).
2. Химик (Источник).
Рекомендованное домашнее задание
1. №№ 1-4 (с.125) Рудзитис Г.Е. Неорганическая и органическая химия. 8 класс: учебник для общеобразовательных учреждений: базовый уровень/ Г. Е. Рудзитис, Ф.Г. Фельдман. М.: Просвещение. 2011 г.176с.:ил.
2. Какие характеристики атома изменяются периодичности ?
3. Дайте характеристику химического элемента кислорода по его положению в Периодической системе Д.И.Менделеева.
2. Заполнение электронных слоёв атомов элементов малых периодов
Общее число электронов в атоме равно порядковому номеру химического элемента в Периодической таблице.
Каждый электрон находится на своей орбитали. Чем больше энергия электрона, тем больше по размеру его орбиталь, и тем дальше он находится от ядра.
Электроны с близкими значениями энергии образуют энергетический уровень (электронный слой).
Энергетический уровень (электронный слой) — совокупность электронов с близкими значениями энергии.
Энергетические уровни нумеруют, начиная с самого близкого к ядру.
Установлено, что максимальное число электронов на энергетическом уровне равно \(2n²\), где \(n \)— его номер. Значит, на первом уровне может находиться не более \(2\) электронов, на втором — не более \(8\), на третьем — не более \(18\) и т. д.
В атоме водорода — один электрон, и он располагается на первом энергетическом уровне:
h2)1.
В атоме гелия — два электрона. Первый энергетический уровень у гелия завершён, так как он не может содержать более двух электронов:
He2)2.
В атоме лития — три электрона. Два из них находятся на первом уровне. Третий электрон имеет большую энергию и движется дальше от ядра. В атоме лития появляется второй энергетический уровень:
Li3)2)1.
У следующих элементов второго периода электроны добавляются на второй уровень:
Be4)2)2; B5)2)3; C6)2)4; N7)2)5; O8)2)6; F9)2)7; Ne10)2)8.
У неона второй электронный слой завершён, так как содержит \(8\) электронов — максимально возможное число.
Заполнение третьего энергетического уровня начинается у атома натрия и завершается у атома аргона:
Na11)2)8)1; Mg12)2)8)2; Al13)2)8)3; Si14)2)8)4; P15)2)8)5; S16)2)8)6; Cl17)2)8)7; Ar18)2)8)8.
Максимальное количество электронов на третьем слое равно \(18\), но у элементов третьего периода его заполнение не происходит, потому что внешний электронный слой не может содержать более \(8\) электронов.
Обрати внимание!
На внешнем электронном слое не может быть более \(8\) электронов.
У элементов четвёртого периода начинается заполнение четвёртого энергетического уровня:
K19)2)8)8)1; Ca20)2)8)8)2.
Полностью четвёртый электронный слой заполняется, как и в малых периодах, у инертного газа криптона.
Ответы Mail.ru: Химия: принцип распределения электронных уровней
По простому, дак по простому s подуровни имеют 1 энергетическую ячейку (в ячейке может быть максимум 2 электрона) , т. е. на данных подуровнях может быть максимум 2 электрона p подуровни имеют 3 энергетические ячейки, т. е. на данных подуровнях может быть максимум 6 электронов d подуровни имеют 5 энергетических ячеек, т. е. на данных подуровнях может быть максимум 10 электронов f подуровни имеют 7 энергетических ячеек, т. е. на данных подуровнях может быть максимум 14 электронов Дальше. Заполнение электронами орбиталей в атоме происходит по <a rel=»nofollow» href=»http://ru.wikipedia.org/wiki/Правило_Клечковского» target=»_blank» >правилу Клечковского</a>, если Вы школьник то можете не читать правило, а знать всего лишь последовательность: 1s > 2s > 2p > 3s > 3p > 4s > 3d > 4p > 5s > 4d > 5p > 6s > 4f > 5d > 6p > 7s > 5f > 6d > 7p Еще одно <a rel=»nofollow» href=»http://ru.wikipedia.org/wiki/Правило_Хунда» target=»_blank» >правило Хунда</a>. В каждой из орбиталей подслоя заполняется сначала один электрон, а только после исчерпания незаполненных орбиталей на эту орбиталь добавляется второй электрон. Дальше. Допустим вы написали актиний номер 89 (порядковый номер показывает сколько протонов и электронов у данного элемента) . Задача распределить эти электроны по ячейкам. Смотрим на последовательность вначале видим заполняется 1s, в соответствии с тем что написано выше 2 электрона мы ставим на 1s-подуровень и вычитаем из 89 два электрона которые теперь находятся на 1s-подуровне 89 — 2 = 87. Смотрим дальше на последовательность видим что дальше заполняется 2s-подуровень, в соответствии с тем что написано выше 2 электрона мы ставим на 2s-подуровень и вычитаем из 87 два электрона которые теперь находятся на 2s-подуровне 87 — 2 = 85. И т. д. P.S. Прочитайте все, потом зайдите на сюда <a rel=»nofollow» href=»http://www.xumuk.ru/esa/» target=»_blank»>http://www.xumuk.ru/esa/</a> подвигайте ползунок влево-вправо и все поймете. Есть еще так называемые электронные проскоки/провалы, например они наблюдаются у меди, хрома, ниобия, это вам имхо не обязательно знать, а если надо то учите =))
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d 7p на S-уровне по 2 электрона при полном заполнении на P-уровне по 6 на d-уровне по 10 на f-уровне по 14
вообще, самое главное — какой порядковый номер — столько всего электронов у элемента. Номер главной группы говорит о том, сколько у элемента электронов на внешней оболочке (валентные) . В подгруппах номер говорит о отом, сколько электронов на последнем уровне предыдущей оболочки. первый период — заполнение s-уровня, всего два электрона до полной электронной оболочки, инертный газ гелий как раз с заполненным s-уровнем. второй период — к 1s прибавляется 2s 2 р. Этот уровень «вмещает» шесть электронов. У неона оба уровня заполнены. Наполнения идёт по принципу — сначала s, потом р. У элементов третьего периода появляется третий уровень — d, он вмещает 10 электронов, но в третьем периоде заполняются только s и р-уровни. Всего здесь уже три оболочки: 1s 2s 2р 3s 3з 3d. d начинает заполнятся в четвёртом периоде, у элементов с 21-го по 30-й на внешней оболочке по два электрона, а с порядковым номером прибавляется по электрону на d. Орбитали выглядят s круг, р — восьмёрка, d — три восьмёрки на трёх осях. Пример электронной формулы… например железо, порядковый номер 26, четвёртый период, восьмая подгруппа. Значит, всего 26 электронов, два из них на внешней (последней) оболочке, шесть на d предыдущей. всего четыре оболочки. 1s2 / 2s2 2р6 / 3 s2 3 р6 3d6 / 4 s2 ну вот как-то так.
Разбор задания №1 ЕГЭ по химии
Система оценивания экзаменационной работы по химии
За правильный ответ на каждое из заданий 1-8, 12-16, 20, 21, 27-29 ставиться 1 балл.
Задания 9–11, 17–19, 22–26 считаются выполненными верно, если правильно указана последовательность цифр. За полный правильный ответ в заданиях 9–11, 17–19, 22–26 ставится 2 балла; если допущена одна ошибка – 1 балл; за неверный ответ (более одной ошибки) или его отсутствие – 0 баллов.
Теория по заданию:
Для выполнения задания используйте следующий ряд химических элементов. Ответом в задании является последовательность трех цифр, под которыми указаны химические элементы в данном ряду.
1) F 2) S 3) I 4) Na 5) Mg
Определите, атомам каких из указанных элементов в основном состоянии до завершения внешнего электронного слоя недостаёт одного электрона.
1
Решение
Восьмиэлектронная оболочка соответствует оболочке инертного газа. Для каждого из веществ в периоде котором они находятся соответствуют инерный газ, для фтора неон, для серы аргон, для йода ксенон, для натрия и магния аргон, но из перечисленных элементов, лишь фтору и йоду не хватает одного электрона до восьмиэлектронной оболочки, так как они находятся в седьмой группе.
 Для выполнения задания используйте следующий ряд химических элементов. Ответом в задании является последовательность трех цифр, под которыми указаны химические элементы в данном ряду.
Для выполнения задания используйте следующий ряд химических элементов. Ответом в задании является последовательность трех цифр, под которыми указаны химические элементы в данном ряду.1) Be 2) H 3) N 4) K 5) C
Определите, атомам каких из указанных элементов в основном состоянии содержат одинаковое число неспаренных электронов.
1

