Что такое CO2 в химии . Ну типа кислота какая-то , а вот какая ???
Углекислый газ.
Это углекислый газ
Оксид углерода (углекислый газ, диоксид углерода, двуокись углерода, угольный ангидрид)
Это оксид, кислотный. Не кислота. Кислота вот h3CO3 — угольнаяЭто оксид углерода (IV), которому соответствует угольная кислота Н2СО3!!! Это кислотный оксид, второе название углекислый газ!
углекислород…
Углекислый газ — это… Что такое Углекислый газ?
| Диоксид углерода | |
|---|---|
  | |
| Другие названия | углекислый газ, углекислота, сухой лед(твердый) |
| Формула | CO2 |
| Молярная масса | 44.0095(14) г/моль |
| В твердом виде | сухой лед |
| Вид | бесцветный газ |
| Номер CAS | [124-38-9] |
| Свойства | |
| Плотность и фазовое состояние | 1.98 кг/м³, при н.у.; 771 кг/м³, жидкий; 1512 кг/м³, твёрдый |
| Растворимость в воде | 1.45 кг/м³ |
| Удельная теплота плавления | 25.13 кДж/моль |
| Точка плавления | −57 °C (216 K), под давлением |
| Точка кипения | −78 °C (195 K), возгоняется |
| Константа диссоциации кислоты (pKa) | 6.35 and 10.33 |
| Вязкость | 0.07 пз при −78 °C |
| Строение | |
| Форма молекулы | линейная |
| Кристаллическая решётка | кварцевидная |
| Дипольный момент | ноль |
| Техника безопасности | |
| MSDS | External MSDS |
| Главные опасности | удушающее, раздражающее |
| NFPA 704 |  0 0 0
(жидкость) |
| R-phrases | R: As, Fb |
| S-phrases | S9, S23, S36 (ж) |
| RTECS number | FF6400000 |
| Страница дополнительных сведений | |
| Структура и свойства | n, εr, и т. д. |
| Спектр | УФ, ИК, ЯМР, Масс-спектроскопия |
| Родственные соединения | |
| Оксиды | CO C3O2 C2O CO3 |
| Если не указано иное, данные даны для материалов при стандартных условиях (25 °C, 100 кПа) Infobox disclaimer and references | |
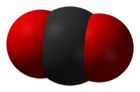
Диокси́д углеро́да (двуо́кись углеро́да, углеки́слый газ, окси́д углеро́да (IV), диокси́д углеро́да, у́гольный ангидрид, углекислота́) — CO2, бесцветный газ со слегка кисловатым запахом и вкусом.
Концентрация углекислого газа в атмосфере Земли составляет 0,038 %.
- Не следует путать с Диоксин.
Свойства
Физические
Плотность при нормальных условиях 1,98 г/л. При атмосферном давлении диоксид углерода не существует в жидком состоянии, переходя непосредственно из твёрдого состояния в газообразное. Твёрдый диоксид углерода называют сухим льдом. При повышенном давлении и обычных температурах углекислый газ переходит в жидкость, что используется для его хранения.
Углекислый газ легко пропускает ультрафиолетовые лучи и лучи видимой части спектра, которые поступают на Землю от Солнца и обогревают её. В то же время он поглощает испускаемые Землёй инфракрасные лучи и является одним из парниковых газов, вследствие чего принимает участие в процессе глобального потепления. Постоянный рост уровня содержания этого газа в атмосфере наблюдается с начала индустриальной эпохи.
Химические
По химическим свойствам диоксид углерода относится к кислотным оксидам. При растворении в воде образует угольную кислоту. Реагирует со щёлочами с образованием карбонатов и гидрокарбонатов. Вступает в реакции электрофильного замещения (например, с фенолом — реакция Кольбе) и нуклеофильного присоединения (например, с магнийорганическими соединениями).
Биологические
Диоксид углерода играет одну из главных ролей в живой природе, участвуя во многих процессах метаболизма живой клетки. Диоксид углерода получается в результате множества окислительных реакций у животных, и выделяется в атмосферу с дыханием. Углекислый газ атмосферы — основной источник углерода для растений. Однако, ошибкой будет утверждение, что животные только выделяют углекислый газ, а растения — только поглощают его. Растения поглощают углекислый газ в процессе фотосинтеза, а без освещения они тоже его выделяют.
Диоксид углерода не токсичен, но не поддерживает дыхание. Большая концентрация в воздухе вызывает удушье (см. Гиперкапния). Недостаток углекислого газа тоже опасен (см. Гипокапния)
Углекислый газ в организмах животных имеет и физиологическое значение, например, участвует в регуляции сосудистого тонуса (см. Артериолы).
Получение
В промышленности получают из печных газов, из продуктов разложения природных карбонатов (известняк, доломит). Смесь газов промывают раствором карбоната калия, который поглощает углекислый газ, переходя в гидрокарбонат. Раствор гидрокарбоната при нагревании разлагается, высвобождая углекислоту. При промышленном производстве закачивается в баллоны.
В лабораторных условиях небольшие количества получают взаимодействием карбонатов и гидрокарбонатов с кислотами, например мрамора с соляной кислотой.
Применение
В пищевой промышленности диоксид углерода используется как консервант и обозначается на упаковке под кодом Е290, а также в качестве разрыхлителя теста.
Жидкая углекислота (жидкая пищевая углекислота) — сжиженный углекислый газ, хранящийся под высоким давлением (~ 65-70 Атм). Бесцветная жидкость. При выпуске жидкой углекислоты из баллона в атмосферу часть её испаряется, а другая часть образует хлопья сухого льда.
Баллоны с жидкой углекислотой широко применяются в качестве огнетушителей и для производства газированной воды и лимонада. Углекислый газ используется в качестве активной среды при сварке проволокой так как при температуре дуги углекислота разлагается на угарный газ СО и кислород который в свою очередь и входит в заимодействие с жидким металом окисляя его. Углекислота в баллончиках применяется в пневматическом оружии и в качестве источника энергии для двигателей в авиамоделировании.
Твёрдая углекислота — сухой лёд — используется в качестве хладагента в ледниках и морозильных установках.
Методы регистрации
Измерение парциального давления углекислого газа требуется в технологических процессах, в медицинских применениях — анализ дыхательных смесей при искусственной вентиляции лёгких и в замкнутых системах жизнеобеспечения. Анализ концентрации CO
Углекислый газ регистрируют с помощью газоанализаторов основанных на принципе инфракрасной спектроскопии и других газоизмерительных систем. Медицинский газоанализатор для регистрации содержания углекислоты в выдыхаемом воздухе называется капнограф.
Концентрация
- Подземное животное голый землекоп отличается терпимостью к большим (смертельным для других животных) концентрациям углекислого газа.[1]
Примечания
См. также
Ссылки
Wikimedia Foundation. 2010.
Диоксид триуглерода — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 28 декабря 2018; проверки требуют 5 правок. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 28 декабря 2018; проверки требуют 5 правок.Диокси́д триуглеро́да (1,3-диоксопропадиен, надоксид углерода, недоокись углерода, трикарбодиоксид) С3О2 — органическое соединение, бесцветный ядовитый газ (при нормальных условиях) с резким, удушливым запахом, легко полимеризующийся в обычных условиях с образованием продукта, нерастворимого в воде, жёлтого, красного или фиолетового цвета.
Молекула С3О2 имеет линейное строение О=С=С=С=О с длиной связи С=С 130 пм и С=О 120 пм.
Диоксид триуглерода является внутренним ангидридом малоновой кислоты — при взаимодействии с водой в течение 1 часа количественно даёт малоновую кислоту:
- O=C=C=C=O+2h3O→HOOC-Ch3-COOH{\displaystyle {\mathsf {O{\text{=}}C{\text{=}}C{\text{=}}C{\text{=}}O+2H_{2}O\rightarrow HOOC{\text{-}}CH_{2}{\text{-}}COOH}}}
По остальным свойствам он также сходен с кетенами из-за алленообразного строения молекулы — легко реагирует с нуклеофилами с образованием производных малоновой кислоты. Реакция проходит через образование енолов (нуклеофильное присоединение по карбонильной группе):
- O=C=C=C=O+HX→HO(X)C=C=C(X)OH→X(O)C-Ch3-C(O)X, X=Hal,OH,OR,OCOR,Nh3,NHR,NR2,CN,SH,SR{\displaystyle {\mathsf {O{\text{=}}C{\text{=}}C{\text{=}}C{\text{=}}O+HX\rightarrow HO(X)C{\text{=}}C{\text{=}}C(X)OH\rightarrow X(O)C{\text{-}}CH_{2}{\text{-}}C(O)X,\ \ X=Hal,OH,OR,OCOR,NH_{2},NHR,NR_{2},CN,SH,SR}}}
Полимеризуется при сжижении или хранении при давлении выше 100 мм рт.ст. в красный полимер. Полимеризация ускоряется в присутствии пентаоксида фосфора.
Получают С3О2 пиролизом ангидрида диацетилвинной кислоты, дегидратацией малоновой кислоты или её эфиров, например, фосфорным ангидридом, и другими методами[1]:
- Ch3(COOH)2+P2O5→h5P2O7+C3O2↑{\displaystyle {\mathsf {CH_{2}(COOH)_{2}+P_{2}O_{5}\rightarrow H_{4}P_{2}O_{7}+C_{3}O_{2}\uparrow }}}
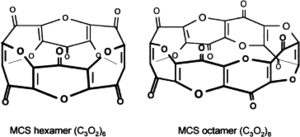 Обнаруженные в организме 6- и 8-членные макроциклические полимеры недокиси углерода являются эндогенными дигоксиноподобными соединениями, ингибиторами Na+/K±АТФ-азы, кальций-зависимой АТФ-азы, эндогенными натриуретиками, антиоксидантами и антигипертензивными веществами
Обнаруженные в организме 6- и 8-членные макроциклические полимеры недокиси углерода являются эндогенными дигоксиноподобными соединениями, ингибиторами Na+/K±АТФ-азы, кальций-зависимой АТФ-азы, эндогенными натриуретиками, антиоксидантами и антигипертензивными веществамиДиоксид триуглерода может образовываться в малых количествах как побочный продукт во всех биохимических процессах, в которых обычно образуется окись углерода (CO), в частности при окислении гема ферментом гемоксигеназой. Кроме того, диоксид триуглерода в организме может также образовываться из малоновой кислоты, внутренним ангидридом которой он является. Показано, что в организме диоксид триуглерода способен полимеризоваться в макроциклические структуры вида (C3O2)n (в основном (C3O2)6 и (C3O2)8), причём эти макроциклические соединения обладают дигоксин-подобной активностью, способностью угнетать активность Na+/K+-АТФ-азы и кальций-зависимой АТФ-азы и натрийуретической активностью и, очевидно, являются эндогенными аналогами дигоксина и уабаина в клетках животных и эндогенными регуляторами функции Na+/K+-АТФ-азы и натрийуреза, а также эндогенными антигипертензивными веществами[2][3][4]. Кроме того, этим макроциклическим соединениям диоксида триуглерода приписывают также способность защищать клетки от свободнорадикального повреждения и оксидативного стресса (что логично, учитывая «недоокисленность» углерода в них) и роль эндогенной противоопухолевой защиты, в частности, в подвергающихся высокой степени воздействия оксидативного стресса светочувствительных клетках сетчатки глаза[5].
- ↑ Дашкевич Л. Б., Бейлин В. Г. Недокись углерода в органическом синтезе // Успехи химии. — 1967. — Т. 36, вып. 6. — С. 947—964.
- ↑ Franz Kerek. The structure of the digitalislike and natriuretic factors identified as macrocyclic derivatives of the inorganic carbon suboxide // Hypertension Research. — Sep 2000. — Т. 23, вып. 23 Suppl S33, № Suppl S33. — С. S33-38. — DOI:10.1291/hypres.23.Supplement_S33. — PMID 11016817.
- ↑ Robert Stimac, Franz Kerek, Hans-Jurgen Apell. Macrocyclic carbon suboxide oligomers as potent inhibitors of the Na,K-ATPase // Annals of the New York Academy of Sciences. — Apr 2003. — Т. 986. — С. 327-329. — DOI:10.1111/j.1749-6632.2003.tb07204.x. — PMID 12763840.
- ↑ Franz Kerek, Robert Stimac, Hans-Jürgen Apell, Frank Freudenmann, Luis Moroder. Characterization of the macrocyclic carbon suboxide factors as potent Na,K-ATPase and SR Ca-ATPase inhibitors // Biochimica et Biophysica Acta (BBA) — Biomembranes. — 23 December 2002. — Т. 1567, № 1—2. — С. 213—220. — DOI:10.1016/S0005-2736(02)00609-0. — PMID 12488055.
- ↑ Tubaro E. Carbon suboxide, the probable precursor of an antitumor cellular sustance: retina (italian) // Boll Chim Farm. — Jun 1966. — Т. 105, вып. 105(6), № 6. — С. 415-416. — PMID 6005012.
- «Dictionary of organic compounds». — Vol.1, Abadole-Cytosine. — New York, 1953. — С. 428
- «Руководство по неорганическому синтезу». — Т.3, под ред. Брауэра Г. — М.: Мир, 1985. — С. 682—684
- «Справочник химика». — 2 изд., Т.1. — Л.-М.: Химия, 1966. — С. 605 (давление паров)
- «Справочник химика». — Т.2. — Л.-М.: Химия, 1964. — С. 228—229
- Binneweis M., Milke E. «Thermochemical Data of Elements and Compounds». — 2ed, 2002. — С. 267
- Некрасов Б. В. «Основы общей химии». — Т.1. — М.: Химия, 1973. — С. 513
- Реми Г. «Курс неорганической химии». — Т.1. — М., 1963. — С. 481
- Успехи химии. — 1967. — Т.36, № 6. — С. 947—964
Оксид бора — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 2 октября 2017; проверки требуют 12 правок. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 2 октября 2017; проверки требуют 12 правок.Окси́д бо́ра B2O3{\displaystyle {\ce {B2O3}}} — ангидрид борной кислоты, бесцветное, довольно тугоплавкое, стекловидное или кристаллическое вещество, диэлектрик.
Стеклообразный оксид бора имеет слоистую структуру (расстояние между слоями 0,185 нм), в слоях атомы бора расположены внутри равносторонних треугольников BO3{\displaystyle {\ce {BO3}}} (d В—О=0,145 нм). Эта модификация плавится в интервале температур 325—450 °C и обладает высокой твёрдостью. Она получается при нагревании бора на воздухе 700 °C или обезвоживанием ортоборной кислоты. Кристаллический B2O3{\displaystyle {\ce {B2O3}}}, который получают осторожным отщеплением воды от метаборной кислоты HBO2{\displaystyle {\ce {HBO2}}}, существует в двух модификациях — с гексагональной кристаллической решёткой, при 400 °C и 2200 МПа переходящей в моноклинную.
- Борный ангидрид гигроскопичен, он бурно растворяется в воде, образуя вначале различные метаборные кислоты общей формулы (HBO2)n{\displaystyle {\ce {(HBO2)_n}}}. Дальнейшее оводнение приводит к образованию ортоборной кислоты h4BO3{\displaystyle {\ce {h4BO3}}}.
- Расплавленный B2O3{\displaystyle {\ce {B2O3}}} хорошо растворяет оксиды многих элементов. С оксидами металлов образует соли бораты.
- 2B2O3+P4O10→4BPO4{\displaystyle {\mathsf {2B_{2}O_{3}+P_{4}O_{10}\rightarrow 4BPO_{4}}}}
- B2O3+3h3O→2h4BO3{\displaystyle {\mathsf {B_{2}O_{3}+3H_{2}O\rightarrow 2H_{3}BO_{3}}}}
- С соляной кислотой реагирует при нагревании (t>100∘C{\displaystyle {\ce {t>100^{\circ }C}}}):
- B2O3+6HCl →t∘ 2BCl3+3h3O{\displaystyle {\mathsf {B_{2}O_{3}+6HCl\ {\xrightarrow {t^{\circ }\ }}\ 2BCl_{3}+3H_{2}O}}}
- Сам оксид бора не восстанавливается углеродом даже при температуре белого каления, однако разлагается, если одновременно ввести в реакцию вещества, способные заместить кислород (хлор или азот):
- B2O3+3C+3Cl2→2BCl3+3CO{\displaystyle {\mathsf {B_{2}O_{3}+3C+3Cl_{2}\rightarrow 2BCl_{3}+3CO}}}
- При нагревании оксида бора с элементарным бором выше 1000о в парах существуют термически устойчивые линейные молекулы O=B—B=O. При быстром охлаждении паров ниже 300о может быть получен белый твёрдый полимер состава (B2O2)n{\displaystyle {\ce {(B2O2)_n}}}, не имеющий определённой точки плавления и сильно реакционноспособный. Под давлением в 60 тыс. ат. и температуре 1500о оксид бора взаимодействует с элементарным бором по реакции:
- B2O3+4B→3B2O{\displaystyle {\mathsf {B_{2}O_{3}+4B\rightarrow 3B_{2}O}}}
- Этот низший оксид бора имеет графитоподобную слоистую структуру.
Образуется при нагревании бора в атмосфере кислорода или на воздухе
- 4B+3O2→2B2O3,{\displaystyle {\mathsf {4B+3O_{2}\rightarrow 2B_{2}O_{3},}}}
А также при обезвоживании борной кислоты:
- 2h4BO3→B2O3+3h3O.{\displaystyle {\mathsf {2H_{3}BO_{3}\rightarrow B_{2}O_{3}+3H_{2}O.}}}
Флюсы для стекла и эмали
Исходный материал для синтеза других соединений бора, таких как карбид бора
Добавка, используемая в стекловолокне (оптических волокнах)
Используется в производстве боросиликатного стекла
Используется в качестве кислотного катализатора в органическом синтезе
- Карапетьянц М. Х. Дракин С. И. Общая и неорганическая химия. М.: Химия 1994
- Реми Г. «Курс неорганической химии» М.: Иностранная литература, 1963
Карбонат кальция — Википедия
Карбона́т ка́льция (углеки́слый кальций) — неорганическое химическое соединение, соль угольной кислоты и кальция. Химическая формула CaCO3{\displaystyle {\mathsf {CaCO_{3}}}}.
В природе встречается в виде многочисленных минералов, например, кальцита, арагонита и ватерита, является главной составной частью известняка, мрамора, мела, входит в состав скорлупы яиц птиц.
Нерастворим в воде и этаноле.
Зарегистрирован как белый пищевой краситель (E170).
Используется как белый пищевой краситель Е170. Являясь основой мела, используется для письма на досках. Используется в быту для побелки потолков, покраски стволов деревьев, для подщелачивания почвы в садоводстве.
Массовое производство/использование[править | править код]
 Таблетки из карбоната кальция
Таблетки из карбоната кальцияОчищенный от примесей, карбонат кальция широко используется в бумажной и пищевой промышленности, в качестве наполнителя при производстве пластмасс, красок, резины, продукции бытовой химии, в строительстве.
При производстве бумаги карбонат кальция применяют одновременно в качестве отбеливателя, наполнителя, а также раскислителя.
Используется при производстве силикатного стекла, — материала для производства оконного стекла, стеклянных бутылок, стекловолокна.
Применяется при производстве предметов гигиены (например, зубной пасты), в медицине.
В пищевой промышленности часто используется в качестве препарата препятствующего слеживанию и для препятствования слипания в комки сухих молочных продуктах.
При употреблении сверх рекомендованной дозы (1,5 г в день) может вызывать молочно-щелочной синдром (синдром Бернетта). Рекомендован при болезнях костных тканей[источник не указан 455 дней].
Производители пластмассы — одни из основных потребителей чистого карбоната кальция (более 50% всего потребления). Используемый в качестве наполнителя и красителя, карбонат кальция необходим при производстве поливинилхлорида (PVC), полиэфирных волокон (кримплен, лавсан, и т. п.), полиолефинов. Изделия из данных видов пластмасс распространены повсеместно — это трубы, сантехника, кафельная плитка, черепица, линолеум, ковровые покрытия, и т.п. Карбонат кальция составляет порядка 20% красящего пигмента, используемого при производстве красок[источник не указан 455 дней].
В строительстве[править | править код]
Строительство — ещё один из основных потребителей карбоната кальция. Например, в качестве наполнителя шпаклёвок и герметиков.
Также карбонат кальция является важным составным элементом при производстве продукции бытовой химии — средств для чистки сантехники, кремов для обуви.
Карбонат кальция широко применяется для раскисления кислых почв.
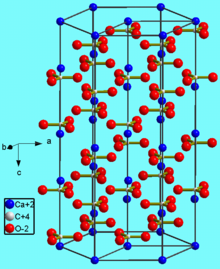
Карбонат кальция находится в минералах в виде полиморфов:
Тригональная кристаллическая структура кальцита является наиболее распространенной.
Минералы карбоната кальция находятся в следующих горных породах:
Залежи карбоната кальция в виде меловых пластов — отложений известковых раковин моллюсков, в основном, мелового периода является распространенным минералом на всех континентах.
В природе встречаются три кристаллические модификации (минералы с одинаковым химическим составом, но с различной кристаллической структурой): кальцит, арагонит и фатерит (ватерит).
Некоторые горные породы (известняк, мел, мрамор, травертин и другие известковые туфы) практически полностью состоят из карбоната кальция с различными примесями.
Кальцит является устойчивой кристаллической модификацией карбоната кальция и встречается в самых разнообразных геологических условиях: в осадочных, метаморфических и магматических горных породах.
Около 10 % всех осадочных пород составляют известняки, сложенные преимущественно кальцитовыми остатками раковин морских организмов. Арагонит является второй по распространённости кристаллической модификацией CaCO3 и в основном формируется в раковинах моллюсков и скелетах некоторых других организмов[каких?].
Также арагонит может образовываться и в неорганических процессах, например в карстовых пещерах или гидротермальных источниках.
Фатерит является наименее стабильной разновидностью этого карбоната, и очень быстро превращается в воде либо в кальцит, либо в арагонит. В природе встречается относительно редко, когда его кристаллическая структура стабилизирована теми или иными примесями.
Подавляющее количество карбоната кальция, добывающееся из полезных ископаемых, используется в промышленности. Чистый карбонат кальция (например, для производства продуктов питания или использования в фармацевтических целях), может быть изготовлен из природного минерала с малым количеством вредных примесей, например, из мрамора.
В лаборатории карбонат кальция может быть приготовлен предварительным гашением оксида кальция — негашеной извести. При этом образуется гидроксид кальция, и затем в суспензию продувается углекислый газ для получения карбоната кальция[2]:
- CaO+h3O⟶Ca(OH)2,{\displaystyle {\mathsf {CaO+H_{2}O\longrightarrow Ca(OH)_{2}}},}
- Ca(OH)2+CO2⟶CaCO3+h3O.{\displaystyle {\mathsf {Ca(OH)_{2}+CO_{2}\longrightarrow CaCO_{3}+H_{2}O}}.}
При нагревании до 900—1000 °C разлагается на кислотный оксид — углекислый газ CO2 и основный оксид — негашёную известь CaO:
- CaCO3⟶CaO+CO2↑.{\displaystyle {\mathsf {CaCO_{3}\longrightarrow CaO+CO_{2}\uparrow }}.}
Растворяется в воде при избытке углекислого газа образуя кислую соль — гидрокарбонат кальция Ca(HCO3)2:
- CaCO3+CO2+h3O⟶Ca(HCO3)2.{\displaystyle {\mathsf {CaCO_{3}+CO_{2}+H_{2}O\longrightarrow Ca(HCO_{3})_{2}}}.}.
Из-за этой реакции образуются сталактиты, сталагмиты. Природные подземные воды, обильные углекислом газом, растворяют плохо растворимый карбонат кальция с образованием много лучше растворимого в воде гидрокарбоната кальция, при выделении подземной воды в виде капель с потолков пещер при попадании в воздух с низкой концентрацией углекислого газа происходит обратная реакция превращения гидрокарбоната кальция в плохо растворимый осадок карбоната кальция, образующего красивые природные формы в пещерах, и из-за этого же механизма образуются карстовые пещеры.
При обжиге с температурой свыше 1500 °C с углеродом, например, в форме кокса, образует карбид кальция и угарный газ:
- CaCO3+4C⟶CaC2+3CO↑{\displaystyle {\mathsf {CaCO_{3}+4C\longrightarrow CaC_{2}+3CO\uparrow }}}.



