Реакция обмена — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 23 января 2016; проверки требуют 4 правки. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 23 января 2016; проверки требуют 4 правки.Реакция обмена, реакция метатезиса — химическая реакция между двумя соединениями, при которой проходит обмен между обоими реагентами, реакционными группами или ионами.
- A−B + C−D⟶A−D + C−B{\displaystyle \mathrm {A{-}B\ +\ C{-}D\longrightarrow A{-}D\ +\ C{-}B} }
В неорганической химии при реакции обмена, например, обмениваются катионы двух солей своими анионами:
- AgNO3(aq)+NaCl(aq)⟶AgCl(s)+NaNO3(aq){\displaystyle {\mathsf {AgNO_{3(aq)}+NaCl_{(aq)}\longrightarrow AgCl_{(s)}+NaNO_{3(aq)}}}}
- При замене нитрат-ионов на ионы хлора в водном растворе выпадает осадок хлорида серебра.
В органической химии в реакции метатезиса участвуют радикалы. Реакцию впервые наблюдал в 1950 годах при полимеризации этилена Карл Циглер. Работы Ива Шовена из Института Нефти Франции раскрывают механизм этих реакций и их применение в промышленности.

Реакция используется в промышленном масштабе (например корпорацией Royal Dutch Shell в Shell Higher Olefin Process) уже с 70-х годов 20 века.
Проведение сложного органического синтеза стало возможным с разработкой в 1990-х годах стабильных катализаторов Робертом Граббсом и Ричардом Шроком.
Наряду с проведением обычных реакций в нефтехимии благодаря новым катализаторам стало возможным проведение сложных кольцевых реакций обмена[1] при синтезе сложных циклических соединений для производства гормонов, антибиотиков, феромонов, гербицидов. Роберт Граббс, Ричард Шрок и Ив Шовен в 2005 году за их работу по химии комплексов металлкарбенов и их применении в каталитических олефиновых реакциях метатезиса были удостоены Нобелевской премии по химии.
- ↑ Alois Fürstner, Oliver R. Thiel, Lutz Ackermann, Hans-Jörg Schanz, and Steven P. Nolan: Ruthenium Carbene Complexes with N,N‘-Bis(mesityl)imidazol-2-ylidene Ligands: RCM Catalysts of Extended Scope, J. Org. Chem., 2000, 65, 2204—2207,DOI: 10.1021/jo9918504.
Реакции ионного обмена — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 20 апреля 2015; проверки требуют 26 правок. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 20 апреля 2015; проверки требуют 26 правок.Реакция ионного обмена
Химические реакции в растворах электролитов (кислот, оснований и солей) протекают при участии ионов. Ионными уравнениями могут быть изображены любые реакции, протекающие в полярных растворах между электролитами. Если при таких реакциях не происходит изменения зарядов ионов (не изменяется степень окисления), то они называются ионообменными.
Реакцию обмена в растворе можно выразить тремя видами уравнений: молекулярным, полным ионным и сокращённым ионным. В ионном уравнении слабые электролиты, газы и малорастворимые вещества изображают молекулярными формулами.
1. Запишем уравнение реакции в молекулярной форме:
FeCl3+3NaOH⟶Fe(OH)3↓+3NaCl{\displaystyle {\ce {FeCl3 + 3NaOH -> Fe(OH)3 v + 3NaCl}}}
2. Перепишем это уравнение, изобразив хорошо диссоциирующие вещества в виде ионов:
Fe3++3Cl−+3Na++3OH−⟶Fe(OH)3↓+3Na++3Cl−{\displaystyle {\ce {Fe^3+ + 3Cl^- + 3Na^+ + 3OH^- -> Fe(OH)3 v + 3Na^+ + 3Cl^-}}}
Это ионное уравнение реакции.
3. Исключим из обеих частей ионного уравнения одинаковые ионы, т.е. ионы, не участвующие в реакции, и запишем уравнение реакции в окончательном виде:
Fe3++3OH−⟶Fe(OH)3↓{\displaystyle {\ce {Fe^3+ + 3OH^- -> Fe(OH)3 v}}}
Это сокращенное ионное уравнение реакции. Как видно из этого уравнения, сущность реакции сводится к взаимодействию ионов Fe3+ и OH—, в результате чего образуется осадок Fe(OH)3. При этом вовсе не имеет значения, в состав каких электролитов входили эти ионы до их взаимодействия.
Правила написания реакций ионного обмена[править | править код]
- При написании ионных уравнений следует обязательно руководствоваться таблицей растворимости кислот, оснований и солей в воде, то есть обязательно проверять растворимость реагентов и продуктов, отмечая это в уравнениях.
- Следует иметь в виду, что реакции двойного обмена между солями с образованием осадков протекают во всех тех случаях, когда растворимость реагентов выше, чем растворимость одного из продуктов.
- Для получения малорастворимого вещества всегда надо выбирать хорошо растворимые реагенты и использовать достаточно концентрированные растворы.
Ионный обмен — Википедия
Материал из Википедии — свободной энциклопедии
Ионный обмен — это обратимая химическая реакция, при которой происходит обмен ионами между твердым веществом (ионитом) и раствором электролита. Ионный обмен может происходить как в гомогенной среде (истинный раствор нескольких электролитов), так и в гетерогенной, в которой один из электролитов является твёрдым (при контакте раствора электролита с осадком, ионитом и др.).
Катио́нный обмен — частный случай ионного обмена, под которым в химии понимают обратимый процесс стехиометрического обмена ионами между двумя контактирующими фазами.
Ионный обмен основан на использовании ионитов — сетчатых полимеров разной степени сшивки, гелевой микро- или макропористой структуры, ковалентно связанных с ионогенными группами. Обменивающиеся ионы называются противоионами. Иониты состоят из неподвижного каркаса — матрицы и функциональных групп — фиксированных ионов, которые жестко прикреплены к матрице и взаимодействуют с противоионами. В зависимости от знака заряда противоионов иониты делят на катиониты и аниониты. Если противоионы заряжены положительно, то они являются катионами (например, ионы водорода Н+ или ионы металлов), ионит называют катионитом. Если противоионы заряжены отрицательно, то есть являются анионами (например, ион гидроксила ОН- или кислотные остатки), ионит называют анионитом.
Кинетика ионного обмена определяет скорость протекания ионообменной реакции. На скорость ионного обмена влияют следующие факторы:
- доступность фиксированных ионов внутри каркаса ионита,
- размер гранул ионита,
- температура,
- концентрация раствора и т. д.
Общая скорость процесса ионного обмена может быть представлена как совокупность процессов, происходящих в растворе (диффузия противоионов к зерну и от зерна ионита) и в ионите (диффузия противоионов от поверхности к центру зерна ионита и в обратном направлении; обмен противоионов ионита на противоионы из раствора). В условиях, приближенных к реальным условиям очистки воды, доминирующим фактором, определяющим скорость ионного обмена, является диффузия ионов внутри зерна ионита. Следовательно, скорость ионного обмена, прежде всего, зависит от размера зерна ионита и увеличивается с уменьшением размера зерна. В зависимости от природы матрицы различают неорганические и органические иониты.
Кроме того, под ионным обменом подразумевают:
- Реакции и процессы разделения, выделения и очистки веществ, проводимые с применением ионообменных материалов: ионообменных смол, цеолитов, и др.
- Процессы обмена ионов между почвами и содержащейся в них (омывающей их) водой.
Реакции замещения — Википедия
Реакции замещения (англ. substitution reaction) — химические реакции, в которых одни функциональные группы, входящие в состав химического соединения, меняются на другие группы. Реакции замещения обозначают английской буквой «S».
Общий вид реакций замещения:
R−X+Y−Z→R−Y+X−Z{\displaystyle {\mathsf {R\!\!-\!\!X+Y\!\!-\!\!Z}}\rightarrow {\mathsf {R\!\!-\!\!Y+X\!\!-\!\!Z}}}
Обычно, один из реагентов, в котором происходит замещение («R-X»), называют субстратом, а другой («Y-Z») — атакующим реагентом. Группа «X» называется уходящей, а группа «Y» — вступающей[1].
Примером реакции замещения может служить фотолитическое хлорирование метана:
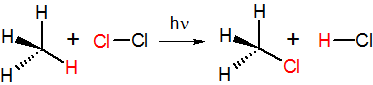
В зависимости от способа расщепления связи, реакции замещения делятся на гомолитические (радикальные) и гетеролитические. Последние, в свою очередь, из-за типа атакующего реагента относят к нуклеофильным или электрофильным реакциям[2].
В органической химии реакции замещения имеют важнейшее значение. Детальное изучение типового механизма реакции позволяет не просто предсказать её результат для конкретных реагентов, но и получить представление о выборе оптимальных температурных условий её протекания, подборе растворителя или возможного катализатора.
В реакциях нуклеофильного замещения атакующей частицей является нуклеофил, то есть отрицательно заряженная частица или частица со свободной электронной парой. Уходящая группа носит название нуклеофуг.
Реакции нуклеофильного замещения более характерны для алифатических систем.
Общий вид реакций нуклеофильного замещения:
R−X+Y−→R−Y+X−{\displaystyle {\mathsf {R\!\!-\!\!X+Y^{-}}}\rightarrow {\mathsf {R\!\!-\!\!Y+X^{-}}}}
Реакции нуклеофильного замещения обозначаются «SN». Обычно, разделяют реакции алифатического (SN) и ароматического (SNAr) нуклеофильного замещения.
Наиболее распространено два типа механизмов реакций нуклеофильного замещения[3]:
- SN1 — мономолекулярное нуклеофильное замещение: двухстадийный процесс — на первой (медленной) стадии образуется промежуточный карбкатион, который на второй (быстрой) стадии реагирует с нуклеофилом.
- SN2 — бимолекулярное нуклеофильное замещение: одностадийный процесс без образования интермедиата.
Примером реакции нуклеофильного замещения может служить гидролиз алкилгалогенидов:
C2H5−Br+OH−→C2H5−OH+Br−{\displaystyle {\mathsf {C_{2}H_{5}\!\!-\!\!Br+OH^{-}}}\rightarrow {\mathsf {C_{2}H_{5}\!\!-\!\!OH+Br^{-}}}}
Наиболее распространенные нуклеофильные группы[4]:
HO−,RO−,RCOO−,Nh3−,RNH−,R2N−,HS−,RS−,F−,Cl−,Br−,I−.{\displaystyle {\mathsf {HO^{-},RO^{-},RCOO^{-},NH_{2}^{-},RNH^{-},R_{2}N^{-},HS^{-},RS^{-},F^{-},Cl^{-},Br^{-},I^{-}.}}}
h3O, Nh4, R3N, R2S, R3P, ROH, RCOOH.{\displaystyle {\mathsf {H_{2}O,\ NH_{3},\ R_{3}N,\ R_{2}S,\ R_{3}P,\ ROH,\ RCOOH.}}}
В реакциях электрофильного замещения атакующей частицей является электрофил, то есть положительно заряженная частица или частица с дефицитом электронов. Уходящая частица носит название электрофуг.
Реакции электрофильного замещения более характерны для ароматических систем.
Общий вид реакций электрофильного замещения:
R−X+Y+→R−Y+X+{\displaystyle {\mathsf {R\!\!-\!\!X+Y^{+}}}\rightarrow {\mathsf {R\!\!-\!\!Y+X^{+}}}}
Реакции электрофильного замещения обозначаются «SE».
Для ароматических систем существует только один (основной) механизм электрофильного замещения SEAr, который включает в себя образование промежуточного положительно заряженного интермедиата, у которого на второй стадии отщепляется уходящая группа[3].
У алифатических соединений встречаются как механизмы SE1, так и SE2, аналогичные механизмам SN1 и SN2.
Пример реакции электрофильного замещения:

Наиболее распространенные электрофильные группы:
H+,RCO+,R+,RN2+,R2NH+,NO2+,Li+,Cl+,Br+,I+.{\displaystyle {\mathsf {H^{+},RCO^{+},R^{+},RN_{2}^{+},R_{2}NH^{+},NO_{2}^{+},Li^{+},Cl^{+},Br^{+},I^{+}.}}}
В реакциях радикального замещения атакующей частицей являются свободные радикалы.
Общий вид реакций радикального замещения:
R−X+Y⋅→R−Y+X⋅{\displaystyle {\mathsf {R\!\!-\!\!X+Y}}\cdot \rightarrow {\mathsf {R\!\!-\!\!Y+X}}\cdot }
Реакции радикального замещения обозначаются «SR».
Примером реакции радикального замещения может служить приведенная выше реакция хлорирования метана.