молярная масса, закон Авогадро, массовая доля элемента
Молярная масса
Количество вещества 1 моль, то есть порция, которая обязательно содержит 6,02 ∙ 1023 частиц, обладает массой, характерной именно для данного вещества. Так, 1 моль углерода отвечает массе 12 г, 1 моль воды H2O – массе 18 г. Эту характеристику вещества – массу одного моля вещества – называют молярной массой и обозначают М. Очевидно, если порция вещества будет 2 моль, то масса этой порции окажется в 2 раза больше значения М для данного вещества.
 Молярная масса вещества В – это отношение массы данной порции вещества mВк количеству вещества nВв этой порции:
Молярная масса вещества В – это отношение массы данной порции вещества mВк количеству вещества nВв этой порции:
Единица молярной массы – г/моль.
Рассмотрим некоторые примеры: МС = 12 г/моль, М(H2O) = 18 г/моль.
Отметим тот важный факт, что молярная масса данного вещества М всегда численно равна его относительной молекулярной массе Mr (для атомного вещества – относительной атомной массе Ar). Иными словами, для расчета М нужно вычислить значение Mr данного вещества по Периодической системе и приписать ему единицу г/моль:
Н Ar = 1 М = 1 г/моль;
Cа Ar = 40 М = 40 г/моль.
Все указные массовые порции веществ содержат 1 моль
этих веществ или 6,02 ∙ 1023 их формульных единиц.Закон Авогадро. Молярный объем газа. Относительная плотность газа
В химических расчетах объемами газов часто заменяют массу газообразных реагентов и продуктов. Основной газовый закон – это закон Авогадро: при одинаковых температуре и давлении в равных объемах различных газов содержится одно и то же число молекул.
В 1811 году итальянским физикохимиком А. Авогадро закон был высказан как гипотеза и интерпретирован в 1858 году итальянским химиком С. Канниццаро с позиции атомно-молекулярного учения.
Первое следствие из закона Авогадро говорит о том, что равные количества различных газов при одинаковых условиях занимают равные объемы.
В частности, при нормальных условиях, то есть при температуре
В некоторых случаях – при определенных условиях – молярный объем газа Vм равен отношению объема порции газа В (Vв) к количеству вещества в этой порции (nв): Vм = Vв/ nв.
Единица молярного объема газа – это л/моль.
При нормальных условиях Vм = 22,4 л/моль. Эту константу следует запомнить.
Из определения Vмследует, что Vв = Vмnв = Vм(mВ/МВ ).
Это выражение позволяет пересчитывать массы газов в их объемы.
Второе следствие из закона Авогадро гласит, что молярная масса вещества В в газообразном состоянии равна его удвоенной плотности по водороду, то есть
МВ = М(Н2)∙D(Н2) = 2D(Н2) [г/моль].
Аналогично, с учетом средней молярной массы воздуха Мвозд = 29 г/моль имеем: МВ = Мвозд ∙ Dвозд = 29Dвозд [г/моль].
Относительная плотность по водороду D(Н2), по воздуху Dвозд и по любому иному газу определяется посредством эксперимента, а затем только рассчитывается молекулярная масса газа.
Массовая доля элемента в сложном веществе
Массовые доли элементов, входящих в сложное вещество, определяют по известной химической формуле
В общей массе сложного вещества массовая доля элемента (wэ) – это отношение массы, которая приходится на этот элемент (то есть массы части), к массе всего вещества (то есть к массе целого): wэ = mэ / mвещ. Массовая доля элемента – это доля от единицы или от 100 %.
В сложном веществе массовая доля элемента всегда меньше единицы (wэ < 1 или 100 %), например, для воды Н2О: wн = 0,11 (11 %) и wо = 0,89 (89 %).
(89 %).
Сумма массовых долей всех элементов, входящих в сложное вещество, равна 1 (или 100 %).
Например, для воды: wн + wо = 0,11 + 0,89 = 1 (100 %).
Обычно для расчета wэпорцию вещества берут равной молярной массе; масса данного элемента в этой порции равна его молярной массе, умноженной на число атомов данного элемента в молекуле. Для двухэлементного вещества АаВb:
wА = mА / mвещ = аМА / Мвещ и wВ = mВ / mвещ = bМВ / Мвещ
Причем wВ можно также определить по выражению: wВ = 1 – wА
Аналогичные формулы используются для многоэлементных веществ.
© blog.tutoronline.ru, при полном или частичном копировании материала ссылка на первоисточник обязательна.
Массовая доля (также называют процентной концентрацией)
Массовая доля — отношение массы растворённого вещества к массе раствора. Массовая доля измеряется в долях единицы.
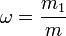 ,
,
где:
m1 — масса растворённого вещества, г ;
m — общая масса раствора, г .
Массовое процентное содержание компонента, m%
m%=(mi/Σmi)*100
В бинарных растворах часто существует однозначная (функциональная) зависимость между плотностью раствора и его концентрацией (при данной температуре). Это даёт возможность определять на практике концентрации важных растворов с помощью денсиметра (спиртометра, сахариметра, лактометра). Некоторые ареометры проградуированы не в значениях плотности, а непосредственно концентрации раствора (спирта, жира в молоке, сахара). Следует учитывать, что для некоторых веществ кривая плотности раствора имеет максимум, в этом случае проводят 2 измерения: непосредственное, и при небольшом разбавлении раствора.
Часто для выражения концентрации (например, серной кислоты в электролите аккумуляторных батарей) пользуются просто их плотностью. Распространены ареометры(денсиметры, плотномеры), предназначенные для определения концентрации растворов веществ.
Объёмная доля
Объёмная доля — отношение объёма растворённого вещества к объёму раствора. Объёмная доля измеряется в долях единицы или в процентах.
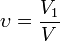 ,
,
где:
V1 — объём растворённого вещества, л;
V — общий объём раствора, л.
Как было указано выше, существуют ареометры, предназначенные для определения концентрации растворов определённых веществ. Такие ареометры проградуированы не в значениях плотности, а непосредственно концентрации раствора. Для распространённых растворов этилового спирта, концентрация которых обычно выражается в объёмных процентах, такие ареометры получили название спиртомеров или андрометров.
Молярность (молярная объёмная концентрация)
Молярная концентрация — количество растворённого вещества (число молей) в единице объёма раствора. Молярная концентрация в системе СИ измеряется в моль/м³, однако на практике её гораздо чаще выражают в моль/л или ммоль/л. Также распространено выражение в «молярности». Возможно другое обозначение молярной концентрации CM , которое принято обозначать М. Так, раствор с концентрацией 0,5 моль/л называют 0,5-молярным. Примечание: единица «моль» не склоняется по падежам. После цифры пишут «моль», подобно тому, как после цифры пишут «см», «кг» и т. д.
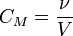
где:
ν — количество растворённого вещества, моль;
V — общий объём раствора, л.
Нормальная концентрация (мольная концентрация эквивалента)
Нормальная концентрация — количество эквивалентов данного вещества в 1 литре раствора. Нормальную концентрацию выражают в моль-экв/л или г-экв/л (имеется в виду моль эквивалентов). Для записи концентрации таких растворов используют сокращения «н» или «N». Например, раствор содержащий 0,1 моль-экв/л, называют децинормальным и записывают как 0,1 н.
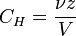 ,
,
где:
ν — количество растворённого вещества, моль;
V — общий объём раствора, л;
z — число эквивалентности.
Нормальная
концентрация может отличаться в
зависимости от реакции, в которой
участвует вещество. Например, одномолярный
раствор H2SO4 будет
однонормальным, если он предназначается
для реакции со щёлочью с образованием
гидросульфата KHSO
studfile.net
Как найти массовую долю химического элемента по формуле вещества?
Как найти массовую долю вещества 1. Прочитайте внимательно задачу. Кратко с левой стороны страницы запишите ее данные с использованием буквенных обозначений и формул химических веществ, если они есть. Определите из вопроса задачи, что нужно найти. 2. Запишите с правой стороны листа общую формулу массовой доли растворенного вещества ω = m1 / m, где m1 – масса растворенного вещества, а m – масса всего раствора. Если содержание массовой доли растворенного вещества нужно узнать в процентах, умножьте полученное число на 100%: ω = m1 / m х 100% 3. В задачах, где нужно вычислить массовые доли каждого из элементов, входящих в состав химического вещества, используйте таблицу Д. И. Менделеева. Например, узнайте массовые доли каждого из элементов, входящих в состав углеводорода, формула которого C6h22 m (C6h22) = 6 х 12 + 12 х 1= 84 г/моль ω (С) = 6 m1(С) / m (C6h22) х 100% = 6 х 12 г / 84 г/моль х 100% = 85% ω (Н) = 12 m1(Н) / m (C6h22) х 100% = 12 х 1 г / 84 г/моль х 100% = 15% 4. Выпишите ответ задачи. «Расчёт массовой доли химических элементов по формуле вещества» . interneturok.ru/…/urok_18_raschet_massovoj_doli_himicheskih_ele…
посмотрите тему урока в книге обычно примеры решения задачи бывают там
touch.otvet.mail.ru