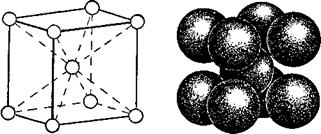
7.2. Строение и структура металлов
Металлы относятся к твердым телам кристаллического строения.
Твердое тело — это агрегатное состояние вещества, характеризующееся стабильностью формы и объема. По своему внутреннему строению твердые тела разделяются на кристаллические и аморфные.
Кристаллы — это твёрдые тела, частицы которых располагаются в строгом порядке, образуя пространственные периодически повторяющиеся структуры.
Точнее, частицы колеблются около определенных положений равновесия. Если их мысленно соединить прямыми линиями, то получается своего рода «скелет» кристалла. Такое изображение кристалла называется кристаллической решеткой.
Теоретически доказано, что всего может существовать 230 различных пространственных кристаллических структур.
Большинство из них (но не все) обнаружены в природе или созданы искусственно.
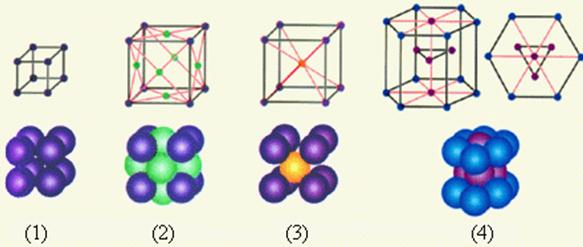
Рис. 7.1. Виды кристаллического строения металлов
На рис. 7.1. приведены примеры простых кристаллических решеток: 1 – простая кубическая решетка; 2 – гранецентрированная кубическая решетка; 3 – объемно-центрированная кубическая решетка; 4 – гексагональная решетка.
Металлы имеют относительно сложные типы кубических решеток — объемно центрированная (ОЦК) и гранецентрированная (ГЦК) кубические решетки.

Рис. 7.2. Объемно-центрированная кристаллическая решетка
Основу ОЦК-решетки составляет элементарная кубическая ячейка (рис.7.2.), в которой положительно заряженные ионы металла находятся в вершинах куба, и еще один атом в центре его объема, т. е. на пересечении его диагоналей. Такой тип решетки в определенных диапазонах температур имеют железо, хром, ванадий, вольфрам, молибден и др. металлы.
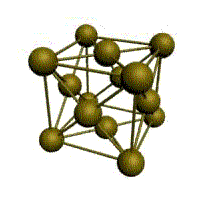
Рис.7.3. Гранецентрированная кристаллическая решетка
В гранецентрированной кристаллической решетке (ГЦК-решетки) (рис.7.3) элементарной ячейкой служит куб с центрированными гранями. Подобную решетку имеют железо, алюминий, медь, никель, свинец и др. металлы.

Рис.7.4. Гексагональная плотноупакованная кристаллическая решетка
Третьей распространенной разновидностью плотноупакованных решеток является гексагональная плотноупакованная (ГПУ, рис.7.4). ГПУ-ячейка состоит из отстоящих друг от друга на параметр с параллельных центрированных гексагональных оснований. Три иона (атома) находятся на средней плоскости между основаниями.
В гексагональных решетках отношение параметра с/а всегда больше единицы. Такую решетку имеют магний, цинк, кадмий, бериллий, титан и др.
Компактность кристаллической решетки или степень заполненности ее объема атомами является важной характеристикой. Она определяется такими показателями, как параметр решетки, число атомов в каждой элементарной ячейке, координационное число и плотность упаковки.
Параметр решетки – это расстояние между атомами по ребру элементарной ячейки. Параметры решетки измеряются в нанометрах (1 нм = 10-9 м = 10 Å). Параметры кубических решеток характеризуются длиной ребра куба и обозначаются буквой а.
Для характеристики гексагональной решетки принимают два параметра – сторону шестигранника а и высоту призмы с. Когда отношение с/а = 1,633, то атомы упакованы наиболее плотно, и решетка называется гексагональной плотноупакованной (рис. 7.4). Некоторые металлы имеют гексагональную решетку с менее плотной упаковкой атомов (с/а > 1,633). Например, для цинка с/а = 1,86, для кадмия с/а = 1,88.
Параметры, а кубических решеток металлов находятся в пределах от 0,286 до 0,607 нм. Для металлов с гексагональной решеткой, а лежит в пределах 0,228-0,398 нм, а с в пределах 0,357- 0,652 нм.
Параметры кристаллических решеток металлов могут быть измерены с помощью рентгеноструктурного анализа.
При подсчете числа атомов в каждой элементарной ячейке следует иметь в виду, что каждый атом входит одновременно в несколько ячеек. Например, для ГЦК-решетки, каждый атом, находящийся в вершине куба, принадлежит 8 ячейкам, а атом, центрирующий грань, двум. И лишь атом, находящийся в центре куба, полностью принадлежит данной ячейке.
Таким образом, ОЦК — и ГЦК-ячейки содержат соответственно 2 и 4 атома.
Под координационным числом понимается количество ближайших соседей данного атома.
2. Структура и свойства металлов
2.1 Общая характеристика и классификация металлов
В технике под металлами понимают материалы, обладающие целым комплексом специфических физических, химических, технологических, эксплуатационных и механических свойств.
Физические свойстваотражают поведение материалов в различных тепловых, электромагнитных и гравитационных полях. К наиболее характерным физическим свойствам металлов следует отнести металлический блеск, высокую электро- и теплопроводность, способность испускать электроны при нагреве, а также сравнительно высокую плотность большинства металлов.
Химические свойстваотражают способность материалов взаимодействовать с другими веществами. С точки зрения химических свойств металлы это химические элементы, расположенные в левой части таблицы Менделеева. Атомы этих элементов содержат на внешней электронной оболочке небольшое число электронов, слабо связанных с ядром. Вступая в химические взаимодействия с неметаллами, атомы металлов легко отдают им свои внешние валентные электроны и становятся положительно заряженными ионами.
Технологические свойстваотражают способность материалов подвергаться тому или иному виду обработки. К наиболее характерным технологическим свойствам металлов следует отнести их относительно хорошую деформируемость (в частности, штампуемость и ковкость), а также хорошую свариваемость и возможность получать изделия методом литья.
Эксплуатационные свойства характеризуют поведение материалов в реальных условиях эксплуатации. Среди эксплуатационных свойств металлов можно выделить их неплохую износостойкость.
Механические свойстваотражают способность материалов сопротивляться деформации и разрушению под воздействием различного рода нагрузок. К наиболее характерным механическим свойствам металлов относят их достаточно высокую пластичность и вязкость, а также твёрдость и прочность.
Физические и химические свойства металлов наиболее подробно изучаются в рамках дисциплин «Физика» и «Химия». Материаловедение большее внимание уделяет механическим и технологическим свойствам материалов.
Все металлы делят на две большие группы: на чёрные металлы и цветные металлы.
Чёрные металлы отличаются специфическим темно-серым цветом, высокой температурой плавления и относительно высокой твёрдостью. Цветные металлы имеют характерную белую, желтую или красную окраску, и отличаются от чёрных металлов большей пластичностью, меньшей твёрдостью и невысокой температурой плавления.Чёрные металлы, в свою очередь, подразделяют на 5 групп:
1. Металлы группы железа – Fe, Cо, Ni и Mn.
Fe составляет основу самых распространённых в промышленности сплавов – сталей и чугунов. Остальные металлы этой группы применяются либо в качестве добавок к железоуглеродистым сплавам, либо в качестве основы для соответствующих сплавов (кобальтовых, никелевых и т.п.).
2. Тугоплавкие металлы – Ti, V, Cr, Mo, W и др.
Металлы этой группы имеют температуру плавления выше, чем у железа, т.е. более 1539°С. Их обычно используют в качестве добавок к легированным сталям, либо в качестве основы для специальных сплавов (например, титановых или хромовых). Вольфрам в чистом виде используют для изготовления нитей накала электроламп.
3. Урановые металлы или актиноиды – Ac, Th и т.д. Применяются, как правило, для изготовления сплавов, используемых в атомной энергетике.
4. Редкоземельные металлы или лантаноиды – La, Ce и т.д. Эти металлы обычно встречаются в смешанном виде и имеют близкие свойства. Их используют для изготовления специальных сплавов, обладающих особыми физическими и иными свойствами.
5. Щелочные металлы – Li, Na, K и т.д. Отличаются высокой химической активностью и поэтому в свободном виде не используются.
Цветные металлы подразделяют на 3 группы:
1. Легкие металлы – Al, Mg, Be. Обладают сравнительно низкой плотностью. Al из-за своей высокой электропроводности широко применяется для изготовления электропроводов. Кроме того, Al используют для получения алюминиевых сплавов, широко применяемых в машиностроении.
2. Благородные металлы – Ag, Au, Pt и т.д. в том числе Cu. Данные металлы отличаются высокой пластичностью, электропроводностью и коррозионной стойкостью. Благодаря этим свойствам они широко применяются в микроэлектронике и ювелирном деле. Медь используют также для получения бронз и латуней. Слитки благородных металлов, размещённые в банках, играют роль фактических денег.
3. Легкоплавкие металлы – Sn, Pb, Zn, Hg и т.д. Имеют сравнительно низкую температуру плавления. Температура плавления ртути (Hg) ниже комнатной и поэтому данный металл в обычных условиях является жидким. Sn и Pb используют для изготовления припоев, те сплавов, служащих для соединения деталей методом пайки.
Наиболее распространенным металлом на земном шаре является алюминий (8,8%). На втором месте находится железо (4,65%), которое к тому же является одним из наиболее дешёвых металлов.
СТРОЕНИЕ МЕТАЛЛОВ И СПЛАВОВ
РЕДКИЕ МЕТАЛЛЫ
Еталлы, как и все окружающие нас тела, состоят из отдельных невидимых даже в самый сильный микроскоп частиц, называемых атомами. Но атомы в свою очередь построены из ещё более мелких частиц: протонов, электронов и нейтронов. Протоны и электроны имеют электрические заряды: протон — положительный заряд, а электрон — отрицательный, нейтрон же не имеет никакого электрического заряда.
Если два протона «находятся близко, они отталкиваются друг от друга, так как они заряжены одноимённым электричеством. Так же ведут себя и два электрона. Напротив, протон и электрон притягиваются друг к другу, причём силы взаимного притяжения протона и электрона равны между собой, т. е. протон обладает элементарным электрическим зарядом, равным заряду электрона.
Атом в нормальном состоянии, т. е. когда он содержит одинаковое количество протонов и электронов, не обладает электрическим зарядом. Но бывают такие состояния атома, когда он приобретает или теряет электроны. Тогда атом становится электрически заряженным. При избытке электронов атом заряжен отрицательным электричеством, а при нехватке электронов он заряжен положительным электричеством. Вот такие атомы, в которых имеется избыток или недостаток электронов, называются ионами.
Как же располагаются элементарные частицы в атоме?
В настоящее время считают, что атом построен следующим образом. Протоны и нейтроны составляют ядро, находящееся в центре атома. Вокруг ядра обращаются электроны, которые образуют электронную оболочку атома. В каждом атоме количество электронов равно количеству протонов.
Электроны в электронной оболочке расположены слоями. В каждом слое может поместиться лишь опреде* лённое количество электронов. Первый слой, окружающий непосредственно ядро, может вместить лишь два электрона, второй слой — 8, третий — от 8 до 18 электронов. Каждый новый слой электронов при переходе от одного атома к другому образуется обычно после заполнения близлежащего к ядру внутреннего слоя.
Например, ядро атома натрия, как установлено, имеет 11 протонов, а его 11 электронов распределены в трёх оболочках: в первой — 2, во второй — 8 и в третьей —
1 электрон. Ядро атома рубидия содержит 37 протонов и окружено 37 электронами, котс^рые расположены в пяти оболочках: в первой — 2, во второй — 8, в третьей—18, в четвёртой — 8, в пятой — 1 электрон. Ещё более сложное строение имеет атом урана. Его ядро содержит 92 протона, а в электронной оболочке имеется 92 электрона.
Протон и нейтрон почти одинаковы по весу, а электрон почти в 1840 раз легче протона. Значит, основная масса атома содержится в его ядре. Чем большее количество нейтронов и протонов содержится в ядре, тем больший вес имеет атом.
Вес атома, например, в граммах выражать очень неудобно: потребовалось бы писать десятки нулей после запятой. Поэтому ввели понятие об относительном весе атомов, об атомном весе. Вначале за единицу был принят атомный вес водорода; с ним сравнивали атомные веса всех других элементов.
Стройную систему химических элементов создал великий русский химик Д. И. Менделеев в 1869 году, на основе открытого им периодического закона.
Сущность закона Менделеева состоит в том, что все химические элементы, расположенные один за другим в порядке возрастания атомных весов, образуют ряд, в котором химические свойства элементов через определённое количество элементов периодически повторяются.
Д. И. Менделеев расположил химические элементы в своей таблице так, что элементы, помещённые в одних и тех же вертикальных столбцах, обладают сходными химическими свойствами. Зная место элемента в таблице, можно определить большинство химических свойств элемента и его соединений. Каждый химический элемент в таблице Менделеева имеет порядковый номер. Его теперь называют числом Менделеева. Этот номер указывает число протонов в ядре. В одни и те же вертикальные столбцы таблицы попадают атомы с одинаковым числом электронов во внешней оболочке.
В зависимости от числа электронов во внешней оболочке меняются химические и физические свойства элемента.
Атомы одного и того же элемента, отличающиеся друг от друга лишь числом нейтронов в ядре, называются изотопами. «Изотоп» — греческое слово. Оно обозначает «занимающий одно и то же место». Изотопы каждого элемента располагаются в одной и той же клетке таблицы Менделеева, поскольку заряд ядра (количество прогонов) у изотопов одного и того же элемента одинаков. Металлы в отличие от жидких и газообразных тел в обычных условиях являются кристаллическими телами. Кристалл — это правильная фигура, ограниченная плоскими поверхностями.
Внутреннее строение кристаллов в настоящее время изучено довольно хорошо с помощью рентгеновских лучей. Освещая ими кристаллы, получают рентгенограмму, т. е. картину на фотопластинке, по которой определяют расположение атомов в кристаллической решётке и расстояния между ними. Рентгенограммы показали, что ионы металлов «укладываются» в кристалле примерно так же, как располагаются в ящике твёрдые шары.
Атомы разных металлов образуют неодинаковые кристаллические решётки. Чаще всего встречаются три типа решёток.
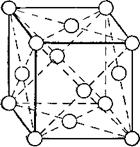
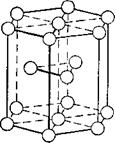
Первый тип — кубическая объёмноцентрированная решётка (рис. 1). Атомы металла в такой решётке находятся в вершинах и центре куба. Каждый атом окружён
Рис. 1. Кубическая объёмноцентрированная кристаллическая решётка Металла. |
Восемью атомами. Такую решётку имеют металлы ванадий, вольфрам, молибден, литий, хром и другие.
Второй тип решётки — кубическая гранецентрирован — иая (рис. 2). Атомы металла в ней расположены по вершинам граней куба. Такой решёткой обладают, например, алюминий, свинец, золото, серебро, никель, торий.
Третий тип — гексагональная (шестиугольная) плотно упакованная решётка (рис. 3). Она встречается у цинка, магния, кадмия, бериллия.
На рис. 1—3 атомы условно изображены в виде шариков. В зависимости от типа решётки атомы занимают в ней больше или меньше места. Например, в кубической объёмноцентрированной решётке атомы занимают 68% пространства, а в кубической гранецентрированной—74%.
Расположение атомов в кристаллической решётке оказывает большое влияние на свойства металла.
У некоторых металлов кристаллическая решётка может перестраиваться из одного типа в другой. Например, чистое железо при температурах ниже 910° имеет кубическую
объёмноцентрированную решётку, а выше 910° решётка становится гранецентрированной. Свойством изменять кристаллическую решётку обладают и такие металлы, как олово, уран, титан, таллий, цирконий, лантан, церий.
|
Рис. 2. Кубическая гранецентрированная решётка металла. |
 Свойство веществ образовывать решётки разной формы называют аллотропией; в переводе с греческого
Свойство веществ образовывать решётки разной формы называют аллотропией; в переводе с греческого
|
Рис. 3. Гексагональная (шестиугольная) плотно упакованная решётка. |
Языка это слово означает «другой поворот», «другое свойство». Общеизвестна аллотропия у кристаллического углерода. Он может находиться в виде графита и в виде алмаза. Графит и алмаз построены из атомов углерода; отличие их только в строении кристаллической решётки. А какая огромная разница в свойствах! Графит — мягкий,
Непрозрачный минерал чёрного цвега, алмаз, напротив, прозрачен, бесцветен и твёрд.
Атомы в кристаллической решётке металлов расположены столь близко друг к другу, что их внешние электроны имеют возможность двигаться не только вокруг одного атома, а вокруг многих атомов. Следовательно, внешние электроны, распределяющиеся в металле равномерно, свободно перемещаются по всему куску металла, образуя своеобразный электронный газ.
Таким образом, любой металл представляет собой решётку из правильно расположенных положительных ионов, заполненную электронным газом. Высокая прочность металлов и объясняется наличием электронного газа, который обволакивает все ионы, превращая металлический кристалл как бы в одно целое.
Ионы, находящиеся в определённых местах (узлах) кристаллической решётки, могут совершать, однако, движение — колебание. В ненагретом металле колебания ионов замедлены, в нагретом — ионы испытывают сильное колебание. Чем выше температура, тем сильнее раскачиваются ионы. Наконец, наступает момент, когда силы взаимодействия уже не могут удержать ионы в узлах кристаллической решетки и она разрушается; металл из твёрдого состояния переходит в жидкое. Это и есть температура плавления.
Если два расплавленных металла тщательно перемешать, то после затвердевания получится сплав этих металлов. Сплавы получаются и при сплавлении металла с неметаллом, например железа с углеродом, алюминия с кремнием и т. д. Свойства полученного сплава зависят не только от того, какие элементы входят в сплав, но и от внутреннего строения, или, как говорят, структуры сплава. Сплав является тоже кристаллическим телом.
Строение сплавов может быть различно. Составные части сплава могут образовать либо механическую смесь, либо твёрдый раствор, либо химическое соединение. Но есть сплавы, в которых имеются одновременно и механические смеси, и твёрдые растворы, и химические соединения.
Механическая смесь получается в том случае, когда составные части не взаимодействуют химически, а находятся в сплаве в виде самостоятельных мелких кристал
Ликов. Их можно наблюдать при рассматривании отполированной поверхности в микроскоп. Механические смеси образуются, например, при сплавлении свинца с сурьмой, висмута с кадмием и др.
Каждый знает раствор сахара или поваренной соли в иоде. Растворяя сахар или поваренную соль в воде, можно получить однородное вещество — жидкий раствор. В стакане воды можно растворить различное количество сахара

 Или поваренной соли. Поэтому такие растворы являются однородными веществами переменного состава.
Или поваренной соли. Поэтому такие растворы являются однородными веществами переменного состава.
Чр—ф—^—ф — 0) Атом тда Т Атом ткеля Рис. 4. Кристаллическая решётка твёрдого раствора замещения. |
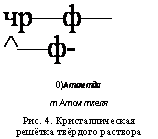 Оказывается, что подобные однородные системы переменного состава образуются и в твёрдых телах. Их называют твёрдыми растворами. В них атомы растворённого вещества и растворителя «рассеяны», перемешаны между собой. В кристаллической решётке вещества, являющегося растворителем, некоторые его атомы замещаются атомами растворённого вещества (рис. 4). Такие растворы называются твёрдыми растворами замещения. Их образуют при сплавлении, например, металлы медь и никель, железо и хром, золото и медь, серебро и золото, медь и платина и др.
Оказывается, что подобные однородные системы переменного состава образуются и в твёрдых телах. Их называют твёрдыми растворами. В них атомы растворённого вещества и растворителя «рассеяны», перемешаны между собой. В кристаллической решётке вещества, являющегося растворителем, некоторые его атомы замещаются атомами растворённого вещества (рис. 4). Такие растворы называются твёрдыми растворами замещения. Их образуют при сплавлении, например, металлы медь и никель, железо и хром, золото и медь, серебро и золото, медь и платина и др.
Замещение одних атомов другими в кристаллической решётке происходит в том случае, если атомы растворяемого металла близки по своим размерам атомам раство* рителя. Если разница в размерах атомов превышает 15%, твёрдый раствор замещения образоваться не может.
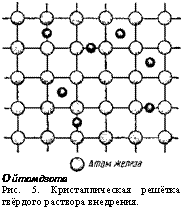
При очень большой разнице в размерах атомов образуются твёрдые растворы внедрения. Они чаще всего получаются тогда, когда металл растворяет в себе неметаллические элементы, атомы которых значительно меньше атомов металла. Самым распространённым сплавом, построенным по типу твёрдых растворов внедрения, является сплав железа с углеродом; этот сплав называется сталью. При образовании твёрдого раствора внедрения атомы внедряющегося элемента располагаются
в промежутках кристаллической решётки между атомами растворителя. Кристаллическая решётка твёрдого раствора внедрения показана на рис. 5.
А много ли можно растворить одного металла в другом? Неограниченная растворимость присуща далеко не всем металлам. В меди, например, может раствориться сколько угодно никеля, точно так же и в никеле можно растворить любое количество меди. Растворителем считают тот металл, которого больше в сплаве по весу.
О йтом дзота Рис. 5. Кристаллическая решётка твёрдого раствора внедрения. |
 Многие металлы обладают ограниченной растворимостью. Например, в алюминии можно растворить не более 5,5% меди по весу. При большем количестве медь находится в сплаве в виде отдельных нераст — ворённых частиц. Чем выше температура твёрдого раствора, тем больше меди можно растворить в алюминии (но не более 5,5%).При охлаждении этого сплава медь выделяется в виде мельчайших, очень твёрдых и хрупких частиц.
Многие металлы обладают ограниченной растворимостью. Например, в алюминии можно растворить не более 5,5% меди по весу. При большем количестве медь находится в сплаве в виде отдельных нераст — ворённых частиц. Чем выше температура твёрдого раствора, тем больше меди можно растворить в алюминии (но не более 5,5%).При охлаждении этого сплава медь выделяется в виде мельчайших, очень твёрдых и хрупких частиц.
Какова природа этих частиц? Оказывается — это не чистая медь, а её х и м и ч е — ское соединение с алюминием. Избыток меди в сплаве взаимодействует с алюминием химически. Кристаллики любого химического соединения в сплаве имеют вполне определённый состав. Так, например, при образовании химических соединений: железа с углеродом, называемого карбидом железа, три атома железа химически связаны с одним атомом углерода; алюминия с медью—два атома алюминия соединены с одним атомом меди. Для образования карбидов вольфрама или ванадия нужно, чтобы соотношение атомов этих металлов и атомов углерода было равно 1 : 1, а в карбиде хрома 23 атома хрома взаимодействуют с шестью атомами углерода.
Кристаллические решётки химических соединений очень сложны. При сильном разогревании сплава кристаллы химических соединений могут растворяться в твёр-
Дом растворе сплава, а при снижении температуры нагревания образовываться вновь.
Сплавы, применяемые в технике, имеют сложный химический состав. Высокопрочные стали, например, имеют в своем составе до десятка различных химических элементов. Чем сложнее состав и строение сплава, тем разнообразнее его свойства.
Редкие металлы, вводимые в состав сталей и сплавов, улучшают их качество, коренным образом изменяют первоначальные свойства сплавов, так как они часто образуют кристаллы химических соединений, упрочняющих твёрдый раствор.
Металлурги пользуются редкими металлами для того, чтобы выплавленные стали и сплавы были более прочны, более твёрды, обладали нужной пластичностью, упругостью, жароупорностью, химической’ стойкостью и т. д. О том, какие это свойства и как они изменяются при добавке редких металлов, будет рассказано ниже.
« Химия металлов».Строение атомов металлов , его свойства.
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ ПЕРМСКОГО КРАЯ
Государственное бюджетное образовательное учреждение
среднего профессионального образования
«СОЛИКАМСКИЙ ТЕХНОЛОГИЧЕСКИЙ КОЛЛЕДЖ»
Внеурочное задание по теме:
« Химия металлов»
Учебная дисциплина (Междисциплинарный курс :_______Химия________
Студентка_____Циковкиной Эльвиры
Курс _1_ Группа (шифр)_К-11
Специальность (код, название) __38,02,04, Коммерция_________________________________
Выполнила:_Циковкина Эльвира __ ________________
(подпись) (Ф.И.О.)
Проверил Филиппова Н. В_ _____________
(подпись) (Ф.И.О.)
г. Соликамск 2015 г.
Содержание.
1. Положение металлов в Периодической системе химических элементов Д. И. Менделеева.
2. Строение атомов металлов , его свойства.
3. Содержание ионов металла в живых организмах.
4. Металл – простое вещество.
5. Физические свойства.
6. Химические свойства.
7. Способы получения металлов.
8. Применение металлов.
9. Список литературы.
Положение металлов в Периодической системе химических элементов Д. И. Менделеева.
В настоящее время известно 105 химических элементов, большинство из них – металлы. Последние весьма распространены в природе и встречаются в виде различных соединений в недрах земли, водах рек, озер, морей, океанов, составе тел животных, растений и даже в атмосфере.
По своим свойствам металлы резко отличаются от неметаллов. Впервые это различие металлов и неметаллов определил М. В. Ломоносов. “Металлы, – писал он, – тела твердые, ковкие блестящие”.
Причисляя тот или иной элемент к разряду металлов, мы имеем в виду наличие у него определенного комплекса свойств:
1. Плотная кристаллическая структура.
2. Характерный металлический блеск.
3. Высокая теплопроводность и электрическая проводимость.
4. Уменьшение электрической проводимости с ростом температуры.
5. Низкие значения потенциала ионизации, т.е. способность легко отдавать электроны.
6. Ковкость и тягучесть.
7. Способность к образованию сплавов.
Строение атомов металлов ,его свойства.
Металлы составляют большую часть химических элементов. Каждый период периодической системы (кроме 1-го) химических элементов начинается с металлов, причем с увеличением номера периода их становится все больше. Если во 2-м периоде металлов всего 2 (литий и бериллий), в 3-м — 3 (натрий, магний, алюминий), то уже в 4-м — 13, а в 7-м — 29.
Атомы металлов имеют сходство в строении внешнего электронного слоя, который образован небольшим числом электронов (в основном не больше трех).
Это утверждение можно проиллюстрировать на примерах Na, алюминия А1 и цинка Zn. Составляя схемы строения атомов, по желанию можно составлять электронные формулы и приводить примеры строения элементов больших периодов, например цинка.
В связи с тем что электроны внешнего слоя атомов металлов слабо связаны с ядром, они могут быть «отданы» другим частицам, что и происходит при химических реакциях:
Свойство атомов металлов отдавать электроны явтяется их характерным химическим свойством и свидетельствует о том, что металлы проявляют восстановительные свойства.
При характеристике физических свойств металлов следует отметить их общие свойства: электрическую проводимость, теплопроводность, металлический блеск, пластичность, которые обусловлены единым видом химической связи — металлической, и металлической кристаллической решетки. Их особенностью является наличие свободно перемещающихся обобществленных электронов между ион – атомами, находящимися в узлах кристаллической решетки.
При характеристике химических свойств важно подтвердить вывод о том, что во всех реакциях металлы проявляют свойства восстановителей, и проиллюстрировать это записью уравнений реакции. Особое внимание следует обратить на взаимодействие металлов с кислотами и растворами солей, при этом необходимо обратиться к ряду напряжений металлов (ряд стандартных электродных потенциалов).
Примеры взаимодействия металлов с простыми веществами (неметаллами):
с солями ( Zn в ряду напряжений стоит левее Сu): Zn + СuС12 = ZnCl2 + Сu!
Таким образом, несмотря на большое многообразие металлов, все они обладают общими физическими и химическими свойствами, что объясняется сходством в строении атомов и строении простых веществ.
Содержание ионов металла в живых организмах.
Бионеорганическая химия изучает в первую очередь поведение десяти металлов жизни в живом организме. К металлам жизни относятся пять ионов с замкнутыми электронными оболочками (ионы нз- рия, калия, магния, кальция и цинка), четыре иона с недостроенной З -электронной оболочкой (ионы марганца, железа, кобальта и меди) и только один элемент молибден, у которого могут появиться электроны на 4 -оболочке.
Ионы многих металлов, в том числе железа (Ре), калия (К), кальция (Са) и магния (М ), необходимы для здоровья человека. Л,о 10% наших потребностей в этих элементах удовлетворяется за счет минералов, растворенных в питьевой воде. Другие металлы, называемые тяжелыми, образованы более массивными атомами, чем металлы, необходимые для здоровья. Они также могут растворяться в воде в виде ионов. Наиболее важные тяжелые металлы свинец (РЬ), ртуть (Hg) и кадмий (Сс1). Ионы этих элементов токсичны даже в малых количествах. Они связываются с белками, из которых состоит живой организм, и приводят к их неправильному функционированию. Отравление тяжелыми металлами может приводит), к очень серьезным последствиям. Сюда относятся повреждения нервной системы, почек, печени, слабоумие и даже смерть. Свинец, ртуть и кадмий особенно опасны, поскольку они широко распространены и могут попадать в пищу или воду. По мере накопления в организме эти элементы могут стать еще более опасными.
Эти два соединения, хлорофилл и гем, играют важнейшую роль в сложном механизме поглощения солнечной энергии и ее превращении для использования живыми организмами. Мы уже знаем, что характерным свойством комплексов переходных металлов является наличие нескольких близко расположенных -уровней, что позволяет им поглощать свет в видимой области спектра и придает окраску. Порфириновый цикл вокруг иона Mg в молекуле хлорофилла выполняет такую же роль. Хлорофилл в растениях поглощает фотоны видимого света и переходит в возбужденное электронное состояние Эта энергия возбуждения может инициировать цепь химических реакций, приводящих в конце концов к образованию сахаров из диоксида углерода и воды
Шесть металлов Ь1, Ма, К, КЬ, Сз, Рг называют щелочными, так как их гидроксиды хорошо растворимы в воде и полностью диссоциируют на ионы. Наиболее распространены в природе натрий и калий (по 2,5%). Они входят в состав большинства горных пород, множества минералов и солей, в состав морской воды, рассолов и минерализованных вод, живых организмов и т. д. Литий входит в состав многих алюмосиликатов и алюмофосфатов (его кларк — 6,5 10″ , цезий и особенно рубидий — очень рассеянные элементы, также встречающиеся в некоторых алюмосиликатах (кларки соответственно 7 10 % и 3 10″ %).
Многие ионы металлов необходимы клеткам живых организмов. Это Na, К, Mg, Са, Мп, Fe, Со, Си, Мо, Zn. Они составляют 3% массы человеческого тела. Na(I), К(1) и Са(П) особенно важны как участники так называемого ионного насоса , который сопровождается активным транспортом метаболитов и энергетическими процессами. Другие металлы, такие, как Zn(II) и Со(И), обнаружены в различных металлоферментах, где они координируются с аминокислотами и ускоряют реакции, происходящие в активном центре [214]. Они выступают как сверхкислотные катализаторы, оказывающие прямое или матричное действие. В то же время ионы Fe(II) и u(II) предпочтительно связываются с простетическими группами порфиринового типа и участвуют во многих системах электронного переноса
В свою очередь гомогенный катализ можно разделить по типу применяемого катализатора на кислотно-основной (в присутствии кислот и оснований), окислительно -восстановительный (в присутствии ионов металлов переменной валентности), координационный или металлокомплексный (промежуточные продукты — комплексные соединения) и гомогенный газофазный (например, окисление диоксида серы кислородом в присутствии следов оксидов азота). К гомогенно-каталитическим процессам относят и ферментативный катализ биохимических процессов, происходящих в живых организмах под влиянием сложных белковых катализаторов — ферментов (энзимов).
Большое значение имеют иониты при охране окружающей среды. Так, например, в сточных водах многих производств содержатся ионы тяжелых металлов, которые очень вредны для живых организмов. Так как концентрация тяжелых металлов в сточных водах очень мала, применение обычных методов удаления (например, осаждение) неэффективно и дорого. Сточные воды обрабатывают катионитом, причем можно использовать катионит, содержащий не ион водорода, а, например, ион натрия. Ионы тяжелых металлов, обмениваясь на ион натрия, поглощаются катионитом, нз которого их можно легко извлечь и использовать в народном хозяйстве.
Металл – простое вещество.
Металлы – простые вещества. Металлов в природе больше оттого, что у них у всех одинаковое строение кристаллической решетки и один тип химической связи. Это и придает им ряд общих свойств. Это отличает металлы от неметаллов, которым присуще больше различие свойств, чем их общность. В виде простого вещества атомы металлов связаны между собой, так называемой металлической связью. У металлов, особенно щелочных, валентные электроны связаны с атомами слабо и при отрыве затрачивается сравнительно немного энергии. При этом возникают ионы, имеющие устойчивый электронный слой из 8 электронов. Поэтому металлы как в твердом, таки в жидком состоянии существуют в виде ионов, между которыми в хаотичном движении находятся электроны, получившие условное название электронного газа. Ионы при столкновении с электронами на некоторое время превращаются в атомы. Таким образом, твердый металл представляет собой каркас из положительных ионов, атомов, погруженных в море подвижных электронов.
Физические свойства.
С внешней стороны металлы, как известно, характеризуются прежде всего особым “металлическим” блеском, который обусловливается их способностью сильно отражать лучи света. Однако этот блеск наблюдается обыкновенно только в том случае, когда металл образует сплошную компактную массу. Правда, магний и алюминий сохраняют свой блеск, даже будучи превращенными в порошок, но большинство металлов в мелкораздробленном виде имеет черный или темно-серый цвет. Затем типичные металлы обладают высокой тепло- и электропроводностью, причем по способности проводить тепло и ток располагаются в одном и том же порядке: лучшие проводники – серебро и медь, худшие – свинец и ртуть. С повышением температуры электропроводность падает, при понижении температуры, наоборот, увеличивается.
Очень важным свойством металлов является их сравнительно легкая механическая деформируемость. Металлы пластичны, они хорошо куются, вытягиваются в проволоку, прокатываются в листы и т.п.
Характерные физические свойства металлов находятся в связи с особенностями их внутренней структуры. Согласно современным воззрениям, кристаллы металлов состоят из положительно заряженных ионов и свободных электронов, отщепившихся от соответствующих атомов. Весь кристалл можно себе представить в виде пространственной решетки, узлы которой заняты ионами, а в промежутках между ионами находятся легкоподвижные электроны. Эти электроны постоянно переходят от одних атомов к другим и вращаются вокруг ядра то одного, то другого атома. Так как электроны не связаны с определенными ионами, то уже под влиянием небольшой разности потенциалов они начинают перемещаться в определенном направлении, т.е. возникает электрический ток.
Наличием свободных электронов обусловливается и высокая теплопроводность металлов. Находясь в непрерывном движении, электроны постоянно сталкиваются с ионами и обмениваются с ними энергией. Поэтому колебания ионов, усилившиеся в данной части металла вследствие нагревания, сейчас же передаются соседним ионам, от них – следующим и т.д., и тепловое состояние металла быстро выравнивается; вся масса металла принимает одинаковую температуру.
Химические свойства.
Основным химическим свойством металлов является способность их атомов легко отдавать свои валентные электроны и переходить в положительно заряженные ионы. Типичные металлы никогда не присоединяют электронов; их ионы всегда заряжены положительно.
Легко отдавая при химических реакциях свои валентные электроны, типичные металлы являются энергичными восстановителями.
Способность к отдаче электронов проявляется у отдельных металлов далеко не в одинаковой степени. Чем легче металл отдает свои электроны, тем он активнее, тем энергичнее вступает во взаимодействие с другими веществами.
Опустим кусочек цинка в раствор какой-нибудь свинцовой соли. Цинк начинает растворяться, а из раствора выделяется свинец. Реакция выражается уравнением:
Zn + Pb(NO 3 ) 2 = Pb + Zn(NO 3 ) 2
Из уравнения следует, что эта реакция является типичной реакцией окисления-восстановления. Сущность ее сводится к тому, что атомы цинка отдают свои валентные электроны ионам двухвалентного свинца, тем самым превращаясь в ионы цинка, а ионы свинца восстанавливаются и выделяются в виде металлического свинца. Если поступить наоборот, то есть погрузить кусочек свинца в раствор цинковой соли, то никакой реакции не произойдет. Это показывает, что цинк более активен, чем свинец, что его атомы легче отдают, а ионы труднее присоединяют электроны, чем атомы и ионы свинца.
Вытеснение одних металлов из их соединений другими металлами впервые было подробно изучено русским ученым Бекетовым, расположившим металлы по их убывающей химической активности в так называемый “вытеснительный ряд”. В настоящее время вытеснительный ряд Бекетова носит название ряда напряжений.
В таблице №2 представлены значения стандартных электродных потенциалов некоторых металлов. Символом Me + /Me обозначен металл Me, погруженный в раствор его соли. Стандартные потенциалы электродов, выступающих как восстановители по отношению к водороду, имеют знак “-” , а знаком “+” отмечены стандартные потенциалы электродов, являющихся окислителями.
Способы получения металлов.
Огромное большинство металлов находится в природе в виде соединений с другими элементами.
Только немногие металлы встречаются в свободном состоянии, и тогда они называются самородными. Золото и платина встречаются почти исключительно в самородном виде, серебро и медь – отчасти в самородном виде; иногда попадаются также самородные ртуть, олово и некоторые другие металлы.
Добывание золота и платины производится или посредством механического отделения их от той породы, в которой они заключены, например промывкой воды, или путем извлечения их из породы различными реагентами с последующим выделением металла из раствора. Все остальные металлы добываются химической переработкой их природных соединений.
Минералы и горные породы, содержащие соединения металлов и пригодные для получения этих металлов заводским путем, носят название руд. Главными рудами являются оксиды, сульфиды и карбонаты металлов.
Важнейший способ получения металлов из руд основан на восстановлении их оксидов углем.
Если, например, смешать красную медную руду (куприт) Cu 2 O с углем и подвергнуть сильному накаливанию, то уголь, восстанавливая медь, превратится в оксид углерода(II), а медь выделится в расплавленном состоянии:
Cu 2 O + C = 2Cu + CO
Подобным же образом производится выплавка чугуна их железных руд, получение олова из оловянного камня SnO 2 и восстановление других металлов из оксидов.
При переработке сернистых руд сначала переводят сернистые соединения в кислородные путем обжигания в особых печах, а затем уже восстанавливают полученные оксиды углем. Например:
2ZnS + 3O 2 = 2ZnO + 2SO 2
ZnO + C = Zn + CO
В тех случаях, когда руда представляет собой соль угольной кислоты, ее можно непосредственно восстанавливать углем, как и оксиды, так как при нагревании карбонаты распадаются на оксид металла и двуокись углерода. Например:
ZnCO 3 = ZnO + CO 2
Обычно руды, кроме химического соединения данного металла, содержат еще много примесей в виде песка, глины, известняка, которые очень трудно плавятся. Чтобы облегчить выплавку металла, к руде примешивают различные вещества, образующие с примесями легкоплавкие соединения – шлаки. Такие вещества называются флюсами. Если примесь состоит из известняка, то в качестве флюса употребляют песок, образующий с известняком силикат кальция. Наоборот, в случае большого количества песка флюсом служит известняк.
Во многих рудах количество примесей (пустой породы) так велико, что непосредственная выплавка металлов из этих руд является экономически невыгодной. Такие руды предварительно “обогащают”, то есть удаляют из них часть примесей. Особенно широким распространением пользуется флотационный способ обогащения руд (флотация), основанный на различной смачиваемости чистой руды и пустой породы.
Техника флотационного способа очень проста и в основном сводится к следующему. Руду, состоящую, например, из сернистого металла и силикатной пустой породы, тонко измельчают и заливают в больших чанах водой. К воде прибавляют какое-нибудь малополярное органическое вещество, способствующее образованию устойчивой пены при взбалтывании воды, и небольшое количество специального реагента, так называемого “коллектора”, который хорошо адсорбируется поверхностью флотируемого минерала и делает ее неспособной смачиваться водой. После этого через смесь снизу пропускают сильную струю воздуха, перемешивающую руду с водой и прибавленными веществами, причем пузырьки воздуха окружаются тонкими масляными пленками и образуют пену. В процессе перемешивания частицы флотируемого минерала покрываются слоем адсорбированных молекул коллектора, прилипают к пузырькам продуваемого воздуха, поднимаются вместе с ними кверху и остаются в пене; частицы же пустой породы, смачивающиеся водой, оседают на дно. Пену собирают и отжимают, получая руду с значительно большим содержанием металла.
Для восстановления некоторых металлов из их оксидов применяют вместо угля водород, кремний, алюминий, магний и другие элементы.
Процесс восстановления металла из его оксида с помощью другого металла называется металлотермией. Если, в частности, в качестве восстановителя применяется алюминий, то процесс носит название алюминотермии.
Очень важным способом получения металлов является также электролиз. Некоторые наиболее активные металлы получаются исключительно путем электролиза, так как все другие средства оказываются недостаточно энергичными для восстановления их ионов.
Применение металлов.
Конструкционные материалы
Металлы и их сплавы — одни из главных конструкционных материалов современной цивилизации. Это определяется, прежде всего, их высокой прочностью, однородностью и непроницаемостью для жидкостей и газов. Кроме того, меняя рецептуру сплавов, можно менять их свойства в очень широких пределах.
Электротехнические материалы
Металлы используются в качестве хороших проводников электричества (медь, алюминий), так и в качестве материалов с повышенным сопротивлением для резисторов и электронагревательных элементов (нихром и т. п.).
Инструментальные материалы
Металлы и их сплавы широко применяются для изготовления инструментов (их рабочей части). В основном, это инструментальные стали и твёрдые сплавы. В качестве инструментальных материалов применяются также алмаз, нитрид бора, керамика.
Список использованной литературы.
1. “Основы общей химии”. Ю.Д.Третьяков , Ю.Г.Метлин. Москва “Просвещение” 1980 г.
2. “Общая химия”. Н.Л.Глинка. Издательство “Химия”, Ленинградское отделение 1972 г.
3. “Отчего и как разрушаются металлы”. С.А.Балезин. Москва “Просвещение” 1976 г.
4. “Пособие по химии для поступающих в вузы”. Г.П.Хомченко. 1976 г.
5. “Книга для чтения по неорганической химии”. Часть 2. Составитель В.А.Крицман. Москва “Просвещение” 1984 г.
6. “Химия и научно-технический прогресс”. И.Н.Семенов, А.С.Максимов, А.А.Макареня. Москва “Просвещение” 1988г.
Лекция по «Материаловедение» на тему «Строение и кристаллизация металлов»
Строение и кристаллизация металлов
Более двухсот лет назад великий русский ученый М. В. Ломоносов дал научное определение металлам: «Металлы суть светлые тела, которые ковать можно». Оно свидетельствует о том, что все металлы имеют характерный металлический блеск и пластичны. Сейчас к определению, данному М. В. Ломоносовым, можно добавить, что все металлы обладают также относительно высокой электро- и теплопроводностью и что электропроводность металлов с ростом температуры уменьшается. У некоторых металлов характерные металлические свойства выражены сильнее, у других — слабее. Характерные свойства металлов обусловлены их строением.
Каждый атом металла состоит из положительно заряженного тяжелого ядра, расположенного в центре, и окружающих ядро отрицательно заряженных электронов. Число электронов равно порядковому номеру элемента в таблице Д. И. Менделеева. В ядре атома находятся протоны и нейтроны. Количество протонов равно количеству окружающих ядро электронов; заряды протонов и электронов взаимно уравновешиваются, поэтому атом электрически нейтрален.
Почти вся масса атома сосредоточена в его ядре. Электроны движутся вокруг ядра с большой скоростью по орбитам, близким к круговым или эллиптическим. Они притягиваются к ядру по закону Кулона, т. е. с силой, обратно пропорциональной квадрату расстояния между взаимодействующими частицами. На орбите электрон удерживают центробежные силы, уравновешивающие центростремительную силу от статического притяжения ядром. Электроны могут устойчиво перемещаться, не излучая энергии в окружающее пространство, только по определенным орбитам, положение которых определяется условиями квантовой механики.
В зависимости от запаса энергии электроны одного атома могут принадлежать различным слоям (энергетическим уровням). Все многообразие физико-химических свойств различных веществ определяется особенностями строения электронных оболочек их атомов. Внешние, так называемые валентные, электроны у всех металлов относительно слабо связаны с ядром. Элементы-металлы легко отдают внешние валентные электроны, вступая в химические реакции с элементами-неметаллами, при приложении ничтожной разности электрических потенциалов и т. д. Слабой связью внешних валентных электронов с ядром и объясняются характерные металлические свойства.
К металлам относится примерно 3/4 всех химических элементов.
Между понятием «металл» как химический элемент и как вещество есть некоторая разница. Химия делит все элементы на металлы и неметаллы по их поведению в химических реакциях. Теория металлического состояния рассматривает крупные скопления атомов металлов, в котором они обладают характерными металлическими свойствами: пластичностью, высокой тепло- и электропроводностью, металлическим блеском. Эти свойства характерны для больших групп атомов. У одиночных атомов таких свойств нет.
Согласно современным представлениям, атомы в металле находятся в ионизированном состоянии. Отдавая часть внешних валентных электронов, они превращаются в положительно заряженные ионы. Свободные электроны непрерывно перемещаются между ионами. Электроны образуют легкоподвижный электронный газ.
При комнатной температуре все металлы, кроме ртути, представляют собой твердые тела, имеющие кристаллическое строение. Для кристаллов характерно строго определенное расположение в пространстве ионов, образующих кристаллическую решетку.
Металлы имеют кристаллические решетки различных типов. Каждая кристаллическая решетка может быть охарактеризована элементарной кристаллической ячейкой — наименьшим комплексом атомов, повторяя который многократно можно построить весь кристалл. У металлов чаще всего встречаются три типа элементарных кристаллических ячеек: объемноцентрированная кубическая, гранецентрированная кубическая и гексагональная плотноупакованная (рис. 2, а —в).
В кубической объемноцентрированной решетке восемь ионов располагаются по вершинам и один в центре куба, на пересечении диагоналей. Объемноцентрированную кубическую решетку имеют кристаллы железа при комнатной температуре, хрома, вольфрама, молибдена, ванадия и многих других металлов. Эта решетка характеризуется всего одним параметром решетки — расстоянием между центрами двух ионов, расположенных по одному ребру. На рис. 2, а параметр решетки обозначен а. У различных металлов, имеющих решетку объемноцентрированного куба, параметры разные. Параметры решеток принято измерять в ангстремах (1 А = МО»10 ж) или килоиксах (1 кХ = 1,00202 А).
Многие металлы, используемые в технике, имеют гранецентрированную кубическую решетку. В элементарной решетке гранецентрированного куба ионы расположены по вершинам куба и в центре каждой грани (на пересечении ее диагоналей). Центр куба (пересечение диагоналей куба) остается свободным. Такую решетку имеют кристаллы меди, никеля, алюминия, свинца, серебра и некоторых других металлов. Гранецентрированная решетка также характеризуется одним параметром — длиной ребра куба а. Например, параметр решетки меди составляет 3,61 кХ, алюминия 4,04 кХ.
Элементарная ячейка гексагональной плотноупакованной решетки представляет собой шестигранную призму. По основаниям призмы расположены правильные шестиугольники. По вершинам шестиугольников и в их центрах находятся ионы. Кроме того, посередине между основаниями вклинивается правильный треугольник с ионами по вершинам. Гексагональная решетка характеризуется двумя параметрами: а и с (рис. 2, в). Наибольшая плотность упаковки атомов достигается при соотношении параметров — = 1,633. При этом три атома, расположенных внутри элементарной ячейки, касаются атомов, расположенных на верхней и нижней плоскостях. Такая решетка называется гранецентрированной плотноупакованной. Ее имеют титан, цирконий, кобальт, цинк, магний и некоторые другие металлы.
Металлы могут иметь кристаллические решетки и других типов, кроме рассмотренных нами.
Покажем, что все характерные свойства металлов обусловлены наличием электронного газа. Сначала рассмотрим природу сил взаимодействия между ионами и электронами в металлах и установим, почему металлы пластичны.
Между положительно заряженными ионами металла в кристаллической решетке существуют силы электростатического отталкивания. Одновременно действуют электростатические силы притяжения между положительно заряженными ионами и электронами, образующими электронный газ. Взаимодействие между ионами и электронами осложняется быстрым перемещением электронов. В результате возникают электродинамические силы. Когда ионы металлов отстоят один от другого на расстояние, равное параметру решетки, силы притяжения и отталкивания уравновешиваются. Характер изменения суммарных сил взаимо-действия между двумя атомами при изменении расстояния между ними показан на рис. 3. При растяжении металлического тела расстояния между ионами увеличиваются, и силы притяжения
Сила, приложенная к металлу, вызывает деформацию. Деформация может быть упругой, исчезающей после снятия нагрузок, и пластической, остающейся после снятия нагрузок. На рис. 4, а показаны два ряда ионов в кристаллической решетке металла. Верхний ряд сдвигается относительно нижнего возрастающей силой Р. Если эта сила будет расти и вызовет смещение верхнего ряда ионов относительно нижнего на целый параметр решетки, то верхний ряд окажется опять в устойчивом положении (рис. 4, б). Вслед за ионами сместятся электроны. Сила взаимодействия между рядами атомов не будет нарушена. Произойдет остаточная деформация кристалла без его разрушения. Поэтому все металлы пластичны.
Рассмотрим, к каким последствиям приведет аналогичный сдвиг в кристалле с неметаллическим характером связи. Для примера возьмем кристалл поваренной соли, представляющий собой химическое соединение NaCl. В этом кристалле имеются положительно заряженные ионы натрия и отрицательно заряженные ионы хлора.
Характер взаимодействия между ионами электростатический. Ближайшими соседями положительно заряженного иона натрия являются отрицательно заряженные ионы хлора, и наоборот. Если увеличить силу Р, для того чтобы сдвинуть верхний ряд атомов относительно нижнего на целый параметр решетки, то в этом случае после сдвига одноименные ионы окажутся один против другого (рис. 4, г). Как известно, одноименные ионы отталкиваются. В результате по линии сдвига образуется трещина. 10
начинают преобладать над силами отталкивания. Так возникают внутренние силы, уравновешивающие внешние растягивающие силы.
Все металлы обладают высокой электропроводностью, что объясняется слабой связью электронного газа с положительно заряженными ионами. Достаточно приложить небольшую разность электрических потенциалов к концам металлического тела, чтобы вызвать перемещение электронного газа, т. е. получить электрический ток.
Рассмотрим причины высокой теплопроводности металлов. Ионы в узлах кристаллической решетки совершают колебательные движения. Средняя амплитуда этих колебаний определяет температуру металла. Чем выше температура, тем больше средняя амплитуда колебаний. В неметаллах в передаче тепловой энергии от одного объема к другому принимают участие только ионы. В металлах, кроме ионов, в процессе передачи тепла участвует также легкоподвижный электронный газ. Поэтому скорость передачи тепла в металлах значительно выше, чем в неметаллах.
Металлы, используемые в технике, состоят из большого числа кристаллов неправильной формы, называемых зернами или кристаллитами.
Такое строение металлов называется поликристаллическим. Схематически. По границам между зернами металла нарушается правильность строения кристаллической решетки. Обычно зерна повернуты произвольно.
Для научных целей путем очень медленного охлаждения можно получить весьма крупные куски металла, масса которых составляет несколько сот граммов, представляющих собой один кристалл. Их называют монокристаллами.
Металлы их признаки и свойства
Металлами называют несомненно вещества, обладающие следующими основными и характерными для них признаками:хорошей проводимостью тепла и электричества, ковкостью, непрозрачностью и особым блеском в изломе, называемым в народе металлическим;
металлы одноатомны и образуют обычно основного характера окислы;
ионы металлов электроположительны;
в обычных условиях в твердом состоянии металл имеет определенное кристаллическое строение.
О структуре строения различных металлов можно получить представление прежде всего по самому виду излома, наблюдаемого простым невооруженным глазом; структура наблюдаемая невооруженным глазом или с увеличением не больше чем в десять раз называется макро структурой. Таким образом из числа открытых в мире элементов к собственно металлам следует отнести семьдесят один элемент.
На современном и стремительном этапе развития экономической деятельности появилась тенденция к применению более редких металлов и всевозможных экстравагантных соединений, которые способны выполнять совсем новые, мало изученные действия и реакции, особенно в результате перестановки атомов с применением нанотехнологий.
Кроме того к преимуществам металла можно отнести и высокую электро- и теплопроводность, которая имеет свойство увеличиваться, когда температура понижается.
Свойства металлов
Именно благодаря своему электронному строению металл обладает отмеченными свойствами.
Сплавы металлов — состоящие из двух и более металлов вещества с примесью неметаллов. Получают сплавлением.
Свойствами и строением металлы отличаются друг от друга, тем не менее имеют схожие признаки, по которым их можно сортировать в определённые группы.
В первую очередь, металлы относят к двум большим группам — цветные металлы и чёрные. Характерная окраска (красная, желтая, белая) говорит о том, что это цветной металл. Металлы такого типа обладают большой пластичностью, плавятся при относительно низкой температуре, особой твёрдостью не обладают, полиморфизм отсутствует. Медь является наиболее типичным металлом этой группы.
Цветные металлы можно разделить на: благородные, лёгкие и лёгкоплавкие металлы. Темно-серый цвет имею
Металлы их признаки и свойства
Металлами называют несомненно вещества, обладающие следующими основными и характерными для них признаками: хорошей проводимостью тепла и электричества, ковкостью, непрозрачностью и особым блеском в изломе, называемым в народе металлическим; металлы одноатомны и образуют обычно основного характера окислы; ионы металлов электроположительны; в обычных условиях в твердом состоянии металл имеет определенное кристаллическое строение. О структуре строения различных металлов можно получить представление прежде всего по самому виду излома, наблюдаемого простым невооруженным глазом; структура наблюдаемая невооруженным глазом или с увеличением не больше чем в десять раз называется макро структурой. Таким образом из числа открытых в мире элементов к собственно металлам следует отнести семьдесят один элемент. На современном и стремительном этапе развития экономической деятельности появилась тенденция к применению более редких металлов и всевозможных экстравагантных соединений, которые способны выполнять совсем новые, мало изученные действия и реакции, особенно в результате перестановки атомов с применением нанотехнологий. Кроме того к преимуществам металла можно отнести и высокую электро- и теплопроводность, которая имеет свойство увеличиваться, когда температура понижается. Свойства металлов Именно благодаря своему электронному строению металл обладает отмеченными свойствами. Сплавы металлов — состоящие из двух и более металлов вещества с примесью неметаллов. Получают сплавлением. Свойствами и строением металлы отличаются друг от друга, тем не менее имеют схожие признаки, по которым их можно сортировать в определённые группы. В первую очередь, металлы относят к двум большим группам — цветные металлы и чёрные. Характерная окраска (красная, желтая, белая) говорит о том, что это цветной металл. Металлы такого типа обладают большой пластичностью, плавятся при относительно низкой температуре, особой твёрдостью не обладают, полиморфизм отсутствует. Медь является наиболее типичным металлом этой группы. Цветные металлы можно разделить на: благородные, лёгкие и лёгкоплавкие металлы. Темно-серый цвет имеют черные металлы. К его свойствам можно также отнести достаточно большую плотность, относительно не малую твёрдость, полиморфизм, высокую температуру плавления. Наиболее ярким примером этой группы является железо. А как известно, железо — это основа стали. Чёрные металлы разделяются следующим образом: тугоплавкие металлы (температура плавления которых выше, чем железа) ; железные металлы — кобальт, марганец, железо и никель; урановые металлы — актиниды, применяются в основном в сплавах использующихся атомной энергетикой; редкоземельные металлы — церий, неодим, празеодим, лантан и другие; щелочноземельные металлы (используют только в особых случаях) . Использование того или металла зависит от его распространённости в природе, а также зависит от уровня и развития техники. Медь, серебро и золото — первые металлы, с которыми начал работать человек. Человечество ещё ничего не знало о металлургии, не было знакомо со способами извлечения металлов из руд, а эти металлы можно встретить в природе в самородном (чистом) виде. Затем нашлось применение металлам, которые относительно не сложно восстанавливаются (свинец и олово) их также достаточно в природе.
свой-ва (физические -проводит эл ток, твердые, магнитятся… (химические -окисление (взаимодействие с кислородом)…, а признаки металлов смотря какие и про чего надо ??