План-конспект урока по химии (8 класс): Типы химических реакций
Урок химии в 8 классе на тему «Типы химических реакций»
Цели урока:
деятельностная: сформировать познавательные универсальные учебные действия при изучении типов химических реакций.
предметно-дидактическая: сформировать понятия: реакции соединения, реакции разложения, реакции замещения, реакции обмена; сформировать знание о признаках химических реакций, научить определять тип реакции по числу и составу продуктов и реагентов реакции.
Планируемые образовательные результаты урока
личностные: убеждаются в познаваемости мира.
метапредметные:
регулятивные: умение планировать и регулировать свою деятельность, владение основами самоконтроля и самооценки;
коммуникативные: готовность получать необходимую информацию, продуктивно взаимодействовать со своими партнерами и учителем;
познавательные: умение определять понятия, устанавливать аналогии, строить логические рассуждения и делать выводы, производить поиск информации, анализировать и оценивать её достоверность.
предметные: знать определения «типы химических реакций», «признаки классификации реакций», «реакции соединения, разложения, замещения, обмена», «закон сохранения массы веществ».
Тип урока:
1. По ведущей дидактической цели: урок изучения нового материала, последовательного изучения ключевых вопросов темы.
- По способу организации: синтетический урок
- По ведущему методу обучения: проблемный урок
Метод обучения
- Основной: урок-исследование
- Дополнительные: самостоятельная работа, работа с приложениями, взаимоконтроль
Основные вопросы урока:
- Типы химических реакций по числу и составу продуктов и реагентов
- Реакции соединения.
- Реакции разложения.
- Реакции замещения.
- Реакции обмена.
Оборудование: учебник, приложения, дидактический материал, таблица растворимости, реактивы для лабораторного опыта: штатив с пробирками, спиртовка, пробиркодержатель, спички, медная проволока, гранулы цинка, растворы: сульфат меди, гидроксид натрия
Ход урока:
Организационный момент
— Добрый день! Всё, что нас окружает, состоит из веществ. Кажется, что они живут своей жизнью, таинственной и непостижимой. Взаимодействуя, они изменяют свои свойства и состав. И задача человека, изучив этот мир, постараться использовать полученные знания во благо.
— Сегодня мы продолжим знакомство с этим удивительным и волшебным миром химических реакций.
Актуализация
На экране кластер “Химические реакции”
— Ребята, перед вами кластер «Химические реакции». Он не закончен. Давайте заполним пустые овалы. В середине кластера находится основное понятие (отмечено зеленым цветом) – химические реакции. От него отходят стрелки к желтым овалам, в них указаны признаки, по которым вам необходимо охарактеризовать химические реакции.
— Итак, что такое химические реакции — это превращение одного или нескольких исходных веществ (реагентов) в отличающиеся от них по химическому составу или строению вещества (продукты реакции).
— Как мы можем отразить химическую реакцию на письме? (с помощью химического уравнения)
— А что такое химическое уравнение? В чем отличие от реакции? (запись химической реакции с помощью формул и математических знаков)
— Какой закон мы используем при составлении химического уравнения? (закон сохранения массы веществ)
— Сформулируйте этот закон (Масса веществ вступивших в химическую реакцию равна массе веществ, образовавшихся в результате ее)
— Кто открыл закон сохранения массы веществ? (М.В.Ломоносов в 1748г)
— Как закон сохранения массы отображается в уравнении? (уравниваем с помощью коэффициентов)
— Скажите, какими признаками сопровождаются химические реакции? (образование осадка или газа, изменение цвета, выделение или поглощение теплоты, появление запаха)
Учитель открывает слайды по мере ответов учащихся. И подводит итог по кластеру.
Овал “Типы реакций” остается пустыми, т.к. учащиеся еще не знают этой информации
— Ребята, мы с вами разобрали понятие химические реакции. Но мы не знаем, какие типы химических реакций существуют. Как вы думаете, какая тема нашего урока? (Типы химических реакций) Записываем тему в рабочие тетради.
— Как вы думаете, для чего нужно классифицировать реакции? (Для изучения химических свойств веществ, которые характеризуем химическими уравнениями)
— Решать расчетные задачи по уравнениям, ведь вы уже убедились, что если неверно составлено уравнение, не правильно расставлены коэффициенты задача будет решена неверно.
— Скажите, пожалуйста, что является результатом нашего труда? (научиться классифицировать химические реакции)
— Сегодня, по мере выполнения заданий, баллы за правильные ответы вы заносите в оценочные листы. В конце урока, мы подсчитаем сумму баллов, и вы получите отметки за работу на уроке. Напишите фамилию и имя на листах.
Работа у доски
На доске написаны реакции. Учитель вызывает к доске 2 учащихся и предлагает выполнить задание.
— Вспомним, как реализуется закон сохранения массы веществ в химических реакциях.
Задание. Расставить коэффициенты и объяснить.
- Al + CuCl2 → AlCl3 + Cu
- N2 + O2 → NO
- P + O2 → P2O5
- NaOH + h4PO4 → Na3PO4 + h3O
- h3O → h3 + O2
- Al2O3 + HCl→ AlCl3 + h3O
- KOH +h3SO4 → K2SO4 + h3O
- Al + O2 → Al2O3
2 ученика работают у доски, уравнивая по 4 реакции
— Остальным учащимся предлагаю выполнить задание на карточке №1, ответив вопрос:
Карточка №1
Выполняется ли закон сохранения массы в следующих схемах химических реакций? (Нужно ответить ДА или НЕТ)
Схемы химических реакций | Да/Нет |
Ca + Cl2→ CaCl2 | |
2C + O2 → 2CO | |
Fe(OH)2 → FeO + h3O | |
CaCO3 → CaO + CO2 | |
2Zn + HCl → ZnCl2 + h3 | |
Fe + CuCl2 → Cu + FeCl2 | |
АgNO3 + NaCl → AgCl + NaNO3 | |
Na2SO4 + BaCl2 → NaCl + BaSO4 |
Учитель проверяет выполненные задания. Ответы на карточку №1 выводит на экран.
Учащиеся сверяют свои ответы с эталоном (ответы «да» или «нет»)
— У всех совпало с ответом?
— Почему в некоторых уравнениях закон не сохраняется? (учитель выводит на экран схемы с коэффициентами, учащиеся определяют ошибки)
— Посчитайте количество правильных ответов и занесите в лист. 1 уравнение – 1 балл (максимально – 8 баллов)
— Посмотрите, пожалуйста, на уравнения реакций на доске. Найдите ошибки.
— Сколько типов реакций вы можете здесь выделить? ( 4 типа)
— Назовите номера реакций, которые вы отнесете к одному и тому же типу. (1 реакция – 1 тип, 2,3,8 – второй тип, 5 – третий тип, 4,6,7 — четвертый тип)
(учитель на доске обводит цветным мелом разные типы)
Учитель выводит на экран реакции, разделенные на типы:
Реакции соединения N2 + O2 → NO P + O2 → P2O5 Al + O2 → Al2O3 | Реакции замещения Al + CuCl2 → AlCl3 + Cu |
Реакции разложения h3O → h3 + O2 | Реакции обмена NaOH + h4PO4 → Na3PO4 + h3O Al2O3 + HCl→ AlCl3 + h3O KOH +h3SO4 → K2SO4 + h3O |
Изучение нового материала
— Химические реакции можно классифицировать по различным признакам. По числу и составу исходных веществ выделяют 4 типа химических реакций. Давайте подумаем, как они называются? В первой схеме, что происходит с веществами? (соединяются), реакции так и называются реакции соединения. Следующий тип, обратный предыдущему. Какая особенность этих реакций? (вещества распадаются) Или разлагаются — реакции разложения. В третьем типе реакций — участвует простое и сложное вещество, причем атомы простого вещества занимают место одного из атомов сложного вещества, замещают его — реакции замещения. Что необычного вы заметили в последнем типе реакций? (вещества меняются своими составными частями) Реакции так и называются — обмена.
Учитель делит учащихся на 4 варианта и предлагает выполнить задание тренажерной карты (дидактический материал № 8)
— А сейчас, на отдельном листочке бумаги, выполните задание: не переписывая реакции, под номерами укажите тип химической реакции.
— Обменяйтесь листочками друг с другом и сравните ответы с эталоном.
Ответы:
1 вариант 1. реакция соединения 2. реакция замещения 3. реакция замещения 4. реакция замещения 5. реакция соединения 6. реакция обмена 7. реакция обмена 8. реакция обмена 9. реакция соединения | 2 вариант 1. реакция замещения 2. реакция соединения 3. реакция замещения 4. реакция обмена 5. реакция соединения 6. реакция обмена 7. реакция замещения 8. реакция обмена 9. реакция разложения | 3 вариант 1. реакция соединения 2. реакция обмена 3. реакция замещения 4. реакция соединения 5. реакция обмена 6. реакция обмена 7. реакция обмена 8. реакция замещения 9. реакция замещения | 4 вариант 1. реакция замещения 2. реакция замещения 3. реакция замещения 4. реакция соединения 5. реакция разложения 6. реакция обмена 7. реакция обмена 8. реакция обмена 9. реакция соединения |
— Посчитайте число правильных ответов (1 реакция – 1 балл) и занесите в оценочный лист. Максимально – 9 баллов.
— А сейчас возьмите приложение №1 (Таблица «Типы химических реакций»). Посмотрите, пожалуйста, на таблицу. В ней описаны типы химических реакций, написаны правила составления уравнений каждого типа. На протяжении урока вы будете работать с этой таблицей, занося в свободные ячейки уравнения химических реакций.
На экране записана схема: NaOH + CuSO4 →
— Как вы думаете, к какому типу относится данная реакция? (обмен) В таблице запишите реагенты и закончите уравнение химической реакции.
— Посмотрите по правилам протекания реакций обмена, возможна ли эта реакция? (Да) Почему? (образуется осадок)
Учитель выводит на экран продукты реакции.
2NaOH + CuSO4 = Сu(OH)2↓+ Na2SO4
— Мы с вами спрогнозировали результат данной реакции. Давайте, убедимся, на практике проведя эксперимент. Правила ТБ Помните, при работе со щелочами, аккуратно обращайтесь с реактивами.
Учащиеся проводят опыт, наблюдают за образованием осадка.
— Какие изменения вы наблюдаете? (Появление осадка синего цвета)
Вывод: Таким образом, произошла реакция обмена, т. к. в ней принимали участие два сложных вещества, в результате образовались два новых вещества.
Учитель выводит на экран схему:
Cu(OH)2 →
— Как вы думаете, к какому типу реакций можно отнести данную реакцию? (разложения)
— Запишите в карте продукты, ориентируясь на правила написания.
t
Cu(OH)2 → CuO + h3O
— Оксид меди, это осадок черного цвета. Давайте убедимся, что реакция разложения протекает при нагревании. Для этого возьмите пробирку, в которой получен гидроксид меди (II), закрепите в пробиркодержатель, проведите нагревание.
—Напомните мне правила работы со спиртовкой. (Сначала прогреваем всю пробирку, а затем нагреваем раствор; нагревание проводим в верхней части пламени, т. к. именно оно обладает самой высокой температурой.)
Учащиеся проводят опыт “разложение гидроксида меди (II)”, наблюдают за происходящими изменениями.
– Какие изменения вы наблюдаете? (Появление черного осадка, а на стенках пробирки капли воды)
Вывод: Таким образом, произошла реакция разложения, т. к. из одного сложного вещества образовалось два новых вещества.
Учитель выводит на экран схему:
Сu + O2 →
— Как вы думаете, к какому типу реакций можно отнести данную реакцию? (соединения)
— Запишите в карте продукты, ориентируясь на правила написания.
2Сu + O2 = 2CuO
— Какого цвета оксид меди? (черный) Давайте убедимся в этом.
— Проведем реакцию. Прокалите колечко медной проволоки над зажженной спиртовкой. (УЧИТЕЛЬ НАПОМИНАЕТ ПРАВИЛА РАБОТЫ СО СПИРТОВКОЙ)
Учащиеся проводят опыт, наблюдают за происходящими изменениями.
— Что вы наблюдаете? (образование черного налета)
Вывод: Таким образом, произошла реакция соединения, т. к. из двух веществ образовалось одно новое вещество.
Учитель выводит на экран схему:
CuSO4 + Zn →
— Как вы думаете, к какому типу реакций можно отнести данную реакцию? (замещения)
— Допишите реакцию, ориентируясь на правила написания в таблице. Что выделяется в результате реакции? (чистая медь красно-коричневого цвета)
CuSO4 + Zn = ZnSO4 + Cu
— Проведем опыт. В пробирку опустим гранулу цинка и прильем раствор сульфата меди.(ПРАВИЛА ТБ)
Учащиеся проводят опыт, наблюдают за образованием осадка.
— Какие изменения происходят? (Гранула цинка покрывается налетом – медью)
Вывод: Таким образом, произошла реакция замещения, в которой участвовало простое и сложное вещество, получены два новых вещества.
Закрепление
— Ребята, посмотрите внимательно на экран, определите тип реакции и выберите лишнее. Почему?
Третий лишний.
1 группа
- 4P+5O2 →2P2O5
- Fe+S=FeS
- 2HgO→2Hg+O2
2 группа
- 2h3O→2h3 +O2
- CaCO3 →CaO+CO2
- 2Cu+O2→2CuO
3 группа
- 2KClO3 →2KCl+3O2
- 2KMnO4 →K2MnO4 +MnO2 +O2
- Zn+2HCl→ZnCl2 +h3
— А сейчас возьмите карточку №2 и выполните задания самостоятельно
Карточка №2
1. Восстановите пропущенную запись, укажите тип химической реакции, расставьте коэффициенты:
а) ? + h3SO4 = Al2(SO4)3 + h3 б) Mg + ? = MgO
в) Na2O + ? = NaOH г) Zn + ? = ZnО
2. Определите правую часть уравнения реакции по его левой части.
Левая часть уравнения | Правая часть уравнения |
А. Сu(OH)2 = Б. Сu + S = |
|
3. Найдите ошибки в предложенных реакциях, укажите их количество и исправьте.
а) h3 + O2 = h3O – реакция соединения
б) 2KCl + AgNO3 = KNO3 + AgCl↓ – реакция обмена
в) Mg(OH)2 + HNO3 = Mg(NO3)2 + 2h3O – реакция обмена
г) Cu + HCl = CuCl2 + h3 – реакция замещения
д) FeCl3 + 3NaOH = Fe(OH)3 +3NaCl – реакция замещения
е) Na2O + h3O = 2NaOH — реакция замещения
— Обменяйтесь карточками, проверьте ответы одноклассников по образцу. Посчитайте баллы 1 уравнение – 1 балл. Общая сумма баллов за задания: 12 баллов
— Занесите баллы в оценочный лист и подсчитайте общую сумму баллов и определите отметки за урок.
Учитель выводит критерии отметок:
29-25 – отметка «5»
24-18 – отметка «4»
17-10 – отметка «3»
— Поднимите руку, у кого «5». А «4» есть?
Подведение итога и рефлексия
Учитель подводит итог урока
— Ребята, как вы думаете, достигли ли мы цели урока?
— Сможете ли вы по числу и составу реагентов и продуктов определить тип химической реакции?
— Сейчас еще раз проверим. О каких реакциях идет речь?
Ты было сложным, я простым, мы встретились однажды,
В тебе я атом заместил, мы подружились даже.
И сразу изменился мир: я сложным стал, а ты простым. (замещения)
Нас было много, мы соединились,
В одно большое вместе превратились.
Такое процесс объединения – реакция … (соединения)
Когда два сложных вещества в реакцию вступают,
Меняются фрагментами (себя не обижают),
И происходят с ними тут простые перемены
Такой процесс мы назовем реакцией … (обмена)
Учитель предлагает учащимся проанализировать свое эмоциональное состояние:
— Покажите, что вы нарисовали.
— Сдайте, пожалуйста, оценочные листы.
— Домашнее задание: конспект (приложение №1), выполнить упражнение письменно (карточка №3)
Карточка №3
Допишите практически осуществимые уравнения реакций, расставьте коэффициенты, укажите типы реакций
Тип реакции | Уравнение реакции |
а) CuCl2 + Zn → | |
б) Fe(OH)2 → | |
в) KI + Pb(NO3)2 → | |
г) Ca + O2 → |
— Спасибо за работу на уроке!
Список литературы:
1. Габриелян О.С. Химия.8 класс: учебник. 18-е изд., стереотип. – М.:Дрофа, 2013. – 270с.
2. Занимательные задачи по химии под ред Н.Е.Дерябиной. – М.:ИПО «У Никитских ворот», — 48с.
Задания по теме «Типы химических реакций» (8 класс)
Задания по теме «Типы химических реакций»
Какие из приведенных схем выражают реакцию разложения?
а) CaO + H2O Ca(OH)2
б) CuCl2 + 2KOH Cu(OH)2 + 2KCl
в) Zn + H2SO4 ZnSO4 + H2
г) CaCO3 CaO + CO2
Какие из приведенных схем выражают реакцию замещения?
а) Fe3O4 + 4H2 3Fe + 4H2O
б) MnO2 + Al Mn + Al2O3
в) Ca + 2HCl CaCl2 + H2
г) 2NO + O2 2NO2
Какие из приведенных схем выражают реакцию обмена?
а) CH4 + 2O2 CO2 + 2H2O
б) CaO + H2O Ca(OH)2
в) 2KOH + H2SO4 K2SO4 + 2H2O
г) Fe2O3 + 6HCl 2FeCl3 + 3H2O
Какие из приведенных схем выражают реакцию соединения?
а) 2NO + O2 2NO2
б) 4HNO3 2H2O + 4NO2 + O2
в) CuSO4 + 2NaOH Cu(OH)2 + Na2SO4
г) CaCO3 CaO + CO2
Какие из приведенных схем выражают реакцию обмена?
а) 2Al + 6HCl 2AlCl 3 + 3H2
б) 2Na + 2H2O 2NaOH + H2
в) CuO + H2SO4 CuSO4 + H2O
г) Al2O3 + 6HCl 2AlCl3 + 3H2O
Типы химических реакций — Химия
Тема: Типы химических реакций
Класс: 8
Цель урока: обеспечение усвоения учащимися понятия классификации химических реакций, деления их на типы.
Задачи:
Образовательные — развить навыки самостоятельной работы, умения записывать уравнения реакций и расставлять коэффициенты, указывать типы реакций, делать выводы и обобщения.
Развивающие — развить речевые навыки, способности к анализу; развитие познавательных способностей, мышления, внимания, умения использовать изученный материал для познания нового.
Воспитательные — воспитание самостоятельности, сотрудничества, нравственных качеств — коллективизма, способности к взаимовыручке, адекватной самооценке.
Оборудование и реактивы:
компьютер
проектор
презентация «Типы химических реакций» (Приложение1.)
на столах у учащихся инструктивная карточка для проведения исследования
набор соответствующих реактивов, пробирки, спиртовка и т.п.
карточки с тестом для проверки знаний по теме: «Типы химических реакций»
смайлики для оценки эмоционального состояния учащихся во время урока.
Парты в классе расставлены так, чтобы весь класс был разделен на 4 группы, в каждой группе есть ассистент, он отмечает в учетных карточках группы положительные ответы учеников.
Тип урока: урок изучения нового материала и закрепления полученных знаний.
Методы:
словесный, проблемно-поисковый, наглядный, практический, исследовательский.Ход урока
I. Организационный этап (1 слайд) Приветствие Проверка присутствующих на уроке
II. Мотивационный этап (2 слайд)
Учитель:
Всё, что нас окружает, состоит из веществ. Кажется, что они живут своей жизнью, таинственной и непостижимой. Взаимодействуя, они изменяют свои свойства и состав. И задача человека, изучив этот мир, постараться использовать полученные знания во благо.
Сегодня мы продолжим знакомство с этим удивительным и волшебным миром химических реакций.
О чем же пойдет речь на сегодняшнем уроке? (3 слайд)
Чтобы ответить на этот вопрос, попробуйте отгадать загадку: » Она идет, она прошла, никто не скажет, что пришла. Она (химическая реакция).
III. Актуализация опорных знаний. (беседа)
Учитель:
Так о чем же пойдет речь на сегодняшнем уроке? (О химических реакциях)
А что такое химическая реакция? (4 слайд) (Это явление, при котором из одних веществ образуются другие)
Каковы признаки химических реакций? (5 слайд) ( Изменение цвета, выпадение осадка, выделение тепла и света, выделение газа — это признаки химических реакций)
Каковы условия возникновения химических реакций? (6 слайд) (Измельчение, нагревание, соприкосновение, растворение и смешивание веществ — это условия проведения реакций)
Как много химических реакций окружает нас в жизни? (Великое множество различных реакций окружает нас в жизни )
Что может помочь нам в изучении многообразия химических реакций? (Классификация химических реакций) (7 слайд)
Что такое классификация? (Деление на группы)
Верно. Так что же будет являться целью нашего сегодняшнего урока? (Изучение типов химических реакций и их классификация)
Запишите тему урока в тетрадь (8 слайд)
IV. Этап выявления существенных признаков для определения типов химических реакций.
На экране появляется 9 слайд, на котором представлены несколько химических реакций:
2H2 + O2 — 2H2O;
CaO + H2O — Ca(OH)2
Cu(OH)2 — CuO + H2O;
2HgO — 2Hg + O2
— можно ли выделить признак, по которому эти реакции, возможно, разделить на группы?
— различаются ли между собой реакции одной группы?
В ходе обсуждения учащиеся приходят к выводу, что одним из признаков, по которому можно классифицировать химические реакции является число и состав вступающих и образующихся в результате реакции веществ.
Введение понятия реакции соединения.
На экране появляется слайд № 10, на котором представлены реакции:
(1) 2H2 + O2— 2H2O;
(2) 4P + 5O2 — 2P2O5;
(3) Na2O + SO3 — Na2SO4;
(4) CaO + H2O — Ca(OH)2
Обсуждаются вопросы:
— что объединяет все эти реакции?
— в чём их отличие?
— как одним словом мы можем назвать процесс, который протекает?
Учащиеся приходят к выводу, что идет процесс соединения веществ (реакции соединения), но в первом и втором случаях вступают в реакцию простые вещества, в третьем и четвертом — сложные вещества. Во всех реакциях образуется одно сложное вещество.
Учитель предлагает учащимся попытаться вывести определение этого типа реакций (наиболее подготовленные учащиеся делают это легко) и, используя буквы А, В, С, вывести уравнение реакции соединения в общем виде:
A + B — AB
AB + CB — AB2 C
Введение понятий реакции разложения, замещения, обмена.
По такой же схеме, как и реакции соединения, изучаются реакции разложения, замещения, обмена (слайды №,11,12,13).
После изучения всех типов реакций появляется слайд № 14 и проводится обобщение материала.
Итак, мы узнали, как классифицируют химические реакции.
V. Самостоятельная работа по группам. (слайд №15)
А теперь проведем лабораторные исследования и определим, к какому типу принадлежит реакция проведенная вами.
1 группа — лабораторный опыт по реакции замещения,
2 группа — лабораторный опыт по реакции обмена,
3 группа — лабораторный опыт по реакции разложения,
4 группа — лабораторный опыт по реакции соединения.
Образец инструктивной карточки для проведения опыта:
Железный гвоздь опустите в раствор сульфата меди (II). Через 2 минуты выньте гвоздь. Что наблюдаете? Кирпично-красный цвет налета на гвозде говорит об образовании чистой меди. Спрогнозируйте, что образовалось еще? Запишите уравнения реакции. Определите тип реакции. Укажите признаки, по которым вы определили, что реакция прошла?
По одному человеку от группы отчитываются. Зачитывают уравнения реакций с комментарием. Затем на экране высвечивается правильная соответствующая запись уравнения. (слайд №16)
VI. Проверка знаний. (Рефлексия) (слайд №17)
Каждый ученик в группе получает карточку с заданием тестом и выполняет ее в течение 10 минут.
Тест состоит из 2-х частей: часть А включает 4 вопроса с выбором ответа, а часть Б — 2 вопроса на восстановление недостающих записей уравнений химических реакций.
ВАРИАНТ № 1
А.
1. (2 балла) Физическое явление – это:
а) ржавление железа
б) горение древесины
в) плавление свинца
2. (2 балла) Уравнение реакции обмена:
а) CaO + SiO2 = CaSiO3
б) FeS + 2 HCl = FeCl2 + H2S
в) 2 KClO3 = 2 KCl + 3O2
3. (3 балла) По данной левой части уравнения CuO + H2SO4 = … восстановите его правую часть.
а) CuSO4 + H2O
б) CuSO4 + 2 H2O
в) CuSO4 + H2
4. (2 балла) Из нескольких простых или сложных веществ образуется одно более сложное вещество в реакции:
а) замещение
б) обмена
в) разложение
г) соединение
Б.
5. (6 баллов) Расставьте коэффициенты в схемах и укажите типы химических реакций:
а) Li + O2  Li2O
Li2O
 Al2O3 + Fe
Al2O3 + Fe6. (7 баллов) Восстановите пропущенную запись и укажите тип химической реакции:
а) ? + 2 HCl = FeCl2 + H2
б) 2 Al + ? = 2 AlCl3
ВАРИАНТ № 2
А.
1. (2 балла) Химическое явление – это:
а) горение свечи
б) испарение бензина
в) плавление льда.
2. (2 балла) Уравнение реакции разложения:
а) CaO + SiO2 = CaSiO3
б) FeS + 2 HCl = FeCl2 + H2S
в) 2 KNO3 = 2 KNO2 + O2
3.(3 балла) По данной правой части уравнения … = CuCl2 + 2 H2O восстановите его левую часть.
а) Cu + 2 HCl
б) Cu(OH)2 + 2 HCl
в) CuO + 2 HCl
4. (2 балла) Из одного сложного вещества образуется два или более новых веществ в реакции:
а) замещение
б) обмена
в) разложение
г) соединение
Б.
5. (6 баллов) Расставьте коэффициенты в схемах и укажите типы химических реакций:
а) CuO + HCl  CuCl2 + H2O
CuCl2 + H2O
б) NH3 N2 + H2
N2 + H2
6. (7 баллов) Восстановите пропущенную запись, укажите тип химической реакции:
а) Fe2O3 + 3 H2 = ? + 3 H2O
б) Zn + ? = ZnCl2 + H2
ВАРИАНТ № 3
А.
1. (2 балла) Физическое явление – это:
а) испарение воды
б) горение керосина
в) скисание молока.
2. (2 балла) Уравнение реакции замещения:
а) BaO + H2O = Ba(OH)2
б) CuO + H2 = Cu + H2O
в) 3 KOH + H3PO4 = K3PO4 + 3 H2O
3. (3 балла) По данной левой части уравнения ZnO + 2 HCl =… восстановите его правую часть.
а) ZnCl2 + H2O
б) ZnCl2 + 2 H2O
в) ZnCl2 + H2
4. (2 балла) Из одного сложного вещества образуется два или более новых веществ в реакции:
а) замещение
б) обмена
в) разложение
г) соединение
Б.
5. (6 баллов) Расставьте коэффициенты в схемах и укажите типы химических реакций:
а) Fe2O3 + HCl  FeCl3 + H2O
FeCl3 + H2O
б) NO + O2  NO2
NO2
6. (7 баллов) Восстановите пропущенную запись, укажите тип химической реакции:
а) ? + H2SO4 = ZnSO4 + H2
б) 4 Al + ? = 2 Al2O3
ВАРИАНТ № 4
А.
1. (2 балла) Химическое явление – это:
а) плавление олова
б) горение магния
в) замерзание воды..
2. (2 балла) Уравнение реакции соединения:
а) N2 + O2 = 2 NO
б) CaCO3 = CaO + CO2
в) CH4 + 2 O2 = CO2 + 2 H2O
3. (3 балла) По данной левой части уравнения Zn(OH)2 + 2 HCl = … восстановите его правую часть.
а) ZnCl2 + H2
б) ZnCl2 + H2O
в) ZnCl2 + 2 H2O
4. (2 балла) Из двух сложных веществ образуется два новых сложных вещества в реакции
а) замещение
б) обмена
в) разложение
г) соединение
Б.
5 (6 баллов) Расставьте коэффициенты в схемах и укажите типы химических реакций:
а) Al2O3 + H2SO4  Al2(SO4)3 + H2O
Al2(SO4)3 + H2O
б) H2 + Cl2  HCl
HCl
6. (7 баллов) Восстановите пропущенную запись, укажите тип химической реакции:
а) Mg + 2 HCl = ? + H2
б) 2 Na + ? = 2 NaCl
(При наличии времени проводится взаимопроверка и оценивание друг друга).
Затем ученикам предлагается выбрать карточки с изображением смайликов характеризующих их эмоциональное состояние на уроке.
Ассистенты делают анализ работы их групп.
VII. Домашнее задание. Итоги урока. Выставление оценок. (слайд №18.)
Оформить на альбомном листе работу, где необходимо привести примеры разных типов реакций и нарисовать рисунки, иллюстрирующие эти типы.
Примеры таких работ приведены на следующих слайдах.
Если осталось время.
Дано K2SO4 + AgNO3 = … Какова правая часть уравнения? Каков тип реакции? Почему?
Расставьте коэффициенты и укажите тип реакции. Fe + Cl2 FeCl3 объяснить.
FeCl3 объяснить.
Проверочная работа по химии 8 класс » Типы химических реакций»
Химические реакции. Вариант 1.
1. Расставьте коэффициенты, определите тип реакции:
а) H2 + N2 →NH3
б) CO +O2 → CO2
в) HNO3 → NO2+H2O+O2↑
г ) Ca3N2 + H2O → Ca(OH)2 + NH3↑
д) Ba + H2O → Ba(OH)2 + H2↑
2. Дописать уравнения реакций, расставить коэффициенты, назвать сложные вещества.
а) Реакция соединения: Ag + O2 →
б) Реакция соединения: P +Cl2→
в) Реакция замещения: Сr2O3 + C →
г) Реакция обмена: Al2O3 + HCI →
3. Газ выделяется при взаимодействии растворов. Написать уравнения.
1) хлорида калия и серной кислоты
2) карбоната кальция и азотной кислоты
3) серной кислоты и гидроксида бария
4) фосфата натрия и соляной кислоты
Вариант 2.
1. Расставьте коэффициенты, определите тип реакции:
а) Mg + N2 →Mg3N2
б) C +Cr2 O3→ CO2 +Cr
в) HNO3 + CaO→ Ca(NO3)2+H2O
г ) Na + H2O → NaOH+ H2↑
д) Ba O+ H2SO4 → BaSO4 ↓+ H2O
2. Дописать уравнения реакций, расставить коэффициенты, назвать сложные вещества.
а) Реакция соединения: Al+ O2 →
б) ) Реакция соединения: Mg +Cl2→
в) Реакция замещения: MnO2 + H2 →
г ) Реакция обмена: Al2O3 + H2SO4 →
3. С выделением газа протекает реакция между
1) силикатом калия и гидроксидом кальция
2) карбонатом кальция и соляной кислотой
3) нитратом цинка и оксидом бария
4) сульфатом калия и хлоридом магния
Вариант 3.
1. Расставьте коэффициенты, определите тип реакции:
а) P + S →P2S3
б) CuO +Al → Al2O3 +Cu
в) HNO3 + CaCO3→ Ca (NO3)2+H2O +CO2↑
г ) KClO3 → KCl+ O2↑
д) KOH+ H3PO4 → K3PO4 + H2O
2. Дописать уравнения реакций, расставить коэффициенты, назвать сложные вещества.
а) Реакция соединения: B+ O2 →
б) ) Реакция соединения: Al +S→
в) Реакция замещения: Cr2O3 + C→
г ) Реакция разложения(электролиз): H2O →
3. Какое уравнение соответствует реакции обмена
1) Zn + H₂SO₄ = ZnSO₄ + H₂
2) Ba + 2H₂O = Ba(OH)₂ + H₂
3) Na₂O + 2HCI = 2NaCI + H₂O
4) 2AI(OH)₃ = AI₂O₃ + 3H₂O
Вариант 4.
1. Расставьте коэффициенты, определите тип реакции:
а) P2О5 + Н2О →Н3РО4
б) Cl2+Al → AlCl3
в) NaNO3 → NaNO2+O2↑
г ) KBr +Cl2 → KCl+ Br2↑
д) K2O+ H3PO4 → K3PO4 + H2O
2. Дописать уравнения реакций, расставить коэффициенты, назвать сложные вещества.
а) Реакция соединения: B+ O2 →
б) ) Реакция соединения: Al +N2→
в) Реакция замещения: FeO + Al →
г ) Реакция обмена Al2O3 + НСl →
3.С выделением газа протекает реакция между:
1) карбонатом натрия и нитратом магния
2) фосфорной кислотой и нитратом бария
3) хлоридом аммония и гидроксидом кальция
4) хлоридом калия и нитратом серебра
Вариант 5.
1. Расставьте коэффициенты, определите тип реакции:
а) N2О5 + Н2О →НNО3
б) Li + Cl2 → LiCl
в) Cu(NO3) → CuO+O2↑+NO2↑
г ) KOH +AlCl3 → KCl+ Al(OH)3↓
д) Mg+ H3PO4 → Mg3(PO4)2 + H2↑
2. Дописать уравнения реакций, расставить коэффициенты, назвать сложные вещества.
а) Реакция соединения: Ba+ N2 →
б) ) Реакция соединения: K +Cl2→
в) Реакция замещения: Fe2O3 + Mg →
г ) Реакция разложения: HgO →
3. Выделение газа происходит в результате реакции серной кислоты с
1) гидроксидом калия
2) карбонатом натрия
3) оксидом калия
4) нитратом свинца
Вариант 6.
1. Расставьте коэффициенты, определите тип реакции:
а) P2О5 + Н2О →Н3РО4
б) Cl2+Al → AlCl3
в) NaNO3 → NaNO2+O2↑
г ) KBr +Cl2 → KCl+ Br2↑
д) K2O+ H3PO4 → K3PO4 + H2O
2. Дописать уравнения реакций, расставить коэффициенты, назвать сложные вещества.
а) Реакция соединения: B+ O2 →
б) ) Реакция соединения: Al +N2→
в) Реакция замещения: FeO + Al →
г ) Реакция разложения(электролиз): Al2O3 →
3. Выделение газа происходит в результате реакции серной кислоты с… Написать уравнение
1) SO₃ 2)HNO₃ 3) KCI 4) HBr
Вариант 7.
1. Расставьте коэффициенты, определите тип реакции:
а) K2O + Н2О → KOH
б) Li + N2 → Li3N
в) AgNO3 → Ag +O2↑+NO2↑
г ) KOH +CuSO4 → K2SO4+ Cu(OH)2↓
д) Mg+ HCl → MgCl2 + H2↑
2. Дописать уравнения реакций, расставить коэффициенты, назвать сложные вещества.
а) Реакция соединения: Ba+ N2 →
б) ) Реакция соединения: K +Cl2→
в) Реакция замещения: Fe2O3 + Mg →
г ) Реакция разложения(электролиз): HgO →
3.К реакциям обмена относится взаимодействие между
1) оксидом натрия и углекислым газом
2) хлоридом железа (||) и хлором
3) соляной кислотой и гидроксидом магния
4) ортофосфорной кислотой и цинком
Вариант 8.
1. Расставьте коэффициенты, определите тип реакции:
а) K2O + P2O5 → K3PO4
б) Li + N2 → Li3N
в) AgNO3 → Ag +O2↑+NO2↑
г ) KOH +CuSO4 → K2SO4+ Cu(OH)2↓
д) Mg+ HCl → MgCl2 + H2↑
2. Дописать уравнения реакций, расставить коэффициенты, назвать сложные вещества.
а) Реакция соединения: N2 +O2→
б) ) Реакция соединения: S+Cl2→
в) Реакция обмена: Fe2O3 + H2SO4 →
г ) Реакция разложения(электролиз):NaCl →
3.Какое уравнение соответствует реакции обмена
1) CuO + H₂SO₄ = CuSO₄ + H₂O
2) CaO + H₂O = Ca(OH)₂
3) Zn + 2HCI = ZnCI₂ + H₂
4) 2Cr(OH)₃ = Cr₂O₃ + H₂O
Вариант 9.
1. Расставьте коэффициенты, определите тип реакции:
а) K2O + Н2О → KOH
б) А l+ S → Al2S3
в) Fe(OH)3 → Fe2O3 + H2O
г ) NaOH +FeSO4 → K2SO4+ Fe(OH)2↓
д) Zn + HCl → ZnCl2 + H2↑
2. Дописать уравнения реакций, расставить коэффициенты, назвать сложные вещества.
а) Реакция соединения: Ba+ Br2 →
б) ) Реакция соединения: Fe +Cl2→
в) Реакция обмена: Fe2O3 + HNO3 →
г ) Реакция разложения(электролиз) KCl→
3. Какое уравнение соответствует реакции обмена
1) Zn + H₂SO₄ = ZnSO₄ + H₂
2) Ba + 2H₂O = Ba(OH)₂ + H₂
3) Na₂O + 2HCI = 2NaCI + H₂O
4) 2AI(OH)₃ = AI₂O₃ + 3H₂O
Вариант 10.
1. Расставьте коэффициенты, определите тип реакции:
а) NO2 + Н2О+O2 → HNO3
б) А l2O3+ SO3 → Al2(SO4)3
в) Fe(OH)3 → Fe2O3 + H2O
г ) NaOH +H3PO4 → Na3PO4+ H2O
д) ZnO + HCl → ZnCl2 + H2O
2. Дописать уравнения реакций, расставить коэффициенты, назвать сложные вещества.
а) Реакция соединения: K+ Br2 →
б) ) Реакция соединения: P +Cl2→
в) Реакция обмена: FeO + HNO3 →
г ) Реакция разложения(электролиз) LiCl→
3. С выделением газа протекает реакция между
1) силикатом калия и гидроксидом кальция
2) карбонатом кальция и соляной кислотой
3) нитратом цинка и оксидом бария
4) сульфатом калия и хлоридом магния
Вариант 11.
1. Расставьте коэффициенты, определите тип реакции:
а) SO2 +O2 → SO3
б) P+ S → P2S3
в) Cr(OH)3 → Cr2O3 + H2O
г ) Ba(OH)2 +H3PO4 → Ba3(PO4)2+ H2O
д) Zn + HCl → ZnCl2 + H2↑
2. Дописать уравнения реакций, расставить коэффициенты, назвать сложные вещества.
а) Реакция соединения: MgО+ SiO2 →
б) ) Реакция соединения: P +O2→
в) Реакция обмена: CuO + HNO3 →
г ) Реакция разложения(электролиз) LiF→
3. Газ выделяется при взаимодействии растворов. Написать уравнения.
1) хлорида калия и серной кислоты
2) карбоната кальция и азотной кислоты
3) серной кислоты и гидроксида бария
4) фосфата натрия и соляной кислоты
Вариант 12.
1. Расставьте коэффициенты, определите тип реакции:
а) Н2 +O2 → Н2О
б) Сl2+ O2 → Cl2O7
в) CuOH → Cu2O + H2O
г ) Ba(OH)2 +HPO3→ Ba (PO3)2+ H2O
д) Fe + HCl → FeCl2 + H2↑
2. Дописать уравнения реакций, расставить коэффициенты, назвать сложные вещества.
а) Реакция соединения: Н2 +N2 →
б) ) Реакция замещения: К +НОН→
в) Реакция обмена: CuO + H2SO4 →
г ) Реакция разложения(электролиз) BaF2→
3. К реакциям обмена относится взаимодействие между. Написать уравнения.
1) оксидом калия и водой
2) хлором и кислородом
3) азотной кислотой и гидроксидом бария
4) серной кислотой и магнием
Вариант 13.
1. Расставьте коэффициенты, определите тип реакции:
а) Н2 +N2 → NH3
б) С +Ca → CaC2
в) KClO3 → KCl + O2↑
г ) Mg Cl2 +AgNO3→ Mg (NO3)2+ AgCl↓
д) Al + H2SO4→ Al2(SO4)3 + H2↑
2. Дописать уравнения реакций, расставить коэффициенты, назвать сложные вещества.
а) Реакция соединения: F2 +B →
б) ) Реакция замещения: Ca +НОН→
в) Реакция обмена: Ba(NO3)2 + Na2SO4 →
г ) Реакция разложения(электролиз) CaO→
3. Осадок не образуется при смешивании растворов
1) карбоната натрия и серной кислоты
2) сульфата натрия и нитрата бария
3) карбоната кальция и соляной кислоты
4) сульфита калия и хлорида бария
Вариант 14.
1. Расставьте коэффициенты, определите тип реакции:
а) Н2 +F2 → HF
б) С +Na → Na4C
в) KMnO4 → K2MnO4 + MnO2 + O2↑
г ) Mg(OH)2 +HNO3→ Mg (NO3)2+ H2O
д) Al + HBr→ AlBr3 + H2↑
2. Дописать уравнения реакций, расставить коэффициенты, назвать сложные вещества.
а) Реакция соединения: Н2 +Cl2 →
б) ) Реакция замещения: Ba +НОН→
в) Реакция обмена: BaCl2 + H2SO4 →
г ) Реакция разложения(электролиз) BaO→
3. Какое уравнение соответствует реакции обмена
1) Zn + H₂SO₄ = ZnSO₄ + H₂
2) Ba + 2H₂O = Ba(OH)₂ + H₂
3) Na₂O + 2HCI = 2NaCI + H₂O
4) 2AI(OH)₃ = AI₂O₃ + 3H₂O
Вариант 15.
1. Расставьте коэффициенты, определите тип реакции:
а) SO2 +O2 → SO3
б) P+ S → P2S3
в) Cr(OH)3 → Cr2O3 + H2O
г ) Ba(OH)2 +H3PO4 → Ba3(PO4)2+ H2O
д) Zn + HCl → ZnCl2 + H2↑
2. Дописать уравнения реакций, расставить коэффициенты, назвать сложные вещества.
а) Реакция соединения: MgО+ SiO2 →
б) ) Реакция соединения: P +O2→
в) Реакция обмена: CuO + HNO3 →
г ) Реакция разложения(электролиз) LiF→
3. Газ выделяется при взаимодействии растворов. Написать уравнения.
1) хлорида калия и серной кислоты
2) карбоната кальция и азотной кислоты
3) серной кислоты и гидроксида бария
4) фосфата натрия и соляной кислоты
Урок химии «Типы химических реакций (8 класс)
Учитель высшей категории
Анисимова Тамара Алексеевна
МБОУ «Лицей №28г.Йошкар-Олы»
Республика Марий Эл
Урок «Типы химических реакций»
8 класс
Цель урока: Сформировать понятия: реакция соединения, разложения, замещения, обмена.
Задачи:
Образовательные:
Систематизировать знания учащихся о явлениях, происходящих с веществами, совершенствовать умения школьников при составлении химических уравнений, рассмотреть классификацию веществ по «числу и составу исходных и образующихся веществ».
Развивающие:
Совершенствование умения сравнивать и обобщать; развитие памяти, устойчивого внимания, самостоятельного мышления, умения быстро и четко формулировать и высказывать свои мысли, логически рассуждать, развитие интереса к предмету.
Продолжить формирование экспериментальных навыков работы учащихся при работе с лабораторным оборудованием и реактивами; формирование умения оформлять результаты учебного эксперимента.
Воспитательные:
Формирование научного мировоззрения учащихся; воспитание культуры общения через работу в парах ученик–ученик, учитель–ученик; воспитание таких качеств личности, как наблюдательность, пытливость, инициатива, стремление к самостоятельному поиску.
Тип урока: Урок изучения нового материала.
Оборудование: Компьютер учителя, проектор.
Оборудование и реактивы для проведения демонстрационных опытов:
Малахит в порошке, магний, соляная кислота, сульфат меди(2), гидроксид натрия
Пробирки, штатив, спиртовка, газоотводная трубка, спички.
Оборудование и реактивы для проведения лабораторного опыта:
Штатив для пробирок, пробирки; спиртовка, спички.
Раствор сульфата меди (II), гидроксида натрия, медная проволока, железный гвоздь, хлорид железа (3)
Основные понятия: Физические и химические явления, условия возникновения химических реакций, признаки протекания химических реакций, уравнение химической реакции, классификация химических реакций: типы химических реакций по числу и составу исходных и образующихся веществ (соединения, разложения, замещения, обмена),
Ход урока
I. Организационный этап Проверка присутствующих на уроке
II. Мотивационный этап)
Всё, что нас окружает, состоит из веществ. Кажется, что они живут своей жизнью, таинственной и непостижимой. Взаимодействуя, они изменяют свои свойства и состав. И задача человека, изучив этот мир, постараться использовать полученные знания во благо.
Сегодня мы продолжим знакомство с этим удивительным и волшебным миром химических реакций.
О чем же пойдет речь на сегодняшнем уроке?
Чтобы ответить на этот вопрос, попробуйте отгадать загадку: » Она идет, она прошла, никто не скажет, что пришла. Она (химическая реакция).
III. Актуализация опорных знаний. (беседа)
1. Так о чем же пойдет речь на сегодняшнем уроке? (О химических реакциях)
2. А что такое химическая реакция? (4 слайд) (Это явление, при котором из одних веществ образуются другие)
3. Каковы признаки химических реакций? (5 слайд) ( Изменение цвета, выпадение осадка, выделение тепла и света, выделение газа — это признаки химических реакций)
4. Каковы условия возникновения химических реакций? (6 слайд) (Измельчение, нагревание, соприкосновение, растворение и смешивание веществ — это условия проведения реакций)
5. Как много химических реакций окружает нас в жизни? (Великое множество различных реакций окружает нас в жизни )
6. Что может помочь нам в изучении многообразия химических реакций? (Классификация химических реакций) (7 слайд)
7. Что такое классификация? (Деление на группы)
8. Верно. Так что же будет являться целью нашего сегодняшнего урока? (Изучение типов химических реакций и их классификация)
Вывод учителя: Химических реакций протекающих вокруг человека очень много. Они протекают постоянно. Что же необходимо сделать, чтобы не запутаться во всём многообразии химических реакций?
— Научиться классифицировать и выявлять существенные признаки классов.
Запишите тему урока в тетрадь (8 слайд)
IV. Этап выявления существенных признаков для определения типов химических реакций.
Решим проблему: как можно классифицировать химические реакции? Посмотроте на слайд. Я разместила химические реакции в 2 столбика. Посмотрите, по числу и составу веществ, вступивших в реакцию и образовавшихся можно ли как-то различить реакции левого и правого столбиков.
Определите тип химической реакции:
K + O2 —- K2O CaCO3 ——
K2O CaCO3 —— CaO + H2O
CaO + H2O
MgO + H2O —- Mg(OH)2 KClO3 ——
Mg(OH)2 KClO3 —— KCl + O2
KCl + O2
H2 + Cl2 ——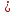 HCl CuOH ——
HCl CuOH ——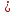 Cu2O + H2O
Cu2O + H2O
Al + S ———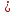 Al2S3 H2O ——
Al2S3 H2O ——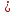 H2 + O2
H2 + O2
Тип:______________ тип:____________________
Fe + HCl —- FeCl2 + H2 FeO + HCl ——
FeCl2 + H2 FeO + HCl —— FeCl2 + H2O
FeCl2 + H2O
C + MgO —— CO2 + Mg ZnO + HNO3 —-
CO2 + Mg ZnO + HNO3 —- Zn(NO3)2 + H2O
Zn(NO3)2 + H2O
Al + TiO2 —— Al2O3 + Ti NaOH + CuCl2 ——
Al2O3 + Ti NaOH + CuCl2 —— Cu(OH)2 + NaCl
Cu(OH)2 + NaCl
Тип:______________ Тип:_________________________
ТИПЫ ХИМИЧЕСКИХ РЕАКЦИЙ:
соединения
определение:
разложения
определение:
замещения
определение:
Обмена
Определение:
В реакциях соединения из нескольких исходных веществ образуется одно сложное вещество
Реакции разложения приводят к распаду одного исходного сложного вещества на несколько про-дуктов.
Реакции замещения – это реакции между простым и сложным веществами, протекающие с образованием двух новых веществ – простого и сложного.
Реакциями обмена называют взаимодейст-вие между двумя слож-ными веществами, при котором они обмениваются атомами или группами атомов.
А + В = С
С = А + В
А + ВС = АС + В
АВ + СД = АД + СВ
К какому из предложенных типов относится данная реакция?(проблема)
CH4 + 2O2 —— CO2 + 2H2O
CO2 + 2H2O
Это реакция горения. Ни к одному типу данных реакций она не относится.
Демонстрационные опыты:
Химия- наука экспериментальная. Подтверждением теории являются опыты. Сейчас вы увидите несколько опытов, потом вам самим необходимо будет провести химическую реакцию и определить её тип. Смотрите внимательно, сколько веществ я беру для реакции , простые они или сложные и сколько образуется новых веществ.
Опыт №1: разложение малахита
(CuOH)2CO3 —— 2CuO + H2O CO2
2CuO + H2O CO2
Запишите уравнение реакции, расставьте коэффициенты и укажите тип её.
Опыт №2: растворение магния в кислоте
Mg + HCl —— MgCl2 + H2
MgCl2 + H2
Запишите уравнение реакции, расставьте коэффициенты и укажите тип её
Опыт №3:взаимодействие сульфата меди (2) с гидроксидом натрия.
CuSO4 + NaOH ——- Na2SO4 + Cu(OH)2
Запишите уравнение реакции, расставьте коэффициенты и укажите тип её.
Лабораторные опыты
Техника безопасности работы: тушение спиртовки колпачком, правильное удерживание пробирки, реактивы, попавшие на руку смывать водой.
Опыт №1: нагревание медной проволоки:
Проведите опыт .Запишите уравнение реакции, расставьте коэффициенты и укажите тип её.
Cu + O2 —— CuO
CuO
Опыт №2 покрытие железного гвоздя медью:
Проведите опыт. Запишите уравнение реакции, расставьте коэффициенты и укажите тип её.
CuSO4 + Fe ——- FeSO4 + Cu
FeSO4 + Cu
Опыт №3 .взаимодействие соли железа с гидроксидом натрия:
Проведите опыт .Запишите уравнение реакции, расставьте коэффициенты и укажите тип её.
FeCl3 + NaOH —— NaCl + Fe(OH)3
NaCl + Fe(OH)3
Подведение итогов:
Химию создавали люди необычной судьбы – вначале алхимики, затем врачи, аптекари и, наконец, собственно химики. Они верили в свое предназначение и не щадили здоровья, а материалы.
Об одной такой реакции более подробно:
В 1843 году Рудольф Беттгер получил дихромат аммония – оранжево – красное кристаллическое вещество. Он решил испытать это вещество на способность взрываться от удара и воспламеняться от горящей лучины. Удар молотком на чугунной плите всего лишь превратил кристаллы дихромата аммония в порошок. Затем, насыпав на тарелку горку кристаллов, Беттгер поднес к ней горящую лучинку. Кристаллы не вспыхнули, но вокруг конца горящей лучинки что – то закипело, начали стремительно вылетать раскаленные частицы.
Позднее было установлено, что дихромат аммония самопроизвольно разлагается не только от зажженной лучинки или спички, но и от нагретой стеклянной палочки. порой и жизни в стремлении открыть двери в неизведанное, получить новые вещества .
Мы же с вами, по ступенькам изучая химию, должны понимать, что с веществами могут происходить различные превращения (сегодня мы изучили 4 различных типа превращений). Мы можем научиться управлять этими превращениями.
5.Закрепление
Предложено 5 схем химических реакций. Определите тип этих реакций. При правильном определении типов реакций вы выберёте соответствующие буквы , из которых образуется один очень важный для нас термин:
Уравнения реакций Типы химических реакций
соединения разложения замещения обмена
Mg + 2HCl → MgCl2 + H2 Б В Х З
2Fe(OH)3 → Fe2O3 + 3h3O Г И К Д
2Ca + O2 → 2CaO М Ж С А
HCl +NaOH=NaCl + H2O Н У Т И
2HgO → 2Hg + O2 А Я Р П
(1 человек работает у доски, остальные на своих местах. Ответ: химия)
Учитель:
— Ребята поднимите руки : у кого получилось слово «химия» — замечательная наука, которая помогает нам разобраться во всем разнообразии химических реакций.
(Продолжаем путешествие по миру химических реакций.)
соберём букет из химических реакций.
Сконструируем химические реакции.проблема стоит все та же: определить тип химических реакций.
Уравнения из химических «цветов»
—1) Однажды Петя принес из школы модель молекулы углекислого газа. Как только Петя отвернулся, кот Филимон столкнул модель со стола, и она развалилась. На что развалилась модель молекулы углекислого газа?
СО2 = С + О2↑
—2)Один дурной мальчик взял без спросу кусок негашеной извести (СаО) и спрятал его за пазуху. Спасаясь от преследователей, он попал в воду. Известь нагрелась и причинила ему сильные ожоги. Мораль: не следует брать ничего без спросу!
СаО + Н2О = Са(ОН)2
—3)Способ получения водорода, открытый в давние времена, используется в лабораториях до сих пор. Для этого в аппарат Киппа загружают палочки, отлитые из цинка, и заливают 20 % серную кислоту:
Zn + H2SO4 =ZnSO4 + H2↑
4)Чистую азотную кислоту впервые получил немецкий химик Иоганн Рудольф Глаубер действуя на селитру купоросным маслом (концентрированной серной кислотой).
KNO3 + H2SO4 (конц.) = KHSO4 + HNO3↑
Итак, мы собрали букет из 4-х типов химических реакций. Букет этот не должен завянуть. Поддерживать его мы будем каждый урок химии и дома , выполняя домашнее задание.
Домашнее задание : № 2-13, 2-14, 2-15. Пар. Практическое задание: найдите дома гвозди железные, обратите внимание на ржавчину и подумайте ,какой же тип химической реакции произошел с простым веществом железом под действием кислорода воздуха и водяных паров.
Методическая разработка (химия, 8 класс) по теме: «Типы химических реакций».
Урок по теме: « Типы химических реакций».
Цели урока: 1) Сформировать представление о химическом уравнении.
2) Дать понятие о реакциях разложения, соединения, замещения.
3) Начать формировать умение составлять уравнения химических реакций, наблюдать и объяснять химические явления, анализировать результаты наблюдаемых опытов, формулировать определения.
4) Воспитать наблюдательность, трудолюбие, уверенность в своих силах, дисциплинированность.
Оборудование: Штатив с пробирками, держатель, спички, р-р cульфата меди(II), медная проволока, железный гвоздь, химические стаканы, свежеполученный студёнистый осадок гидроксида меди(II), компьютер.
Тип урока: Урок изучения нового учебного материала.
Вид урока: Рассказ. Демонстрация.
Методы и приемы: Объяснительно- иллюстративный, частично-поисковый.
Ход урока.
- Актуализация прежних знаний и умений. Проверка домашнего задания.
Учитель проводит самостоятельную работу (1-2 мин.) по теме «Химические уравнения».
1. Учащиеся выполняют тест по теме: « Химические уравнения».
1.Химическим уравнением называют:
а) уравнение, состоящее из химических формул;
б) условную запись химической реакции с помощью химических формул и математических знаков;
в) запись химической реакции, показывающая количество исходных веществ и продуктов реакции
2.Коэффициент перед продуктом реакции в уравнении h3+Cl2=HCl равен:
а) 1;
б) 2;
в) 3;
г) 4.
3.О законе сохранения массы веществ можно сказать:
а) масса веществ сохраняется, так как атомы не разрушаются;
б) из графита массой 3г можно получить 3г алмазов;
в) масса веществ, вступивших в реакцию, равна массе образовавшихся веществ;
г) масса веществ остается постоянной.
2.После завершения работы учащиеся проверяют друг у друга ответы по слайду и оценивают друг друга.
Ответы: 1-б; 2-б; 3-в.
Учитель:
— Вы все очень хорошо справились с заданиями и оценили друг друга.
Изучение нового материала. Тема:
«Классификация химических реакций».
Учитель сообщает тему урока, учащиеся оформляют соответствующие записи в тетради.
Учитель:
— В окружающем мире и внутри нас ежесекундно протекают миллионы реакций. Получить
представление о них нам помогает классификация реакций. С одной из классификаций – по признаку поглощения или выделения теплоты- вы уже познакомились. Рассмотрим
ещё одну классификацию реакций, в основу которой положен признак числа и состава исходных веществ и продуктов реакции. Познакомимся с реакциями разложения. Обратимся к истории химии.
В 1774г. английский химик Дж. Пристли взял простую лупу и направил сконцентрированный ею пучок солнечных лучей на оксид ртути(II) и получил кислород:
( Демонстрация слайда с уравнениями химических реакций).
2HgO=2Hg+O2.
В настоящее время ,согласно требованиям техники безопасности ,опыты с ртутью и ее соединениями из-за их токсичности запрещены. Поэтому рассмотрим другую аналогичную реакцию: разложение воды электрическим током в электролизере:
2h3O=2h3+O2.
Учитель:
— Как вы думаете, что объединяет эти реакции?
Ученик:
-Их объединяет то, что в реакцию вступает одно вещество, а получаются два вещества.
Учитель:
— Верно!
— Рассмотрим еще одну разновидность реакций разложения. Подогреем в пробирке на пламени спиртовки свежеполученный голубой студенистый осадок гидроксида меди(II).
Опыт: Далее учитель проводит демонстрационный эксперимент- берет пробирку со свежеполученным гидроксидом меди(II). Содержимое пробирки чернеет из-за получающегося в результате реакции разложения оксида меди(II). Учащиеся наблюдают за признаками химической реакции.
Учитель:
-Каковы признаки этой реакции?
Ученики:
— Признаками этой реакции является изменение цвета гидроксида меди(II).
Учитель:
— Обратите внимание на следующий признак этой реакции разложения- в нее вступает одно сложное вещество, а образуются два новых сложных вещества.
Теперь попробуйте составить уравнение этой реакции.
Учащиеся записывают уравнения реакций разложения в тетрадях.
Cu(OH)2=CuO+h3O.
Учитель:
-Подведем итоги — сформулируем определение понятия «реакция разложения».
Реакции разложения – это такие реакции, в результате которых из одного сложного вещества образуются два и более новых веществ.
(Демонстрация слайда с определением реакции разложения. Учащиеся делают записи в своих тетрадях) .
Учитель:
-Как вы думаете, имеют ли эти реакции для нас и для окружающей среды значение? Вспомните курс биологии, экологии и попробуйте ответить.
Ученик:
— Да. Если бы не разлагались опавшие листья, вся земля покрылась бы мусором. Это было бы неприятно. Разлагаясь листья превращаются в питательные вещества, которые сами же растения и будут использовать.
Учитель:
-Понятие «реакции соединения» является антонимом понятия «реакции разложения». Попробуйте, используя прием противопоставления, дать определение понятия «реакции соединения».
Ученик:
— Реакции соединения – это такие реакции, в результате которых из одного или нескольких исходных веществ образуется одно сложное вещество.
Учитель:
-Верно!
Учитель демонстрирует на слайде определение реакций соединения и примеры уравнений реакций соединения.
2h3+O2=2h3O;
SO3+h3O=h3SO4.
Опыт :Теперь попробуем сами провести реакцию соединения. Для этого возьмем медную проволоку и положим в сухую пробирку. Пробирку закрепляем в держателе и нагреваем. Учащиеся наблюдают за признаками этой реакции и отмечают изменение цвета медной проволоки.
Учитель:
-Каковы признаки этой реакции?
Ученик:
— Изменение цвета медной проволоки. В реакцию вступают два вещества, а образуется только одно вещество.
Учитель:
— Теперь напишем уравнение этой реакции.
2Cu+O2=2CuO.
Ученики делают записи в тетрадях.
Учитель:
— Каково значение этих реакций?
Ученик:
-Их нужно знать, так как в результате этих реакций образуются новые вещества.
Учитель:
-Верно! Теперь познакомимся с третьим типом реакций – реакциями замещения. (Учащиеся оформляют соответствующие записи в тетрадях). Хочу вам показать на слайде несколько уравнений химических реакций. Первое уравнение это уравнение реакции взаимодействия соляной кислоты с цинком.
Zn+2HCl=ZnCl2+h3
Эту реакцию проводил замечательный английский химик лорд Генри Кавендиш. В результате он заметил выделение газа. Этим газом был водород.
Fe2O3+3h3=2Fe+3h3O
Опыт: Теперь обратимся к эксперименту: поместим в пробирку с раствором сульфата меди (II) большой железный гвоздь.
(Учитель демонстрирует эксперимент).
— Что произошло с гвоздем?
Ученик:
— Та часть гвоздя, которая находится в растворе, покрылась красным налетом .
Учитель:
-Что образует этот налет?
Ученик:
-Налет образует выделившийся медь.
Учитель:
-О чем свидетельствует изменение цвета гвоздя?
Ученик:
— О том, что произошла химическая реакция.
Учитель:
-Хорошо. Теперь все вместе напишем уравнение этой реакции.
Один ученик работает на доске, все остальные на месте.
Fe+CuSO4=FeSO4+Cu
Учитель:
-Вы все хорошо справились с заданием. Скажите, какой признак объединяет эти реакции?
Ученик:
-То, что в реакцию вступают одно простое и одно сложное вещество, а в результате реакции образуются одно простое и одно сложное вещество.
Учитель разъясняет механизм данных реакций, используя уравнения химических реакций.
Учитель:
— В данной реакции атом двухвалентной меди в сложном веществе (сульфате меди(II) ) заместился на атом железа. В результате реакции образовались новое сложное вещество и новое простое вещество. Итак, какие реакции называются реакциями замещения?
Ученики пробуют ответить на этот вопрос. Учитель демонстрирует слайд и дает определение реакции замещения.
Учитель:
— Реакции замещения – это такие реакции, в результате которых атомы Учитель простого вещества замещают атомы одного из химических элементов в сложном веществе.
Учитель формулирует правило вытеснения: каждый металл вытесняет из солей металлы, которые стоят правее в ряду активности металлов.
Учитель:
-Имеют ли значение для нас реакции замещения? Вспомните курс географии и попробуйте ответить.
Ученик:
-Имеют. Железные руды содержат железо и чтобы выделить из них железо III. Закрепление изученного материала.
Учитель демонстрирует слайд на компьютере с несколькими уравнениями химических реакций.
, используются реакции замещения.
4NO2+2h3O+O2=4HNO3;
Cu+2AgNO3=Cu(NO3)2+2Ag;
CaCO3=CaO+CO2.
На доске начерчена незаполненная схема по классификации химических реакций.
Химические реакции
соединения
замещения
разложения
Учитель:
- Для закрепления изученного материала я вам предлагаю несколько уравнений химических реакций. Вы должны определить типы этих реакций и заполнить предложенную схему(Ученики выполняют задание)
IV Домашнее задание.
Изучить тему: «Классификация химических реакций».
Выполнить упражнение 2 (стр.145).
Тест по химии (8 класс) на тему: Тест по теме Типы химических реакций. (8 класс)
Тест по теме: Типы химических реакций. (8 класс)
1 вариант.
1. Какое уравнение соответствует реакции разложения?
1) Ca(OH)2 + CO2 = CaCO3 + h3O
2) 2HCl + Ba(OH)2 = BaCl2 + 2h3O
3) Na2S + Br2 = 2NaBr + S
4) 2AgI = 2Ag + I2
2. Какое уравнение соответствует реакции замещения?
1) 2K + 2h3O = 2KOH + h3
2) 2Al(OH)3 = Al2O3 + 3h3O
3) Ch5 + 2O2 = CO2 + 2h3O
4) 2KNO3 = 2KNO2 + O2
3. Какое уравнение соответствует реакции обмена?
1) 2Al + Fe2O3 = 2Fe + Al2O3
2) CuCl2 + Fe = FeCl2 + Cu
3) 2Na + O2 = Na2O2
4) 2KOH + h3SO4 = K2SO4 + 2h3O
4. Какое уравнение соответствует реакции соединения?
1)Fe + 2HCl = FeCl2 + h3
2)4Fe(OH)2 + O2 + 2h3O = 4Fe(OH)3
3)Cu(OH)2 = CuO + h3O
4)Na3PO4 + 3HNO3 = 3NaNO3 + h4PO4
5. Какое уравнение соответствует реакции разложения?
1)Cu + Hg(NO3)2 = Cu(NO3)2 + Hg
2)4NO2 + 2h3O + O2 = 4HNO3
3)2HCl + MgO = MgCl2 + h3O
4)(Nh5)2CO3 = 2Nh4 + CO2 + h3O
Тест по теме: Типы химических реакций. (8 класс)
2 вариант.
1. Какое уравнение соответствует реакции обмена?
1) Ca(OH)2 + CO2 = CaCO3 + h3O
2) 2HCl + Ba(OH)2 = BaCl2 + 2h3O
3) Na2S + Br2 = 2NaBr + S
4) 2AgI = 2Ag + I2
2. Какое уравнение соответствует реакции разложения?
1) 2K + 2h3O = 2KOH + h3
2) 2Al(OH)3 = Al2O3 + 3h3O
3) Ch5 + 2O2 = CO2 + 2h3O
4) 2KNO3 = 2KNO2 + O2
3. Какое уравнение соответствует реакции замещения?
1) 2Al + Fe2O3 = 2Fe + Al2O3
2) CuCl2 + Fe = FeCl2 + Cu
3) 2Na + O2 = Na2O2
4) 2KOH + h3SO4 = K2SO4 + 2h3O
4. Какое уравнение соответствует реакции замещения?
1)Fe + 2HCl = FeCl2 + h3
2)4Fe(OH)2 + O2 + 2h3O = 4Fe(OH)3
3)Cu(OH)2 = CuO + h3O
4)Na3PO4 + 3HNO3 = 3NaNO3 + h4PO4
5. Какое уравнение соответствует реакции соединения?
1)Cu + Hg(NO3)2 = Cu(NO3)2 + Hg
2)4NO2 + 2h3O + O2 = 4HNO3
3)2HCl + MgO = MgCl2 + h3O
4)(Nh5)2CO3 = 2Nh4 + CO2 + h3O
Тест по теме: Типы химических реакций. (8 класс)
3 вариант.
1. Какое уравнение соответствует реакции обмена?
1)2SO2 + O2 = 2SO3
2)h3S + CаO = CаS + h3O
3)SO3 + Na2O = Na2SO4
4)h3SO4 + Zn = ZnSO4 + h3
2. Какое уравнение соответствует реакции разложения?
1)Fe + h3SO4 = FeSO4 + h3
2)Ca + 2h3O = Ca(OH)2 + h3
3)Na2O + 2HСl = 2NaCl + h3O
4)2Al(OH)3 = Al2O3 + 3h3O
3. Какое уравнение соответствует реакции замещения?
1)Fe + CuSO4 = FeSO4 + Cu
2)CaCl2 + K2CO3 = CaCO3 + 2KCl
3)AgNO3 + NaСl = AgCl + NaNO3
4)Zn(OH)2 = ZnO + h3O
4. Какое уравнение соответствует реакции замещения?
1)Na2O + h3O = 2NaOH
2)BaCl2 + h3SO4 = BaSO4 + 2HCl
3)2KClO3 = 2KCl + 3O2
4)Zn + h3SO4 = ZnSO4 + h3
5. Какое уравнение соответствует реакции соединения?
1)Nh4 + HNO3 = Nh5NO3
2)h3S + MgO = MgS + h3O
3)SO3 + 2NaOН = Na2SO4 + Н2О
4)CuO + h3 = Cu + h3O
Тест по теме: Типы химических реакций. (8 класс)
4 вариант.
1. Какое уравнение соответствует реакции замещения?
1)2SO2 + O2 = 2SO3
2)h3S + CаO = CаS + h3O
3)SO3 + Na2O = Na2SO4
4)h3SO4 + Zn = ZnSO4 + h3
2. Какое уравнение соответствует реакции обмена?
1)Fe + h3SO4 = FeSO4 + h3
2)Ca + 2h3O = Ca(OH)2 + h3
3)Na2O + 2HСl = 2NaCl + h3O
4)2Al(OH)3 = Al2O3 + 3h3O
3. Какое уравнение соответствует реакции разложения?
1)Fe + CuSO4 = FeSO4 + Cu
2)CaCl2 + K2CO3 = CaCO3 + 2KCl
3)AgNO3 + NaСl = AgCl + NaNO3
4)Zn(OH)2 = ZnO + h3O
4. Какое уравнение соответствует реакции соединения?
1)Na2O + h3O = 2NaOH
2)BaCl2 + h3SO4 = BaSO4 + 2HCl
3)2KClO3 = 2KCl + 3O2
4)Zn + h3SO4 = ZnSO4 + h3
5. Какое уравнение соответствует реакции замещения?
1)Nh4 + HNO3 = Nh5NO3
2)h3S + MgO = MgS + h3O
3)SO3 + 2NaOН = Na2SO4 + Н2О
4)CuO + h3 = Cu + h3O