Строение металлов и их свойства
Все металлы имеют кристаллическую структуру. В расплавленном состоянии атомы металлов находятся в беспорядочном движении, а при переходе в твердое состояние они ориентируются определенным образом в пространстве, образуя кристаллическую решетку. Строение решетки и расположение в ней атомов зависит от вида металла. Наиболее распространенными типами кристаллической решетки являются кубическая – у железа и гексагональная – у алюминия.
Рассмотренные виды кристаллических решеток характерны для идеальных кристаллов. Для реальных металлов и сплавов характерно наличие различных дефектов. Дефекты бывают точечные, линейные, и поверхностные. К самым простым точечным дефектам относятся вакансии и межузельные атомы.
Вакансией называется пустой узел кристаллической решетки. Межузельным атомом
К линейным дефектам относятся дислокации. Дислокации образуются за счет нарушения правильного чередования атомных плоскостей при кристаллизация, а также в результате большого числа вакансий.
Поверхностные дефекты образуются в более крупных структурах металла, например, на границе зерен, т.е. групп кристаллов, которые могут быть сориентированы в пространстве различным образом.
Все физико-механические свойства металлов и их особенности являются следствием кристаллической решетки. Высокая прочность металлов объясняется наличием сил, удерживающих атомы в определенных местах кристаллической решетки. В основе упругих деформаций лежит обратимое смещение атомов кристаллической решетки от положения равновесия. В основе пластического деформирования металлов лежит перемещение дислокаций практически при любых температурах и нагрузках.
Основные свойства металлов:
Наличие плоскостей скольжения.
Плоскость скольжения обычно возникает в кристалле в месте наибольшей концентрации атомов.
Наклеп.
Наклеп – это упрочнение металла в процессе его пластической деформации.
Сущность наклепа состоит в том, что при перемещении одних частей кристаллов относительно других по плоскостям скольжения, искажается их форма, они поворачиваются, часть кристаллов может претерпеть излом, что приводит к образованию структуры типа мозаичной. Это приводит к увеличению сопротивления металла деформациям, а следовательно, к повышению его прочности.
Полиморфность.
Свойство металла иметь несколько модификаций. Многие металлы, например железо, могут переходить из одной модификации в другую, т.е. могут иметь различные типы кристаллической решетки.
Применение металлов в строительстве
По применению, стали подразделяются на конструкционные и инструментальные. Конструкционные стали используются для изготовления различных строительных конструкций и деталей машин, а инструментальные – для изготовления инструмента (применяются высокоуглеродистые стали).
Строительные стали, являются малоуглеродистыми. Среднеуглеродистые стали, в основном применяют в машиностроении.
Строительные и машиностроительные стали относят к группе конструкционных сталей.
По механическим характеристикам конструкционные стали делят на семь марок: СтО, Ст1, Ст2, СТЗ, Ст4, Ст5, Ст6. Основными строительными сталями являются СтЗ и Ст5, из которых изготавливают несущие металлические конструкции и арматуру для железобетона. Из сталей Ст4 и Ст5 изготавливают также болты, шурупы и т.д.
Углеродистые стали обыкновенного качества в зависимости от гарантируемых свойств объединяют в группы А, Б и В. В маркировке эту букву добавляют спереди, а в конце маркировки — способ раскисления: спокойный — сп, полуспокойный — пс, кипящий — кп, например: АСтЗпс, ВСт4пс. По группе А стали поставляют с гарантированными механическими свойствами, по группе Б — химическому составу, по группе В — по механическим свойствам и химическому составу.
По требованиям ударной вязкости в зависимости от температурных условий эксплуатации и назначения конструкций углеродистые стали разделяют на 6 категорий (номер категории указывают в конце маркировки после обозначения способа раскисления), например, ВСтЗкп2.
Легированные конструкционные, в том числе и строительные стали маркируют следующим образом. Первые две цифры показывают содержание углерода в сотых долях процента. Затем следуют условные обозначения легирующих элементов. Цифра, стоящая за условным обозначением, показывает приблизительное содержание элемента в процентах. Например, сталь 18Гсп в среднем содержит 0,18% углерода и приблизительно 1% марганца. Буквы «сп» обозначают, что сталь спокойная (по способу раскисления). Сталь 20ХГ2С в среднем содержит 0,2% углерода, приблизительно 1% хрома, приблизительно 2% марганца и приблизительно 1% кремния. Если количество легирующих добавок менее 0,3%, то обозначение легирующего элемента не проставляется. Буква А в конце марки означает, что сталь высококачественная. В строительстве применяют низколегированные стали (по экономическим соображениям): 18Г, 09Г2; 10Г2С1;20ХГ2С и др.
Большое влияние на механические характеристики сталей оказывает содержание углерода. С повышением содержания углерода твердость стали увеличивается, а пластичность уменьшается. Упругость сталей изменяется мало. Модуль упругости изменяется в пределах 2*10 5 — 2,06-105 Мпа. Предел прочности увеличивается до содержания углерода 0,8-1,0%, а затем снижается.
В строительстве сталь применяют в виде прокатных изделий, имеющих различную форму поперечного сечения – профиль. Используют сталь в строительстве для изготовления несущих конструкций: колонн, балок, ферм. Из низколегированных сталей изготавливают различные виды арматуры периодического профиля (для железобетона). Также сталь используется для изготовления оконных и дверных переплетов.
Основным способом получения стальных изделий являются горячая прокатка. Этим способом получают различные профили, листы, стержни, трубы. Изделия в этом случае называют горячекатанными.
Важной особенностью сталей является способность улучшать свои физико-механические свойства и, в частности, прочность в результате термической и механической обработки.
К термическим видам обработки, применяемым для строительной стали, относят
Отпуск стали производят с целью уменьшения внутренних напряжений, возникающих при закалке, а также для снижения хрупкости и твердости закаленной стали. Стали при этом нагревают до температуры не выше 600°С и после изотермической выдержки постепенно охлаждают.
Проволоку изготовляют путем вытяжки (волочения). Некоторые виды арматуры периодического профиля изготовляют путем холодного сплющивания. И в том и в другом случае сталь упрочняется за счет наклепа. Арматуру при этом называют холоднотянутой.
Арматуру классифицируют по четырем признакам:
в зависимости от технологии изготовления различают стержневую и проволочную арматуру. Под стержневой в данной классификации подразумевают арматуру любого диаметра в пределах d=6…40 мм;
в зависимости от способа последующего упрочнения горячекатаная арматура может быть термически упрочненной, т.е. подвергнутой термической обработке, или упрочненной в холодном состоянии — вытяжкой, волочением
по форме поверхности арматура бывает периодического профиля и гладкой. Выступы в виде ребер на поверхности стержневой арматуры периодического профиля, рифы или вмятины на поверхности проволочной арматуры значительно улучшают сцепление с бетоном;
по способу применения при армировании железобетонных элементов различают напрягаемую арматуру, т.е. подвергаемую предварительному натяжению, и ненапрягаемую.
Стержневая горячекатаная арматура в зависимости от ее основных механических характеристик подразделяется на шесть классов с условным обозначением: А-I, А-II, А-III, А-IV, А-V, А-VI. Термическому упрочнению подвергают стержневую арматуру четырех классов; упрочнение в ее обозначении отмечается дополнительным индексом «т»: Ат-III, Ат-IV, Ат-V, Ат-VI. Дополнительной буквой С указывается на возможность стыкования сваркой, буквой К — на повышенную коррозионную стойкость. Подвергнутая вытяжке в холодном состоянии стержневая арматура класса А-III, отмечается дополнительным индексом В.
Каждому классу арматуры соответствуют определенные марки арматурной стали с одинаковыми механическими характеристиками, но различным химическим составом. В обозначении марки стали отражается содержание углерода и легирующих добавок.
Стержневая арматура всех классов имеет периодический профиль за исключением круглой (гладкой) арматуры класса А-I.
Арматурную проволоку диаметром 3…8 мм подразделяют на два класса: Вр-I — обыкновенная арматурная проволока (холоднотянутая, низкоуглеродистая), предназначенная главным образом для изготовления сварных сеток; В-II, Вр-II—высокопрочная арматурная проволока (многократно волоченная, углеродистая), применяемая в качестве напрягаемой арматуры предварительно напряженных элементов. Периодический профиль обозначается дополнительным индексом «р»: Вр-I, Вр-II.
Применение в строительстве алюминиевых сплавов:
Чистый алюминий применяют для устройства кровли здания.
Из лент алюминия, переплетенных друг с другом, делают бесчердачные покрытия большого пролета. Остается лишь положить теплую кровлю.
Из прокатных профилей изготавливают оконные и дверные переплеты.
Из проката изготовляют фермы и арки для перекрытия больших пролетов. Выигрыш малый вес.
Несущие конструкции верхних этажей зданий в сейсмических районах, а также в зданиях с агрессивными средами.
Листы из алюминиевых сплавов применяют для облицовки внутренних и наружных стен.
studfile.net
Строение и свойства металлов
Характерными свойствами металлов являются наличие металлического блеска и пластичности, высокая электро- и теплопроводность. Характерные свойства металлов обусловлены их строением.
Атомы металлов не однородны. Атом состоит из положительно заряженного тяжелого ядра, и окружающих ядро отрицательно заряженных электронов. Число электронов равно порядковому номеру элемента в таблице Д.И. Менделеева. В ядре атома находятся положительно заряженные элементарные частицы, называемые протонами. Количество протонов равно количеству окружающих ядро электронов. Кроме протонов, в ядре находятся тяжелые электрически нейтральные частицы – нейтроны. Масса электрона в 1840 раз меньше массы протона или нейтрона. Таким образом, вся масса атома сосредоточена в его ядре.
Электроны быстро вращаются вокруг ядра. Внешние, так называемые валентные, электроны у всех металлов относительно слабо связаны с ядром. Слабой связью внешних валентных электронов с ядром и объясняются характерные металлические свойства.
Замечание
Между понятием «металл» как химический элемент и как вещество есть некоторая разница. Химия делит все элементы на металлы и неметаллы по их поведению в химических реакциях. Теория металлического состояния рассматривает крупные скопления атомов металлов, в котором они обладают характерными металлическими свойствами: пластичностью, высокой тепло- и электропроводностью, металлическим блеском. Эти свойства характерны для больших групп атомов. У отдельных атомов таких свойств нет.
Атомы в металле находятся в ионизированном состоянии. Атомы металлов, отдавая часть внешних валентных электронов, превращаются в положительно заряженные ионы. Свободные электроны непрерывно перемещаются между ними, образуя подвижный электронный газ.
При комнатной температуре все металлы, кроме ртути, представляют собой твердые тела, имеющие кристаллическое строение. Для кристаллов характерно строго определенное расположение в пространстве ионов, образующих кристаллическую решетку.
Металлы имеют кристаллические решетки различных типов. Каждая кристаллическая решетка может быть охарактеризована элементарной кристаллической ячейкой.
Элементарная кристаллическая ячейка – наименьший комплекс атомов, повторяя который многократно, можно построить весь кристалл.
У металлов чаще всего встречаются три типа элементарных кристаллических ячеек:
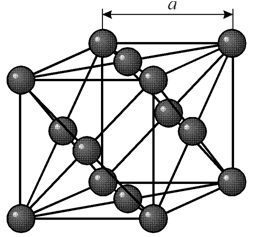
В кубической объемноцентрированной (ОЦК) решетке восемь ионов располагаются по вершинам и один в центре куба, на пересечении диагоналей. Объемноцентрированную кубическую решетку имеют кристаллы железа при комнатной температуре, хрома, вольфрама, молибдена, ванадия и др. Эта решетка характеризуется всего одним параметром решетки – расстоянием между центрами двух ионов, расположенных по одному ребру, обозначенным на рисунке а.
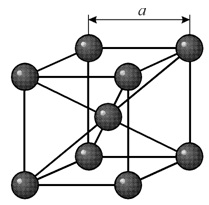

Многие металлы, используемые в технике, имеют гранецентрированную кубическую решетку. В элементарной решетке гранецентрированного куба ионы расположены по вершинам куба и в центре каждой грани (на пересечении ее диагоналей). Центр куба остается свободным. Такую кристаллическую решетку имеют кристаллы меди, никеля, алюминия, свинца, серебра и др. гранецентрированная решетка также характеризуется одним параметром – длиной ребра куба а.
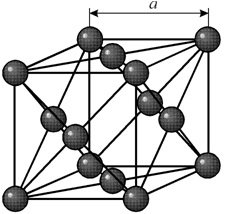

Элементарная ячейка гексагональной плотноупакованной решетки представляет собой шестигранную призму. По основаниям призмы расположены правильные шестиугольники по вершинам которых и в их центрах находятся ионы. Посередине между основаниями вклинивается правильный треугольник с ионами по вершинам.
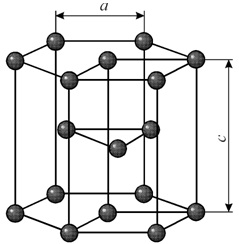

Гексагональная решетка характеризуется двумя параметрами: а и с. Наибольшая плотность упаковки достигается при соотношении параметров с/а = 1.633. Гранецентрированная решетка с таким соотношением параметров называется гранецентрированной плотноупакованной. Такую решетку имеют титан, цирконий, кобальт, цинк, магний и др.
Строение металлических сплавов
Под металлическим сплавом понимают вещество, получаемое сплавлением двух или более элементов, обладающее характерными металлическими свойствами.
Металлические сплавы получают сплавлением элементов – металлов или металлов с неметаллами при преимущественном содержании металлов. Строение сплавов сложнее, чем чистых металлов.
При кристаллизации жидкого сплава могут получаться твердые металлические сплавы с различным строением.
Механическая смесь двух чистых металлов А и В получается в том случае, когда в процессе кристаллизации сплава из жидкого состояния разнородные атомы не входят в общую кристаллическую решетку. В механической смеси каждый металл образует самостоятельные кристаллы. Кристаллы каждого их металлов, находящиеся в этом сплаве, обладают теми же строением и свойствами, которыми они обладают в куске чистого металла.
Твердый раствор – сплав, у которого атомы растворимого элемента размещены в кристаллической решетке растворителя. На микрошлифе твердого раствора кристаллы после травления выглядят одинаково. В кристаллах твердого раствора существует только один тип кристаллической решетки. Растворителем является тот элемент, кристаллическую решетку которого имеет твердый раствор. Растворимый элемент может либо замещать элемент-растворитель в узлах кристаллической решетки, либо располагаться в междоузлиях. По типу расположения атомов растворимого элемента в кристаллической решетке твердые растворы делят на две группы: замещения и внедрения.
Твердые растворы внедрения образуют металлы с неметаллами. Атомы неметаллов меньше атомов металлов. Поэтому атомы неметаллов могут располагаться в междоузлиях кристаллической решетки металлов. Внедрившийся атом вызывает искажение решетки металла-растворителя. Все твердые растворы внедрения – растворы с ограниченной растворимостью.
Химические соединения металлы образуют как с металлами так и с неметаллами. Химическое соединение характеризуется определенной температурой плавления, скачкообразным изменением свойств при изменении состава. Химические соединения металлов с неметаллами образуются при строго определенных соотношениях входящих в них элементов, соответствующих нормальным валентностям. Химические соединения обладают повышенной твердостью и пониженной пластичностью. Кристаллическая решетка химического соединения имеет сложное строение.
Диаграмма состояния
Диаграмма состояния представляет собой графическое изображение состояния сплава. Если изменится состав сплава, его температура, давление, то состояние сплава изменится, и это находит отражение в диаграмме состояния.
Диаграмма состояния показывает устойчивые состояния, которые при данных условиях обладают минимальным уровнем свободной энергии. Поэтому диаграмма состояния может также называться диаграммой равновесия, поскольку показывает, какие при данных условиях существуют равновесные фазы. Следовательно, и изменения в состоянии, которые отображены на диаграмме, относятся к равновесным условиям, т.е. при отсутствии перенагрева или переохлаждения. Так как превращения в отсутствии перенагрева или переохлаждения в действительности не могут совершаться, поэтому диаграмма состояния представляет собой теоретический случай.
Общие закономерности сосуществования устойчивых фаз, отвечающих теоретическим условиям равновесия, описываются правилом фаз или законом Гиббса.
Закон Гиббса дает количественную зависимость между степенью свободы системы и количеством фаз и компонентов.
Фазой называется однородная часть системы, отделенная от других частей системы (фаз) поверхностью раздела, при переходе через которую химический состав или структура вещества изменяется скачком.
Однородная жидкость – однофазная система.
Смесь двух видов кристаллов – двухфазная система.
Компонентами называются вещества, образующие систему.
Чистый металл – однокомпонентная система.
Сплав двух металлов – двухкомпонентная система.
Среди диаграмм состояния металлических сплавов самое большое значение имеет диаграмма состояния системы железо-углерод. Это объясняется наиболее широким применением в технике железоуглеродистых сплавов.
Диаграмма железо-углерод относится к диаграммам состояния для сплавов с ограниченной растворимостью. Диаграмма железо-углерод, как ясно из названия, должна распространяться от железа до углерода. Железо образует с углеродом ряд химических соединений, но надежно установлено лишь одно Fe3C – карбид железа или цементит. Каждое устойчивое химическое соединение можно рассматривать как компонент, а диаграмму изучать по частям.
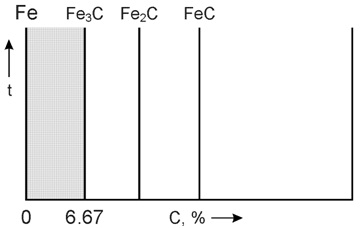

Следовательно, рассматривая диаграмму железо-углерод на участке от железа до цементита, мы можем компонентами системы считать железо и цементит.
Рассмотрим свойства отдельных компонентов.
Железо. Температура плавления 1539 °С. Железо аллотропическое вещество. Атомы элемента могут образовывать, если исходить только из геометрических соображений, любую кристаллическую решетку. Однако устойчивым, а, следовательно, реально существующим типом является решетка, обладающая наиболее низким запасом свободной энергии.
В ряде случаев (и для железа в том числе) при изменении температуры или давления может оказаться, что для одного и того же металла более устойчивой будет другая решетка, чем та, которая была при другой температуре или давлении.
Так для железа характерны две кристаллические решетки:
• объемноцентрированный куб;
• гранецентрированный куб.
Существование одного металла в нескольких кристаллических формах носит название полиморфизма или аллотропии. Различные кристаллические формы одного и того же вещества называются полиморфными или аллотропическими модификациями. Аллотропические формы обозначаются греческими буквами α, β, γ и т.д., которые в виде индексов добавляются к символу, обозначающему элемент. Аллотропическая форма, существующая при самой низкой температуре, обозначается через α, следующая через β и т.д. Превращение одной аллотропической формы в другую при нагреве чистого металла сопровождается поглощением тепла и происходит при постоянной температуре. На термической кривой превращение отмечается горизонтальным участком. При охлаждении происходит выделение тепла теоретически при той же температуре, что и при нагреве, но практически при более низкой вследствие переохлаждения.
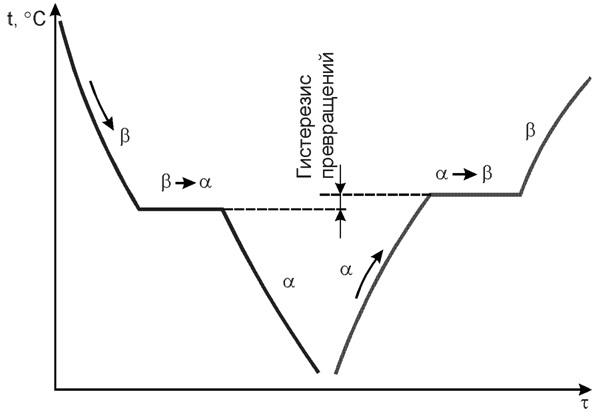

Явление полиморфизма основано на едином законе об устойчивости состояния с наименьшим запасом энергии.
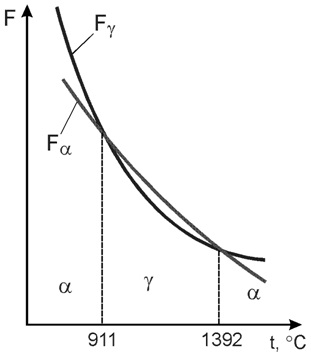

Запас свободной энергии зависит от температуры. Поэтому в одном интервале температур более устойчивой является модификация α, а в другом модификация γ.
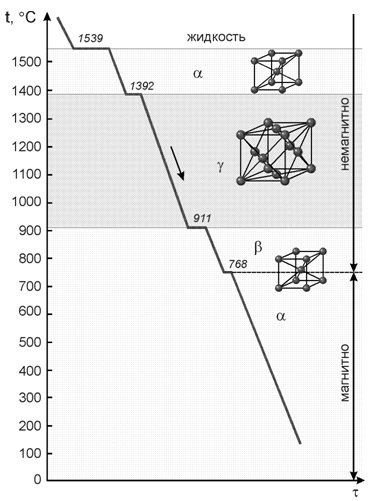

Железо имеет две температуры полиморфного превращения: 911 и 1392 °С.
Особо следует рассмотреть образование растворов углерода в железе. Растворимость С в Fe существенно зависит от того, в какой кристаллической форме существует железо.
Диаметр атома углерода (в свободном состоянии) равен 1.54 A. В объемноцентрированной решетке имеется 12 свободных мест в середине ребер. Диаметр такого свободного места 0.62 A. Такой объем явно недостаточен для помещения в нем атома углерода.
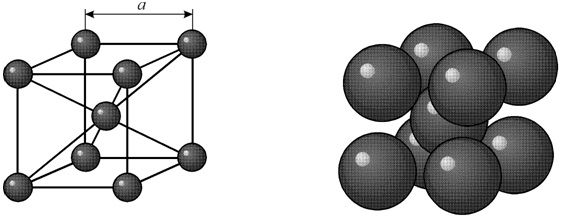

В гранецентрированной кристаллической решетке в центре имеется пора диаметром 1.02 A. В этой поре атом углерода может поместиться, вызывая естественно некоторое увеличение размера решетки γ-железа.
Таким образом, геометрические соображения подсказывают, что α-железо не растворяет, а γ-железо растворяет углерод. В действительности α-железо растворяет углерод, но в очень небольшом количестве ≈ 0.02%.

Твердый раствор углерода в α-железе называется ферритом, а в γ-железе аустенитом.
Цементит. Цементит – это химическое соединение углерода с железом (карбид железа Fe3C).
Так как растворимость углерода в α-железе мала, то при нормальных температурах в подавляющем большинстве случаев в структуру стали входят высокоуглеродистые фазы в виде цементита.
Кристаллическая структура цементита очень сложна.
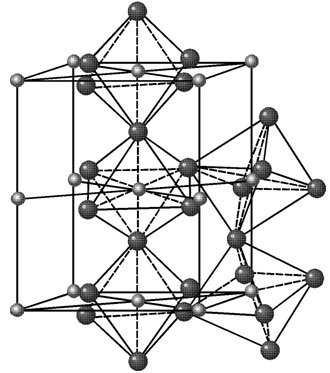

Температура плавления цементита 1600 °С. Аллотропических превращений не испытывает. Цементит имеет высокую прочность ~ 800 НВ и практически нулевую пластичность.
Цементит — соединение неустойчивое и при определенных условиях распадается с образованием свободного углерода в виде графита. Процесс имеет огромное практическое значение.
Историческая справка. Начало изучению диаграммы железо-углерод (а также железоуглеродистых сплавов и процессов термической обработки) было положено работой Чернова Д.К. «Критический обзор статей Лаврова и Калакуцкого о стали и стальных орудиях и собственные исследования Д.К.Чернова по этому же предмету», опубликованной в 1868 году. Этот год можно считать годом возникновения науки металловедения.
В этой работе Чернов впервые указал на существование в стали критических точек, и на зависимость их положения от содержания углерода. Таким образом, Чернов дал первое представление о диаграмме железо-углерод.
Диаграмма железо-цементит имеет двойную концентрационную ось абсцисс. Содержание углерода и содержание цементита.
Линия ABCD является ликвидусом. Это линия – геометрическое место точек начала кристаллизации. Линия AHJECF – солидус. Геометрическое место точек конца кристаллизации.
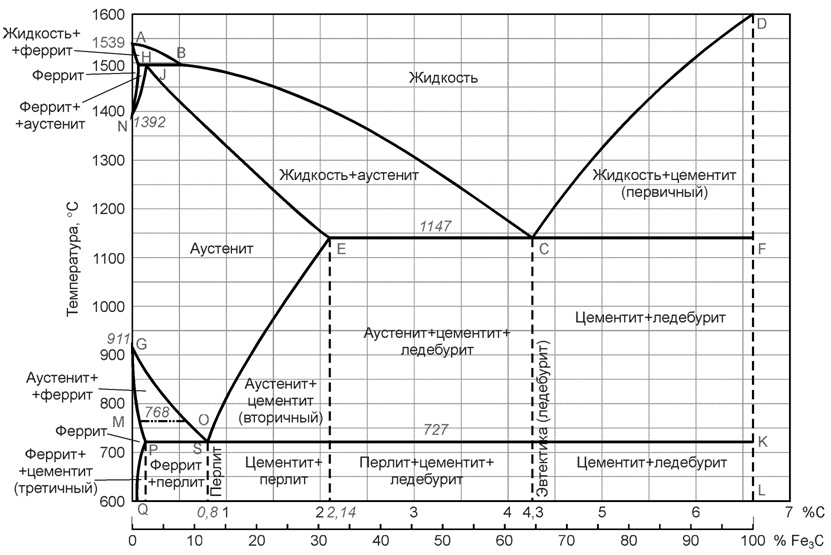

Так как железо с углеродом образует химическое соединение Fe3C, и еще имеет две аллотропические формы α и γ следовательно в системе существуют следующие фазы:
• жидкость (жидкий раствор углерода в железе) располагается выше линии ликвидус и обозначается Ж;
• цементит Fe3C – вертикаль DFKL, обозначается Ц;
• феррит – структурная составляющая, которая представляет собой α-железо, растворяющая в незначительном количестве углерод, область феррита левее линий GPQ и AHN, обозначается Feα;
• аустенит – структура, представляющая собой твердый раствор углерода в γ-железе, область аустенита на диаграмме NJESG, обозначается Feγ.
Три горизонтальные линии на диаграмме HJB, ECF, PSK указывают на протекание трех нонвариантных реакций. Вариантность – это число степеней свободы системы. Если число степеней свободы равно нулю (нонвариантная система), то нельзя изменить внешние и внутренние факторы системы (температуру, давление, концентрацию) без того, чтобы это не вызвало изменение числа фаз.
При 1499 °С (линия HJB) протекает перитектическая реакция:
Ж + Feα → Feγ
Перитектическая реакция представляет собой реакцию, когда жидкость реагирует с ранее выпавшими кристаллами и образует новый вид кристаллов.
В результате перитектической реакции образуется аустенит. Реакция имеет место только у сплавов, содержащих углерода от 0.1 до 0.5%.
При температуре 1147 °С (горизонталь ECF) протекает эвтектическая реакция:
Ж → Feγ + Ц
Эвтектическая реакция – реакция кристаллизации одновременно двух (или более) видов кристаллов из жидкости. Механическая смесь двух (или более) видов кристаллов называется эвтектикой. В результате этой реакции образуется эвтектическая смесь. Эвте
all4study.ru
1. Строение металлов. Материаловедение: конспект лекций [litres]
1. Строение металлов
Металлы и их сплавы – основной материал в машиностроении. Они обладают многими ценными свойствами, обусловленными в основном их внутренним строением. Мягкий и пластичный металл или сплав можно сделать твердым, хрупким, и наоборот. Для того чтобы сознательно изменять свойства металлов, необходимо знать основы их кристаллического строения. Как известно, все тела состоят из большого количества атомов, которые удерживаются силами сцепления, совершая колебания большой частоты возле точек равновесия. Поскольку атомы разных металлов различны, каждый металл имеет свои определенные свойства. Эти свойства зависят от расположения атомов между собой, характера их связей, от расстояния между ними. Если изменить расстояние между атомами или порядок их расположения, изменятся и свойства металла. В аморфных телах – смоле, стекле, канифоли и т. п. – атомы расположены беспорядочно. В металлах они находятся в определенном геометрическом порядке, образуя кристаллы, поэтому металлы являются кристаллическими телами. Металлы различаются не только порядком расположения атомов, но и кристаллической решеткой, которая представляет собой воображаемую пространственную сетку, состоящую из элементарных ячеек, в узлах которой находятся атомы.
Различают следующие кристаллические решетки металлов с плотной упаковкой атомов: кубическую объемно—центрированную, кубическую гранецентрированную и гексагональную. В ячейке кубической объемно—центрированной решетки атомы расположены в вершинах и центре куба. Такая ячейка содержит девять атомов (хром, вольфрам, ванадий, молибден, литий, а при определенных температурах – железо и другие металлы).
В ячейке кубической гранецентрированной решетки атомы находятся в вершинах куба и на пересечении диагоналей каждой плоскости. Такая ячейка имеет 14 атомов (свинец, никель, медь, золото, серебро, пластина, железо при определенных температурах и другие металлы).
В ячейке гексагональной кристаллической решетки атомы располагаются в вершинах и в центре шестигранных оснований призмы, а три атома – в средней ее плоскости, при этом такая ячейка содержит 17 атомов (магний, цинк, кадмий, осмий, бериллий и другие металлы).
При определенных условиях некоторые металлы – железо, титан, цирконий, стронций, кобальт, кальций и другие могут перестраиваться из одного вида кристаллической решетки в другой, например из кубической объемно—центрированной – в гранецентрированную и даже гексагональную. Элементарная ячейка отображает только один элемент, или одну ячейку, кристаллической решетки.
Вся кристаллическая решетка в реальном металле состоит из большого числа многократно повторяющихся элементарных ячеек. Большое значение имеет расстояние между атомами ячейки кристаллической решетки или между параллельными атомными плоскостями, образующими элементарную ячейку. Чем больше это расстояние, тем менее прочен металл. Расстояние между ними измеряется в ангстремах – 1 А = = 10 –8 см или в нанометрах – 1 А = 0,1 нм.
Из практики известно, что железо прочнее меди, а медь прочнее алюминия.
Данный текст является ознакомительным фрагментом.Читать книгу целиком
Поделитесь на страничкеСледующая глава >
tech.wikireading.ru
Внутреннее строение металлов и сплавов Кристаллическое строение металлов
У веществ в твердом состоянии строение кристаллическое или аморфное. В кристаллическом веществе атомы расположены по геометрически правильной схеме и на определенном расстоянии друг от друга, в аморфном же (стекле, канифоли) атомы расположены беспорядочно.
У всех металлов и их сплавов строение кристаллическое. На рис.12показана структура чистого железа. Кристаллические зерна неопределенной формы не похожи на типичные кристаллы — многогранники, поэтому их называюткристаллитами, зернамиили гранулами. Однако строение кристаллитов столь же закономерно, как и у развитых кристаллов.

Рис.12.Микроструктура чистого железа (х — 150)
Виды кристаллических решеток. При затвердевании атомы металлов образуют геометрически правильные системы, называемыекристаллическими решетками. Порядок расположения атомов в решетке может быть различным. Многие важнейшие металлы образуют решетки, простейшие (элементарные) ячейки которых представляют форму центрированного куба (— и— железо, хром, молибден, вольфрам, ванадий, марганец), куба с центрированными гранями (— железо, алюминий, медь, никель, свинец) или гексагональную, как у шестигранной призмы, ячейку (магний, цинк,— титан,— кобальт).
Элементарная ячейкаповторяется непрерывно в трех измерениях, образуя кристаллическую решетку, поэтому положение атомов в элементарной ячейке определяет структуру всего кристалла.
Элементарная ячейка центрированного куба (рис.13) состоит из девяти атомов, из которых восемь расположены по вершинам куба, а девятый — в его центре.

Рис.13. Элементарная ячейкаРис.14. Часть пространственной решет-
центрированного куба ки центрированного куба
Для характеристики кристаллической решетки (атомной структуры кристалла) применяют пространственную решетку, которая является геометрической схемой кристаллической решетки и состоит из точек (узлов), закономерно расположенных в пространств.

Рис.15. Элементарная ячейка кубаРис.16. Часть пространственной ре-
с центрированными гранями шетки куба с центрированными
гранями
На рис.14приведена часть пространственной решетки центрированного куба. Здесь взяты восемь смежных элементарных ячеек; узлы, расположенные по вершинам и в центре каждой ячейки, отмечены кружками. Элементарная ячейка куба с центрированными гранями (рис.15) состоит из 14 атомов, из них 8 атомов расположены по вершинам — куба и 6 атомов — по граням.
На рис.16приведена часть пространственной
решетки куба с центрированными гранями
( гранецентрированного куба). На схеме
имеется восемь элементарных ячеек; узлы
расположены по вершинам и по центрам
граней каждой ячейки. Гексагональная
ячейка (рис.17) состоит из 17 атомов,
из них 12 атомов расположены по вершинам
шестигранной призмы, 2 атома — в центре
оснований и 3 атома — внутри призмы. Для
измерения расстояния между атомами
кристаллических решеток пользуются
специальной единицей, называемойангстремом 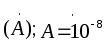 см.
см.
Рис.17. Гексагональная ячейка
Параметр решеток (сторона или шестигранника) у меди 3,6 А, а у алюминия 4,05 А, у цинка 2,67 А и т. д.
Каждый атом состоит из положительно заряженного ядра и нескольких слоев (оболочек) отрицательно заряженных и движущихся вокруг ядра электронов. Электроны внешних оболочек атомов металлов, называемые валентными, легко отщепляются, быстро движутся между ядрами и называютсясвободными. Вследствие наличия свободных электронов атомы металлов являются положительно заряженными ионами.
Таким образом, в узлах решеток, обозначенных кружками рис.14и16, находятся положительно заряженные ионы. Ионы, однако, не находятся в покое, а непрерывно колеблются положения равновесия. С повышением температуры амплитуда колебаний увеличивается, что вызывает расширение кристаллов, а при температуре плавления колебания частиц усиливаются настолько, что кристаллическая решетка разрушается.
Во всех кристаллах наблюдаются небольшие отклонения от идеальной решетки — незанятые узлы и различного рода смещения атомов.
Анизотропность и спайность кристаллов. В отдельных кристаллах свойства различны в разных направлениях. Если взять большой кристалл (существуют лабораторные и даже производственные методы выращивания крупных кристаллов) вырезать из него несколько одинаковых по размеру, но различно ориентированных образцов, и испытать их свойства, то иногда наблюдается весьма значительная разница в свойствах между отдельными образцами. Например, при испытании образцов, вырезанных из кристалла меди, относительное удлинение изменялось в пределах от 10 — 50 %, а предел прочности—от 14 до 35 кГ/мм2для различных образцов. Это свойство кристаллов называютанизотропностью. Анизотропность кристаллов объясняется особенностями расположения атомов в пространстве.
Следствием анизотропности кристаллов является спайность, которая выявляется при разрушении. В местах излома кристаллов можно наблюдать правильные плоскости, указывающие на смещение частиц под влиянием внешних сил не беспорядочное, а правильными рядами, в определенном направлении, соответственно расположению частиц в кристалле. Эти плоскости называютсяплоскостями спайности.
Аморфные тела изотропны, т. е. все их свойства одинаковы во всех направлениях. Излом аморфного тела всегда имеет неправильную искривленную, так называемую, раковистую поверхность.
Металлы, затвердевшие в обычных условиях, состоят не из одного кристалла, а из множества отдельных кристаллитов, различно ориентированных друг к другу, поэтому свойства литого металла приблизительно одинаковы во всех направлениях; это явление называют квазиизотропностью(кажущейся изотропностью).
Аллотропия металлов(или полиморфизм) — их свойство перестраивать решетку при определенных температурах в процессе нагревания или охлаждения. Аллотропию обнаруживают все элементы, меняющие валентность при изменении температуры: например, железо, марганец, никель, олово и др. Каждое аллотропическое превращение происходит при определенной температуре. Например, одно из превращений железа происходит при температуре 910°С, ниже которой атомы составляют решетку центрированного куба (см.рис.14), а выше — решетку гранецентрированного куба (см.рис.16).
Та или иная структура называется аллотропической формой или модификацией. Различные модификации обозначают греческими буквами , , и т. д., причем буквойобозначают модификацию, существующую при температурах ниже первого аллотропического превращения. Аллотропические превращения сопровождаются отдачей (уменьшением) или поглощением (увеличением) энергии.
Кристаллизация металлов. Кристаллизацией называется образование кристаллов в металлах (и сплавах) при переходе из жидкого состояния в твердое (первичная кристаллизация). Перекристаллизацию из одной модификации в другую при остывании эатвердевшего металла называют (вторичной кристаллизацией). Процесс кристаллизации металла легче всего проследить с помощью счетчика времени и термоэлектрического пирометра, который представляет собой милливольтметр, подключенный к термопаре. Термопару (две разнородные проволоки спаянные концами) погружают в расплавленный металл. Возникающий при этом термоток пропорционален температуре металла и стрелка милливольтметра отклоняется, указывая эту температуру по градуированной шкале.
Показания пирометра автоматически записываются во времени и по полученным данным строят кривые охлаждения в координатах «температура — время» (такие кривые вычерчивает самописец).
Температура, соответствующая какому-либо превращению в металле, называется критической точкой.
На рис.18, априведена кривая нагрева металла. Здесь точка а— начало плавления, точкаb — окончание плавления.

Рис.18. Кривые нагревания (а) и охлаждения (б— без петли,
в — с петлей) металла
Участок аbуказывает на неизменность температуры во времени при продолжающемся нагревании. Это показывает, что тепловая энергия затрачивается на внутреннее превращение в металле, в данном случае. на превращение твердого металла в жидкий (скрытая теплота плавления).
Переход из жидкого состояния в твердое при охлаждении сопровождается образованием кристаллической решетки, т. е. кристаллизацией. Чтобы вызвать кристаллизацию, жидкий металл нужно переохладитьнесколько ниже температуры плавления. Поэтому площадка на кривой охлаждения (рис.19,6) находится несколько нижеtпл при температуре переохлажденияtпр.
У некоторых металлов переохлаждение (tпл — tпр) может оказаться весьма значительным (например, у сурьмы до 40°С) и при температуре переохлажденияtпр(рис. 18, в) сразу бурно начинается кристаллизация, в результате чего температура скачком повышается почти доtпл. В этом случае на графике вычерчивается петля теплового гистерезиса.
При затвердевании и при аллотропическом превращении в металле вначале возникают зародыши кристалла (центры кристаллизации), вокруг которых группируются атомы, образуя соответствующую кристаллическую решетку.
Таким образом, процесс кристаллизации складывается из двух этапов: образования центров кристаллизации и роста кристаллов.
У каждого из возникающих кристаллов кристаллографические плоскости ориентированы случайно, кроме того, при первичной кристаллизации кристаллы могут поворачиваться, так как они окружены жидкостью. Смежные кристаллы растут навстречу друг другу и точки их соприкосновения определяют границы кристаллитов (зерен).
Кристаллизация железа. Рассмотрим в качестве примера кристаллизацию и критические точки железа.

Рис.19. Кривые охлаждения и нагревания железа
На рис.19приведены кривые охлаждения и нагревания чистого железа, которое плавится при температуре 15390С. Наличие критических точек при меньших температурах указывает на аллотропические превращения в твердом железе.
Критические точки обозначаются буквой А, при нагревании обозначаютАcи при охлажденииAr индексы 2, 3, 4 служат для отличия аллотропических превращений (индекс 1 обозначает превращение на диаграмме состоянияFe — Fe3C.
При температурах ниже 768 0С железо магнитно и имеет кристаллическую решетку центрированного куба. Эту модификацию называют-железо ; при нагревании она в точкеАс2переходит в немагнитную модификацию-железо. Кристаллическая структура при этом не меняется.
В точке Ас3при температуре 9100С-железо переходит в-железо с кристаллической решеткой гранецентрированного куба.
В точке Ас4при температуре 14010С-железо переходит в-железо, причем кристаллическая решетка вновь перестраивается из гранецентрированного куба в центрированный куб.
При охлаждении происходят те же переходы, только в обратной последовательности.
Из перечисленных превращений наибольшее практическое значение имеют превращения А3 как при нагреве (Ас3), так и при охлаждении (Аr3).
Превращение в точке А3сопровождается изменением объема, так как плотность кристаллической решетки-железа больше плотности решетки-железа, в точкеАс3 объем уменьшается, в точкеAr3 — увеличивается.
studfile.net
2.1 Строение реальных металлов.
Металлы и сплавы, полученные в обычных условиях, состоят из большого количества кристаллов, то есть, имеют поликристаллическое строение. Эти кристаллы называются зернами. Они имеют неправильную форму и различно ориентированы в пространстве. Каждое зерно имеет свою ориентировку кристаллической решетки, отличную от ориентировки соседних зерен, вследствие чего свойства реальных металлов усредняются, и явления анизотропии не наблюдается.
2.2 Дефекты кристаллического строения.
В кристаллической решетке реальных металлов имеются различные дефекты (несовершенства), которые нарушают связи между атомами и оказывают влияние на свойства металлов. Различают следующие структурные несовершенства:
• точечные – малые во всех трех измерениях;
• линейные – малые в двух измерениях и сколь угодно протяженные в третьем;
• поверхностные – малые в одном измерении.
2.2.1 Точеные дефекты
Одним из распространенных несовершенств кристаллического строения является наличие точечных дефектов: вакансий, примесей и дислоцированных атомов. (рис.1.4.)

Рис.1.4. Точечные дефекты
А) Вакансия – отсутствие атомов в узлах кристаллической решетки, «дырки», которые образовались в результате различных причин. Образуется при переходе атомов с поверхности в окружающую среду или из узлов решетки на поверхность, в результате пластической деформации. Концентрация вакансий в значительной степени определяется температурой тела. Перемещаясь по кристаллу, одиночные вакансии могут встречаться и объединяться. Скопление многих вакансий может привести к образованию пор и пустот.
Б) Примесные дефекты всегда присутствуют в металле. Размер дефекта зависит от размера атома примеси разместившегося в узле кристаллической решетки или дислоцированного в междоузлиях.
В) Дислоцированный атом – это атом, вышедший из узла решетки и занявший место в междоузлие. Концентрация дислоцированных атомов значительно меньше, чем вакансий, так как для их образования требуются существенные затраты энергии. При этом на месте переместившегося атома образуется вакансия.
Точечные дефекты вызывают незначительные искажения решетки, что не приводит к изменению свойств тела (электропроводность, магнитные свойства), их наличие способствует процессам диффузии и протеканию фазовых превращений в твердом состоянии.
Под воздействием внешних факторов (температура, давление) в кристаллической структуре металла, возникает перемещение точечных дефектов по материалу способствующее объединению их в группы- дислокации. Как правило дислокации образуются в процессе кристаллизации, при деформациях, при термической обработке.
2.2.2 Линейные дефекты.
Дислокация – это линейные дефекты кристаллического строения, представляющие собой линии, вдоль и вблизи которых нарушено характерное для кристалла правильное расположение атомных плоскостей.
Простейшие видами дислокаций являются краевые и винтовые.
Впервые априорное представление о краевых дислокациях использовано в 1934 году Орованом и Тейлером.
Краевая дислокация представляет собой линию, вдоль которой обрывается внутри кристалла край «лишней» полуплоскости (экстраплоскости) (рис. 1.5)

Рис. 1.5. Краевая дислокация (а) и механизм ее образования (б)

Рис. 1.6. Искажения в кристаллической решетке при наличии краевой дислокации.
Наибольшие искажения в расположении атомов в кристалле имеют место вблизи нижнего края экстраплоскости. Вправо и влево от края экстраплоскости эти искажения малы (несколько периодов решетки), а вдоль края экстраплоскости искажения простираются через весь кристалл и могут быть очень велики (тысячи периодов решетки) (рис. 1.6).
Если экстраплоскость находится в верхней части кристалла, то краевая дислокация – положительная (׀), если в нижней, то – отрицательная (׀). Дислокации одного знака отталкиваются, а противоположные притягиваются.
Другой тип дислокаций был описан Бюргерсом, и получил название винтовая дислокация, которая является следствием сдвига параллельных атомных слоев. Если переход от верхних горизонтов к нижним осуществляется поворотом по часовой стрелке, то дислокация правая, а если поворотом против часовой стрелки – левая.

Рис. 1.7. Механизм образования винтовой дислокации
Дислокационная структура материала характеризуется плотностью дислокаций.
Плотность дислокаций в кристалле определяется как среднее число линий дислокаций, пересекающих внутри тела площадку площадью 1 м2, или как суммарная длина линий дислокаций в объеме 1 м3
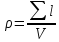 (см-2;
м-2)
(см-2;
м-2)
Плотность дислокаций изменяется в широких пределах и зависит от состояния материала.Плотность дислокации в значительной мере определяет пластичность и прочность материала (рис. 1.8). С уменьшением плотности сопротивление деформированию резко возрастает, а прочность приближается к теоретической. На практике повышение прочности достигается созданием металла с бездефектной структурой, а также повышением плотности дислокаций, затрудняющим их движение.
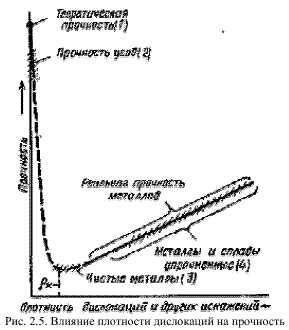
Рис. 1.8. Влияние плотности дислокаций на прочность.
Дислокации влияют не только на прочность и пластичность, но и на другие свойства кристаллов. С увеличением плотности дислокаций возрастает внутреннее напряжения, изменяются оптические свойства, повышается электросопротивление металла. Дислокации ускоряют старение и другие процессы, уменьшают химическую стойкость.
studfile.net
Внутреннее строение металлов и сплавов Кристаллическое строение металлов
У веществ в твердом состоянии строение кристаллическое или аморфное. В кристаллическом веществе атомы расположены по геометрически правильной схеме и на определенном расстоянии друг от друга, в аморфном же (стекле, канифоли) атомы расположены беспорядочно.
У всех металлов и их сплавов строение кристаллическое. На рис.12показана структура чистого железа. Кристаллические зерна неопределенной формы не похожи на типичные кристаллы — многогранники, поэтому их называюткристаллитами, зернамиили гранулами. Однако строение кристаллитов столь же закономерно, как и у развитых кристаллов.
Рис.12.Микроструктура чистого железа (х — 150)
Виды кристаллических решеток. При затвердевании атомы металлов образуют геометрически правильные системы, называемыекристаллическими решетками. Порядок расположения атомов в решетке может быть различным. Многие важнейшие металлы образуют решетки, простейшие (элементарные) ячейки которых представляют форму центрированного куба (— и— железо, хром, молибден, вольфрам, ванадий, марганец), куба с центрированными гранями (— железо, алюминий, медь, никель, свинец) или гексагональную, как у шестигранной призмы, ячейку (магний, цинк,— титан,— кобальт).
Элементарная ячейкаповторяется непрерывно в трех измерениях, образуя кристаллическую решетку, поэтому положение атомов в элементарной ячейке определяет структуру всего кристалла.
Элементарная ячейка центрированного куба (рис.13) состоит из девяти атомов, из которых восемь расположены по вершинам куба, а девятый — в его центре.
Рис.13. Элементарная ячейкаРис.14. Часть пространственной решет-
центрированного куба ки центрированного куба
Для характеристики кристаллической решетки (атомной структуры кристалла) применяют пространственную решетку, которая является геометрической схемой кристаллической решетки и состоит из точек (узлов), закономерно расположенных в пространств.
Рис.15. Элементарная ячейка кубаРис.16. Часть пространственной ре-
с центрированными гранями шетки куба с центрированными
гранями
На рис.14приведена часть пространственной решетки центрированного куба. Здесь взяты восемь смежных элементарных ячеек; узлы, расположенные по вершинам и в центре каждой ячейки, отмечены кружками. Элементарная ячейка куба с центрированными гранями (рис.15) состоит из 14 атомов, из них 8 атомов расположены по вершинам — куба и 6 атомов — по граням.
На рис.16приведена часть пространственной решетки куба с центрированными гранями ( гранецентрированного куба). На схеме имеется восемь элементарных ячеек; узлы расположены по вершинам и по центрам граней каждой ячейки. Гексагональная ячейка (рис.17) состоит из 17 атомов, из них 12 атомов расположены по вершинам шестигранной призмы, 2 атома — в центре оснований и 3 атома — внутри призмы. Для измерения расстояния между атомами кристаллических решеток пользуются специальной единицей, называемойангстремом см.
Рис.17. Гексагональная ячейка
Параметр решеток (сторона или шестигранника) у меди 3,6 А, а у алюминия 4,05 А, у цинка 2,67 А и т. д.
Каждый атом состоит из положительно заряженного ядра и нескольких слоев (оболочек) отрицательно заряженных и движущихся вокруг ядра электронов. Электроны внешних оболочек атомов металлов, называемые валентными, легко отщепляются, быстро движутся между ядрами и называютсясвободными. Вследствие наличия свободных электронов атомы металлов являются положительно заряженными ионами.
Таким образом, в узлах решеток, обозначенных кружками рис.14и16, находятся положительно заряженные ионы. Ионы, однако, не находятся в покое, а непрерывно колеблются положения равновесия. С повышением температуры амплитуда колебаний увеличивается, что вызывает расширение кристаллов, а при температуре плавления колебания частиц усиливаются настолько, что кристаллическая решетка разрушается.
Во всех кристаллах наблюдаются небольшие отклонения от идеальной решетки — незанятые узлы и различного рода смещения атомов.
Анизотропность и спайность кристаллов. В отдельных кристаллах свойства различны в разных направлениях. Если взять большой кристалл (существуют лабораторные и даже производственные методы выращивания крупных кристаллов) вырезать из него несколько одинаковых по размеру, но различно ориентированных образцов, и испытать их свойства, то иногда наблюдается весьма значительная разница в свойствах между отдельными образцами. Например, при испытании образцов, вырезанных из кристалла меди, относительное удлинение изменялось в пределах от 10 — 50 %, а предел прочности—от 14 до 35 кГ/мм2для различных образцов. Это свойство кристаллов называютанизотропностью. Анизотропность кристаллов объясняется особенностями расположения атомов в пространстве.
Следствием анизотропности кристаллов является спайность, которая выявляется при разрушении. В местах излома кристаллов можно наблюдать правильные плоскости, указывающие на смещение частиц под влиянием внешних сил не беспорядочное, а правильными рядами, в определенном направлении, соответственно расположению частиц в кристалле. Эти плоскости называютсяплоскостями спайности.
Аморфные тела изотропны, т. е. все их свойства одинаковы во всех направлениях. Излом аморфного тела всегда имеет неправильную искривленную, так называемую, раковистую поверхность.
Металлы, затвердевшие в обычных условиях, состоят не из одного кристалла, а из множества отдельных кристаллитов, различно ориентированных друг к другу, поэтому свойства литого металла приблизительно одинаковы во всех направлениях; это явление называют квазиизотропностью(кажущейся изотропностью).
Аллотропия металлов(или полиморфизм) — их свойство перестраивать решетку при определенных температурах в процессе нагревания или охлаждения. Аллотропию обнаруживают все элементы, меняющие валентность при изменении температуры: например, железо, марганец, никель, олово и др. Каждое аллотропическое превращение происходит при определенной температуре. Например, одно из превращений железа происходит при температуре 910°С, ниже которой атомы составляют решетку центрированного куба (см.рис.14), а выше — решетку гранецентрированного куба (см.рис.16).
Та или иная структура называется аллотропической формой или модификацией. Различные модификации обозначают греческими буквами , , и т. д., причем буквойобозначают модификацию, существующую при температурах ниже первого аллотропического превращения. Аллотропические превращения сопровождаются отдачей (уменьшением) или поглощением (увеличением) энергии.
Кристаллизация металлов. Кристаллизацией называется образование кристаллов в металлах (и сплавах) при переходе из жидкого состояния в твердое (первичная кристаллизация). Перекристаллизацию из одной модификации в другую при остывании эатвердевшего металла называют (вторичной кристаллизацией). Процесс кристаллизации металла легче всего проследить с помощью счетчика времени и термоэлектрического пирометра, который представляет собой милливольтметр, подключенный к термопаре. Термопару (две разнородные проволоки спаянные концами) погружают в расплавленный металл. Возникающий при этом термоток пропорционален температуре металла и стрелка милливольтметра отклоняется, указывая эту температуру по градуированной шкале.
Показания пирометра автоматически записываются во времени и по полученным данным строят кривые охлаждения в координатах «температура — время» (такие кривые вычерчивает самописец).
Температура, соответствующая какому-либо превращению в металле, называется критической точкой.
На рис.18, априведена кривая нагрева металла. Здесь точка а— начало плавления, точкаb — окончание плавления.
Рис.18. Кривые нагревания (а) и охлаждения (б— без петли,
в — с петлей) металла
Участок аbуказывает на неизменность температуры во времени при продолжающемся нагревании. Это показывает, что тепловая энергия затрачивается на внутреннее превращение в металле, в данном случае. на превращение твердого металла в жидкий (скрытая теплота плавления).
Переход из жидкого состояния в твердое при охлаждении сопровождается образованием кристаллической решетки, т. е. кристаллизацией. Чтобы вызвать кристаллизацию, жидкий металл нужно переохладитьнесколько ниже температуры плавления. Поэтому площадка на кривой охлаждения (рис.19,6) находится несколько нижеtпл при температуре переохлажденияtпр.
У некоторых металлов переохлаждение (tпл — tпр) может оказаться весьма значительным (например, у сурьмы до 40°С) и при температуре переохлажденияtпр(рис. 18, в) сразу бурно начинается кристаллизация, в результате чего температура скачком повышается почти доtпл. В этом случае на графике вычерчивается петля теплового гистерезиса.
При затвердевании и при аллотропическом превращении в металле вначале возникают зародыши кристалла (центры кристаллизации), вокруг которых группируются атомы, образуя соответствующую кристаллическую решетку.
Таким образом, процесс кристаллизации складывается из двух этапов: образования центров кристаллизации и роста кристаллов.
У каждого из возникающих кристаллов кристаллографические плоскости ориентированы случайно, кроме того, при первичной кристаллизации кристаллы могут поворачиваться, так как они окружены жидкостью. Смежные кристаллы растут навстречу друг другу и точки их соприкосновения определяют границы кристаллитов (зерен).
Кристаллизация железа. Рассмотрим в качестве примера кристаллизацию и критические точки железа.
Рис.19. Кривые охлаждения и нагревания железа
На рис.19приведены кривые охлаждения и нагревания чистого железа, которое плавится при температуре 15390С. Наличие критических точек при меньших температурах указывает на аллотропические превращения в твердом железе.
Критические точки обозначаются буквой А, при нагревании обозначаютАcи при охлажденииAr индексы 2, 3, 4 служат для отличия аллотропических превращений (индекс 1 обозначает превращение на диаграмме состоянияFe — Fe3C.
При температурах ниже 768 0С железо магнитно и имеет кристаллическую решетку центрированного куба. Эту модификацию называют-железо ; при нагревании она в точкеАс2переходит в немагнитную модификацию-железо. Кристаллическая структура при этом не меняется.
В точке Ас3при температуре 9100С-железо переходит в-железо с кристаллической решеткой гранецентрированного куба.
В точке Ас4при температуре 14010С-железо переходит в-железо, причем кристаллическая решетка вновь перестраивается из гранецентрированного куба в центрированный куб.
При охлаждении происходят те же переходы, только в обратной последовательности.
Из перечисленных превращений наибольшее практическое значение имеют превращения А3 как при нагреве (Ас3), так и при охлаждении (Аr3).
Превращение в точке А3сопровождается изменением объема, так как плотность кристаллической решетки-железа больше плотности решетки-железа, в точкеАс3 объем уменьшается, в точкеAr3 — увеличивается.
studfile.net
Строение металлов
Излом металла обычно шероховат, а при рассматривании в микроскоп в металле видны зерна различной величины и формы. Что представляют собой эти зерна? Каково строение их?
Ученые и инженеры одинаково стремились к разрешению этих загадок.
Инженеры в своей практике собирали факты. Физики пытались объяснить эти факты, исходя из представления об атомах. Так совместными усилиями была разгадана тайна строения металлов и поведения их под нагрузкой.
Проникновение в эту тайну началось исследованиями русского инженера-металлурга Д. К. Чернова.
Еще в 1878 году Чернов на заседании Русского технического общества нарисовал яркую картину кристаллизации расплавленного железа. Он проследил, как возникают и развиваются кристаллы при затвердевании расплава.
В остывающей массе жидкого металла часто образуются пустоты. В них кристаллики не стеснены ничем в своем развитии. На стенках пустот сперва появляются небольшие столбики. Каждый из них представляет собой сросток кубиков-кристалликов железа. Затем от них отходят под прямым углом такие же веточки, которые также разветвляются.
Так образуются в пустотах, или «раковинах», металла — «дендриты»— древовидные сростки кристаллов железа.
Масса металла состоит также из кристалликов. Но при своем росте они стесняют друг друга. Вместо правильных ветвеобразных сростков образуются бесформенные «зерна».
Однако внутреннее строение зерен одинаково со строением правильных кристалликов: кристалличность вещества заключается не в правильности формы, а в его свойствах. Одно из этих свойств — спайность, то есть способность от удара раскалываться по определенно направленным плоскостям. Если из кристалла каменной соли, который имеет форму куба, выточить шар, то он не потеряет свойства спайности. Разбив его ударом молотка, мы увидим, что плоские стороны кусков пересекаются под прямым углом, как и грани кристалла каменной соли.
Но правильный куб, изготовленный из некристаллического вещества — стекла, асфальта, — не приобретает свойства спайности.
Как же построен кристалл? Как расположены в нем атомы? Какими силами удерживаются они друг возле друга?
На эти вопросы впервые попытался ответить французский ученый XVIII века Гаюи. Изучая довольно редко встречающийся в природе кристалл кальцита (кристаллический известняк), Гаюи нечаянно уронил его на каменный пол. Кристалл разбился на несколько кусков.
Огорченный исследователь бросился собирать обломки. Внимательно рассматривая их, он заметил, что кристалл распадается на части, повторяющие его форму.
Случайность это или закон природы?
Гаюи стал осторожно разбивать кристаллы других минералов и убедился, что сделал важное открытие: плоские стороны обломков всегда составляют те же углы, что и грани целого кристалла. Значит, кристалл раскалывается по плоскостям, параллельным его граням.
Зерня металлического сплава при большом увеличений.
Структура кристалла, как ее представлял себе Гаюи.
Чем же объяснить существование в кристалле этих «плоскостей спайности»?
Гаюи предположил, что кристаллы сложены из мельчайших, такой же формы кристалликов: кубические — из кубиков, призматические — из призмочек, и так далее, подобно тому как складывается стена из кирпичей. Понятно, что при таком строении кристалл будет раскалываться по определенным плоскостям.
Но физики не согласились с Гаюи. Они указывали, что все тела при охлаждении сжимаются, а при нагревании расширяются. Значит, кристалл, сложенный из плотно прилегающих друг к другу «кирпичиков»-атомов, не мог бы изменить свой объем. Только минералоги пользовались гипотезой Гаюи для объяснения спайности кристаллов.
Проходили десятки лет, наука развивалась, перед ней возникали все новые задачи. Наконец замечательным русским ученым Е. С. Федоровым была решена и загадка строения кристалла. В то время еще никто не мог бы сказать, отличается ли внутреннее строение кристалла от строения некристаллического или, как говорят, аморфного вещества. Все поражались правильной форме, которую имеют горный хрусталь и другие минералы, но никто не понимал, чем объяснить ее. Это была загадка природы.
Модель кристаллической решетки (проволочки, удерживающие «атомы» модели, должны быть мысленно удалены).
Федоров первый разгадал ее.
В отличие от Гаюи, Федоров утверждал, что кристалл — не сплошная «кладка», а ажурная постройка из частиц, как бы «висящих» в пространстве в узлах воображаемой «решетки».
К тому времени почти все ученые признали, что тела состоят из молекул, а молекулы — из атомов. Но как расположены эти частицы в кристалле?
Федоров объяснил происхождение кристаллов тем, что атомы и молекулы располагаются симметрично относительно некоторых осей, плоскостей и центров. «Сущность дела не в форме мельчайших слагающих элементов кристалла, — говорил он, — а в их расположении».
Расположение атомов в кристалле таково, что в нем повторяется одинаковая группа правильно распределенных в ней атомов. В такой группе атомы могут, например, занимать вершины воображаемого куба. Соединив воображаемыми линиями атомы кристалла, получим так называемую пространственную решетку, состоящую из приложенных друг к другу воображаемых кубиков.
Это самый простой вид кристаллической решетки. Существуют кристаллы, решетка которых состоит из прямоугольных или косоугольных параллелепипедов. При этом атомы могут находиться не только в «узлах», то есть вершинах кубиков или параллелепипедов, но, например, и в центрах этих элементарных ячеек или в центрах их граней.
Решетка — воображаемый «скелет» кристалла; она только указывает на порядок, в каком атомы расположены, или, как говорят, «упакованы», в кристалле.
Почему вошло в употребление такое выражение, как «упаковка» атомов? Потому, что при изучении кристаллов ученые считали атомы просто шариками. Любой кристалл, встречающийся в природе, можно построить из атомов-шариков, уложенных в определенном порядке, подобно тому, как упаковываются яблоки в ящиках.
Строением кристалла легко объясняются и его свойства, например спайность.
Представим себе, что через узлы решетки проведены в различных направлениях воображаемые плоскости. Они не одинаково густо «усеяны» атомами: одни — реже, другие — гуще.
Понятно, что чем гуще расположены атомы, тем крепче они связаны друг с другом. Поэтому кристалл и раскалывается по плоскостям, которые густо усеяны атомами.
Кристаллическая решетка позволяет объяснить все свойства кристалла. Но существует ли она в действительности? Не является ли она просто воображаемым построением?
На этот вопрос впервые ответил немецкий физик Макс Лауэ. Занимаясь исследованием кристаллов, он сделал в 1912 году замечательный опыт. Чтобы понять, в чем заключался его опыт, нужно познакомиться со свойствами света.
Свет распространяется прямолинейно, что легко видеть, пропустив его через маленькое отверстие ставня в темную комнату: темноту прорежет яркий луч, освещающий носящиеся в воздухе пылинки. От зеркала световой луч отражается по тому же закону, как резиновый мячик от стены: угол падения равен углу отражения. Поэтому сперва принимали, что свет — поток несущихся прямолинейно мельчайших частиц.
Однако некоторые наблюдаемые явления оказалось невозможно объяснить таким предположением. Например, в центре тени от круглого диска можно обнаружить некоторое количество света. Если свет — поток прямолинейно движущихся частиц, то он не мог бы проникнуть в тень. Но это явление можно объяснить, если распространение света подобно движению волн.
Плотные «упаковки» атомов.
Все видели, как распространяются колебания частиц воды от упавшего на ее поверхность камня: каждая частица воды колеблется сверху вниз около положения равновесия, а движение ее передается в горизонтальном направлении по прямой линии; значит, колебания происходят поперек направления, по которому они распространяются. Возникают кольцеобразные волны, центром которых служит место падения камня. Встретив на пути препятствие, например столб, волны огибают его.
Чтобы объяснить проникновение света в тень, можно предположить, что свет представляет собой подобные же колебания, распространяющиеся волнами от его источника. Известны и другие оптические явления, которые возможно объяснить только при этом же предположении.
Известный немецкий физик Лауэ ожидал, что атомы в узлах кристаллической решетки будут рассеивать проникающие через нее лучи. Но световые лучи не годились для этого опыта, потому что волны видимого света: в тысячи раз длиннее поперечника атомов и так же свободно обходят их, как огибают расходящиеся по вод волны встречающиеся небольшие препятствия.
Поэтому Лауэ направил на маленький кристаллик пучок рентгеновых лучей, волны которых во много раз короче. Позади кристаллика он поставил фотографическую пластинку. На фотографии его глазам представилась неожиданная картина: запечатлелись не только круглое пятно от пучка лучей, но и множество симметрично расположенных маленьких пятнышек.
Что же это за пятнышки? Каково их происхождение?
Лауэ объяснил это явление тем, что рентгеновы луч» рассеиваются, то есть отражаются частицами в узлах кристаллической решетки.
Исследуя рентгеновыми лучами любой кристалл, можно по расположению этих пятнышек определить положение осей и плоскостей, относительно которых симметрично расположены частицы.
Так была доказана реальность существования кристаллической «решетки», или, что одно и то же, правильной «упаковки» атомов в кристалле.
Что же заставляет атомы располагаться в правильном порядке? Простой опыт позволяет приблизиться к разгадке этого явления.
Насыпьте на блюдечко с вогнутым дном немного гороху и несколько раз слегка встряхните его, чтобы горошины зашевелились. Вы увидите, что они лягут плотным слоем, образуя правильный шестиугольник.
На горошины действует сила тяжести. Под влиянием ее они укладываются как можно плотнее, занимая по возможности низкие места. В этом случае их потенциальная энергия в поле силы тяжести имеет наименьшую величину. Подобное же явление происходит и при кристаллизации металлов. Под влиянием действующих между ними сил атомы «стремятся» уложиться как можно плотнее.
Межатомные силы можно сравнить с действием спиральных пружинок: при растягивании пружинки сопротивляются удалению атомов друг от друга, при сжатии они препятствуют сближению их. Образуя кристалл, атомы занимают такое положение, в котором между силами притяжения и отталкивания устанавливается равновесие.
Зная строение кристаллических зерен металлов и действие межатомных сил, можно разгадать поведение металлов под нагрузкой.
Светлое центральное пятно — след первичного луча; маленькие пятна — следы вторичных рассеянных лучей, прошедших между атомами кристаллика.
www.stroitelstvo-new.ru