2.2.3. Кислоты
Кислотами называются сложные вещества, распадающиеся в водном растворе (или расплаве) на положительно заряженные ионы водорода и отрицательно заряженные ионы кислотного остатка (определение Аррениуса).
Например:
HCl H+ + Cl
хлороводородная кислота ион водорода кислотный остаток
Н2SO4 2Н+ + SO4 2-
серная кислота ионы водорода кислотный остаток
Классификация кислот
1. Все кислоты по основности можно подразделить на одноосновные и многоосновные.
Основность кислот определяется количеством атомов водорода в молекуле кислоты, которые могут замещаться на атомы металлов с образованием соли.
Одноосновные кислоты
Например:
HCI – хлороводородная (соляная кислота),
НJ – йодоводородная кислота,
HBr – бромоводородная кислота,
НNО3 – азотная кислота,
НСN – циановодородная (синильная) кислота,
HPO3 – метафосфорная кислота,
HNO2 – азотистая кислота и др.
Многоосновные кислоты
а) двухосновные:
например:
Н2S – сероводородная кислота,
H2SO4 – серная кислота,
Н2SО3 – сернистая кислота,
Н2СО3 – угольная кислота,
H3PO3 (H2HPO3) – фосфористая кислота.
в) трехосновные:
например:
H3PO4 – ортофосфорная кислота,
H3AsO4 – ортомышьяковая кислота и др.
2. По наличию в составе молекулы кислоты кислорода
все кислоты подразделяются на бескислородные и кислородсодержащие (оксокислоты).Бескислородные кислоты (как говорит само название) не содержат в своем составе кислорода.
Кислородсодержащие кислоты представляют собой гидраты кислотных оксидов (ангидридов кислот):
SO2 + Н2О = Н2SО3 – сернистая кислота,
CO2 + H2O = H2CO3 – угольная кислота,
Р2О5 + 3Н2О = 2Н3РО4 – ортофосфорная кислота.
Некоторые кислотные оксиды непосредственно с водой не взаимодействуют, но соответствующие им гидраты, полученные другим способом, представляют собой кислородсодержащие кислоты.
Например:
S iO2
iO2
Данная реакция не идет, но в качестве гидрата оксиду кремния (IV) соответствует кремниевая кислота H2SiO3, которую можно получить косвенным путем.
3. В зависимости от количества молекул воды, присоединенных одной молекулой кислотного оксида (ангидрида), кислородсодержащие кислоты можно подразделить на мета-, пиро- и орто — формы.
Например:
Р2О5 + Н2О = 2НРО3 – метафосфорная кислота,
P2O5 + 2H2O = H4P2O7 – пирофосфорная кислота,
Р2О5 + ЗН2О = 2Н3РО4 ортофосфорная кислота.
Если кислота имеет две формы, то менее богатая водой форма –это метаформа кислоты, более богатая водой форма ортоформа
кислоты.Например:
НВО2 – метаборная кислота,
Н3ВО3 – ортоборная кислота,
НА1O2 – метаалюминиевая кислота,
H3AlO3 – ортоалюминиевая кислота и др.
Номенклатура кислот
Водные растворы галогеноводородов, а также водородных соединений серы, селена, теллура и некоторые другие рассматривают как бескислородные кислоты.
Названия бескислородных кислот образуются от названия неметалла с прибавлением слова водородная:
Например:
HF – фтороводородная кислота
НС1 – хлороводородная кислота
НВr – бромоводородная кислота
HJ – йодоводородная кислота
НСN – циановодородная кислота
НСNS – родановодородная кислота
Традиционные названия кислородсодержащих кислот образуются в зависимости от названия элемента, образующего кислоту (кислотообразующего элемента), с учетом степени его окисления.
Например:
H2S+6O4 – серная кислота,
НМn+7О4 – марганцовая кислота,
H2Ge+4O3 – германиевая кислота.
Традиционные названия кислородсодержащих кислот представлены в табл. 2.1.
Таблица 2.1
Традиционные названия некоторых кислородсодержащих кислот
Формула | Название |
H3AsO4 | Ортомышьяковая кислота |
H3AsO3 | Ортомышьяковистая кислота |
HAsO3 | Метамышьяковая кислота |
H3BO3 | Ортоборная кислота |
НВО2 | Метаборная кислота |
НВrO4 | Бромная кислота |
HBrO3 | Бромноватая кислота |
НВrО | Бромноватистая кислота |
Н2CO3 | Угольная кислота |
HClO4 | Хлорная кислота |
HClO3 | Хлорноватая кислота |
HClO2 | Хлористая кислота |
НС1O | Хлорноватистая кислота |
НМnО4 | Марганцовая кислота |
Н2МnО4 | Марганцовистая кислота |
НNO3 | Азотная кислота |
НNO2 | Азотистая кислота |
H3PO4 | Фосфорная кислота |
Н3PО3 | Ортофосфористая кислота |
Н4P2O7 | Дифосфорная (пирофосфорная) кислота |
H2SO4 | Серная кислота |
H2S2O7 | Дисерная кислота |
H2SO3 | Сернистая кислота |
H2SiO3 | Кремниевая кислота |
H2CrO4 | Хромовая кислота |
H2Cr2O7 | Двухромовая кислота |
CH3COOH | Уксусная кислота |
studfile.net
Карбоновые кислоты.
Органическая химия
Карбоновые кислоты.
Строение карбоновых кислот
Карбоксильная группа является функциональной (характеристической) группой этого класса соединений. Примерами карбоновых кислот могут служить:
Свойства карбоновых кислот.
Кислотный характер этих соединений является результатом того, что атом водорода гидроксильной группы способен диссоциировать с образованием иона водорода, например:
Взаимодействуя с основаниями карбоновые кислоты образуют соли:
Карбоновые кислоты являются слабыми кислотами, поэтому их соли подвергаются обратимоми гидролизу. Наиболее сильные из карбоновых кислот
– муравьиная и уксусная.Карбоновые кислоты со спиртами образуют сложные эфиры. Сложные эфиры – чрезвычайно важное соединение, очень часто встречающееся в продуктах животного и растительного мира.
Классификация карбоновых кислот.
Карбоновые кислоты можно классифицировать по различным признакам:
- По количеству гидрокильных групп (одно- и двухосновные),
- По числу атомов углерода (низшие, средние, высшие),
- По наличию в них предельных и не предельных связей (предельные и непредельные).
Одноосновные и двухосновные карбоновые кислоты.
Карбоновые кислоты делятся одноосновные и двухосновные в зависимости от кличества в их составе гидроксильных групп ОН.
Все карбоновые кислоты, рассмотренные выше – это примеры одноосновных кислот. В их сотавах содержится по одной гидроксильной группе.
Низшие, средние и высшие карбоновые кислоты.
По числу атомов углерода в молекуле карбоновые кислоты делят на:
Низшие (С1-С3),
Средние (С4-С8) и
Высшие (С9-С26).
Высшие карбоновые кислоты называют высшими жирными кислотами, по причине того, что они входят в состав природных жиров.
Но иногда жирными называют все ациклические карбоновые кислоты. Таким образом, термины «жирные кислоты» и «карбоновые кислоты» часто используются как синонимы.
Предельные и непредельные карбоновые кислоты.
Предельные карбоновые кислоты в своём составе, содержат радикал предельных углеводородов, т.е. радикал только с простыми, одинарными связями.
И наоборот, непредельные карбоновые кислоты в своём составе содержат радикал непредельных углеводородов, т.е. радикал, в котором присутствуют кратные (двойные и тройные) связи.
Высшие карбоновые (жирные) кислоты
Напомним, что высшим карбоновым кислотам относят такие карбоновые кислоты, молекулы которых содержат сравнительно большое число атомов углерода (С9-С26).
По причине того, что высшие карбоновые кислоты входят в состав животных и растительных жиров их называют высшими жирными кислотами.
Примеры предельных высших жирных кислот:
- Каприновая кислота — C9H19COOH,
- Лауриновая кислота — С11Н23СООН,
- Миристиновая кислота — С13Н27СООН,
- Пальмитиновая кислота — С15Н31СООН,
- Стеариновая кислота – С17Н35СООН.
Примеры непредельных высших жирных кислот:
- Олеиновая кислота — С17Н33СООН – имеет одну двойную связь,
- Линолевая кислота – С17Н31СООН — имеет две двойных связи,
- Линоленовая кислота – С17Н29СООН – имеет три двойных связи.
Структурные формулы соединений, в которых присутствуют длинные углеводородный радикалы, часто изображают следующим образом:
В углеводородной цепи атомы углерода расположены не по прямой линии, а виде «змейки». Угол между двумя соседними отрезками такой «змейки» 109 градусов 28 минут. В случае двойной связи угол другой. В структурной формуле каждая вершина такой «змейки» означает атом углерода, соединённый с двумя атомами водорода. Последний атом углерода соединён с тремя атомами водорода. При этом сами символы углерода (С) и водорода(Н) не изображаются.
Предельные и непредельные жирные кислоты имеют в значительной степени различные свойства.
Высшие предельные кислоты – воскообразные вещества, непредельные – жидкости (напоминающие растительное масло).
Натриевые и калиевые соли высших жирных кислот называют мылами.
Например:
C17H35COONa – стеарат натрия,
СН31СООК – пальмитат калия.
Натриевые мыла – твёрдые, калиевые – жидкие.
Примеры карбоновых кислот
Уксусная кислота
Уксусная кислота – жилкость с острым раздражающим запахом.
Температура кипения 118,5 градусов С, при +16,6 градусах С застывает в кристаллическую массу, похожую на лёд.
Смешивается с водой в любых соотношениях.
Широко применяется как прправа к пище и консервирующее средство. В продаже встречается в виде уксусной эссенции (80%) и уксуса (9,3%).
Натуральный или винный уксус – продукт, содержащий уксусную кислоту и получающийся при скисании виноградного вина.
Уксусная кислота используется также при синтезе многих органических веществ и в качестве растворителя.
Уксусную кислоту получают преимущественно синтезом из ацетилена – присоединением к нему воды и окислением образующегося уксусного альдегида.
Бензойная кислота
Бензойная кислота простейшая одноосновная кислота ароматического ряда. Формула С6Н5-СООН.
На вид – бесцветные кристаллы.
Бензойная кислота – антисептик. Применяется для консервирования пищевых продуктови во многих органических синтезах.
Щавелевая кислота
Щавелевая кислота – простейшая двухосновная карбоновая кислота.
Формула НООС-СООН.
Щавелевая кислота – кристаллическое вещество, растворяется в воде, ядовита.
В виде кислой калиевой соли содержится во многих растениях.
Применяется для крашения тканей.
Терефталевая кислота
Терефталевая кислота НООС-С6Н4-СООН
Двухосновная карбоновая кислота ароматического ядра.
Её структурная формула:
Из терефталевой кислоты и этиленгликоля получают синтетическое волокно лавсан.
Молочная кислота
Молочная кислота может служить примером соединения со смешанными функциями – проявляет свойства кислоты и спирта (спиртокислота)
Она образуется при молочнокислом брожении сахаристых веществ, вызываемых особыми бактериями. Содержится в кислом молоке, рассоле квашеной капусты, силосе.
Салициловая кислота
Салициловая кислота – аналог молочной кислоты в ароматическом ряду. Имеет строение:
Относится к соединениям со смешанными функциями – проявляет свойства кислоты и фенола (фенолокислота).
Салициловая кислота – антисептик. Её используют (особенно её соли и эфиры) как лекарственное вещество.
Также салициловую кислоту используют при синтезе других продуктов.
xn—-7sbb4aandjwsmn3a8g6b.xn--p1ai
Одноосновные ненасыщенные кислоты
Если в молекуле
карбоновой кислоты имеется одна или
несколько связей 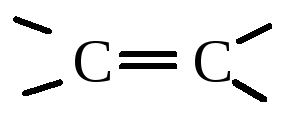 или
или 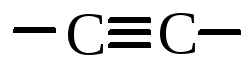 ,
то такие кислоты являются ненасыщенными:
,
то такие кислоты являются ненасыщенными:

Структурная изомерия одноосновных ненасыщенных кислот связана со строением углеродного скелета и положением двойной связи. Для ненасыщенных кислот существует пространственная изомерия (цис- и транс-):

СПОСОБЫ ПОЛУЧЕНИЯ
Для получения ненасыщенных кислот обычно используют соединение, уже содержащее одну из функциональных групп (карбоксильную группу или двойную связь).
1) Высшие карбоновые кислоты (содержащие от 12 до 22 атомов углерода), получают гидролизом жиров (липидов). Метод был рассмотрен ранее.
2) Из α-галогенкарбоновых кислот. Кратная связь образуется под действием спиртовых растворов щелочей или твердой щелочи.

3) Дегалогенирование дигалогенозамещенных карбоновых кислот, содержащих галогены у соседних атомов углерода. Образование кратной связи происходит под действием цинковой пыли.

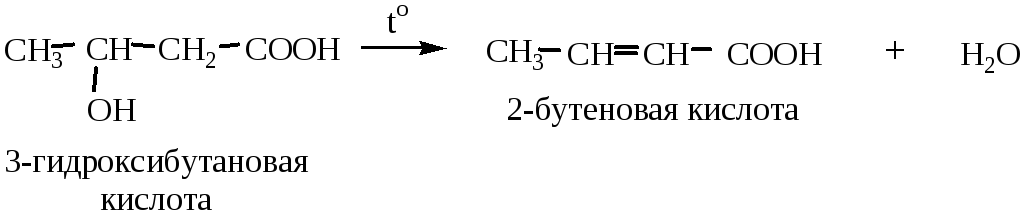
4) Дегидратация β-гидроксикислот (при нагревании они легко отщепляют воду с образованием двойной связи):
5) Окисление непредельных альдегидов:
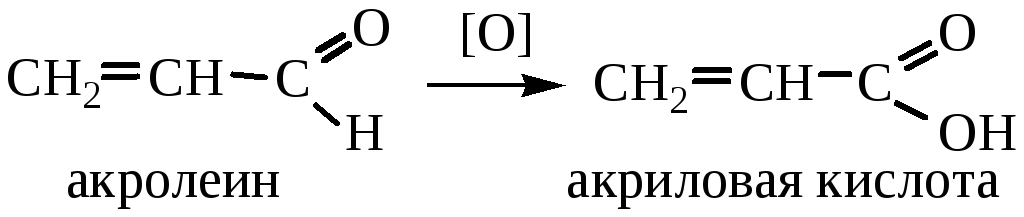
6) Получение непредельных карбоновых кислот из алкенов:

Физические свойства.
Ненасыщенные одноосновные кислоты – жидкости или твердые вещества, низшие – со специфическим запахом, растворимы в воде; высшие – без запаха и нерастворимы в воде.
ХИМИЧЕСКИЕ СВОЙСТВА
Химические свойства определяются наличием двух функциональных группировок: карбоксильной группы и двойной связи. Они вступают во все реакции, характерные для карбоновых кислот, а по двойной связи – в реакции присоединения, окисления, полимеризации.
Введение в молекулу двойной связи увеличивает силу кислоты. Влияние двойной связи снижается по мере удаления ее от карбоксильной группы. Кислоты, в которых двойная связь находится между вторым и третьим атомом углерода, отличаются некоторыми особенностями поведения из-за сопряжения между двойной связью и карбоксильной группой. Например, присоединение галогеноводородов, Н2О и H2SO4 происходит по типу 1,4 (водород присоединяется к наименее гидрогенизированному атому углерода, т.е. против правила Марковникова):
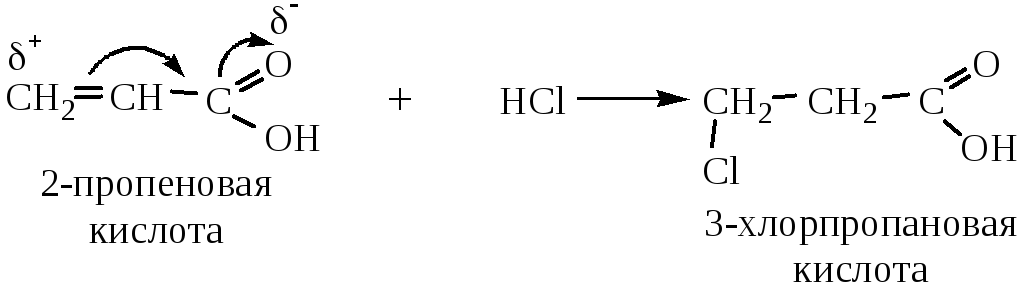
Применение.
Акриловая кислота – ее эфиры применяют для получения ценных полимерных материалов (органического стекла).
Сорбиновая кислота – антисептик, применяется для консервирования мясных и рыбных изделий, сыра, соков, овощей и др.
Олеиновая кислота – широко распространена в природе, входит в состав практически всех жиров. Является не только важнейшим компонентом пищи, но и широко применяется в технике, для производства пластмасс, мыла и т.д.
Двухосновные кислоты
Двухосновные карбоновые кислоты – это соединения, в молекулах которых содержатся две карбоксильные группы.
В зависимости от строения углеводородного радикала различают насыщенные, ненасыщенные, ароматические двухосновные карбоновые кислоты.
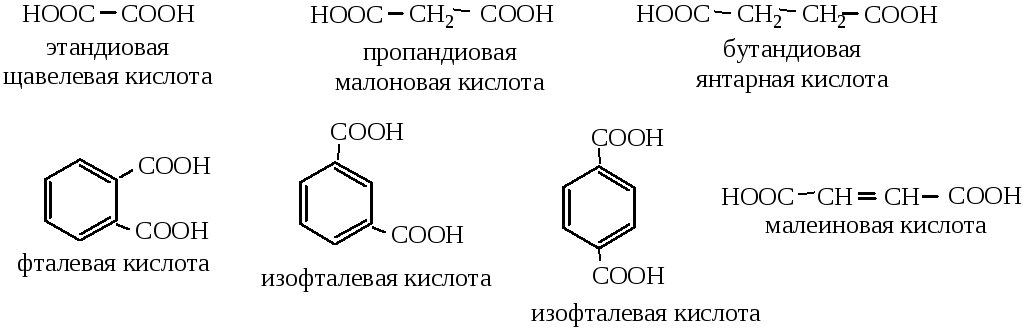
Структурная изомерия насыщенных алифатических двухосновных кислот обусловлена строением углеводородного радикала, ненасыщенных – строением радикала и положением двойных связей. У ненасыщенных кислот появляется также геометрическая (цис-, транс-) изомерия.

У ароматических кислот изомерия связана с взаимным расположением карбоксильных групп.
ФИЗИЧЕСКИЕ СВОЙСТВА.
Двухосновные кислоты – твердые вещества, без запаха, растворимы в воде и нерастворимы в углеводородах. Растворимость уменьшается с увеличением числа атомов углерода.
СПОСОБЫ ПОЛУЧЕНИЯ.
Большинство двухосновных кислот имеют специфические способы получения.
1) Получение щавелевой кислоты из формиата натрия:
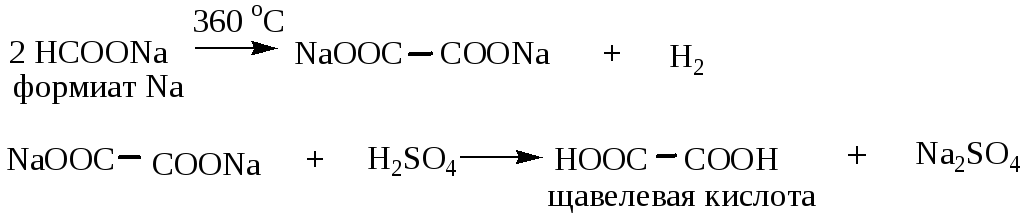
2) Получение малоновой кислоты из монохлоруксусной:

3) Получение фталевой кислоты окислением о-ксилола:
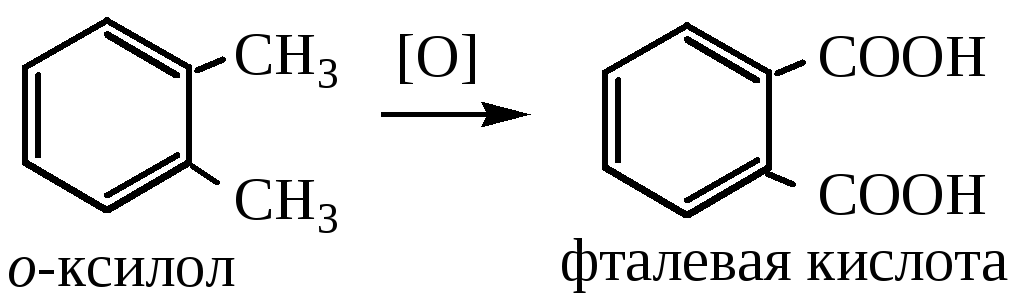
ХИМИЧЕСКИЕ СВОЙСТВА.
Двухосновные кислоты – сильнее одноосновных, т.к. вторая карбоксильная группа, выступая в качестве акцептора электронов, инициирует ионизацию первой карбоксильной группы. В водных растворах двухосновные кислоты диссоциируют на ионы:
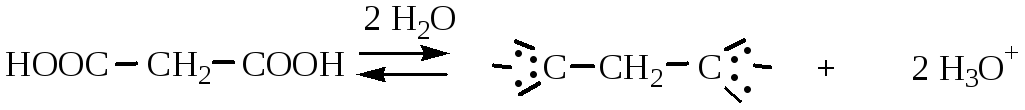
Двухосновные кислоты вступают во все реакции, характерные для одноосновных кислот, либо одной или обеими карбоксильными группами. Кислоты алифатического ряда с количеством атомов углерода С2 – С5 обладают рядом особенностей, связанных с расположением карбоксильных групп относительно друг друга.
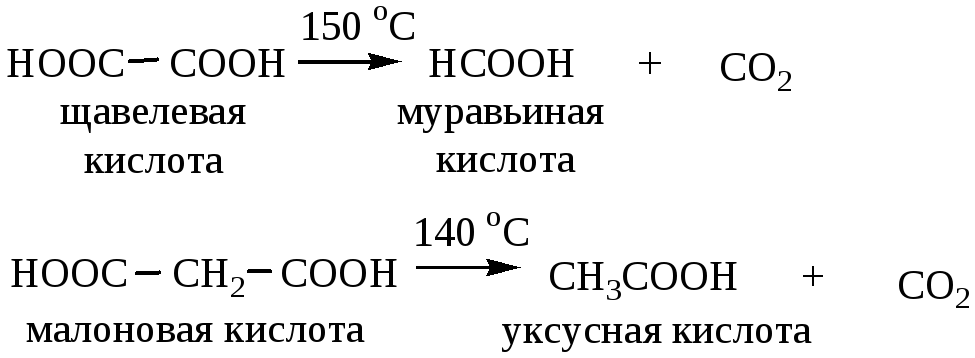
1) Декарбоксилирование двухосновных карбоновых кислот. Кислоты с близко расположенными карбоксильными группами легко отщепляют карбоксильную группировку с образованием одноосновных кислот:
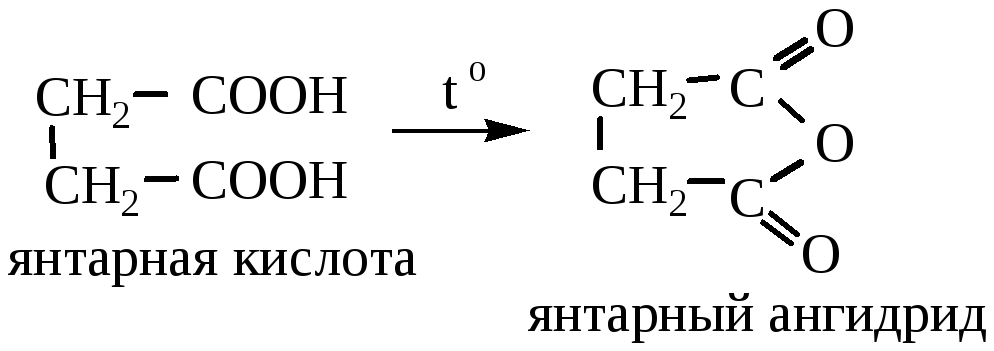
Дикарбоновые кислоты, у которых карбоксильные группы находятся в положении 1,4 и 1,5 при нагревании образуют циклические ангидриды:
Двухосновные кислоты, содержащие непредельные связи или ароматическое кольцо, вступают в реакции, характерные для алкенов и производных бензола.
studfile.net
Предельные одноосновные карбоновые кислоты, их строение и свойства на примере уксусной кислоты.
Карбоновые кислоты — органические вещества, молекулы которых содержат одну или несколько карбоксильных групп -СООН, соединённых с углеводородным радикалом или водородным атомом.
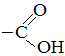 – карбоксильная группа
– карбоксильная группа
Гомологический ряд
НСООН метановая (муравьиная)
СН3СООН этановая (уксусная)
С2Н5СООН пропановая (пропионовая)
С3Н7СООН бутановая (масляная)
С4Н9СООН пентановая
С15Н31СООН пальмитиновая
С17Н35СООН стеариновая
Физические свойства
Низшие карбоновые кислоты – это жидкости с острым запахом, растворимы в воде. Высшие карбоновые кислоты – твёрдые вещества без запаха, не растворимы в воде. Муравьиная кислота – средней силы, уксусная – слабая.
Химические свойства
1. Диссоциация (слабые кислоты, меняют окраску индикаторов)
CH3COOH 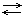 CH3COO— + H+
CH3COO— + H+
2. Взаимодействие с металлами
2CH3COOH + Mg → (CH3–COО)2Mg + H2
3. С оксидами
CH3COOH + MgO → (CH3–COO)2Mg + H2O
4. С гидроксидами
CH3COOH + NaOH → CH3COONa + H2O
5. С солями более слабых и летучих кислот
2CH3COOH + Na2CO3 → CH3COONa + H2CO3 (разлагается на H2O и CO2 )
)
6. Со спиртами (реакция этерификации)
CH3COOH + С2Н5ОН →СН3СООС2Н5 +Н2О
уксусно-этиловый
эфир
Применение уксусной кислоты: получение лекарств, волокон, пластмасс, солей, фруктовых эссенций, растворителей, в пищевой промышленности.
Жиры как сложные эфиры глицерина и карбоновых кислот, их состав и свойства. Жиры в природе, превращение жиров в организме. Продукты технической переработки жиров, понятие о мылах.
Жиры –сложные эфиры трёхатомного спирта глицерина и высших карбоновых кислот.

Физические свойства
Жиры – легкоплавкие вещества, легче воды, нерастворимы в воде, растворимы в органических растворителях, имеют низкую теплопроводность. Животные жиры – твёрдые, растительные жиры (масла) – жидкие. В состав животных жиров входят преимущественно насыщенные кислоты: стеариновая С17Н35СООН, пальмитиновая С15Н31СООН, в состав растительных масел входят ненасыщенные кислоты: олеиновая С17Н33СООН, линолевая С17Н31СООН.
Химические свойства
1. Гидролиз жиров. Жиры гидролизуются с образованием глицерина и карбоновых кислот:
СН2-О-СО-С17Н35 СН2ОН
СН -О-СО-С17Н35 + 3Н2О → СНОН + 3 С17Н35СООН
СН2-О-СО-С17Н35 СН2ОН
2. Гидрирование масел. Жидкие растительные масла превращаются в твёрдые
СН2-О-СО-С17Н33 СН2ОСОС17Н35
СН -О-СО-С17Н33 + 3Н2 → СНО СОС17Н35
СН2-О-СО-С17Н33 СН2ОСОС17Н35
жидкий жир твёрдый жир
3. Получение мыла. Мыла – соли щелочных металлов высших карбоновых кислот.
СН2-О-СО-С17Н35 СН2ОН
СН -О-СО-С17Н35 + 3NaОH → СНОН + 3 С17Н35СООNa
СН2-О-СО-С17Н35 СН2ОН
Применение — жиры – ценный продукт питания, служат для получения глицерина, карбоновых кислот, мыла, гидрированный жир служит для получения маргарина.
Жиры в природе. Жиры входят в состав животных и растительных организмов, служат источником энергии. При пищеварении жиры под действием ферментов распадаются на глицерин и карбоновые кислоты.
studopedia.net