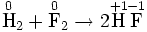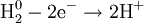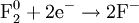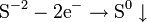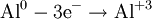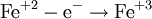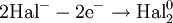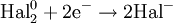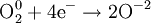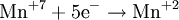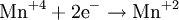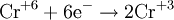Окислительно-восстановительная реакция — это… Что такое Окислительно-восстановительная реакция?
Окисли́тельно-восстанови́тельные реа́кции — это химические реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ, реализующихся путём перераспределения электронов между атомом-окислителем и атомом-восстановителем.
Описание
В процессе окислительно-восстановительной реакции восстановитель отдаёт электроны, то есть окисляется; окислитель присоединяет электроны, то есть восстанавливается. Причём любая окислительно-восстановительная реакция представляет собой единство двух противоположных превращений — окисления и восстановления, происходящих одновременно и без отрыва одного от другого.
Окисление
При окисле́нии вещества в результате отдачи электронов увеличивается его степень окисления. Атомы окисляемого вещества, называются донорами электронов, а атомы окислителя — акцепторами электронов.
В некоторых случаях при окислении молекула исходного вещества может стать нестабильной и распасться на более стабильные и более мелкие составные части. При этом некоторые из атомов получившихся молекул имеют более высокую степень окисления, чем те же атомы в исходной молекуле.
Окислитель, принимая электроны, приобретает восстановительные свойства, превращаясь в сопряжённый восстановитель:
- окислитель + e− ↔ сопряжённый восстановитель.
Восстановление
Восстановле́нием называется процесс присоединения электронов атомом вещества, при этом его степень окисления понижается.
При восстановлении атомы или ионы присоединяют электроны. При этом происходит понижение степени окисления элемента. Примеры: восстановление оксидов металлов до свободных металлов при помощи водорода, углерода, других веществ; восстановление органических кислот в альдегиды и спирты; гидрогенизация жиров и др.
Восстановитель, отдавая электроны, приобретает окислительные свойства, превращаясь в сопряжённый окислитель:
- восстановитель — e− ↔ сопряжённый окислитель.
Виды окислительно-восстановительных реакций
- межмолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах разных веществ, например:
- Н2S + Cl2 —> S + 2HCl
- внутримолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах одного и того же вещества, например:
- NH4NO3 —> N2O + 2 H2O
- диспропорционирование (самоокисление-самовосстановление) — реакции, в которых атомы с промежуточной степенью окисления превращаются в эквимолярную смесь атомов с более высокой и более низкой степенями окисления:
- M+N —> M+(N-x) + M+(N+x)
Примеры
Окислительно-востановительная реакция между водородом и фтором
Разделяется на две полуреакции:Ы
1) Окисление:
2) Восстановление:
Окисление, восстановление
В окислительно-восстановительных реакциях электроны от одних атомов, молекул или ионов переходят к другим. Процесс отдачи электронов — окисление. При окислении степень окисления повышается:
Процесс присоединения электронов — восстановление. При восстановлении степень окисления понижается:
Атомы или ионы, которые в данной реакции присоединяют электроны являются окислителями, а которые отдают электроны — восстановителями.
Для запоминания процессов окисления-восстановления, а также свойств окислителей и восстановителей существует несколько мнемонических правил:
- Отдать — Окислиться, Взять — Восстановиться (слова начинаются с одинаковых букв; при отдавании кем-либо чего-либо полезного — кислое, опущенное выражение лица, при получении — воспрявшее, восстановленное).
- Окислитель — грабитель (в процессе окислительно-восстановительной реакции окислитель присоединяет электроны).
См. также
Ссылки
- Окислительно-восстановительные реакции в органической химии [1], [2]
Wikimedia Foundation. 2010.
dic.academic.ru
Характеристика окислительно-восстановительных реакций — урок. Химия, 8–9 класс.
Окислительно-восстановительные реакции (ОВР) — это реакции, в которых происходит изменение степеней окисления атомов элементов.
В ОВР происходит переход электронов от одних атомов к другим, одновременно протекают два противоположных процесса: окисление и восстановление.
Окисление — процесс отдачи электронов.
Элемент, отдающий электроны — восстановитель.
Окисление:
N+1−4e−→N+5,
O−2−2e−→O0,
C−4−6e−→C+2,
N+1, O−2, C−4 — восстановители.
Восстановление — процесс принятия электронов.
Элемент, принимающий электроны — окислитель.
Восстановление:
S+6+2e−→S+4,
N0+3e−→N−3,
Cl+1+2e−→Cl−1,
S+6, N0, Cl+1 — окислители.
Обрати внимание!
В ОВР восстановитель окисляется, а окислитель восстанавливается.
Суммарный заряд всех частиц, участвующих в окислительно-восстановительной реакции, не меняется. В схемах процессов окисления и восстановления суммы зарядов слева и справа равны. Например:
N−3−5e−→N+2(−3)−5⋅(−1)=+2−3+5=+2+2=+2.
Обрати внимание!
При протекании ОВР степень окисления восстановителя повышается, а степень окисления окислителя понижается.
Окислительно-восстановительные реакции являются самыми распространёнными в природе и на производстве. В природе — это фотосинтез, дыхание, брожение, гниение. В промышленности их используют для получения металлов, удобрений. В повседневной жизни мы наблюдаем горение топлива, ржавление железа и др.
www.yaklass.ru
Окислительно-восстановительные реакции — это… Что такое Окислительно-восстановительные реакции?
Окисли́тельно-восстанови́тельные реа́кции, ОВР, редокс (от англ. redox ← reduction-oxidation — окисление-восстановление) — это встречно-параллельные химические реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ, реализующихся путём перераспределения электронов между атомом-окислителем и атомом-восстановителем.
Описание
В процессе окислительно-восстановительной реакции восстановитель отдаёт электроны, то есть окисляется; окислитель присоединяет электроны, то есть восстанавливается. Причём любая окислительно-восстановительная реакция представляет собой единство двух противоположных превращений — окисления и восстановления, происходящих одновременно и без отрыва одного от другого.
Окисление
Окисление — процесс отдачи электронов, с увеличением степени окисления.
При окисле́нии вещества в результате отдачи электронов увеличивается его степень окисления. Атомы окисляемого вещества называются донорами электронов, а атомы окислителя — акцепторами электронов.
В некоторых случаях при окислении молекула исходного вещества может стать нестабильной и распасться на более стабильные и более мелкие составные части (см. Свободные радикалы). При этом некоторые из атомов получившихся молекул имеют более высокую степень окисления, чем те же атомы в исходной молекуле.
Окислитель, принимая электроны, приобретает восстановительные свойства, превращаясь в сопряжённый восстановитель:
- окислитель + e− ↔ сопряжённый восстановитель.
Восстановление
При восстановлении атомы или ионы присоединяют электроны. При этом происходит понижение степени окисления элемента. Примеры: восстановление оксидов металлов до свободных металлов при помощи водорода, углерода, других веществ; восстановление органических кислот в альдегиды и спирты; гидрогенизация жиров и др.
Восстановитель, отдавая электроны, приобретает окислительные свойства, превращаясь в сопряжённый окислитель:
- восстановитель — e− ↔ сопряжённый окислитель.
Несвязанный, свободный электрон является сильнейшим восстановителем.
Окислительно-восстановительная пара
Окислитель и его восстановленная форма, либо восстановитель и его окисленная форма составляет сопряжённую окислительно-восстановительную пару, а их взаимопревращения являются окислительно-восстановительными полуреакциями.
В любой окислительно-восстановительной реакции принимают участие две сопряжённые окислительно-восстановительные пары, между которыми имеет место конкуренция за электроны, в результате чего протекают две полуреакции: одна связана с присоединением электронов, т.е. восстановлением, другая — с отдачей электронов, т.е. окислением.
Виды окислительно-восстановительных реакций
Межмолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах разных веществ, например:
- Н2S + Cl2 → S + 2HCl
Внутримолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах одного и того же вещества, например:
- 2H2O → 2H2 + O2
Диспропорционирование (самоокисление-самовосстановление) — реакции, в которых один и тот же элемент выступает и как окислитель, и как восстановитель, например:
- Cl2 + H2O → HClO + HCl
Репропорционирование (конпропорционирование) — реакции, в которых из двух различных степеней окисления одного и того же элемента получается одна степень окисления, например:
- NH4NO3 → N2O + 2H2O
Примеры
Окислительно-восстановительная реакция между водородом и фтором
Разделяется на две полуреакции:
1) Окисление:
2) Восстановление:
Окисление, восстановление
В окислительно-восстановительных реакциях электроны от одних атомов, молекул или ионов переходят к другим. Процесс отдачи электронов — окисление. При окислении степень окисления повышается:
Процесс присоединения электронов — восстановление. При восстановлении степень окисления понижается:
Атомы или ионы, которые в данной реакции присоединяют электроны являются окислителями, а которые отдают электроны — восстановителями.
См. также
Ссылки
dic.academic.ru
Окислительно-восстановительные реакции — Википедия
Окисли́тельно-восстанови́тельные реа́кции (ОВР), также редокс (сокр. англ. redox, от reduction-oxidation — восстановление-окисление) — это встречно-параллельные химические реакции, протекающие с изменением степеней окисления и не более 2 атомов, входящих в состав реагирующих веществ (или ионов веществ), реализующимся путём перераспределения электронов между атомом-окислителем (акцептором) и атомом-восстановителем (донором).
Историческая справка
Издавна ученые полагали, что окисление — это потеря флогистона (особого невидимого горючего вещества), а восстановление — его приобретение. Но, после создания А. Лавуазье в 1777 году кислородной теории горения к началу XIX века, химики стали считать окислением взаимодействие веществ с кислородом, а восстановлением их превращения под действием водорода. Тем не менее в качестве окислителя могут выступать и другие элементы, например
- Fe+2HCl→FeCl2+h3↑{\displaystyle {\mathsf {Fe+2HCl\rightarrow FeCl_{2}+H_{2}\uparrow }}}
В этой реакции окислитель — ион водорода[1] — H+, а железо выступает в роли восстановителя.
В соответствии с электронно-ионной теорией окисления-восстановления, разработанной Л. В. Писаржевским в 1914 г., окисление — процесс отщепления электронов от атомов или ионов элемента, который окисляется; Восстановлением называется процесс присоединения электронов к атомам или ионам элемента, каковой восстанавливается. Например, в реакции
- Zn0+Cl02→Zn+2Cl−12{\displaystyle {\mathsf {{\stackrel {0}{\mbox{Zn}}}+{\stackrel {0}{\mbox{Cl}}}_{2}\rightarrow {\stackrel {+2}{\mbox{Zn}}}{\stackrel {-1}{\mbox{Cl}}}_{2}}}}
атом цинка теряет два электрона, то есть окисляется, а молекула хлора присоединяет их, то есть восстанавливается.
Описание
В процессе окислительно-восстановительной реакции восстановитель отдаёт электроны, то есть окисляется; окислитель присоединяет электроны, то есть восстанавливается. Причём любая окислительно-восстановительная реакция представляет собой единство двух противоположных превращений — окисления и восстановления, происходящих одновременно и без отрыва одного от другого.[2]
Окисление
Окисление — процесс отдачи электронов с увеличением степени окисления.
При окисле́нии вещества в результате отдачи электронов увеличивается его степень окисления. Атомы окисляемого вещества называются донорами электронов, а атомы окислителя — акцепторами электронов.
В некоторых случаях при окислении молекула исходного вещества может стать нестабильной и распасться на более стабильные и более мелкие составные части (см. Свободные радикалы). При этом некоторые из атомов получившихся молекул имеют более высокую степень окисления, чем те же атомы в исходной молекуле.
Восстановитель, отдавая электроны, приобретает окислительные свойства, превращаясь в сопряжённый окислитель (сам процесс называется окислением):
- восстановитель — e− ↔ сопряжённый окислитель.
Несвязанный, свободный электрон является сильнейшим восстановителем.
Восстановление
Восстановле́ние — процесс присоединения электронов атомом вещества, при этом его степень окисления понижается.
При восстановлении атомы или ионы присоединяют электроны. При этом происходит понижение степени окисления элемента. Примеры: восстановление оксидов металлов до свободных металлов при помощи водорода, углерода, других веществ; восстановление органических кислот в альдегиды и спирты; гидрогенизация жиров и др.
Окислитель, принимая электроны, приобретает восстановительные свойства, превращаясь в сопряжённый восстановитель (сам процесс называют восстановлением):
- окислитель + e− ↔ сопряжённый восстановитель.
Окислительно-восстановительная пара
Окислитель и его восстановленная форма, либо восстановитель и его окисленная форма составляет сопряжённую окислительно-восстановительную пару, а их взаимопревращения являются окислительно-восстановительными полуреакциями.
В любой окислительно-восстановительной реакции принимают участие две сопряжённые окислительно-восстановительные пары, между которыми имеет место конкуренция за электроны, в результате чего протекают две полуреакции: одна связана с присоединением электронов, то есть восстановлением, другая — с отдачей электронов, то есть окислением.
Виды окислительно-восстановительных реакций
Межмолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах разных веществ, например:
- h3S+Cl2→S+2HCl{\displaystyle {\mathsf {H_{2}S+Cl_{2}\rightarrow S+2HCl}}}
Внутримолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах одного и того же вещества, например:
- 2h3O→2h3+O2{\displaystyle {\mathsf {2H_{2}O\rightarrow 2H_{2}+O_{2}}}}
Диспропорционирование (самоокисление-самовосстановление) — реакции, в которых один и тот же элемент выступает и как окислитель, и как восстановитель, например:
- h3O+Cl2→HCl+HOCl{\displaystyle {\mathsf {H_{2}O+Cl_{2}\rightarrow HCl+HOCl}}}
Репропорционирование (конпропорционирование) — реакции, в которых из двух различных степеней окисления одного и того же элемента получается одна степень окисления:
- SO2+2h3S→3S+2h3O{\displaystyle {\mathsf {SO_{2}+2H_{2}S\rightarrow 3S+2H_{2}O}}}
Примеры
Окислительно-восстановительная реакция между водородом и фтором
- H02+F02→2H+1F−1{\displaystyle {\mathsf {{\stackrel {0}{\mbox{H}}}_{2}+{\stackrel {0}{\mbox{F}}}_{2}\rightarrow 2{\stackrel {+1}{\mbox{H}}}{\stackrel {-1}{\mbox{F}}}}}}
Разделяется на две полу-реакции:
1) Окисление:
- h30−2e−→2H+{\displaystyle {\mathsf {{\mbox{H}}_{2}^{0}-2{\mbox{e}}^{-}\rightarrow 2{\mbox{H}}^{+}}}}
2) Восстановление:
- F20+2e−→2F−{\displaystyle {\mathsf {{\mbox{F}}_{2}^{0}+2{\mbox{e}}^{-}\rightarrow 2{\mbox{F}}^{-}}}}
- h30−2e−→2H+{\displaystyle {\mathsf {{\mbox{H}}_{2}^{0}-2{\mbox{e}}^{-}\rightarrow 2{\mbox{H}}^{+}}}}
- S2−−2e−→S0↓{\displaystyle {\mathsf {{\mbox{S}}^{2-}-2{\mbox{e}}^{-}\rightarrow {\mbox{S}}^{0}\downarrow }}}
- Al0−3e−→Al3+{\displaystyle {\mathsf {{\mbox{Al}}^{0}-3{\mbox{e}}^{-}\rightarrow {\mbox{Al}}^{3+}}}}
- Fe2+−e−→Fe3+{\displaystyle {\mathsf {{\mbox{Fe}}^{2+}-{\mbox{e}}^{-}\rightarrow {\mbox{Fe}}^{3+}}}}
- 2Hal−−2e−→Hal20{\displaystyle {\mathsf {2{\mbox{Hal}}^{-}-2{\mbox{e}}^{-}\rightarrow {\mbox{Hal}}_{2}^{0}}}}
Процесс присоединения электронов — восстановление. При восстановлении степень окисления понижается:
- O20+4e−→2O2−{\displaystyle {\mathsf {{\mbox{O}}_{2}^{0}+4{\mbox{e}}^{-}\rightarrow 2{\mbox{O}}^{2-}}}}
- Mn7++5e−→Mn2+{\displaystyle {\mathsf {{\mbox{Mn}}^{7+}+5{\mbox{e}}^{-}\rightarrow {\mbox{Mn}}^{2+}}}}
- Mn4++2e−→Mn2+{\displaystyle {\mathsf {{\mbox{Mn}}^{4+}+2{\mbox{e}}^{-}\rightarrow {\mbox{Mn}}^{2+}}}}
- Cr6++6e−→Cr0{\displaystyle {\mathsf {{\mbox{Cr}}^{6+}+6{\mbox{e}}^{-}\rightarrow {\mbox{Cr}}^{0}}}}
Атомы или ионы, которые в данной реакции присоединяют электроны являются окислителями, а атомы или ионы, которые отдают электроны — восстановителями.
Для нахождения пропорции веществ, вступающих в химическую реакцию, часто требуется уравнять ОВР. Уравнивание ОВР сводится к нахождению стехиометрических коэффициентов (то есть, количества молей каждого соединения). Стехиометрические коэффициенты могут принимать только значения целых величин от 1 и выше, дробные стехиометрические коэффициенты допускаются лишь в некоторых случаях записи термохимических уравнениях из курса физической химии. Различают два методы уравнивания ОВР: метод полуреакций и метод электронного баланса. Метод электронного баланса более прост и используется в случае протекания реакции в газообразной среде (например, процессы горения или термического разложения соединений). Метод полуреакций более сложен и используется в случае протекания реакции в жидкой среде. Метод полуреакций оперирует не свободными атомами и одноатомными ионами, а реально существующими в растворе частицами, образовавшимися в результате процессов растворения и/или диссоциации реагирующих веществ. Оба метода занимают важное место в базовом курсе общей и неорганической химии, изучаемом студентами различных учебных заведений[3].
Примечания
- ↑ В этом, как и во многих других случаях водород рассматривают как помещенный в VII группе периодической системы химических элементов над галогенами-окислителями.
- ↑ Несущественно, переходят ли электроны с одного атома на другой вполне (ионная связь) или же только более или менее оттягиваются (полярная ковалентная связь). Поэтому в данном случае мы будем говорить об отдаче или присоединении электронов независимо от действительного типа валентной связи. В общем, окислительно-восстановительные процессы можно определить как реакции, связанные с переходом электронов от одних атомов к другим. То есть валентности [ковалентных молекулярных соединений] в этих реакциях выступают как степени окисления. Более строго, в узком смысле под степенью окисления имеется ввиду в том числе и валентности.
- ↑ ОВР методом полуреакций. Химия и химическая технология в жизни (10.07.2013).
Литература
- Хомченко Г. П., Севастьянова К. И., Окислительно-восстановительные реакции, 2 изд., М., 1980;
- Кери Ф., Сандберг Р., Углубленный курс органической химии, пер. с англ., кн. 2, М., 1981, с. 119-41, 308-43;
- Марч Дж., Органическая химия, пер. с англ., т. 4, М., 1988, с. 259—341;
- Турьяи Я. И., Окислительно-восстановительные реакции и потенциалы в аналитической химии, М., 1989;
- Тодрес 3. В., Электронный перенос в органической и металлоорганической химии, в сб.: Итоги науки и техники. Сер. Органическая химия, т. 12, М., 1989. С. И. Дракин, З. В. Тодрес.
wikipedia.green
Окислительно-восстановительные реакции — Википедия (с комментариями)
Материал из Википедии — свободной энциклопедии
Окисли́тельно-восстанови́тельные реа́кции, также редокс (англ. redox, от reduction-oxidation — восстановление-окисление) — это встречно-параллельные химические реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ (или ионов веществ), реализующимся путём перераспределения электронов между атомом-окислителем (акцептором) и атомом-восстановителем (донором).
Историческая справка
Издавна ученые полагали, что окисление — это потеря флогистона (особого невидимого горючего вещества), а восстановление — его приобретение. Но, после создания А. Лавуазье в 1777 году кислородной теории горения к началу XIX века, химики стали считать окислением взаимодействие веществ с кислородом, а восстановлением их превращения под действием водорода. Тем не менее в качестве окислителя могут выступать и другие элементы, например
- <math>\mathsf{Fe + 2HCl \rightarrow FeCl_2 + H_2\uparrow}</math>
В этой реакции окислитель — ион водорода[1] — H+, а железо выступает в роли восстановителя.
В соответствии с электронно-ионной теорией окисления-восстановления, разработанной Л. В. Писаржевским в 1914 г., окисление — процесс отщепления электронов от атомов или ионов элемента, который окисляется; Восстановлением называется процесс присоединения электронов к атомам или ионам элемента, каковой восстанавливается. Например, в реакции
- <math> \mathsf{\stackrel{0}{\mbox {Zn}} + \stackrel{0}{\mbox {Cl}}_{2} \rightarrow \stackrel{+2}{\mbox {Zn}} \stackrel{-1}{\mbox {Cl}}_{2}} </math>
атом цинка теряет два электрона, то есть окисляется, а молекула хлора присоединяет их, то есть восстанавливается.
Описание
В процессе окислительно-восстановительной реакции восстановитель отдаёт электроны, то есть окисляется; окислитель присоединяет электроны, то есть восстанавливается. Причём любая окислительно-восстановительная реакция представляет собой единство двух противоположных превращений — окисления и восстановления, происходящих одновременно и без отрыва одного от другого.[2]
Окисление
Окисление — процесс отдачи электронов, с увеличением степени окисления.
При окисле́нии вещества в результате отдачи электронов увеличивается его степени окисления. Атомы окисляемого вещества называются донорами электронов, а атомы окислителя — акцепторами электронов.
В некоторых случаях при окислении молекула исходного вещества может стать нестабильной и распасться на более стабильные и более мелкие составные части (см. Свободные радикалы). При этом некоторые из атомов получившихся молекул имеют более высокую степень окисления, чем те же атомы в исходной молекуле.
Окислитель, принимая электроны, приобретает восстановительные свойства, превращаясь в сопряжённый восстановитель:
- окислитель +e− ↔ сопряжённый восстановитель.
Восстановление
Восстановле́ние — процесс присоединения электронов атомом вещества, при этом его степень окисления понижается.
При восстановлении атомы или ионы присоединяют электроны. При этом происходит понижение степени окисления элемента. Примеры: восстановление оксидов металлов до свободных металлов при помощи водорода, углерода, других веществ; восстановление органических кислот в альдегиды и спирты; гидрогенизация жиров и др.
Восстановитель, отдавая электроны, приобретает окислительные свойства, превращаясь в сопряжённый окислитель:
- восстановитель -e− ↔ сопряжённый окислитель.
Несвязанный, свободный электрон является сильнейшим восстановителем.
Окислительно-восстановительная пара
Окислитель и его восстановленная форма, либо восстановитель и его окисленная форма составляет сопряжённую окислительно-восстановительную пару, а их взаимопревращения являются окислительно-восстановительными полуреакциями.
В любой окислительно-восстановительной реакции принимают участие две сопряжённые окислительно-восстановительные пары, между которыми имеет место конкуренция за электроны, в результате чего протекают две полуреакции: одна связана с присоединением электронов, то есть восстановлением, другая — с отдачей электронов, то есть окислением.
Виды окислительно-восстановительных реакций
Межмолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах разных веществ, например:
- <math>\mathsf{H_2S + Cl_2 \rightarrow S + 2HCl}</math>
Внутримолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах одного и того же вещества, например:
- <math>\mathsf{2H_2O \rightarrow 2H_2 + O_2}</math>
Диспропорционирование (самоокисление-самовосстановление) — реакции, в которых один и тот же элемент выступает и как окислитель, и как восстановитель, например:
- <math>\mathsf{H_2O + Cl_2 \rightarrow HCl + HOCl}</math>
Репропорционирование (конпропорционирование) — реакции, в которых из двух различных степеней окисления одного и того же элемента получается одна степень окисления:
- <math>\mathsf{SO_2 + 2H_2S \rightarrow 3S + 2H_2O}</math>
Примеры
Окислительно-восстановительная реакция между водородом и фтором
- <math> \mathsf{ \stackrel{0}{\mbox {H}}_{2} + \stackrel{0}{\mbox {F}}_{2} \rightarrow 2\stackrel{+1}{\mbox {H}} \stackrel{-1}{\mbox {F}}}</math>
Разделяется на две полу-реакции:
1) Окисление:
- <math> \mathsf{{\mbox {H}}_{2}^{0} — 2{\mbox {e}}^{-} \rightarrow 2 {\mbox {H}}^{+}} </math>
2) Восстановление:
- <math> \mathsf{{\mbox {F}}_{2}^{0} + 2{\mbox {e}}^{-} \rightarrow 2 {\mbox {F}}^{-}} </math>
Окисление, восстановление
В окислительно-восстановительных реакциях электроны от одних атомов, молекул или ионов переходят к другим. Процесс отдачи электронов — окисление. При окислении степень окисления повышается:
- <math> \mathsf{{\mbox {H}}_{2}^{0} — 2{\mbox {e}}^{-} \rightarrow 2 {\mbox {H}}^{+}} </math>
- <math> \mathsf{{\mbox {S}}^{2-} — 2{\mbox {e}}^{-} \rightarrow {\mbox {S}}^{0} \downarrow} </math>
- <math> \mathsf{{\mbox {Al}}^{0} — 3{\mbox {e}}^{-} \rightarrow {\mbox {Al}}^{3+}} </math>
- <math> \mathsf{{\mbox {Fe}}^{2+} — {\mbox {e}}^{-} \rightarrow {\mbox {Fe}}^{3+}} </math>
- <math> \mathsf{2{\mbox {Hal}}^{-} — 2{\mbox {e}}^{-} \rightarrow {\mbox {Hal}}_{2}^{0}} </math>
Процесс присоединения электронов — восстановление. При восстановлении степень окисления понижается:
- <math> \mathsf{{\mbox {O}}_{2}^{0} + 4{\mbox {e}}^{-} \rightarrow 2{\mbox {O}}^{2-}} </math>
- <math> \mathsf{{\mbox {Mn}}^{7+} + 5{\mbox {e}}^{-} \rightarrow {\mbox {Mn}}^{2+}} </math>
- <math> \mathsf{{\mbox {Mn}}^{4+} + 2{\mbox {e}}^{-} \rightarrow {\mbox {Mn}}^{2+}} </math>
- <math> \mathsf{{\mbox {Cr}}^{6+} + 6{\mbox {e}}^{-} \rightarrow {\mbox {Cr}}^{0}} </math>
Атомы или ионы, которые в данной реакции присоединяют электроны являются окислителями, а атомы или ионы, которые отдают электроны — восстановителями.
Для нахождения пропорции веществ, вступающих в химическую реакцию, часто требуется уравнять ОВР. Уравнивание ОВР сводится к нахождению стехиометрических коэффициентов (то есть, количества молей каждого соединения). Стехиометрические коэффициенты могут принимать только значения целых величин от 1 и выше, дробные стехиометрические коэффициенты допускаются лишь в некоторых случаях записи термохимических уравнениях из курса физической химии. Различают два методы уравнивания ОВР: метод полуреакций и метод электронного баланса. Метод электронного баланса более прост и используется в случае протекания реакции в газообразной среде (например, процессы горения или термического разложения соединений). Метод полуреакций более сложен и используется в случае протекания реакции в жидкой среде. Метод полуреакций оперирует не свободными атомами и одноатомными ионами, а реально существующими в растворе частицами, образовавшимися в результате процессов растворения и/или диссоциации реагирующих веществ. Оба метода занимают важное место в базовом курсе общей и неорганической химии, изучаемом студентами различных учебных заведений[3].
См. также
Напишите отзыв о статье «Окислительно-восстановительные реакции»
Примечания
- ↑ В этом, как и во многих других случаях водород рассматривают как помещенный в VII группе периодической системы химических элементов над галогенами-окислителями.
- ↑ Несущественно, переходят ли электроны с одного атома на другой вполне (ионная связь) или же только более или менее оттягиваются (полярная ковалентная связь). Поэтому в данном случае мы будем говорить об отдаче или присоединении электронов независимо от действительного типа валентной связи. В общем, окислительно-восстановительные процессы можно определить как реакции, связанные с переходом электронов от одних атомов к другим. Т.е. валентности [ковалентных молекулярных соединений] в этих реакциях выступают как степени окисления. Более строго, в узком смысле под степенью окисления имеется ввиду в т.ч. и валентности.
- ↑ [www.chemfive.ru/news/19_ovr_metodom_polureakcij/2013-07-10-19 ОВР методом полуреакций]. Химия и химическая технология в жизни (10.07.2013).
Литература
- Хомченко Г. П., Севастьянова К. И., Окислительно-восстановительные реакции, 2 изд., М., 1980;
- Кери Ф., Сандберг Р., Углубленный курс органической химии, пер. с англ., кн. 2, М., 1981, с. 119-41, 308-43;
- Марч Дж., Органическая химия, пер. с англ., т. 4, М., 1988, с. 259—341;
- Турьяи Я. И., Окислительно-восстановительные реакции и потенциалы в аналитической химии, М., 1989;
- Тодрес 3. В., Электронный перенос в органической и металлоорганической химии, в сб.: Итоги науки и техники. Сер. Органическая химия, т. 12, М., 1989. С. И. Дракин, З. В. Тодрес.
Ссылки
- [www.chemport.ru/chemical_encyclopedia_article_2534.html Окислительно-восстановительные реакции в органической химии]
- [www.chem-astu.ru/science/redox/ Составление уравнений окислительно-восстановительных реакций онлайн]
- [www.youtube.com/watch?v=9-oT4qfFau0&list=PLLrNs_8cKAo2WSnSQN9Q7EnqxmztiTZ4T&index=9 Учебный фильм «Окислительно-восстановительные реакции»]
Отрывок, характеризующий Окислительно-восстановительные реакции
Они вошли в изящно, заново, богато отделанную столовую. Всё, от салфеток до серебра, фаянса и хрусталя, носило на себе тот особенный отпечаток новизны, который бывает в хозяйстве молодых супругов. В середине ужина князь Андрей облокотился и, как человек, давно имеющий что нибудь на сердце и вдруг решающийся высказаться, с выражением нервного раздражения, в каком Пьер никогда еще не видал своего приятеля, начал говорить:– Никогда, никогда не женись, мой друг; вот тебе мой совет: не женись до тех пор, пока ты не скажешь себе, что ты сделал всё, что мог, и до тех пор, пока ты не перестанешь любить ту женщину, какую ты выбрал, пока ты не увидишь ее ясно; а то ты ошибешься жестоко и непоправимо. Женись стариком, никуда негодным… А то пропадет всё, что в тебе есть хорошего и высокого. Всё истратится по мелочам. Да, да, да! Не смотри на меня с таким удивлением. Ежели ты ждешь от себя чего нибудь впереди, то на каждом шагу ты будешь чувствовать, что для тебя всё кончено, всё закрыто, кроме гостиной, где ты будешь стоять на одной доске с придворным лакеем и идиотом… Да что!…
Он энергически махнул рукой.
Пьер снял очки, отчего лицо его изменилось, еще более выказывая доброту, и удивленно глядел на друга.
– Моя жена, – продолжал князь Андрей, – прекрасная женщина. Это одна из тех редких женщин, с которою можно быть покойным за свою честь; но, Боже мой, чего бы я не дал теперь, чтобы не быть женатым! Это я тебе одному и первому говорю, потому что я люблю тебя.
Князь Андрей, говоря это, был еще менее похож, чем прежде, на того Болконского, который развалившись сидел в креслах Анны Павловны и сквозь зубы, щурясь, говорил французские фразы. Его сухое лицо всё дрожало нервическим оживлением каждого мускула; глаза, в которых прежде казался потушенным огонь жизни, теперь блестели лучистым, ярким блеском. Видно было, что чем безжизненнее казался он в обыкновенное время, тем энергичнее был он в эти минуты почти болезненного раздражения.
– Ты не понимаешь, отчего я это говорю, – продолжал он. – Ведь это целая история жизни. Ты говоришь, Бонапарте и его карьера, – сказал он, хотя Пьер и не говорил про Бонапарте. – Ты говоришь Бонапарте; но Бонапарте, когда он работал, шаг за шагом шел к цели, он был свободен, у него ничего не было, кроме его цели, – и он достиг ее. Но свяжи себя с женщиной – и как скованный колодник, теряешь всякую свободу. И всё, что есть в тебе надежд и сил, всё только тяготит и раскаянием мучает тебя. Гостиные, сплетни, балы, тщеславие, ничтожество – вот заколдованный круг, из которого я не могу выйти. Я теперь отправляюсь на войну, на величайшую войну, какая только бывала, а я ничего не знаю и никуда не гожусь. Je suis tres aimable et tres caustique, [Я очень мил и очень едок,] – продолжал князь Андрей, – и у Анны Павловны меня слушают. И это глупое общество, без которого не может жить моя жена, и эти женщины… Ежели бы ты только мог знать, что это такое toutes les femmes distinguees [все эти женщины хорошего общества] и вообще женщины! Отец мой прав. Эгоизм, тщеславие, тупоумие, ничтожество во всем – вот женщины, когда показываются все так, как они есть. Посмотришь на них в свете, кажется, что что то есть, а ничего, ничего, ничего! Да, не женись, душа моя, не женись, – кончил князь Андрей.
– Мне смешно, – сказал Пьер, – что вы себя, вы себя считаете неспособным, свою жизнь – испорченною жизнью. У вас всё, всё впереди. И вы…
Он не сказал, что вы , но уже тон его показывал, как высоко ценит он друга и как много ждет от него в будущем.
«Как он может это говорить!» думал Пьер. Пьер считал князя Андрея образцом всех совершенств именно оттого, что князь Андрей в высшей степени соединял все те качества, которых не было у Пьера и которые ближе всего можно выразить понятием – силы воли. Пьер всегда удивлялся способности князя Андрея спокойного обращения со всякого рода людьми, его необыкновенной памяти, начитанности (он всё читал, всё знал, обо всем имел понятие) и больше всего его способности работать и учиться. Ежели часто Пьера поражало в Андрее отсутствие способности мечтательного философствования (к чему особенно был склонен Пьер), то и в этом он видел не недостаток, а силу.
В самых лучших, дружеских и простых отношениях лесть или похвала необходимы, как подмазка необходима для колес, чтоб они ехали.
– Je suis un homme fini, [Я человек конченный,] – сказал князь Андрей. – Что обо мне говорить? Давай говорить о тебе, – сказал он, помолчав и улыбнувшись своим утешительным мыслям.
Улыбка эта в то же мгновение отразилась на лице Пьера.
– А обо мне что говорить? – сказал Пьер, распуская свой рот в беззаботную, веселую улыбку. – Что я такое? Je suis un batard [Я незаконный сын!] – И он вдруг багрово покраснел. Видно было, что он сделал большое усилие, чтобы сказать это. – Sans nom, sans fortune… [Без имени, без состояния…] И что ж, право… – Но он не сказал, что право . – Я cвободен пока, и мне хорошо. Я только никак не знаю, что мне начать. Я хотел серьезно посоветоваться с вами.
Князь Андрей добрыми глазами смотрел на него. Но во взгляде его, дружеском, ласковом, всё таки выражалось сознание своего превосходства.
– Ты мне дорог, особенно потому, что ты один живой человек среди всего нашего света. Тебе хорошо. Выбери, что хочешь; это всё равно. Ты везде будешь хорош, но одно: перестань ты ездить к этим Курагиным, вести эту жизнь. Так это не идет тебе: все эти кутежи, и гусарство, и всё…
– Que voulez vous, mon cher, – сказал Пьер, пожимая плечами, – les femmes, mon cher, les femmes! [Что вы хотите, дорогой мой, женщины, дорогой мой, женщины!]
– Не понимаю, – отвечал Андрей. – Les femmes comme il faut, [Порядочные женщины,] это другое дело; но les femmes Курагина, les femmes et le vin, [женщины Курагина, женщины и вино,] не понимаю!
Пьер жил y князя Василия Курагина и участвовал в разгульной жизни его сына Анатоля, того самого, которого для исправления собирались женить на сестре князя Андрея.
– Знаете что, – сказал Пьер, как будто ему пришла неожиданно счастливая мысль, – серьезно, я давно это думал. С этою жизнью я ничего не могу ни решить, ни обдумать. Голова болит, денег нет. Нынче он меня звал, я не поеду.
– Дай мне честное слово, что ты не будешь ездить?
– Честное слово!
Уже был второй час ночи, когда Пьер вышел oт своего друга. Ночь была июньская, петербургская, бессумрачная ночь. Пьер сел в извозчичью коляску с намерением ехать домой. Но чем ближе он подъезжал, тем более он чувствовал невозможность заснуть в эту ночь, походившую более на вечер или на утро. Далеко было видно по пустым улицам. Дорогой Пьер вспомнил, что у Анатоля Курагина нынче вечером должно было собраться обычное игорное общество, после которого обыкновенно шла попойка, кончавшаяся одним из любимых увеселений Пьера.
«Хорошо бы было поехать к Курагину», подумал он.
Но тотчас же он вспомнил данное князю Андрею честное слово не бывать у Курагина. Но тотчас же, как это бывает с людьми, называемыми бесхарактерными, ему так страстно захотелось еще раз испытать эту столь знакомую ему беспутную жизнь, что он решился ехать. И тотчас же ему пришла в голову мысль, что данное слово ничего не значит, потому что еще прежде, чем князю Андрею, он дал также князю Анатолю слово быть у него; наконец, он подумал, что все эти честные слова – такие условные вещи, не имеющие никакого определенного смысла, особенно ежели сообразить, что, может быть, завтра же или он умрет или случится с ним что нибудь такое необыкновенное, что не будет уже ни честного, ни бесчестного. Такого рода рассуждения, уничтожая все его решения и предположения, часто приходили к Пьеру. Он поехал к Курагину.
Подъехав к крыльцу большого дома у конно гвардейских казарм, в которых жил Анатоль, он поднялся на освещенное крыльцо, на лестницу, и вошел в отворенную дверь. В передней никого не было; валялись пустые бутылки, плащи, калоши; пахло вином, слышался дальний говор и крик.
Игра и ужин уже кончились, но гости еще не разъезжались. Пьер скинул плащ и вошел в первую комнату, где стояли остатки ужина и один лакей, думая, что его никто не видит, допивал тайком недопитые стаканы. Из третьей комнаты слышались возня, хохот, крики знакомых голосов и рев медведя.
Человек восемь молодых людей толпились озабоченно около открытого окна. Трое возились с молодым медведем, которого один таскал на цепи, пугая им другого.
– Держу за Стивенса сто! – кричал один.
– Смотри не поддерживать! – кричал другой.
– Я за Долохова! – кричал третий. – Разними, Курагин.
– Ну, бросьте Мишку, тут пари.
– Одним духом, иначе проиграно, – кричал четвертый.
– Яков, давай бутылку, Яков! – кричал сам хозяин, высокий красавец, стоявший посреди толпы в одной тонкой рубашке, раскрытой на средине груди. – Стойте, господа. Вот он Петруша, милый друг, – обратился он к Пьеру.
Другой голос невысокого человека, с ясными голубыми глазами, особенно поражавший среди этих всех пьяных голосов своим трезвым выражением, закричал от окна: «Иди сюда – разойми пари!» Это был Долохов, семеновский офицер, известный игрок и бретёр, живший вместе с Анатолем. Пьер улыбался, весело глядя вокруг себя.
wiki-org.ru
Окислительно-восстановительные реакции с участием органических веществ » HimEge.ru
В окислительно-восстановительных реакциях органические вещества чаще проявляют свойства восстановителей, а сами окисляются. Легкость окисления органических соединений зависит от доступности электронов при взаимодействии с окислителем. Все известные факторы, вызывающие увеличение электронной плотности в молекулах органических соединений (например, положительные индуктивный и мезомерные эффекты), будут повышать их способность к окислению и наоборот.
Склонность органических соединений к окислению возрастает с ростом их нуклеофильности, что соответствует следующим рядам:
Рост нуклеофильности в ряду
Рассмотрим окислительно-восстановительные реакции представителей важнейших классов органических веществ с некоторыми неорганическими окислителями.
Окисление алкенов
При мягком окислении алкены превращаются в гликоли (двухатомные спирты). Атомы-восстановители в этих реакциях – атомы углерода, связанные двойной связью.
Реакция с раствором перманганата калия протекает в нейтральной или слабо щелочной среде следующим образом:
3C2H4 + 2KMnO4 + 4H2O → 3CH2OH–CH2OH + 2MnO2 + 2KOH
В более жестких условиях окисление приводит к разрыву углеродной цепи по двойной связи и образованию двух кислот (в сильно щелочной среде – двух солей) или кислоты и диоксида углерода (в сильно щелочной среде – соли и карбоната):
1) 5CH3CH=CHCH2CH3 + 8KMnO4 + 12H2SO4 → 5CH3COOH + 5C2H5COOH + 8MnSO4 + 4K2SO4 + 17H2O
2) 5CH3CH=CH2 + 10KMnO4 + 15H2SO4 → 5CH3COOH + 5CO2 + 10MnSO4 + 5K2SO4 + 20H2O
3) CH3CH=CHCH2CH3 + 8KMnO4 + 10KOH → CH3COOK + C2H5COOK + 6H2O + 8K2MnO4
4) CH3CH=CH2 + 10KMnO4 + 13KOH → CH3COOK + K2CO3 + 8H2O + 10K2MnO4
Дихромат калия в сернокислотной среде окисляет алкены аналогично реакциям 1 и 2.
При окислении алкенов, в которых атомы углерода при двойной связи содержат по два углеродных радикала, происходит образование двух кетонов:
Окисление алкинов
Алкины окисляются в несколько более жестких условиях, чем алкены, поэтому они обычно окисляются с разрывом углеродной цепи по тройной связи. Как и в случае алкенов, атомы-восстановители здесь – атомы углерода, связанные кратной связью. В результате реакций образуются кислоты и диоксид углерода. Окисление может быть проведено перманганатом или дихроматом калия в кислотной среде, например:
5CH3C≡CH + 8KMnO4 + 12H2SO4 → 5CH3COOH + 5CO2 + 8MnSO4 + 4K2SO4 + 12H2O
Ацетилен может быть окислен перманганатом калия в нейтральной среде до оксалата калия:
3CH≡CH +8KMnO4→ 3KOOC –COOK +8MnO2 +2КОН +2Н2О
В кислотной среде окисление идет до щавелевой кислоты или углекислого газа:
5CH≡CH +8KMnO4 +12H2SO4 → 5HOOC –COOH +8MnSO4 +4К2SO4 +12Н2О
CH≡CH + 2KMnO4 +3H2SO4 → 2CO2 + 2MnSO4 + 4H2O + K2SO4
Окисление гомологов бензола
Бензол не окисляется даже в довольно жестких условиях. Гомологи бензола могут быть окислены раствором перманганата калия в нейтральной среде до бензоата калия:
C6H5CH3 +2KMnO4 → C6H5COOK + 2MnO2 + KOH + H2O
C6H5CH2CH3 + 4KMnO4 → C6H5COOK + K2CO3 + 2H2O + 4MnO2 + KOH
Окисление гомологов бензола дихроматом или перманганатом калия в кислотной среде приводит к образованию бензойной кислоты.
5С6Н5СН3+6КMnO4+9 H2SO4→ 5С6Н5СООН+6MnSO4 +3K2SO4 + 14H2O
5C6H5–C2H5 + 12KMnO4 + 18H2SO4 → 5C6H5COOH + 5CO2 + 12MnSO4 + 6K2SO4 + 28H2O
Окисление спиртов
Непосредственным продуктом окисления первичных спиртов являются альдегиды, а вторичных – кетоны.
Образующиеся при окислении спиртов альдегиды легко окисляются до кислот, поэтому альдегиды из первичных спиртов получают окислением дихроматом калия в кислотной среде при температуре кипения альдегида. Испаряясь, альдегиды не успевают окислиться.
3C2H5OH + K2Cr2O7 + 4H2SO4 → 3CH3CHO + K2SO4 + Cr2(SO4)3 + 7H2O
С избытком окислителя (KMnO4, K2Cr2O7) в любой среде первичные спирты окисляются до карбоновых кислот или их солей, а вторичные – до кетонов.
5C2H5OH + 4KMnO4 + 6H2SO4 → 5CH3COOH + 4MnSO4 + 2K2SO4 + 11H2O
3CH3–CH2OH + 2K2Cr2O7 + 8H2SO4 → 3CH3–COOH + 2K2SO4 + 2Cr2(SO4)3 + 11H2O
Третичные спирты в этих условиях не окисляются, а метиловый спирт окисляется до углекислого газа.
Двухатомный спирт, этиленгликоль HOCH2–CH2OH, при нагревании в кислой среде с раствором KMnO4 или K2Cr2O7 легко окисляется до щавелевой кислоты, а в нейтральной – до оксалата калия.
5СН2(ОН) – СН2(ОН) + 8КMnO4+12H2SO4→ 5HOOC –COOH +8MnSO4 +4К2SO4 +22Н2О
3СН2(ОН) – СН2(ОН) + 8КMnO4→ 3KOOC –COOK +8MnO2 +2КОН +8Н2О
Окисление альдегидов и кетонов
Альдегиды – довольно сильные восстановители, и поэтому легко окисляются различными окислителями, например: KMnO4, K2Cr2O7, [Ag(NH3)2]OH, Cu(OH)2. Все реакции идут при нагревании:
3CH3CHO + 2KMnO4 → CH3COOH + 2CH3COOK + 2MnO2 + H2O
3CH3CHO + K2Cr2O7 + 4H2SO4 → 3CH3COOH + Cr2(SO4)3 + 7H2O
CH3CHO + 2KMnO4 + 3KOH → CH3COOK + 2K2MnO4 + 2H2O
5CH3CHO + 2KMnO4 + 3H2SO4 → 5CH3COOH + 2MnSO4 + K2SO4 + 3H2O
CH3CHO + Br2 + 3NaOH → CH3COONa + 2NaBr + 2H2O
реакция «серебряного зеркала»
C аммиачным раствором оксида серебра альдегиды окисляются до карбоновых кислот которые в аммиачном растворе дают соли аммония (реакция «серебрянного зеркала»):
CH3CH=O + 2[Ag(NH3)2]OH → CH3COONH4 + 2Ag + H2O + 3NH3
CH3–CH=O + 2Cu(OH)2 → CH3COOH + Cu2O + 2H2O
Муравьиный альдегид (формальдегид) окисляется, как правило, до углекислого газа:
5HCOH + 4KMnO4(изб) + 6H2SO4 → 4MnSO4 + 2K2SO4 + 5CO2 + 11H2O
3СН2О + 2K2Cr2O7 + 8H2SO4 → 3CO2 +2K2SO4 + 2Cr2(SO4)3 + 11H2O
HCHO + 4[Ag(NH3)2]OH → (NH4)2CO3 + 4Ag↓ + 2H2O + 6NH3
HCOH + 4Cu(OH)2 → CO2 + 2Cu2O↓+ 5H2O
Кетоны окисляются в жестких условия сильными окислителями с разрывом связей С-С и дают смеси кислот:
Карбоновые кислоты. Среди кислот сильными восстановительными свойствами обладают муравьиная и щавелевая, которые окисляются до углекислого газа.
НСООН + HgCl2 =CO2 + Hg + 2HCl
HCOOH+ Cl2 = CO2 +2HCl
HOOC-COOH+ Cl2 =2CO2 +2HCl
Муравьиная кислота, кроме кислотных свойств, проявляет также некоторые свойства альдегидов, в частности, восстановительные. При этом она окисляется до углекислого газа. Например:
2KMnO4 + 5HCOOH + 3h3SO4 → K2SO4 + 2MnSO4 + 5CO2↑ + 8h3O
При нагревании с сильными водоотнимающими средствами (h3SO4 (конц.) или P4O10) разлагается:
HCOOH →(t) CO↑ + h3O
Каталитическое окисление алканов:
Каталитическое окисление алкенов:
Окисление фенолов:
himege.ru
Окисление — это… Что такое Окисление?
Окисли́тельно-восстанови́тельные реа́кции — это химические реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ, реализующихся путём перераспределения электронов между атомом-окислителем и атомом-восстановителем.
Описание
В процессе окислительно-восстановительной реакции восстановитель отдаёт электроны, то есть окисляется; окислитель присоединяет электроны, то есть восстанавливается. Причём любая окислительно-восстановительная реакция представляет собой единство двух противоположных превращений — окисления и восстановления, происходящих одновременно и без отрыва одного от другого.
Окисление
При окисле́нии вещества в результате отдачи электронов увеличивается его степень окисления. Атомы окисляемого вещества, называются донорами электронов, а атомы окислителя — акцепторами электронов.
В некоторых случаях при окислении молекула исходного вещества может стать нестабильной и распасться на более стабильные и более мелкие составные части. При этом некоторые из атомов получившихся молекул имеют более высокую степень окисления, чем те же атомы в исходной молекуле.
Окислитель, принимая электроны, приобретает восстановительные свойства, превращаясь в сопряжённый восстановитель:
- окислитель + e− ↔ сопряжённый восстановитель.
Восстановление
Восстановле́нием называется процесс присоединения электронов атомом вещества, при этом его степень окисления понижается.
При восстановлении атомы или ионы присоединяют электроны. При этом происходит понижение степени окисления элемента. Примеры: восстановление оксидов металлов до свободных металлов при помощи водорода, углерода, других веществ; восстановление органических кислот в альдегиды и спирты; гидрогенизация жиров и др.
Восстановитель, отдавая электроны, приобретает окислительные свойства, превращаясь в сопряжённый окислитель:
- восстановитель — e− ↔ сопряжённый окислитель.
Виды окислительно-восстановительных реакций
- межмолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах разных веществ, например:
- Н2S + Cl2 —> S + 2HCl
- внутримолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах одного и того же вещества, например:
- NH4NO3 —> N2O + 2 H2O
- диспропорционирование (самоокисление-самовосстановление) — реакции, в которых атомы с промежуточной степенью окисления превращаются в эквимолярную смесь атомов с более высокой и более низкой степенями окисления:
- M+N —> M+(N-x) + M+(N+x)
Примеры
Окислительно-востановительная реакция между водородом и фтором
Разделяется на две полуреакции:Ы
1) Окисление:
2) Восстановление:
Окисление, восстановление
В окислительно-восстановительных реакциях электроны от одних атомов, молекул или ионов переходят к другим. Процесс отдачи электронов — окисление. При окислении степень окисления повышается:
Процесс присоединения электронов — восстановление. При восстановлении степень окисления понижается:
Атомы или ионы, которые в данной реакции присоединяют электроны являются окислителями, а которые отдают электроны — восстановителями.
Для запоминания процессов окисления-восстановления, а также свойств окислителей и восстановителей существует несколько мнемонических правил:
- Отдать — Окислиться, Взять — Восстановиться (слова начинаются с одинаковых букв; при отдавании кем-либо чего-либо полезного — кислое, опущенное выражение лица, при получении — воспрявшее, восстановленное).
- Окислитель — грабитель (в процессе окислительно-восстановительной реакции окислитель присоединяет электроны).
См. также
Ссылки
- Окислительно-восстановительные реакции в органической химии [1], [2]
Wikimedia Foundation. 2010.
dic.academic.ru