В Москве оценили состояние атмосферного воздуха за первое полугодие 2020 года
По итогам первого полугодия 2020 года средние концентрации основных антропогенных загрязняющих веществ в городе соответствуют установленным нормативам. Также специалисты отметили, что воздух в Москве стал чище относительно аналогичного периода 2019 года.
Информация о состоянии воздуха поступает с 56 московских автоматических станций контроля загрязнения атмосферы, метеорологических комплексов, из передвижных лабораторий и аналитической лаборатории. Они располагаются вблизи автотрасс, на жилых и природных территориях, а также на территориях, находящихся под влиянием промышленных предприятий.
Станции работают круглосуточно. Это позволяет получать оперативные сведения и отслеживать любые изменения загрязнения воздуха. Данные со станций мониторинга доступны на сайте.
Концентрации основных загрязняющих веществ в столице составляют: по оксиду азота — 0,2 предельно допустимой среднесуточной концентрации химического вещества в воздухе (ПДКсс), оксиду углерода — 0,1 ПДКсс, диоксиду серы — менее 0,1 ПДКсс, взвешенным частицам РМ10 — 0,5 ПДКсс и диоксиду азота — 0,7 ПДКсс.
Случаев высокого уровня загрязнения атмосферного воздуха по основным загрязняющим веществам не зарегистрировано.
Также снизилось количество случаев превышений нормативов по оксиду углерода, диоксиду азота и взвешенным частицам РМ10, а по диоксиду серы превышений не зафиксировано. Рост концентраций с превышением нормативов был связан с метеоусловиями.
В целом по городу концентрации оксида углерода оказались ниже прошлогоднего уровня на 11 процентов, диоксида и оксида азота — на 22 процента, диоксида серы — на 36 процентов, взвешенных частиц РМ10 — на 13 процентов.
Вблизи автомобильных трасс средние концентрации загрязняющих веществ не превысили установленных нормативов, за исключением оксида азота и взвешенных частиц РМ10 — превышения их максимальных разовых концентраций отмечались при ухудшении условий рассеивания в атмосфере.
В жилых кварталах средние концентрации основных загрязняющих веществ не превысили установленных нормативов и находились в пределах 0,04–0,6 ПДКсс. Превышения отмечены лишь по оксиду азота и взвешенным частицам РМ10 с повторяемостью менее 0,1 процента. По всем основным загрязняющим веществ в первом полугодии отмечено снижение концентраций.
Снижение уровня загрязнения воздуха произошло несмотря на то, что в этом году часто возникали метеоусловия, мешающие рассеиванию вредных веществ.
Дней с такими неблагоприятными условиями было почти вдвое больше (21). Наиболее часто они отмечались в феврале и марте, а также в июне.
Положительная динамика состояния воздуха связана с мерами, которые принимаются для улучшения экологии в Москве, а также со снижением интенсивности движения автотранспорта в период самоизоляции.
Также снижение выбросов отмечается и от стационарных источников. По данным автоматизированной системы контроля, в первом полугодии 2020 года количество промышленных выбросов объектов теплоэнергетики снизилось почти на 19 процентов.
Актуальные данные о состоянии атмосферного воздуха в Москве опубликованы в докладе о состоянии окружающей среды на сайте столичного Департамента природопользования и охраны окружающей среды.
Загрязняющие вещества 4 класса опасности — Челябинский гидрометеоцентр
Главная> Мониторинг среды> Загрязняющие вещества> Загрязняющие вещества 4 класса опасностиОксид углерода (угарный газ).
Оксид углерода – бесцветный газ, не имеющий запаха, немного легче воздуха, плохо растворим в воде, имеет температуру кипения: – 191,5°С. На воздухе загорается при температуре 700°С и сгорает синим пламенем до СО 2.
Источники поступления в окружающую среду.
Монооксид углерода входит в состав атмосферы (10%). В атмосферу оксид углерода попадает в составе вулканических и болотных газов, в результате лесных и степных пожаров, выделения микроорганизмами, растениями, животными и человеком. Из поверхностных слоев океанов в год выделяется 220х106 тонн оксида углерода в результате фоторазложения красных, сине-зеленых и др. водорослей, продуктов жизнедеятельности планктона. Естественный уровень содержания оксида углерода в атмосферном воздухе – 0,01-0,9 мг/м3.
Угарный газ попадает в атмосферу от промышленных предприятий, в первую очередь металлургии. В металлургических процессах при выплавке 1 млн. тонн стали образуется 320-400 тонн оксида углерода. Большое количество СО образуется в нефтяной промышленности и на химических предприятиях (крекинг нефти, производство формалина, углеводородов, аммиака и др.). Еще одним немаловажным источником оксида углерода является табачный дым. Высока концентрация оксида углерода в угольных шахтах, на углеподающих трассах. Оксид углерода образуется при неполном сгорании топлива в печах и двигателях внутреннего сгорания. Важным источником оксида углерода является автомобильный транспорт.
В результате деятельности человека в атмосферу ежегодно поступает 350-600х106 тонн угарного газа. Около 56-62% этого количества приходится на долю автотранспорта (содержание оксида углерода в выхлопных газах может достигать величины 12%).
Поведение в окружающей среде.
При обычных условиях монооксид углерода инертен. Он химически не взаимодействует с водой. Растворимость СО в воде около 1:40 по объему. В растворе способен восстанавливать соли золота и платины до свободных металлов уже при обычной температуре. Не реагирует СО также с щелочами и кислотами. Взаимодействует с едкими щелочами только при повышенных температурах и высоких давлениях.
Убыль оксида углерода в окружающей среде происходит за счет его разложения почвенными грибами. Кроме того, при избытке кислорода в почвах тяжелого механического состава, богатых органическими веществами, имеет место переход СО в СО2.
Воздействие на организм человека.
Оксид углерода чрезвычайно ядовит. Допустимое содержание СО в производственных помещениях составляет 20 мг/м3 в течение рабочего дня, 50 мг/м3 в течение 1 часа, 100 мг/м3 в течение 30 минут, в атмосферном воздухе города максимальная разовая (за 20 мин) – 5 мг/м
СО вдыхается вместе с воздухом и поступает в кровь, где конкурирует с кислородом за молекулы гемоглобина. Оксид углерода, имея двойную химическую связь, соединяется с гемоглобином более прочно, чем молекула кислорода. Чем больше СО содержится в воздухе, тем больше молекул гемоглобина связывается с ним и тем меньше кислорода достигает клеток организма. Нарушается способность крови доставлять кислород к тканям, вызываются спазмы сосудов, снижается иммунологическая активность человека, сопровождающиеся головной болью, потерей сознания и смертью. По этим причинам СО в повышенных концентрациях представляет собой смертельный яд.
СО нарушает фосфорный обмен. Нарушение азотистого обмена вызывает зотемию, изменение содержания белков плазмы, снижение активности холинэстеразы крови и уровня витамина В 6. Угарный газ влияет на углеводный обмен, усиливает распад гликогена в печени, нарушая утилизацию глюкозы, повышая уровень сахара в крови. Поступление СО из легких в кровь обусловлено концентрацией СО во вдыхаемом воздухе и длительностью ингаляции. Выделение СО происходит главным образом через дыхательные пути.
Больше всего при отравлении страдает ЦНС. При вдыхании небольшой концентрации (до 1 мг/л) – тяжесть и ощущение сдавливания головы, сильная боль во лбу и висках, головокружение, дрожь, жажда, учащение пульса, тошнота, рвота, повышение температуры тела до 38-40°С. Слабость в ногах свидетельствует о распространении действия на спинной мозг.
Слабость в ногах свидетельствует о распространении действия на спинной мозг.
Чрезвычайная ядовитость СО, отсутствие у него цвета и запаха, а также очень слабое поглощение его активированным углем обычного противогаза делают этот газ особенно опасным.
Класс опасности вещества — 4.
Аммиак – бесцветный газ с резким запахом, температура плавления – 80°С, температура кипения – 36°С, хорошо растворяется в воде, спирте и ряде других органических растворителей. Синтезируют из азота и водорода. В природе образуется при разложении азотсодержащих органических соединений.
Нахождение в природе.
В природе образуется при разложении азотсодержащих органических соединений.
Резкий запах аммиака известен человеку с доисторических времен, так как этот газ образуется в значительных количествах при гниении, разложении и сухой перегонке содержащих азот органических соединений, например мочевины или белков. Не исключено, что на ранних стадиях эволюции Земли в ее атмосфере было довольно много аммиака. Однако и сейчас ничтожные количества этого газа всегда можно обнаружить в воздухе и в дождевой воде, поскольку он непрерывно образуется при разложении животных и растительных белков.
Антропогенные источники поступления в окружающую среду.
Основными источниками выделения аммиака являются азотнотуковые комбинаты, предприятия по производству азотной кислоты и солей аммония, холодильные установки, коксохимические заводы и животноводческие фермы. В районах техногенного загрязнения концентрации аммиака достигают величин 0,015-0,057 мг/м3, в контрольных районах – 0,003-0,005 мг/м3.
Влияние на организм человека.
Этот газ токсичен. Человек способен почувствовать запах аммиака в воздухе уже в ничтожной концентрации – 0,0005 мг/л, когда еще нет большой опасности для здоровья. При повышении концентрации в 100 раз (до 0,05 мг/л) проявляется раздражающее действие аммиака на слизистую оболочку глаз и верхних дыхательных путей, возможна даже рефлекторная остановка дыхания. Концентрацию 0,25 мг/л с трудом выдерживает в течение часа даже очень здоровый человек. Еще более высокие концентрации вызывают химические ожоги глаз и дыхательных путей и становятся опасными для жизни. Внешние признаки отравления аммиаком могут быть весьма необычными. У пострадавших, например, резко снижается слуховой порог: даже не слишком громкие звуки становятся невыносимы и могут вызвать судороги. Отравление аммиаком вызывает также сильное возбуждение, вплоть до буйного бреда, а последствия могут быть весьма тяжелыми – до снижения интеллекта и изменения личности. Очевидно, аммиак способен поражать жизненно важные центры, так что при работе с ним надо тщательно соблюдать меры предосторожности.
При повышении концентрации в 100 раз (до 0,05 мг/л) проявляется раздражающее действие аммиака на слизистую оболочку глаз и верхних дыхательных путей, возможна даже рефлекторная остановка дыхания. Концентрацию 0,25 мг/л с трудом выдерживает в течение часа даже очень здоровый человек. Еще более высокие концентрации вызывают химические ожоги глаз и дыхательных путей и становятся опасными для жизни. Внешние признаки отравления аммиаком могут быть весьма необычными. У пострадавших, например, резко снижается слуховой порог: даже не слишком громкие звуки становятся невыносимы и могут вызвать судороги. Отравление аммиаком вызывает также сильное возбуждение, вплоть до буйного бреда, а последствия могут быть весьма тяжелыми – до снижения интеллекта и изменения личности. Очевидно, аммиак способен поражать жизненно важные центры, так что при работе с ним надо тщательно соблюдать меры предосторожности.
Хроническое воздействие сублетальных доз аммиака приводит к вегетативным расстройствам, повышению возбудимости парасимпатического отдела нервной системы, жалобы на слабость, недомогание, насморк, кашель, боли в груди.
Класс опасности вещества – 4.
«назад»
Принцип действия: | Перекрестная модуляция, хемилюминесценция. |
Применение: | Измерение концентрации NО, NO2, NOx в атмосферном воздухе |
Стандартные диапазоны: | 0…0,1/0,2/0,5/1 млн-1; 4 дополнительных диапазона, переключаемых в пределах 0-10 млн-1 при условии десятикратного отношения границ. Предусмотрено автоматическое и ручное определение диапазонов, а также дистанционное управле-ние. |
Предел обнаружения: | 0,5 ppb (3 σ) |
Воспроизводимость: | ±1% от полной шкалы прибора. |
Линейность: | ±1% от полной шкалы прибора. |
Дрейф нуля: | < порога чувствительности в день на нижнем диапазоне. |
Дрейф шкалы: | < порога чувствительности в день на нижнем диапазоне. |
Время отклика (Т90): | В пределах 90 с на нижнем диапазоне. |
Скорость потока образца газа: | 0,8 л/мин |
Показания: | Измеренное значение, диапазон, сигнализация. |
Cигнализация: | автокалибровки, ошибка калибровки и т.п. |
Входные/выходные сигналы: | 0-1 В/0-10 В/4-20 мА. Возможен вывод зна чений моментальных и интегральных, либо скользящего среднего. |
Интерфейс ввода/вывода: | RS-232C |
Температура эксплуатации: | 5…40°С |
Напряжение питания: | 220В, 50/60 Гц |
Габариты: | 430 (Ш) х 550 (Г) х 221 (В) мм |
Масса: | 21 кг |
|
|
| Органические соединения | |||
| 1-метоксипропан-2-ол альфа-метиловый эфир пропиленгликоля | |||
| 1-этоксипропан-2-ол пропиленгликоль альфа-этиловый эфир, 1-0-этилпропиленгликоль | |||
| 2-феноксиэтанол фенилцеллозольв, этиленгликоля монофениловый эфир | |||
| 2-хлорэтанол этиленхлоргидрин | |||
| 2-этилгексан-1-ол | |||
| 2-этоксиэтиловый эфир уксусной кислоты 2-этоксиэтилацетат | |||
| N,N-диметилацетамид диметиламид уксусной кислоты | |||
| Акриламид | |||
| Акрилонитрил цианистый винил, винилоцианид, проп-2-енонитрил | |||
| Акролеин пропеналь | |||
| Аллиловый спирт пропен-2-ол-1 | |||
| Альфа-метилстирол изопренилбензол | |||
| Амиловый спирт пентановый спирт, пентанол | |||
| Аминофенол | |||
| Анилин аминобензол, фениламин | |||
| Ацетальдегид уксусный альдегид, этаналь, метилформальдегид | |||
| Ацетилен этин | |||
| Ацетон диметилкетон, пропан-2-он, пропанон-2 | |||
| Бенз(а)пирен | |||
| Бензальдегид | |||
| бензилкарбинол бензиловый спирт | |||
| Бензол | |||
| Бромдихлорметан | |||
| Бромоформ трибромметан | |||
| Бута-1,3-диен дивинил, бутадиен-1,3 | |||
| Бутан | |||
| Бутены | |||
| Бутилакрилат | |||
| Бутилацетат | |||
| Бутилкарбитол 2-(2-бутоксиэтокси)этанол, бутилдигликоль | |||
| Бутиловый спирт бутанол-1, бутан-1-ол | |||
| Бутилцеллозольв 2-бутоксиэтанол | |||
| Валериановая кислота пентановая кислота | |||
| Ванилин 4-гидрокси-3-метоксибензальдегид | |||
| Винилацетат | |||
| Гексан | |||
| Гексан-1-ол | |||
| Гексен | |||
| Гептан | |||
| Гептен | |||
| Гидразин | |||
| Декан | |||
| Дибромхлорметан | |||
| Диизопропиловый эфир изопропиловый эфир, 2-изопропоксипропан | |||
| Диметиламин | |||
| Диметиланилин | |||
| Диметилсульфид | |||
| Диметилсульфоксид | |||
| Диметилформамид | |||
| Дихлорметан | |||
| Дихлорэтан | |||
| Диэтиламин | |||
| Дурол 1,2,4,5-тетраметилбензол | |||
| Изоамиловый спирт | |||
| Изобутилацетат изобутиловый эфир уксусной кислоты | |||
| Изобутиловый спирт изобутанол | |||
| Изооктиловый спирт | |||
| Изопрен 2-метилбета-1,3-диен | |||
| Изопропилацетат 1-метилэтилацетат | |||
| Изопропилбензол | |||
| Изопропиловый спирт изопропанол | |||
| Изопропилцеллозольв 2-(1-метилэтокси)этанол | |||
| Изофорон | |||
| Капролактам гексагидро-2H-азепин-2-он | |||
| Капроновая кислота гексановая кислота | |||
| Карбамид мочевина | |||
| Крезолы (мета-; орто-; пара-) метилфенолы, гидрокситолуолы | |||
| Ксилолы (орто-; мета-; пара-) диметилбензол | |||
| Масляная кислота бутановая кислота | |||
| Мезитилен 1,3,5-триметилбензол | |||
| Меркаптаны метантиол, этантиол, пропантиол, метилмеркаптан, этилмеркаптан, пропилмеркаптан | |||
| Метакриламид | |||
| Метан | |||
| метил-2-пирролидон | |||
| Метилакрилат | |||
| Метиланилин | |||
| Метилацетат | |||
| Метилбутаноат | |||
| Метилбутилкетон 2-гексанон, бутилметилкетон | |||
| Метилизобутилкетон 4-метилпентан-2-он | |||
| Метилмеркаптан метантиол | |||
| Метилметакрилат | |||
| Метиловый спирт метанол | |||
| Метилпропионат | |||
| Метил-трет-бутиловый эфир | |||
| Метилцеллозольв 2-метоксиэтанол | |||
| Метилциклогексан | |||
| Метилэтилкетон бутанон | |||
| Моноэтаноламин | |||
| Муравьиная кислота метановая кислота | |||
| Нафталин | |||
| Н-бутилацетат | |||
| Н-бутилбензол | |||
| Нитроанилин (пара-; орто) | |||
| Нонан | |||
| Окись этилена этиленоксид, оксиран, 1,2-эпоксиэтан | |||
| Оксидибензол дифениловый эфир | |||
| Октан | |||
| Октан-1-ол октиловый спирт, октанол-1 | |||
| Октен | |||
| Пентан | |||
| пентилацетат н-амилацетат | |||
| Перхлорэтилен тетрахлорэтилен | |||
| Пиридин | |||
| Пропан | |||
| Пропаналь пропионовый альдегид | |||
| Пропилацетат | |||
| Пропилбензол | |||
| Пропилен пропен | |||
| Пропиленгликоль пропан-1,2-диол | |||
| Пропиловый спирт | |||
| Пропионовая кислота | |||
| Псевдокумол 1,2,4-триметилбензол | |||
| Сероуглерод | |||
| Стирол винилбензол, этиленбензол | |||
| Терефталевая кислота 1,4-бензолдикарбоновая кислота | |||
| Тетрагидрофуран | |||
| Толуол метилбензол | |||
| Трихлорэтилен | |||
| Уксусная кислота этановая кислота | |||
| Фенол гидроксибензол | |||
| Формальдегид метаналь | |||
| Фуран | |||
| Фурфуриловый спирт 2 фурилметанол, альфафуранкарбинол | |||
| Фурфурол 2-фуранкарбальдегид, фурфураль | |||
| Хлорбензол | |||
| Хлорвинил винилхлорид, хлористый винил, этиленхлорид, хлористый этилен | |||
| Хлористый метил хлорметан, метилхлорид | |||
| Хлоропрен хлорбутадиен, 2-хлор-1,3-бутадиен | |||
| Хлороформ трихлорметан | |||
| Циклогексан | |||
| Циклогексанол | |||
| Циклогексанон | |||
| Четыреххлористый углерод тетрахлорметан | |||
| Эпихлоргидрин хлорметилоксиран | |||
| Этан | |||
| Этанол | |||
| Этиламин | |||
| Этилацетат | |||
| Этилбензол | |||
| Этилбутаноат | |||
| Этилен этен | |||
| Этиленгликоль этан-1,2-диол | |||
| Этилмеркаптан этантиол | |||
| Этиловый эфир диэтиловый эфир | |||
| Этилпропионат | |||
| Этилформиат | |||
| Этилхлорид хлорэтан | |||
| Этилцеллозольв 2-этоксиэтанол, моноэтиловый эфир этиленгликоля | |||
Структура ИрНИТУ
Д-301 Лаборатория аналитической химии
Оборудование лаборатории:
Акводистилятор эл. АЭ 10-МО, блок -ИМТ-5, муфельная печь, сушильный шкаф, Электроплитка 2-х конфорочная мечта-4м.
АЭ 10-МО, блок -ИМТ-5, муфельная печь, сушильный шкаф, Электроплитка 2-х конфорочная мечта-4м.
Фактический адрес:
г. Иркутск, ул. Лермонтова, 83 ИрГТУ, ауд. Д-301
Оборудование лаборатории:
Блок питания выпрямитель, Кондуктометр «Эксперт», Колориметр КФК-2, Магнитная мешалка, Потенциометр Р-307, Рефрактометр ИРФ-471, Ультратермостат, Шкаф вытяжной 1500 ШВ-2 «Квадро», Эл. плита, Весы торсионные типа ВТ до 500 мг.
Фактический адрес:
г. Иркутск, ул. Лермонтова, 83 ИрГТУ, ауд. Д-301а
Оборудование лаборатории:
Иономер ЭВ-74, Лабораторный комплекс «Химия под управлением с ПК», Прибор универсальный 4383, Сушильный шкаф СНОЛ, Ультратермостат ИТИ-2, Фотоколориметр КФК-3, Акводистилятор, Плитка электрическая «Мечта -20», Шкаф вытяжной 1500 ШВ-2 «Квадро»
Фактический адрес:
г. Иркутск, ул. Лермонтова, 83 ИрГТУ, ауд. Д-308
Оборудование лаборатории:
Прибор для определения молярной массы эквивалентов цинка, атмосферный манометр, атмосферный термометр, калориметр для определения теплоты реакции нейтрализации, прибор для изучения химического равновесия, состоящий из двух совмещенных шаров, заполненных смесью оксида азота (IV) и его димера, прибор для изучения электролиза растворов солей, установка для титриметрического определения жесткости воды.
Фактический адрес:
г. Иркутск, ул. Лермонтова, 83 ИрГТУ, ауд. Д-201
Оборудование лаборатории:
Прибор для определения молярной массы эквивалентов цинка, атмосферный манометр, атмосферный термометр, калориметр для определения теплоты реакции нейтрализации, прибор для изучения химического равновесия, состоящий из двух совмещенных шаров, заполненных смесью оксида азота (IV) и его димера, прибор для изучения электролиза растворов солей, установка для титриметрического определения жесткости воды.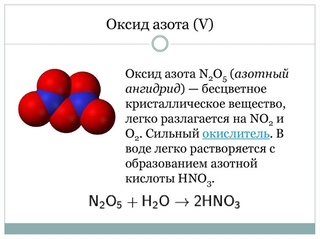
Фактический адрес:
г. Иркутск, ул. Лермонтова, 83 ИрГТУ, ауд. Д-202
Оборудование лаборатории:
Прибор для определения молярной массы эквивалентов цинка, атмосферный манометр, атмосферный термометр, калориметр для определения теплоты реакции нейтрализации, прибор для изучения химического равновесия, состоящий из двух совмещенных шаров, заполненных смесью оксида азота (IV) и его димера, прибор для изучения электролиза растворов солей, установка для титриметрического определения жесткости воды.
Фактический адрес:
г. Иркутск, ул. Лермонтова, 83 ИрГТУ, ауд. Д-207
В Тамбовской области исследовано 390 проб на санитарно-химические показатели атмосферного воздуха
Специалисты Роспотебнадзора по Тамбовской области ежеквартально проводят мониторинг состояния атмосферного воздуха на автомагистралях и наиболее нагруженных перекрестках городов региона. Такая работа позволяет своевременно выявлять факты превышения предельно допустимого уровня вредных выбросов в атмосферу от автотранспорта. Во втором квартале 2019 года было исследовано 390 проб на санитарно-химические показатели в зонах влияния автотранспорта.
Исследования проводились в городах Тамбов, Рассказово, Моршанск, Уварово, Мичуринск. Специалисты брали пробы на оксид углерода, формальдегид, диоксид азота, диоксид серы, взвешенные вещества, пыль, свинец, аммиак.
Незначительное превышение предельно допустимой концентрации загрязняющего вещества (оксида углерода) было выявлено всего в одном исследовании в Тамбове.
В городах Рассказово, Моршанск, Уварово, Мичуринск превышений предельно допустимых концентраций загрязняющих веществ не выявлено ни по одному из исследуемых компонентов.
Напомним, что по итогам 2018 года в регионе отмечено снижение общего количества загрязняющих атмосферу веществ от всех источников выбросов. Основную их часть по-прежнему составляют выбросы от передвижных источников загрязнения атмосферы (включая ж/д транспорт). При этом в 2018 году количество зарегистрированных автотранспортных средств (без учета мототранспортных) увеличилось по сравнению с предыдущим годом на 2,2 процента.
Для снижения общего объема выбросов загрязняющих веществ автомобильным транспортом в Тамбовской области реализуется проект по расширению потребления на автомобильном транспорте компримированного природного газа в качестве моторного топлива.
В 2018 году в муниципальное транспортное предприятие города Тамбова поступило 6 новых автобусов на газомоторном топливе, соответствующих современным стандартам экологии. Всего в Тамбовской области на данный момент работает 65 таких автобусов. В 2019 году парк пассажирской техники планируется пополнить еще 15 газомоторными автобусами.
Наталия Парамонова
Управление информационной политики департамента общественных связей и информационной политики аппарата главы администрации Тамбовской области
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.
Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.

- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
оксидов азота | UCAR Center for Science Education
Оксид азота (NO) и диоксид азота (NO 2 ) — два газа, молекулы которых состоят из атомов азота и кислорода. Эти оксиды азота вносят свой вклад в проблему загрязнения воздуха, играя роль в образовании как смога, так и кислотных дождей. Они выбрасываются в атмосферу Земли как из естественных, так и из антропогенных источников.
Оксид азота — бесцветный горючий газ с легким запахом. Двуокись азота — это темно-красно-оранжевый газ, который ядовит, но не воспламеняется.Он вместе с аэрозолями отвечает за красновато-коричневый цвет смога. В высоких концентрациях он очень токсичен и может вызвать серьезное повреждение легких. Двуокись азота является сильным окислителем и поэтому очень реагирует с другими соединениями.
Источники оксидов азота
По оценкам ученых, природа ежегодно производит от 20 до 90 миллионов тонн оксидов азота на Земле. Природные источники включают вулканы, океаны, биологический распад и удары молний. В результате деятельности человека в нашу атмосферу ежегодно попадает еще 24 миллиона тонн оксидов азота.
Четыре представления химики используют для диоксида азота (NO 2 ).
Кредит: UCAR (Рэнди Рассел)
И NO, и NO 2 образуются во время высокотемпературного горения в атмосфере, когда кислород соединяется с азотом. Выхлопные газы легковых и грузовых автомобилей являются основными источниками оксидов азота, как и выбросы электростанций. Выхлопные газы автомобилей содержат больше NO, чем NO 2 , но как только NO выбрасывается в атмосферу, он быстро соединяется с кислородом воздуха с образованием NO 2 .
Окиси азота как загрязнители
Оксиды азота, по крайней мере, частично ответственны за несколько типов загрязнения воздуха. Двуокись азота придает свой цвет красновато-коричневой дымке, которую мы называем смогом. Фотодиссоциация диоксида азота под действием солнечного света производит оксид азота и озон в тропосфере, который является еще одним компонентом смога. Ряд химических реакций превращает летучие органические соединения (ЛОС) в вещества, которые соединяются с диоксидом азота с образованием ПАН (пероксиацитилнитрата), еще одного элемента в смоге.Двуокись азота в воздухе также вступает в реакцию с водяным паром с образованием азотной кислоты, одного из типов кислот в кислотных дождях.
Ряд химических реакций превращает летучие органические соединения (ЛОС) в вещества, которые соединяются с диоксидом азота с образованием ПАН (пероксиацитилнитрата), еще одного элемента в смоге.Двуокись азота в воздухе также вступает в реакцию с водяным паром с образованием азотной кислоты, одного из типов кислот в кислотных дождях.
Концентрация диоксида азота в незагрязненном воздухе составляет около 10 частей на миллиард (ppb). В смоге концентрация повышается в двадцать раз до примерно 200 частей на миллиард.
Использование оксидов азота
Хотя оксиды азота получили сомнительное признание в качестве загрязнителей, они также с успехом используются в некоторых промышленных процессах. Оксид азота производится в больших масштабах и впоследствии используется для производства азотной кислоты (HNO 3 ).Чтобы создать оксид азота для промышленного использования, химики объединяют аммиак (NH 3 ) с кислородом (O 2 ), выделяя воду (H 2 O) в качестве побочного продукта. Соединения азота, полученные из азотной кислоты, используются для создания химических удобрений, взрывчатых веществ и других полезных веществ.
Индикаторы изменения климата: атмосферные концентрации парниковых газов | Показатели изменения климата в США
Техническая документация
Список литературы
1. IPCC (Межправительственная группа экспертов по изменению климата). 2013. Изменение климата 2013: основы физических наук. Вклад Рабочей группы I в Пятый оценочный доклад МГЭИК. Кембридж, Соединенное Королевство: Издательство Кембриджского университета. www.ipcc.ch/report/ar5/wg1.
2. IPCC (Межправительственная группа экспертов по изменению климата). 2013. Изменение климата 2013: основы физических наук. Вклад Рабочей группы I в Пятый оценочный доклад МГЭИК. Кембридж, Соединенное Королевство: Издательство Кембриджского университета.www.ipcc.ch/report/ar5/wg1.
3. IPCC (Межправительственная группа экспертов по изменению климата). 2013. Изменение климата 2013: основы физических наук. Вклад Рабочей группы I в Пятый оценочный доклад МГЭИК. Кембридж, Соединенное Королевство: Издательство Кембриджского университета. www.ipcc.ch/report/ar5/wg1.
4. IPCC (Межправительственная группа экспертов по изменению климата). 2013. Изменение климата 2013: основы физических наук. Вклад Рабочей группы I в Пятый оценочный доклад МГЭИК.Кембридж, Соединенное Королевство: Издательство Кембриджского университета. www.ipcc.ch/report/ar5/wg1.
5. [см. Полный список ниже]
6. [см. Полный список ниже]
7. [см. Полный список ниже]
8. AGAGE (Расширенный глобальный эксперимент по атмосферным газам). 2016. База данных ALE / GAGE / AGAGE. По состоянию на июнь 2016 г. http://agage.mit.edu/.
9. Rigby, M. Обновление данных, первоначально опубликованных в: Arnold, T., C.M., 2016 г. Harth, J. Mühle, A.J. Мэннинг, П. Саламе, Дж. Ким, Д.Дж. Айви, Л.П. Стил, В.В. Петренко, Ю.П. Северингхаус, Д. Баггенстос, Р.Ф. Вайс. 2013. Глобальные выбросы трифторида азота, оцененные на основе обновленных атмосферных измерений. P. Natl. Акад. Sci. США 110 (6): 2029–2034. Данные обновлены в июле 2016 года.
10. NOAA (Национальное управление океанических и атмосферных исследований). 2016. Группа «Галоуглероды и другие микробы в атмосфере» (HATS).По состоянию на июнь 2016 г. www.esrl.noaa.gov/gmd/hats.
11. НАСА (Национальное управление по аэронавтике и исследованию космического пространства). 2013. Данные — информационные продукты TOMS / SBUV TOR. По состоянию на ноябрь 2013 г. http://science.larc.nasa.gov/TOR/data.html.
12. НАСА (Национальное управление по аэронавтике и исследованию космического пространства). 2015. Данные по тропосферному озону от AURA OMI / MLS. По состоянию на май 2015 г. http://acdb-ext.gsfc.nasa.gov/Data_services/cloud_slice/new_data.html.
НАСА (Национальное управление по аэронавтике и исследованию космического пространства). 2015. Данные по тропосферному озону от AURA OMI / MLS. По состоянию на май 2015 г. http://acdb-ext.gsfc.nasa.gov/Data_services/cloud_slice/new_data.html.
13. НАСА (Национальное управление по аэронавтике и исследованию космического пространства). 2016. Объединенный набор данных по озону SBUV (MOD). Версия 8.6. По состоянию на март 2016 г. http://acdb-ext.gsfc.nasa.gov/Data_services/merged/index.html.
14. МГЭИК (Межправительственная группа экспертов по изменению климата). 2013. Изменение климата 2013: основы физических наук. Вклад Рабочей группы I в Пятый оценочный доклад МГЭИК. Кембридж, Соединенное Королевство: Издательство Кембриджского университета. www.ipcc.ch/report/ar5/wg1.
Концентрации парниковых газов в атмосфере: цитаты для рисунков 1, 2 и 3
Рисунок 1
EPICA Dome C и станция Восток, Антарктида: приблизительно с 796 562 г. до н.э. по 1813 г. н.э.
Lüthi, D., M. Le Floch, B. Bereiter, T. Blunier, J.-M. Barnola, U. Siegenthaler, D. Raynaud, J. Jouzel, H. Fischer, K. Kawamura, T.F. Stocker. 2008. Рекорд концентрации углекислого газа с высоким разрешением 650 000–800 000 лет назад. Природа 453: 379–382. www.ncdc.noaa.gov/paleo/pubs/luethi2008/luethi2008.html.
Лоу Доум, Антарктида, 75-летнее сглаживание: приблизительно с 1010 г. н.э. до 1975 г. н.э.
Этеридж, Д.М., Л.П. Стил, Р.Л. Лангенфельдс, Р.Дж. Фрэнси, Ж.-М.Барнола, В.И. Морган. 1998. Исторический CO 2 записей из ледяных кернов Law Dome DE08, DE08-2 и DSS. В: Тенденции: сборник данных о глобальных изменениях. Ок-Ридж, Теннесси: Министерство энергетики США. По состоянию на 14 сентября 2005 г. http://cdiac.ornl.gov/trends/co2/lawdome.html.
Станция Сипле, Антарктида: приблизительно с 1744 г. по 1953 г.
по 1953 г.
Нефтель, А., Х. Фридли, Э. Моор, Х. Летчер, Х. Эшгер, У. Зигенталер и Б. Штауфер. 1994. Историческая запись содержания углекислого газа в ледяном керне станции Сипле.В: Тенденции: сборник данных о глобальных изменениях. Ок-Ридж, Теннесси: Министерство энергетики США. По состоянию на 14 сентября 2005 г. http://cdiac.ornl.gov/trends/co2/siple.html.
Мауна-Лоа, Гавайи: с 1959 г. до н.э. 2015 г.
NOAA (Национальное управление океанических и атмосферных исследований). 2016. Среднегодовые концентрации углекислого газа для Мауна-Лоа, Гавайи. По состоянию на 14 апреля 2016 г. ftp://ftp.cmdl.noaa.gov/products/trends/co2/co2_annmean_mlo.txt.
Барроу, Аляска: 1974 г. — CE 2014 г.
Мыс Мататула, Американское Самоа: 1976 г. — 2014 CE
Южный полюс, Антарктика: 1976 г. — CE 2014 г.
NOAA (Национальное управление океанических и атмосферных исследований).2016. Среднемесячные концентрации углекислого газа для Барроу, Аляска; Мыс Мататула, Американское Самоа; и Южный полюс. По состоянию на 14 апреля 2016 г. ftp://ftp.cmdl.noaa.gov/data/trace_gases/co2/in-situ/surface.
Мыс Грим, Австралия: с 1992 г. по н.э. в 2006 г.
Шетландские острова, Шотландия: с 1993 г. по н.э. в 2002 г.
Steele, L.P., P.B. Круммель и Р.Л.Лангенфельдс. 2007. Концентрации CO в атмосфере 2 (ppmv) получены из проб воздуха в колбах, собранных на мысе Грим, Австралия, и на Шетландских островах, Шотландия.Организация Содружества научных и промышленных исследований. По состоянию на 20 января 2009 г. http://cdiac.esd.ornl.gov/ftp/trends/co2/csiro.
Остров Лампедуза, Италия: с 1993 г. по 2000 г. н.э.
Шамар, П., Л. Чиаталья, А. ди Сарра и Ф. Монтелеоне. 2001. Запись содержания углекислого газа в атмосфере по измерениям в колбах на острове Лампедуза. В: Тенденции: сборник данных о глобальных изменениях. Ок-Ридж, Теннесси: Министерство энергетики США. По состоянию на 14 сентября 2005 г. http: // cdiac.ornl.gov/trends/co2/lampis.html.
Ок-Ридж, Теннесси: Министерство энергетики США. По состоянию на 14 сентября 2005 г. http: // cdiac.ornl.gov/trends/co2/lampis.html.
Рисунок 2
EPICA Dome C, Антарктида: приблизительно с 797 446 до н.э. до 1937 г. н.э.
Лоулерг, Л., А. Шилт, Р. Спани, В. Массон-Дельмотт, Т. Блунье, Б. Лемье, Ж.-М. Барнола, Д. Рейно, Т.Ф. Stocker, J. Chappellaz. 2008. Орбитальные и тысячелетние особенности атмосферного CH 4 за последние 800 000 лет. Природа 453: 383–386. www.ncdc.noaa.gov/paleo/pubs/loulergue2008/loulergue2008.html.
Лоу Доум, Антарктида: приблизительно с 1008 г. по 1980 г. н.э.
Этеридж, Д.М., Л.П. Стил, Р.Дж. Фрэнси и Р.Л.Лангенфельдс. 2002. Исторические записи CH 4 из кернов льда Антарктики и Гренландии, данные антарктического фирна и архивные пробы воздуха с мыса Грим, Тасмания. В: Тенденции: сборник данных о глобальных изменениях. Ок-Ридж, Теннесси: Министерство энергетики США. По состоянию на 13 сентября 2005 г. http://cdiac.ornl.gov/trends/atm_meth/lawdome_meth.html.
Кейп-Грим, Австралия: с 1985 г. по 2015 г. по н.э.
NOAA (Национальное управление океанических и атмосферных исследований).2016. Среднемесячные концентрации CH 4 для мыса Грим, Австралия. По состоянию на 16 июля 2016 г. ftp://ftp.cmdl.noaa.gov/data/trace_gases/ch5/flask/surface/ch5_cgo_surface-flask_1_ccgg_month.txt.
Мауна-Лоа, Гавайи: 1984–2015 гг.
NOAA (Национальное управление океанических и атмосферных исследований). 2016. Среднемесячные концентрации CH 4 для Мауна-Лоа, Гавайи. По состоянию на 16 июля 2016 г. ftp://ftp.cmdl.noaa.gov/data/trace_gases/ch5/flask/surface/ch5_mlo_surface-flask_1_ccgg_month.текст.
Шетландские острова, Шотландия: с 1993 г. по н.э. в 2001 г.
Steele, L.P., P.B. Круммель и Р.Л.Лангенфельдс. 2002. Запись метана в атмосфере с Шетландских островов, Шотландия (версия от октября 2002 г. ). В: Тенденции: сборник данных о глобальных изменениях. Ок-Ридж, Теннесси: Министерство энергетики США. По состоянию на 13 сентября 2005 г. http://cdiac.esd.ornl.gov/trends/atm_meth/csiro/csiro-shetlandch5.html.
). В: Тенденции: сборник данных о глобальных изменениях. Ок-Ридж, Теннесси: Министерство энергетики США. По состоянию на 13 сентября 2005 г. http://cdiac.esd.ornl.gov/trends/atm_meth/csiro/csiro-shetlandch5.html.
Рисунок 3
EPICA Dome C, Антарктида: приблизительно 796475 г. до н.э. — 1937 г. н.э.
Schilt, A., М. Баумгартнер, Т. Блунье, Дж. Швандер, Р. Спани, Х. Фишер и Т.Ф. Stocker. 2010. Изменения концентрации закиси азота в атмосфере в ледниково-межледниковом и тысячелетнем масштабе за последние 800 000 лет. Quaternary Sci. Откровение 29: 182–192. ftp://ftp.ncdc.noaa.gov/pub/data/paleo/icecore/antarctica/epica_domec/edc-n2o-2010-800k.txt.
Антарктида: приблизительно с 1903 г. по 1976 г. н.э.
Батл, М., М. Бендер, Т. Сауэрс, П. Танс, Дж. Батлер, Дж. Элкинс, Дж.Эллис, Т. Конвей, Н. Чжан, П. Ланг и А. Кларк. 1996. Концентрации атмосферных газов за последнее столетие, измеренные в воздухе фирном на Южном полюсе. Природа 383: 231–235. ftp://daac.ornl.gov/data/global_climate/global_N_cycle/data/global_N_perturbations.txt.
Кейп-Грим, Австралия: с 1979 г. по 2013 г. до н.э.
AGAGE (Расширенный эксперимент по глобальным атмосферным газам). 2015 г. Среднемесячные концентрации N 2 O для мыса Грим, Австралия. По состоянию на 5 июня 2015 г.http://ds.data.jma.go.jp/gmd/wdcgg/cgi-bin/wdcgg/catalogue.cgi.
Южный полюс, Антарктида: с 1998 г. по н.э. по 2015 г. по н.э.
Барроу, Аляска: с 1999 г. по 2015 г. 2016. Среднемесячные концентрации N 2 O для Барроу, Аляска; Мауна-Лоа, Гавайи; и Южный полюс. По состоянию на 8 июня 2016 г. www.esrl.noaa.gov/gmd/hats/insitu/cats/cats_conc.html.
оксидов азота (NOx) | Система информации о загрязнении воздуха
Источники
Оксиды азота образуются в процессах горения, частично из соединений азота в топливе, но в основном в результате прямого сочетания атмосферного кислорода и азота в пламени. Окислы азота образуются естественным путем при молнии, а также, в небольшой степени, в результате микробных процессов в почве.
Окислы азота образуются естественным путем при молнии, а также, в небольшой степени, в результате микробных процессов в почве.
Источники и тенденции выбросов
Антропогенные выбросы оксидов азота преобладают в общем объеме выбросов в Европе, при этом выбросы в Великобритании составляют около двух.2 миллиона тонн NO 2 каждый год. Из них около четверти приходится на электростанции, половина — на автомобили, а остальная часть — на другие промышленные и бытовые процессы сжигания. В отличие от выбросов диоксида серы, выбросы оксидов азота в Великобритании снижаются только медленно, поскольку стратегии контроля выбросов для стационарных и мобильных источников компенсируются увеличением количества дорожных транспортных средств.
Выбросы от производства электроэнергии — Выбросы NOx от производства электроэнергии довольно постоянны с 1970 года по 1990 год.В начале 1990-х годов рост использования газа в производстве электроэнергии вытеснил уголь и нефть (DECC, 2009). Более чистое топливо и более современные электростанции привели к значительному сокращению выбросов NOx в этом секторе до 2000 года. С 2000 года абсолютный уровень газа, используемого для производства электроэнергии, оставался довольно постоянным, а повышенный спрос удовлетворялся угольными электростанциями. С 2006 года использование угля (и общее количество топлива, используемого для производства электроэнергии) существенно сократилось (DECC, 2009).
Выбросы NOx от автомобильного транспорта — сектор автомобильного транспорта внес значительный вклад в тенденцию к снижению выбросов в Великобритании. Выбросы от автомобильного транспорта в настоящее время вносят наибольший вклад в общий объем выбросов в Великобритании, составляя около 33% в 2010 году (Defra, 2011). Первые бензиновые автомобили с трехкомпонентным катализатором были представлены в 1992 году, что привело к значительному сокращению выбросов NOx. Пределы выбросов для дизельных автомобилей и легких грузовых автомобилей вступили в силу в 1993/94 году. Ограничения на выбросы от грузовых автомобилей (HGV) впервые вступили в силу в 1988 году, что привело к постепенному снижению уровня выбросов по мере появления в парке новых грузовых автомобилей. Введение этих стандартов оказало существенное влияние на выбросы NOx в секторе автомобильного транспорта по сравнению с 1990-ми годами (RoTAP, 2012).
Ограничения на выбросы от грузовых автомобилей (HGV) впервые вступили в силу в 1988 году, что привело к постепенному снижению уровня выбросов по мере появления в парке новых грузовых автомобилей. Введение этих стандартов оказало существенное влияние на выбросы NOx в секторе автомобильного транспорта по сравнению с 1990-ми годами (RoTAP, 2012).
Дополнительную информацию и данные о выбросах можно найти по адресу: http://naei.defra.gov.uk/overview/pollutants?pollutant_id=6
Химия атмосферы и перенос
Основным загрязняющим веществом, непосредственно выбрасываемым в атмосферу, является оксид азота. (NO) вместе с небольшой долей диоксида азота (NO 2 ).NO окисляется озоном в атмосфере в течение десятков минут с образованием NO 2 . В сельском воздухе, вдали от источников NO, большая часть оксидов азота в атмосфере находится в форме NO 2 . NO и NO2 в совокупности известны как NO x , потому что они быстро преобразуются в течение дня. NO 2 расщепляется УФ-светом с образованием NO и атома O, который соединяется с молекулярным кислородом (O 2 ) с образованием озона (O 3 ). Следовательно, в течение дня NO, NO 2 и озон находятся в квазиравновесии, которое зависит от количества солнечного света.В конечном итоге NO 2 окисляется до азотной кислоты (HNO 3 , пар), которая поглощается непосредственно землей, превращается в нитратсодержащие частицы или растворяется в облачных каплях. Ночью различные процессы окисления превращают NO 2 в нитраты.
Хотя азотная кислота быстро абсорбируется при контакте с поверхностями (облачными каплями, почвой или растительностью), другие оксиды азота удаляются довольно медленно и могут перемещаться на многие сотни километров, прежде чем они в конечном итоге превратятся в азотную кислоту или нитраты.Следовательно, выбросы в одной стране будут депонированы в других. Великобритания экспортирует около трех четвертей своих выбросов NO X (RoTAP, 2012).
Измеренные концентрации NO 2 показывают преобладание транспортных потоков и городских источников с наибольшими концентрациями в крупных городах и прилегающих к сети автомагистралей, со среднегодовыми концентрациями, превышающими 10 частей на миллиард в этих областях.
Воздействие на экосистему
Вероятно, что наибольшее влияние выбросов оксидов азота на территории Великобритании обусловлено их вкладом в общее осаждение азота.Однако прямое воздействие газообразных оксидов азота также может быть важным, особенно в районах, близких к источникам (например, на обочинах дорог). Критический уровень воздействия NOx для всех типов растительности установлен на уровне 30 мкг / м 3 . Экспериментальные данные свидетельствуют о том, что умеренные концентрации NOx могут вызывать как положительную, так и отрицательную реакцию роста, при этом очень важна возможность синергетического взаимодействия с диоксидом серы (SO 2 ). Имеются веские доказательства того, что эффекты NO 2 с большей вероятностью будут отрицательными в присутствии эквивалентных концентраций SO 2 .В то же время отношение SO 2 к NO 2 значительно снизилось в городских районах Великобритании за последние 30 лет.
Одним из важных эффектов NOx может быть его влияние на популяции насекомых; есть данные об улучшении показателей насекомых-вредителей на растениях, выращиваемых при умеренных концентрациях NO 2 и SO 2 (Dohmen et al., 1984)
Оксиды азота также являются одним из предшественников фотохимического образования озона (см. озон обзор информации о воздействии озона).
Атмосферное окисление: тропики, Арктика, море
Мои исследования в области химического окисления были сосредоточены на окислении химических веществ, выделяемых деревьями и водорослями, а также на понимании переноса загрязнения в Арктику.
Окисление в тропиках
Как летучие органические соединения (ЛОС) окисляются в тропиках?
По оценкам, на тропические леса в мире приходится почти половина всех биогенных выбросов ЛОС в атмосферу. Самый эффективный окислитель в атмосфере и главный путь разрушения ЛОС — это гидроксильный (ОН) радикал. Образовавшийся из продуктов фотолиза озона, реагирующего с водяным паром, ОН быстро реагирует с монооксидом углерода (СО) с образованием гидроперокси-радикала (НО2), который сам быстро реагирует с оксидом азота (NO) с преобразованием ОН. Измерение OH и HO2, хотя и является весьма сложной задачей, позволяет понять окислительную способность атмосферы.
Самый эффективный окислитель в атмосфере и главный путь разрушения ЛОС — это гидроксильный (ОН) радикал. Образовавшийся из продуктов фотолиза озона, реагирующего с водяным паром, ОН быстро реагирует с монооксидом углерода (СО) с образованием гидроперокси-радикала (НО2), который сам быстро реагирует с оксидом азота (NO) с преобразованием ОН. Измерение OH и HO2, хотя и является весьма сложной задачей, позволяет понять окислительную способность атмосферы.
Мы измерили OH и HO2 с помощью прибора лазерной флуоресценции низкого давления на борту британского исследовательского самолета BAe-146 в Борнео, Малайзия (OP3), чтобы понять влияние органических веществ, таких как изопрен, на тропосферу.В отличие от района Борнео с высоким содержанием летучих органических соединений, мы также измерили OH и HO2 в Западной Африке (AMMA), чтобы понять влияние западноафриканского муссона на состав тропосферы.
Окисление над африканским Сахелем
Сахель, Нигер до муссона
Р. Комман и др.: Наблюдения радикалов ОН и НО2 над Западной Африкой, ACP, 2010
Д. Стоун и др. др .: Воздействие изопрена и NOx, ACP, 2010
MD Andres-Hernandez, et al.: Перокси-радикальное разделение во время проведения радикального взаимного сравнения AMMA, ACP, 2010
C.H. Мари и др.: Состав атмосферы Западной Африки: основные моменты международной программы AMMA, Atmos. Sci. Let., 2010
Окисление в среде с высоким содержанием летучих органических соединений
Борнео, Фото Мартина Ирвина
Д. Стоун и др .: Механизмы окисления изопрена: измерение и моделирование OH и HO2 на юге Тропический лес Восточной Азии во время полевой кампании OP3, ACP, 2011
A.Р. Маккензи и др.: Химический состав атмосферы газовых примесей и твердых частиц, выбрасываемых различными видами землепользования в Борнео, Фил. Пер. R. Soc. B., 2011
C.N. Хьюитт и др.: Обзор: фотохимические процессы окислителей и частиц над тропическим лесом Юго-Восточной Азии (проект OP3): введение, обоснование, характеристики местоположения и инструменты, ACP, 2010
_________________________________________________________________________
Окисление в Арктике
Что контролирует окисление в полярном пограничном слое?
Ожидается, что в сухой полярной атмосфере с ограниченным светом уровни OH и HO2 будут минимальными. Однако в рамках проекта COBRA, связанного с Международным полярным годом 2007, мы измерили OH и HO2 в весеннем полярном пограничном слое на севере Квебека. Неожиданно высокие уровни OH и HO2 были получены в результате фотолиза таких веществ, как озон и формальдегид (HCHO).
Однако в рамках проекта COBRA, связанного с Международным полярным годом 2007, мы измерили OH и HO2 в весеннем полярном пограничном слое на севере Квебека. Неожиданно высокие уровни OH и HO2 были получены в результате фотолиза таких веществ, как озон и формальдегид (HCHO).
Кууджуараапик, Квебек, МПГ 2007
П. М. Эдвардс и др.: Фотохимия оксида водорода в весеннем пограничном слое Северной Канады, JGR, 2011
S.J. Моллер и др.: Измерения оксидов азота в Гудзоновом заливе: Последствия для выбросов NOx с покрытых снегом и льдом поверхностей, Atmos Env, 2010
A.S. Махаджан и др.: Доказательства химического состава химически активного йода в пограничном слое Арктики, JGR, 2010
_________________________________________________________________________
Окисление в пограничном слое моря
Могут ли водоросли влиять на состав морского пограничного слоя?
Окись йода (IO) — это окислитель на основе йода, который присутствует в высоких концентрациях в морской среде.НВ может привести к разрушению озона и образованию новых частиц, но точечные измерения НД были ограничены. Прибор для измерения флуоресценции, индуцированной лазером низкого давления (адаптированный из системы HOx LIF), был разработан для измерения монооксида йода (IO) в низких концентрациях.
Для нашего исследования воздействия йода на прибрежные районы на станции атмосферных исследований Мейс-Хед на западном побережье Ирландии мы измерили самые высокие концентрации ИО во время дневного отлива, и наблюдалась сильная зависимость от высоты прилива.Самым крупным источником йода была ламинария цифровая. Изображение любезно предоставлено сайтом Seaweed Site
Над открытым океаном (круиз RHaMBLe) IO было менее 2 pptv. Однако этого достаточно, чтобы повлиять на уровень озона в морском пограничном слое [Read et al., Nature, 2008].
R. Commane и др.: Окись йода на чистом морском побережье: наблюдения высокочастотных вариаций и неоднородных распределений, ACP, 2011
C. S.E. Бейл и др.: Новые измерения содержания йода в атмосфере с помощью резонансной флуоресценции, J.Атмоса. Chem., 2008
S.E. Бейл и др.: Новые измерения содержания йода в атмосфере с помощью резонансной флуоресценции, J.Атмоса. Chem., 2008
JD Lee и др.: Реактивные галогены в морском пограничном слое (RHaMBLe): эксперименты в тропической Северной Атлантике, ACP, 2010
Спутниковые извлечения изопрена ограничивают выбросы и атмосферное окисление — Penn State
@article {71046cbf20004956a6a1a71c88a5ca23,
title = «Спутниковое извлечение изопрена ограничивает выбросы и атмосферное окисление»,
abstract = «Изопрен является доминирующим неметановым органическим соединением, выбрасываемым в атмосферу1–3.Он стимулирует производство озона и аэрозолей, модулирует атмосферное окисление и взаимодействует с глобальным круговоротом азота4–8. Эмиссия изопрена весьма неопределенна1,9, как и нелинейная химическая связь изопрена и гидроксильного радикала ОН — его основного стока10–13. Здесь мы представляем глобальные измерения изопрена, сделанные из космоса с помощью Cross-Track Infrared Sounder. Вместе с наблюдениями за формальдегидом, продуктом окисления изопрена, эти измерения позволяют ограничить выбросы изопрена и атмосферное окисление.Мы обнаружили, что отношения изопрен-формальдегид, измеренные из космоса, в целом согласуются с текущим пониманием химии изопрена-ОН, без каких-либо указаний на отсутствие рециклинга ОН при низких концентрациях оксида азота. Мы анализируем эти наборы данных по четырем глобальным горячим точкам изопрена в отношении прогнозов модели и представляем количественную оценку выбросов изопрена, основанную непосредственно на спутниковых измерениях самого изопрена. Серьезное несоответствие возникает в Амазонии, где в настоящее время занижены оценки выбросов естественного оксида азота при моделировании ОН и, следовательно, изопрена.На юге Африки мы обнаруживаем, что в восходящих прогнозах отсутствует заметная горячая точка изопрена. Многолетний анализ проливает свет на межгодовую изменчивость изопрена и предполагает влияние Эль-Ниньо / Южного колебания. »,
»,
author =« Wells, {Kelley C.} and Millet, {Dylan B. .} и Пейн, {Вивьен Х.} и Девентер, {М. Джулиан и Бейтс, {Кельвин Х.} и {де Гоу}, {Йост А.} и Мартин Граус, и Карстен Варнеке, и Армин Вистхалер и Фуэнтес, {Хосе Д.} «,
note =» Информация о финансировании: Благодарности Работа была поддержана Программой моделирования и анализа атмосферного состава НАСА (номер гранта NNX17AF61G) и Миннесотским институтом суперкомпьютеров.Мы благодарим Д. Фу за предоставление оптимальной оценки извлечения изопрена в Амазонии и за вклад в эту рукопись; К. Барнету, Э. Мэннингу и Р. Монарресу за предоставление данных по извлечению HNO3 с помощью программы CLIMCAPS; М. Альварадо, К. Кади-Перейра, Д. Гомбос, Дж. Хегарти и И. Стрикленд за создание и тестирование используемых здесь справочных таблиц поглощения изопрена; и E. Edgerton за предоставление данных по изопрену из сети SouthEastern Aerosol Research and CHaracterization (SEARCH). Спонсорами сети ПОИСК выступили Южная компания и НИЭИ.Измерения изопрена на борту NASA DC-8 во время SEAC4RS были поддержаны Федеральным министерством транспорта, инноваций и технологий Австрии (bmvit) через Австрийскую программу космических приложений (ASAP) Австрийского агентства содействия исследованиям (FFG). Благодарим Т. Миковины за поддержку на SEAC4RS. Мы благодарим С. Спрингстона за данные GoAmazon T3, которые были поддержаны Исследовательским центром климата ARM, Центральным офисом крупномасштабного эксперимента по биосферной атмосфере в Амазонии (LBA), Национальным институтом пескисас да Амазония (INPA) и Universidade сделать Estado do Amazonia (UEA).Часть этой работы была выполнена в Лаборатории реактивного движения Калифорнийского технологического института по контракту с НАСА. Авторское право издателя: {\ textcopyright} 2020, Автор (ы), по исключительной лицензии Springer Nature Limited. Авторские права: Copyright 2020 Elsevier BV, Все права защищены. «,
год =» 2020 «,
месяц = сен,
день =» 10 «,
doi =» 10.

 Общие сведения
Общие сведения Общие сведения
Общие сведения Общие сведения
Общие сведения Общие сведения
Общие сведения Общие сведения
Общие сведения д.)
д.) Квалификационные требования
Квалификационные требования Объявления
Объявления