основных, амфотерных, кислотных – HIMI4KA

Определения и формулы основных, амфотерных и кислотных оксидов были приведены ранее в уроке 6.
Характерные химические свойства основных оксидов: реакции с кислотными оксидами с образованием солей и с кислотами с образованием солей и воды, например:


Некоторые основные оксиды реагируют с водой с образованием оснований. Эта реакция проходит в том случае, если продукт реакции растворим в воде:


В аналогичных условиях, например, оксид железа (II) с водой реагировать не будет, так как гидроксид железа (II) в воде нерастворим.
Амфотерные оксиды взаимодействуют как с кислотами, так и с основаниями с образованием солей и воды или комплексных соединений:
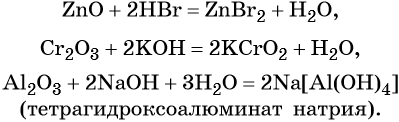
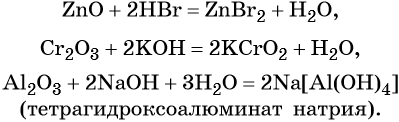
Кроме того, амфотерные оксиды могут взаимодействовать как с кислотными, так и с основными оксидами, например:


С водой амфотерные оксиды не взаимодействуют.
Кислотные оксиды реагируют с основными оксидами с образованием солей; с основаниями, с образованием солей и воды или кислых солей, а также с водой, в том случае если образующаяся в ходе такой реакции кислота растворима в воде:


Кроме того, кислотные оксиды вступают в окислительно-восстановительные и обменные реакции:


Тренировочные задания
1. Оксид натрия взаимодействует с каждым из двух веществ:
1) серная кислота и вода
2) уксусная кислота и азот
3) оксид лития и фосфор
4) оксид бария и серная кислота
2. Оксид калия взаимодействует с
1) азотом и фосфором
2) водой и сульфатом натрия
3) серной кислотой и оксидом фосфора (V)
4) литием и хлоридом натрия
3. Оксид кальция взаимодействует с
1) оксидом кремния
2) оксидом углерода (II)
3) оксидом азота (II)
4) оксидом азота (I)
4. Оксид бария взаимодействует с каждым из двух веществ:
1) азотной кислотой и водой
2) уксусной кислотой и хлором
3) оксидом натрия и азотом
4) оксидом серы (IV) и кремнием
5. Оксид магния не взаимодействует с
1) соляной кислотой
2) серной кислотой
3) оксидом лития
4) оксидом кремния
6. Оксид кальция взаимодействует с каждым из двух веществ:
1) оксидом фосфора (V), водой
2) оксидом углерода (IV) и сульфидом натрия
3) оксидом магния и азот
4) кислородом и сульфатом натрия
7. Оксид кальция реагирует с
1) медью
2) фосфором
3) оксидом углерода (IV)
4) оксидом магния
8. Оксид натрия реагирует с
1) водой
2) сульфатом калия
3) нитратом железа (II)
4) оксидом азота (II)
9. Оксид бария реагирует с каждым из двух веществ:
1) оксидом азота (II) и хлором
2) азотной кислотой и водой
3) оксидом углерода (II) и железом
4) серой и хлоридом кальция
10. Оксид магния реагирует с каждым из двух веществ:
1) оксидом кальция и оксидом железа (II)
2) оксидом алюминия и оксидом хрома (II)
3) соляной кислотой и оксидом кремния (VI)
4) оксидом фосфора (V) и цинком
11. Оксид цинка
1) растворяется в кислотах, но не реагирует с основаниями
2) растворяется в щелочах, но не реагирует с кислотами
3) реагирует с оксидом натрия, но не реагирует с водой
4) реагирует с оксидом калия и водой
12. Оксид хрома (III) реагирует с
1) оксидом калия
2) водой
3) оксидом серы (VI)
4) оксидом азота (I)
13. Оксид алюминия амфотерен, поскольку он способен взаимодействовать
1) как с азотной, так и серной кислотой
2) с водой и кислотами
3) с водой и щелочами
4) как с кислотами, так и со щелочами
14. Оксид алюминия реагирует с
1) сульфатом калия
2) оксидом калия
3) оксидом азота (II)
4) оксидом углерода (IV)
15. Оксид серы (VI) взаимодействует с каждым из двух веществ:
1) оксидом лития и углекислым газом
2) водой и углекислым газом
3) водой и гидроксидом калия
4) кислородом и натрием
16. Оксид фосфора (V) взаимодействует с каждым из двух веществ:
1) кислородом и водородом
2) водой и углекислым газом
3) водой и гидроксидом натрия
4) водой и оксидом углерода (II)
17. Оксид серы (VI) не взаимодействует с
1) водой
2) хлоридом калия
3) гидроксидом натрия
4) оксидом бария
18. Оксид серы (IV) взаимодействует с
1) оксидом углерода (IV) и водой
2) оксидом фосфора (V) и водой
3) сульфатом калия и водой
4) оксидом кальция и гидроксидом натрия
19. Оксид серы (IV) не взаимодействует с
1) водой
2) фосфатом кальция
3) раствором гидроксида натрия
4) гидроксидом кальция
20. Оксид хлора (VII) взаимодействует с каждым из двух веществ:
1) кальцием и углекислым газом
2) водой и углеродом
3) водой и оксидом калия
4) кислородом и азотом
21. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) Na2O + HCl →
Б) Na2O + CO2 →
В) Na2O + O2 →
ПРОДУКТЫ РЕАКЦИИ
1) Na2CO3
2) NaCl + H2
3) NaCl + H2O
4) NaO3
5) Na2O2
22. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) Na2O + H2SO4 (изб.) →
Б) Na2O + Al2O3 →
В) Na2O + P2O5 →
ПРОДУКТЫ РЕАКЦИИ
1) NaHSO4
2) NaHSO4 + H2O
3) NaAlO2
4) Na3PO4
5) Na2SO4 + H2O
23. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) CaO + H3PO4 (изб.) →
Б) CaO + H2O →
В) CaO + CO2 →
ПРОДУКТЫ РЕАКЦИИ
1) Ca(H2PO4)2 + H2O
2) CaCO3
3) Ca(OH)2
4) CaCO2
5) Ca3(PO4)2
24. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) CaO + SiO2 →
Б) CaO + H3PO4 (разб.) →
В) CaO + HCl →
ПРОДУКТЫ РЕАКЦИИ
1) Ca(H2PO4)2 + H2O
2) Ca3(PO4)2 + H2O
3) CaCl2 + H2O
4) CaSiO3 5) Ca(OCl)2
25. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) ZnO + HCl →
Б) ZnO + NaOH ⎯⎯H2O→
В) ZnO + Na2O ⎯⎯сплавление→
ПРОДУКТЫ РЕАКЦИИ
1) ZnCl2 + H2O
2) ZnCl2
3) Na2[Zn(OH)4]
4) Na2ZnO2 + H2O
5) Na2ZnO2
26. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) ZnO + H3PO4 →
Б) ZnO + NaOH + H2O →
В) ZnO + C →
ПРОДУКТЫ РЕАКЦИИ
1) Na2[Zn(OH)4] + H2
2) Na2ZnO2
3) Zn(H2PO4)2 + H2O
4) Zn + CO
5) Zn3(PO4)2 + H2O
27. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) P2O5 + H2O →
Б) P2O5 + Ca(OH)2 ⎯⎯сплавление→
В) P2O5 + NaOH (изб.) →
ПРОДУКТЫ РЕАКЦИИ
1) Ca3(PO4)2 + H2O
2) CaHPO4
3) Na3PO4 + H2O
4) Na3PO4
5) H3PO4
28. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) P2O5 + H2O →
Б) P2O5 + Na2O →
В) P2O5 + HNO3 →
ПРОДУКТЫ РЕАКЦИИ
1) H3PO4 + HNO2
2) H3PO4
3) Na3PO4
4) H3PO3
5) HPO3 + N2O5
29. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) SO2 + Ca(OH)2 (изб.) →
Б) SO2 + Na2O →
В) SO2 + O2 →
ПРОДУКТЫ РЕАКЦИИ
1) CaSO3 + H2O
2) SO3
3) Ca(HSO3)2
4) Na2SO4
5) Na2SO3
30. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) SO2 + H2S →
Б) SO2 (изб.) + NaOH →
В) SO2 + NaOH (изб.) →
ПРОДУКТЫ РЕАКЦИИ
1) Na2SO4 + H2O
2) Na2SO3 + H2O
3) NaHSO3
4) S + H2O
5) NaHSO4
31. Дана схема превращений:


Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
32. Дана схема превращений:


Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
33. Дана схема превращений:
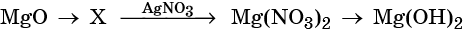
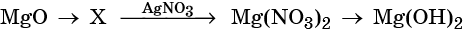
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
34. Дана схема превращений:
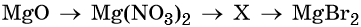
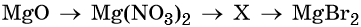
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для первого превращения составьте сокращённое ионное уравнение реакции.
35. Дана схема превращений:


Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
36. Дана схема превращений:


Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
37. Дана схема превращений:


Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
38. Дана схема превращений:


Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
39. Дана схема превращений:
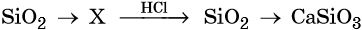
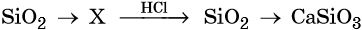
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращённое ионное уравнение реакции.
40. Дана схема превращений:
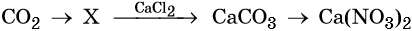
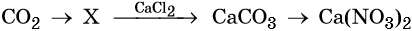
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращённое ионное уравнение реакции.
41. Дана схема превращений:


Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
42. Дана схема превращений:


Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для первого превращения составьте сокращённое ионное уравнение реакции.
43. Дана схема превращений:
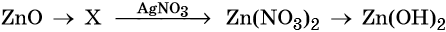
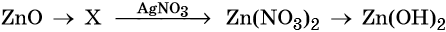
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращённое ионное уравнение реакции.
44. Дана схема превращений:


Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращённое ионное уравнение реакции.
45. Дана схема превращений:


Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
46. Дана схема превращений:


Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращённое ионное уравнение реакции.
47. Дана схема превращений:


Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для первого превращения составьте сокращённое ионное уравнение реакции.
48. Дана схема превращений:


Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
49. Дана схема превращений:


Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
50. Дана схема превращений:


Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
Ответы


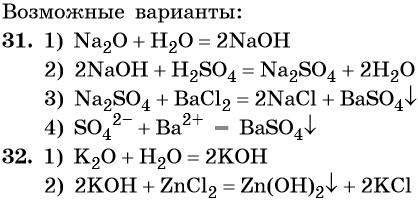
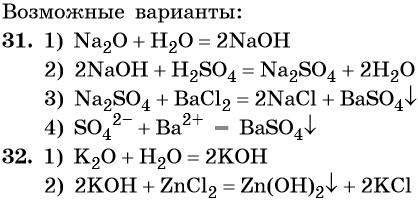
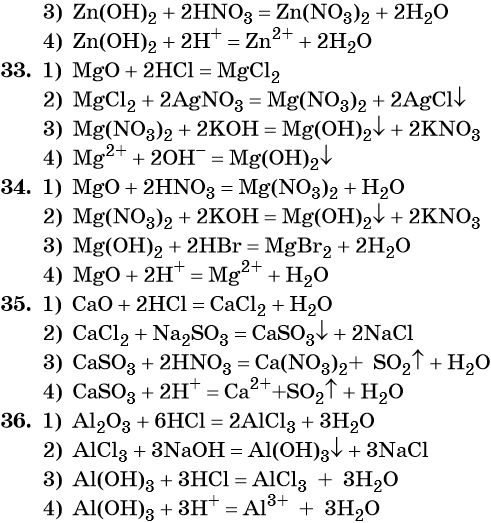
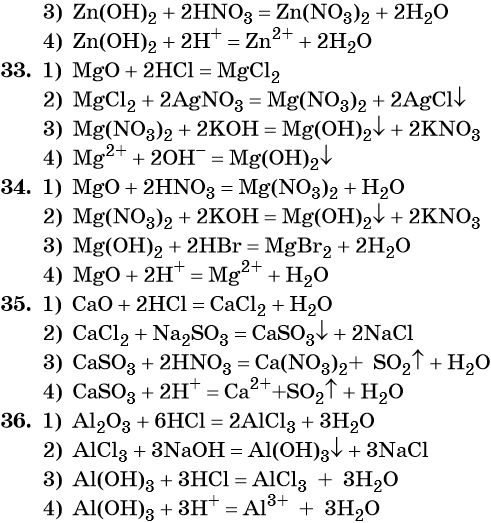
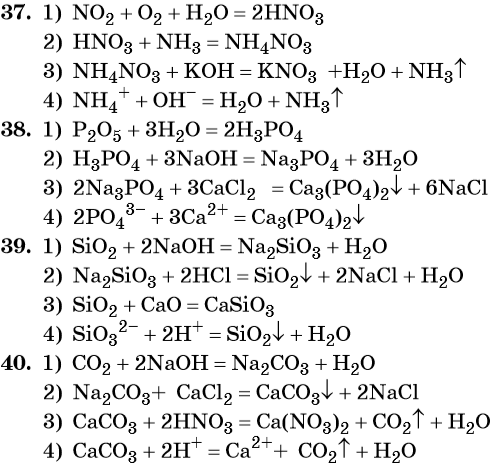
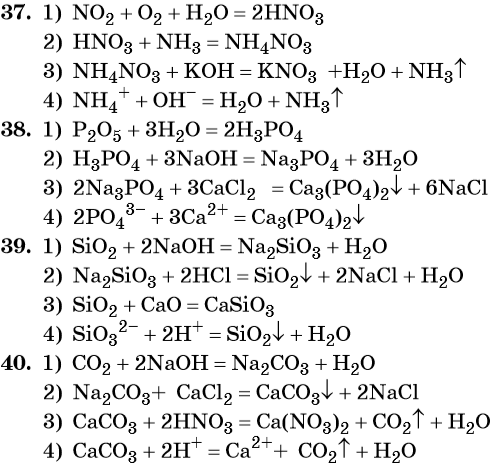
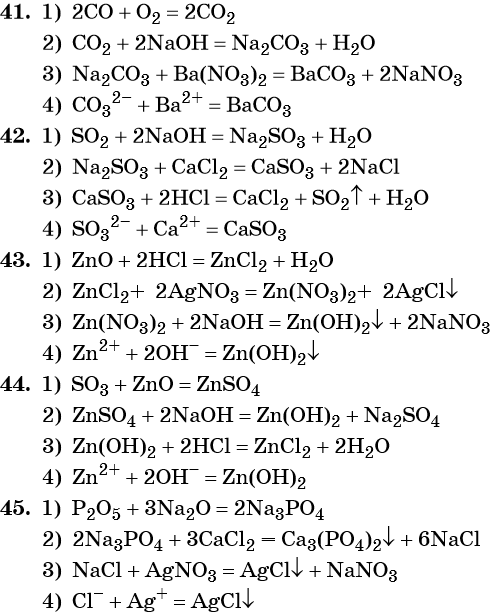
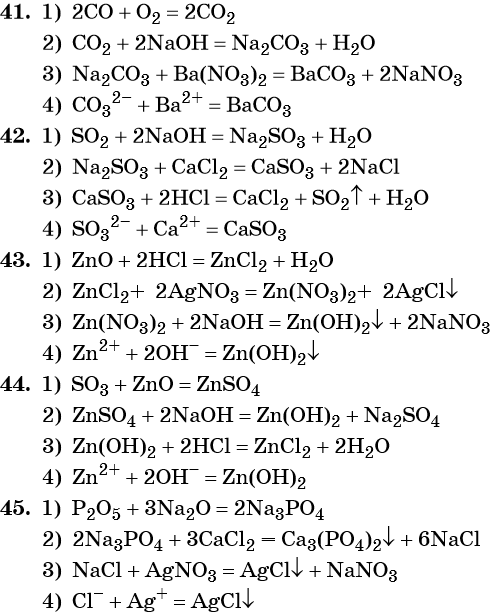
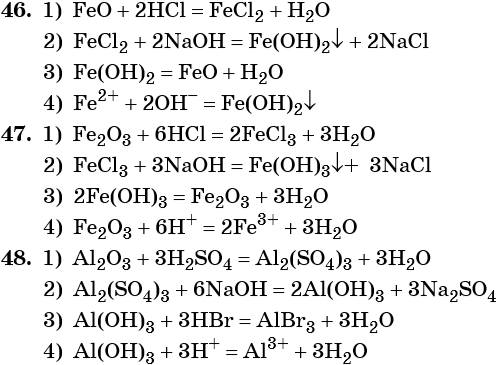
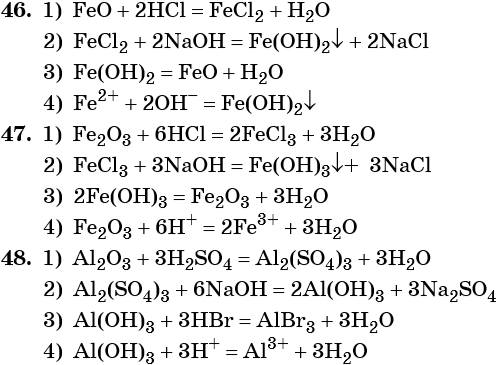


himi4ka.ru
Химические свойства оксидов для ЕГЭ 2020 / Блог
Классификация оксидов:
1 группа — несолеобразующие — N2O, NO, CO, SiO.
2 группа — солеобразующие:
- Основные — это такие оксиды, которым соответствуют основания. Оксиды металлов, степень окисления которых +1, +2 : Na2O, CaO, CuO, FeO, CrO. Реагируют с избытком кислоты с образованием соли и воды. Основным оксидам соответствуют основания: 1) щелочные металлы; 2) щелочноземельные металлы; 3) некоторые — CrO, MnO, FeO. Типичные реакции основных оксидов:
- Основный оксид + кислота → соль + вода (реакция обмена).
- Основный оксид + кислотный оксид → соль (реакция соединения)
- Основный оксид + вода → щелочь (реакция соединения).
- Кислотные —— это такие оксиды, которым соответствуют кислоты. Оксиды неметаллов. Оксиды металлов, степень окисления которых > +5: SO2, SO3, P2O5, CrO3, Mn2O7. Реагируют с избытком щелочи с образованием соли и воды. Типичные реакции кислотных оксидов:
- Кислотный оксид + основание → соль + вода (реакция обмена).
- Кислотный оксид + основный оксид → соль (реакция соединения).
- Кислотный оксид + вода → кислота (реакция соединения)
- Амфотерные — это оксиды, которые в зависимости от условий проявляют основные или кислотные свойства. Оксиды металлов, степень окисления которых +2, +3, +4: BeO, ZnO, Al2O3, Cr2O3, MnO2. Взаимодействуют как с кислотами так и с основаниями. Реагируют с основными и кислотными оксидами. Амфотерные оксиды с водой непосредственно не соединяются. Типичные реакции амфотерных оксидов:
- Амфотерный оксид + кислота → соль + вода (реакция обмена).
- Амфотерный оксид + основание → соль + вода или комплексное соединение.
Оксид углерода 2 и 4
Оксид углерода(II) в химическом отношении – инертное вещество. Не реагирует с водой, однако при нагревании с расплавленными щелочами образует соли муравьиной кислоты: CO + NaOH = HCOONa.
Взаимодействие с кислородом
При нагревании в кислороде сгорает красивым синим пламенем: 2СО + О2 = 2СО2.
Взаимодействие с водородом: СО + Н2 = С + Н2О.
Взаимодействие с другими неметаллами. При облучении и в присутствии катализатора взаимодействует с галогенами: СО + Cl2 = COCl2 (фосген). и серой СО + S = COS (карбонилсульфид).
Восстановительные свойства
СО – энергичный восстановитель. Восстанавливает многие металлы из их оксидов:
C+2O + CuO = Сu + C+4O2.
Взаимодействие с переходными металлами
С переходными металлами образует карбонилы:
- Ni + 4CO = Ni(CO)4;
- Fe + 5CO = Fe(CO)5.
Оксид углерода (IV) (углекислый газ, диоксид углерода, двуокись углерода,угольный ангидрид) — CO2, бесцветный газ (в нормальных условиях), без запаха, со слегка кисловатым вкусом. Химически оксид углерода (IV) инертен.
Окислительные свойства
С сильными восстановителями при высоких температурах проявляет окислительные свойства. Углем восстанавливается до угарного газа: С + СО2 = 2СО.
Магний, зажженный на воздухе, продолжает гореть и в атмосфере углекислого газа: 2Mg + CO2 = 2MgO + C.
Свойства кислотного оксида
Типичный кислотный оксид. Реагирует с основными оксидами и основаниями, образуя соли угольной кислоты:
- Na2O + CO2 = Na2CO3,
- 2NaOH + CO2 = Na2CO3 + H2O,
- NaOH + CO2 = NaHCO3.
Качественна реакция — для обнаружения углекислого газа является помутнение известковой воды:
Ca(OH)2 + CO2 = CaCO3↓ + H2O.
В начале реакции образуется белый осадок, который исчезает при длительном пропускании CO2 через известковую воду, т.к. нерастворимый карбонат кальция переходит в растворимый гидрокарбонат: CaCO3 + H2O + CO2 = Сa(HCO3)2.
Изучай химические свойства
Решай с ответами:
bingoschool.ru
Типичные реакции кислот, оснований, оксидов, солей (условия их проведения)
Типичные реакции кислот, оснований, оксидов, солей (условия их проведения)
Типичные реакции кислот
1. Кислота + основание → соль + вода
2. Кислота + оксид металла → соль + вода
3. Кислота + металл → соль + водород (условия: а) металл должен находиться в электрохимическом ряду напряжений левее водорода; б) должна получиться растворимая соль; в) нерастворимая кислота – кремниевая не реагирует с металлами; г) концентрированные серная и азотная кислоты реагируют иначе с металлами, водород не выделяется)
4. Кислота + соль → новая кислота + новая соль. (условие: реакция идёт в том случае, если образуется осадок или газ)
Типичные реакции оснований
1. Основание + кислота → соль + вода
3. Щёлочь + соль → новое основание + новая соль (условие: образуется осадок или газ)
Типичные реакции основных оксидов
1. Основный оксид + кислота → соль + вода
2. Основный оксид + кислотный оксид → соль
3. Основный оксид + вода → щёлочь (условие: образуется растворимое основание-щёлочь)
Типичные реакции кислотных оксидов
1. Кислотный оксид + основание → соль + вода
2. Кислотный оксид + основный оксид → соль
3. Кислотный оксид + вода → кислота (условие: кислота должна быть растворимой)
Типичные реакции солей
1. Соль + кислота → другая соль + другая кислота (условие: если образуется осадок или газ)
2. Соль + щёлочь → другая соль + другое основание (условие: если образуется осадок или газ)
3. Соль1 + соль2 → соль3 + соль 4 (условие: образуется осадок)
4. Соль + металл → другая соль + другой металл (условие: каждый металл вытесняет из растворов солей все другие металлы, расположенные правее его в ряду напряжений; при этом обе соли должны быть растворимыми)
infourok.ru