Оксиды. Классификация. Номенклатура. Свойства оксидов. Получение. Применение. Химия. 8 класс. Конспект урока
УМК «Химия. 8 класс» О. С. Габриеляна.
Тип урока: урок изучения нового материала (урок-исследование).
Цели:
- образовательная: повторить, углубить и обобщить знания учащихся о химических свойствах, получении и применении основных и кислотных оксидов;
- воспитательная: развивать коммуникабельность, интерес к предмету;
- развивающая: формировать способность к самостоятельному приобретению знаний; развивать умения анализировать, синтезировать, обобщать, делать выводы, устанавливать причинно – следственные связи ( состав – строение – свойства).
Задачи: организация проблемно-поисковой деятельности. Работа в группах. Проведение самостоятельной работы по вариантам. Эксперимент. Обсуждение результатов. Формулирование выводов.
Обсуждение результатов. Формулирование выводов.
Использованные источники:
- Химия. 8 класс: учеб. для общеобразоват. учреждений / О.С.Габриелян. – 12-е изд., стереотип. – М. : Дрофа, 2007. – 267, [5 с. : ил.]
- Химия. 8 класс. Тетрадь для лабораторных опытов и практических работ. Вертикаль О.С.Габриелян. – М. : Дрофа, 2013. – 96.
- Химия. 8 класс. Рабочая тетрадь к учебнику О.С. Габриеляна «Химия. 8 класс» (с тестовыми заданиями ЕГЭ). Вертикаль О.С.Габриелян, Сладков С.А. – М. : Дрофа,2013. – 208.
- Химия. 8–9 классы. Электронное приложение к учебникам О.С.Габриеляна. http: //www.drofa.ru
Урок-исследование
Оборудование. На демонстрационном столе: оксид бария, оксид фосфора (V), оксид меди (II), оксид железа (III), растворы гидроксида натрия, хлороводородной (соляной) кислоты, лакмуса, фенолфталеина, четыре химических стакана (50 мл), подъемный столик, черно-белый экран для демонстрационных опытов;
Ход урока
Ι.
 Изучение нового материала
Изучение нового материалаОрганизация проблемно-поисковой деятельности. Работа в группах.
Задание 1-й группе (Оксиды. Классификация. Номенклатура.)
1) Пользуясь представленной на столах коллекцией оксидов и статьёй «Физические свойства оксидов» с. 218, опишите их физические свойства, отметьте агрегатное состояние, цвет. Сделайте вывод. Попытайтесь объяснить подобное многообразие.
Предполагаемый ответ: Исследование представленных оксидов показало, что они бывают твердые – оксид меди (П) СuО, оксид кальция СаО, жидкие оксид cepы(VI) SO3 и газообразные- оксид углерода(IV) СO2. Цвет их также чрезвычайно разнообразен: СuО черного цвета, оксид кальция СаО белого цвета, оксид углерода(IV) СO2 – бесцветный. Можно предположить, что причины в различном строении этих оксидов.
2) Выберите из перечня слов ключевые слова, которые, по вашему мнению характеризуют оксиды: простые вещества, сложные вещества, летучие, не имеющие окраски, окрашенные, бинарные соединения, содержат кислород, неметаллы, металлы.
На основании ключевых слов сформулируйте определение оксидов. Запишите его. Проверьте по учебнику с. 91.
3) Классификация. Выделите признаки, на основании которых можно оксиды разделить на группы.
Предполагаемый ответ:
Ι. по принадлежности элемента, образующего оксид, к металлам и неметаллам:
а) оксиды металлов;
б) оксиды неметаллов.
ΙΙ. по способности образовывать гидроксиды определённого класса: основания (щёлочи), кислоты:
а) основные оксиды;
б) кислотные оксиды.
ΙΙΙ. по химическим свойствам:
а) несолеобразующие
б) солеобразующие.
4) Номенклатура. Работа с книгой. С помощью инструкции учебника с.89-90 назовите предложенные оксиды. Сформулируйте правило названия оксидов.
Задание 2-й группе
1) свойства кислотных оксидов.
Осуществите превращения:
Углерод (C) → оксид углерода (CO2) → угольная кислота (H2CO3) → карбонат кальция (CaCO3) → силикат кальция (CaSiO3).
Сделайте вывод о химических свойствах кислотных оксидов. Проверьте своё заключение, сверив его с данными учебника с. 220.
2) свойства основных оксидов.
Осуществите превращения:
|
Cu → CuO → |
CuSO |
|
|
↓ |
|
Li2O → LiOH → |
Cu(OH)2 |
Сделайте вывод о химических свойствах основных оксидов. Проверьте своё заключение, сверив его с с данными учебника с. 219.
Задание 3-й группе.

1) Получение оксидов.
а) Получите P2O5, CO2 реакцией горения.
б) Получите Al2O3, SO3, CaO разложением сложных веществ.
Сделайте вывод о способах получения оксидов.
Предполагаемый ответ: оксиды образуются:
1) при горении простых и сложных веществ;
2) при разложении сложных веществ: а) нерастворимых оснований; б) кислот; в) солей.
Задание 4-й группе
Применение.
1) Докажите или опровергните утверждение:
- Песок не имеет применения в промышленности
- Углекислый газ – продукт фотосинтеза
- Из руд, состоящих из оксидов железа Fe2O3 и Fe3O4 получают чугун и сталь
ΙΙ. Закрепление знаний, умений, навыков
Проведение самостоятельной работы по вариантам:
Вариант I
1) С какими из перечисленных веществ, формулы которых приведены ниже, будет вступать в реакцию оксид кальция: НС1, NaOH, H2O, H2SO4, KС1? Составьте уравнения возможных реакций.
2) Составьте формулы оснований, соответствующих оксидам натрия, кальция, алюминия, магния.
Вариант 2
2) Составьте формулы кислот, соответствующих оксидам серы (VI), фосфора (V), азота (V), углерода (IV).
Вариант 3 (экспериментальное)
Задача I. Как доказать, что оксид бария —основный оксид?
Беседа о порядке решения экспериментальной задачи. Выполнение опыта учащимся у доски, растворение оксида бария в воде и обнаружение индикатором образующейся щелочи. Другой учащийся растворяет оксид бария в хлороводородной (соляной) кислоте, предварительно «подкрашенной» лакмусом. Далее они составляют уравнения реакций.
Вариант 4 (экспериментальное)
Задача 2. Как доказать, что оксид фосфора (V) — кислотный оксид?
Как доказать, что оксид фосфора (V) — кислотный оксид?
Обсуждение решения задачи всем классом. Опыты выполняет учитель. Учащиеся составляют уравнения реакций и отвечают на вопросы:
1) Какой кислотный оксид не взаимодействует с водой?
2) Может ли оксид фосфора (V) находиться в природных условиях?
В целях обобщения химических свойств оксидов составляется сравнительная таблица и используется Электронное приложение к учебникам О.С.Габриеляна Химия. 8-9классы.
http: //www.drofa.ru «Основные классы неорганических соединений. Оксиды» фото и видеоролики.
Домашнее задание
§ 30. Знать определение оксидов, уметь писать уравнения реакций, характеризующие свойства оксидов. Выполните упражнения 1–3 с. 221, решить задачи 4,5 с.221. Повторить §18.
Оксиды. Классификация оксидов. Названия оксидов
Оксиды — это сложные неорганические соединения, состоящие из двух элементов, один из которых кислород (в степени окисления -2).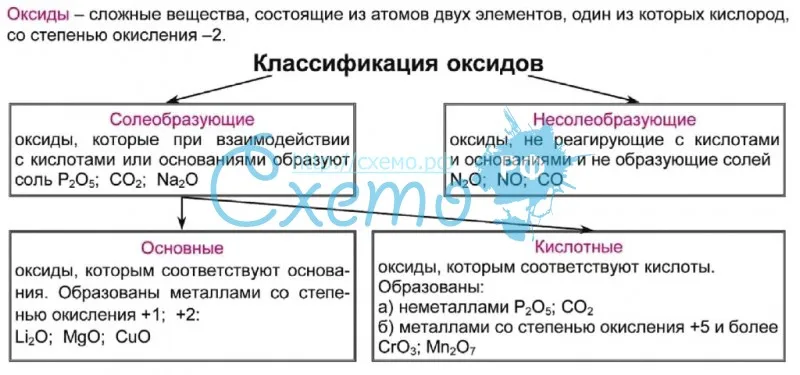
Например, Na2O, B2O3, Cl2O7 относятся к оксидам. Все перечисленные вещества содержат кислород и еще один элемент. Вещества Na2O2, H2SO4, HCl не относятся к оксидам: в первом степень окисления кислорода равна -1, в составе второго не два, а три элемента, а третье вообще не содержит кислорода.
Если вы не понимаете смысл термина «степень окисления», ничего страшного. Во-первых, можно обратиться к соответствующей статье на этом сайте. Во-вторых, даже без понимания этого термина можно продолжать чтение. Временно можете забыть про упоминание о степени окисления.
Получены оксиды практически всех известных на сегодняшний день элементов, кроме некоторых благородных газов и «экзотических» трансурановых элементов. Более того, многие элементы образуют несколько оксидов (для азота, например, их известно шесть).
Номенклатура оксидов
Мы должны научиться называть оксиды. Это очень просто.
Это очень просто.Пример 1. Назовите следующие соединения: Li2O, Al2O3, N2O5, N2O3.
Li2O — оксид лития,
Al2O3 — оксид алюминия,
N2O5 — оксид азота (V),
N2O3 — оксид азота (III).
Обратите внимание на важный момент: если валентность элемента постоянна, мы НЕ упоминаем ее в названии оксида. Если валентность меняется, следует обязательно указать ее в скобках! Литий и алюминий имеют постоянную валентность, у азота валентность переменная; именно по этой причине названия окислов азота дополнены римскими цифрами, символизирующими валентность.
Задание 1. Назовите оксиды: Na
Еще один важный момент: вещество F2O правильнее называть не «оксид фтора», а «фторид кислорода»!
Физические свойства оксидов
Физические свойства весьма разнообразны. Обусловлено это, в частности, тем, что в оксидах могут проявляться разные типы химической связи. Температуры плавления и кипения варьируются в широких пределах. При нормальных условиях оксиды могут находиться в твердом состоянии (CaO, Fe2O3, SiO2, B2O3), жидком состоянии (N2O3, H2O), в виде газов (N2O, SO2, NO, CO).
Разнообразна окраска: MgO и Na2O белого цвета, CuO — черного, N2O3 — синего, CrO3 — красного и т. д.
Расплавы оксидов с ионным типом связи хорошо проводят электрический ток, ковалентные оксиды, как правило, имеют низкую электропроводность.
Классификация оксидов
Все существующие в природе оксиды можно разделить на 4 класса: основные, кислотные, амфотерные и несолеобразующие. Иногда первые три класса объединяют в группу солеобразующих оксидов, но для нас это сейчас несущественно. Химические свойства оксидов из разных классов отличаются весьма сильно, поэтому вопрос классификации очень важен для дальнейшего изучения этой темы!
Иногда первые три класса объединяют в группу солеобразующих оксидов, но для нас это сейчас несущественно. Химические свойства оксидов из разных классов отличаются весьма сильно, поэтому вопрос классификации очень важен для дальнейшего изучения этой темы!
Начнем с несолеобразующих оксидов. Их нужно запомнить: NO, SiO, CO, N2O. Просто выучите эти четыре формулы!
Для дальнейшего продвижения мы должны вспомнить, что в природе существуют два типа простых веществ — металлы и неметаллы (иногда выделяют еще группу полуметаллов или металлоидов). Если вы четко понимаете, какие элементы относятся к металлам, продолжайте читать эту статью. Если есть малейшие сомнения, обратитесь к материалу «Металлы и неметаллы» на этом сайте.
Итак, сообщаю вам, что все амфотерные оксиды являются оксидами металлов, но не все оксиды металлов относятся к амфотерным. Я перечислю наиболее важные из них: BeO, ZnO, Al2O3, Cr2O3, SnO.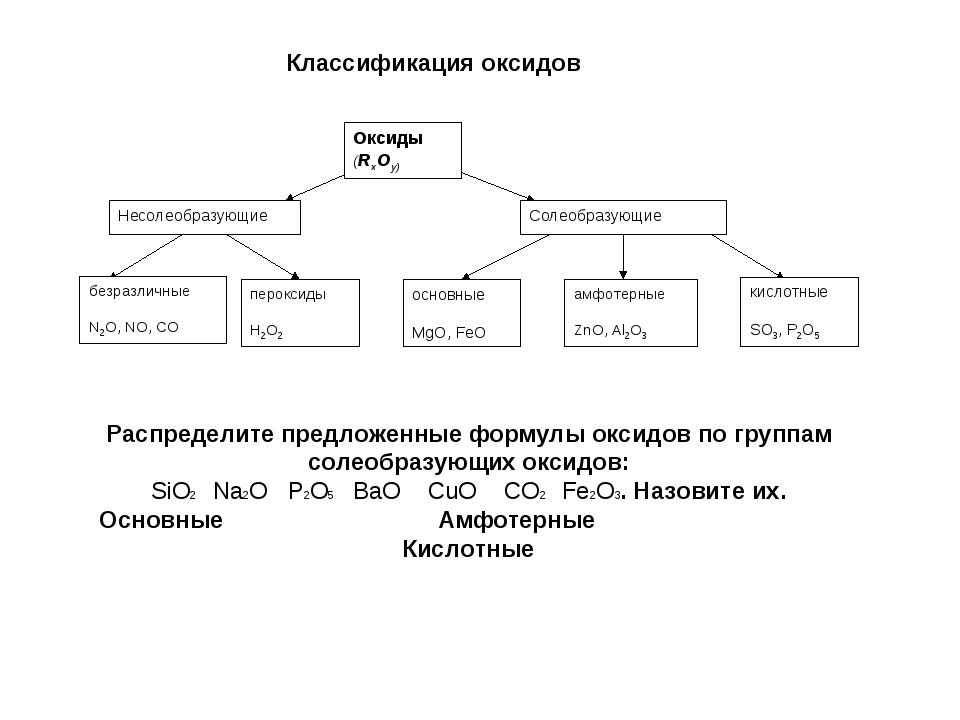 Список не является полным, но перечисленные формулы следует обязательно запомнить! В большинстве амфотерных оксидов металл проявляет степень окисления +2 или +3 (но есть исключения).
Список не является полным, но перечисленные формулы следует обязательно запомнить! В большинстве амфотерных оксидов металл проявляет степень окисления +2 или +3 (но есть исключения).
В следующей части статьи мы продолжим говорить о классификации; обсудим кислотные и основные оксиды.
Продолжение статьи →
Оксиды: классификация, номенклатура, свойства оксидов, получение, применение
Просит учеников дать определение оксидам.
Оксиды — это сложные вещества, состоящие из двух химических элементов, один из которых кислород, с валентностью равной 2.
Общая формула оксидов имеет следующий вид:
RxOy ,
где R – элемент (металл или неметалл), O – кислород, x и y – индексы, которые показывают количество атомов химического элемента и кислорода в оксиде.
Любое из химических соединений имеет определенное название, так и оксиды. Их название начинается со слова «оксид» с добавлением названия второго химического элемента (металла или неметалла). Попробуем назвать оксиды, записные на доске.
Их название начинается со слова «оксид» с добавлением названия второго химического элемента (металла или неметалла). Попробуем назвать оксиды, записные на доске.
Классификация оксидов
В чем сходство этих химических соединений?
( Наличие кислорода, сложные вещества, состоят из 2-х элементов (бинарные).
Сходство нашли. Теперь посмотрите внимательно и скажите, чем отличаются оксиды? Обратите внимание, что в одних оксидах атом кислорода связан с атомом металла, а в других оксидах – с неметаллом (CO2, h3O).
В зависимости от того, с каким химическим элементом связан кислород, различают – КИСЛОТНЫЕ (оксиды неметаллов) и ОСНОВНЫЕ оксиды (оксиды металлов). Кроме того, выделяют несолеобразующие оксиды и амфотерные (их изучают позже).
Несолеобразующие оксиды – это оксиды безразличные к кислотам и основаниям. К ним относятся оксиды неметаллов с валентностью I и II (Например, N2O, NO, CO).
Амфотерные оксиды – это оксиды, которым соответствуют основания и кислоты. К ним относятся оксиды металлов главных и побочных подгрупп с валентностью III, иногда IV, а также цинк и бериллий (Например, BeO, ZnO, Al2O3).
Получение оксидов
Как вы думаете, как можно получить оксиды?
Оксиды получают двумя способами.
Физические свойства
Любые вещества обладают физическими и химическими свойствами. Давайте вспомним, что относится к физическим свойствам?
(Агрегатное состояние: твердое жидкое и газообразное, цвет, запах)
Оксиды могут быть твердыми, жидкими и газообразными веществами, различной окраски, с запахом и без запаха, тяжелее или легче воздуха.
Вода — оксид, по агрегатному состоянию – жидкая. Если открыть бутылку воды, то мы слышим шипение и видим пузырьки выделяющегося газа – это оксид углерода (углекислый газ).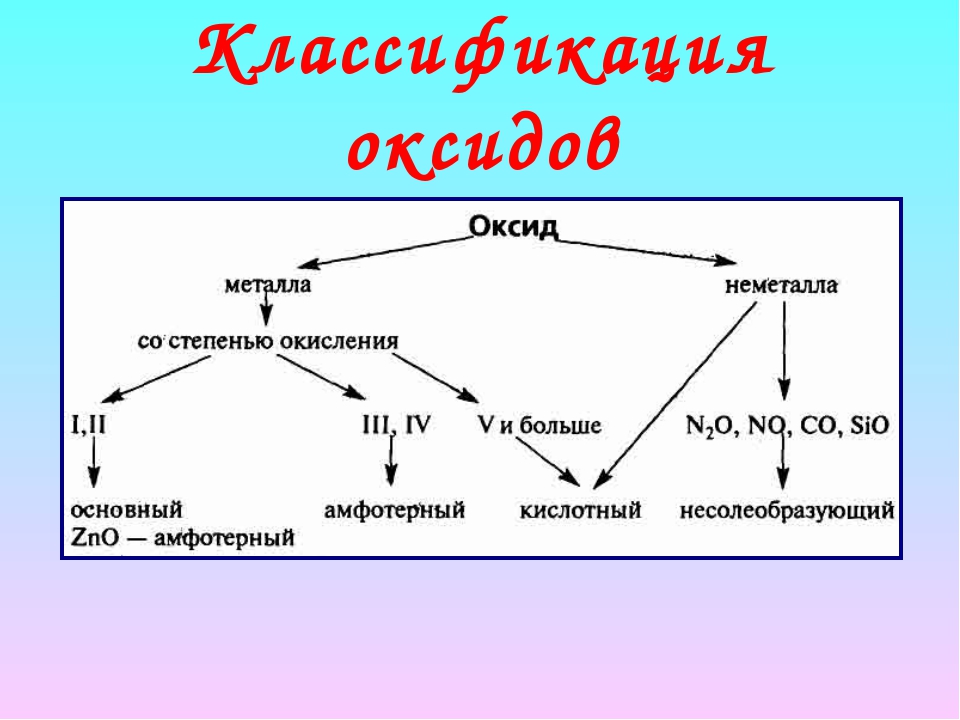
Химические свойства оксидов
Все оксиды, как кислотные, так и основные оксиды обладают разными свойствами (раздаточный материал – вклеить в тетрадь).
Значение оксидов в природе и жизни человека
Значение оксидов в промышленности и быту, а также для природных процессов — велика.
В промышленности: Fe2O3 и Fe3O4 – применяют в производстве чугуна (сплав железа с углеродом) и стали; CaO и SiO2 – производство строительных материалов;CO2 – в пищевой промышленности для производства газированных напитков; H2O – в производственных охладительных системах, для получения новых веществ, в системах орошения, в качестве растворителя и т.д.
В быту: H2O – в питьевых и хозяйственных целях; SiO2 – входит в состав чистящих веществ; ZnO –входит в состав белой краски.
В природных процессах: H2O и CO2 – обеспечивают осуществление процессов фотосинтеза; H2O – естественный растворитель, составляет основную часть цитоплазмы животных и растительных клеток и т.д.
| 1. |
Агрегатное состояние оксидов
Сложность: лёгкое |
1 |
2.
|
Распознавание химических формул оксидов
Сложность: лёгкое |
1 |
| 3. |
Классификация оксидов
Сложность: лёгкое |
1 |
4.
|
Составление формулы оксида по его названию
Сложность: лёгкое |
1 |
| 5. |
Составление формулы оксида и расчёт его молярной массы
Сложность: лёгкое |
2 |
6.
|
Распознавание и классификация оксидов
Сложность: среднее |
2 |
| 7. |
Составление названия оксида
Сложность: среднее |
2 |
8.
|
Составление названия оксида и расчёт его молярной массы
Сложность: среднее |
2 |
| 9. |
Химические свойства и получение оксидов
Сложность: среднее |
2 |
10.
|
Распознавание оксидов по описанию их свойств
Сложность: сложное |
3 |
| 11. |
Химические свойства и получение оксидов
Сложность: сложное |
3 |
12.
|
Расчёт формулы оксида
Сложность: сложное |
3 |
Оксиды. Классификация. Свойства. Номенклатура
Оксиды. Классификация. Свойства. НоменклатураК наиболее важным и распространенным кислородсодержащим соединениям элементов относятся оксиды.
Оксиды — бинарные соединения элементов с кислородом в степени окисления -2. Общая формула оксидов
.Почти все элементы образуют оксиды. Исходя из степени окисления кислорода и положения в ПС Д. И.Менделеева, состав оксидов можно представить простейшими формулами:
И.Менделеева, состав оксидов можно представить простейшими формулами:
К оксидам не относятся соединения, содержащие атомы кислорода, связанные химической связью друг с другом (
— пероксид натрия: )Название оксидов состоит соответственно из слова «оксид» плюс название элемента в родительном падеже единственного числа:
— оксид натрия, — оксид кальцияЕсли элемент проявляет переменную степень окисления, то в скобках дополнительно указывают степени окисления элемента:
— оксид серы (IV), — оксид серы (VI).Несолеобразующими называют оксиды, которым не соответствуют ни кислоты, ни основания и поэтому, с точки зрения кислотно-основных свойств, их характер может быть назван безразличным.
Солеобразующими называются оксиды, которые образуют соли. Солеобразующие оксиды делятся на основные, амфотерные и кислотные. Основными называются оксиды, элемент которых при образовании соли или основания становится катионом. Для основных оксидов характерны ионные или сильно полярные связи между атомами, что обусловливает прочность их кристаллических решеток и способность к поляризации атомов кислорода.
Для основных оксидов характерны ионные или сильно полярные связи между атомами, что обусловливает прочность их кристаллических решеток и способность к поляризации атомов кислорода.
К основным оксидам относятся:
Кислотными называют оксиды, элемент которых при образовании соли или кислоты входит в состав аниона. Оксиды ( высшие) малоактивных металлов и неметаллических элементов характеризуются наличием ковалентных связей в молекуле. Они способны быть акцепторами поляризованных атомов кислорода. Большинство оксидов неметаллов являются кислотными оксидами
К неметаллам относятся элементы:Остальные элементы — металлы.
Оксиды переходных металлов в высших степенях окисления проявляют преимущественно также свойства кислотных оксидов (например,
) . Большинство кислот образуется при взаимодействии кислотных оксидов с водой. Поэтому кислотные оксиды называют ангидридами кислот.Например :
Элемент, образующий ангидрид, проявляет одинаковую степень окисления и в ангидриде, и в соответствующей ему кислоте:
Амфотерные оксиды в зависимости от условий реакции могут проявлять как кислотные, так и основные свойства. Например :
Например :
В нервом случае алюминий проявляет свойства металла и входит в состав электроположительной составляющей
, во втором случае — свойства неметалла и входит в состав электроотрицательной составляющей формулы соли .Соединения, обладающие амфотерными свойствами, образуют следующие металлы:
и др.Кислотно-основной характер зависит от электроотрицательности, степени окисления элементов и эффективного заряда на атоме кислорода. Оксиды элементов с высокой электроотрицательностью имеют кислотный характер. Чем выше окислен металл, т.с. чем выше его степень окисления, тем более кислотным характером обладает оксид.
В периодах уменьшается отрицательный эффективный заряд на атомах кислорода и осуществляется постепенный переход от основных через амфотерные к кислотным оксидам.
Зависимость кислотно-основных свойств оксидов от эффективного заряда на атоме кислорода:
При увеличении степени окисления элемента усиливаются кислотные свойства оксида:
В главных подгруппах ПС при переходе от одного элемента к другому сверху вниз наблюдается усиление основных свойств оксидов:
В результате взаимодействия элемента с кислородом образуются соединения с ионной или полярной ковалентной связью. Тип химической связи в оксидах зависит главным образом от химической природы атома, его заряда и размера. Типичные металлы образуют оксиды с ионной связью. С ослаблением металлических свойств элемента в соединениях наблюдается переход от ионной связи к ковалентной полярной с постепенным снижением степени полярности и больше проявляются кислотные свойства.
Тип химической связи в оксидах зависит главным образом от химической природы атома, его заряда и размера. Типичные металлы образуют оксиды с ионной связью. С ослаблением металлических свойств элемента в соединениях наблюдается переход от ионной связи к ковалентной полярной с постепенным снижением степени полярности и больше проявляются кислотные свойства.
В пределах периодов с возрастанием порядкового номера элемента увеличивается заряд ядра атома и уменьшается его размер, что приводит к тому , что связь изменяется от ионной
к полярной ковалентной, а характер высших оксидов от основных через амфотерные к кислотным.
В пределах групп с возрастанием порядкового номера элемента степень окисления не изменяется , но вследствие увеличения энергетических уровней размер элемента возрастает. Это приводит к тому , что связь Э-О ослабевает, т.е становится более полярной ковалентной или ионной и в пределах групп усиливаются основные свойства оксидов.
Изменение химического характера оксидов одного элемента связано с тем, что с увеличением степени окисления элемента уменьшается его размер. Это приводит к тому, что тип химической связи изменяется от ионной к полярной ковалентной. Поэтому оксиды, в которых степень окисления наиболее низкая, относятся к основным, с высшей — к кислотным, а с промежуточной — к амфотерным.
Это приводит к тому, что тип химической связи изменяется от ионной к полярной ковалентной. Поэтому оксиды, в которых степень окисления наиболее низкая, относятся к основным, с высшей — к кислотным, а с промежуточной — к амфотерным.
Большинство основных оксидов представляет собой твердые кристаллические вещества ионного характера, в узлах кристаллической решетки расположены ионы металлов, достаточно прочно связанные с оксид-ионами О“’. поэтому оксиды типичных металлов обладают высокими температурами плавления и кипения.
Близость ионных радиусов многих ионов металлов приводит к тому, что в кристаллической решетке оксидов часть ионов одного металла может быть заменена на ионы другого металла. Это приводит к тому, что для оксидов часто не выполняется закон постоянства состава и могут существовать смешанные оксиды переменного состава.
Свойства оксидовОсновные:
1. Оксиды активных металлов взаимодействуют с водой с образованием щелочей:
2. Взаимодействуют с кислотами, образуя соли:
Взаимодействуют с кислотами, образуя соли:
3. Взаимодействуют с кислотными оксидами, образуя соли:
Кислотные:
1. Взаимодействуют с водой с образованием кислот:
2. Взаимодействуют с основаниями с образованием кислых и средних солей:
3. Взаимодействуют с основными оксидами .образуя соли:
Амфотерные:
Оксид свинца и оксид алюминия, реагируя с сильной кислотой или кислотным оксидом, проявляет свойства основного оксида:
При взаимодействии с сильным основанием или основным оксидом — свойства кислотного оксида:
Эта теория взята со страницы помощи по химии:
Онлайн помощь по химии
Возможно эти страницы вам помогут:
Оксиды. Классификация. Номенклатура. Физические и химические свойства. Получение. Применение
2. Задание. Выпишите формулы бинарных соединений, содержащих кислород.
P2O5,Mg3N2, CaО, FeCl3,
SO2, K2O, CuBr2, Na2CO3,
h3SO4, K2SiO3, CrO3, Fe2O3
3.
 Правильно! P2O5
Правильно! P2O5CaO
SO2
K2O
CrO3,
Fe2O3
Дать
названия этим оксидам.
P2O5
CaO
SO2
K2O
CrO3
Fe2O3
оксид фосфора(V)
оксид кальция
оксид серы(IV)
оксид калия
оксид хрома(VI)
оксид железа(III)
5. Задание. Составьте формулы оксидов по названиям.
Оксиднатрия
Оксид магния
Оксид серы(IV)
Оксид серы(VI)
Оксид хрома(VI)
6. Правильно!
Оксиднатрия
Оксид магния
Оксид серы(IV)
Оксид серы(VI)
Оксид хрома(VI)
Na2O
MgO
SO2
SO3
CrO3
Оксиды
основные
Na2O, MgO
кислотные
SO2,SO3,CrO3
ОКСИДЫ В
ПРИРОДЕ
Угарный
газ
CO
11. Рубин
В земной коре оксидычасто встречаются в
виде минералов
Рубин
12. Сапфир
13. Горный хрусталь
14. Корунд
АгатАметист
Оксиды бывают разные:
Жидкие, твёрдые,
газообразные.
По-разному называются
И свойствами отличаются.

18. Лабораторный опыт «Ознакомление с образцами оксидов»
1)2)
3)
4)
Задание.
Опишите физические свойства
оксидов при обычных условиях;
обменяйтесь результатами своих
наблюдений;
заполните таблицу;
сделайте выводы.
Название и
формула оксида
Оксид меди(II)
CuO
Оксид железа(III)
Fe2O3
Оксид кальция
СаО
Оксид водорода
h3O
Цвет
Агрегатное
состояние
t плавл.,
оC
Чёрный
Твёрдое
1026
Коричневый
Твёрдое
1562
Белый
Твёрдое
2570
Бесцветный
Жидкое
0
Первая группа
СaO + h3O → Ca(OH)2
СaO + 2HCl → CaCl2 + h3O
1.
2.
Вторая группа
1.
CaCO3 + 2HCl → CaCl2 + CO2 + h3O
2. CO2 + h3O → h3CO3
3. CO2 + Ca(OH)2 → CaCO3 + h3O
21. Упражнение 1
Найдитеформулы оксидов
и назовите их.
Mg3N2,
CuO, SiO2,
Al2O3, P2O3, Ch5, Nh4
22. Упражнение 1
Al2O3оксид меди(II)
оксид кремния
оксид алюминия
P2O3
оксид фосфора(III)
CuO
SiO2
23.
 Упражнение 2 Найдите соответствие между
Упражнение 2 Найдите соответствие междуформулой оксида и его названием.
В тетрадях запишите к цифре
соответствующую букву.
1) SO3
a) Оксид азота(IV)
2) ZnO
б) Оксид натрия
3) NO2
в) Оксид серы(VI)
4) SO2
г) Оксид цинка
5) Na2O
д) Оксид серы(IV)
1 – в, 2 – г, 3 – а, 4 – д, 5 – б.
24. Упражнение 3
Найдителишнее.
CuO,
SO2, Na2O
CO2, CaO, P2O5
25. Упражнение 4
Найдите соответствие.CO2
NaOH
Na2O
h3SO4
MgO
h3CO3
SO3
Mg(OH)2
26. Упражнение 5
Найдите соответствие.Na2O
+ h3SO4
BaO + CO2
SO3 + h3O
Na2SO3
+ h3O
Na2SO4 + h3O
BaCO3
h3SO4
h3SO3
| Класс | Название урока | Ссылка на учебные материалы |
| 8 | Предмет химии. Тела и вещества. Основные методы познания. Вводный инструктаж по технике безопасности Тела и вещества. Основные методы познания. Вводный инструктаж по технике безопасности |
https://resh.edu.ru/subject/lesson/1521/main/ |
| 8 | Чистые вещества и смеси. Способы разделения смесей | https://resh.edu.ru/subject/lesson/1522/main/ |
| 8 | Физические и химические явления | https://resh.edu.ru/subject/lesson/1485/main/ |
| 8 | Атом. Молекула | https://resh.edu.ru/subject/lesson/1486/main/ |
| 8 | Химический элемент. Знаки химических элементов | https://resh.edu.ru/subject/lesson/1486/main/ |
| 8 | Простые и сложные вещества | https://resh.edu.ru/subject/lesson/1486/main/ |
| 8 | Валентность. Составление химических формул бинарных соединений | https://resh.edu.ru/subject/lesson/1520/main/ |
| 8 | Химические уравнения. Коэффициенты. Закон сохранения массы веществ Коэффициенты. Закон сохранения массы веществ |
https://resh.edu.ru/subject/lesson/1519/main/ |
| 8 | Вычисления по химическим уравнениям количества и массы вещества по количеству вещества, массе реагентов или продуктов реакции | https://resh.edu.ru/subject/lesson/2448/main/ |
| 8 | Обобщение и систематизация знаний по теме «Первоначальные химические понятия» | https://resh.edu.ru/subject/lesson/2448/main/ |
| 8 | Кислород – химический элемент и простое вещество. Озон. Состав воздуха | https://resh.edu.ru/subject/lesson/2447/main/ |
| 8 | Физические и химические свойства кислорода | https://resh.edu.ru/subject/lesson/2447/main/ |
| 8 | Получение и применение кислорода | https://resh.edu.ru/subject/lesson/2447/main/ |
| 8 | Озон. Аллотропия кислорода. Состав воздуха. Горение Состав воздуха. Горение |
https://resh.edu.ru/subject/lesson/2446/main/ |
| 8 | Водород – химический элемент и простое вещество. Физические и химические свойства водорода | https://resh.edu.ru/subject/lesson/3119/main/ |
| 8 | Получение и применение водорода | https://resh.edu.ru/subject/lesson/3119/main/ |
| 8 | Объёмные отношения газов при химических реакциях | https://resh.edu.ru/subject/lesson/2731/main/ |
| 8 | Вода в природе. Круговорот воды в природе. Физические свойства воды | https://resh.edu.ru/subject/lesson/2062/main/ |
| 8 | Химические свойства воды. Взаимодействие с металлами | https://resh.edu.ru/subject/lesson/2062/main/ |
| 8 | Химические свойства воды. Взаимодействие воды с оксидами металлов | https://resh. edu.ru/subject/lesson/2062/main/ edu.ru/subject/lesson/2062/main/ |
| 8 | Растворы. Растворимость веществ в воде. Массовая доля растворённого вещества в растворе | https://resh.edu.ru/subject/lesson/2062/main/ |
| 8 | Расчёт массовой доли растворённого вещества в растворе | https://resh.edu.ru/subject/lesson/2062/main/ |
| 8 | Оксиды. Классификация. Номенклатура | https://resh.edu.ru/subject/lesson/2445/main/ |
| 8 | Амфотерные оксиды и гидроксиды | https://resh.edu.ru/subject/lesson/2684/main/ |
| 8 | Физические и химические свойства оксидов | https://resh.edu.ru/subject/lesson/2444/main/ |
| 8 | Получение и применение оксидов | https://resh.edu.ru/subject/lesson/2444/main/ |
| 8 | Основания. Классификация. Номенклатура | https://resh. edu.ru/subject/lesson/2442/main/ edu.ru/subject/lesson/2442/main/ |
| 8 | Получение и применение оснований | https://resh.edu.ru/subject/lesson/2442/main/ |
| 8 | Кислоты. Классификация. Номенклатура | https://resh.edu.ru/subject/lesson/2055/main/ |
| 8 | Физические и химические свойства кислот. Индикаторы. Изменение окраски индикаторов в различных средах | https://resh.edu.ru/subject/lesson/3120/main/ |
| 8 | Получение и применение кислот | https://resh.edu.ru/subject/lesson/3120/main/ |
| 8 | Соли. Классификация. Номенклатура. Получение и применение солей | https://resh.edu.ru/subject/lesson/2054/main/ |
| 8 | Физические и химические свойства солей | https://resh.edu.ru/subject/lesson/2441/main/ |
| 8 | Генетическая связь между классами неорганических соединений | https://resh. edu.ru/subject/lesson/2440/main/ edu.ru/subject/lesson/2440/main/ |
| 8 | Строение атома: ядро, энергетический уровень |
https://resh.edu.ru/subject/lesson/2051/main/ https://mosobr.tv/release/7883 |
| 8 | Состав ядра атома: протоны, нейтроны. Изотопы | https://resh.edu.ru/subject/lesson/2051/main/ |
| 8 | Периодический закон Д. И. Менделеева. Периодическая система химических элементов Д. И. Менделеева | https://resh.edu.ru/subject/lesson/2050/main/ |
| 8 | Физический смысл атомного (порядкового) номера химического элемента, номера группы и периода периодической системы | https://resh.edu.ru/subject/lesson/2050/main/ |
| 8 | Закономерности изменения свойств атомов химических элементов и их соединений на основе положения в периодической системе Д. И. Менделеева и строения атома |
https://resh. edu.ru/subject/lesson/2049/main/ edu.ru/subject/lesson/2049/main/ |
| 8 | Электроотрицательность атомов химических элементов | https://resh.edu.ru/subject/lesson/2439/main/ |
| 8 | Ковалентная химическая связь: неполярная и полярная. Ионная связь | https://resh.edu.ru/subject/lesson/2048/main/ |
| 8 | Металлическая связь. Понятие о водородной связи и её влиянии на физические свойства веществ на примере воды | https://resh.edu.ru/subject/lesson/2438/main/ |
| 8 | Валентность и степень окисления. Правила определения степеней окисления | https://resh.edu.ru/subject/lesson/3121/main/ |
| 8 | Окислительно-восстановительные реакции | https://resh.edu.ru/subject/lesson/3122/main/ |
| 8 | Повторение и обобщение по теме «Строение атома. Строение вещества. Химическая связь» | https://resh. edu.ru/subject/lesson/3093/main/ edu.ru/subject/lesson/3093/main/ |
| 8 | Химические формулы. Индексы. Закон постоянства состава вещества | https://interneturok.ru/lesson/chemistry/8-klass/bpervonachalnye-himicheskie-predstavleniyab/himicheskaya-formula-veschestva?seconds=0 |
| 8 | Относительная атомная и молекулярная массы. Массовая доля химического элемента в соединении |
Относительная+атомная+и+молекулярная+массы |
| 8 | Вычисление массовой доли химического элемента по формуле соединения | Вычисление+массовой+доли+химического+элемента |
| 8 | Моль – единица количества вещества. Молярная масса | Моль+-+единица+количества+вещества.+Молярная+масса |
| 8 | Тепловой эффект химических реакций. Понятие об экзо- и эндотермических реакциях | Тепловой+эффект+химических+реакций.+Понятие+об +экзо-+и+эндотермических+реакциях |
| 8 | Физические и химические свойства оснований | Физические+и+химические+свойства+оснований |
| 9 | Окислительно-восстановительные реакции. Реакции соединения, разложения, замещения и обмена с точки зрения окисления и восстановления Реакции соединения, разложения, замещения и обмена с точки зрения окисления и восстановления |
https://resh.edu.ru/subject/lesson/2104/main/ |
| 9 | Тепловой эффект химических реакций. Понятие об экзо- и эндотермических реакциях | https://resh.edu.ru/subject/lesson/2437/main/ |
| 9 | Скорость химических реакций. Первоначальные представления о катализе | https://resh.edu.ru/subject/lesson/2102/main/ |
| 9 | Обратимые и необратимые реакции. Понятие о химическом равновесии | https://resh.edu.ru/subject/lesson/2103/main/ |
| 9 | Сущность процесса электролитической диссоциации. Диссоциация кислот, оснований и солей. Слабые и сильные электролиты. Степень диссоциации | https://resh.edu.ru/subject/lesson/1518/main/ |
| 9 | Реакции ионного обмена и условия их протекания | https://resh.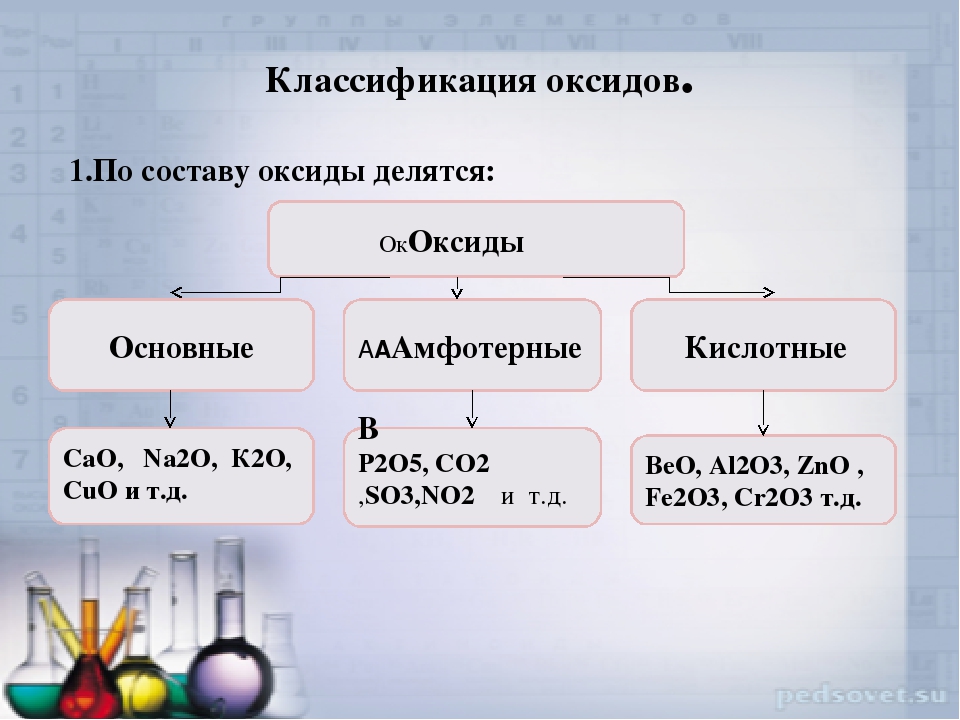 edu.ru/subject/lesson/1603/main/ edu.ru/subject/lesson/1603/main/ |
| 9 | Гидролиз солей | https://resh.edu.ru/subject/lesson/3123/main/ |
| 9 | Химические свойства основных классов неорганических соединений в свете представлений об электролитической диссоциации и окислительно-восстановительных реакциях | https://resh.edu.ru/subject/lesson/1606/main/ |
| 9 | Обобщение и систематизация знаний по теме «Химические реакции» | https://resh.edu.ru/subject/lesson/2101/main/ |
| 9 | Общая характеристика элементов VIIA группы. Галогены в природе. Физические свойства галогенов | https://resh.edu.ru/subject/lesson/2075/main/ |
| 9 | Химические свойства и применение галогенов | https://resh.edu.ru/subject/lesson/2075/main/ |
| 9 | Хлороводород. Соляная кислота и её соли | https://resh.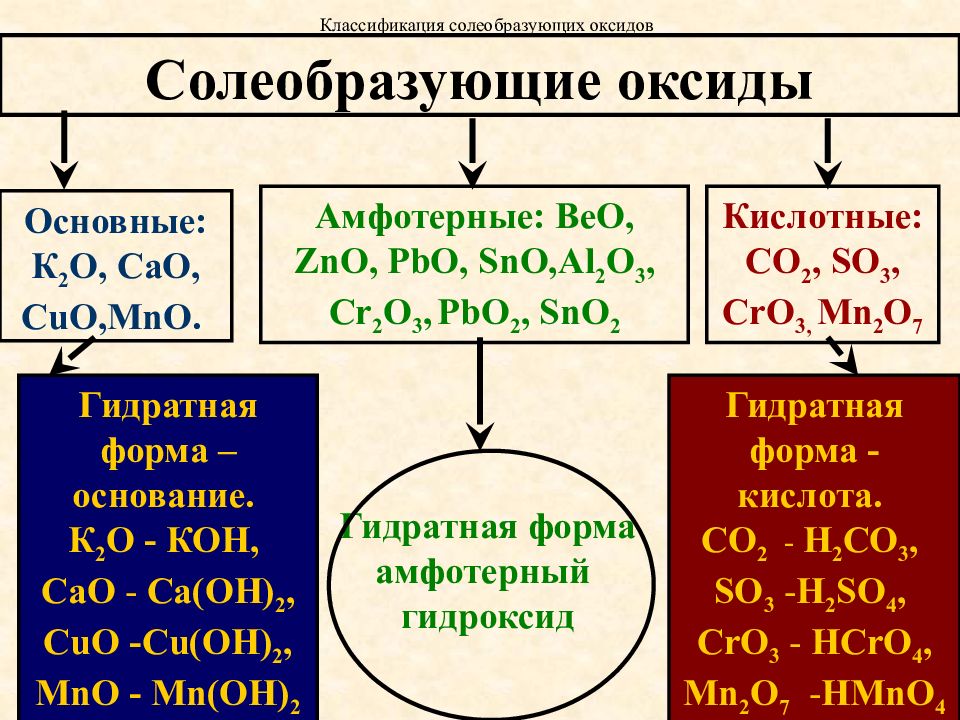 edu.ru/subject/lesson/2075/main/ edu.ru/subject/lesson/2075/main/ |
| 9 | Общая характеристика элементов VIA группы. Сера в природе. Физические и химические свойства серы | https://resh.edu.ru/subject/lesson/2434/main/ |
| 9 | Сероводород. Сульфиды | https://resh.edu.ru/subject/lesson/2434/main/ |
| 9 | Оксиды серы (IV). Сернистая кислота и её соли | https://resh.edu.ru/subject/lesson/2076/main/ |
| 9 | Оксиды серы (VI). Серная кислота и её соли | https://resh.edu.ru/subject/lesson/2077/main/ |
| 9 | Общая характеристика элементов VA группы. Азот в природе. Физические и химические свойства азота | https://resh.edu.ru/subject/lesson/2078/main/ |
| 9 | Аммиак: строение молекулы, физические и химические свойства | https://resh.edu.ru/subject/lesson/2078/main/ |
| 9 | Аммиак: химические свойства, получение, применение | https://resh. edu.ru/subject/lesson/2078/main/ edu.ru/subject/lesson/2078/main/ |
| 9 | Соли аммония | https://resh.edu.ru/subject/lesson/2078/main/ |
| 9 | Азотная кислота и её соли | https://resh.edu.ru/subject/lesson/2078/main/ |
| 9 | Фосфор. Оксид фосфора (V) | https://resh.edu.ru/subject/lesson/2073/main/ |
| 9 | Фосфорная кислота и её соли | https://resh.edu.ru/subject/lesson/2073/main/ |
| 9 | Характеристика элементов IVA группы. Углерод и кремний в природе. Физические и химические свойства углерода. Аллотропия углерода | https://resh.edu.ru/subject/lesson/2072/main/ |
| 9 | Оксиды углерода | https://resh.edu.ru/subject/lesson/2071/main/ |
| 9 | Угольная кислота и её соли | https://resh.edu.ru/subject/lesson/2070/main/ |
| 9 | Кремний и его соединения | https://resh.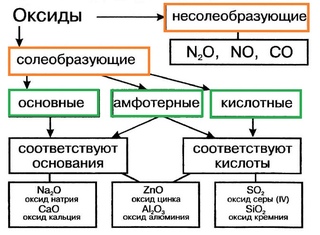 edu.ru/subject/lesson/2069/main/ edu.ru/subject/lesson/2069/main/ |
| 9 | Обобщение и систематизация знаний по теме «Неметаллы IV и V групп и их соединения» | https://resh.edu.ru/subject/lesson/2068/main/ |
| 9 | Положение металлов в Периодической системе химических элементов Д. И. Менделеева. Общие физические свойства металлов |
https://resh.edu.ru/subject/lesson/1607/main/ https://mosobr.tv/release/7942 |
| 9 | Общие химические свойства металлов |
https://resh.edu.ru/subject/lesson/1607/main/ https://mosobr.tv/release/7974 |
| 9 | Получение и применение металлов | https://resh.edu.ru/subject/lesson/1607/main/ |
| 9 | Положение щелочных и щелочноземельных металлов в Периодической таблице химических элементов Д. И. Менделеева и строение их атомов. Свойства Свойства |
https://resh.edu.ru/subject/lesson/1602/main/ |
| 9 | Соединения щелочных и щелочноземельных металлов | https://resh.edu.ru/subject/lesson/3124/main/ |
| 9 | Положение алюминия в Периодической таблице химических элементов Д. И. Менделеева и строение атома. Физические и химические свойства алюминия | https://resh.edu.ru/subject/lesson/1604/main/ |
| 9 | Соединения алюминия | https://resh.edu.ru/subject/lesson/1604/main/ |
| 9 | Положение железа в Периодической таблице химических элементов Д. И. Менделеева и строение атома. Нахождение в природе. Физические и химические свойства железа | https://resh.edu.ru/subject/lesson/1605/main/ |
| 9 | Соединения железа и их свойства | https://resh.edu.ru/subject/lesson/1605/main/ |
| 9 | Получение и применение соединений железа | https://resh. edu.ru/subject/lesson/1605/main/ edu.ru/subject/lesson/1605/main/ |
| 9 | Обобщение и систематизация знаний по теме «Металлы и их соединения» | https://resh.edu.ru/subject/lesson/2067/main/ |
| 9 | Углеводороды | https://resh.edu.ru/subject/lesson/1608/main/ |
| 9 | Спирты: метанол, этанол, глицерин | https://resh.edu.ru/subject/lesson/2066/main/ |
| 9 | Карбоновые кислоты: уксусная, стеариновая, олеиновая, аминоуксусная кислоты | https://resh.edu.ru/subject/lesson/2065/main/ |
| 9 | Биологически важные вещества: жиры, углеводы, белки | https://resh.edu.ru/subject/lesson/1609/main/ |
| 9 | Полимеры | https://resh.edu.ru/subject/lesson/2435/main/ |
| 9 | Обобщающий урок по теме «Важнейшие органические соединения» | https://resh.edu.ru/subject/lesson/2064/main/ |
| 9 | Степень окисления атомов и её определение в соединениях | Степень+окисления+атомов+и+её+определение+в+соединениях |
| 9 | Положение неметаллов в Периодической системе химических элементов Д. И. Менделеева | https://www.youtube.com/watch?v=ohFd4lJ9RcE&feature=emb_logo |
| 9 | Химические свойства металлов. Взаимодействие металлов с неметаллами | https://www.youtube.com/watch?v=qgzo40bfL1o |
| 9 | Оксиды азота | https://www.youtube.com/watch?time_continue=130&v=JmbTPhygCdk&feature=emb_logo |
| 9 | Общие химические свойства металлов | https://www.youtube.com/watch?time_continue=217&v=3O_1UupZ71E&feature=emb_logo |
| 9 | Получение и применение металлов | https://www.youtube.com/watch?time_continue=347&v=ZmgAo8Q3jFI&feature=emb_logo |
| 9 | Природные источники углеводородов: природный газ, нефть, уголь | https://www.youtube.com/watch?time_continue=206&v=O9e6ORyASjI&feature=emb_logo |
| 9 | Свойства металлов, неметаллов и их соединений. Генетическая связь между классами неорганических соединений | Свойства+металлов+неметаллов+и+их+соединений |
| 9 | Вычисления по химическим уравнениям количества, объёма, массы вещества по количеству, объёму, массе реагентов или продуктов реакции | https://www.youtube.com/watch?time_continue=8&v=nwIVA6XBq5w&feature=emb_logo |
Классификация оксидов — Введение, классификация, примеры и реакции
Что такое оксиды?
Оксид — это химическое соединение, которое содержит по крайней мере один атом кислорода и еще один элемент. Дианион кислорода также называют оксидом, который представлен O-2. Все оксидные соединения содержат хотя бы один дианион кислорода. Оксиды обычно представляют собой бинарные соединения, состоящие из кислорода и другого элемента.
Примеры оксидов — Al2O3 — оксид алюминия, CO2 — диоксид углерода, SO2 — диоксид серы, CaO — оксид кальция, MgO — оксид магния, Na2O — оксид натрия и т. Д.
Классификация оксидов
(изображение будет обновлено в ближайшее время)
Оксиды можно разделить на следующие типы в зависимости от валентности другого элемента в оксидах —
Простые оксиды — Простые оксиды состоят из одного металла или полуметалла и кислород. Эти оксиды несут только то количество атомов кислорода, которое допускается нормальной валентностью элемента или металла.
Примеры простых оксидов — h3O, MgO, CaO, SiO2 и т. Д.
Смешанные оксиды — Смешанные оксиды образуются при объединении простых оксидов.Эти два простых оксида могут быть из одного металла (элемента) или из разных.
Примеры смешанных оксидов — Красный свинец (Pb3O) представляет собой смешанный оксид диоксида свинца (PbO2) и монооксида свинца (PbO). Другой пример — оксид железа и железа (Fe3O4), который представляет собой смешанный оксид двух простых оксидов — оксида железа (Fe2O3) и оксида железа (FeO).
Оксиды можно разделить на следующие типы в зависимости от металлического характера другого элемента в оксидах —
Основной оксид
Амфотерный оксид
Кислотный оксид
Нейтральный оксид
(изображение будет скоро загружено)
Оксиды металлов — Оксиды металлов состоят из металла и кислорода.Обычно они встречаются в природе в виде минералов. Они образуются при окислении металлов.
Примеры оксидов металлов — CaO, MgO, Fe3O4, BaO, ZnO и т. Д.
Их можно разделить на следующие два типа —
Основной оксид
Амфотерный оксид
Основной оксид — Если оксид реагирует с водой и образует основание, называемое основным оксидом. Таким образом, основной оксид при реакции с водой дает основание. Это означает, что если мы приготовим раствор основного оксида и воды и окунем в него красную лакмусовую бумажку, он станет синим.
Примеры основных оксидов — MgO, CaO, BaO и т. Д.
Горение магниевой ленты — Когда мы сжигаем магниевую ленту, она вступает в реакцию с кислородом воздуха и образует соединение серого цвета, которое является оксидом магния. Теперь, когда мы растворяем это серое соединение в воде и окунаем в него лакмусовую бумагу красного цвета, она превращает красную лакмусовую бумажку в синюю, поскольку при реакции с водой образует гидроксид магния. Участвующие реакции приведены ниже —
2Mg + O2 🡪 2MgO
MgO + h3O 🡪 Mg (OH) 2
Амфотерный оксид — Амфотерный оксид — это оксид металла, который проявляет двойное поведение.Он ведет себя как кислый оксид, так и как основной оксид. Он также реагирует как с основаниями, так и с кислотами.
Примеры амфотерных оксидов — оксид цинка (ZnO)
Когда оксид цинка реагирует с конц. Гидроксид натрия действует как кислый оксид, а когда он реагирует с HCl, он действует как основной оксид. Реакции приведены ниже —
ZnO + 2h3O + 2NaOH 🡪 Na3Zn [OH] 4 + h3
Кислый оксид цинка
ZnO + 2HCl 🡪 ZnCl2 + h3O
Основной оксид цинка
Другой пример амфотерного оксида алюминия Al — окись.Когда он реагирует с серной кислотой, он действует как основание, а когда он реагирует с гидроксидом натрия, он действует как кислота. Реакции приведены ниже —
Al2O3 + 3h3SO4 🡪 Al2 (SO4) 3 + 3h3O
Основной
Al2O3 + 2NaOH 🡪 2NaAlO2 + h3O
Кислый алюминат натрия BeO0005,
и т. Д. Неметаллические оксиды. Неметаллические оксиды образуются неметаллами и кислородом.Обычно они встречаются в природе в виде таких газов, как диоксид углерода. Они образуются при окислении неметаллов.
Примеры оксидов металлов — CO2, SO2, P2O5, CO и т.д. с водой и образует кислоту, называемую кислым оксидом. Таким образом, кислый оксид при реакции с водой дает основание. Это означает, что если мы приготовим раствор кислого оксида и воды и окунем в него синюю лакмусовую бумажку, то она станет красной.В основном кислые оксиды представляют собой оксиды неметаллов, но некоторые оксиды металлов с высокой степенью окисления также обладают кислотным характером. Таким образом, некоторые оксиды металлов, такие как CrO3, Mn2O7 и т. Д., Также являются кислыми оксидами.
Примеры кислых оксидов — SO2, CO2, SO3 и т. Д.
Когда триоксид серы реагирует с водой, он образует серную кислоту. Реакция приведена ниже —
SO3 + h3O 🡪 h3SO4
Нейтральный оксид — Нейтральные оксиды — это оксиды, которые не проявляют ни кислотных свойств, ни основных свойств.Они не образуют соли, когда реагируют с кислотой или основанием.
Примеры нейтральных оксидов — N2O, NO, CO и т. Д.
Это все о классификации оксидов, если вы ищете решения проблем NCERT на основе оксидов, войдите на веб-сайт Vedantu или загрузите приложение Vedantu Learning App. Таким образом вы сможете получить доступ к бесплатным PDF-файлам решений NCERT, а также к заметкам о редакции, пробным тестам и многому другому.
Оксид | химическое соединение | Британника
Оксид , любой из большого и важного класса химических соединений, в котором кислород сочетается с другим элементом.За исключением более легких инертных газов (гелий [He], неон [Ne], аргон [Ar] и криптон [Kr]), кислород (O) образует по крайней мере один бинарный оксид с каждым из элементов.
Как металлы, так и неметаллы могут достигать своей наивысшей степени окисления (т. Е. Отдавать максимальное количество доступных валентных электронов) в соединениях с кислородом. Щелочные металлы и щелочноземельные металлы, а также переходные металлы и постпереходные металлы (в их более низких степенях окисления) образуют ионные оксиды — т.е.е., соединения, содержащие анион O 2-. Металлы с высокой степенью окисления образуют оксиды, связи которых имеют более ковалентную природу. Неметаллы также образуют ковалентные оксиды, которые обычно имеют молекулярный характер. Плавное изменение типа связи в оксидах от ионного к ковалентному наблюдается по мере перехода таблицы Менделеева от металлов слева к неметаллам справа. Такое же изменение наблюдается в реакции оксидов с водой и, как следствие, кислотно-щелочном характере продуктов.Ионные оксиды металлов реагируют с водой с образованием гидроксидов (соединений, содержащих ион OH — ) и образующихся основных растворов, тогда как большинство оксидов неметаллов реагируют с водой с образованием кислот и образующихся кислотных растворов ( см. таблицу).
| группа 1 | группа 2 | группа 13 | группа 14 | группа 15 | группа 16 | группа 17 | |
|---|---|---|---|---|---|---|---|
| Источник: Источник: W.Робинсон, Дж. Одом и Х. Хольцкло-младший, Химия: концепции и модели, D.C. Heath and Co., 1992. | |||||||
| реакция оксидов с водой и кислотно-основной характер гидроксидов | Na 2 O дает NaOH (сильное основание) | MgO дает Mg (OH) 2 (слабое основание) | Al 2 O 3 не реагирует | SiO 2 не реагирует | P 4 O 10 дает H 3 PO 4 (слабая кислота) | SO 3 дает H 2 SO 4 (сильная кислота) | Cl 2 O 7 дает HClO 4 (сильная кислота) |
| связь в оксидах | Na 2 O ионный | MgO ионный | Al 2 O 3 ионный | SiO 2 ковалентный | P 4 O 10 ковалентный | SO 3 ковалентный | Cl 2 O 7 ковалентный |
Определенные органические соединения реагируют с кислородом или другими окислителями с образованием веществ, называемых оксидами.Таким образом, амины, фосфины и сульфиды образуют аминооксиды, фосфиноксиды и сульфоксиды соответственно, в которых атом кислорода ковалентно связан с атомом азота, фосфора или серы. Так называемые оксиды олефинов представляют собой циклические простые эфиры.
Оксиды металлов
Оксиды металлов — это твердые кристаллические вещества, содержащие катион металла и анион оксида. Обычно они реагируют с водой с образованием оснований или с кислотами с образованием солей.
Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту.Подпишитесь сейчас Щелочные металлы и щелочноземельные металлы образуют три различных типа бинарных кислородных соединений: (1) оксиды, содержащие ионы оксидов, O 2-, (2) пероксиды, содержащие ионы пероксидов, O 2 2-, которые содержат ковалентные одинарные связи кислород-кислород, и (3) супероксиды, содержащие ионы супероксида, O 2 — , которые также имеют ковалентные связи кислород-кислород, но с одним отрицательным зарядом меньше, чем ионы пероксида. Щелочные металлы (которые имеют степень окисления +1) образуют оксиды M 2 O, пероксиды M 2 O 2 и супероксиды MO 2 .(M представляет собой атом металла.) Щелочноземельные металлы (со степенью окисления +2) образуют только оксиды, MO и пероксиды, MO 2 . Все оксиды щелочных металлов могут быть получены нагреванием соответствующего нитрата металла с элементарным металлом.
2MNO 3 + 10M + тепло → 6M 2 O + N 2 Обычное получение оксидов щелочноземельных металлов включает нагревание карбонатов металлов.
MCO 3 + тепло → MO + CO 2 И оксиды щелочных металлов, и оксиды щелочноземельных металлов являются ионными и реагируют с водой с образованием основных растворов гидроксида металла.M 2 O + H 2 O → 2MOH (где M = металл группы 1)
MO + H 2 O → M (OH) 2 (где M = металл группы 2)
Таким образом, эти соединения часто называют основными оксидами. В соответствии со своим основным поведением они реагируют с кислотами в типичных кислотно-основных реакциях с образованием солей и воды; Например,
M 2 O + 2HCl → 2MCl + H 2 O (где M = металл группы 1).
Эти реакции также часто называют реакциями нейтрализации. Наиболее важными основными оксидами являются оксид магния (MgO), хороший проводник тепла и электрический изолятор, который используется в огнеупорном кирпиче и теплоизоляции, и оксид кальция (CaO), также называемый негашеной известью или известью, широко используемый в сталелитейной промышленности и в воде. очищение.
Периодические тренды оксидов тщательно изучены. В любой данный период связывание в оксидах прогрессирует от ионного к ковалентному, и их кислотно-основной характер изменяется от сильно основного до слабоосновного, амфотерного, слабокислого и, наконец, сильнокислого. В общем, основность увеличивается вниз по группе (например, в оксидах щелочноземельных металлов BeO
химическое соединение | Определение, примеры и типы
Химическое соединение , любое вещество, состоящее из идентичных молекул, состоящих из атомов двух или более химических элементов.
молекула метанаМетан, в котором четыре атома водорода связаны с одним атомом углерода, является примером основного химического соединения. На структуру химических соединений влияют сложные факторы, такие как валентные углы и длина связи.
Британская энциклопедия, Inc.Британская викторина
По химии
Возможно, вы знаете, что элементы составляют воздух, которым мы дышим, и воду, которую мы пьем, но знаете ли вы о них больше? Какой элемент почти такой же легкий, как водород? Что вы называете смесью двух химических элементов? Узнайте ответы в этой викторине.
Вся материя Вселенной состоит из атомов более 100 различных химических элементов, которые встречаются как в чистом виде, так и в сочетании в химических соединениях. Образец любого данного чистого элемента состоит только из атомов, характерных для этого элемента, и атомы каждого элемента уникальны. Например, атомы углерода отличаются от атомов железа, которые, в свою очередь, отличаются от атомов золота. Каждый элемент обозначается уникальным символом, состоящим из одной, двух или трех букв, возникающих либо из текущего имени элемента, либо из его исходного (часто латинского) имени.Например, символы углерода, водорода и кислорода — это просто C, H и O соответственно. Символ железа — Fe, от оригинального латинского названия ferrum . Фундаментальный принцип химической науки состоит в том, что атомы различных элементов могут объединяться друг с другом, образуя химические соединения. Например, метан, который образован из элементов углерода и водорода в соотношении четыре атома водорода на каждый атом углерода, как известно, содержит различные молекулы CH 4 .Формула соединения, например, CH 4 , указывает типы присутствующих атомов с нижними индексами, представляющими относительное количество атомов (хотя цифра 1 никогда не записывается).
молекула водыМолекула воды состоит из двух атомов водорода и одного атома кислорода. Одиночный атом кислорода содержит шесть электронов в своей внешней оболочке, которая может содержать в общей сложности восемь электронов. Когда два атома водорода связаны с атомом кислорода, внешняя электронная оболочка кислорода заполняется.
Encyclopædia Britannica, Inc.Исследуйте магнитоподобную ионную связь, образующуюся при передаче электронов от одного атома к другому
Ионы — атомы с положительным или отрицательным суммарным зарядом — связываются вместе, образуя ионные соединения.
Encyclopædia Britannica, Inc. См. Все видео для этой статьиПосмотрите, как работают молекулярные связи, когда два атома водорода соединяются с атомом серы, образуя сероводород
Молекулярные соединения образуются при образовании молекул, таких как молекулы метана или воды , соединяются вместе, деля электроны.
Encyclopædia Britannica, Inc. Посмотреть все видео по этой статье
Вода, которая представляет собой химическое соединение водорода и кислорода в соотношении два атома водорода на каждый атом кислорода, содержит молекулы H 2 O. Хлорид натрия — это химическое соединение, образованное из натрия (Na) и хлора (Cl) в соотношении 1: 1. Хотя формула хлорида натрия — NaCl, соединение не содержит реальных молекул NaCl. Скорее, он содержит равное количество ионов натрия с положительным зарядом (Na + ) и ионов хлора с отрицательным зарядом (Cl — ).( См. Ниже Тенденции химических свойств элементов, где обсуждается процесс превращения незаряженных атомов в ионы [т.е. частицы с положительным или отрицательным суммарным зарядом].) Вышеупомянутые вещества служат примером двух основных типов химических веществ. соединения: молекулярные (ковалентные) и ионные. Метан и вода состоят из молекул; то есть они являются молекулярными соединениями. С другой стороны, хлорид натрия содержит ионы; это ионное соединение.
Атомы различных химических элементов можно сравнить с буквами алфавита: так же, как буквы алфавита объединяются в тысячи слов, атомы элементов могут объединяться различными способами, образуя бесчисленное множество соединений. .Фактически, известны миллионы химических соединений, и многие миллионы возможны, но еще не открыты или синтезированы. Большинство веществ, встречающихся в природе, таких как древесина, почва и камни, представляют собой смеси химических соединений. Эти вещества могут быть разделены на составляющие их соединения физическими методами, которые не изменяют способ агрегирования атомов в соединениях. Соединения можно разбить на составные элементы путем химических изменений.Химическое изменение (то есть химическая реакция) — это изменение, при котором изменяется организация атомов. Пример химической реакции — горение метана в присутствии молекулярного кислорода (O 2 ) с образованием диоксида углерода (CO 2 ) и воды. CH 4 + 2O 2 → CO 2 + 2H 2 O В этой реакции, которая является примером реакции горения, происходят изменения в способе связывания атомов углерода, водорода и кислорода. в соединениях.
Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчасХимические соединения обладают поразительным набором характеристик. При обычных температурах и давлениях некоторые из них являются твердыми телами, некоторые — жидкостями, а некоторые — газами. Цвета различных составных частей совпадают с цветами радуги. Некоторые соединения очень токсичны для человека, тогда как другие необходимы для жизни. Замена только одного атома в соединении может быть причиной изменения цвета, запаха или токсичности вещества.Чтобы понять это огромное разнообразие, были разработаны системы классификации. В приведенном выше примере соединения классифицируются как молекулярные или ионные. Соединения также подразделяются на органические и неорганические. Органические соединения ( см. Ниже Органические соединения), названные так потому, что многие из них были первоначально изолированы от живых организмов, обычно содержат цепи или кольца атомов углерода. Из-за большого разнообразия способов, которыми углерод может связываться с самим собой и другими элементами, существует более девяти миллионов органических соединений.Соединения, которые не считаются органическими, называются неорганическими соединениями ( см. Ниже Неорганические соединения).
ртуть (Hg)Ртуть (химический символ: Hg) — единственный металлический элемент, который находится в жидком состоянии при комнатной температуре.
© marcel / FotoliaВ рамках широких классификаций органических и неорганических веществ существует множество подклассов, в основном основанных на конкретных элементах или группах присутствующих элементов. Например, среди неорганических соединений оксиды содержат ионы O 2- или атомы кислорода, гидриды содержат ионы H — или атомы водорода, сульфиды содержат ионы S 2- и т. Д.Подклассы органических соединений включают спирты (содержащие группу OH), карбоновые кислоты (характеризующиеся группой COOH), амины (содержащие группу NH 2 ) и так далее.
Различные способности различных атомов объединяться с образованием соединений лучше всего можно понять с помощью периодической таблицы. Периодическая таблица Менделеева была первоначально построена для представления закономерностей, наблюдаемых в химических свойствах элементов ( см. химическая связь). Другими словами, по мере развития химии было обнаружено, что элементы можно сгруппировать в соответствии с их химической реакционной способностью.Элементы с подобными свойствами перечислены в вертикальных столбцах периодической таблицы и называются группами. Когда были раскрыты детали атомной структуры, стало ясно, что положение элемента в периодической таблице коррелирует с расположением электронов, которыми обладают атомы этого элемента ( см. атом). В частности, было замечено, что электроны, определяющие химическое поведение атома, находятся в его внешней оболочке. Такие электроны называются валентными электронами.
Таблица МенделееваПериодическая таблица элементов.
Encyclopædia Britannica, Inc.Например, атомы элементов в группе 1 периодической таблицы все имеют один валентный электрон, атомы элементов в группе 2 имеют два валентных электрона и так далее, до группы 18 , элементы которого содержат восемь валентных электронов. Самое простое и самое важное правило для предсказания того, как атомы образуют соединения, состоит в том, что атомы имеют тенденцию объединяться таким образом, чтобы они могли либо опустошить свою валентную оболочку, либо завершить ее (т.е., заполните его), в большинстве случаев всего с восемью электронами. Элементы в левой части таблицы Менделеева имеют тенденцию терять свои валентные электроны в химических реакциях. Натрий (в Группе 1), например, имеет тенденцию терять свой одинокий валентный электрон с образованием иона с зарядом +1. Каждый атом натрия имеет 11 электронов ( e — ), каждый с зарядом -1, чтобы просто сбалансировать заряд +11 на его ядре. Потеря одного электрона оставляет у него 10 отрицательных зарядов и 11 положительных зарядов, что дает суммарный заряд +1: Na → Na + + e — .Калий, расположенный непосредственно под натрием в группе 1, также образует +1 ион (K + ) в своих реакциях, как и остальные члены группы 1: рубидий (Rb), цезий (Cs) и франций (Fr). Атомы элементов в правом конце периодической таблицы имеют тенденцию вступать в реакции, так что они получают (или разделяют) достаточно электронов, чтобы заполнить свою валентную оболочку. Например, кислород в группе 16 имеет шесть валентных электронов и, следовательно, нуждается в двух дополнительных электронах, чтобы завершить его внешнюю оболочку. Кислород достигает этой договоренности, реагируя с элементами, которые могут терять или делиться электронами.Например, атом кислорода может реагировать с атомом магния (Mg) (в Группе 2), принимая два валентных электрона магния, образуя ионы Mg 2+ и O 2-. (Когда нейтральный атом магния теряет два электрона, он образует ион Mg 2+ , а когда нейтральный атом кислорода получает два электрона, он образует ион O 2-.) В результате образуется ион Mg 2+ и O 2- затем объединяют в соотношении 1: 1 с получением ионного соединения MgO (оксид магния). (Хотя составной оксид магния содержит заряженные частицы, он не имеет чистого заряда, поскольку содержит равное количество ионов Mg 2+ и O 2-.) Аналогичным образом кислород реагирует с кальцием (чуть ниже магния в группе 2) с образованием CaO (оксид кальция). Кислород аналогичным образом реагирует с бериллием (Be), стронцием (Sr), барием (Ba) и радием (Ra), остальными элементами в группе 2. Ключевым моментом является то, что, поскольку все элементы в данной группе имеют одинаковое количество валентных электронов, они образуют аналогичные соединения.
Химические элементы можно классифицировать по-разному. Наиболее фундаментальное разделение элементов — на металлы, которые составляют большинство элементов, и неметаллы.Типичными физическими свойствами металлов являются блестящий внешний вид, пластичность (способность растираться в тонкий лист), пластичность (способность вытягиваться в проволоку), а также эффективная теплопроводность и электрическая проводимость. Самым важным химическим свойством металлов является тенденция отдавать электроны с образованием положительных ионов. Например, медь (Cu) — типичный металл. Он блестящий, но легко тускнеет; это отличный проводник электричества и обычно используется для электрических проводов; и из него легко превращаться в изделия различной формы, такие как трубы для систем водоснабжения.Медь содержится во многих ионных соединениях в форме иона Cu + или Cu 2+ .
Металлические элементы находятся слева и в центре таблицы Менделеева. Металлы групп 1 и 2 называются типичными металлами; те, что находятся в центре периодической таблицы, называются переходными металлами. Лантаноиды и актиноиды, показанные под периодической таблицей, представляют собой особые классы переходных металлов.
Неметаллы, которых относительно мало, находятся в верхнем правом углу таблицы Менделеева, за исключением водорода, единственного неметаллического члена Группы 1.У неметаллов отсутствуют физические свойства, характерные для металлов. В химических реакциях с металлами неметаллы приобретают электроны с образованием отрицательных ионов. Неметаллические элементы также реагируют с другими неметаллами, в этом случае образуя молекулярные соединения. Хлор — это типичный неметалл. При обычных температурах элементарный хлор содержит молекулы Cl 2 и реагирует с другими неметаллами с образованием таких молекул, как HCl, CCl 4 и PCl 3 . Хлор реагирует с металлами с образованием ионных соединений, содержащих ионы Cl — .
Разделение элементов на металлы и неметаллы является приблизительным. Некоторые элементы вдоль разделительной линии проявляют как металлические, так и неметаллические свойства и называются металлоидами или полуметаллами.
Ионные стекла: структура, свойства и классификация
Из-за отсутствия микроструктуры и практически неограниченного разнообразия составов стеклообразные материалы являются идеальными кандидатами для рациональных методов прогнозирования взаимосвязей между структурой и свойствами. В наиболее распространенных моделях структуры стекла трехмерная сетчатая основа и менее локализованные межузельные частицы считаются основными составляющими стекла.Такие теоретические основы не подходят для широкого диапазона стеклообразующих композиций, в которых ковалентные связи не просачиваются и, следовательно, нет сетки в классическом смысле. В первую очередь это относится к классу ионных стекол, которые в настоящее время появляются как отдельный класс аморфных материалов, который включает классические обратные стекла, геометрически фрустрированные соединения, смеси простых солей и ионных жидкостей, а также органические и неорганические гибриды.
Здесь мы критически рассмотрим ионные стекла как отдельную группу материалов, в которых предсказания структуры осложняются преобладанием дальнодействующих связывающих взаимодействий, которым недостает направленности.Во-первых, мы переоценим правила Захариасена и Хэгга для обычного стеклования, чтобы попытаться расширить существующее понимание образования стекла и включить ионные стекла. Анализируя состав и свойства многих простых и сложных стеклообразующих солей, мы видим общие черты ионных стекол и их уникальные характеристики по сравнению с другими классами стекол. В частности, мы обсуждаем важность неперколяционной топологии для динамических свойств, таких как механическое поведение, ионная проводимость, релаксационные процессы и кристаллизация.Мы также демонстрируем актуальность смежных областей ионных жидкостей и аморфных металлоорганических каркасов и выделяем возможности для плодотворного междисциплинарного обмена. Структура ионных стекол, в которой преобладают кулоновские взаимодействия, обеспечивает высокую композиционную гибкость и, следовательно, создает значительные возможности в поиске оптических материалов с расширенными окнами пропускания, проводников с быстрыми ионами, материалов с фазовым переходом или например . , адаптированные припои, герметики и диэлектрические изоляторы.
Что такое оксид? Определение и примеры
Оксид — это ион кислорода со степенью окисления, равной -2 или O 2-. Любое химическое соединение, содержащее O 2- в качестве аниона, также называется оксидом. Некоторые люди более широко применяют этот термин для обозначения любого соединения, в котором кислород выступает в качестве аниона. Оксиды металлов (например, Ag 2 O, Fe 2 O 3 ) являются наиболее распространенной формой оксидов, составляющей большую часть массы земной коры.Эти оксиды образуются, когда металлы реагируют с кислородом воздуха или воды. Хотя оксиды металлов являются твердыми веществами при комнатной температуре, образуются также газообразные оксиды. Вода — это оксид, который является жидкостью при нормальной температуре и давлении. Некоторые из оксидов, обнаруженных в воздухе, — это диоксид азота (NO 2 ), диоксид серы (SO 2 ), монооксид углерода (CO) и диоксид углерода (CO 2 ).
Ключевые выводы: определение оксидов и примеры
- Оксид относится либо к аниону кислорода 2 — (O 2- ), либо к соединению, содержащему этот анион.
- Примеры обычных оксидов включают диоксид кремния (SiO 2 ), оксид железа (Fe 2 O 3 ), диоксид углерода (CO 2 ) и оксид алюминия (Al 2 O 3 ) .
- Оксиды обычно бывают твердыми или газообразными.
- Оксиды образуются естественным образом, когда кислород воздуха или воды реагирует с другими элементами.
Образование оксидов
Большинство элементов образуют оксиды. Благородные газы могут образовывать оксиды, но это происходит редко.Благородные металлы устойчивы к взаимодействию с кислородом, но в лабораторных условиях образуют оксиды. Естественное образование оксидов включает окисление кислородом или гидролиз. Когда элементы горят в богатой кислородом среде (например, металлы в термитной реакции), они легко образуют оксиды. Металлы также реагируют с водой (особенно щелочными металлами) с образованием гидроксидов. Большинство металлических поверхностей покрыто смесью оксидов и гидроксидов. Этот слой часто пассивирует металл, замедляя дальнейшую коррозию от воздействия кислорода или воды.Железо в сухом воздухе образует оксид железа (II), но гидратированные оксиды железа (ржавчина) Fe 2 O 3-x (OH) 2x образуются, когда присутствуют и кислород, и вода.
Номенклатура
Соединение, содержащее оксид-анион, можно просто назвать оксидом. Например, CO и CO 2 оба являются оксидами углерода. CuO и Cu 2 O — оксид меди (II) и оксид меди (I) соответственно. В качестве альтернативы для обозначения можно использовать соотношение между катионом и атомами кислорода.Для именования используются греческие числовые префиксы. Итак, вода или H 2 O — это монооксид дигидрогена. CO 2 — диоксид углерода. СО — диоксид углерода.
Оксиды металлов также могут быть названы с использованием суффикса -a . Al 2 O 3 , Cr 2 O 3 и MgO представляют собой, соответственно, оксид алюминия, оксид хрома и магнезию.
Для оксидов используются специальные названия, основанные на сравнении более низких и высоких степеней окисления кислорода. Под этим наименованием O 2 2- представляет собой пероксид, а O 2 — представляет собой супероксид.Например, H 2 O 2 — перекись водорода.
Структура
Оксиды металлов часто образуют структуры, подобные полимерам, где оксид связывает вместе три или шесть атомов металла. Полимерные оксиды металлов обычно нерастворимы в воде. Некоторые оксиды являются молекулярными. К ним относятся все простые оксиды азота, а также оксид углерода и диоксид углерода.
Что не является оксидом?
Чтобы быть оксидом, степень окисления кислорода должна быть -2, и кислород должен действовать как анион.Следующие ионы и соединения технически не являются оксидами, поскольку не соответствуют этим критериям:
- Дифторид кислорода (OF 2 ) : Фтор более электроотрицателен, чем кислород, поэтому он действует как катион (O 2+ ), а не как анион в этом соединении.
- Диоксигенил (O 2 + ) и его соединения : Здесь атом кислорода находится в степени окисления +1.
Источники
- Чатман, С.; Zarzycki, P .; Россо, К. М. (2015). «Самопроизвольное окисление воды на гранях кристаллов гематита (α-Fe2O3)». Прикладные материалы и интерфейсы ACS . 7 (3): 1550–1559. DOI: 10.1021 / am5067783
- Cornell, R.M .; Швертманн, У. (2003). Оксиды железа: структура, свойства, реакции, встречаемость и использование (2-е изд.). DOI: 10.1002 / 3527602097. ISBN 9783527302741.
- Кокс, П.А. (2010). Оксиды переходных металлов. Введение в их электронную структуру и свойства .Издательство Оксфордского университета. ISBN 9780199588947.
- Greenwood, N. N .; Эрншоу, А. (1997). Химия элементов (2-е изд.). Оксфорд: Баттерворт-Хайнеманн. ISBN 0-7506-3365-4.
- ИЮПАК (1997). Сборник химической терминологии (2-е изд.) («Золотая книга»). Составлено А. Д. Макнотом и А. Уилкинсоном. Научные публикации Блэквелла, Ox ford.
Оксид натрия | AMERICAN ELEMENTS ®
РАЗДЕЛ 1.ИДЕНТИФИКАЦИЯ
Наименование продукта: Оксид натрия
Номер продукта: Все применимые коды продуктов American Elements, например NA-OX-80
Номер CAS: 1313-59-3
Соответствующие установленные области применения вещества: Научные исследования и разработки
Информация о поставщике:
American Elements
10884 Weyburn Ave.
Los Angeles , CA
Тел: +1 310-208-0551
Факс: +1 310-208-0351
Телефон экстренной связи:
Внутренний, Северная Америка: +1 800-424-9300
Международный: +1 703 -527-3887
РАЗДЕЛ 2.ИДЕНТИФИКАЦИЯ ОПАСНОСТИ
Классификация вещества или смеси в соответствии с 29 CFR 1910 (OSHA HCS)
GHS05 Коррозия
Skin Corr. 1B h414 Вызывает серьезные ожоги кожи и повреждения глаз.
Eye Dam. 1 h418 Вызывает серьезное повреждение глаз.
Опасности, не классифицируемые иным образом Данные отсутствуют
Элементы маркировки GHS, включая меры предосторожности
Пиктограммы опасности
GHS05
Сигнальное слово Опасно
Краткая характеристика опасности
h414 Вызывает серьезные ожоги кожи и повреждения глаз.
Меры предосторожности
P260 Избегать вдыхания пыли / дыма / газа / тумана / паров / аэрозолей.
P303 + P361 + P353 При попадании на кожу (или волосы): немедленно снять всю загрязненную одежду. Промыть кожу водой / принять душ.
P305 + P351 + P338 ПРИ ПОПАДАНИИ В ГЛАЗА: осторожно промыть глаза водой в течение нескольких минут. Снимите контактные линзы, если они есть и это легко сделать. Продолжайте полоскание.
P301 + P330 + P331 ПРИ ПРОГЛАТЫВАНИИ: прополоскать рот. Не вызывает рвоту.
P405 Хранить под замком.
P501 Утилизировать содержимое / контейнер в соответствии с местными / региональными / национальными / международными правилами.
Классификация WHMIS
D2B — Токсичный материал, вызывающий другие токсические эффекты
E — Коррозийный материал
Система классификации
Рейтинги HMIS (шкала 0-4)
(Система идентификации опасных материалов)
ЗДОРОВЬЕ
ПОЖАР
РЕАКТИВНОСТЬ
3
0
2
Здоровье (острые эффекты) = 3
Воспламеняемость = 0
Физическая опасность = 2
Другие опасности
Результаты оценки PBT и vPvB
PBT: N / A
vPvB: N / A
РАЗДЕЛ 3. СОСТАВ / ИНФОРМАЦИЯ О КОМПОНЕНТАХ
Вещества
CAS No./ Название вещества:
1313-59-3 Оксид натрия
Идентификационный номер:
Номер ЕС: 215-208-9
РАЗДЕЛ 4. МЕРЫ ПЕРВОЙ ПОМОЩИ
Описание мер первой помощи
Общая информация Немедленно удалите все одежда, загрязненная продуктом.
При вдыхании:
Обеспечьте пациента свежим воздухом. Если не дышит, сделайте искусственное дыхание. Держите пациента в тепле.
Немедленно обратитесь за медицинской помощью.
При попадании на кожу:
Немедленно промыть водой с мылом; тщательно промыть.
Немедленно обратитесь за медицинской помощью.
При попадании в глаза:
Промыть открытый глаз под проточной водой в течение нескольких минут. Проконсультируйтесь с врачом.
При проглатывании:
Обратитесь за медицинской помощью.
Информация для врача
Наиболее важные симптомы и воздействия, как острые, так и замедленные.
Вызывает серьезные ожоги кожи.
Вызывает серьезное повреждение глаз.
Указание на необходимость немедленной медицинской помощи и специального лечения:
Данные отсутствуют
РАЗДЕЛ 5. МЕРЫ ПОЖАРОТУШЕНИЯ
Средства пожаротушения
Подходящие средства тушения CO2, песок, порошковое средство для тушения.Не используйте воду.
Средства пожаротушения, непригодные из соображений безопасности Вода
Особые опасности, исходящие от вещества или смеси
Бурно реагирует с водой
При пожаре могут образоваться следующие вещества:
Рекомендации для пожарных
Защитное снаряжение:
Самостоятельно содержал респиратор.
Надеть полностью защитный непромокаемый костюм.
РАЗДЕЛ 6. МЕРЫ ПРИ СЛУЧАЙНОМ ВЫБРОСЕ
Меры личной безопасности, защитное снаряжение и порядок действий в чрезвычайной ситуации
Используйте средства индивидуальной защиты.Не подпускайте незащищенных людей.
Обеспечьте соответствующую вентиляцию.
Меры по защите окружающей среды: Не допускайте попадания материала в окружающую среду без официального разрешения.
Методы и материалы для локализации и очистки:
Используйте нейтрализующий агент.
Утилизируйте зараженный материал как отходы в соответствии с разделом 13.
Обеспечьте соответствующую вентиляцию.
Не смывать водой или водными чистящими средствами.
Предотвращение вторичных опасностей: Никаких специальных мер не требуется.
Ссылка на другие разделы
См. Раздел 7 для получения информации о безопасном обращении.
См. Раздел 8 для получения информации о средствах индивидуальной защиты.
Информацию об утилизации см. В Разделе 13.
РАЗДЕЛ 7. ОБРАЩЕНИЕ И ХРАНЕНИЕ
Обращение
Меры предосторожности для безопасного обращения
Работать в атмосфере сухого защитного газа.
Хранить контейнер плотно закрытым.
Хранить в сухом прохладном месте в плотно закрытой таре.
Обеспечьте хорошую вентиляцию на рабочем месте.
Информация о защите от взрывов и пожаров: Данные отсутствуют.
Условия безопасного хранения с учетом любых несовместимостей.
Требования, предъявляемые к складским помещениям и таре: Нет специальных требований.
Информация о хранении в одном общем хранилище:
Не хранить вместе с кислотами.
Хранить вдали от воздуха.
Хранить вдали от воды / влаги.
Дополнительная информация об условиях хранения:
Хранить в сухом инертном газе.
Этот продукт чувствителен к влаге.
Этот продукт чувствителен к воздуху.
Беречь от влаги и воды.
Хранить контейнер плотно закрытым.
Хранить в прохладном, сухом месте в хорошо закрытых емкостях.
Особые виды конечного использования Нет данных
РАЗДЕЛ 8.КОНТРОЛЬ ВОЗДЕЙСТВИЯ / ИНДИВИДУАЛЬНАЯ ЗАЩИТА
Дополнительная информация о конструкции технических систем:
Правильно работающий вытяжной шкаф для химических веществ, предназначенный для опасных химикатов и имеющий среднюю скорость движения не менее 100 футов в минуту.
Параметры контроля
Компоненты с предельными значениями, требующие контроля на рабочем месте:
Нет.
Дополнительная информация: Нет данных
Средства контроля за опасным воздействием
Средства индивидуальной защиты
Соблюдайте стандартные правила защиты и гигиены при обращении с химическими веществами.
Хранить вдали от продуктов питания, напитков и кормов.
Немедленно снимите всю грязную и загрязненную одежду.
Мыть руки перед перерывами и по окончании работы.
Избегать контакта с глазами и кожей.
Поддерживайте эргономичную рабочую среду.
Дыхательное оборудование: При высоких концентрациях используйте подходящий респиратор.
Защита рук:
Непроницаемые перчатки
Осмотрите перчатки перед использованием.
Выбор подходящих перчаток зависит не только от материала, но и от качества.Качество будет варьироваться от производителя к производителю.
Время проницаемости материала перчаток (в минутах) Данные отсутствуют
Защита глаз:
Плотно закрытые очки
Полная защита лица
Защита тела: Защитная рабочая одежда.
РАЗДЕЛ 9. ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА
Информация об основных физических и химических свойствах
Внешний вид:
Форма: порошок, шарики или твердое вещество в различных формах
Цвет: от белого до серого
Запах: без запаха
Порог запаха: нет данных имеется в наличии.
pH: N / A
Точка плавления / интервал плавления:> 400 ° C (> 752 ° F) (разл.)
Точка кипения / интервал кипения: данные отсутствуют
Температура сублимации / начало: данные отсутствуют
Воспламеняемость (твердое, газ) Нет данных.
Температура возгорания: данные отсутствуют
Температура разложения: данные отсутствуют
самовоспламенение: данные отсутствуют.
Взрывоопасность: данные отсутствуют.
Пределы взрываемости:
Нижний: данные отсутствуют
Верхние: данные отсутствуют
Давление пара: нет
Плотность при 20 ° C (68 ° F): 2.27 г / см 3 (18,943 фунта / галлон)
Относительная плотность Нет данных.
Плотность пара Нет данных
Скорость испарения Нет данных
Растворимость в / Смешиваемость с
Вода: Реагирует бурно
Коэффициент распределения (н-октанол / вода): Нет данных.
Вязкость:
Динамическая: Нет
Кинематическая:
Другая информация Нет данных
РАЗДЕЛ 10. СТАБИЛЬНОСТЬ И РЕАКЦИОННАЯ СПОСОБНОСТЬ
Реакционная способность Бурно реагирует с водой.
Химическая стабильность Стабилен при соблюдении рекомендуемых условий хранения.
Термическое разложение / условия, которых следует избегать: При использовании и хранении в соответствии со спецификациями разложения не происходит.
Возможность опасных реакций Бурно реагирует с водой
Условия, которых следует избегать Данные отсутствуют
Несовместимые материалы:
Кислоты
Воздух
Вода / влага
Опасные продукты разложения: Окись углерода и двуокись углерода
РАЗДЕЛ 11. ТОКСИКОЛОГИЧЕСКАЯ ИНФОРМАЦИЯ
токсикологические эффекты
Острая токсичность: Проглатывание приводит к сильному разъеданию рта и горла и к опасности перфорации пищевода и желудка.
Значения LD / LC50, имеющие отношение к классификации: Нет данных
Раздражение или разъедание кожи: Вызывает серьезные ожоги кожи.
Раздражение или коррозия глаз: Вызывает серьезное повреждение глаз.
Сенсибилизация: сенсибилизирующие эффекты неизвестны.
Мутагенность зародышевых клеток: Эффекты неизвестны.
Канцерогенность: Нет данных о классификации канцерогенных свойств этого материала от EPA, IARC, NTP, OSHA или ACGIH.
Репродуктивная токсичность: Эффекты неизвестны.
Специфическая системная токсичность, поражающая отдельные органы-мишени — повторное воздействие: Эффекты неизвестны.
Специфическая системная токсичность, поражающая отдельные органы-мишени при однократном воздействии: Эффекты неизвестны.
Опасность при вдыхании: Воздействие неизвестно.
От подострой до хронической токсичности: Эффекты неизвестны.
Дополнительная токсикологическая информация: Насколько нам известно, острая и хроническая токсичность этого вещества полностью не изучена.
РАЗДЕЛ 12. ЭКОЛОГИЧЕСКАЯ ИНФОРМАЦИЯ
Токсичность
Водная токсичность: данные отсутствуют
Стойкость и разлагаемость Данные отсутствуют
Потенциал биоаккумуляции Нет данных
Подвижность в почве Данные отсутствуют
Дополнительная экологическая информация:
Не допускать образования материала выпущен в окружающую среду без официальных разрешений.
Не допускайте попадания неразбавленного продукта или больших количеств продукта в грунтовые воды, водоемы или канализационные системы.
Избегать попадания в окружающую среду.
Результаты оценки PBT и vPvB
PBT: N / A
vPvB: N / A
Другие побочные эффекты Нет данных
РАЗДЕЛ 13. УТИЛИЗАЦИЯ
Методы обработки отходов
Рекомендации Для обеспечения надлежащей утилизации обратитесь к официальным правилам.
Неочищенная тара:
Рекомендация: Утилизация должна производиться в соответствии с официальными предписаниями.
РАЗДЕЛ 14. ИНФОРМАЦИЯ ПО ТРАНСПОРТИРОВКЕ
Номер ООН
DOT, IMDG, IATA UN1825
Собственное транспортное наименование ООН
DOT Окись натрия
IMDG, IATA ОКИСЬ НАТРИЯ
Класс опасности при транспортировке
DOT
Класс 8 Коррозионные вещества.
Этикетка 8
Класс 8 (C6) Коррозионные вещества
Этикетка 8
IMDG, IATA
Класс 8 Коррозионные вещества.
Наклейка 8
Группа упаковки
DOT, IMDG, IATA II
Опасности для окружающей среды: N / A
Особые меры предосторожности для пользователя Предупреждение: Коррозионные вещества
Номер EMS: FA, SB
Группы разделения Щелочи
Транспортировка навалом в соответствии с Приложением II MARPOL73 / 78 и код IBC N / A
Транспортировка / Дополнительная информация:
DOT
Морской загрязнитель (DOT): №
Типовой регламент ООН: UN1825, окись натрия, 8, II
РАЗДЕЛ 15.НОРМАТИВНАЯ ИНФОРМАЦИЯ
Нормы / законодательные акты по безопасности, охране здоровья и окружающей среды, относящиеся к веществу или смеси
Элементы маркировки GHS, включая меры предосторожности
Пиктограммы опасности
GHS05
Сигнальное слово Опасно
Предупреждения об опасности
h414 Вызывает серьезные ожоги кожи и повреждения глаз.
Меры предосторожности
P260 Избегать вдыхания пыли / дыма / газа / тумана / паров / аэрозолей.
P303 + P361 + P353 При попадании на кожу (или волосы): немедленно снять всю загрязненную одежду.Промыть кожу водой / принять душ.
P305 + P351 + P338 ПРИ ПОПАДАНИИ В ГЛАЗА: осторожно промыть глаза водой в течение нескольких минут. Снимите контактные линзы, если они есть и это легко сделать. Продолжайте полоскание.
P301 + P330 + P331 ПРИ ПРОГЛАТЫВАНИИ: прополоскать рот. Не вызывает рвоту.
P405 Хранить под замком.
P501 Утилизировать содержимое / контейнер в соответствии с местными / региональными / национальными / международными правилами.
Национальные правила
Все компоненты этого продукта перечислены в Реестре химических веществ в соответствии с Законом о контроле за токсичными веществами Агентства по охране окружающей среды США.
Все компоненты этого продукта занесены в Канадский список веществ, предназначенных для домашнего использования (DSL).
SARA Раздел 313 (списки конкретных токсичных химикатов) Вещество не указано.
Предложение 65 штата Калифорния
Предложение 65 — Химические вещества, вызывающие рак. Вещества не указаны.
Предложение 65 — Токсичность для развития Вещество не указано.
Предложение 65 — Токсичность для развития, женская Вещество не перечислено.
Предложение 65 — Токсичность для развития, мужские вещества Вещество не указано.
Информация об ограничении использования: Для использования только технически квалифицированными специалистами.
Другие постановления, ограничения и запретительные постановления
Вещество, вызывающее особую озабоченность (SVHC) в соответствии с Регламентом REACH (EC) № 1907/2006. Вещества нет в списке.
Условия ограничений согласно Статье 67 и Приложению XVII Регламента (ЕС) № 1907/2006 (REACH) для производства, размещения на рынке
и использования должны соблюдаться.
Вещества нет в списке.
Приложение XIV Правил REACH (требуется разрешение на использование) Вещество не указано.
Оценка химической безопасности: Оценка химической безопасности не проводилась.
РАЗДЕЛ 16. ПРОЧАЯ ИНФОРМАЦИЯ
Паспорт безопасности в соответствии с Регламентом (ЕС) № 1907/2006 (REACH). Вышеупомянутая информация считается правильной, но не претендует на исчерпывающий характер и должна использоваться только в качестве руководства. Информация в этом документе основана на текущем уровне наших знаний и применима к продукту с учетом соответствующих мер безопасности.Это не является гарантией свойств продукта. American Elements не несет ответственности за любой ущерб, возникший в результате обращения или контакта с вышеуказанным продуктом. Дополнительные условия продажи см. На обратной стороне счета-фактуры или упаковочного листа. АВТОРСКИЕ ПРАВА 1997-2021 AMERICAN ELEMENTS. ЛИЦЕНЗИОННЫМ ДАННЫМ РАЗРЕШЕНО ИЗГОТОВЛЕНИЕ НЕОГРАНИЧЕННЫХ КОПИЙ БУМАГИ ТОЛЬКО ДЛЯ ВНУТРЕННЕГО ИСПОЛЬЗОВАНИЯ
Классификация токсичности оксидных наноматериалов: эффекты заполнения пробелов в данных и подходы к скринингу на основе баллов PChem
Сбор данных
На рисунке 1 представлена сводная информация о рабочем процессе для метаанализа с подробностями, описанными в разделе «Методы».Из базы данных S2NANO (www.s2nano.org) 6842 строки данных по 1) физико-химическим (PChem) свойствам и методам их измерения, 2) квантово-механическим (QM) свойствам и 3) экспериментальным условиям in vitro и жизнеспособности клеток ( Tox) были извлечены и скомпилированы как набор данных для 26 НЧ оксидов металлов. Обзор набора данных показан в Таблице 1 и Дополнительной Таблице 1. Атрибуты PChem, которыми были размер керна, гидродинамический размер, поверхностный заряд и удельная площадь поверхности, были выбраны в соответствии с рекомендациями всестороннего обзора Puzyn et al. . 14 . Методы измерения атрибутов PChem были включены только в целях оценки и отбора данных, но не использовались впоследствии при разработке модели. Набор данных также включает атрибуты Tox для экспериментальных условий оценки токсичности: анализ, название клетки, вид клеток, происхождение клеток, тип клеток, время воздействия и дозировку. Атрибут «имя ячейки» содержал более 50 элементов, что было чрезмерным и могло ухудшить обобщаемость модели 9 , поэтому он был исключен из процесса разработки модели.Жизнеспособность клеток не использовалась в качестве атрибута при разработке модели, но была включена в число атрибутов Tox, поскольку использовалась для определения конечной точки классификации. В дополнение к этим атрибутам, извлеченным непосредственно из базы данных S2NANO, были включены свойства QM (энтальпия образования, энергия зоны проводимости и валентной зоны, электроотрицательность), поскольку они, как сообщалось, коррелировали с конечными точками токсичности НЧ. Чжан и др. . 15 использовали электроотрицательность, зону проводимости и энергию валентной зоны для прогнозирования окислительного стресса и острого легочного воспаления 24 НЧ оксидов металлов.Аналогичным образом Лю и др. . 4 разработал классификационную модель, описывающую цитотоксичность 9 наночастиц оксидов металлов, основанную на энергии атомизации оксидов металлов. В нашем наборе данных конкретный NP может подвергаться воздействию нескольких клеточных линий в нескольких концентрациях в течение разной продолжительности и тестироваться с помощью различных анализов. Вот почему один NP занимал более одной строки данных, в которых атрибуты PChem и QM были одинаковыми, но атрибуты Tox описывали разные клеточные линии, анализы, дозу, время и процент жизнеспособности.
Рисунок 1Рабочий процесс сбора данных, предварительной обработки, разработки модели, проверки и интерпретации.
Поскольку первый принцип (Q) SAR проверки ОЭСР предполагает определенную конечную точку 16 , конечные точки классификации «токсичный» и «нетоксичный» в этом исследовании были четко определены. Строка данных была помечена как «Токсичная», если процент жизнеспособности был менее 50%; в противном случае он считался «нетоксичным». В отличие от назначения класса в Лю и др. . 4,5 , который был основан на NP, при присвоении этого класса учитывались условия подверженности риску.Это сделало бы интерпретацию более ясной относительно того, является ли NP с определенным набором свойств PChem и QM токсичными или нетоксичными в определенных условиях воздействия.
Влияние заполнения пробелов данных и проверки качества данных на производительность модели
Неоднородность литературных данных привела к множеству пропущенных значений и различным уровням качества. Как показано на рис. 2а, в исходном наборе данных значительная часть пропущенных значений в атрибутах PChem: 18% данных о размере керна, 39% данных о гидродинамических размерах, 41% данных о заряде поверхности и 74% данных об удельной поверхности.Чтобы преодолеть эту проблему, мы предложили подход к заполнению пробелов в данных (см. Методы). Поскольку мы специально выбрали публикации, которые предоставляют данные о нанотоксичности, отсутствовали пропущенные значения и необходимость в заполнении пробелов данных в атрибутах Tox или конечной точке. Были только отсутствующие значения в атрибутах PChem, потому что в некоторых публикациях не сообщается о характеристиках НЧ. На основании ранее описанных критериев Климиш и др. . 17 и Любински и др. . 13 , мы разработали собственные критерии оценки с учетом свойств PChem (то есть балла PChem), чтобы справиться с различными уровнями качества данных. Мы расширили предыдущие работы, используя наборы данных, проверенные по шкале PChem, для разработки моделей нано-SAR, чтобы изучить влияние качества данных на производительность модели. Критерии, используемые для расчета баллов PChem, показаны в таблице 2, а подробности процедуры подсчета баллов описаны в разделе «Методы». При таком наборе критериев максимальный балл составлял 5, а минимальный — 0.
Рисунок 2( a ) Отсутствует карта данных для атрибутов PChem в исходном наборе данных; ( b ) Наборы данных с разными этапами предварительной обработки; ( c ) Влияние заполнения пробелов в данных на распределение баллов PChem.
Таблица 2 Правила оценки для данных PChem.Мы разделили исходный набор данных на несколько поднаборов данных в зависимости от их подхода к заполнению пробелов в данных и оценок PChem (рис. 2b). Исходный набор данных содержал отсутствующие значения и был обозначен как «Набор данных I».Поскольку пропущенные значения не допускались и должны быть вменены во время процедуры разработки модели, для отсутствующих значений в наборе данных был применен подход замещения среднего значения. Однако баллы PChem вмененных данных остались прежними, поскольку в модели выполнялась замена среднего. Процедура разработки, которая проводилась после завершения этапа оценки, как показано на рис. 1. Затем пропущенные значения обрабатывались методом заполнения пробелов с использованием спецификаций и / или оценок производителей, и результирующий набор данных был обозначен как «Набор данных II ».В Dataset II оценки PChem были изменены в соответствии с заполнением пробелов в данных. Затем набор данных был проверен на основе оценки PChem: первые 50% и 20% данных в порядке убывания оценок PChem были обозначены как III-A и III-B, соответственно. На основе этих наборов данных были разработаны модели нано-SAR с использованием алгоритма случайного леса, и их производительность сравнивалась, чтобы исследовать влияние методов предварительной обработки данных на качество моделей нано-SAR.
Распределение оценок PChem для исходного набора данных и набора данных, обработанных с использованием подхода заполнения пробелов в данных, представлено на рис.2c. В исходном наборе данных (набор данных I) большинство оценок было распределено от 1 до 4. Замена отсутствующих значений спецификациями и / или оценками производителей значительно сместила распределение в область высоких баллов с 4 до 5 (набор данных II ). Это указывает на то, что некоторым образцам, изначально имевшим пропущенные значения, были присвоены низкие оценки, но их оценки резко улучшились, когда недостающие значения были заполнены с помощью подхода заполнения пробелов в данных. Этап замены не только уменьшил количество пропущенных значений, но также переместил распределение оценок PChem на более высокий уровень и увеличил количество используемых данных для разработки модели нано-SAR.
Показатели производительности модели (т.е. чувствительность, точность, точность и оценка F1) пяти повторений при внешней проверке были усреднены для каждого набора данных и приведены в таблице 3, а показатели производительности при перекрестной проверке представлены в дополнительной таблице 2. Из набор данных от I до II, до III-A и до III-B, все показатели производительности постоянно увеличиваются. Увеличение количества данных от I к II подтвердило, что предложенный нами подход к заполнению пробелов в данных эффективен для замены отсутствующих значений и повышения предсказуемости модели.Подход к заполнению пробелов в данных систематически заменял недостающие значения и тем самым повышал качество данных, а также объем данных, которые можно использовать для моделирования нанорасширяющего излучения. Этот метод заполнения пробелов в данных был бы особенно подходящим для таких внутренних свойств, как размер ядра и удельная площадь поверхности, поскольку эти свойства не зависят от экспериментальных условий. Увеличение от набора данных II (без проверки) до III-A (с верхними 50% данных с высоким баллом PChem), а затем до III-B (с верхними 20% данными с высоким баллом PChem) указывает на то, что наборы данных имеют более высокие баллы будет производить модели с лучшей предсказуемостью.Оценка PChem позволила отфильтровать данные высокого качества для повышения производительности модели.
Таблица 3 Результаты проверки моделей, построенных на наборах данных с различными этапами предварительной обработки.Хотя показатели эффективности были высокими, прогнозы не были сбалансированы между токсичными и нетоксичными классами, особенно в наборе данных I, где чувствительность, показывающая степень истинного прогноза токсичности, была очень скромной и составляла 3%. Это было вызвано дисбалансом между классами токсичных и нетоксичных веществ в наборе данных.Этот дисбаланс может нарушить обобщение моделей, делая прогнозы смещенными в пользу доминирующего класса. На рисунке 3 показано количество строк данных в токсичных и нетоксичных классах в каждом наборе данных. Можно видеть, что все четыре набора данных страдали от проблемы дисбаланса, когда большинство строк данных принадлежало нетоксичному классу. В этой ситуации оценка F1 была более подходящей для оценки производительности модели, чем ее точности. Как и ожидалось, оценка F1 для набора данных I была очень низкой, всего 6%.Хотя он увеличился для наборов данных II, III-A и III-B, его максимум составил всего 89%. Чтобы улучшить производительность модели, мы попытались решить эту проблему дисбаланса данных с помощью техники передискретизации SMOTE и обсудили ее в другой рукописи.
Рис. 3Сравнение строк «Токсичные» и «Нетоксичные» в обучающем наборе ( a ) и тестовом наборе ( b ) каждого набора данных.
Область применимости
Общее определение области применимости (AD) было предложено Нетзевой и др. .на семинаре 52 nd Европейского центра валидации альтернативных методов (ECVAM): «Область применимости модели QSAR — это пространство отклика и химической структуры, в котором модель делает прогнозы с заданной надежностью» 18 . Прогнозы новых точек данных, которые находятся в AD, имеют высокую надежность, но могут быть не такими надежными, если новые данные сильно отличаются от обучающего набора 19,20,21 . Поскольку третий принцип ОЭСР предлагает определенную область применимости 16 , AD разработанных моделей нано-SAR в этом исследовании были проанализированы с помощью алгоритма k-ближайших соседей с использованием взвешенного евклидова расстояния (см. Методы).AD в отношении числовых атрибутов четырех моделей, разработанных на основе четырех наборов данных, показаны в таблице 4 (AD в отношении номинальных атрибутов показаны в дополнительной таблице 5). В наборе данных II любые строки данных, содержащие пропущенные значения, которые не могли быть заполнены методом заполнения пробелов в данных, были удалены, поэтому граница набора данных II была уже, чем у набора данных I. От наборов данных II к III-A и к III-B , объявления вообще стали меньше. Это было связано с тем, что наборы данных прошли этап проверки качества данных, на котором сохранялись данные с высокими оценками PChem и удалялись данные с низкими оценками PChem, что уменьшало объем данных и, следовательно, ограничивало AD.Это означает, что в обмен на высококачественные обучающие данные и точный прогноз AD может стать узким. В публикации Тонга и др. . 22 , авторы сообщили о снижении точности прогноза для двух моделей, касающихся активности связывания рецептора эстрогена, по мере того, как образцы данных отклонялись дальше от обучающей области. Точность снизилась более чем на 50%, когда образцы данных находились примерно на 30% от домена. Однако в некоторых случаях, таких как энергия валентной зоны (E v ) и электроотрицательность (χ) от III-A до III-B, области расширялись по мере того, как наборы данных проверялись с более высокими баллами.Возможно, это было вызвано распределением данных. В некоторых наборах данных данные были распределены неравномерно, и некоторые точки данных могут располагаться далеко от большинства. Когда мы применили алгоритм k-ближайших соседей, эти смещенные точки данных будут исключены и вызовут сокращение AD.
Таблица 4 Области применимости числовых атрибутов.Важность атрибута
В таблице 5 показаны результаты внешней проверки для моделей классификации, разработанных с наборами данных, имеющими различные комбинации категорий атрибутов (результаты перекрестной проверки представлены в дополнительной таблице 3).Вводимая доза использовалась во всех наборах данных, поскольку уже хорошо известно, что она напрямую влияет на цитотоксичность НЧ с наибольшей ошибкой OOB (рис. 4). В случае наборов данных с дозой и одной дополнительной категорией атрибутов (например, атрибуты PChem, QM или Tox) добавление атрибутов PChem дало более высокую точность прогноза и оценку F1, чем добавление атрибутов QM или Tox. После этого атрибуты PChem сохранялись в наборах данных вместе с дозой, и каждая из двух других категорий атрибутов добавлялась поочередно.На этот раз добавление атрибутов Tox дало лучшую производительность, чем добавление атрибутов QM. Эти результаты означают, что атрибуты PChem были наиболее важными среди этих трех категорий атрибутов, и они стали более влиятельными в сочетании с атрибутами Tox. Это также хорошо согласуется с результатами, приведенными на рис. 4, который показывает относительную важность всех атрибутов, оцененных путем сравнения ошибок OOB с исключением одного-единственного. Были найдены первые шесть атрибутов с наибольшими ошибками OOB: доза, тип анализа, время воздействия, площадь поверхности, размер ядра и гидродинамический размер.Этот результат показал, что эти атрибуты, которые принадлежали к категориям Tox и PChem, были более актуальны для цитотоксичности наночастиц оксидов металлов, чем другие атрибуты QM.
Таблица 5 Результаты проверки моделей, построенных на наборах данных с различными комбинациями атрибутов. Рисунок 4Устранение одноразовых ошибок OOB для атрибутов.
Как показано выше, атрибуты PChem вместе с введенной дозой, типом анализа и временем воздействия оказали значительное влияние на цитотоксичность НЧ.Ранее сообщалось, что размер ядра 23,24,25,26 , гидродинамический размер 27,28 и поверхностный заряд 26 НЧ оказывают критическое влияние на процесс их клеточной интернализации, в то время как удельная площадь поверхности связана с реакционной способностью.