урок химии « Оксиды. Основания. Кислоты» — Лицей №14
Разработка урока химии в 8 классе
по теме: « Оксиды. Основания. Кислоты»
подготовила учитель химии и биологии
высшей квалификационной категории
МАОУ лицей №14 «Экономический»
Кофанова Людмила Владимировн
Ростов-на-Дону
2012 г.
Тема: «Оксиды. Основания. Кислоты».
(Обобщение, закрепление и расширение знаний обучающихся о классах неорганических соединений).
Задачи:
— акцентировать внимание обучающихся на основных признаках и свойствах веществ,
как представителей классов неорганических соединений;
— продолжить развитие умений анализа, синтеза, умений обобщать и делать выводы;
— формировать умения работать с различными источниками информации;
— формировать умения записывать формулы веществ;
— совершенствовать способности обучающихся к самоанализу и самооценке;
— воспитывать чувство взаимопомощи и доброжелательного отношения друг к другу.
Данный урок является обобщающим в теме «Соединения химических элементов» (химия 8 класс, программа Рудзитис, Фельдман) с использованием учебно-лабораторного оборудования нового поколения для проведения уроков химии.
Компьютерные технологии позволяет излагать достаточно абстрактный материал эмоционально насыщенными визуальными образами.
Урок сохраняет уровень креативности – обучающиеся активно участвуют в работе, тактильно создают информацию.
Использование игровой формы урока способствует активному развитию детей, поскольку происходит естественное саморазвёртывание системы, её расширение. Играя в новой среде, имеющей, большие и разнообразные возможности, ребёнок учиться манипулировать сложной средой, моделировать различные ситуации.
В ходе данного урока средствами компьютера, организацией групповой работы решается проблема диалогичности детей при работе с компьютером (выведение на экран результатов групповой деятельности), развития навыков коммуникативности (через групповую работу), пользование средствами мультимедиа (Интернет, литературные источники, создание презентации) конкурс «Домашнее задание».
Здоровьесберегающим компонентом урока является разминка и релаксминутка, разнообразие видов и форм деятельности, психологическая поддержка группы.
Цели урока:
— закрепить учебный материал по пройденным темам с помощью заданий, связанных с развитием творческих способностей, и стандартных задач;
— отработать умения различать химические формулы различных классов веществ;
— отработать умения составлять формулы исходных веществ по их названиям.
— продолжить развитие речевых навыков, наблюдательности и умения делать выводы на основе наблюдений, интереса к предмету, детской фантазии и представлений;
— совершенствовать культуру организации эксперимента; установить связь теории с практикой на примере перехода из одного класса в другой.
Тип урока: обобщения и систематизации знаний.
Планируемые результаты обучения :
- Обучающиеся должны уметь составлять химические формулы оксидов, оснований и кислот.
- Знать состав и номенклатуру неорганических веществ.
- Уметь переходить от веществ одного класса к веществам другого класса;
- Уметь объяснять причины многообразия веществ в природе, их материальное единство.
- Уметь сравнивать основания и кислоты по составу.
ХОД УРОКА
I. Организационный момент.
Организационный момент.
Проводится разминка, задавая вопросы, цель которых – подготовить обучающихся к активной учебной деятельности на уроке.
· О каком камне мечтает каждая женщина?
(Алмаз.)
· Инициалы Менделеева?
(Д.И.)
· Как называется расстояние от центра окружности до точки, лежащей на ней?
(Радиус.)
· В дроби над чертой пишем…
(Числитель.)
· Чем дышит все живое на Земле?
(Кислород.)
· Как называется профессия человека, изучающего погодные явления?
(Метеоролог.)
Показ слайда 1
Сегодня у нас урок – обобщение. Давайте вместе с вами постараемся определить, что нам необходимо повторить? Какое лабораторное оборудование используется для изучения данной темы?
Показ слайда 2
II. Проверка домашнего задания.
Устный фронтальный опрос.
- 1. Что называют оксидами?
Показ слайдов 3, 4
- 2. Какие бывают оксиды?
Показ слайдов 5
- 3. Какие вещества называют основаниями?
Показ слайда 6
- 4. Что называют кислотами?
Показ слайда 7
- 5. С какими кислотами вы познакомились?
Показ слайдов 8, 9
6. Проверка изученного материала игра «Кто лишний?»
Показ слайда 10
- 7. С помощью чего можно распознать кислоты и основания? Покажите, какое лабораторное оборудование используется для этого?
Показ слайдов 11, 12
Химический диктант:
- Кислота, которая вырабатывается во время принятия пищи.
 Способствует пищеварению. HCl
Способствует пищеварению. HCl - Едкий натр. Мылкое на ощупь, входит в состав мыла. Разъедает кожу, ткани. NaOH
- Оксид водорода, самый распространенный оксид. Н2О
- Молекулярный кислород, поддерживающий дыхание и горение. О2
- Отработанный газ, который мы выдыхаем (все живое). СО2
- Входит в состав кремнезема, горного хрусталя, стекла. SiO2
III. Актуализация знаний обучающихся.
Оставшееся время используется на уроке для выполнения тренировочных упражнений по темам «Оксиды», «Основания», « Кислоты».
Работа в группах.
- 1. Распределить вещества по классам, оформить согласно предложенной таблице.
K2O, HCl, HNO3, CuO, H2SO4, Al2O3, Na2O, H2S, SO3, Ca(OH)2.
| Оксиды | Основания | Кислоты |
Проверка ведется другой группой. Показ слайда 13
Проверка тетрадей. Показ слайда 14
- 2. Составить формулы веществ:
Показ слайда 15
- 3. Составить формулы оксидов элементов: магния, калия, алюминия, фосфора (V), хлора (VII), железа (III), углерода (IV), серы (VI).
Показ слайда 16
- 4. Написать формулы оснований и кислот, которые соответствуют данным оксидам: Показ слайдов 17
SО3, Na2О, Al2O3, СО2, ВаО
Комментарии. В заданиях 3 разделить сразу оксиды на основные и кислотные. У доски по одному обучающемуся каждого варианта.
В заданиях 3 разделить сразу оксиды на основные и кислотные. У доски по одному обучающемуся каждого варианта.
Релаксоминутка: звучит музыка или зачитывается стихотворение.
Показ слайдов 18, 19, 20
В кружево будто одеты
Деревья, кусты, провода.
И кажется сказкою это,
А все это просто вода.
Безбрежная ширь океана
И тихая заводь пруда,
Каскад водопада и брызги фонтана,
А в сущности, это вода.
Высокие волны вздымая,
Бушует морская вода,
И топит, и губит, играя,
Большие морские суда.
Вот белым легли покрывалом
На землю родную снега…
А время придет — все растает,
И будет простая вода.
- Осуществить реакции;
- Определить какие свойства (кислот, оснований, оксидов и солей) характеризует каждая реакция;
- Определить тип реакции, обратимость;
- Для реакций ионного обмена привести уравнения в молекулярном, в полном и сокращенном ионном виде.
Практическая работа. Свойства кислот, оснований, оксидов и солей.
Инструктаж по Т.Б.
| Цель работы: | осуществить реакции, характеризующие некоторые свойства кислот, оснований, оксидов и солей |
Оборудование: спиртовка, штатив с пробирками.
Реактивы: HCl, NaOH, Zn, AgNO3, Ca(OH)2, CaO
Ход работы.
| Уравнения реакций | Наблюдения, тип реакции |
|
Выводы:Задание:
- Осуществить реакции.

- Определить какие свойства (кислот, оснований, оксидов и солей) характеризует каждая реакция.
- Определить тип реакции, обратимость.
- Для реакций ионного обмена привести уравнения в молекулярном, в полном и сокращенном ионном виде.
Выводы:
IV. Закрепление изученного
Самостоятельная работа по карточкам 3 варианта
Карточки
| Ф.И. обучающегося ___________________________ класс _______ |
1 вариант
1. Написать по названию формулы кислот и оснований:
Сернистая кислота, гидроксид лития, азотная кислота, гидроксид железа (II), гидроксид алюминия
2. Написать к составленным формулам соответствующие оксиды.
| Ф.И. обучающегося ___________________________ класс _______ |
2 вариант
1. Написать по названию формулы кислот и оснований:
Фосфорная кислота, гидроксид натрия, азотистая кислота, гидроксид хрома (III), гидроксид кальция
2. Написать к составленным формулам соответствующие оксиды.
| Ф.И. обучающегося ___________________________ класс _______ |
3 вариант
1. Написать по названию формулы кислот и оснований:
Угольная кислота, гидроксид железа (III), серная кислота, гидроксид меди (II), гидроксид бария
2. Написать к составленным формулам соответствующие оксиды.
V. Подведение итогов. Выставление оценок.
VI. Домашнее задание: повторить § 18, 19, 20.
Рефлексия.
Понравился ли вам урок?
Удалось ли достигнуть поставленной цели?
Оксиды.
 Кислоты. Основания. Амфотерность. Соли реферат по биологии
Кислоты. Основания. Амфотерность. Соли реферат по биологииОксиды. Кислоты. Основания. Амфотерность. Соли. 1. Оксиды Оксиды –это сложные вещества, образованные двумя элементами, одним из которых является кислород (O). Оксиды могут находиться в трех агрегатных состояниях, а именно: в твердом, жидком и газообразном. Температура плавления зависит от их строения. CuO, Fe O — твердые вещества, немолекулярного строения. Оксиды: MgO –магния NiO –никеля SiO — кремния Fe O — железа ClO — хлора CO — углерода NO — азота 1.2. Вода Массовая доля воды в организме человека составляет 65%. Взрослый человек потребляет ежедневно почти 2 л воды. Плотность воды наибольшая при 4градусов –г/см в кубе. При нуле –лёд, а при 100 –водяной пар. Вода реагирует: А) с активными металлами, образуя щелочи и водород(H). 2Na + 2H O = 2NaOH + H Из этой реакции видим, что водород выделился и образовался гидроксид натрия NaOH –щелочь. Если при добавлении фиолетового лакмуса окраска становится синей –это признак того, что в растворе есть щелочь. 2K + H O = 2KOH + H Ca + 2H O = Ca(OH) + H Б) с оксидами активных металлов, образуя растворимые основания –щелочи. CaO + H O = Ca(OH) Оксиды которым соответствуют основания (независимо от того, реагируют они с водой или нет) называются основными. Б) еще примеры: Na O + H O = 2NaOH BaO + HO = Ba(OH) В) со многими оксидами неметаллов, образуя кислоты. P O + H O = 2HPO а с горячей водой: P O + 3H PO = 2H PO CO + H O = H CO SO + H O = H SO Г) вода разлагается под действие высокой температуры или электрического тока. 2H O = 2H + O Оксиды которым соответствуют кислоты (независимо от того, реагируют они с водой или нет) называются кислотными. 2. Кислоты В формулах кислот на первом месте всегда стоит водород, а дальше –кислотный остаток. Во время химических реакций он переходит из одного соединения в другое, не изменяясь. Пример: SO — кислотный остаток. Его валентность = 2, поскольку в серной кислоте он соединен с двумя атомами водорода, которые способны замещаться атомами цинка (к примеру). Вывод: валентность кислотных остатков определяется числом атомов водорода, способных замещаться атомами металла. Основность кислот –это количество атомов водорода, способных замещаться атомами металла с образованием соли. Многие кислородосодержащие кислоты можно получить путем взаимодействия кислотных оксидов с водой: SO + H O = H SO N O + H O = 2HNO 2.1. Химические свойства кислот 1ое свойство: кислоты действуют на индикаторы. Вещества, изменяющие свою окраску под действием кислот (или щелочей, называются индикаторами. Индикаторы: Лакмус, метилоранж, фенолфталеин. 2ое свойство: кислоты реагируют с металлами. Mg + 2HCl = MgCl + H Zn + 2HCl = ZnCl + H Cu + HCl = реакция не происходит! 3е свойство: кислоты реагируют с основными оксидами. CuO + 2HCl = CuCl + H O — — — — Cu (II) Реакции обмена: это реакции между двумя сложными веществами, в результате которых они обмениваются своими составными частями. Примечание: Во время взаимодействия азотной кислоты с металлами вместо водорода выделяются другие газы. BaSO — бария Na SO — сульфит натрия K PO — фосфат калия CaCO — карбонат кальция 5.1. Химические свойства солей Соли реагируют: А) с металлами: Cu + 2AgNO = Cu(NO ) + 2Ag Образуется новая соль и металл. Примечание: реагируют с водой только те металлы, которые в вытеснительном ряду размещаются левее от того металла, который входит в состав соли. Но для таких реакций нельзя брать очень активные металлы, типо Li, Na, K, Ca, Ba и т.п., которые реагируют с водой в н.у. Б) с растворимыми основаниями (щелочами): AlCl +3NaOH = Al(OH) + 3NaCl K SO + Ba(OH) = 2KOH + BaSO Образуется новая соль и новое основание. Примечание: реагирующие вещества надо подбирать так, чтобы в результате реакции одно из образующихся веществ (основание или соль) выпадало в осадок. В) с кислотами: CaCo + 2HCl = CaCl + H CO / \ H O CO Образуется новая соль и новая кислота. Поскольку H CO очень непрочная, она разлагается на воду и CO . Примечание: реакция между солью и кислотой будет происходить при таких условиях: а) когда образуется осадок, не растворимый в кислотах: AgNO + HCl = AgCl + HNO б) когда реагирующая кислота сильнее, чем та, которой образована соль: Ca (PO ) + 3H SO = 3CaSO + 2H PO в) когда соль образована летучей кислотой, а реагирующая кислота нелетучая: 2NaNO + H SO = Na SO + 2HNO Г) с солями: BaCl + Na SO = BaSO + 2NaCl Примечание: реакция будет происходить только тогда, когда обе исходные соли будут взяты в растворах, но одна из вновь образующихся солей будет выпадать в осадок.
Вывод: валентность кислотных остатков определяется числом атомов водорода, способных замещаться атомами металла. Основность кислот –это количество атомов водорода, способных замещаться атомами металла с образованием соли. Многие кислородосодержащие кислоты можно получить путем взаимодействия кислотных оксидов с водой: SO + H O = H SO N O + H O = 2HNO 2.1. Химические свойства кислот 1ое свойство: кислоты действуют на индикаторы. Вещества, изменяющие свою окраску под действием кислот (или щелочей, называются индикаторами. Индикаторы: Лакмус, метилоранж, фенолфталеин. 2ое свойство: кислоты реагируют с металлами. Mg + 2HCl = MgCl + H Zn + 2HCl = ZnCl + H Cu + HCl = реакция не происходит! 3е свойство: кислоты реагируют с основными оксидами. CuO + 2HCl = CuCl + H O — — — — Cu (II) Реакции обмена: это реакции между двумя сложными веществами, в результате которых они обмениваются своими составными частями. Примечание: Во время взаимодействия азотной кислоты с металлами вместо водорода выделяются другие газы. BaSO — бария Na SO — сульфит натрия K PO — фосфат калия CaCO — карбонат кальция 5.1. Химические свойства солей Соли реагируют: А) с металлами: Cu + 2AgNO = Cu(NO ) + 2Ag Образуется новая соль и металл. Примечание: реагируют с водой только те металлы, которые в вытеснительном ряду размещаются левее от того металла, который входит в состав соли. Но для таких реакций нельзя брать очень активные металлы, типо Li, Na, K, Ca, Ba и т.п., которые реагируют с водой в н.у. Б) с растворимыми основаниями (щелочами): AlCl +3NaOH = Al(OH) + 3NaCl K SO + Ba(OH) = 2KOH + BaSO Образуется новая соль и новое основание. Примечание: реагирующие вещества надо подбирать так, чтобы в результате реакции одно из образующихся веществ (основание или соль) выпадало в осадок. В) с кислотами: CaCo + 2HCl = CaCl + H CO / \ H O CO Образуется новая соль и новая кислота. Поскольку H CO очень непрочная, она разлагается на воду и CO . Примечание: реакция между солью и кислотой будет происходить при таких условиях: а) когда образуется осадок, не растворимый в кислотах: AgNO + HCl = AgCl + HNO б) когда реагирующая кислота сильнее, чем та, которой образована соль: Ca (PO ) + 3H SO = 3CaSO + 2H PO в) когда соль образована летучей кислотой, а реагирующая кислота нелетучая: 2NaNO + H SO = Na SO + 2HNO Г) с солями: BaCl + Na SO = BaSO + 2NaCl Примечание: реакция будет происходить только тогда, когда обе исходные соли будут взяты в растворах, но одна из вновь образующихся солей будет выпадать в осадок. Выводы по всем этим темам ( с параграфа 29-38 ) и классификация неорганических веществ и их реакций: Ответы на некоторые вопросы после параграфов: Какие вещества называют оксидами? Оксиды –это сложные вещества образованные двумя элементами одним из которых является кислород. Какие вещества относятся к кислотам? К кислотам относятся сложные вещества, в состав которых входят водород и кислотный остаток. Что называется реакцией соединения? Это реакция в результате которой из двух или нескольких веществ (простых или сложных) образуется одно новое сложное вещество. Напишите уравнения химических реакций которые происходят при таких превращениях: C CO H CO P P O HPO C + O = CO CO + H O = H CO P + O = P O Как химическим путем отличить серебро от цинка? Что такое хлороводород и как его получить? Хлороводород –это бесцветный газ с резким запахом, немного тяжелее воздуха, во влажном воздухе “дымит”. Очень хорошо растворяется в воде. Получить хлороводород можно из кристаллического хлорида натрия NaCl при нагревании его с концентрированной серной кислотой. Почему хлороводород на воздухе дымит? Как доказать что выданный вам раствор кислота и это соляная кислота? Надо юзить на него индикатором. Лакмус опустить – краснеет, метилоранж –розовеет, фенолфталеин – бесцветный. Какие вещества относятся к основаниям и как их классифицируют? Привести примеры. К основаниям относятся вещества имеющие гидроксильную группу и металл. Основания классифицируют на щелочи и нерастворимые. Все металлы не растворяются, а неметаллы наоборот. Растворимые –NaOH, KOH, нерастворимые –Cu(OH) Fe(OH) . ) Что вам известно о гидроксиде натрия? Гидроксид натрия NaOH –растворимый в воде… 11) Ca CaO Ca(OH) Ca(NO ) Ca + O = 2CaO CaO + H O = Ca(OH) Ca(OH) + 2HNO = Ca(NO ) + 2H O ) P P O H PO Mg(PO ) P + 5O = 2P O P O + 3H O = 2H PO Что называется амфотерностью? Амфотерность –это способность химических соединений Проявлять кислотные или основные свойства в зависимости от природы веществ, с которыми они реагируют. Что такое соли? Соли –это сложные вещества, образованные атомами металлов и кислотными остатками.
Выводы по всем этим темам ( с параграфа 29-38 ) и классификация неорганических веществ и их реакций: Ответы на некоторые вопросы после параграфов: Какие вещества называют оксидами? Оксиды –это сложные вещества образованные двумя элементами одним из которых является кислород. Какие вещества относятся к кислотам? К кислотам относятся сложные вещества, в состав которых входят водород и кислотный остаток. Что называется реакцией соединения? Это реакция в результате которой из двух или нескольких веществ (простых или сложных) образуется одно новое сложное вещество. Напишите уравнения химических реакций которые происходят при таких превращениях: C CO H CO P P O HPO C + O = CO CO + H O = H CO P + O = P O Как химическим путем отличить серебро от цинка? Что такое хлороводород и как его получить? Хлороводород –это бесцветный газ с резким запахом, немного тяжелее воздуха, во влажном воздухе “дымит”. Очень хорошо растворяется в воде. Получить хлороводород можно из кристаллического хлорида натрия NaCl при нагревании его с концентрированной серной кислотой. Почему хлороводород на воздухе дымит? Как доказать что выданный вам раствор кислота и это соляная кислота? Надо юзить на него индикатором. Лакмус опустить – краснеет, метилоранж –розовеет, фенолфталеин – бесцветный. Какие вещества относятся к основаниям и как их классифицируют? Привести примеры. К основаниям относятся вещества имеющие гидроксильную группу и металл. Основания классифицируют на щелочи и нерастворимые. Все металлы не растворяются, а неметаллы наоборот. Растворимые –NaOH, KOH, нерастворимые –Cu(OH) Fe(OH) . ) Что вам известно о гидроксиде натрия? Гидроксид натрия NaOH –растворимый в воде… 11) Ca CaO Ca(OH) Ca(NO ) Ca + O = 2CaO CaO + H O = Ca(OH) Ca(OH) + 2HNO = Ca(NO ) + 2H O ) P P O H PO Mg(PO ) P + 5O = 2P O P O + 3H O = 2H PO Что называется амфотерностью? Амфотерность –это способность химических соединений Проявлять кислотные или основные свойства в зависимости от природы веществ, с которыми они реагируют. Что такое соли? Соли –это сложные вещества, образованные атомами металлов и кислотными остатками. Сформулируйте правило для составления формул солей. Сумма единиц валентностей атомов металла должна равняться сумме единиц валентностей атомом кислотного остатка. Ca CaO Ca(OH) CaCl CaSO Ca + O = 2CaO CaO + H O = Ca(OH) Ca(OH) + 2HCl = CaCl + 2H O CaCl + H SO = CaSO + 2HCl Ba Ba(OH) Ba(NO ) BaCO BaCl Ba + H O = Ba(OH) Ba(OH) + 2HNO = Ba(NO ) + 2H O Ba(NO ) + H CO = BaCO + 2HNO BaCO + 2HCl = BaCl + H CO Обобщение знаний: Какие вещества называются простыми? На какие две группы их можно разделить? Сравнить характерные свойства металлов и неметаллов. Простые вещества –это вещества состоящие из одного элемента. Их можно разделить на металлы и неметаллы. Металлы –нерастворимые в воде вещества. Они имеют металлический блеск и пластичность. Неметаллы –это растворимые в воде вещества, которые хрупкие и т.п. Какие вещества называются сложными? На какие классы делятся неорганические вещества? Сложные вещества –это вещества состоящие из двух или более элементов. Неорганические вещества делятся на простые и сложные. Сложные делятся на оксиды, основания, кислоты и соли. По какому признаку оксиды делят на основные и кислотные? Оксиды которым соответствуют основания называют основными, а те которым соответствуют кислоты — кислотными. ) С чем могут взаимодействовать кислотные и основные оксиды? Что получается? Кислотные и основные оксиды могут взаимодействовать с водой и получается кислоты или основания.
Сформулируйте правило для составления формул солей. Сумма единиц валентностей атомов металла должна равняться сумме единиц валентностей атомом кислотного остатка. Ca CaO Ca(OH) CaCl CaSO Ca + O = 2CaO CaO + H O = Ca(OH) Ca(OH) + 2HCl = CaCl + 2H O CaCl + H SO = CaSO + 2HCl Ba Ba(OH) Ba(NO ) BaCO BaCl Ba + H O = Ba(OH) Ba(OH) + 2HNO = Ba(NO ) + 2H O Ba(NO ) + H CO = BaCO + 2HNO BaCO + 2HCl = BaCl + H CO Обобщение знаний: Какие вещества называются простыми? На какие две группы их можно разделить? Сравнить характерные свойства металлов и неметаллов. Простые вещества –это вещества состоящие из одного элемента. Их можно разделить на металлы и неметаллы. Металлы –нерастворимые в воде вещества. Они имеют металлический блеск и пластичность. Неметаллы –это растворимые в воде вещества, которые хрупкие и т.п. Какие вещества называются сложными? На какие классы делятся неорганические вещества? Сложные вещества –это вещества состоящие из двух или более элементов. Неорганические вещества делятся на простые и сложные. Сложные делятся на оксиды, основания, кислоты и соли. По какому признаку оксиды делят на основные и кислотные? Оксиды которым соответствуют основания называют основными, а те которым соответствуют кислоты — кислотными. ) С чем могут взаимодействовать кислотные и основные оксиды? Что получается? Кислотные и основные оксиды могут взаимодействовать с водой и получается кислоты или основания.
Тест Оксиды. Основания. Кислоты. Соли с ответами (8 класс) по теме химии
Сложность: знаток.Последний раз тест пройден 1 час назад.
Вопрос 1 из 10
Все кислоты в своем составе имеют кислород:
- Правильный ответ
- Неправильный ответ
- Вы и еще 82% ответили правильно
- 82% ответили правильно на этот вопрос
В вопросе ошибка?
Следующий вопросОтветитьВопрос 2 из 10
Кислотам соответствуют следующие соединения:
- Правильный ответ
- Неправильный ответ
- Вы и еще 60% ответили правильно
- 60% ответили правильно на этот вопрос
В вопросе ошибка?
ОтветитьВопрос 3 из 10
Кислоты образуются при взаимодействии:
- Правильный ответ
- Неправильный ответ
- Вы и еще 56% ответили правильно
- 56% ответили правильно на этот вопрос
В вопросе ошибка?
ОтветитьВопрос 4 из 10
Оксиды состоят из кислорода и:
- Правильный ответ
- Неправильный ответ
- Вы и еще 71% ответили правильно
- 71% ответили правильно на этот вопрос
В вопросе ошибка?
ОтветитьВопрос 5 из 10
Все оксиды могут взаимодействовать с водой
- Правильный ответ
- Неправильный ответ
- Вы и еще 62% ответили правильно
- 62% ответили правильно на этот вопрос
В вопросе ошибка?
ОтветитьВопрос 6 из 10
Оксиды, которые образуют соли при взаимодействии с основаниями или основными оксидами называют:
- Правильный ответ
- Неправильный ответ
- Вы ответили лучше 63% участников
- 37% ответили правильно на этот вопрос
В вопросе ошибка?
ОтветитьВопрос 7 из 10
Кислотные оксиды могут взаимодействовать с:
- Правильный ответ
- Неправильный ответ
- Вы и еще 57% ответили правильно
- 57% ответили правильно на этот вопрос
В вопросе ошибка?
ОтветитьВопрос 8 из 10
Основания могут вступать в реакцию с:
- Правильный ответ
- Неправильный ответ
- Вы и еще 54% ответили правильно
- 54% ответили правильно на этот вопрос
В вопросе ошибка?
ОтветитьВопрос 9 из 10
Взаимодействие основания с солью:
- Правильный ответ
- Неправильный ответ
- Вы и еще 57% ответили правильно
- 57% ответили правильно на этот вопрос
В вопросе ошибка?
ОтветитьВопрос 10 из 10
Формулы, которым соответствуют соли:
- Правильный ответ
- Неправильный ответ
- Вы ответили лучше 55% участников
- 45% ответили правильно на этот вопрос
В вопросе ошибка?
Ответить
Доска почёта
Чтобы попасть сюда — пройдите тест.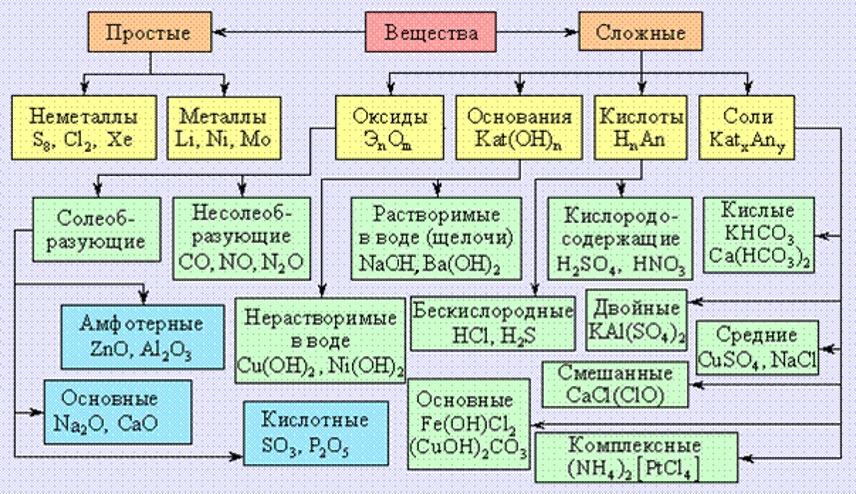
-
Ярослав Галкин
10/10
Татьяна Тицкая
10/10
Антон Павлюковец
10/10
Артем Винокуров
7/10
Анастасия Балиевич
10/10
Олег Остапук
10/10
Алина Самойлова
3/10
Виктор Смирнов
10/10
Сергей Ефремов
8/10
Денис Пашков
10/10
Тест «Оксиды. Основания кислоты. Соли» с ответами разработан для учащихся средней школы. Он поможет закрепить знания, выявить плохо усвоенный материал. Выполнение теста требует знания свойств названных химических веществ, их взаимодействия с другими веществами. Более сложные задания по теме практической направленности. Уже поданные правильные ответы позволят сразу запоминать то, что «упущено». Вопросы охватывают информацию, которая предусмотрена программой и является обязательной для изучения.
Тест «Оксиды» (8 класс) с ответами – один из самых удобных способов подготовки к уроку или проверочной работе.
Рейтинг теста
Средняя оценка: 3.4. Всего получено оценок: 2324.
А какую оценку получите вы? Чтобы узнать — пройдите тест.
«Состав и названия оксидов, кислот, оснований , солей» | План-конспект урока по химии (8 класс) по теме:
Состав и названия оксидов, кислот, оснований, солей
Цель урока: повторить и обобщить материал о составе веществ, относящихся к основным классам неорганических соединений, закрепить умения учащихся составлять формулы и давать названия веществам.
Задачи урока
Образовательные:
1. выявить прочность усвоения учащимися основных понятий темы: оксиды, кислоты, основания, соли;
2. закрепить умение учащихся составлять формулы веществ;
3. закрепить умение учащихся давать названия веществам;
4. закрепить умение учащихся классифицировать вещества по их формулам.
Развивающие:
1. развивать мышление;
2. развивать зрительную память учащихся.
Воспитательные:
1. воспитание самостоятельности;
2. показать практическое значение изучаемых веществ.
Оборудование:
Таблица «Классификация неорганических веществ»
Периодическая система химических элементов Д. И. Менделеева
Таблица растворимости
Карточки с общими формулами оксидов, кислот, оснований, солей
Магниты
Карточки для самостоятельной работы
Ход урока:
I. Организационная часть урока.
Сообщение темы, цели и задач урока.
На предыдущих уроках мы познакомились с основными классами неорганических соединений. Среди этих соединений встречается много знакомых нам веществ, например, соляная кислота, которая входит в состав желудочного сока, природные соединения оксида алюминия — драгоценные камни рубин и сапфир, гидроксид калия, используемый в элементах питания, карбонат кальция — мрамор и известняк. Сегодня на уроке мы повторим состав и названия этих соединений, Это понадобится нам в дальнейшем при изучении классификации и химических свойств этих соединений.
II. Основная часть урока.
Фронтальный опрос.
1. Перечислите классы неорганических соединений.
2. Дайте определение оксидам, основаниям, кислотам, солям.
Самостоятельная работа.
Задание 1. Из формул, приведенных ниже, выпишите отдельно оксиды, основания, кислоты, соли и дайте им названия:
НСl, СаО, NaOH, Ca(OH)2, K2CО3, HNО3, Fe(OH)2, СО2, h3SО4, Fе2О3, CuSО4, NaCl
(Учащимся выданы карточки с заданием 1. Во время работы класса 4-х учащихся вызывают для выполнения того же задания у доски: один выписывает формулы оксидов, второй — оснований, третий — кислот, четвертый – солей, записи нe видны классу. Когда работа заканчивается, эти записи открывают для проверки результатов, для исправления ошибок и самопроверки. Названия веществам даются устно.)
Затем проводится беседа по этому заданию:
1) Почему вещества СаО, СО2, Fe2О3 относят к оксидам?
2) Что общего в составе приведенных оснований, кислот, солей?
3) Что общего и чем различаются по составу кислоты и соли, основания и соли?
4) В каких случаях в названиях соединений в скобках приводится римская цифра?
Задание 2. Составьте формулы хлорида меди (II), гидроксида магния, сернистой кислоты, оксида серы (VI), сульфата натрия, фосфорной кислоты, гидроксида железа (III), оксида калия.
Составьте формулы хлорида меди (II), гидроксида магния, сернистой кислоты, оксида серы (VI), сульфата натрия, фосфорной кислоты, гидроксида железа (III), оксида калия.
(Учащимся выданы карточки с заданием 2. Во время работы класса 1 ученика вызывают для выполнения того же задания у доски, записи нe видны классу. Когда работа заканчивается, эти записи открывают для самопроверки, взаимопроверки, для исправления ошибок).
Фронтальная работа
Задание 3. Задание «Третий лишний»
Среди каждой тройки веществ найдите вещество, отличающееся от двух других. Укажите признак отличия.
1. | НNО3 | НСl | Н2О |
2. | Na2SО4 | Н2SО4 | ВаСl2 |
3. | Са(ОН)2 | Al(ОН)3 | Al(NО3)3 |
4. | Cа(ОН)2 | NaОН | Cu(ОН)2 |
5. | P2О5 | SО2 | MgО |
6. | ВаО | СО2 | СаО |
Задание 4. Задание «Найди формулу»
На доску проецируется задание 4 на установление соответствия между формулой вещества и его названием.
Какая формула соответствует
1. гидроксиду натрия
NaН NaОН NaНСО3 Na2СО3
2. сероводородной кислоте
сероводородной кислоте
Н2S Н2SО3 Н2SО4 Н2S2О7
3. гидроксиду бария
Ва(ОН)2 Ве(ОН)2 НВrO BаОНCl
4. карбонату калия
СаСО3 К2SО3 К2СО3 КНСО3
5. соляной кислоте
НСl НСlО НСlО3 НСlО4
6. сульфиту калия
К2СО3 К2SО4 К2SО3 К2S
Задание 5.
Учащиеся отгадывают химические загадки.
1. Кислота, раствор которой используется в аккумуляторах в автомобиле.
2. Кислота тепла боится, быстро в воду превратится.
3. Расскажите в чем тут дело: гасили то, что не горело?
4. Только в воду соль попала, холодней в стакане стало.
5. Порознь каждый ядовит, вместе – будет аппетит.
6. Красив, наряден карбонат, ему строитель очень рад.
7. Поташ, селитру, сильвинит какой металл объединит?
8. Вещество, необходимое растениям для фотосинтеза.
Ответы:
1. Серная кислота.
2. Угольная кислота.
3. Гашение извести или питьевой соды.
4. Нитрат аммония.
5. Хлорид натрия.
6. Мрамор и известняк.
7. Калий.
8. Углекислый газ, вода.
Задание 6. Закрепление материала.
Самостоятельная работа.
Из формул, приведенных ниже, выпишите отдельно оксиды, основания, кислоты, соли и дайте им названия:
КОН, MgО, НСl , Cu(ОН)2 , Н2SО4, СаСО3, SО2, КСl.
Ва(ОН)2 , НNО3, SО3, CaСl2, К2СО3, CuО, КОН, Н2SО3.
АgNО3, Na2SО4, NН3, Al(ОН)3, P2О5, СаS, Fe(ОН)3, СS2, FeСl2, Н2S, Na2О, Н3РО4.
III. Подведение итогов урока.
Задание на дом. Напишите формулы веществ и расскажите, где используются эти вещества: речной песок, углекислый газ, карбонат кальция.
ПРИМЕР Урока развивающего контроля (химия) // Урок развивающего контроля // ГБОУ Лицей № 410
ПРИМЕР Урока развивающего контроля (химия) // Урок развивающего контроля // ГБОУ Лицей № 410ПРИМЕР Урока развивающего контроля (химия)
УРОК _ХИМИИ
ТЕМА_«Основные классы соединений»
КЛАСС _8
ВИД И ТИП УРОКА: УРОК РАЗВИВАЮЩЕГО КОНТРОЛЯ
МЕТОДИЧЕСКОЕ ОБЕСПЕЧЕНИЕ: Учебник О.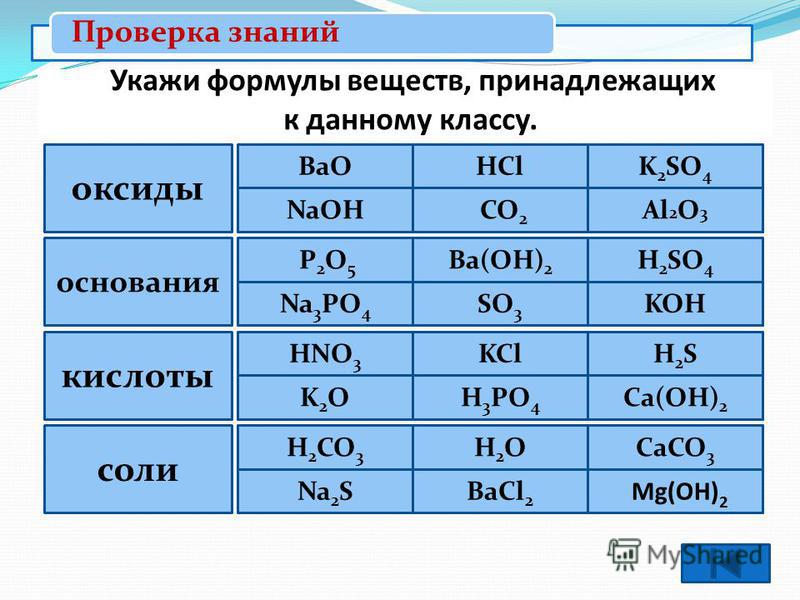 С. Габриелян «Химия. 8 класс.», М., Дрофа, 2010.
С. Габриелян «Химия. 8 класс.», М., Дрофа, 2010.
ТЕХНИЧЕСКОЕ ОБЕСПЕЧЕНИЕ: тексты заданий для проведения контрольной работы; вспомогательные алгоритмы, эталон контрольной работы, алгоритм исправления ошибок школьниками, система заданий для коррекции ошибок, задания, аналогичные к/р для выборочного выполнения школьниками, дополнительные задания для учащихся, которые без ошибок справились с работой – для проведения урока по анализу к/р.
ОБЩИЕ ЦЕЛИ УРОКА
Деятельностная цель: Формирование мотивации образовательной деятельности школьников на основе личностно-ориентированного подхода для контроля уровня усвоения материала по теме «Основные классы соединений». Формирование способности учащихся к осуществлению контрольной функции.
Развивающая цель: контроль и самоконтроль изученных понятий и алгоритмов.
Формы работы учащихся:
- Самостоятельная индивидуальная работа учащихся по выполнению контрольной работы, которая состоит из трёх заданий. Первое задание проверяет знание учащимися основных классов соединений и их названия. Второе – умение составлять формулы гидроксидов и оксидов по степени окисления элементов. Третье — расчётные задачи. Это позволяет проверить не только уровень специальных умений и навыков, но и степень овладения общеобразовательными компетенциями (методологические, логические умения; сравнение, сопоставление объектов по предложенным основаниям работа с информацией, представленной в разных формах и др.).
- Самоконтроль — эталонный вариант предлагается ученику для сравнения и самостоятельного оценивания собственного варианта. Для каждого задания прописаны критерии, по которым будет осуществляться контроль. Таким образом, учащиеся изначально владеют информацией о «стоимости» каждого задания и могут прогнозировать свою оценку за контрольную работу.

- Педагогический контроль – эталон находится у педагога. Способность к самооценке формируется путём согласования с учителем результата, на основе ранее установленных критериев и рефлексивного анализа допущенных ошибок.
Структура урока .
№ п/п | Этап урока | Деятельность учителя | Деятельность учащихся | УУД |
1 | Мотивация к контрольно-коррекционной деятельности. Продолжительность 2-3 минуты. | Применяет прием «До-после», в ходе которого школьники сами формулируют цель урока, создаёт условия для возникновения внутренней потребности включения в контрольно- коррекционную деятельность («хочу»), актуализирует требования к ученику со стороны контрольно-коррекционной деятельности («надо»). Устанавливает тематические рамки и создает основу контрольно-коррекционных действий «могу». Организовывает повторение контролируемых способов действий, сопоставление учащимися своих работ по готовому образцу. | Принимают участие в диалоге с учителем, задают вопросы. | Регулятивные |
2 | Контроль и самопроверка знаний. Продолжительность 37-42 минуты. | Организует индивидуальную деятельность учащихся (написание контрольной работы). | Индивидуальная работа. (Приложение 1). Проверяют свою работу по эталону (Приложение 2.). | Регулятивные |
3 | Локализация индивидуальных затруднений. Продолжительность – 6-8 минут. | Применяет прием «З-Х-У», организует мотивирование учащихся к коррекционной деятельности. | Определяют цель урока. | Познавательные |
4 | Целеполагание и построение проекта коррекции выявленных затруднений. | Применяет прием «Связующие Алгоритмы», организует процесс обсуждения учащимися целей коррекции, а также помогает выбрать необходимые средства и способы их достижения (Приложение 4) . | Формулируют индивидуальные цели и алгоритм коррекционных действий. | Регулятивные |
5 | Реализация построенного проекта. Продолжительность 7-8 минут. | Применяет прием «Мудрые совы», организует выполнение учащимися самостоятельной работы. | Коррекция учащимися своих ошибок (работа с эталоном) в контрольной работе и применение соответствующих способов действий. Выполняют самостоятельную работу. | Регулятивные |
6 | Обобщение затруднений во внешней речи | Применяет прием «Хочу спросить». Организует обсуждение типовых затруднений. | Задают вопросы, участвуют в выявлении типичных ошибок. | Коммуникативные |
7 | Самостоятельная работа с самопроверкой по эталону. | Применяет прием «Райтинг», Организует выполнение учащимися самостоятельной работы. | Выполняют самостоятельную работу. | Регулятивные |
8 | Включение в систему знаний и повторения. Продолжительность 5-7 минут | Применяет прием «Мысли во времени», организует применение способов действий, вызвавших затруднения, повторение и закрепление ранее изученного материала и подготовка к изучению следующих разделов курса. | В течение 1 минуты учащиеся записывать свои мысли, которые «приходят в голову» и связаны со словом «Ошибка». | Регулятивные |
9 | Рефлексия. | Применяет прием «Рюкзак». Проговаривает механизм деятельности по контролю. | Принимают участие в игре, продолжая фразу «Я на уроке…» и передавая по цепочке импровизированный «рюкзак». | Познавательные |
Приложение 1.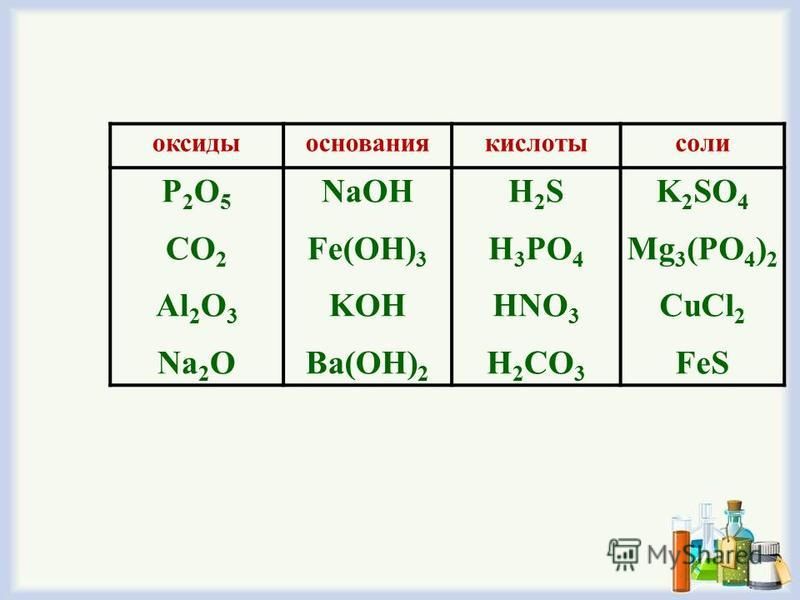
Контрольная работа по теме
«Соединения химических элементов»
1. Из перечня формул выпишите отдельно формулы оксидов, оснований, кислот, солей и дайте им названия:
1 вариант – h3SO4, Na2O, CuSO4, KOH, SO3, h3S, Mg(OH)2, Al2(SO4)3, FeS, h3O, Fe(OH)3, HCl
2 вариант – Cr(OH)3, HNO3, MgCl2, LiOH, FeSO4, h3SO3, CO2, AgNO3, Na2O, HF, Fe2O3, Ca(OH)2
3 вариант– NaCl, Cu2O, Cu(OH)2, HNO2, Al2S3, h3, N2O5, Al(OH)3, FeO, BaSO4, AgOH, h3CO3.
Критерии оценки:
Правильно указаны оксиды – 1 б. Правильно указаны основания – 1б. Правильно указаны кислоты — 1б. Правильно указаны соли — 1б. | Правильно названы все оксиды – 1 б. |
ИТОГО | 8 б. |
2. Укажите заряды ионов и степени окисления элементов в формулах веществ. Для гидроксидов (кислоты и основания) запишите формулы соответствующих им оксидов, а для соли – формулы гидроксидов.
1 вариант – CaCO3, Cr(OH)3, h3SO4
2 вариант – Mg(OH)2, h3CO3, Na2SO4
3 вариант – NaOH, HNO3, Ba(NO3)2.
Критерии оценки:
Правильно указаны заряды всех ионов — 1б. Правильно указаны степени окисления всех элементов – 1б. Правильно записаны формулы оксидов для гидроксидов – 1 б. 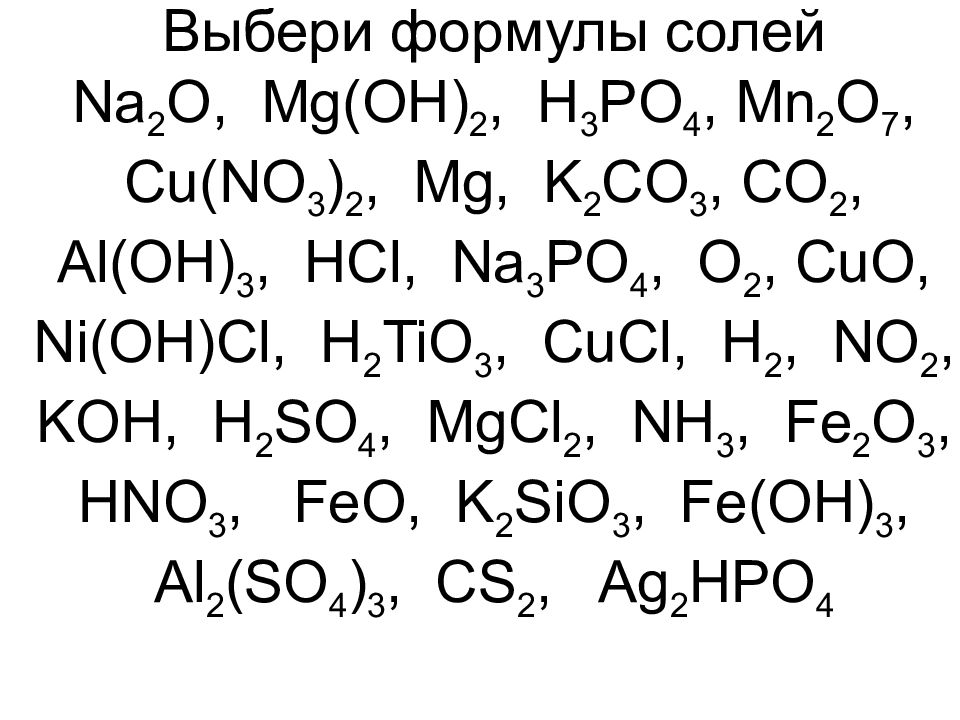 Правильно записаны формулы гидроксидов для соли – 1 б. |
ИТОГО 4 б. |
3. Решите задачу. Ответ запиши с точностью до сотых.
1 вариант –Сколько граммов сахара и сколько граммов воды надо взять для приготовления 250 г 12% раствора?
2 вариант – К 100 г 30 %-го раствора сахара добавили 10 г сахара. Какова массовая доля сахара в полученном растворе?
3 вариант – К 200 г 10 %-го раствора сахара добавили 100 г воды. Какова массовая доля сахара в полученном растворе?
Критерии оценки:
Правильно записано условие задачи — 1б. Правильно записана формула для нахождения неизвестного – 1б. Правильно сделаны вычисления – 1 б. |
ИТОГО 3 б. |
Критерии оценки за контрольную работу
Количество баллов | 15-14 | 13-11 | 10-8 | 7-0 |
Оценка | «5» | «4» | «3» | «2» |
Рекомендации по проведению и проверке контрольной работы.
Контрольная работа представляется в четырёх вариантах. В каждом задании представлены критерии оценивания. Эти критерии необходимо заранее (перед началом работы) оговорить с учащимися. Ребята должны знать, какую оценку они могут получить и что для этого необходимо выполнить. Проверку контрольной работы можно организовать таким способом, чтобы учащиеся использовали другой цвет ручки. На этом этапе не предполагается выяснение причин своих ошибок и их исправление. Данный этап завершается фиксацией своих ошибок и выставлением самооценки и сдачей контрольной работы учителю. На этапе выполнения самостоятельной работы учащиеся выполняют аналогичные задания из другого варианта в контрольной работе.
На этом этапе не предполагается выяснение причин своих ошибок и их исправление. Данный этап завершается фиксацией своих ошибок и выставлением самооценки и сдачей контрольной работы учителю. На этапе выполнения самостоятельной работы учащиеся выполняют аналогичные задания из другого варианта в контрольной работе.
Данный формат контрольных работ позволяет учителю провести поэлементный анализ качества знаний по предложенной теме с целью дальнейшей коррекции содержания и методов обучения.
Приложение 2.
Контрольная работа по теме
«Соединения химических элементов»
Эталонный вариант
1. Из перечня формул выпишите отдельно формулы оксидов, оснований, кислот, солей и дайте им названия:
1 вариант –
Оксиды | Основания | Кислоты | Соли |
Na2O – оксид натрия | KOH – гидроксид калия | h3SO4 — серная | CuSO4 – сульфат меди (II) |
2 вариант –
Оксиды | Основания | Кислоты | Соли |
CO2 – оксид углерода (IV) | Cr(OH)3 — гидроксид хрома(III) | HNO3 — азотная | MgCl2 – хлорид магния |
3 вариант–
Оксиды | Основания | Кислоты | Соли |
Cu2O – оксид меди (II) | Cu(OH)2 — гидроксид меди (II) | HNO2 — азотистая | NaCl — хлорид натрия |
2. Укажите заряды ионов и степени окисления элементов в формулах веществ. Для гидроксидов (кислоты и основания) запишите формулы соответствующих им оксидов, а для соли – формулы гидроксидов.
Укажите заряды ионов и степени окисления элементов в формулах веществ. Для гидроксидов (кислоты и основания) запишите формулы соответствующих им оксидов, а для соли – формулы гидроксидов.
1 вариант – заряды ионов: Ca2+CO32-, Cr3+(OH)3-, H2+SO42-
степени окисления: Ca+2C+4O3-2, Cr3+(O-2H+1)3-, H2+1S+6O4-2
CaCO3→Ca(OH)2, Cr(OH)3 → Cr2O3, h3SO4→ SO3
h3CO3
2 вариант – заряды ионов: Na+2SO2-4, Mg2+ (OH) -2, H+2CO2-3
степени окисления: Na+12S+6O2-4, Mg2+ (O-2H+1)2, H+2C+4O2-3
Na2SO4→NaOH, Mg(OH)2 → MgO, h3CO3→ CO2
h3SO4
3 вариант – заряды ионов: Ba2+ (NO3) -2, Na+OH- , H+NO-3
степени окисления: Ba+2 (N+5O2-3) -2, Na+1 O-2H+1, H+1N+5O2-3
Ba(NO3) 2→Ba(OH)2, NaOH→ Na2O, HNO3→ N2O5
HNO3
3. Решите задачу.
Решите задачу.
1 вариант – Сколько граммов сахара и сколько граммов воды надо взять для приготовления 250 г 12% раствора?
Дано: Решение:
mр-ра= 250 г mр.в.= ω* mр-ра = 0,12*250 = 30 г
ω = 12% = 0,12 mр-ль = mр-ра — mр.в = 250 – 30 = 220 г
mр.в.= х г
mр-ль= у г Ответ: 30 г, 220 г
2 вариант – К 100 г 30 %-го раствора сахара добавили 10 г сахара. Какова массовая доля сахара в полученном растворе?
Дано: Решение:
m1 р-ра= 100 г m1р.в = ω1* m1 р-ра = 0,3 * 100 = 30 г
ω1 = 30% = 0,3
m р.в .= 10 г ω2= (m1р.в + m р.в )/ (m1 р-ра + m р.в ) = (30+10)/100+10 = 0,37
ω2 = x % Ответ: 37%
3 вариант – К 200 г 10 %-го раствора сахара добавили 100 г воды. Какова массовая доля сахара в полученном растворе?
Дано: Решение:
m1 р-ра= 200 г m1р.в = ω1* m1 р-ра = 0,1 * 200 = 20 г
ω1 = 10% = 0,1
m р-ль.= 100 г ω2= m1р.в / (m1 р-ра + m р-ль ) = 20/200+100= 0,07
ω2 = x % Ответ: 7%
Приложение 3.
Дополнительные задания
для учащихся, которые без ошибок справились с контрольной работой.
Вариант 1
- Составьте формулы следующих веществ: нитрита магния, бромида кальция, фосфата стронция, оксида мышьяка (V), фосфата калия, гидроксида свинца (II), оксида кремния (II), бромной кислоты (правильно составлены все формулы — 8 б.
 ).
). - Заполните таблицу по образцу (правильно составлены все формулы — 9 б.):
- Смешали 200 г 40 %-го и 100 г 30 %-го растворов азотной кислоты. Определите массовую долю кислоты в полученном растворе (правильно записано условие задачи, правильно записана формула для нахождения неизвестного, правильно сделаны вычисления – 3 б.).
Вариант 2.
- Составьте формулы следующих веществ: нитрата кальция, фторида алюминия, карбоната лития, оксида мышьяка (III), сульфита натрия, гидроксида железа (II), оксида меди (II), хлорной кислоты (правильно составлены все формулы — 8 б.).
- Заполните таблицу по образцу (правильно составлены все формулы — 9 б.):
- Смешали два раствора гидроксида натрия: 120 г 5 %-го раствора и 130 г 15 %-го раствора. Рассчитайте массовую долю гидроксида натрия в полученном растворе (правильно записано условие задачи, правильно записана формула для нахождения неизвестного, правильно сделаны вычисления – 3 б.).
Приложение 4.
Алгоритм исправления ошибок школьниками:
Приложение 5.
Алгоритм конструирования урока развивающего контроля.
- Определить форму и процедуру проведения контрольной работы.

- Составить список знаний – понятий, алгоритмов, правил, способов действий и т.д., которые требуют контроля усвоения. Подобрать соответствующие эталоны.
- В соответствии с принципом минимакса подобрать задания для контрольной работы на применение перечисленных знаний.
- Составить контрольную работу.
- Подобрать задания для этапа самостоятельной работы с самопроверкой.
- Определить критерии оценивания контрольной работы и форму его представления учащимся.
- Подготовить образцы и эталоны для самопроверки.
- Определить способы организации самопроверки контрольной и самостоятельной работ.
- Продумать форму организации этапа мотивации.
- Продумать форму организации актуализации знаний.
- Продумать организацию работы с алгоритмом исправления и, при необходимости, составить диалог для его коррекции на уроке.
- Спроектировать деятельность учащихся, зафиксировавших отсутствие затруднений (подобрать задания более высокого уровня сложности, продумать способ их предъявления и проверки, продумать возможность их включения в консультационную работу и пр.)
- Продумать формы организации работы в классе на каждом этапе урока.
- Продумать форму организации этапа рефлексии.
- Сконструировать диалоги для организации коллективной работы на всех этапах урока.
- В случае организации групповой работы, сформулировать задания и способы организации обратной связи по результатам работы групп.
- Подобрать задания для этапа повторения, продумать аргументацию выбора заданий.
- Составить технологическую карту урока.
- Провести анализ технологической карты. Внести корректировку.
Алгоритм подготовки урока развивающего контроля см. Приложение 5.
Основания, кислоты и соли в теории электролитической диссоциации
КИСЛОТЫ, ОСНОВАНИЯ и соли с ТОЧКИ ЗРЕНИЯ ТЕОРИИ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ [c. 173]
173]Кислоты, основания и соли с точки зрения теории электролитической диссоциации (ТЭД) [c.123]
Таким образом, теория электролитической диссоциации объясняет общие свойства кислот присутствием в их растворах ионов водорода, а общие свойства оснований — присутствием в их растворах гидроксид-ионов. Это объяснение не является, однако, общим. Известны химические реакции, протекающие с участием кислот и оснований, к которым теория электролитической диссоциации неприменима. В частности, кислоты и основания могут реагировать друг с другом, не будучи диссоциированы на ионы. Так, безводный хлороводород, состоящий только из молекул, легко реагирует с безводными основаниями. Кроме того, известны вещества, не имеющие в своем составе гидроксогрупп, но проявляющие свойства оснований. Например, аммиак взаимодействует с кислотами и образует соли (соли аммония), хотя в его составе нет групп ОН. Так, с хлороводородом он образует типичную соль — хлорид аммония [c.244]
Кислотами с позиций теории электролитической диссоциации называются вещества, диссоциирующие в растворах с образованием ионов водорода, С точки зрения протонной теории кислот и оснований к кислотам относятся вещества, способные отдавать ион водорода, т, е. быть донорами прогонов,, Наиболее характерное химическое свойство кислот — их способность реагировать с основаниями (а также с основными и амфотерными оксидами) с образованием солей, например [c.31]
Соли рассматривают обычно как продукты замены атома водорода,в кислотах на атомы металлов или гидроксильных групп в основаниях на кислотные остатки. С точки зрения теории электролитической диссоциации солями называются сложные вещества, которые при растворении в воде (или при плавлении) дают в растворе катионы металлов и анионы кислот. [c.245]
После Аррениуса было показано, что определение кислот, солей и оснований в терминах теории электролитической диссоциации не охватывает всего многообразия кислотно-основных свойств веществ. [c.116]
[c.116]
Теория электролитической диссоциации позволила дать научное определение понятиям кислота , основание , буферная емкость раствора , создать теорию индикаторов, объяснить процессы ступенчатой диссоциации, гидролиза солей и т. д. Ниже рассмотрены некоторые примеры приложения это[«1 теории к химическому равновесию в растворах. [c.38]
Электролитическая диссоциация. Мы отметили две особенности кислот, солей и оснований 1) своеобразие их химических реакций в водном растворе и 2) способность этих растворов подвергаться электролизу. Эти особенности кислот, солей и оснований хорошо объясняются теорией электролитической диссоциации. Основное положение этой теории заключается в том, что [c.258]
Дальнейшее развитие химии и использование неводных растворителей привело к необходимости объяснить процессы, протекающие в этих растворителях. Например, хлорид аммония, ведущий себя как соль в водном растворе, при растворении в жидком аммиаке проявляет свойства кислоты, растворяя металлы с выделением водорода. Мочевина С0(КНг)2, растворяясь в безводной уксусной кислоте, проявляет свойства основания, в жидком аммиаке — свойства кислоты, а ее водные растворы нейтральны. Все эти факты нельзя было объяснить на основании теории электролитической диссоциации Аррениуса. В связи с этим определение кислот и оснований были пересмотрены. [c.75]
Сванте Аррениус (1859—1927), профессор университета в Стокгольме и директор Нобелевского института. Предложил теорию, объясняющую свойства растворов солей, кислот и оснований и получившую название теории электролитической диссоциации. Аррениусу принадлежит также ряд исследований по астрономии, космической физике и в области приложения физико-химических законов к биологическим процессам. [c.233]
На основе теории электролитической диссоциации дайте определения понятиям кислота, основание, соль. [c.77]
В качестве растворителя чаще всего применяют воду, поэтому рассмотрение кислот, оснований и солей ограничим только водными растворами, для которых целиком сохраняют справедливость определения кислот и оснований, вытекающего из теории электролитической диссоциации Аррениуса. [c.126]
[c.126]
На основе теории электролитической диссоциации даются определения и описываются свойства кислот, оснований и солей. [c.74]
Ионные реакции и уравнения. Согласно теории электролитической диссоциации, реакции между кислотами, основаниями и солями в водных растворах протекают между ионами, на которые распадаются молекулы этих веществ. [c.209]
Основы теории электролитической диссоциации. В 1887 г-Вант-Гофф установил, что определенное экспериментально осмотическое давление в растворах солей, кислот и оснований превышает вычисленное по уравнению (2.59). Подобные отклонения измеренных величин от вычисленных по соответствуюш,им уравнениям наб.5юдаются в сторону повышения для температуры кипения и в сторону понижения для температуры отвердевания этих растворов. Так, например, молекулярная масса Na l равна 58,5, а на основании криоскопических измерений она оказалась равной при-щ мерно 30. Не зная, чем можно объяснить эти отклонения, но стремясь сделать соответствующие уравнения пригодными для этих растворов, Вант-Гофф ввел в них поправочный множитель i, названный изотоническим коэффициентом . Подставляя коэффициент i в уравнение для расчета осмотического давления и в уравнения законов Рауля, получаем соотношения, пригодные для описания разбавленных растворов всех веществ, в том числе и для растворов солей, кислот и оснований [c.246]
Приведем в соответствии с теорией электролитической диссоциации определения кислот, оснований и солей. [c.62]
В 1887 г. С. Аррениусом была создана теория электролитической диссоциации, по которой кислотам и основаниям можно дать следующие определения. Кислоты — это электролиты, отщепляющие в водном растворе ионы H» «, а основания — электролиты, отщепляющие в растворе ионы ОН . В результате ассоциации этих ионов между кислотой и основанием происходит реакция нейтрализации с образованием воды и соответствующей соли. [c.166]
[c.166]
Согласно теории электролитической диссоциации все общие характерные свойства кислот — кислый вкус, изменение цвета индикаторов, взаимодействие с основаниями, основными оксидами, солями — обусловлены присутствием ионов водорода Н . [c.74]
Для объяснения электропроводности растворов и расплавов солей, кислот и оснований шведский ученый С. Аррениус создал теорию электролитической диссоциации (1887 г.) [c.179]
К началу XX в. теория электролитической диссоциации достигла больших успехов. На ее основе были объяснены многочисленные и разнообразные экспериментальные данные по электропроводности растворов, осмотическому давлению, температурам замерзания и другим физико-химическим свойствам растворов. Однако ряд экспериментальных данных теория объяснить не могла. Так, константа диссоциации электролита, выражаемая уравнением типа (152.4), в широком интервале концентраций изменялась. Особенно резкая концентрационная зависимость наблюдалась у водных растворов неорганических кислот, оснований и их солей (h3SO4, НС], NaOH, K l и т. п.). Разные экспериментальные методы часто приводили к неодинаковым значениям степени диссоциации электролита в одних и тех же условиях. [c.431]
Диссоциация кислот, оснований, солей. Определение кислот, оснований и солей дается с точки зрения теории электролитической диссоциации. [c.153]
С помощью теории электролитической диссоциации дают определения и описывают свойства кислот, оснований и солей. [c.109]
Приведенные реакции соответствуют образованию амфотерного соединения — кислоты, основания и соли, так как кислоты являются, например, в воде солями гидроксония, а основания — солями гидроксила. Хлорид аммония в жидком аммиаке является кислотой и одновременно солью аммония. Первый тип реакций показывает, что растворители, распадаясь при взаимодействии их молекул на катион и анион, проявляют амфотерные свойства например, вода дает ионы гидроксония и гидроксила. Эти реакции в классической теории электролитической диссоциации не учитывались. [c.48]
Эти реакции в классической теории электролитической диссоциации не учитывались. [c.48]
В разделе 2 вы уже познакомились с классификацией неорганических веществ, с номенклатурой оксидов, оснований, кислот, амфотерных гидроксидов и важнейших типов солей. Ниже рассматриваются общие химические свойства и способы получения этих важнейших классов неорганических веществ с позиций тех теоретических представлений, которые были получены вами при изучении предыдущих разделов, в частности, с позиции теории электролитической диссоциации. В заключение вскрывается генетическая связь между различными классами неорганических веществ. [c.225]
Согласно классической теории электролитической диссоциации С. Аррениуса кислоты, соли, основания (электролиты) в водных и некоторых неводных растворах существуют в виде независимых друг от друга частиц — ионов, образовавшихся при распаде молекул. Такие частицы (катионы и анионы) существуют в растворах независимо от того, наложено или нет на раствор электрическое напряжение. С. Аррениус ввел представление о частичной диссоциации электролитов в растворах. [c.191]
Выше были рассмотрены понятия кислота и основание с позиции теории электролитической диссоциации (см. 5.6). Однако эта теория не объясняет многих явлений, особенно тех, которые наблюдаются в нсводиых растворах. В водном растворе хлорид аммония ведет себя как соль, диссоциируя на ионы н С -, а е [c.101]
В пользу такой трактовки реакции нейтрализации свидетельствует тот факт, что тепловой эффект ее для сильных кислот и сильных оснований практически один и тот же (57,3 кДж/моль). Однако введенное Аррениусом и Оствальдом определение кислот и оснований не является достаточно общим. Например, из формулы аммиака NHз, с точки зрения теории электролитической диссоциации, никак не следует, что это вещество способно проявлять основные свойства, особенно в отсутствие воды. Однако известно, что газообразный аммиак вступает в реакцию нейтрализации с газообразным хлористы. м водородом с образованием средней соли Nh5 1. [c.94]
м водородом с образованием средней соли Nh5 1. [c.94]
Свойства кислот, оснований и солей с точки зрения теории электролитической диссоциации. Рассмотрим в свете теории элек Тролитической диссоциации свойства веществ, которые в водных растворах проявляют свойства электролитов. [c.243]
Протонная теория кислот и оснований. Теория электролитической диссоциации неприменима к взаимодействиям, не сопровождающимся диссоциацией на ионы. Например, аммиак, реагируя с безводным фтористым водородом, образует соль фторид аммония МНз + + НР = ЫН4р. Аммиак, не имея в своем составе гидроксильной группы, ведет себя как основание. [c.170]
Следует сказать, что теория кислот и оснований Аррениуса получила свое дальнейшее развитие в XX в. Было по-иному рассмотрено представление о природе кислотно-основного взаимодействия. Так, например, с позиций теории электролитической диссоциации аммиак Nh4 никак нельзя назвать основанием. В то же время газообразный аммиак вступает в реакцию с хлоро-водородом с образованием соли Nh5 I, т. е. проявляет основные свойства. Поэтому было дано следующее определение кислоты и основания [c.91]
Представления о кислотах и основаниях, основанные на теории электролитической диссоциации, применимы лишь при условии, что веш,ества реагируют в водном растворе. Однако эти представления не объясняют процессов, протекающих в неводных растворах. Так, например, если хлорид аммония в водном растворе ведет себя как соль (диссоциирует на ионы NH и С1 ), то в жидком аммиаке он проявляет свойства кислоты — растворяет металлы с выделением водорода. Мочевина OiNHa) в жидком аммиаке проявляет свойства кислоты, в безводной уксусной кислоте — свойства основания, а в водном растворе она нейтральна. Как основание ведет себя азотная кислота, растворенная в жидком фтороводороде или в безводной серной кислоте. [c.189]
Классификация неорганических веществ — Химия для Степы
Сложные вещества обычно делят на классы: оксиды, кислоты, основания, амфотерные гидроксиды и соли. Данная классификация несовершенна, т. к. в ней нет места для аммиака, соединений металлов с фосфором, азотом, углеродом и т. д.
Данная классификация несовершенна, т. к. в ней нет места для аммиака, соединений металлов с фосфором, азотом, углеродом и т. д.
Оксиды могут быть солеобразующими и несолеобразующими. Солеобразующим оксидам соответствуют гидроксиды и соли с элементом в той же степени окисления, что и в оксиде. Несолеобразующие оксиды не имеют соответствующих гидроксидов и солей. Таких оксидов немного: N2O, NO, SiO, CO.
Солеобразующие оксиды в зависимости от кислотно-основного характера делятся на кислотные, амфотерные и основные.
Основные оксиды образованы металлами с небольшими степенями окисления +1, +2. Амфотерные оксиды образованы переходными металлами со степенями окисления +3, +4, а также Be, Zn, Sn, Pb. Кислотные оксиды образованы неметаллами, а также металлами со степенью окисления больше, чем +4. Рис. 3.
______________________________________________
Гидроксиды
______________________________________________
Основания
ОСНОВАНИЯ – это сложные вещества, состоящие из ионов металла и гидроксид-ионов.
Основания – это сложные вещества, состоящие из катионов металла и одного или нескольких гидроксид-анионов. В основу классификации оснований могут быть положены разные признаки. Например, их отношение к воде. По данному признаку основания делят на растворимые в воде (щелочи) и нерастворимые в воде.
______________________________________________
Амфотерные гидроксиды
это сложные вещества, которые имеют свойства и кислот, и оснований, и потому их формулы можно записывать в разных формах:
Zn(OH)2 = h3ZnO2
форма основания форма кислоты
______________________________________________
Кислоты
КИСЛОТЫ – это сложные вещества, состоящие из ионов водорода и кислотных остатков.
Кислоты – это сложные вещества, состоящие из атомов водорода, способных замещаться на металлы, и кислотных остатков. Кислоты можно разделить на группы по содержанию кислорода: кислородосодержащие (например, HNO3, h3SO4, h4PO4) и бескислородные (HI, h3S).
______________________________________________
Соли
СОЛИ – это сложные вещества, состоящие из ионов металла и кислотных остатков.
Средние соли состоят из катионов металла (или аммония) и анионов кислотных остатков. Кислые соли, кроме катионов металла, содержат катионы водорода и анион кислотного остатка. Основные соли в своем составе содержат гидроксид-анионы.
Если соль образована двумя видами катионов металлов и одним анионом, то ее называют двойной. Например, сульфат алюминия-калия KAl(SO4)2.
Соли с двумя разными анионами и одним катионом называют смешанными. Например, Са(OCl)Cl – хлорид-гипохлорит кальция.
В комплексных солях содержится сложный ион, который принято заключать в квадратные скобки.
______________________________________________
По материалам сайтов
http://interneturok.ru/ru/school/chemistry/11-klass/undefined/klassifikatsiya-i-nomenklatura-neorganicheskih-veschestv
Кислотно-основное поведение оксидов
На этой странице обсуждаются реакции оксидов элементов периода 3 (натрия в хлор) с водой, а также с кислотами или основаниями, где это необходимо (как и раньше, аргон опускается, потому что он не образует окись).
Краткое описание тенденции
Оксиды: Представляющие интерес оксиды приведены ниже:
| Na 2 O | MgO | Al 2 O 3 | SiO 2 | П 4 О 10 | СО 3 | Класс 2 O 7 |
| П 4 О 6 | СО 2 | класс 2 O |
Тенденцию кислотно-щелочного поведения можно резюмировать следующим образом:
Кислотность увеличивается слева направо, от сильно основных оксидов слева до сильнокислых справа, с амфотерным оксидом (оксидом алюминия) в середине.
Амфотерный оксид — это оксид, который проявляет как кислотные, так и основные свойства.
Эта тенденция применима только к самым высоким оксидам отдельных элементов (см. Верхнюю строку таблицы) с наивысшими степенями окисления для этих элементов. Для других оксидов картина менее ясна. Кислотность неметаллических оксидов определяется в терминах кислотных растворов, образующихся в реакциях с водой — например, триоксид серы реагирует с водой с образованием серной кислоты. Однако все они будут реагировать с основаниями, такими как гидроксид натрия, с образованием солей, таких как сульфат натрия, как подробно описано ниже.
Оксид натрия
Оксид натрия — это простой сильноосновной оксид. Он является основным, поскольку содержит ион оксида, O 2-, который является очень сильным основанием с высокой тенденцией к объединению с ионами водорода.
Реакция с водой : Оксид натрия экзотермически реагирует с холодной водой с образованием раствора гидроксида натрия. Концентрированный раствор оксида натрия в воде будет иметь pH 14.
\ [Na_2O + H_2O \ стрелка вправо 2NaOH \]
Реакция с кислотами: Оксид натрия, как сильное основание, также реагирует с кислотами.Например, он реагирует с разбавленной соляной кислотой с образованием раствора хлорида натрия.
\ [Na_2O + 2HCl \ стрелка вправо 2NaCl + H_2O \]
Оксид магния
Оксид магния — еще один простой основной оксид, который также содержит ионы оксида. Однако он не так сильно щелочной, как оксид натрия, потому что ионы оксида не так слабо связаны. В оксиде натрия твердое вещество удерживается вместе за счет притяжения между ионами 1+ и 2-. В оксиде магния притяжение составляет от 2+ до 2- ионов.Из-за более высокого заряда металла требуется больше энергии, чтобы разорвать эту ассоциацию. Даже с учетом других факторов (таких как энергия, выделяемая при ионно-дипольном взаимодействии между катионами и водой), общий эффект заключается в том, что реакции с участием оксида магния всегда будут менее экзотермическими, чем реакции оксида натрия.
Реакция с водой: На первый взгляд кажется, что порошок оксида магния не реагирует с водой. Однако pH полученного раствора составляет около 9, что указывает на образование гидроксид-ионов.Фактически, в реакции образуется некоторое количество гидроксида магния, но, поскольку этот компонент почти нерастворим, фактически растворяется небольшое количество гидроксид-ионов. Реакция показана ниже:
\ [MgO + H_2O \ стрелка вправо Mg (OH) _2 \]
Реакция с кислотами: Оксид магния реагирует с кислотами, как и предполагалось для простого оксида металла. Например, он реагирует с теплой разбавленной соляной кислотой с образованием раствора хлорида магния.
\ [MgO + 2HCl \ стрелка вправо MgCl_2 + H_2O \]
Оксид алюминия
Описание свойств оксида алюминия может сбивать с толку, поскольку он существует в нескольких различных формах.Одна из этих форм очень инертна (химически известна как альфа-Al 2 O 3 ) и производится при высоких температурах. Следующие ниже реакции касаются более реакционноспособных форм молекулы. Оксид алюминия амфотерный. Он вступает в реакцию и как основание, и как кислота.
Реакция с водой: Оксид алюминия не растворяется в воде и не реагирует подобно оксиду натрия и оксиду магния. Ионы оксида слишком прочно удерживаются в твердой решетке, чтобы реагировать с водой.
Реакция с кислотами: Оксид алюминия содержит ионы оксида и поэтому реагирует с кислотами так же, как оксиды натрия или магния. Оксид алюминия реагирует с горячей разбавленной соляной кислотой с образованием раствора хлорида алюминия.
\ [Al_2O_3 + 6HCl \ стрелка вправо 2AlCl_3 + 3H_2O \]
Эта и другие реакции демонстрируют амфотерную природу оксида алюминия.
Реакция с основаниями: Оксид алюминия также проявляет кислотные свойства, как показано в его реакциях с основаниями, такими как гидроксид натрия. Существуют различные алюминаты (соединения, в которых алюминий является компонентом отрицательного иона), что возможно, потому что алюминий может образовывать ковалентные связи с кислородом. Это возможно, потому что разница электроотрицательностей между алюминием и кислородом мала, в отличие от разницы между натрием и кислородом, например (электроотрицательность увеличивается за период)
Существуют различные алюминаты (соединения, в которых алюминий является компонентом отрицательного иона), что возможно, потому что алюминий может образовывать ковалентные связи с кислородом. Это возможно, потому что разница электроотрицательностей между алюминием и кислородом мала, в отличие от разницы между натрием и кислородом, например (электроотрицательность увеличивается за период)
Оксид алюминия реагирует с горячим концентрированным раствором гидроксида натрия с образованием бесцветного раствора тетрагидроксоалюмината натрия:
\ [Al_2O_3 + 2NaOH + 3H_2O \ стрелка вправо 2NaAl (OH) _4 \]
Диоксид кремния (оксид кремния (IV))
Кремний слишком похож по электроотрицательности на кислород, чтобы образовывать ионные связи.Следовательно, поскольку диоксид кремния не содержит оксидных ионов, он не имеет основных свойств. На самом деле он очень слабокислый, реагирует с сильными основаниями.
Взаимодействие с водой: Диоксид кремния не реагирует с водой из-за термодинамической трудности разрушения его ковалентной сетевой структуры.
Реакция с основаниями : Диоксид кремния реагирует с горячим концентрированным раствором гидроксида натрия, образуя бесцветный раствор силиката натрия:
\ [SiO_2 + 2NaOH \ стрелка вправо Na_2SiO_3 + h3O \]
В другом примере реакции кислого диоксида кремния с основанием, извлечения железа в доменной печи, оксид кальция из известняка реагирует с диоксидом кремния с образованием жидкого шлака, силиката кальция:
\ [SiO_2 + CaO \ стрелка вправо CaSiO_3 \]
Оксиды фосфора
Здесь рассматриваются два оксида фосфора: оксид фосфора (III) P 4 O 6 и оксид фосфора (V) P 4 O 10 .
Оксид фосфора (III): Оксид фосфора (III) реагирует с холодной водой с образованием раствора слабой кислоты, H 3 PO 3 — известной как фосфористая кислота, ортофосфорная кислота или фосфоновая кислота:
\ [P_4O_6 + 6H_2O \ rightarrow 4H_3PO_3 \]
Структура полностью протонированной кислоты показана ниже:
Протоны остаются связанными до тех пор, пока не будет добавлена вода; даже тогда, поскольку фосфорная кислота является слабой кислотой, несколько молекул кислоты депротонируются. Фосфорная кислота имеет pK a , равное 2,00, что является более кислым, чем обычные органические кислоты, такие как этановая кислота (pK a = 4,76).
Фосфорная кислота имеет pK a , равное 2,00, что является более кислым, чем обычные органические кислоты, такие как этановая кислота (pK a = 4,76).
Маловероятно, что оксид фосфора (III) непосредственно взаимодействует с основанием. В фосфористой кислоте два атома водорода в группах -ОН являются кислотными, а третий атом водорода — нет. Следовательно, есть две возможные реакции с основанием, таким как гидроксид натрия, в зависимости от количества добавленного основания:
\ [NaOH + H_3PO_3 \ rightarrow NaH_2PO_3 + H_2O \]
\ [2NaOH + H_3PO_3 \ rightarrow Na_2HPO_3 + 2H_2O \]
В первой реакции только один из протонов реагирует с гидроксид-ионами основания.Во втором случае (используя вдвое больше гидроксида натрия) реагируют оба протона.
Если вместо этого оксид фосфора (III) взаимодействует непосредственно с раствором гидроксида натрия, возможны те же соли:
\ [4NaOH + P_4O_6 + 2H_2O \ стрелка вправо 4NaH_2PO_3 \]
\ [9NaOH + P_4O_6 \ стрелка вправо 4Na_2HPO_3 + 2H_2O \]
Оксид фосфора (V): Оксид фосфора (V) бурно реагирует с водой с образованием раствора, содержащего смесь кислот, природа которой зависит от условий реакции.Обычно рассматривается только одна кислота, фосфорная (V) кислота, H 3 PO 4 (также известная как фосфорная кислота или ортофосфорная кислота).
\ [P_4O_ {10} + 6H_2O \ rightarrow 4H_3PO_4 \]
На этот раз полностью протонированная кислота имеет следующую структуру:
Фосфорная (V) кислота — еще одна слабая кислота с pK a , равным 2,15, что незначительно слабее, чем фосфористая кислота. Растворы каждой из этих кислот с концентрацией около 1 моль дм -3 имеют pH около 1.
Оксид фосфорной кислоты (V) также вряд ли будет напрямую реагировать с основанием, но гипотетические реакции рассматриваются. В кислотной форме молекула имеет три кислотные -ОН группы, которые могут вызывать трехстадийную реакцию с гидроксидом натрия:
\ [NaOH + H_3PO_4 \ rightarrow NaH_2PO_4 + H_2O \]
\ [2NaOH + H_3PO_4 \ rightarrow Na_2HPO_4 + 2H_2O \]
\ [3NaOH + H_3PO_4 \ rightarrow Na_3PO_4 + 3H_2O \]
Подобно оксиду фосфора (III), если оксид фосфора (V) взаимодействует непосредственно с раствором гидроксида натрия, образуется такая же возможная соль, как на третьей стадии (и только эта соль):
\ [12NaOH + P_4O_ {10} \ rightarrow 4Na_3PO_4 + 6H_2O \]
Оксиды серы
Рассматриваются два оксида: диоксид серы SO 2 и триоксид серы SO 3 .
Диоксид серы: Диоксид серы хорошо растворяется в воде, реагируя с образованием раствора сернистой кислоты (также известной как серная (IV) кислота), H 2 SO 3 , как показано в реакции ниже. Этот вид существует только в растворе, и при любой попытке его изолировать выделяется диоксид серы.
\ [SO_2 + H_2O \ стрелка вправо H_2SO_3 \]
Протонированная кислота имеет следующую структуру:
Сернистая кислота также является относительно слабой кислотой с pK и около 1.8, но немного сильнее, чем две указанные выше фосфорсодержащие кислоты. Достаточно концентрированный раствор сернистой кислоты имеет pH около 1.
.Диоксид серы также напрямую реагирует с основаниями, такими как раствор гидроксида натрия. Барботирование диоксида серы через раствор гидроксида натрия сначала образует раствор сульфита натрия, а затем раствор гидросульфита натрия, если диоксид серы находится в избытке.
\ [SO_2 + 2NaOH \ стрелка вправо Na_2SO_3 + H_2O \]
\ [Na_2SO_3 + H_2O \ rightarrow 2NaHSO_3 \]
Другая важная реакция диоксида серы — с основным оксидом кальция с образованием сульфита кальция (также известного как сульфат кальция (IV)).Это один из важных методов удаления диоксида серы из дымовых газов на электростанциях.
\ [CaO + SO_2 \ стрелка вправо CaSO_3 \]
Триоксид серы: Триоксид серы бурно реагирует с водой с образованием тумана из капель концентрированной серной кислоты.
\ [SO_3 + H_2O \ rightarrow H_2SO_4 \]
Чистая, полностью протонированная серная кислота имеет структуру:
Серная кислота — сильная кислота, и растворы обычно имеют pH около 0.{2-} (водн.) \]
Это полезно, если вы понимаете причину, по которой серная кислота является более сильной кислотой, чем серная кислота. Вы можете применить те же рассуждения к другим кислотам, которые вы найдете на этой странице.
Серная кислота сильнее серной кислоты, потому что, когда ион водорода теряется из одной из групп -ОН серной кислоты, отрицательный заряд, оставшийся на кислороде, распространяется (делокализуется) по иону за счет взаимодействия с кислородом с двойной связью. атомы. Отсюда следует, что большее количество атомов кислорода с двойной связью в ионе делает возможной большую делокализацию; большая делокализация приводит к большей стабильности, что снижает вероятность рекомбинации иона с ионом водорода и его превращения в неионизированную кислоту.
Серная кислота имеет только один кислород с двойной связью, тогда как серная кислота имеет два; дополнительная двойная связь обеспечивает гораздо более эффективную делокализацию, гораздо более стабильный ион и более сильную кислоту. Серная кислота проявляет все реакции, характерные для сильной кислоты. Например, при реакции с гидроксидом натрия образуется сульфат натрия; в этой реакции оба кислых протона реагируют с гидроксид-ионами, как показано:
\ [2NaOH + H_2SO_4 \ стрелка вправо Na_2SO_4 + 2H_2O \]
В принципе, гидросульфат натрия можно получить, используя вдвое меньше гидроксида натрия; в этом случае удаляется только один из кислых атомов водорода.
Сам по себе триоксид серы также напрямую реагирует с основаниями, такими как оксид кальция, с образованием сульфата кальция:
\ [CaO + SO_3 \ стрелка вправо CaSO_4 \]
Эта реакция аналогична описанной выше реакции с диоксидом серы.
Оксиды хлора
Хлор образует несколько оксидов, но здесь рассматриваются только два (оксид хлора (VII), Cl 2 O 7 и оксид хлора (I), Cl 2 O). Оксид хлора (VII) также известен как гептоксид дихлора, а оксид хлора (I) — как монооксид дихлора.
Оксид хлора (VII): Оксид хлора (VII) является высшим оксидом хлора — атом хлора находится в максимальной степени окисления +7. Он продолжает тенденцию высших оксидов элементов периода 3 к тому, чтобы быть более сильными кислотами. Оксид хлора (VII) реагирует с водой, давая очень сильную кислоту, хлорную (VII) кислоту, также известную как хлорная кислота.
Оксид хлора (VII) реагирует с водой, давая очень сильную кислоту, хлорную (VII) кислоту, также известную как хлорная кислота.
\ [Cl_2O_7 + H_2O \ стрелка вправо 2HClO_4 \]
Как и в серной кислоте, pH типичных растворов хлорной кислоты составляет около 0.Нейтральная хлорная (VII) кислота имеет следующую структуру:
Когда ион хлората (VII) (перхлорат-ион) образуется в результате потери протона (например, в реакции с водой), заряд делокализован по каждому атому кислорода в ионе. Это делает ион очень стабильным, а хлорную (VII) кислоту очень сильной.
Хлорная (VII) кислота реагирует с раствором гидроксида натрия с образованием раствора хлората натрия (VII):
\ [NaOH + HClO_4 \ стрелка вправо NaClO_4 + h3O \]
Сам оксид хлора (VII) также непосредственно реагирует с раствором гидроксида натрия с образованием того же продукта:
\ [2NaOH + Cl_2O_7 \ стрелка вправо 2NaClO_4 + H_2O \]
Оксид хлора (I): Оксид хлора (I) намного менее кислый, чем оксид хлора (VII).- \) также известна как хлорноватистая кислота.
\ [Cl_2O + H_2O \ rightleftharpoons 2HOCl \]
Структура хлорноватой (I) кислоты в точности такая, как показано ее формулой HOCl. У него нет атомов кислорода с двойными связями и нет способа делокализации заряда по отрицательному иону, образованному в результате потери водорода. Следовательно, образовавшийся отрицательный ион не очень стабилен и легко восстанавливает свой протон, чтобы превратиться в кислоту. Хлорная (I) кислота очень слабая (pK a = 7,43) и реагирует с раствором гидроксида натрия с образованием раствора хлората натрия (I) (гипохлорита натрия):
\ [NaOH + HOCl \ rightarrow NaOCl + H_2O \]
Оксид хлора (I) также напрямую реагирует с гидроксидом натрия с образованием того же продукта:
\ [2NaOH + Cl_2O \ стрелка вправо 2NaOCl + H_2O \]
Реакции кислот — Кислоты и основания — Eduqas — GCSE Chemistry (Single Science) Revision — Eduqas
21z98tv7o7a.0.0.0.1:0.1.0.$0.$1.$0″> Кислоты принимают участие в реакциях, в которых образуются соли.В этих реакциях ионы водорода в кислотах заменяются ионами металлов или ионами аммония.Реакции с металлами
Соль и водород образуются при реакции кислоты с металлами. В общем:
кислота + металл → соль + водород
Металл должен быть более активным, чем водород, в ряду реакционной способности, чтобы он мог реагировать с кислотой.
Например:
соляная кислота + магний → хлорид магния + водород
2HCl (водный) + Mg (s) → MgCl 2 (водный) + H 2 (г)
- Вопрос
Водород собирается в пробирке во время реакции между магнием и соляной кислотой.Опишите лабораторный тест на водород.
- Показать ответ
Поместите освещенную шину возле устья пробирки. Водород воспламеняется с треском.
Реакции с оксидами металлов
Соль и вода образуются, когда кислоты реагируют с оксидами металлов. Оксиды металлов являются основаниями, потому что они нейтрализуют кислоты.
В целом:
кислота + оксид металла → соль + вода
Например:
серная кислота + оксид меди (II) → сульфат меди (II) + вода
H 2 SO 4 (водн. ) + CuO (s) → CuSO 4 (водн.) + H 2 O (l)
Реакции с гидроксидами металлов
При взаимодействии кислот с гидроксидами металлов образуются соль и вода.Гидроксиды металлов являются основаниями, потому что они нейтрализуют кислоты.
В общем:
кислота + гидроксид металла → соль + вода
Например:
соляная кислота + гидроксид магния → хлорид магния + вода
2HCl (водный) + Mg (OH) 2 (s) → MgCl 2 (водн.) + 2H 2 O (l)
Реакции с карбонатами
При взаимодействии кислоты с карбонатами образуются соль, вода и диоксид углерода. В общем:
0.0.1:0.1.0.$0.$6.$2″> кислота + карбонат → соль + вода + диоксид углеродаНапример:
азотная кислота + карбонат меди (II) → нитрат меди (II) + вода + диоксид углерода
2HNO 3 (водн.) + CuCO 3 (т) → Cu (NO 3 ) 2 (водн.) + H 2 O (л) + CO 2 (г)
- Вопрос
Дается двуокись углерода отключается во время реакции между карбонатом меди (II) и соляной кислотой.Опишите лабораторный тест на углекислый газ.
- Показать ответ
Продуть газ через известковую воду. Двуокись углерода превращает известковую воду в молочно-белый или мутно-белый цвет.
Оксиды металлов и гидроксиды металлов реагируют с кислотами с образованием солей и воды.
14.4 Гидролиз солевых растворов — химия
Цели обучения
К концу этого раздела вы сможете:
- Предсказать, будет ли солевой раствор кислым, основным или нейтральным
- Вычислить концентрации различных веществ в солевом растворе
- Опишите процесс, при котором растворы некоторых ионов металлов становятся кислыми
Как мы видели в разделе о химических реакциях, когда кислота и основание смешиваются, они подвергаются реакции нейтрализации. Слово «нейтрализация», по-видимому, подразумевает, что стехиометрически эквивалентный раствор кислоты и основания будет нейтральным. Иногда это верно, но соли, которые образуются в этих реакциях, могут иметь собственные кислотные или основные свойства, как мы сейчас увидим.
Слово «нейтрализация», по-видимому, подразумевает, что стехиометрически эквивалентный раствор кислоты и основания будет нейтральным. Иногда это верно, но соли, которые образуются в этих реакциях, могут иметь собственные кислотные или основные свойства, как мы сейчас увидим.
Раствор считается нейтральным, если он содержит равные концентрации ионов гидроксония и гидроксида. Когда мы смешиваем растворы кислоты и основания, происходит кислотно-щелочная реакция нейтрализации. Однако, даже если мы смешаем стехиометрически эквивалентные количества, мы можем обнаружить, что полученный раствор не является нейтральным.Он может содержать либо избыток ионов гидроксония, либо избыток гидроксид-ионов, поскольку природа образующейся соли определяет, будет ли раствор кислотным, нейтральным или основным. Следующие четыре ситуации иллюстрируют, как растворы с различными значениями pH могут возникать после реакции нейтрализации с использованием стехиометрически эквивалентных количеств:
- Сильная кислота и сильное основание, такие как HCl ( водн. ) и NaOH ( водн. ), будут реагировать с образованием нейтрального раствора, поскольку полученные конъюгированные партнеры имеют незначительную силу (см. Главу 14.3 Относительная сила кислот и оснований):
[латекс] \ text {HCl} (aq) \; + \; \ text {NaOH} (aq) \; {\ rightleftharpoons} \; \ text {NaCl} (aq) \; + \; \ text {H } _2 \ text {O} (l) [/ латекс]
- Сильная кислота и слабое основание дают слабокислый раствор не из-за задействованной сильной кислоты, а из-за сопряженной кислоты слабого основания.
- Слабая кислота и сильное основание дают слабощелочной раствор. Раствор слабой кислоты реагирует с раствором сильного основания с образованием сопряженного основания слабой кислоты и сопряженной кислоты сильного основания.Конъюгированная кислота сильного основания является более слабой кислотой, чем вода, и не влияет на кислотность полученного раствора. Однако сопряженное основание слабой кислоты является слабым основанием и слегка ионизируется в воде.
 Это увеличивает количество гидроксид-иона в растворе, образующемся в реакции, и делает его слегка щелочным.
Это увеличивает количество гидроксид-иона в растворе, образующемся в реакции, и делает его слегка щелочным. - Слабая кислота плюс слабое основание могут давать кислотный, основной или нейтральный раствор. Это самый сложный из четырех типов реакций. Когда конъюгированная кислота и конъюгат основания имеют неодинаковые силы, раствор может быть либо кислотным, либо основным, в зависимости от относительной силы двух конъюгатов.Иногда слабая кислота и слабое основание будут иметь такую же силу , поэтому их соответствующие конъюгированные основание и кислота будут иметь одинаковую силу, и раствор будет нейтральным. Чтобы предсказать, будет ли конкретная комбинация кислотной, основной или нейтральной, необходимо сравнить табличные значения K конъюгатов.
Желудочные антациды
Наши желудки содержат раствор примерно 0,03 M HCl, который помогает нам переваривать пищу, которую мы едим.Чувство жжения, связанное с изжогой, является результатом утечки желудочной кислоты через мышечный клапан в верхней части желудка в нижнюю часть пищевода. Выстилка пищевода не защищена от разъедающего воздействия желудочной кислоты, как слизистая оболочка желудка, и результаты могут быть очень болезненными. Когда у нас изжога, мы чувствуем себя лучше, если уменьшаем избыток кислоты в пищеводе с помощью антацидов. Как вы уже догадались, антациды — это основы.Одним из наиболее распространенных антацидов является карбонат кальция CaCO 3 . Реакция,
[латекс] \ text {CaCO} _3 (s) \; + \; 2 \ text {HCl} (aq) \; {\ rightleftharpoons} \; \ text {CaCl} _2 (aq) \; + \; \ текст {H} _2 \ text {O} (l) \; + \; \ text {CO} _2 (g) [/ latex]
не только нейтрализует желудочную кислоту, но и производит CO 2 ( г, ), что может вызвать удовлетворительную отрыжку.
Молоко магнезии представляет собой суспензию труднорастворимого основного гидроксида магния, Mg (OH) 2 .{-} \; {\ rightleftharpoons} \; 2 \ text {H} _2 \ text {O} (l) [/ latex]
При этой реакции не образуется углекислый газ, но антациды, содержащие магний, могут оказывать слабительное действие.
Некоторые антациды содержат гидроксид алюминия, Al (OH) 3 , в качестве активного ингредиента. Гидроксид алюминия имеет тенденцию вызывать запоры, а некоторые антациды используют гидроксид алюминия вместе с гидроксидом магния, чтобы сбалансировать побочные эффекты двух веществ.
Кулинарные аспекты химии
Кулинария — это синтетическая химия, которую можно употреблять в пищу.В кулинарном мире существует ряд примеров кислотно-щелочной химии. Одним из примеров является использование пищевой соды или бикарбоната натрия в выпечке. NaHCO 3 — это база. Когда он вступает в реакцию с кислотой, такой как лимонный сок, пахта или сметана в жидком тесте, в результате разложения образовавшейся угольной кислоты образуются пузырьки углекислого газа, и тесто «поднимается». Разрыхлитель представляет собой комбинацию бикарбоната натрия и одной или нескольких кислотных солей, которые вступают в реакцию, когда два химических вещества вступают в контакт с водой в жидком тесте.
Многие люди любят добавлять в приготовленную рыбу лимонный сок или уксус, которые являются кислотами (рис. 1). Оказывается, в системе рыб есть летучие амины (основания), которые нейтрализуются кислотами с образованием нелетучих солей аммония. Это уменьшает запах рыбы, а также добавляет «кислый» вкус, который нам нравится.
Рисунок 1. Реакция нейтрализации происходит между лимонной кислотой в лимонах или уксусной кислотой в уксусе и основаниями в мясе рыбы.Маринование — это метод консервирования овощей в кислой среде естественного происхождения. Овощ, например огурец, помещают в герметичную банку, погруженную в рассол. Рассол способствует росту полезных бактерий и подавляет рост вредных бактерий. Полезные бактерии питаются крахмалом в огурце и производят молочную кислоту в качестве побочного продукта в процессе, называемом ферментацией. Молочная кислота в конечном итоге увеличивает кислотность рассола до уровня, который убивает любые вредные бактерии, которым необходима щелочная среда. {\; \; -}] = 0.{-10} [/ латекс]
Решая это уравнение, мы получаем [CH 3 CO 2 H] = 1,1 × 10 −5 M .
Проверьте свои знания
Каков pH 0,083- M раствора CN —? Используйте 4,9 × 10 −10 как K a для HCN. Подсказка: нам, вероятно, потребуется преобразовать pOH в pH или найти [H 3 O + ], используя [OH — ] на заключительных этапах решения этой проблемы.
В растворе соли, образованной реакцией слабой кислоты и слабого основания, чтобы предсказать pH, мы должны знать как K a слабой кислоты, так и K b слабая база.Если K a > K b , раствор является кислым, а если K b > K a , раствор является основным.
Пример 3
Определение кислотной или основной природы солей
Определите, являются ли водные растворы следующих солей кислотными, основными или нейтральными:
(а) KBr
(б) NaHCO 3
(в) NH 4 Класс
(г) Na 2 HPO 4
(e) NH 4 F
Раствор
Рассмотрим каждый из ионов отдельно с точки зрения его влияния на pH раствора, как показано здесь:
(a) Катион K + и анион Br — являются зрителями, поскольку они являются катионом сильного основания (KOH) и анионом сильной кислоты (HBr), соответственно.{\; \; +} [/ latex] составляет 5,6 × 10 −10 , что кажется очень маленьким, но K b F — составляет 1,4 × 10 −11 , поэтому решение является кислым, так как K a > K b .
Проверьте свои знания
Определите, являются ли водные растворы следующих солей кислотными, основными или нейтральными:
(а) К 2 CO 3
(б) CaCl 2
(в) KH 2 PO 4
(г) (NH 4 ) 2 CO 3
(e) AlBr 3
Ответ:
(а) базовый; (б) нейтральный; (в) базовая; (г) базовая; (д) кислая
Если мы измерим pH растворов различных ионов металлов, мы обнаружим, что эти ионы действуют как слабые кислоты в растворе.{\; \; -} (водн.) [/ латекс]
Мы часто видим формулу этого иона просто как «Al 3+ ( aq )», без явного упоминания шести молекул воды, которые являются ближайшими к иону алюминия, и просто описывая ион как сольватированный в воде. (гидратированный). Это похоже на упрощение формулы иона гидроксония, H 3 O + до H + . Однако в этом случае гидратированный ион алюминия является слабой кислотой (рис. 2) и отдает протон молекуле воды.{+} (aq) \; + \; \ text {Al (H} _2 \ text {O}) _ 3 (\ text {OH}) _ 3 (aq) \ end {array} [/ latex]
Обратите внимание, что некоторые из этих разновидностей алюминия проявляют амфипротическое поведение, поскольку они действуют как кислоты, когда они появляются в левой части выражений равновесия, и как основания, когда они появляются в правой части.
Рисунок 2. Когда ион алюминия вступает в реакцию с водой, гидратированный ион алюминия становится слабой кислотой.Однако ионизация катиона, несущего более одного заряда, обычно не происходит за пределами первой стадии.{2 +}] [/ latex] в 0,15- M растворе Al (NO 3 ) 3 , который содержит достаточно сильной кислоты HNO 3 , чтобы получить [H 3 O + ] до 0,10 M ?
Константы для различных стадий ионизации для многих ионов металлов неизвестны, поэтому мы не можем рассчитать степень их ионизации. Однако практически все гидратированные ионы металлов, кроме ионов щелочных металлов, ионизируются с образованием кислых растворов. Ионизация увеличивается по мере увеличения заряда иона металла или уменьшения размера иона металла.
Характерные свойства водных растворов кислот Бренстеда-Лоури обусловлены присутствием ионов гидроксония; водные растворы оснований Бренстеда-Лоури обусловлены присутствием гидроксид-ионов. Нейтрализация, которая происходит при объединении водных растворов кислот и оснований, является результатом реакции ионов гидроксония и гидроксида с образованием воды. Некоторые соли, образующиеся в реакциях нейтрализации, могут сделать растворы продуктов слабокислыми или слабощелочными.
Растворы, содержащие соли или гидратированные ионы металлов, имеют pH, который определяется степенью гидролиза ионов в растворе. PH растворов может быть рассчитан с использованием известных методов равновесия, или он может быть качественно определен как кислотный, основной или нейтральный в зависимости от относительных K a и K b вовлеченных ионов.
Химия: упражнения в конце главы
- Определите, являются ли водные растворы следующих солей кислотными, основными или нейтральными:
(а) Al (NO 3 ) 3
(б) РБИ
(в) KHCO 2
(г) CH 3 NH 3 Br
- Определите, являются ли водные растворы следующих солей кислотными, основными или нейтральными:
(а) FeCl 3
(б) К 2 CO 3
(в) NH 4 Br
(г) KClO 4
- Новокаин, C 13 H 21 O 2 N 2 Cl, представляет собой соль основного прокаина и соляной кислоты.Константа ионизации новокаина составляет 7 · 10 −6 . Кислый или щелочной раствор новокаина? Что такое [H 3 O + ], [OH — ] и pH 2,0% -ного по массе раствора новокаина, предполагая, что плотность раствора составляет 1,0 г / мл.
Решения
Ответы на упражнения по химии в конце главы
2. (а) кислая; (б) базовый; (в) кислая; (г) нейтральный
открытых учебников | Сиявула
Математика
Наука
- Читать онлайн
Учебники
Английский
Класс 7A
Марка 7Б
7 класс (A и B вместе)
Африкаанс
Граад 7А
Граад 7Б
Граад 7 (A en B saam)
Пособия для учителя
- Читать онлайн
Учебники
Английский
Марка 8A
Сорт 8Б
Оценка 8 (вместе A и B)
Африкаанс
Граад 8А
Граад 8Б
Граад 8 (A en B saam)
Пособия для учителя
- Читать онлайн
Учебники
Английский
Марка 9А
Марка 9Б
9 класс (A и B вместе)
Африкаанс
Граад 9А
Граад 9Б
Граад 9 (A en B saam)
Пособия для учителя
- Читать онлайн
Учебники
Английский
Класс 4A
Класс 4Б
Класс 4 (вместе A и B)
Африкаанс
Граад 4А
Граад 4Б
Граад 4 (A en B saam)
Пособия для учителя
- Читать онлайн
Учебники
Английский
Марка 5А
Марка 5Б
Оценка 5 (вместе A и B)
Африкаанс
Граад 5А
Граад 5Б
Граад 5 (A en B saam)
Пособия для учителя
- Читать онлайн
Учебники
Английский
Марка 6А
Марка 6Б
6 класс (A и B вместе)
Африкаанс
Граад 6А
Граад 6Б
Граад 6 (A en B saam)
Пособия для учителя
Наша книга лицензионная
Эти книги не просто бесплатные, они также имеют открытую лицензию! Один и тот же контент, но разные версии (брендированные или нет) имеют разные лицензии, как объяснено:
CC-BY-ND (фирменные версии)
Вам разрешается и поощряется свободное копирование этих версий.Вы можете делать ксерокопии, распечатывать и распространять их сколько угодно раз. Вы можете скачать их на свой мобильный телефон, iPad, ПК или флешку. Вы можете записать их на компакт-диск, отправить по электронной почте или загрузить на свой веб-сайт. Единственным ограничением является то, что вы не можете адаптировать или изменять эти версии учебников, их содержание или обложки, поскольку они содержат соответствующие бренды Siyavula, спонсорские логотипы и одобрены Департаментом базового образования. Для получения дополнительной информации посетите Creative Commons Attribution-NoDerivs 3.0 Непортированный.
Узнайте больше о спонсорстве и партнерстве с другими, которые сделали возможным выпуск каждого из открытых учебников.
CC-BY (версии без марочного знака)
Эти небрендовые версии одного и того же контента доступны для вас, чтобы вы могли делиться ими, адаптировать, преобразовывать, модифицировать или дополнять их любым способом, с единственным требованием — дать соответствующую оценку Siyavula. Для получения дополнительной информации посетите Creative Commons Attribution 3.0 Unported.
Видеоурок: Реакции оксидов
Стенограмма видео
В этом видео мы узнаем, что оксид является кислотным, основным, амфотерным и нейтральным.Посмотрим на химические уравнения того, как некоторые оксиды реагируют с кислотами. Во-первых, давайте спросим себя, что такое оксид? Оксид — это соединение, которое содержит кислород элемента, связанный с другим элементом. Например, в углекислом газе кислород связан с углеродом. Некоторые часто встречающиеся оксиды о которых вы, возможно, слышали, оксид железа (III), который является основным компонентом ржавчина, диоксид серы, который иногда используется в качестве консерванта, диазот монооксид, который является названием ИЮПАК, а общее название — закись азота, это веселящий газ, вода, диоксид кремния или кремнезем, который является основным компонентом песка, оксид алюминия и оксид магния.
Возможно, вы добыли магний оксид в лаборатории. Щипцы содержат магний лента в пламени горелки Бунзена. Происходит сильно экзотермическая реакция при этом выделяется много тепла и света, поскольку магний реагирует с кислородом в воздух для производства оксида магния. Все оксиды можно разделить на одна из четырех групп: кислотные, основные, амфотерные или нейтральные оксиды. Давайте рассмотрим это и начнем с кислыми оксидами.Кислотные оксиды — это те, которые при они реагируют с водой с образованием кислот. Эти оксиды содержат неметаллы из группы с 14 по 17 периодической таблицы. Общее уравнение неметалла оксид плюс вода реагируют с образованием кислоты. Давайте посмотрим на несколько примеров.
Когда газообразный диоксид серы реагирует с вода, образуется сернистая кислота, h3SO3. Когда оксид неметалла, углерод диоксид, реагирует с водой, образуется углекислота или h3CO3.Эти две реакции могут происходить в окружающая среда, когда в атмосфере много SO2 и CO2. Жидкая вода и капли дождя могут взаимодействуют с диоксидом углерода и диоксидом серы в атмосфере и производят две кислоты угольная и сернистая. Эти две кислоты являются компонентами кислотный дождь. Последний пример того, когда неметалл оксид взаимодействует с водой с образованием кислоты — это реакция диоксида азота газ с водой для получения азотной кислоты.Если несколько капель универсального индикатор добавлялся в растворы этих кислот, он становился красно-оранжевым, доказывая что оксиды неметаллов SO2, CO2 и NO2, когда они реагируют с водой, действительно производят кислоты.
Теперь давайте посмотрим на основные оксиды. Основной оксид — это оксид, который при реакции с водой образует основание или щелочь. Обычно основные оксиды содержат металлы из первой или второй группы периодической таблицы.Общее уравнение — оксид металла плюс вода реагирует с образованием основания или щелочи. Щелочь — это вещество, содержащее гидроксид-ион ОН-. Вот два примера уравнений где оксиды металлов производят гидроксиды или щелочные растворы. В первом случае оксид натрия реагирует с водой с образованием гидроксида натрия, а во втором оксид кальция реагирует с вода для производства гидроксида кальция. Гидроксид натрия хорошо растворим в воде, в то время как гидроксид кальция мало растворим.Тем не менее, если несколько капель к этим растворам добавлялся универсальный индикатор, он становился сине-фиолетовым, подтверждение того, что растворы являются щелочными или щелочными, и доказательство того, что эти оксиды действительно реагирует с водой с образованием оснований или щелочей.
До сих пор мы видели, что неметаллические оксиды или кислотные оксиды реагируют с водой с образованием кислот и оксидов металлов или основные оксиды реагируют с водой с образованием основания.Кислые оксиды также могут действовать как кислоты и реагируют с основанием с образованием соли и воды. И основные оксиды могут действовать как основания в результате реакции с кислотой с образованием соли и воды. Применяется общее правило: кислота реагирует с основанием с образованием соли и воды. Чуть позже в этом видео мы конкретно посмотрите, как основные оксиды реагируют с кислотами с образованием соли и вода. А пока перейдем к третьему тип оксида, амфотерные оксиды.
Амфотерные оксиды, в отличие от кислых и основные оксиды, обычно не растворяются в воде и не реагируют с ней. Тем не менее, они показывают как кислотные и основные свойства. Они ведут себя как кислота, когда реагируют с основанием, и они ведут себя как основание, когда реагируют с кислотой. Эти оксиды содержат такие металлы, как медь, цинк, свинец, бериллий, алюминий и олово. Мы видели минуту назад, что когда Реакция взаимодействия кислоты и основания с образованием соли и воды.Так как амфотерные оксиды могут ведут себя как кислоты или основания, есть два общих уравнения, на которые следует обратить внимание. Когда эти оксиды ведут себя как кислота, уравнение представляет собой амфотерный оксид плюс основание, что дает соль и воду. И когда они реагируют как база, уравнение — амфотерный оксид плюс кислота, дающие соль и воду.
Рассмотрим пример для каждый. Оксид алюминия амфотерный. Не растворяется и не реагирует с водой и может действовать как кислота или щелочь.Когда он реагирует с основанием, таким как производятся гидроксид натрия, алюминат натрия, соль и вода. Обратите внимание, что эта формула упрощение. Алюминий может образовывать довольно сложные ионы в растворе. Формула натрия здесь алюминат на самом деле является формулой твердого безводного продукта. Но алюминат натрия в присутствие воды хорошо растворимо и поэтому будет реагировать с водой с образованием гидратированного соединение со сложной формулой, на которое мы здесь не будем смотреть.Когда этот амфотерный оксид реагирует с кислотой образуется соль хлорида алюминия. Эта двойственная природа амфотерного оксиды указаны по их названию. Слово амфотерный происходит от Греческое слово amphoteroi, означающее и то, и другое.
Перейдем к последнему типу оксид, нейтральные оксиды. Нейтральные оксиды не показывают кислых или основные свойства и не вступают в реакцию с кислотами или основаниями. Есть только несколько известных нейтральных оксиды, в том числе оксид углерода, оксид азота и оксид азота.Опять же, нейтральные оксиды не вступают в реакцию с кислотами или основаниями. А теперь давайте посмотрим конкретно о том, как основные оксиды реагируют с кислотами с образованием соли и воды, а также еще кое-что. примеры того, как амфотерные оксиды могут действовать как основания, реагировать с кислотами и производить соль и вода. Когда оксид натрия реагирует с соляная кислота, хлорид натрия и вода. Обратите внимание, что анион в кислоте и катион в основном оксиде определяет, какая соль образуется.
Вы можете угадать, в чем состоит кислота? это следующее уравнение? Оксид магния в значительной степени не растворим в воде. Однако в разбавленном, подогретом кислотном раствора, он может реагировать с образованием соли и воды, в данном случае нитрата магния. и вода. Катион магния в соли продукт поступает из оксида, а NO3 или нитрат-ион должен происходить из кислота. Есть два нитрат-иона, которые означает, что в кислоте должно быть два положительных заряда или два иона H +.Объединяя эти ионы вместе, мы получаем, получаем две HNO3, которые представляют собой азотную кислоту. Ранее мы видели пример того, как амфотерный оксид может действовать как основание и реагировать с кислотой. Рассмотрим еще один пример.
Реакция оксида цинка (II) с серная кислота производит соль сульфата цинка и воду. Опять же, катион в соли приходит из оксида, а анион в соли происходит из кислоты. До сих пор мы рассматривали типы оксидов, как они реагируют, и мы рассмотрели множество уравнений.Прежде чем приступить к практическому примеру, давай сделаем что-нибудь немного другое. Давайте посмотрим, насколько разные элементы реагируют с кислородом с образованием оксидов, и как это дает нам общее представление о ряды реактивности для элементов.
Некоторые элементы реагируют с кислородом более энергично, чем другие. У золота низкая реактивность с кислород. Мы говорим, что это инертно и не реагировать. Серебро и ртуть очень медленные и устойчивы к реакции с кислородом.К этому добавлено больше металлов. список в определенном порядке, и это основано на увеличении реакционной способности с кислородом, в другими словами, увеличение легкости, с которой эти элементы реагируют при увеличении энергия. Элементы в крайнем правом углу серия легко и энергично реагирует с кислородом, требуя мало энергии для подвергаются этой реакции, причем металлический калий является наиболее активным, или мы говорим наиболее реактивный.
Важно знать, что все эти металлы можно заставить реагировать с кислородом при правильных условиях, даже золото. Но здесь мы говорим об их естественная реактивность. Чем более реактивен элемент, тем более вероятно, что он будет обнаружен в природе связанным с кислородом или другими элементами. Этот список здесь называется ряд реактивности. Он показывает общую тенденцию или порядок с которой элементы реагируют с кислородом.Вы заметите, что написаны только металлы на этом ряду реактивности. Но неметаллы также могут реагировать с кислород. С силой, с которой водород реагирует между железом и цинком. Давайте подробнее рассмотрим удельная реактивность четырех неметаллов. Однако имейте в виду, что эти неметаллы могут быть помещены в верхний ряд реактивности среди металлов, согласно их относительной реакционной способности с кислородом.
Известно много оксидов хлор. Однако хлор не реагирует. с кислородом в воздухе и в нормальных условиях. Энергия необходима, чтобы вызвать реакция. Из этих четырех неметаллов хлор наименее реактивный. Углерод также обычно не спонтанно реагируют с кислородом. Подумайте об угле на барбекю. Сначала его нужно нагреть до красного горячий.Тогда он среагирует и загорится кислород в воздухе. Сера немного больше реагирует энергично. Он загорится при перегреве горелка Бунзена. Фосфор, однако, довольно сильно реагирует. энергично и самопроизвольно воспламеняется в кислороде воздуха. Фосфор самый реактивный к кислороду от элементов этой серии. Итак, из их реакции с кислородом, мы можем сделать вывод об увеличении реакционной способности хлора и углерода, серы и фосфор.Пришло время взглянуть на пример, прежде чем мы суммируем все, что мы узнали.
Для определения pH различных оксидов, был поставлен эксперимент. Три мензурки были заполнены 0,5 литров деионизированной воды и несколько капель универсального индикатора. Шпатель следующего оксида затем добавляли в каждый стакан. Какого цвета будет каждое решение перейти на следующее добавление оксида? (A) A: синий, B: зеленый и C: красный.(B) A: зеленый, B: красный и C: синий. (C) A: синий, B: красный и C: зеленый. (D) A: красный, B: зеленый и C: синий. Или (E) A: красный, B: синий и C: зеленый.
Оксид — это соединение, состоящее из кислорода, связанного с другим элементом. P2O10, который был добавлен в первую стакан, представляет собой оксид неметалла, потому что он состоит из неметаллического фосфорного связующего к кислороду. MgO и Al2O3 являются примерами оксидов металлов, потому что Mg, магний, является металлом, а Al, алюминий, также металл.И эти металлы связаны с кислород. В общем, когда оксид неметалла реагирует с водой, образуется кислота. Обычно это происходит, когда неметаллический входит в группы с 14 по 17 периодической таблицы. Когда металл в оксиде металла из первой или второй групп периодической таблицы, например, магний и оксид реагирует с водой, обычно образуется щелочь или раствор щелочи.
Обратите внимание, однако, что есть всегда исключения из правил.Например, оксид бериллия не растворим в воде и не реагирует с водой при нормальных условиях. Другие оксиды металлов, содержащие металлы, не входящие в первую или вторую группу периодической таблицы, например, медь, цинк, свинец, алюминий и олово, когда они помещены в воду, они не обычно реагируют и обычно нерастворимы. Теперь оксида магния тоже нет. очень растворим в воде, но крошечные его количества растворяются и вступают в реакцию с водой с образованием производят щелочной или щелочной раствор.
Нам сказали, что универсальный индикатор был добавлен в каждый стакан для определения pH. Универсальный индикатор красный в очень кислая область шкалы pH, затем оранжево-желтая, затем зеленая около нейтральной точка, затем синяя, и на дальнем конце спектра в очень основной области она фиолетовый. Мы видели, что когда неметалл оксид вступает в реакцию с водой, в стакане А образуется кислота. Таким образом, индикатор станет красным в стакане A.В химическом стакане B в виде металла образуется щелочь или основание. оксид вступает в реакцию с водой, поэтому индикатор приобретает пурпурно-синий цвет. И в стакане C, когда металл оксид добавляется, реакции не происходит.
Оксид алюминия является примером амфотерный оксид. И опять же, обычно это не так. растворимы, и они обычно не реагируют с водой, хотя могут реагировать с кислотами и базы. Потому что нет реакции с воды, pH воды в этом стакане останется нейтральным, а индикатор станет зеленым.Итак, изменение цвета в каждом стакане из-за добавления оксида будет A: красный, B: синий и C: зеленый.
Подведем итоги того, что у нас есть научился. Оксид — это соединение, содержащее кислород связан с другим элементом. Когда оксид неметалла реагирует с вода, образуется кислота. Когда оксид металла реагирует с вода, производится база. При размещении амфотерного оксида в воде не растворяется и не вступает в реакцию.И когда помещается нейтральный оксид в воде тоже нет реакции. Это общие тенденции. Когда оксид неметалла реагирует с основание, соль и вода производятся. Также производится соль и вода. когда оксид металла реагирует с кислотой. И для амфотерных оксидов, которые могут реагируют с кислотой или основанием, потому что они действуют как кислоты или основания, опять же соль и вода — это продукты.
Гидролиз — обзор | Темы ScienceDirect
3.1 Кислотный гидролиз
В химии кислотный гидролиз — это процесс, в котором протонная кислота используется для катализа разрыва химической связи посредством реакции нуклеофильного замещения с добавлением элементов воды (H 2 O). Обычный тип гидролиза происходит, когда соль слабой кислоты или слабого основания (или того и другого) растворяется в воде. Вода спонтанно ионизируется с образованием катионов гидроксония (H 3 O + , для простоты обычно обозначается как H + ) и гидроксид-анионов (OH — ).Соль (например), используя ацетат натрия (CH 3 COONa) в качестве примера, диссоциирует на составляющие катионы (Na + ) и анионы (Ch4COO — ). Ионы натрия имеют тенденцию оставаться в ионной форме (Na + ) и очень мало реагируют с ионами гидроксида (OH — ), тогда как ионы ацетата соединяются с ионами гидроксония с образованием уксусной кислоты (CH 3 COOH). В этом случае чистым результатом является относительный избыток гидроксид-ионов, и раствор имеет основные свойства.С другой стороны, сильные кислоты также подвергаются гидролизу, и когда серная кислота (H 2 SO 4 ) растворяется (смешивается с) водой, растворение сопровождается гидролизом с образованием иона гидроксония (H 3 O + ) ион бисульфата (HSO 4 — ), который является сопряженным основанием серной кислоты.
Примером химического гидролиза является гидролиз хлорида железа (FeCl 3 ) ионами воды, который происходит потому, что соль (хлорид железа) образуется из слабого основания [гидроксид железа, гидроксид железа, Fe (OH) 3 ] и сильная кислота (соляная кислота, HCl):
FeCl 3 + 3H 2 O → Fe (OH) 3 + 3HCl
Обратить реакцию трудно, поскольку гидроксид трехвалентного железа отделяется от водный раствор в виде осадка.
Таким образом, реакция гидролиза — это разрыв химических связей путем добавления воды или основания, которое поставляет гидроксил-ион (OH — ). Химическая связь разрывается, и образуются две новые связи, каждая из которых имеет либо водородный компонент (H), либо гидроксильный компонент (OH) молекулы воды. Это приводит к сильной зависимости от кислотности или щелочности (pH) раствора, часто наблюдаемой, но в некоторых случаях гидролиз может происходить в нейтральной (pH = 7) среде.Адсорбция на минеральном осадке (например, глинистом осадке, обладающем сильной адсорбционной способностью) обычно снижает скорость гидролиза для реакций, катализируемых кислотой или основанием.
Например, силиконовые полимеры, которые часто трудно восстановить (Rücker and Kümmerer, 2015), подвергаются гидролитическому разложению, катализируемому глиной, в почве (Xu, 1998). В этом примере было исследовано влияние уровней влажности и обменных катионов на разложение полидиметилсилоксановой жидкости на глинистые минералы.Каолинит, тальк и монтмориллонит Аризоны, насыщенный ионами натрия (Na + ), ионами кальция (Ca 2+ ) или ионами алюминия (Al 3+ ), были использованы для разрыва его кремний-кислород-кремний ( SiOSi) магистраль. Гидролитическая деградация проходит в две стадии — обе являются реакциями нулевого порядка. Хотя высокая влажность может привести к образованию некоторых летучих циклических производных метилсилоксана на искусственном катализаторе (насыщенном алюминием монтмориллоните), конечным продуктом разложения в остальном был водорастворимый диметилсиландиол.Таким образом, на скорость разложения и продукты силиконовых полимеров влияли (1) тип обменного катиона, (2) уровень влажности и (3) тип глины.
Есть также свидетельства того, что скорость ферментативного гидролиза глюкозо-1-фосфата (G1P), адсорбированного на гетите кислой фосфатазой (AcPase), может быть того же порядка величины, что и в водном растворе. В результате поверхностного процесса в раствор выделяется углерод, тогда как ортофосфат остается адсорбированным на гетите. Эта реакция гидролиза является строго межфазным процессом, который определяется свойствами поверхности раздела.Высокая поверхностная концентрация субстрата опосредует образование каталитически активного слоя, и хотя адсорбция, вероятно, снижает каталитическую эффективность фермента, это снижение почти уравновешивается тем фактом, что фермент и субстрат концентрируются на минеральных поверхностях. Таким образом, минеральные поверхности с подходящими поверхностными свойствами могут быть очень эффективными для концентрирования субстратов и ферментов, тем самым создавая микрохимические среды с высокой ферментативной активностью. Следовательно, сильно адсорбированные молекулы в почве и водной среде также могут подвергаться биоразложению внеклеточными ферментами (Olsson et al., 2012).
Кроме того, адсорбция не влияет на нейтральные реакции (Глава 5), хотя всегда существует вероятность того, что минеральный осадок может вызвать каталитические реакции химического превращения. Многие химические вещества можно изменить в результате прямой реакции с водой. Скорость реакции гидролиза обычно выражается в терминах констант скорости гидролиза, катализируемого кислотой, катализатором нейтральным катализатором и катализируемым основанием.
Многие химические вещества подвергаются гидролизу в условиях, типичных для различных экосистем.Фактически, существует четыре возможных общих правила, включающих реакции солей в водной среде: (1) если соль образована из сильного основания и сильной кислоты , то раствор соли нейтрален, что указывает на то, что связи в солевом растворе не распадается (указывает на отсутствие гидролиза) и раствор является основным, (2) если соль образована из сильной кислоты и слабого основания , связи в солевом растворе разрываются и раствор становится кислым, (3) если соль образована из сильного основания и кислоты слабого , раствор соли является основным и гидролизуется, и (4) если соль образована из слабого основания и слабой кислоты, она будет гидролизуют, но кислотность или основность зависит от констант равновесия K a и K b .Если значение K a больше, чем значение K b , полученный раствор будет кислым, а если значение K b больше, чем значение K a , полученный раствор будет основным. Более того, существует необходимость в оценке относительной восприимчивости некоторых потенциальных загрязнителей окружающей среды к реакциям гидролиза, чтобы определить потенциальные полезные эффекты или потенциальные неблагоприятные эффекты, которые продукт может оказывать на окружающую среду (Rahm et al., 2005).
Обычно в реакции гидролиза гидроксильная группа (OH — ) заменяет другую химическую группу в молекуле, и реакции гидролиза обычно катализируются ионами водорода или гидроксильными ионами. Это приводит к сильной зависимости от кислотности или щелочности (pH) раствора, часто наблюдаемой, но в некоторых случаях гидролиз может происходить в нейтральной (pH = 7) среде. Адсорбция на минеральных отложениях (таких как глинистые отложения, обладающие сильной адсорбционной способностью) обычно снижает скорость гидролиза реакций, катализируемых кислотой или основанием.Адсорбция не влияет на нейтральные реакции, хотя всегда существует вероятность того, что минеральный осадок может вызвать реакции каталитического химического превращения.
Гидролитические процессы обеспечивают базовую скорость потерь любого химического вещества в водной среде. Хотя различные гидролитические пути объясняют значительную деградацию определенных классов химических веществ, другие структуры полностью инертны. Строго говоря, в гидролизе должны участвовать только те химические вещества, которые предоставляет вода, то есть H +, OH — и H 2 O, но полная картина включает аналогичные реакции и, таким образом, эквивалентные эффекты других химических веществ, присутствующих в местном масштабе. окружающей среде, такой как SH — в анаэробных болотах, хлорид-ион (Cl —) в морской воде и различные ионы в лабораторных буферных растворах (Jiang et al., 1994; Вулф и Джефферс, 2000).
Многие химические вещества могут быть изменены путем прямой реакции химического вещества с водой (гидролиз), при которой химическая связь разрывается и образуются две новые связи, каждая из которых имеет либо водородный компонент (H + ), либо гидроксильный компонент. (OH — ) молекулы воды. Обычно гидроксил заменяет другую химическую группу в молекуле, и реакции гидролиза обычно катализируются ионами водорода или гидроксильными ионами. Это приводит к сильной зависимости от кислотности или щелочности (pH) раствора, часто наблюдаемой, но в некоторых случаях гидролиз может происходить в нейтральной (pH = 7) среде.Адсорбция на минеральных отложениях (таких как глинистые отложения, обладающие сильной адсорбционной способностью) обычно снижает скорость гидролиза реакций, катализируемых кислотой или основанием. Адсорбция не влияет на нейтральные реакции, хотя всегда существует вероятность того, что минеральный осадок может вызвать реакции каталитического химического превращения.
Кроме того, на гидролиз химикатов влияет состав растворителя, и константы скорости в воде могут быть намного выше, чем в растворителях.Фактически, можно ожидать, что введение сложной смеси химических веществ в водоем приведет к значительному сдвигу кислотности или щелочности среды, и поэтому не удивительно ожидать, что гидролиз будет затронут в сложных смесях.
Что такое кислотный дождь? | Кислотный дождь
Кислотный дождь или кислотное осаждение — это широкий термин, который включает любую форму осадков с кислотными компонентами, такими как серная или азотная кислота, которые выпадают на землю из атмосферы во влажной или сухой форме.Это может быть дождь, снег, туман, град или даже кислая пыль.
Что вызывает кислотный дождь?
Это изображение иллюстрирует путь кислотных дождей в нашей окружающей среде: (1) Выбросы SO 2 и NO x выбрасываются в воздух, где (2) загрязнители превращаются в частицы кислоты, которые могут переноситься на большие расстояния. . (3) Эти кислотные частицы затем падают на землю в виде влажных и сухих отложений (пыль, дождь, снег и т. Д.) И (4) могут оказывать вредное воздействие на почву, леса, ручьи и озера.
Кислотный дождь возникает, когда диоксид серы (SO 2 ) и оксиды азота (NO X ) выбрасываются в атмосферу и переносятся ветром и воздушными потоками. SO 2 и NO X реагируют с водой, кислородом и другими химическими веществами с образованием серной и азотной кислот. Затем они смешиваются с водой и другими материалами, прежде чем упасть на землю.
Хотя небольшая часть SO 2 и NO X , вызывающих кислотные дожди, поступает из природных источников, таких как вулканы, большая их часть происходит от сжигания ископаемого топлива.Основными источниками SO 2 и NO X в атмосфере являются:
- Сжигание ископаемого топлива для производства электроэнергии. Две трети SO 2 и одна четверть NO X в атмосфере поступают от генераторов электроэнергии.
- Транспортные средства и тяжелая техника.
- Обрабатывающая, нефтеперерабатывающая и другие отрасли промышленности.
Ветры могут дуть SO 2 и NO X на большие расстояния и через границы, что делает кислотные дожди проблемой для всех, а не только для тех, кто живет рядом с этими источниками.
Начало страницы
Формы кислотного осаждения
Влажное осаждение
Влажные отложения — это то, что мы чаще всего называем кислотными дождями . Образовавшиеся в атмосфере серная и азотная кислоты падают на землю в смеси с дождем, снегом, туманом или градом.
Сухое осаждение
Кислые частицы и газы могут также осаждаться из атмосферы в отсутствие влаги, как сухое осаждение .Кислые частицы и газы могут быстро осаждаться на поверхности (водоемы, растительность, здания) или могут реагировать во время атмосферного переноса с образованием более крупных частиц, которые могут быть вредными для здоровья человека. Когда накопленные кислоты смываются с поверхности следующим дождем, эта кислая вода течет по земле и сквозь нее и может нанести вред растениям и животным, таким как насекомые и рыбы.
Количество кислотности в атмосфере, которая откладывается на земле в результате сухого осаждения, зависит от количества осадков, выпадающих на данной территории.Например, в пустынных районах соотношение сухих и влажных отложений выше, чем в районах, где ежегодно выпадает несколько дюймов дождя.
Начало страницы
Измерение кислотных дождей
Кислотность и щелочность измеряются по шкале pH, для которой 7,0 является нейтральным. Чем ниже pH вещества (менее 7), тем оно более кислое; чем выше pH вещества (более 7), тем оно более щелочное. Нормальный дождь имеет pH около 5,6; он слабокислый, потому что в нем растворяется углекислый газ (CO 2 ), образуя слабую угольную кислоту.Кислотный дождь обычно имеет pH от 4,2 до 4,4.
Политики, ученые-исследователи, экологи и разработчики моделей полагаются на Национальную сеть тенденций (NTN) Национальной программы атмосферных осаждений (NADP) для измерений влажных отложений. NADP / NTN собирает кислотные дожди более чем на 250 объектах мониторинга в США, Канаде, Аляске, Гавайях и Виргинских островах США. В отличие от влажного осаждения измерение сухого осаждения сложно и дорого. Оценки сухого осаждения загрязняющих веществ, содержащих азот и серу, предоставлены Сетью по состоянию и тенденциям в области чистого воздуха (CASTNET).CASTNET измеряет концентрации в воздухе более чем в 90 точках.
Когда кислотные отложения смываются в озера и ручьи, они могут стать кислотными. Сеть долгосрочного мониторинга (LTM) измеряет и отслеживает химический состав поверхностных вод более чем на 280 участках, чтобы предоставить ценную информацию о здоровье водных экосистем и о том, как водные объекты реагируют на изменения в выбросах, вызывающих кислоту, и кислотных осаждениях.
Начало страницы
Затем узнайте о влиянии кислотного дождя.
Или узнайте больше о:
.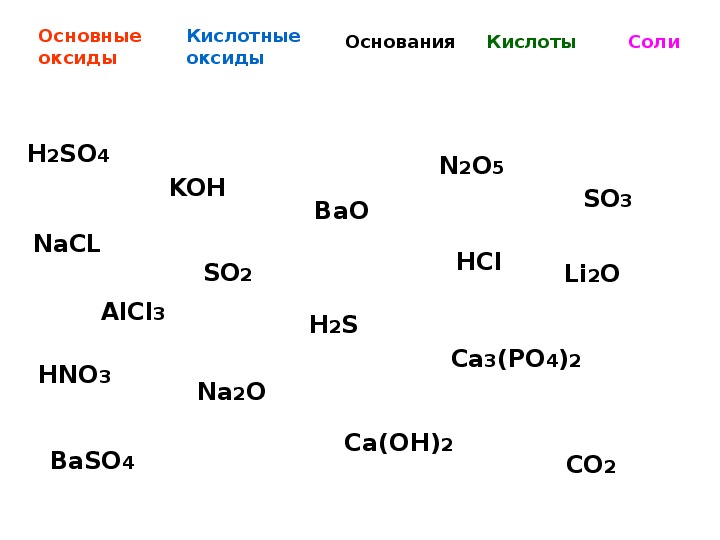 Способствует пищеварению. HCl
Способствует пищеварению. HCl
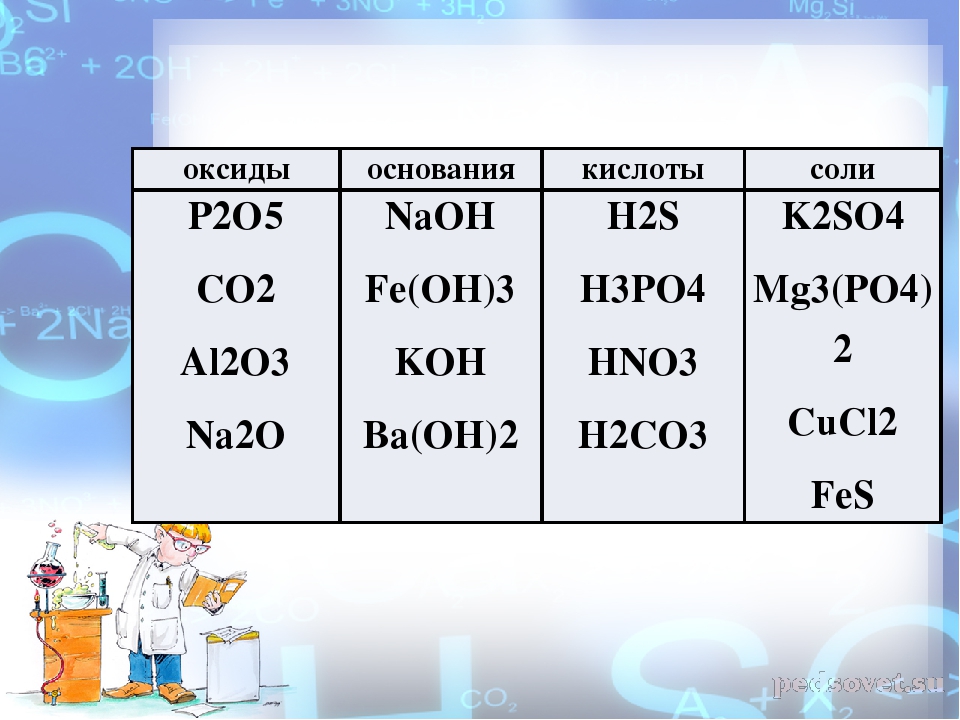

 Продолжительность: 10-12 минут.
Продолжительность: 10-12 минут.

 ).
).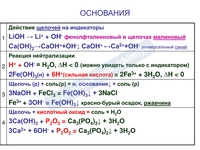
 Амфотерный оксид — это оксид, который проявляет как кислотные, так и основные свойства.
Амфотерный оксид — это оксид, который проявляет как кислотные, так и основные свойства. Это увеличивает количество гидроксид-иона в растворе, образующемся в реакции, и делает его слегка щелочным.
Это увеличивает количество гидроксид-иона в растворе, образующемся в реакции, и делает его слегка щелочным.