Сайт учителя химии Сай Н.С. — My Chemistry AcadeMy
«Учитель — человек, который может делать трудные вещи легкими.»
Ральф Уолдо Эмерсон
Незаметно проходит время, меняются дети, меняются родители, меняется само общество и отношения между людьми. Но неизменной остаётся роль учителя, который понимает, что в любом времени надо учить детей.Каким же всё-таки должен быть современный учитель?
Хороший учитель должен любить свое дело, любить детей, именно это поможет ему справиться с трудностями в профессиональной деятельности. Основная миссия учителя- делать трудные вещи легкими. Современный учитель не только должен идти в ногу со временем, он должен работать на будущее. Будущее своих учеников.
Я работаю учителем химии в МАОУ СОШ №22 с углубленным изучением отдельных предметов города Тамбова, аттестована на высшую квалификационную категорию.
 Самовыражению личности в учебно-познавательном процессе способствует создание ситуаций творческой активности. Ничто не заменит ребёнку наслаждения от собственного творчества, которое доставляет радость, стимулирует процесс мышления, способствует удовлетворению эстетических потребностей и показывает внутреннюю красоту познания. Главное для нашего времени – научить детей учиться.
Самовыражению личности в учебно-познавательном процессе способствует создание ситуаций творческой активности. Ничто не заменит ребёнку наслаждения от собственного творчества, которое доставляет радость, стимулирует процесс мышления, способствует удовлетворению эстетических потребностей и показывает внутреннюю красоту познания. Главное для нашего времени – научить детей учиться.
§ 2. Предмет химии. Вещества
1.
Условие:
Решение:
Советы:
Везде необходимо искать золотую середину и сохранять меру. Крайности еще никому жизнь не облегчили.
2.
Условие:
Решение:
Советы:
Почитайте Михаила Булгакова "Собачье сердце". Очень интересное и веселое произведение с точки зрения химии и биологии.
3.
Условие:
Решение:
Советы:
Воспользуйтесь подсказкой: к названию тела – существительному – можно подобрать относительное прилагательное, образованное от на звания вещества, например: железо и гвоздь – железный гвоздь.
4.
Условие:
Решение:
Советы:
Вода — вещество, капля воды — физическое тело, алюминий — вещество, алюминиевая ложка — физическое тело. Вещество — это совокупность частиц (молекул, атомов или ионов), обладающая определёнными физическими и химическими свойствами.
5.
Условие:
Решение:
Советы:
Старайтесь при любой классификации в химии для себя подмечать сходства и различия. Это развивает наблюдательность.
6.
Условие:
Решение:
Советы:
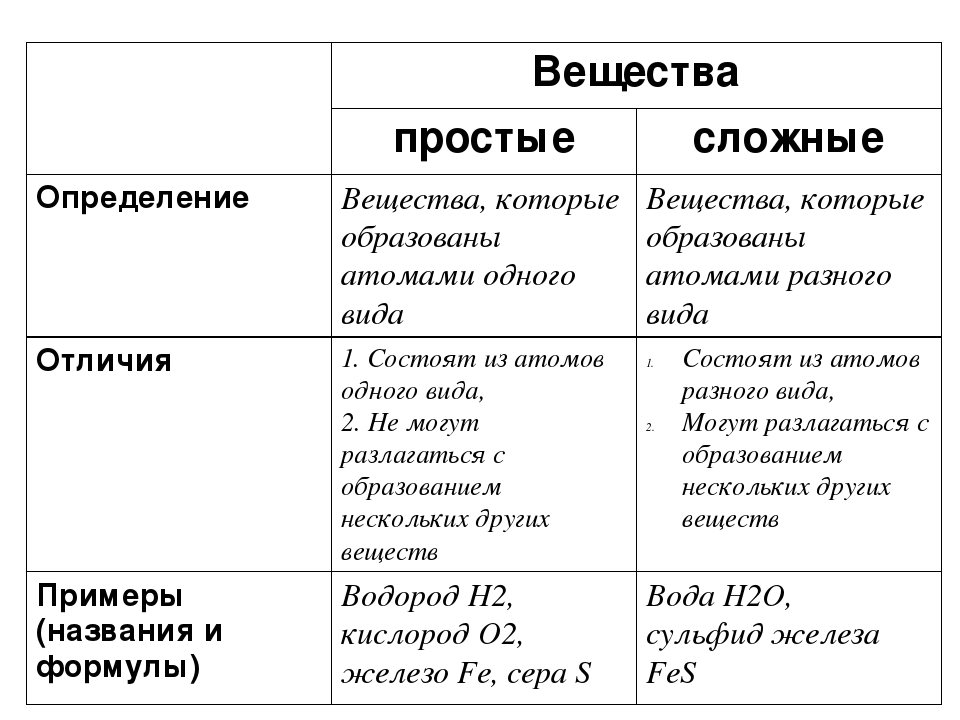
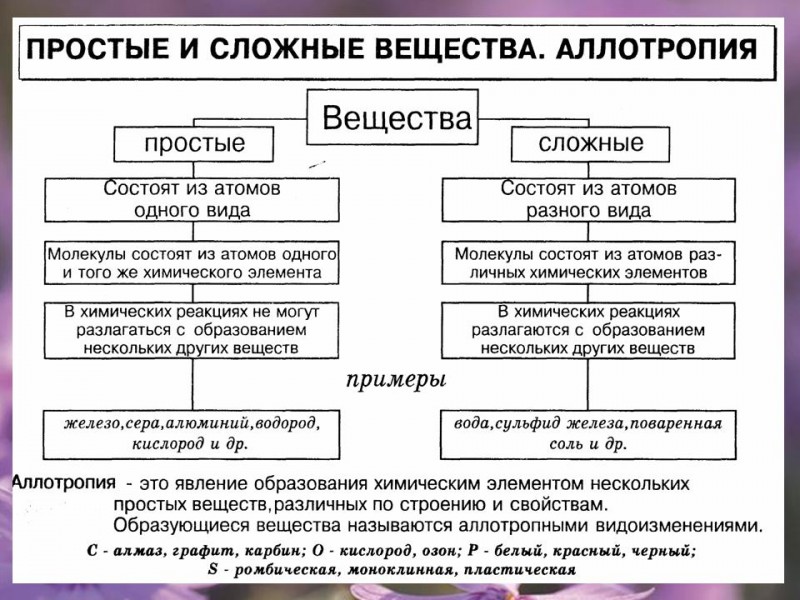
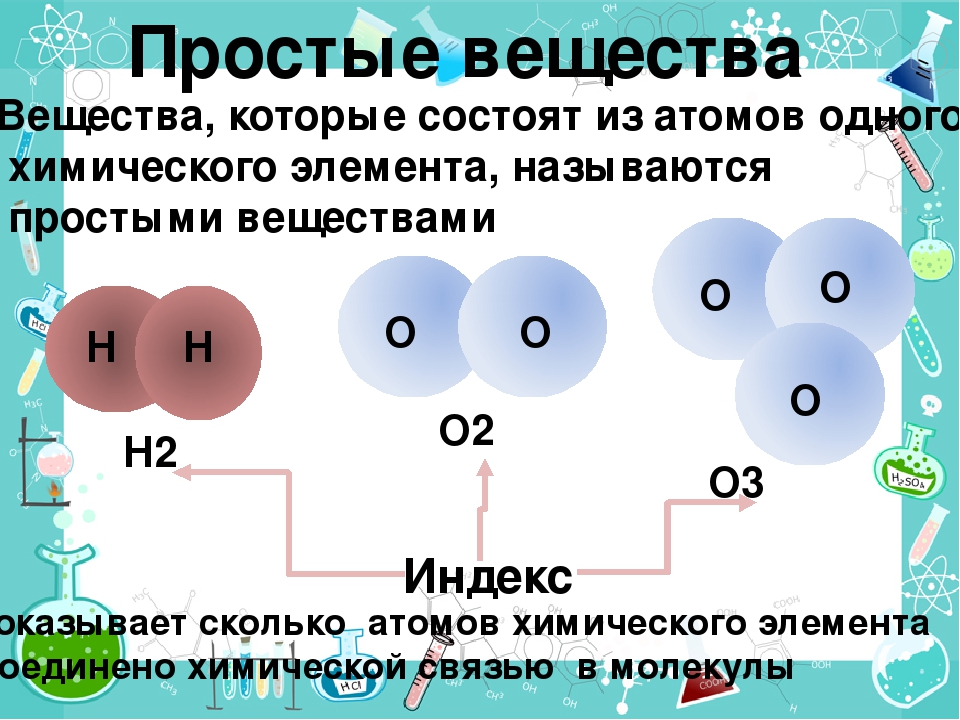
Напоминаем, что простые вещества – вещества, в состав которых входят атомы одного вида, а в состав сложных веществ будут входить несколько видов различных атомов, как минимум двух.
7.
Условие:
Решение:
Советы:
Так же этот вопрос можно трактовать следующим образом: "Понятие химический элемент более широкое. Например, когда говорят о том, что в состав резины входит сера, то имеют ввиду химический элемент, а когда говорят о том, что сера применяется как фунгицид в сельском хозяйстве, то имеют ввиду простое вещество" Какая аргументация вам ближе, тот ответ и выбирайте!
8.
Условие:
Решение:
Советы:
Простое вещество - это субстанция, состоящая из атомов одного химического элемента.
9.
Условие:
Решение:
Советы:
Химический элемент — это определённый вид атомов. Атомы химического элемента могут входить в состав простых и сложных веществ. Можно охарактеризовать распространённость и формы нахождения химического элемента в природе, а также свойства его атомов (массу, размеры, строение). Простое вещество образовано атомами одного химического элемента. Это одна из форм существования химического элемента в природе. Простое вещество характеризуется определённым составом, строением, физическими и химическими свойствами. Его применяют для получения других веществ.
10.
Условие:
Решение:
Советы:
За последние 200 лет человечество изучило свойства веществ лучше, чем за всю историю развития химии. Естественно, количество веществ так же стремительно растет, это связано, прежде всего, с освоением различных методов получения веществ.Желаем Вам открыть новые вещества и новые свойства на благо человечества!
Урок «Разнообразие веществ. Простые и сложные вещества»
УРОК № ___
Тема | Разнообразие веществ. Простые и сложные вещества
|
Цель | обучающая: углубить знания учеников о разнообразии веществ, их классификацию, расширить представление о простых и сложных веществах; формировать умение разделять вещества на простые и сложные, показать отличие строения и физических свойств простых веществ металлов и неметаллов; развивающая: развивать умение анализировать, сравнивать, строить обобщающие заключения, различать понятия, находить причинно-следственные связи; формировать практические знания и умения во время выполнения лабораторного опыта; воспитательная: воспитывать наблюдательность, умение работать самостоятельно.
|
Оборудование | учебник, карточки с заданиями, ноутбук, мультимедийный проектор, мультимедийная презентация «Разнообразие веществ. Простые и сложные вещества», периодическая система химических элементов Д. И. Менделеева, образцы металлов и неметаллов (медь, алюминий, график, сера), магнит, смесь серы и железа, пирит
|
Базовые понятия и термины | атомы, молекулы, химический элемент, простые и сложные вещества, смесь, металлы и неметаллы.
|
Тип урока | комбинированный |
ХОД УРОКА
- Организационный этап
- АКТУАЛИЗАЦИЯ ОПОРНЫХ ЗНАНИЙ УЧАЩИХСЯ
1. «Вспомни определение» (Слайд 1)
Атом, молекула, ион, химический элемент
Учитель.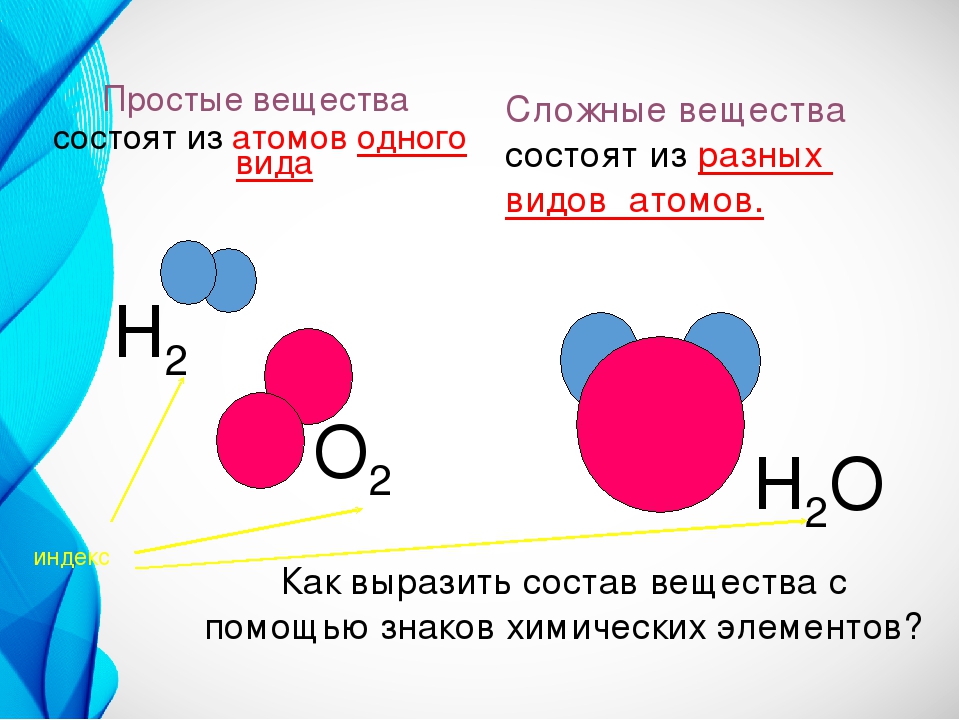
2. Интерактивное упражнение «Я — простое вещество; Я — сложное вещество» (Слайд 2)
На мультимедийном экране — таблица. Ученики анализируют строение веществ (из одинаковых или разных атомов они состоят) и после этого в определенных квадратиках «Я — простое вещество» или «Я — сложное вещество» появляются правильные ответы.
- МОТИВАЦИЯ УЧЕБНОЙ ДЕЯТЕЛЬНОСТИ
Проблемные вопросы: на уроке мы должны выяснить, во-первых, совершенна ли классификация химических элементов на металлы и неметаллы, и, во-вторых, чем обусловлено разнообразие веществ.
- СООБЩЕНИЕ ТЕМЫ И ЦЕЛИ УРОКА (Слайд 3)
- ИЗУЧЕНИЕ НОВОГО МАТЕРИАЛ (Слайд 4)
На мультимедийном экране — «План изучения материала урока»:
- Классификация веществ на простые и сложные.
- Классификация простых веществ на металлы и неметаллы.
- Лабораторный опыт № 4 «Ознакомление с образцами простых и сложных веществ».
Учитель. Сегодня мы с вами усовершенствуем знания о простых и сложных веществах. В 7 классе определения формулируются так:
Простое вещество — это вещество, образованное атомами одного и того самого химического элемента.
Сложное вещество — это вещество, образованное атомами разных химических элементов.
Эти определения находятся у вас в учебнике на стр. 54. Прочтите их про себя.
1. Задача (Слайд 5)
Задача (Слайд 5)
Среди перечня химических формул в один столбик выписать простые вещества, во второй — сложные.
Вещества: Fe, CO, C3H8O3, H2, B, O3, KNO3, Zn, Al2O3, Pb
Простые вещества | Сложные вещества |
Fe, H2, B, O3, Zn, Pb | CO, C3H8O3, KNO3, Al2O3, |
Учитель. Все химические элементы периодической системы Д. И. Менделеева условно разделяют на две большие группы — «Металлы» и «Неметаллы». Они образуют простые вещества — металлы и неметаллы. Названия химических элементов и простых веществ могут совпадать и отличаться. Давайте рассмотрим некоторые примеры.
2. Работа с таблицей «Названия простых веществ и химических элементов» (Слайд 6)
Название простого вещества | Название химического элемента |
Азот | Нитроген |
Кислород | Оксиген |
Хлор | Хлор |
Кальций | Кальций |
Железо | Ферум |
Алюминий | Алюминий |
Медь | Купрум |
Вы должны помнить, что химический элемент — это вид атомов, а простое вещество — это соединение одинаковых атомов.
Учитель демонстрирует образцы металлов (меди, алюминия, цинка) и неметаллов (графита, серы, йода). Что общего для них и чем они отличаются? (Слайд 7)
3. Сообщение учеников о физических свойствах, строении металлов и неметаллов
(Демонстрация мультимедийной презентации с использованием ноутбука, мультимедийного экрана и проектора) (Слайд 8 — 22)
Сообщение 1-го ученика
Химические элементы металлы образуют простые вещества — металлы, например алюминий, железо, медь, хром и т.д. Металлы при обычных условиях твердые, кроме ртути. Имеют металлический блеск. Много металлов имеют серебристо-белый цвет, кроме некоторых. Например, золото — это желтый металл, медь — красно-желтый металл.
Металлы хорошо проводят электрический ток и тепло, в воде практически не растворяются. Все металлы имеют немолекулярное строение.
Сообщение 2-го ученика
Химические элементы неметаллы образуют простые вещества — неметаллы, например сера, фосфор, кислород, хлор и т. д. Неметаллические вещества имеют разное агрегатное состояние при обычных условиях (кислород — газ, бром — жидкость, сера — твердое вещество), разный цвет (сера — желтая, хлор — желто-зеленый, фосфор — белый или красный). Много неметаллических веществ имеют характерный запах, по-разному растворяются в воде (кислород — плохо, хлор — хорошо). Неметаллы преимущественно неэлектропроводные, имеют разное физиологическое действие (отравляющие — белый фосфор, хлор; неядовитые — азот, водород). Неметаллические вещества имеют как молекулярную (кислород, хлор, азот, водород), так и немолекулярное строение (красный фосфор, алмаз, кремний).
д. Неметаллические вещества имеют разное агрегатное состояние при обычных условиях (кислород — газ, бром — жидкость, сера — твердое вещество), разный цвет (сера — желтая, хлор — желто-зеленый, фосфор — белый или красный). Много неметаллических веществ имеют характерный запах, по-разному растворяются в воде (кислород — плохо, хлор — хорошо). Неметаллы преимущественно неэлектропроводные, имеют разное физиологическое действие (отравляющие — белый фосфор, хлор; неядовитые — азот, водород). Неметаллические вещества имеют как молекулярную (кислород, хлор, азот, водород), так и немолекулярное строение (красный фосфор, алмаз, кремний).
Учитель. Почему классификация химических элементов на металлы и неметаллы является условной? (Так же, как металлы могут проявлять некоторые неметаллические свойства, так и неметаллы — металлические)
4.Задача (Слайд 23)
Простые вещества из задачи 1 распределить на две группы — металлы и неметаллы.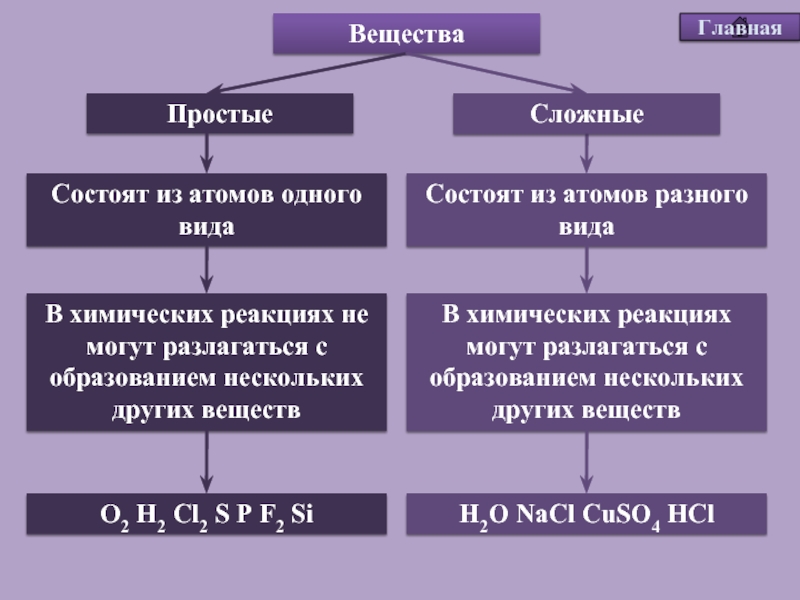
Простые вещества | |
Fe, H2, B, O3, Zn, Pb | |
Металлы | Неметаллы |
Fe, Zn, Pb | H2, B, O3 |
Учитель. Чем объяснить большое разнообразие веществ? (Возможностью атомов химических элементов соединяться между собой в разнообразнейших соединениях и количественных соотношениях)
Вы должны четко различать понятия «сложное вещество» и «смесь». Например, если смешать порошки железа и серы, то мы увидим в этой смеси желтые частички серы и серые частички железа. (Демонстрирует) Каким образом можно разделить эту смесь? (С помощью магнита удалить частички железа) Теперь рассмотрим сложное вещество — естественное соединение Ферума и Сульфура — пирит. (Демонстрирует. ) Какого оно цвета и является ли однородным? (Однородное вещество темно-серого цвета) Попробуем его разделить с помощью магнита. Получилось ли это сделать? Если нет, то почему? (Потому что в сложном веществе свойства простых веществ, из которых оно состоит, не сохраняются)
) Какого оно цвета и является ли однородным? (Однородное вещество темно-серого цвета) Попробуем его разделить с помощью магнита. Получилось ли это сделать? Если нет, то почему? (Потому что в сложном веществе свойства простых веществ, из которых оно состоит, не сохраняются)
5. Работа с таблицей «Сложные вещества и смеси» (Слайд 24)
Признаки | Сложные вещества | Смеси |
Состав | Постоянный | Переменный |
Свойства | Постоянные | Зависят от состава |
Возможность разделения | Физически неразделимые | Можно разделить физическим способом |
6. Лабораторный опыт № 4 «Ознакомление с образцами простых и сложных веществ» (Слайд 25 — 26)
Тема. | Ознакомление с образцами простых и сложных веществ |
Цель: | ознакомиться с образцами простых и сложных веществ, научиться различать их |
Реактивы: І вариант натрий хлорид (поваренная соль — NaCl), медь (Cu), графит (С), кальций карбонат (мел — CaCO3).
IІ вариант алюминий (Al), графит (С), натрий гидрогенкарбонат (пищевая сода – NaHCO3),сахар (С12Н22О11).
Задание: 1. Рассмотрите выданные вам вещества в соответствии с вариантом. Опишите их физические свойства: агрегатное состояние, цвет, блеск, запах, кристалличность, твердость.
2. Внесите в таблицу название каждого вещества, описание физических свойств.
3. Распределите вещества на простые и сложные, а простые на металлы и неметаллы, поставив знак «+» в соответствующий столбец таблицы.
Название вещества, формула | Физические свойства | Простое вещество | Сложное вещество | |
Металл | Неметалл | |||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
- ЗАКРЕПЛЕНИЕ ИЗУЧЕННОГО МАТЕРИАЛА
- На основе изученного на уроке материала устно заполнить схему «Классификация веществ»: (Слайд 27)
- Выполнение теста с последующей взаимопроверкой.
 Один правильный ответ – 1 балл.
Один правильный ответ – 1 балл.
Тесты (Слайд 28)
- Выбрать простое вещество:
а) МgO; б)O2; в) NaCl.
- Указать неметалл:
а) водород; б) ртуть; в) хром.
- Указать название химического элемента металла, который не совпадает с названием простой вещества металла:
а) Плюмбум; б) Алюминий; в) Цинк.
4. Среди неметаллов есть вещества:
а) отравляющие;
б) неядовитые;
в) как отравляющие, так и неядовитые.
- Металлы преимущественно имеют цвет:
а) белый;
б) серебристо-белый;
в) желтый.
- Все неметаллы имеют агрегатное состояние:
а) твердое и жидкое;
б) жидкое и газообразное;
в) твердое, жидкое, газообразное.
- Жидкое агрегатное состояние при обычных условиях имеет металл:
а) свинец; б) ртуть; в) медь.
- Неметаллы в воде:
а) все растворимые;
б) все нерастворимые;
в) как растворимые, так и нерастворимые.
- Металлы имеют строение:
а) только молекулярную;
б) только немолекулярную;
в) как молекулярную, так и немолекулярную.
- Неметаллы:
а) все электропроводные;
б) все неэлектропроводные;
в) как электропроводные, так и неэлектропроводные.
- Выбрать строку, в которой металлы имеют разный цвет:
а) золото, медь, ртуть;
б) хром, вольфрам, свинец;
в) железо, алюминий, цинк.
Ответ
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 |
б | а | а | в | б | в | б | в | б | в | а |
- ПОДВЕДЕНИЕ ИТОГОВ УРОКА.

Выставление оценок
- ДОМАШНЕЕ ЗАДАНИЕ (Слайд 29)
- Читать § 11
- Выучить определения стр. 88
- Письменно в тетради упр. 2, 3, 5 с 89
- Творческое задание: подумайте и ответьте на вопрос какие вещества более важные в жизни: просты или сложные?
От простого вещества к химическому элементу
Страница из
НАПЕЧАТАНО ИЗ OXFORD SCHOLARSHIP ONLINE (oxford.universitypressscholarship.com). (c) Copyright Oxford University Press, 2022. Все права защищены. Отдельный пользователь может распечатать PDF-файл одной главы монографии в OSO для личного использования. Дата: 18 февраля 2022 г.
- Глава:
- (стр. 32) 2 От простого вещества к химическому элементу
- Источник:
- Что такое химический элемент?
- Автор(ы):
Бернадетт Бенсо-Винсент
- Издатель:
- Oxford University Press
DOI:10.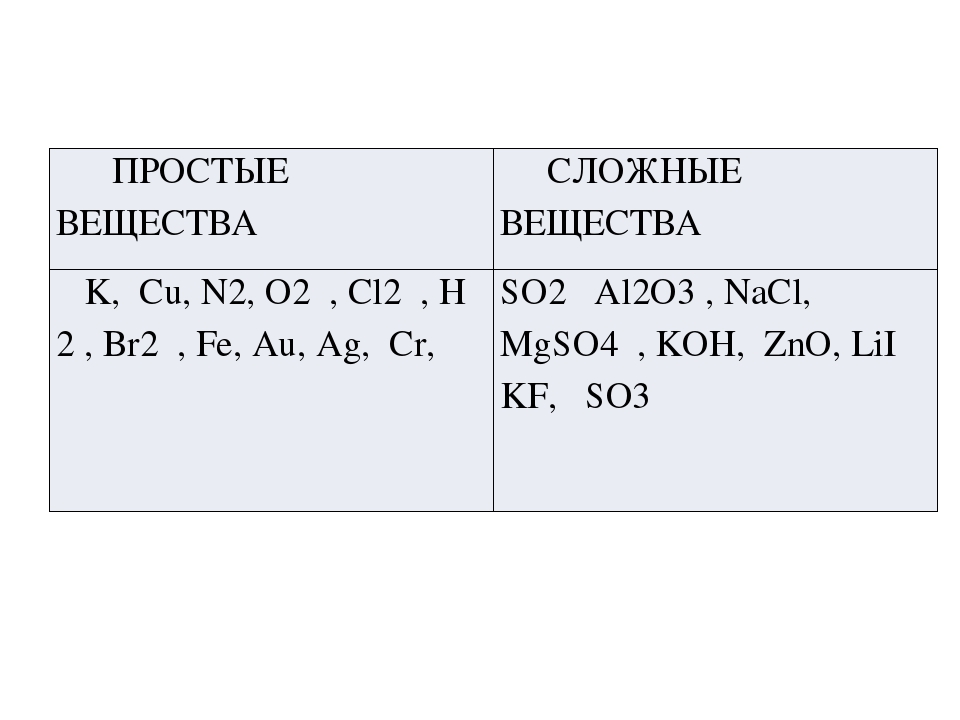 1093/oso/9780190933784.003.0003
1093/oso/9780190933784.003.0003
Введение современной концепции химического элемента часто приписывают Лавуазье. Я утверждаю, что, несмотря на значительное влияние определения элементов как неразлагающихся тел в «Элементах химии» Лавуазье, это утверждение вводит в заблуждение как минимум по трем причинам. Во-первых, элементы уже были определены как остатки анализа до Лавуазье. Во-вторых, Лавуазье не отказался полностью от традиционного взгляда на элементы как составные части всех тел.В-третьих, современное определение химического элемента предполагает четкое разграничение между простыми телами и элементами, которое позднее было введено Дмитрием Менделеевым.
Я обрисую роль этого концептуального различия в менделеевском процессе классификации элементов и симметрично подчеркну, как периодическая система способствовала стабилизации его представления об элементе как об индивидуальном, определяемом его положением в системе.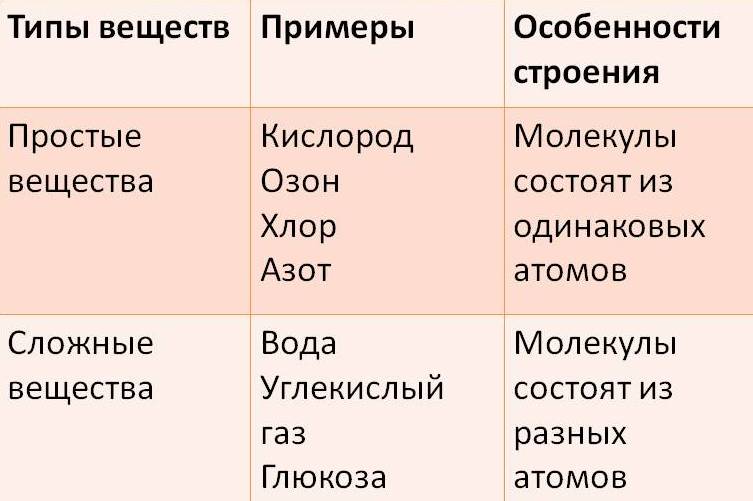 Таким образом, понятие элемента выступает и как предпосылка, и как продукт построения периодической системы.
Таким образом, понятие элемента выступает и как предпосылка, и как продукт построения периодической системы.
Ключевые слова: анализ, атомы, изотопы, Лавуазье, молекулы, вещества
Oxford Scholarship Online требует подписки или покупки для доступа к полному тексту книг в рамках службы. Однако общедоступные пользователи могут свободно осуществлять поиск по сайту и просматривать рефераты и ключевые слова для каждой книги и главы.
Пожалуйста, подпишитесь или войдите, чтобы получить доступ к полнотекстовому содержимому.
Если вы считаете, что у вас должен быть доступ к этому названию, обратитесь к своему библиотекарю.
Для устранения неполадок см.
Часто задаваемые вопросы
, и если вы не можете найти ответ там, пожалуйста,
связаться с нами
.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка браузера на прием файлов cookie
Существует множество причин, по которым файл cookie не может быть установлен правильно. Ниже приведены наиболее распространенные причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки браузера, чтобы принять файлы cookie, или спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файл cookie.
- Ваш браузер не поддерживает файлы cookie. Попробуйте другой браузер, если вы подозреваете это.
- Дата на вашем компьютере в прошлом.
 Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы это исправить, установите правильное время и дату на своем компьютере.
Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы это исправить, установите правильное время и дату на своем компьютере. - Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Предоставить доступ без файлов cookie потребует от сайта создания нового сеанса для каждой посещаемой вами страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в файле cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только та информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, если вы не решите ввести его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступ к остальной части вашего компьютера, и только сайт, создавший файл cookie, может его прочитать.
Что такое химическое вещество?
Наш мир состоит из множества различных веществ, которые мы называем химическими веществами.Вся материя, включая нас и все, что нас окружает, состоит из мельчайших частиц, называемых атомами. Итак, что такое химия? Химикат по определению — это любое вещество, состоящее из материи; это включает твердые тела, жидкости и газ. Химические вещества могут представлять собой чистое вещество или смесь веществ. Химическое вещество, такое как вода (h3O), является чистым химическим веществом, потому что оно имеет одни и те же молекулы и комбинации по всей своей структуре.
Химические элементы и соединения
Химическое вещество, состоящее только из одного атома, называется элементом.Известно 118 элементов, но только 98 из них встречаются в природе на Земле. Каждый из этих элементов представлен химическим символом и может быть найден в периодической таблице элементов.
Химическое соединение – это чистое вещество, состоящее из двух химических соединений. Соединения — это химические вещества, состоящие из более чем одного вида атомов. Вода является примером химического соединения водорода и кислорода. Это означает, что каждая частица или молекула воды имеет атомы водорода и кислорода, связанные вместе.
Элементы и соединения часто встречаются в смесях. Смесь представляет собой комбинацию двух или более веществ, где каждое вещество имеет свою собственную идентичность. В общем, эти комбинации можно разделить на составляющие их вещества. Примером смеси является почва и воздух.
Искусственные химические вещества
Люди объединяют химические вещества на протяжении тысячелетий. В прошлом люди объединяли медь и олово для создания бронзы. Затем из него были созданы новые инструменты, оружие и доспехи.Бронза — это сплав, который был основным продуктом строительства и торговли. По мере того, как были созданы новые комбинации элементов, теперь у нас есть такие материалы, как нержавеющая сталь, легкий алюминий и другие полезные продукты, которые мы используем сегодня.
В прошлом люди объединяли медь и олово для создания бронзы. Затем из него были созданы новые инструменты, оружие и доспехи.Бронза — это сплав, который был основным продуктом строительства и торговли. По мере того, как были созданы новые комбинации элементов, теперь у нас есть такие материалы, как нержавеющая сталь, легкий алюминий и другие полезные продукты, которые мы используем сегодня.
Искусственные химические соединения нашли применение во многих отраслях промышленности. В фармацевтической промышленности химические соединения сыграли большую роль в создании различных видов лекарств. Комбинируя активные и неактивные химические вещества в таблетках, фармацевты могут обеспечить нас лечением различных расстройств или болезней.
Химические вещества в нашей повседневной жизни
Химические соединения встречаются повсюду, от пищи, которую мы едим, до воздуха, которым мы дышим. Искусственные химические вещества в пище помогают ей оставаться свежей и сохранять вкус. Некоторые химические соединения даже используются для улучшения текстуры продуктов, делая их хрустящими, жевательными или гладкими. Однако не все химические соединения могут быть полезны для нас. MSG (глутамат натрия) — это химическое соединение, которое добавляют в пищу для улучшения вкуса. Использование MSG может иметь негативные последствия для нашего здоровья, что может вызвать головные боли и другие негативные реакции.
Некоторые химические соединения даже используются для улучшения текстуры продуктов, делая их хрустящими, жевательными или гладкими. Однако не все химические соединения могут быть полезны для нас. MSG (глутамат натрия) — это химическое соединение, которое добавляют в пищу для улучшения вкуса. Использование MSG может иметь негативные последствия для нашего здоровья, что может вызвать головные боли и другие негативные реакции.
Заявление об отказе от ответственности
Весь контент, опубликованный в блоге ReAgent.co.uk, предназначен только для информации. Блог, его авторы и аффилированные лица не несут ответственности за любые несчастные случаи, травмы или ущерб, вызванные частично или непосредственно в результате использования предоставленной информации. Кроме того, мы не рекомендуем использовать какие-либо химические вещества, не ознакомившись с Паспортом безопасности материала (MSDS), который можно получить у производителя. Вы также должны следовать всем советам по безопасности и мерам предосторожности, указанным на этикетке продукта.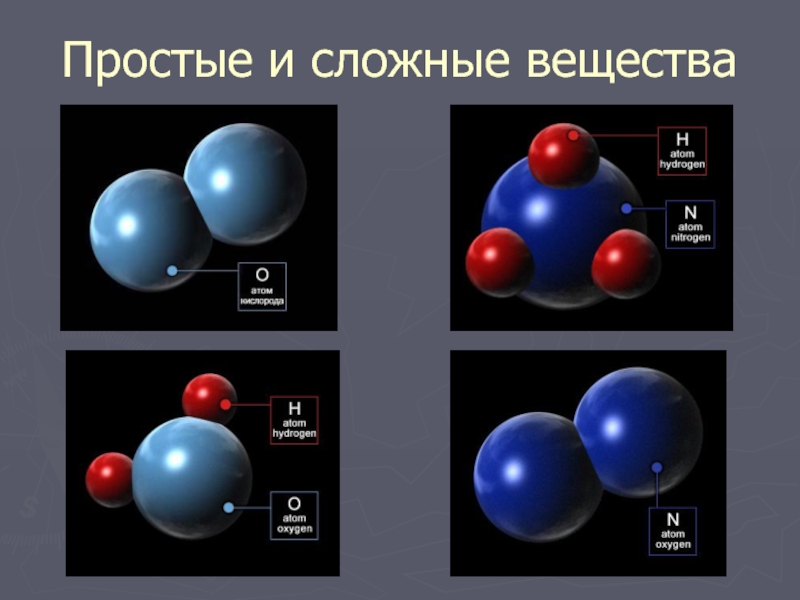 Если у вас есть вопросы, связанные со здоровьем и безопасностью, посетите HSE.gov.uk.
Если у вас есть вопросы, связанные со здоровьем и безопасностью, посетите HSE.gov.uk.
Какое определение элемента является правильным?
Какое определение элемента является правильным? Какое определение элемента является правильным?Согласно Раунди (1989), учителя химии сбивают учащихся с толку, используя устаревшие определения элементов. Ниже приведены три примера взято из учебников:
| Элемент — это вещество, которое нельзя разложить на что-то более простое (Heyworth, 1999). Элемент — это вещество, которое нельзя разложить химическими методами на что-то более простое (Chung, 1997). Элемент — это чистое вещество, которое нельзя разложить химическими методами на что-либо более простое (Cheng & Chow, 1999). |
Большинство элементов состоят из смеси изотопов и поэтому не являются чистыми веществами. Изотопы элемента можно разделить физическим
методы, такие как диффузия и масс-спектрометрия. Также изотопы некоторых элементов можно разделить химическими методами, например, электролизом.Каждый
изотоп элемента — чистое вещество.
Также изотопы некоторых элементов можно разделить химическими методами, например, электролизом.Каждый
изотоп элемента — чистое вещество.
Какое современное определение элемента? Элемент состоит из атомов, каждый из которых имеет одинаковое количество протонов в своей ядра. Важно отметить, что элемент идентифицируется по числу его протонов (т. е. по атомному номеру), независимо от того, существует ли он в виде атома или сложный. Например, все следующие вещества содержат элемент кислород:
MgO, H 2 O, O 2 , O 3 , CH 3 OH
Символ «О» используется для обозначения элемента кислорода в каждой из приведенных выше формул, потому что в ядре восемь протонов.Нам не нужно беспокоиться о числе электронов вокруг ядра O 2- или O 3 .
Чтобы облегчить усвоение учащимися современного определения элемента, учителям может потребоваться изменить последовательность тем, представленных в
большинство учебников.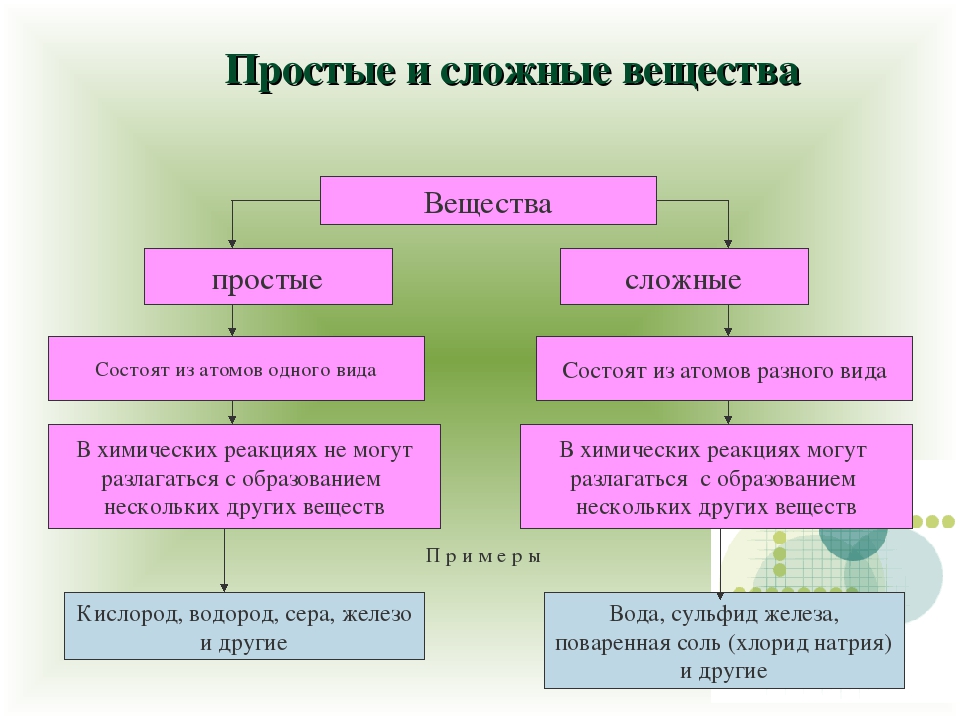 Не начинайте с темы «элементы». Одна из возможных обучающих последовательностей показана ниже:
Не начинайте с темы «элементы». Одна из возможных обучающих последовательностей показана ниже:
- Структура атома
- Атомный номер и массовое число
- Определение элемента
- Названия и обозначения элементов
- Изотопы
Каталожные номера
Ченг, Э.и Чоу, Дж. (1999). Химия: современный взгляд (4 -е -е изд.) . Уилсон Уэлш.
Чанг, LHM (1997). Интегрированная химия сегодня (2 -е изд. ) . Цзин Кунг.
Хейворт, Р. (1999). Chem 2000 (2 и изд.) . Макмиллан.
Раунди, WH (1989). Что такое элемент? Журнал химического образования , том. 66(9), стр. 729-730.
q2-определение терминов-элементов-c | ЛИДО
Решение:
Элемент —
Это основная единица материи, которая никаким образом не может быть разбита на субстанции, но может быть объединена для образования новых субстанций.
Это чистое вещество.
Классифицируется на металлы, неметаллы, металлоиды и инертные газы.
Пример — водород, углерод, кислород
Соединения —
Это комбинация двух или более элементов.
Это чистое вещество.
В результате химических реакций их можно разложить на металлы.
Пример — вода, двуокись углерода
Смеси —
Это комбинация двух или более элементов или соединений, или того и другого.
Вещества, объединенные в смеси, находятся в определенном соотношении.
Пример — меловой порошок, стиральная сода
«привет всем
сегодняшний вопрос — определить термины
элементы
соединения и смеси с целью
показать их основные отличия
так что в этом вопросе сначала будем
определение
что означает элемент что такое
подразумевается под соединением
а что подразумеваются под смесями и то
мы будем смотреть на
основные отличия теперь давайте посмотрим на
что такое элемент как мы определяем
элемент элемент является основным
форма материи, которая не может быть разрушена
вниз
в более простое вещество даже
химические реакции
вот как мы определяем, что такое
элемент теперь давайте двигаться дальше
определить, что понимается под соединением
соединение это комбинация
из двух и более элементов, которые
можно разбить на элементы
химическим или электрохимическим
реакции вот как мы определяем
смеси соединений теперь давайте двигаться дальше
определить, что такое смесь
смесь – это сочетание двух
или соединения нескольких элементов, или и то, и другое
то есть элементы являются соединениями
просто смешать вместе, чтобы сформировать смесь
и никаких новых веществ
получает новое соединение
сформированный
это определение того, что
это элемент, что является соединением и
что такое смесь
теперь элемент всегда чистый
соединение веществ
также также чистые вещества
но смеси, поскольку это комбинация
два и более элемента
имеет переменный состав
элемент имеет классификацию классифицированную
в металлы неметаллы металлоиды и
благородные очки
когда я смотрю на соединения соединения
представляет собой комбинацию каждого нового вещества
всегда фиксировано, и новое вещество
который формируется
как разные свойства, но в смесях
она имеет
переменный состав и вещество
сочетаются в смеси
находятся в определенном соотношении
это еще одно различие между
элементы
соединения и смеси, когда я вижу на
следующие различия мы можем видеть, что
элементы
нельзя разбить на более простые
вещества, а соединения, которые могут быть
сломанный
на элементы химическим или
электрохимический
реакции и смеси компонентов
можно довольно легко отделить
физические методы, поэтому
представляют собой соединения трех составных элементов
и смеси, и это основные
различия
между ними теперь давайте посмотрим на
Примеры
когда я смотрю на примеры, я говорю
этот элемент на самом деле чистый
вещество
так примерами элементов являются водород
углерод кислород следующий
соединения соединения в основном
сочетание двух и более элементов
так и это тоже чистое вещество
поэтому в этом случае я могу сказать, что соединения
примерами являются вода, которая является h3o
углекислый газ, который является сахаром СО2
смеси метана и др.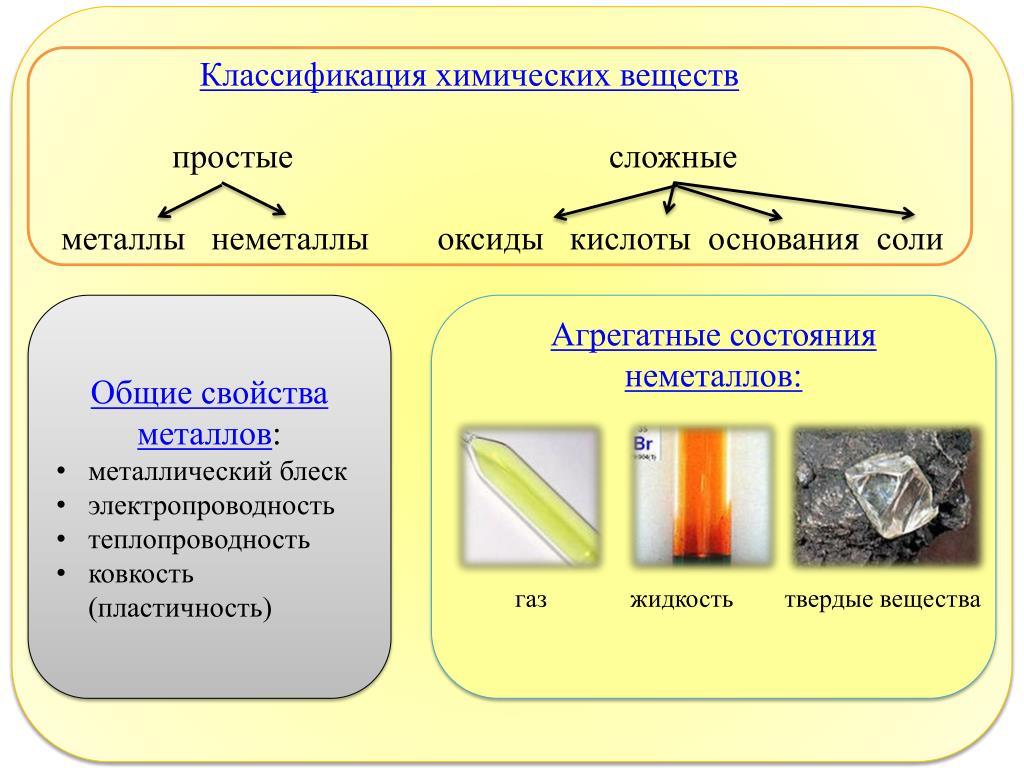 это в основном комбинация двух или
соединения большего количества элементов или и то, и другое
поэтому в этом случае, когда я смотрю на пример
смесей
можно сказать, что примером смесей являются
меловой порошок
и смотреть газировку так вот как в этом
вопрос
мы сначала определяем, что такое элемент, который мы
определил, что такое соединения
и мы определили, что такое смеси и
затем мы рассмотрели основные отличия
соответственно мы также указали примеры
соединений и смесей элементов
Спасибо
»
это в основном комбинация двух или
соединения большего количества элементов или и то, и другое
поэтому в этом случае, когда я смотрю на пример
смесей
можно сказать, что примером смесей являются
меловой порошок
и смотреть газировку так вот как в этом
вопрос
мы сначала определяем, что такое элемент, который мы
определил, что такое соединения
и мы определили, что такое смеси и
затем мы рассмотрели основные отличия
соответственно мы также указали примеры
соединений и смесей элементов
Спасибо
»
Чистые вещества и смеси — Элементы, соединения и смеси — Eduqas — GCSE Chemistry (Single Science) Revision — Eduqas
Значение слова «чистый»
Слово «чистый» используется в химии не так, как его повседневное значение.Например, в магазинах продаются упаковки с надписью «чистый» апельсиновый сок. Этикетка означает, что содержимое представляет собой просто апельсиновый сок, без добавления каких-либо других веществ. Однако сок не является чистым в химическом смысле, потому что он содержит различные вещества, смешанные вместе. В химии:
Однако сок не является чистым в химическом смысле, потому что он содержит различные вещества, смешанные вместе. В химии:
- чистое вещество состоит только из одного элемента или одного соединения
- смесь состоит из двух или более различных веществ, не связанных между собой химически
Смеси и соединения
Водород и кислород являются газами.Вместе, как смесь, водород и кислород могут реагировать и образовывать воду. Вода – это соединение водорода и кислорода. Существуют важные различия между свойствами смеси и соединения.
0.1:0.1.0.$0.$2.$2″> В этой таблице столбец «Смесь» относится к газам водороду и кислороду, а столбец «Соединение» относится к воде.| Смесь | Соединение | |
|---|---|---|
| Состав | $0.$2.$3.$2.$0.$1″> Переменный состав — можно изменять относительные количества двух газов. | Постоянный состав – вода всегда содержит одинаковое соотношение водорода и кислорода. Это соотношение отражено в химической формуле соединения — H 2 O. |
| Соединяется или нет? | Водород и кислород не связаны друг с другом. | Водород и кислород объединились, чтобы сформировать новую субстанцию воду. |
| $2.$0″> Свойства | Сохраняет свойства используемых веществ. Эта смесь находится в газообразном состоянии. | Свойства отличаются от свойств содержащихся в нем элементов. Это соединение является жидкостью. |
| Разделение | Вещества в смеси можно разделить. | Нельзя разделить, но можно получить с помощью химических реакций. |
Различие между чистыми веществами и смесями
8b1cmhpj4g.0.0.0.1:0.1.0.$0.$3.$1.$0″> Чистые вещества имеют высокую температуру плавления , но смеси плавятся в диапазоне температур. Эту разницу легче всего увидеть, когда измеряют температуру горячей жидкости при ее охлаждении и замерзании.На графике показана кривая охлаждения для образца соединения под названием салол.
Температура остается неизменной, в то время как чистое вещество меняет состояниеГоризонтальная часть графика показывает, что салол имеет резкую температуру плавления, поэтому он чистый. Нечистый салол (смесь салола и других веществ) будет вызывать постепенное снижение в диапазоне температур по мере замерзания.
Составление и разложение материи | manoa.hawaii.edu/ExploringOurFluidEarth
Химические реакции
Соединения состоят из атомов двух или более элементов, соединенных химически.Это химическое соединение называется соединением . Существует много типов химических реакций, в результате которых образуются химические соединения, некоторые из них описаны в таблице 1. 4. В химической реакции одно или несколько веществ подвергаются химическому изменению с образованием другого вещества или веществ. Исходными веществами являются реагентов . Новое вещество, полученное в результате химической реакции, представляет собой продукт . Химическая реакция обычно записывается в таком формате:
4. В химической реакции одно или несколько веществ подвергаются химическому изменению с образованием другого вещества или веществ. Исходными веществами являются реагентов . Новое вещество, полученное в результате химической реакции, представляет собой продукт . Химическая реакция обычно записывается в таком формате:
реагент + реагент → продукт + продукт
Стрелка указывает на то, что произошла химическая реакция.Вышеприведенное утверждение следует читать как «реагент плюс реагент дает продукт и продукт».
Примером химической реакции является нейтрализация желудочной кислоты антацидом. Химическая формула антацида Ca(OH) 2 . Желудочная кислота представляет собой соляную кислоту (HCl). Когда эти два реагента объединяются, они реагируют с образованием хлорида кальция (CaCl 2 ) и воды (H 2 O). Вода образуется из OH в Ca(OH) 2 и H в HCl, чтобы получить HOH, другой способ записи H 2 O. Химическая реакция записывается в таком формате:
Химическая реакция записывается в таком формате:
Ca(OH) 2 + 2 HCl → CaCl 2 + 2 H 2 O
Эта реакция гласит: гидроксид кальция плюс соляная кислота дает хлорид кальция плюс вода . Примеры химических реакций приведены в таблице 1.4.
| Тип реакции | Модель Реакция | Пример реакции |
|---|---|---|
| Состав | А + В → АВ
Два или более реагента соединяются с образованием продукта | 4 Fe + O 2 → 2 Fe 2 O 3
железо плюс кислород дает оксид железа упрощенная реакция на образование ржавчины |
| Одиночная замена | А + ХУ → АУ + Х
Производится одиночный переход между компонентами двух реагентов | 3 Ag 2 S + 2 Al → 6 Ag + Al 2 S 3
сульфид серебра плюс алюминий дает серебро и сульфид алюминия реакция для полировки потускневшего серебра в ванне с алюминиевой фольгой |
| Двойная замена | AB + XY → AY + XB
Производится двойной переход между компонентами двух реагентов | Ca(OH) 2 + 2 HCl → CaCl 2 + 2 H 2 O
гидроксид кальция плюс соляная кислота дает хлорид кальция плюс вода реакция на нейтрализацию желудочной кислоты антацидом |
| Горение | C i H j +O 2 → CO 2 + H 2 O
Реагент, состоящий из углерода и водорода (углеводород), реагирует с кислородом с образованием двуокиси углерода и воды.
| CH 4 + 2 O 2 → CO 2 + 2 H 2 O
метан плюс кислород дает углекислый газ и воду реакция сжигания метана (основного компонента природного газа) |
| Разложение | АВ → А + В
Реагент распадается на два или более продуктов | 2 H 2 O 2 → 2 H 2 O + O 2
перекись водорода дает воду и газообразный кислород реакция разложения перекиси водорода |
Соединения могут быть разложены на более простые соединения или их элементарные компоненты путем разрыва связей.Некоторые соединения разлагаются при нагревании или под воздействием солнечного света. Например, карбонат кальция (известняк) при нагревании разлагается на оксид кальция (негашеную известь) и углекислый газ. Свет разлагает перекись водорода на воду и кислород (рис. 1.8). Поскольку вода является чрезвычайно стабильным соединением, она не разлагается легко.
Например, карбонат кальция (известняк) при нагревании разлагается на оксид кальция (негашеную известь) и углекислый газ. Свет разлагает перекись водорода на воду и кислород (рис. 1.8). Поскольку вода является чрезвычайно стабильным соединением, она не разлагается легко.
В процессе электролиза используется электричество для разрыва связей, что приводит к разложению материи. Электричество — это поток электронов, отрицательно заряженных частиц в атомах.При электролизе химическое изменение вызывается электричеством, протекающим через химическое соединение.
Деятельность
Исследование состава воды с помощью электролиза. Чтобы электрический ток протекал, цепь должна быть замкнутой. Цепь может состоять из батареи и двух проводов, соединенных с электродами, которые уходят в раствор.
Аппарат Хоффмана
Аппарат Гофмана используется для электролиза воды. Это стеклянная U-образная трубка, заполненная трубкой чертополоха (рис. 1.11). В таблице 1.5 поясняются части аппарата Хоффмана.
Это стеклянная U-образная трубка, заполненная трубкой чертополоха (рис. 1.11). В таблице 1.5 поясняются части аппарата Хоффмана.
| Помеченные детали на рис. 1.11 | Имя | Описание |
|---|---|---|
| А | Трубка чертополоха | Средняя трубка имеет наверху воронкообразную секцию, называемую чертополоховой трубкой, которая используется для наполнения аппарата водой для электролиза. |
| Б | U-образная трубка | U-образная трубка состоит из двух вертикальных цилиндров, соединенных горизонтальной трубкой. Маркировка на баллонах позволяет точно измерять объемы газов и жидкостей. |
| С | Платиновые электроды | Платиновые электроды находятся на дне цилиндров. Платиновые электроды проводят электричество и не подвержены коррозии. |
| Д | Запорные краны | Запорные краны можно открывать или закрывать для сбора газов. |
Деятельность
Понаблюдайте за демонстрацией испытания пламенем для изучения газообразных продуктов электролиза. Демонстрационные материалы и процедура написаны в этом упражнении.
Электролиз
Электролиз использует электричество для расщепления воды на водород и кислород. На отрицательном полюсе батареи образуются электроны. Эти электроны текут по проводу к электроду в растворе (рис.1.12). На отрицательном (-) электроде электроны передаются воде и подхватываются атомами водорода в воде. Это позволяет водороду отделяться от остальной части молекулы воды и образовывать молекулы h3. На другом электроде, положительном (+), электроны отдаются кислородом в молекуле воды, что позволяет кислороду отделяться от воды и образовывать молекулы O2. Электроны текут от этого электрода обратно к положительной клемме батареи.
Химическая реакция, которая произошла на положительном электроде:
2 H 2 O → O 2 + 4H + + 4e —
На отрицательном электроде произошла химическая реакция:
2 H 2 O + 2e — → H 2 + 2OH —
Физические и химические изменения воды
Когда вода нагревается и кипит (рис.1.13 А) происходит физическое изменение, когда жидкая вода испаряется в газообразный водяной пар. Кипение — это физическое изменение, потому что, хотя вода из жидкого состояния переходит в газообразное, и жидкость, и газ состоят из молекул воды. Молекула воды не распалась.
При электролизе воды (рис. 1.13 Б) из жидкой воды образуются газообразные водород и кислород. Электролиз воды вызывает химическое изменение, при котором молекулы воды расщепляются с образованием водорода и кислорода — двух веществ, которые химически отличаются от воды. Разложение воды затруднено и не может быть достигнуто только путем нагревания. Воду не разбивает даже жар вулканического извержения!
Разложение воды затруднено и не может быть достигнуто только путем нагревания. Воду не разбивает даже жар вулканического извержения!
Сохранение материи
Важной характеристикой материи является то, что она никогда не может быть создана или уничтожена, только преобразована. Физическое или химическое изменение превращает материю из одной формы материи в другую. Джон Дальтон был одним из первых ученых, признавших это свойство материи. Эта идея называется законом сохранения материи.При любом физическом или химическом изменении материя не создается из ничего. Например, металлический предмет, который ржавеет, приобретает коричневатый налет, а также увеличивается в массе. Это происходит из-за химического изменения, реакции атомов железа с атомами кислорода в воздухе. Материя тоже не исчезает, хотя может появиться. Например, при электролизе воды, хотя объем жидкой воды уменьшается, вещество, из которого состоит вода, не исчезает. Скорее, атомы водорода и кислорода в жидкой воде превращаются в молекулы газообразного водорода и газообразного кислорода. Закон сохранения материи является частью атомной теории Дальтона, состоящей из пяти основных частей:
Закон сохранения материи является частью атомной теории Дальтона, состоящей из пяти основных частей:
- Материя состоит из маленьких частиц, называемых атомами.
- Атомы одного и того же элемента одинаковы; атомы разных элементов различны.
- Материя не может быть создана или уничтожена.
- Атомы могут соединяться в различных соотношениях, образуя соединения.
- В химических реакциях атомы перестраиваются, образуя новые соединения.
Атомная теория Дальтона формирует основу современной атомной теории.
.

 Желаем Вам открыть новые вещества и новые свойства на благо человечества!
Желаем Вам открыть новые вещества и новые свойства на благо человечества!

 Один правильный ответ – 1 балл.
Один правильный ответ – 1 балл.
 Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы это исправить, установите правильное время и дату на своем компьютере.
Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы это исправить, установите правильное время и дату на своем компьютере. Нижние индексы i и j относятся к числу атомов C и H, которые различны в разных углеводородах.
Нижние индексы i и j относятся к числу атомов C и H, которые различны в разных углеводородах.